シンバイオ製薬、製品売上51.4%増 トレアキシン®の国内売上が堅調に推移
平成29年上半期のハイライト

吉田文紀氏:トレアキシン®の国内の売上状況は、極めて順調にきております。薬価ベースで33億円、前年同期比43パーセントの増加です。未治療(NHL/MCL適応症)の適用はみなさんご存じのように、12月に承認を取っております。平成28年上半期(1-6月期)は未治療の売上は、0でございます。
つまり、43パーセントの増加のほとんどは、未治療の適応症の売上と考えていただければと思います。これがどこまでいくかということについて、今日は少し時間をかけてお話ししたいと思います。
海外の順調展開については、適応拡大がございませんので、フラットでございます。
パイプラインの進捗については、我々の長年の願いでありました、再発・難治性の中高悪性度。本日の説明会ではDLBCLと呼びたいと思います。この第Ⅲ相試験について、6月にPMDA(独立行政法人医薬品医療機器総合機構)と相談を行いました。
開発計画の概要について、機構とはほぼ合意に至っております。今期中には第Ⅲ相試験を開始したいということで、現在準備中でございます。
リゴセルチブの注射剤につきましては、再発・難治性の高リスクMDS(骨髄異形成症候群)。オンコノバ社が現在進めている、INSPIREという国際共同第Ⅲ相試験に参加しております。目標症例数は225症例ですが、日本の目標症例は25症例。そのうちすでに、20症例が登録されています。
経口剤につきましては、一時、オンコノバ社の委託製造先の問題がありまして、試験のサンプルの供給が止まっておりました。これが7月から再開されたことを受け、6月に試験を開始しております。これは、単剤での第Ⅲ相試験を、もう1回繰り返すということでございます。
SyB P-1501につきましては、第Ⅲ相試験が現在進行中です。ライセンサーであるThe Medicines Companyから、IONSYS(術後自己疼痛管理用医薬品)事業撤退のアナウンスメントが、5月・6月にございました。不確定要素が増大したということを考えて、私どもの方では試験を中断しております。内容については、後ほど少しお話をする予定です。
新規パイプラインにつきましては、3品目・4品目の新規新薬候補品について、ライセンス交渉をしているところです。
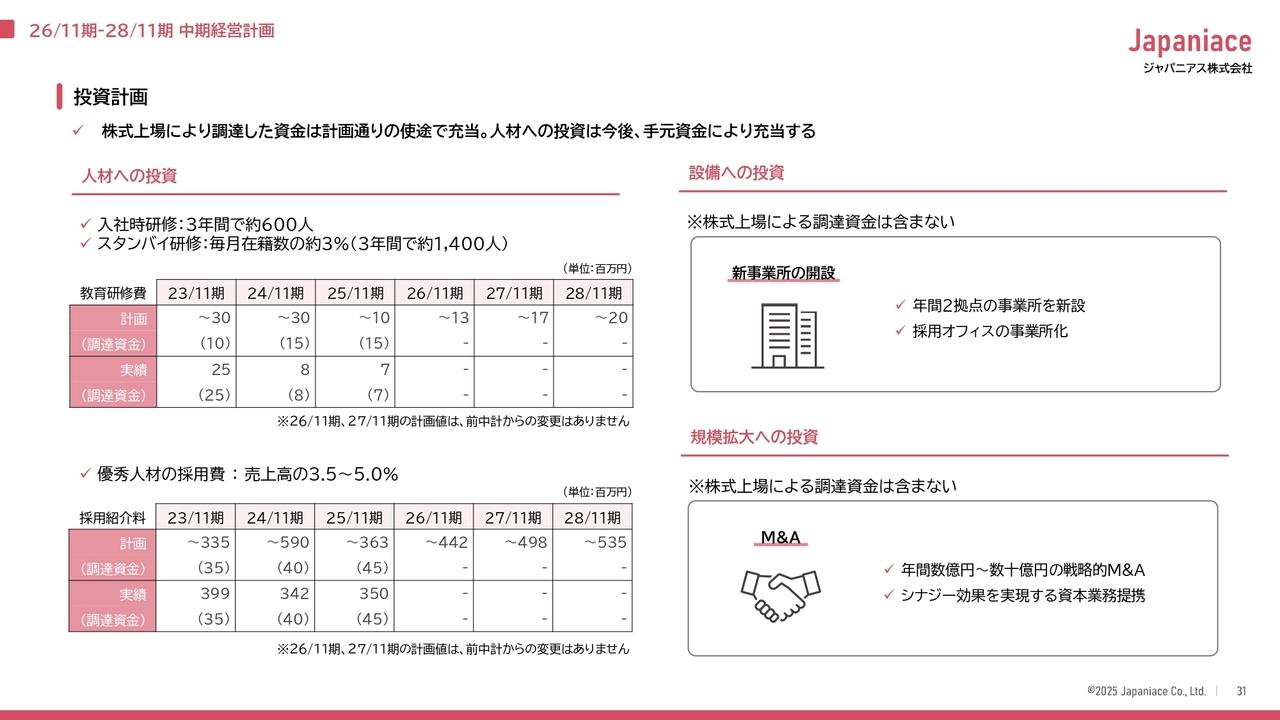
平成29年上半期(1~6月) 損益計算書

損益計算書です。上半期の(売上高は)17億8,600万円。今期はマイルストーンの収入がございませんので、すべて製品売上でございます。このうち16億5,200万円が、国内の売上でございます。前期の11億4,300万円に対して、44.5パーセントの増加です。
経費につきましては、前期(1-6月期)は、研究開発の谷間になっていたこともあり、非常に低レベルの経費でした。今期はリゴセルチブ注射剤、経口剤、SyB P-1501(の臨床試験の進展)ということで、経費は増大傾向にございます。
当期純損益は、12億6,600万円です。
“もはや CHOP-Rを使うことは倫理的に許されない”

少しおさらいになりますが、2012年12月のアメリカの血液学会において、ドイツのBendamustine(以下、ベンダムスチン)の最高権威のルメル教授が、このデータを発表されました。
これはPFS(Progression-Free Survival)、無増悪生存期間を表しています。(赤色の折れ線グラフをご覧ください。)ベンダムスチンとRituximab(以下、リツキサン)の中央値が69.5ヶ月でした。
(青色の折れ線グラフをご覧ください。)それに対して、ゴールドスタンダードのCHOP-R(エンドキサン、アドリアシン、ビンクリスチン、プレドニゾロン+リツキサン)が31.2ヶ月で、倍以上の生存期間を示しました。
ルメル教授のアメリカの血液学会発表からわずか3週間で、アメリカのNCCN(The National Comprehensive Cancer Network)がガイドラインに、このベンダムスチン・リツキサン(赤色のグラフのほう)を、推奨レジメントして取り上げております。
これをきっかけに、欧米ではベンダムスチン・リツキサンが、一気にゴールドスタンダードへ切り替わっていきました。ルメル教授に言わせると、「もはやCHOP-Rを使うことは倫理的に許されないんだ」ということです。
2017年は未治療NHL・MCL領域の新治療方法(BR)の元年

日本においては、2016年12月に未治療(NHL・MCL領域)の承認を取っておりますので、まさに2017年の今期が、新治療方法ベンダムスチン・リツキサン(BR)の元年になります。
権威のルメル教授に、1月に来日していただきまして、日本の主要都市でご講演いただきました。現在は、B-R療法への切り替え中でございます。医学の教科書のいわゆる標準療法というものが、今年から来年にかけて、CHOP-RからB-R療法に切り替わっていく。まさに元年であるということですね。
有効性・安全性 いずれの指標でもB-Rが標準療法・CHOP-Rを凌駕している

少しおさらいです。資料をご覧ください。CHOP-RとB-R療法を比べますと、無増悪生存期間・次治療開始までの期間・全生存期間・安全性の比較といういずれの指標においても、ベンダムスチン・リツキサン(B-R療法)が標準療法を上回っているということが、おわかりいただけるかと思います。
前年同月比 1日当たり販売数量の推移

それでは、その初速度はどれほどかについてお話しします。こちらのは今年の1月から、7月までの推移です。
青色のグラフが2016年、前期の実績です。1日当たりの数量をバイアル(注射剤)数で示しております。(緑色のグラフは2017年、今期7月31日現在の実績です。)この赤字の部分は、前年同月比で、今期の1日当たり販売数量をバイアル数でお示ししています。
前年同月比 1日当たり販売数量の伸長率

もう少しわかりやすく示したものが、こちらの資料です。前年の1日当たりの販売数量を100としております。
今期の前年同月比の進捗率について、お話しします。先ほど申し上げたように、未治療の承認が昨年12月に取れておりますので、この伸長率の部分のほとんどを、未治療の売上と考えていただければと思います。
これをどこまで伸ばせるかが、私どもの現在の課題です。11月、12月あたりまでには、180パーセントから190パーセントのラインに達しているのではないかと考えております。
ここまでいくのであれば、できれば200パーセントのラインを越したいと考えております。現実的には、おそらく180パーセントから190パーセントのところで、12月を終える可能性が十分あると思います。
そうすると2018年の売上は、この2016年に比べて、約190パーセント増のところからのスタートになります。2018年・2019年の売上が、かなり期待できるということはおわかりいただけるかと思います。
これは、ピッチャーの球をバッターが打ち返したときの感触に近いものになるわけです。弾道は非常に良さそうだなということが、おわかりいただけるのでないかなと思います。
全国営業展開はエーザイと協働

現在の全国営業展開は、エーザイさんの130名近いオンコロジー専任MR(医薬情報担当者)。そして少数ではありますが、精鋭のシンバイオのプロダクトマネージャー(PM)が組む、共闘するかたちで全国展開しております。
The Medicines Company イオンシス事業から撤退を発表(FORM 8-K)

今年(2017年)6月1日に、The Medicines Companyから「FORM 8-K」というものが出されました。それにより、シンバイオは第Ⅲ相試験の症例登録を中断しております。
本日のこの説明会では、これ以上のことは申し上げられませんが、ここで3つぐらいのポイントについてお話ししておきたいと思います。
1つ目は、このIONSYSの米国市場から、(2017年)6月19日付で撤退するということを伝えています。
2つ目は、新薬の承認を2015年4月に取っていること。これを、「Remaining open to December 31」と書いてあるとおり、この時点で取り下げるということを言っているわけです。
3つ目は、このIONSYSに関係した60人の社員を解雇するということ。
この3つのポイントをFORM8-Kで伝えております。これを受けてシンバイオは、製造体制またはサプライチェーンマネージメント等について、非常に不安になる。
症例集積をして臨床試験をやるということは、患者さんに入っていただく・ご協力いただくということです。このような状況の中では、やはり倫理的な観点から症例集積を続けるべきではないと判断して、中断をしている状況であります。
現在、紛争中でもありますので、これ以上のコメントは差し控えさせていただきたいと思います。
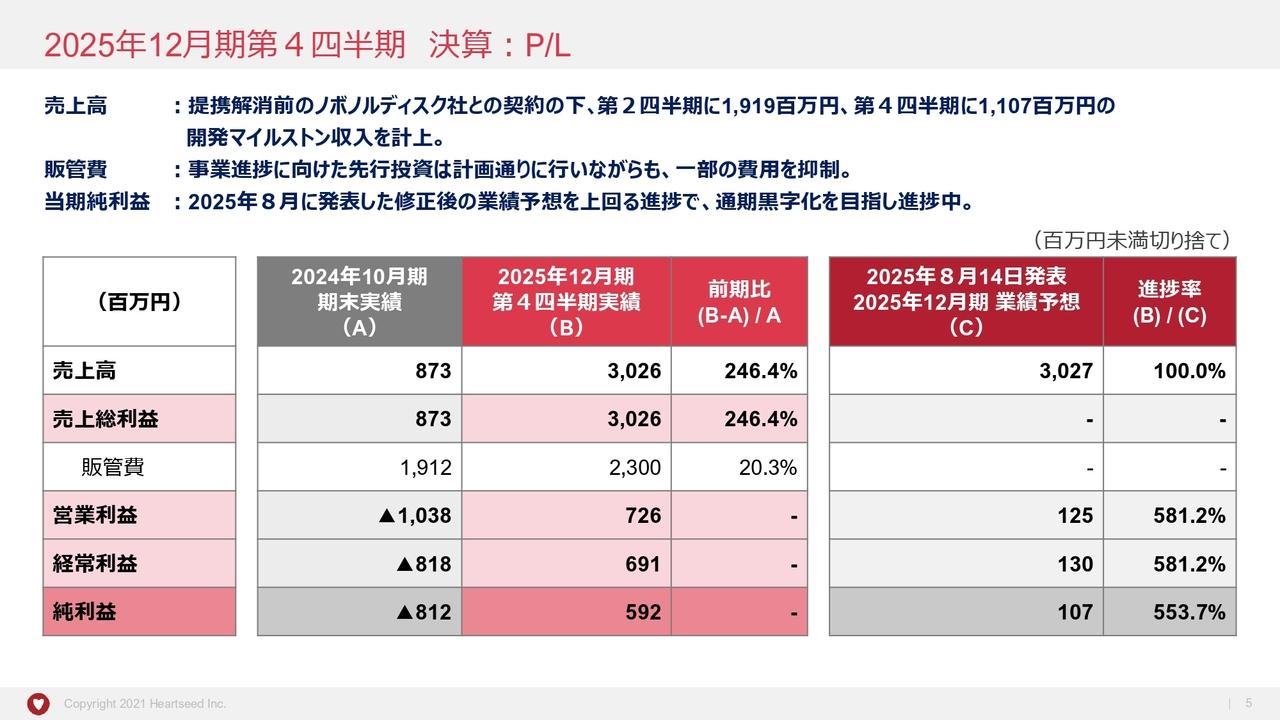
平成29年6月末 貸借対照表

バランスシートです。現在、キャッシュ残高は(2017年)6月末で約49億円。そして、自己資本比率は71.2パーセントとなっております。
平成29年度 通期業績予想

通期の見通しです。2月に発表している通期業績予想については、変更しておりません。
これは、もう少しトレアキシン®の売上動向を見極めたいということ。また、今申し上げたSyB P-1501の(中断中の第Ⅲ相試験が)現在、The Medicines Companyとの協議・紛争が続いていること。これらをもう少し見極めてから、それを反映するかどうかの判断をしたいと考えております。
トレアキシン® 売上実績と今期末予想

トレアキシン®が今期末、どこまで(売上を伸ばして)いくのかということです。グレーの線は、2016年の実績でございます。2016年6月末の段階で、約2万4,000バイアル数。
そして2016年12月末には、約4万9,000バイアル数でございます。
(青色の線の)今期の予算は、計画としては6月末で約3万本。そして、12月末で6万6,000本と予想しておりました。
その結果は(緑色の線の)2017年6月末において、約3万4,000本でした。点線のところは予想ですけれど、12月末に7万5,000本ぐらい、出ているのではないかと考えております。
トレアキシン® 売上期末予想は前年対比約50%の増加

もう少し見やすくしてご説明します。2016年(青色のグラフ)と2017年(緑色のグラフ)。(6月末の前年対比は)41パーセント増ですね。
そして期末では、7万5,000本いけば前年対比で50パーセント増ということになります。なんとか7万5,000本から、できれば8万本に近づけたいと考えております。
トレアキシン® 予想を上回る早いペースで市場浸透

中期はどうなるかということですが、この2017年12月末において、私ども(の予想)は当初未治療の部分(青色のグラフ)。採算値がコンスタントに推移したとして、未治療は35パーセントぐらいの浸透率(を予想しております)。
患者さんの数で言った場合の浸透率は、今のペースでいきますと、おそらく45パーセントから50パーセントのあいだの浸透率で終わるのではないかと考えております。
願わくば、50パーセントを達成したいと思っております。50パーセントを達成することによって、2018年の浸透率の70パーセントが、かなり現実的になるのではないかと考えております。今期末の浸透率50パーセントは、なんとしてでも達成しておきたいと考えております。
(2017年)2月にお示しした中期計画では35パーセント、そして2018年の上限が58パーセント(緑色のグラフ)。下限が43パーセントで、2019年には80パーセントまでいくと見ていたのですが、これが場合によっては、1年前倒しで達成できる可能性が出てきております。
今期の主たるマイルストーン

今期の主たるマイルストーンです。今申し上げたように、トレアキシン®の未治療の市場浸透率35パーセントは、6月末ですでに達成していると考えております。現時点において、おそらく37パーセントから38パーセント浸透しているのではないかと考えております。
リゴセルチブ経口剤については、単剤第Ⅰ相試験をすでに開始しております。
トレアキシン®の注射剤は、再発・難治性中高悪性度NHL(DLBCL)は、年末までに第Ⅲ相試験を開始しておきたいと(考えております)。
リゴセルチブ注射剤です。目標の25症例(のうち)すでに20症例を組み入れておりますので、おそらく25症例は、間違いなく(国内患者を)登録できると考えております。私どもとしては、できるだけ多くの30症例ぐらいまで、組み入れておきたいと考えております。
オンコノバ社の方では、リゴセルチブ注射剤の(国際共同第Ⅲ相試験)INSPIRE Studyの中間解析を、第4四半期に行うことを考えております。これは、非常に大きなマイルストーンになってまいります。
それと、SyB P-1501。国内第Ⅲ相試験を再開できるかどうかの判断に、少し時間はかかると思いますが、今期末までには白黒つけておきたいと考えております。
(新薬候補品の導入については)現在3品目。新規ライセンスを交渉しておりますので、これも今期末までということで、交渉を進めております。
新着ログ
「医薬品」のログ