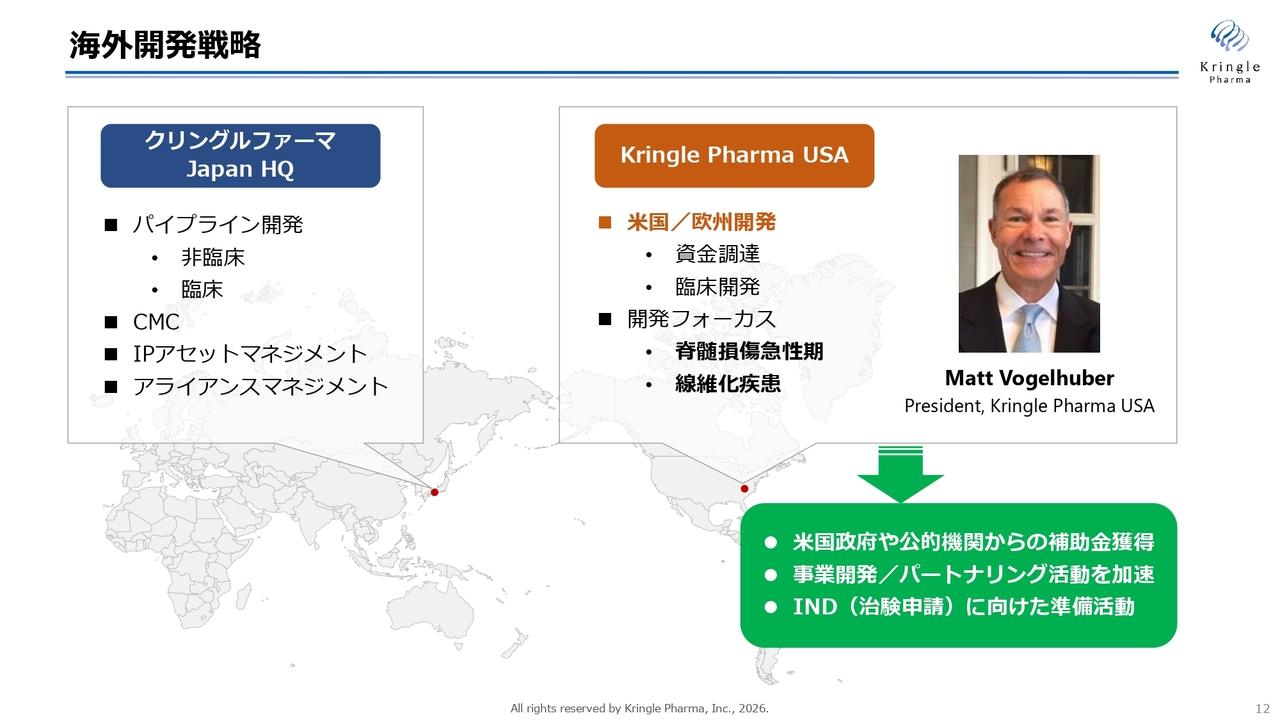
【QAあり】PRISM BioLab、Eli Lillyや小野薬品工業の収益を中心に売上高は昨年の2倍超 引き続き研究開発に注力し積極的に投資
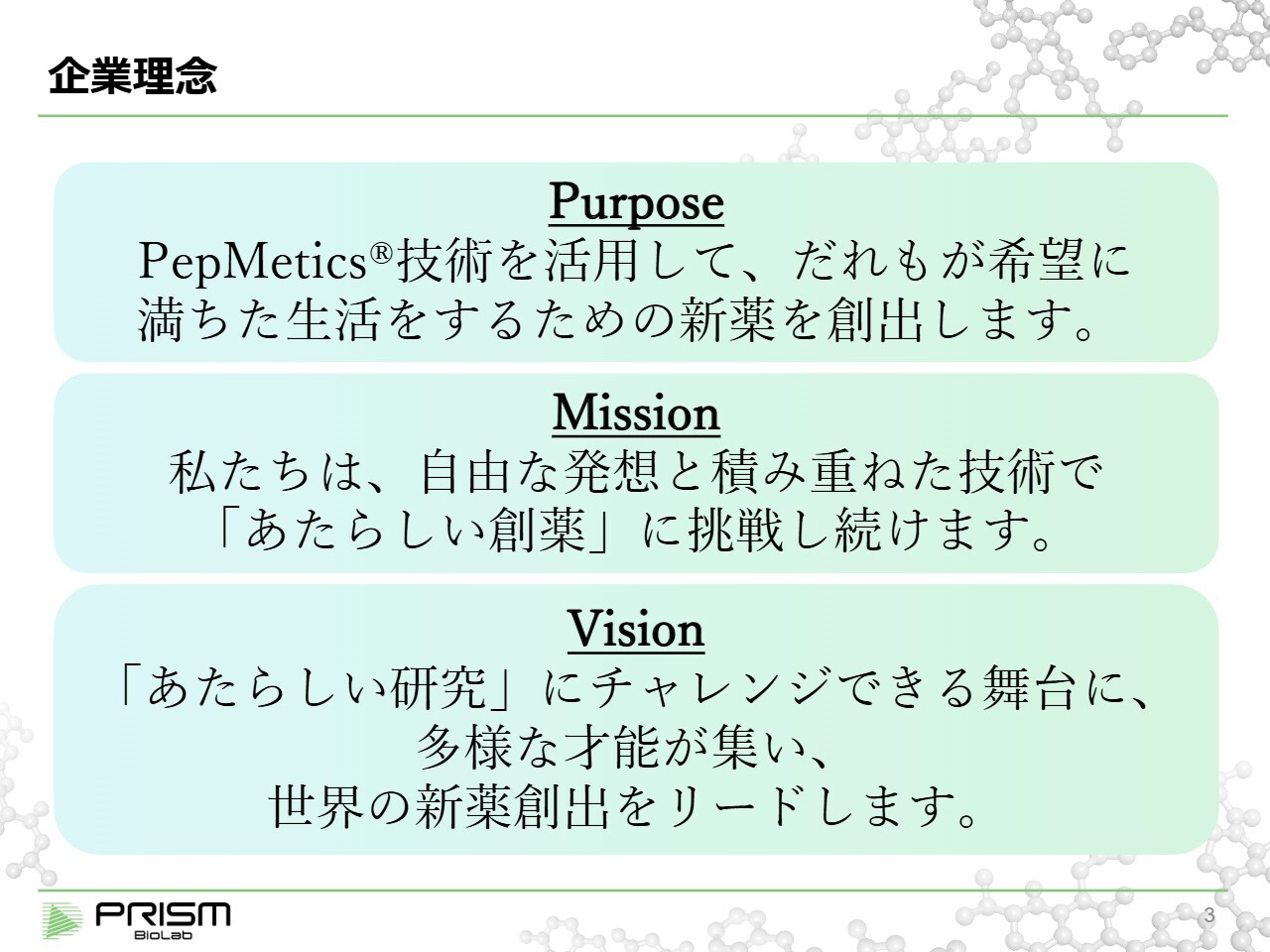
企業理念
竹原大氏(以下、竹原):本日は株式会社PRISM BioLabの2025年9月期決算説明会にご参加いただき、誠にありがとうございます。代表取締役の竹原です。資料を使用しながら弊社についてご説明します。
当社は、「PepMetics」技術という画期的かつ独自の創薬技術を用いて新薬を創ることで、みなさまに希望に満ちた生活を提供することを目的としています。新薬の創出は極めて困難です。特に当社の技術は、これまで創薬が難しいと言われてきた新しい標的を目指すものであり、そのためには自由な発想と優れた技術を活用して新しい創薬を創り出すことが求められます。
当社には大変優秀なサイエンティストたちが集まっています。彼らが実力を十分に発揮し、自由に挑戦できる良い環境を整え、創薬を推進していきたいと考えています。
2025年9月期通期 ハイライト
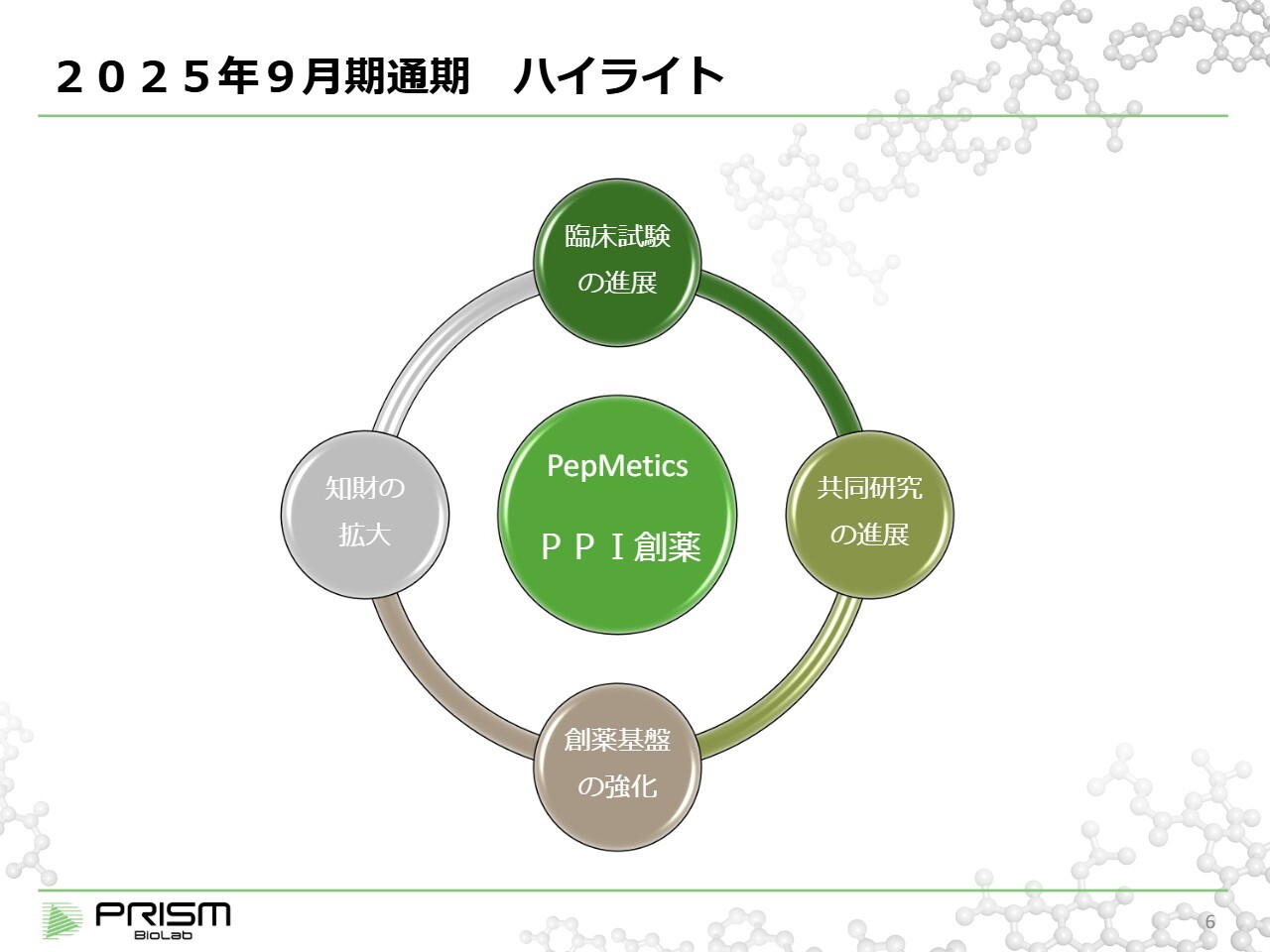
それでは通期の業績について、概要をご説明します。まず、ハイライトとして、PPI(Protein-Protein Interaction)創薬を支えるための臨床試験、共同研究、創薬基盤、知財の拡大についてお話しします。
2025年9月期通期 ハイライト

臨床試験では、エーザイの「E7386」の臨床試験が大変積極的に進められています。エーザイが保有している抗がん剤「レンビマ」との併用試験を行っており、特に今期は子宮体がんに焦点を当てて開発を進めていくことが明確になっています。ご覧のとおり、エーザイはさまざまな機会を通じてその結果を発表しています。なお、詳しくは後ほどご説明します。
共同研究も一定の進捗を見せていますが、すべてのプロジェクトが前に進むわけではありません。創薬は非常に確率が低い事業で、今期はEli Lilly and Company(以下、Eli Lilly)とLES LABORATOIRES SERVIER(以下、Servier)との契約が終了しました。
しかし、2025年11月に発表しましたように、小野薬品工業とのプロジェクトについてはマイルストンを達成し、順調に進んでいます。
終了したEli LillyとServierとの取り組みについても、研究の中でさまざまな成果を上げており、特にグローバルな企業と当社のサイエンティストが1つのチームとなり、大きな成果を出していき、信頼関係を構築したことに意義があります。当社としては、今年度はグローバルに活躍できる舞台を作ることを着実に実現できていると感じています。
2025年9月期通期 ハイライト

次に、創薬基盤の強化についてご説明します。今期はライブラリースクリーニングを実施できる体制が整ってきました。当社は3万個の化合物ライブラリを保有しており、従来はパートナー企業や外部委託でスクリーニングを実施していましたが、今期は社内で効率的にスクリーニングを行える体制が整いました。
また、分子間相互作用測定機能を強化しました。これは、タンパク質に化合物が正確に結合しているかを確認する試験であり、従来は社内で実施できませんでしたが、その体制も整備しました。これにより、創薬の総合的な基盤が着実に構築されています。
それに加えて当社では、AIを活用したさまざまな試みを進めており、AI創薬企業Elixとの業務提携によるプロジェクトも進行中です。当社にとって化合物の空間が最も重要な資産となるため、知的財産を順次拡大しつつ、化合物の基盤を整えています。
2025年9月期 通期損益状況
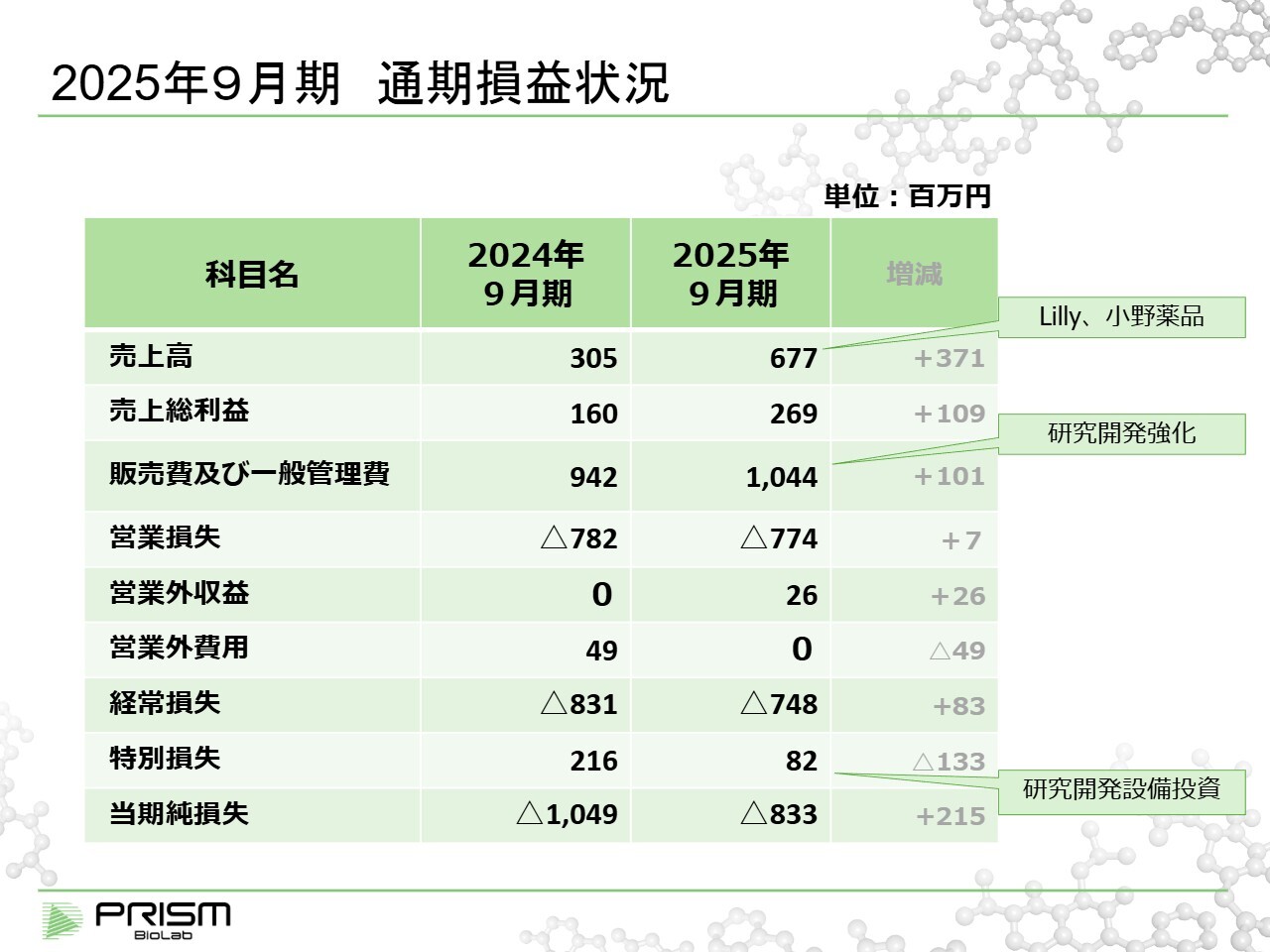
その結果としての財務状況についてご説明します。損益計算書ですが、売上高は昨年の約3億円から今年は6億7,700万円となりました。これは主にEli Lillyおよび小野薬品工業からの収益によるものです。
Eli Lillyについては、今期9月で契約が終了しましたが、その前からお預かりしていた前受金について一括で売上として計上しています。
費用面では引き続き研究開発に力を入れており、販管費や一般管理費には人件費や各種実験費用が含まれています。特別損失に計上されているものについては、当社は赤字経営のため、設備投資として資産計上し減価償却を行うのではなく、毎期特別損失として計上するかたちを取っています。前年度は約2億円、今年も約8,000万円の積極的な投資を行っています。
2025年9月期 通期財政状況
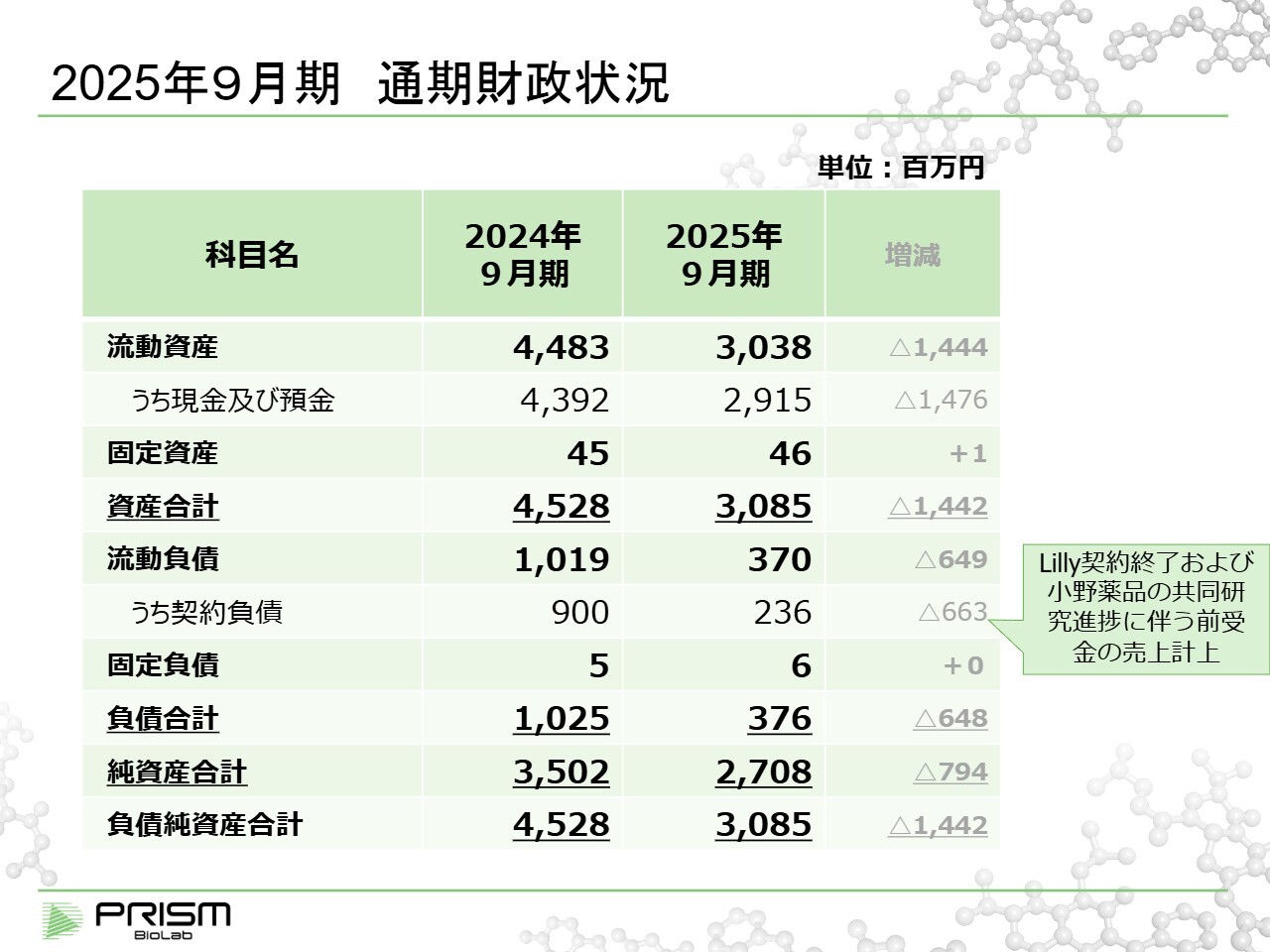
資産が少ないため、バランスシートは非常にシンプルです。1億円を超えるものとしては、現金、契約負債、資本の3つだけです。
契約負債は、先ほどご説明したとおり、契約一時金を受け取った際に計上されるもので、研究の進展に応じてその期間分を売上に振り替えていく原資のようなものです。今期は契約負債が9億円から2億3,600万円に減少し、この差額約6億6,000万円が前受金の取り崩しによって売上に計上されたということになります。
当期、現金は約44億円から約29億円に減少しており、約15億円の減少となりました。この減少額が、当期に当社が実際に使用した費用のほとんどです。
2025年9月期 通期キャッシュフローの状況
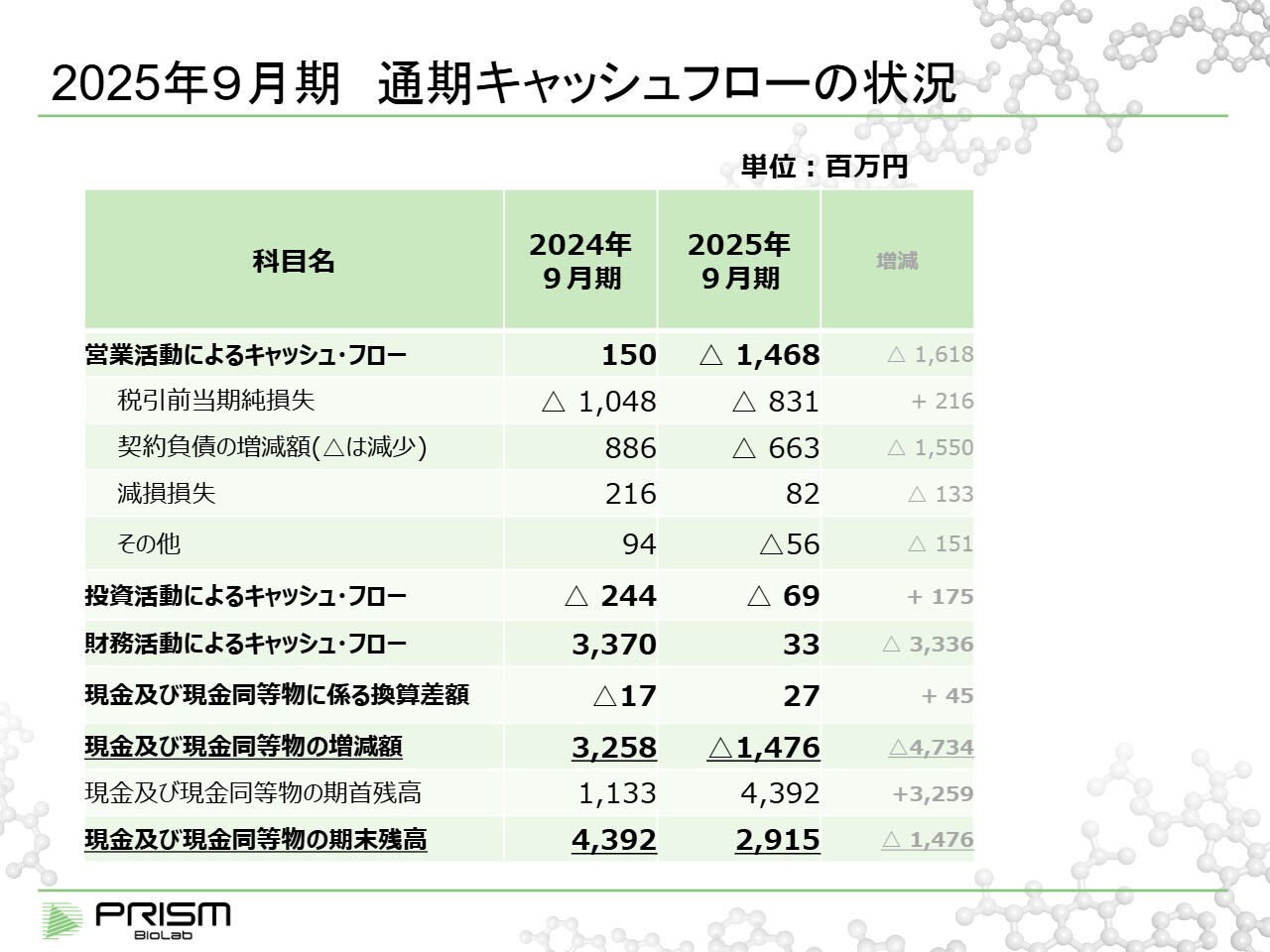
キャッシュフローについては、先ほどお話しした約14億7,000万円が営業キャッシュフローとしてマイナスとなっており、ほぼ同額が全体のキャッシュフローのマイナスとなっています。以上が財務状況です。
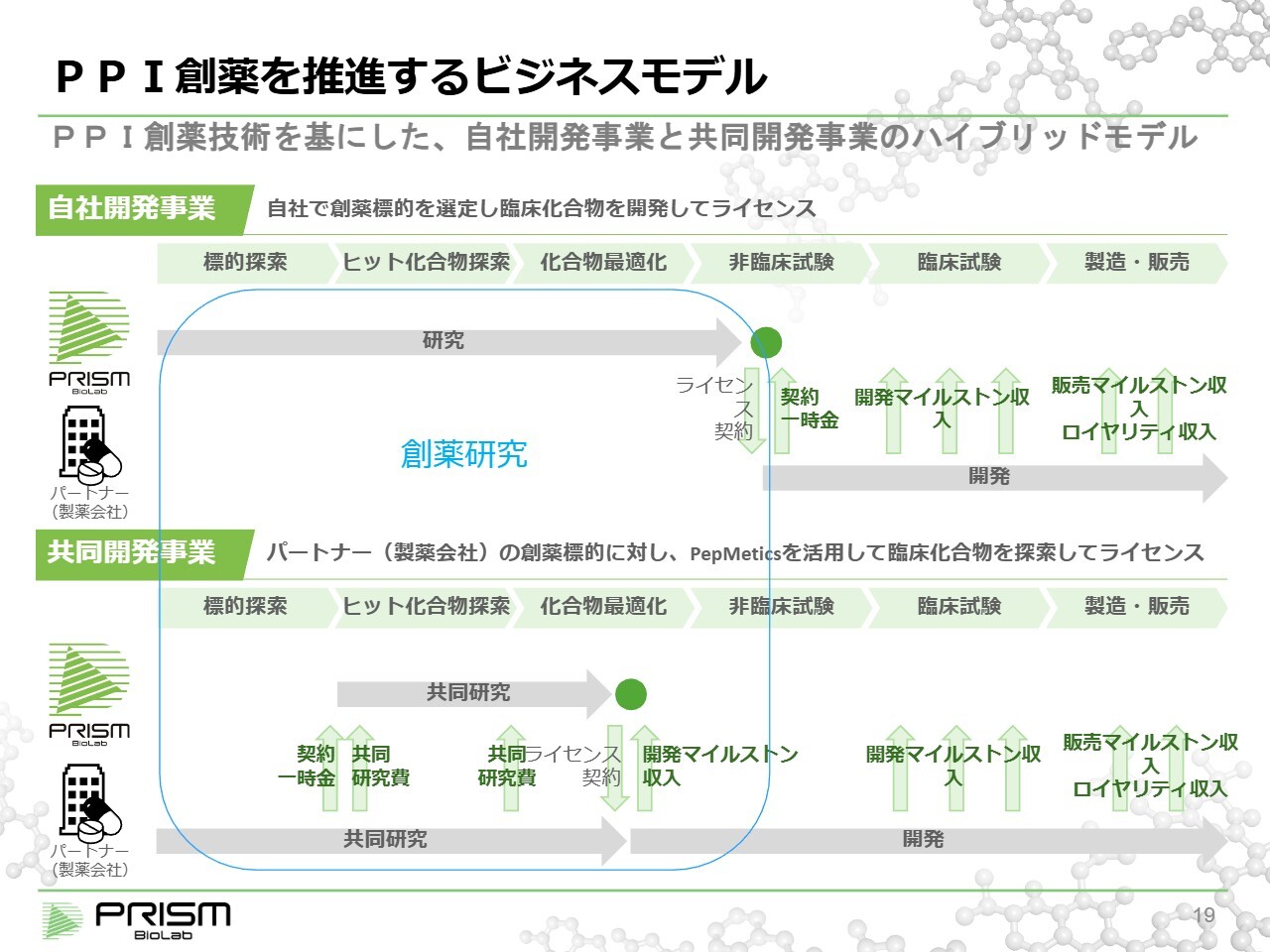
PPI創薬を推進するビジネスモデル
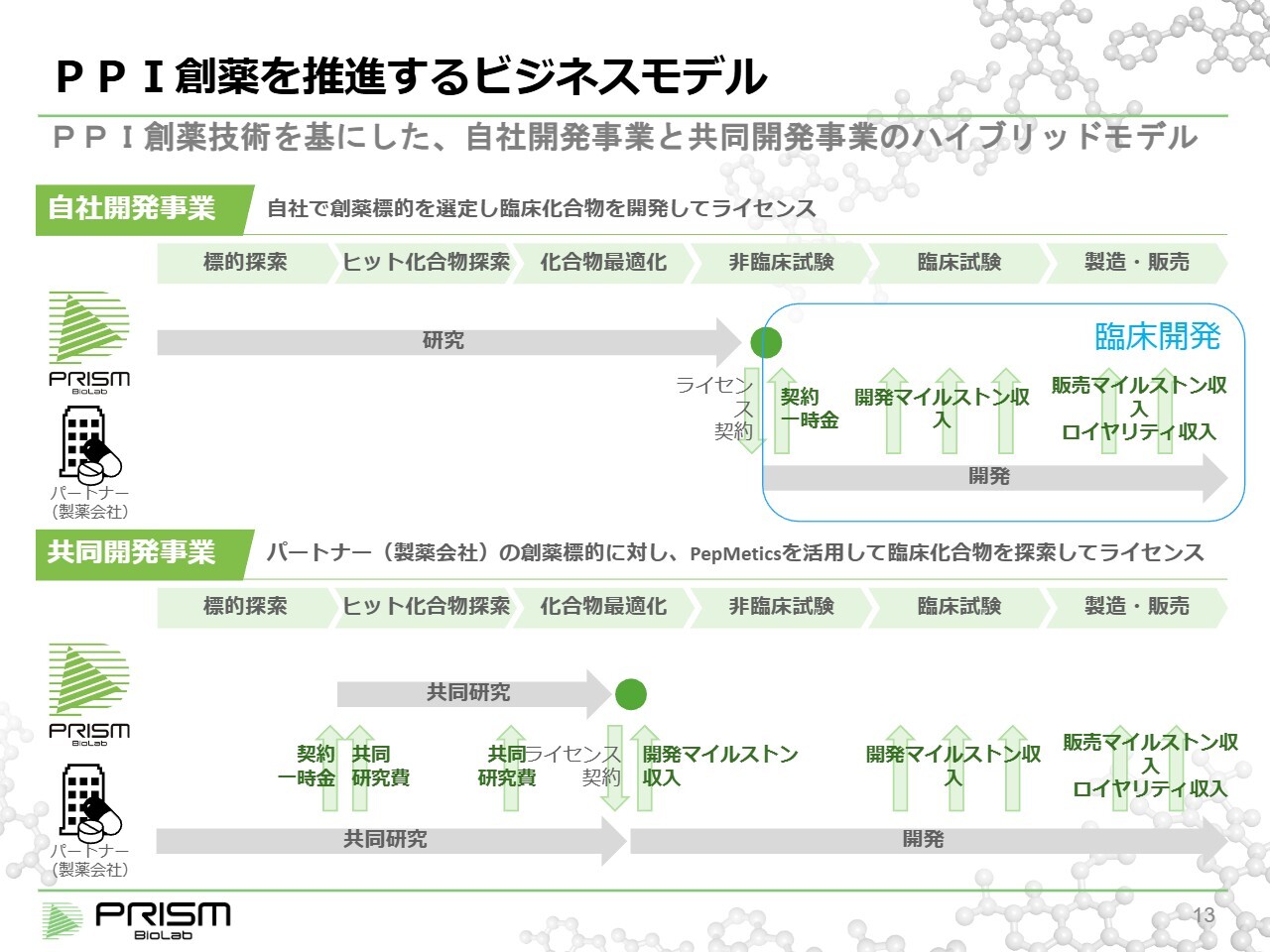
当社事業の進捗について、臨床開発と創薬研究の2つに分けて説明します。その前提として、当社のビジネスモデルを少しご紹介します。当社は、「自社開発」と「共同開発」の2つのビジネスモデルをハイブリッド形式で運営しています。
「自社開発」では、当社が独自に創薬標的を見つけ、ヒット化合物を探索します。このヒット化合物は、標的タンパクに化合物が結合していることが確認されたものを指します。次にリード化合物に進みますが、これは動物試験で効果がきちんと確認される段階です。そして、最終的に臨床候補化合物を創製します。
臨床候補化合物として完成したものが臨床試験に進み、最終的に薬として確立されます。当社は、この臨床候補化合物を独自に創製し、それをライセンスとすることを「自社開発事業」の基盤としています。
一方、「共同開発」では、製薬会社が持つ創薬標的に対して当社の技術を活用し、共同研究を行い、薬の候補となる臨床候補化合物を創製します。最終的には、同様にライセンスを行い、マイルストンやロイヤリティを受け取るかたちとなります。
自社開発事業

臨床開発についてご説明します。これは当社がすでにライセンスを供与し、製薬会社が開発を進めているプロジェクトです。このようなプロジェクトは薬として実現する可能性が最も近い段階にありますが、当社自身が直接関与するわけではなく、費用や管理は製薬会社に委ねています。
現在、2つのプログラムを製薬会社にライセンスしています。1つは「E7386」で、こちらはエーザイと共同開発した化合物ですが、当社分をエーザイにライセンスアウトしており、現在、がんの分野で開発を進めています。もう1つは「PRI-724」で、当社が創出した化合物を大原薬品工業に、肝硬変の用途でライセンスしています。
自社開発事業:E7386
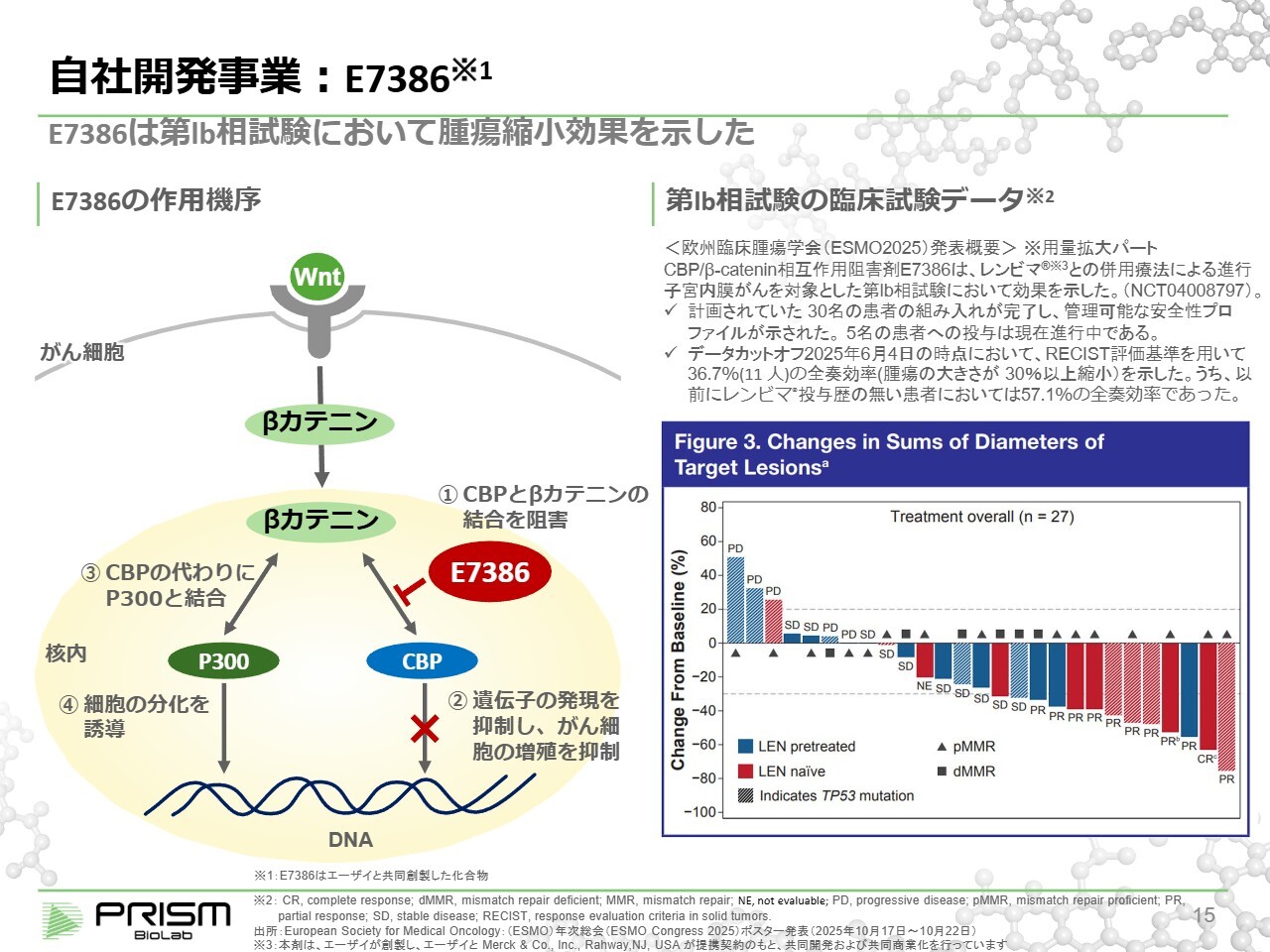
実は、両方とも同じメカニズムであるWntパスウェイを標的としています。このWntパスウェイは、1980年代からがんに強く影響を与えることが知られ、がんの増殖時にWntパスウェイが活性化していることが明らかになっています。
Wntパスウェイは古くから数多くの薬剤が試みられてきましたが、ほとんどが毒性の強さから開発が中止されています。当社では、Wntパスウェイ全体を阻害するのではなく、その下流にある細胞内でβカテニンとCBPというタンパク質が結合するプロセスを、当社の化合物がCBPに結合することで阻害する、という仕組みを採用しています。
このβカテニンとCBPが結合することで細胞の増殖が促進されます。がんは増殖する病気であり、その活性化によってがん細胞が増殖しますが、当社の化合物はこの結合を阻害することで、がんの進行を抑え、がん細胞を死滅させる働きがあります。
一方、βカテニンはP300という別のタンパク質とも結合し、細胞を分化させる機能を持っています。当社の化合物の特徴は、CBPだけに結合してP300には結合しない点です。これにより、Wntパスウェイ全体を止めることなく、がん細胞の活発な増殖だけを抑制し、正常細胞にはほとんど影響を与えず、がん細胞だけを殺す効果が期待されています。
この薬の臨床開発については、エーザイ社が「レンビマ」との併用試験で、先ほど申し上げた子宮内膜がん、子宮体がんを標的として臨床試験を進めています。
スライド右下のグラフはフェーズ1bの臨床試験結果のデータです。30名の患者さまに投与を行い、その結果をまとめたものです。上に示されるのは「がんが大きくなった」、下に示されるのは「がんが小さくなった」という結果です。がんは通常、どんどん大きくなる病気ですが、ご覧のとおり、多くの患者さまでがんの縮小が確認されています。
特に、がんの縮小が30パーセントを超える場合をパーシャルレスポンス(PR)と定義し、有意に反応していると判断します。このパーシャルレスポンスが30名中11名(36.7パーセント)で見られました。これは子宮体がんにおいて極めてよいデータと言われています。
さらに、レンビマの投与歴がない患者さまにおいては、奏効率が57.1パーセントに達しており、非常に有望な治療法であると評価されており、エーザイが積極的に開発を進めています。
自社開発事業:PRI-724
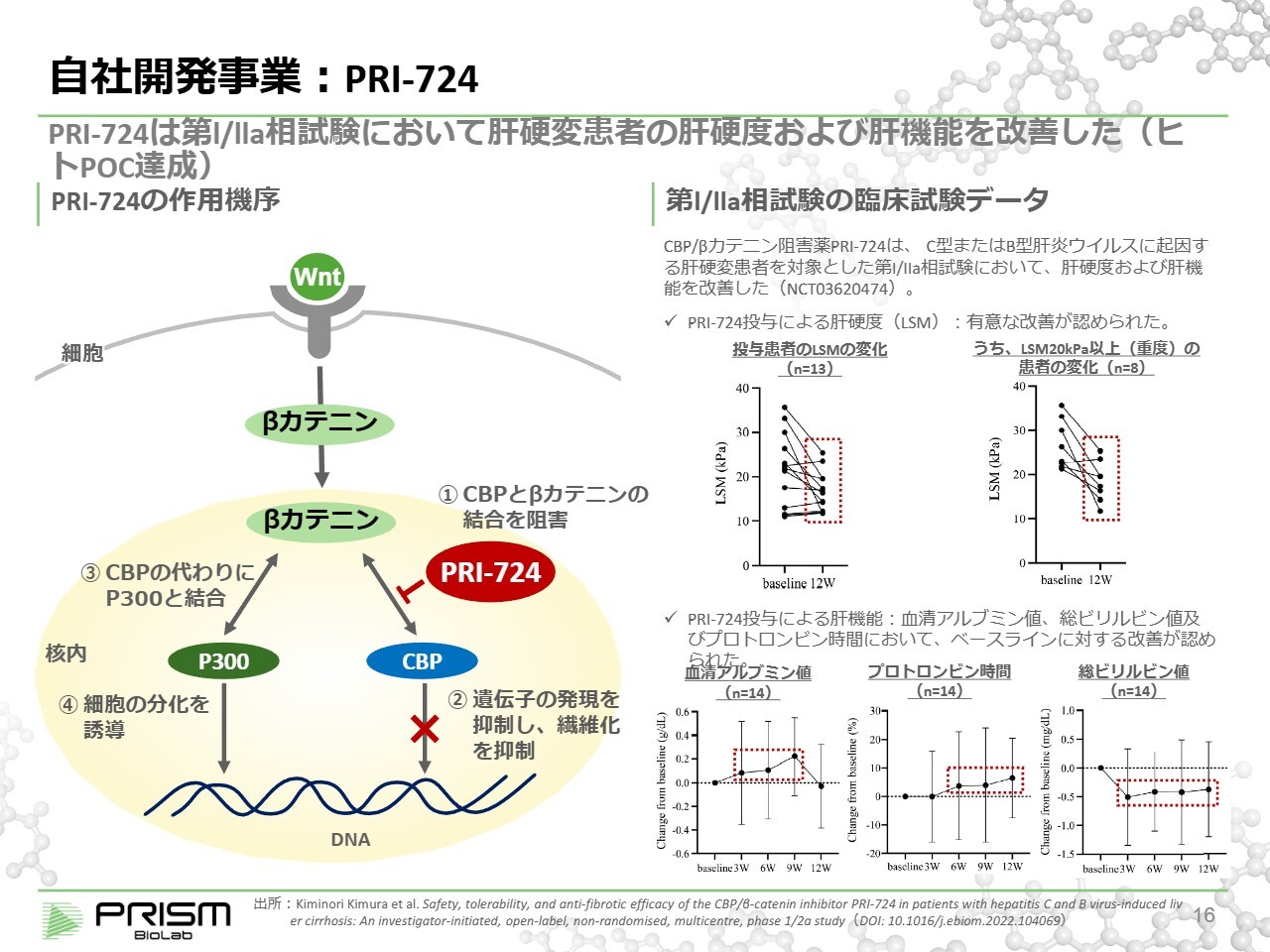
このWntパスウェイは、昔から線維症にも関係していることが知られています。線維症とは、身体のさまざまな部位が硬くなり、疾患を引き起こす病態のことです。Wntパスウェイの活性を切り替えることで、線維症の治療を目指しています。
当社が大原薬品にライセンスアウトしている「PRI-724」は、肝硬変を中心に開発が進められています。肝硬変とは、肝臓が硬くなる疾患であり、その進行や治療効果の指標としてLSMが使用されています。
健康な方はこの指標が10未満ですが、患者さんでは20や30を超える場合もあります。そのような患者さまに3ヶ月の投与することにより硬さがかなり柔らかくなり、すなわち線維化が回復しつつあることが示されています。もともと、線維症は回復しないと言われていましたが、回復の効果が見られたことで注目を集めています。現在は、この結果を基にフェーズ2を進めています。
臨床開発の進捗
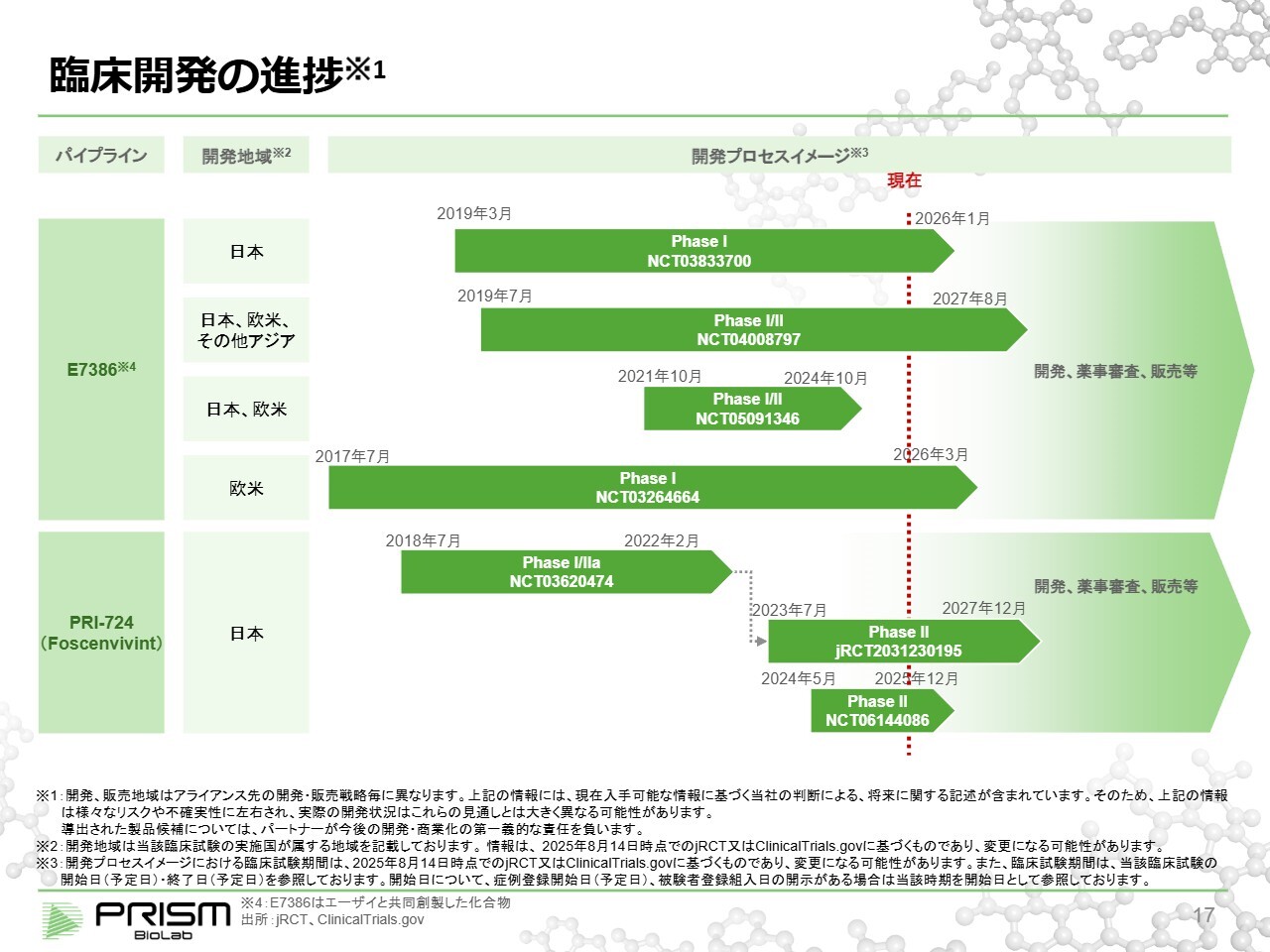
これが全体の臨床試験の概要です。「レンビマ」との併用試験はNCT04008797という試験で、2027年8月に終了する予定です。また、「PRI-724」のフェーズ2試験は、2027年12月に終了する予定です。
PPI創薬を推進するビジネスモデル
次に創薬研究についてご説明します。先ほどのビジネスモデルにおける標的探索から臨床候補化合物の発見までの段階で、当社が最新技術を駆使して精力的に取り組んでいる部分です。
PepMeticsがあたらしい創薬領域を創る可能性
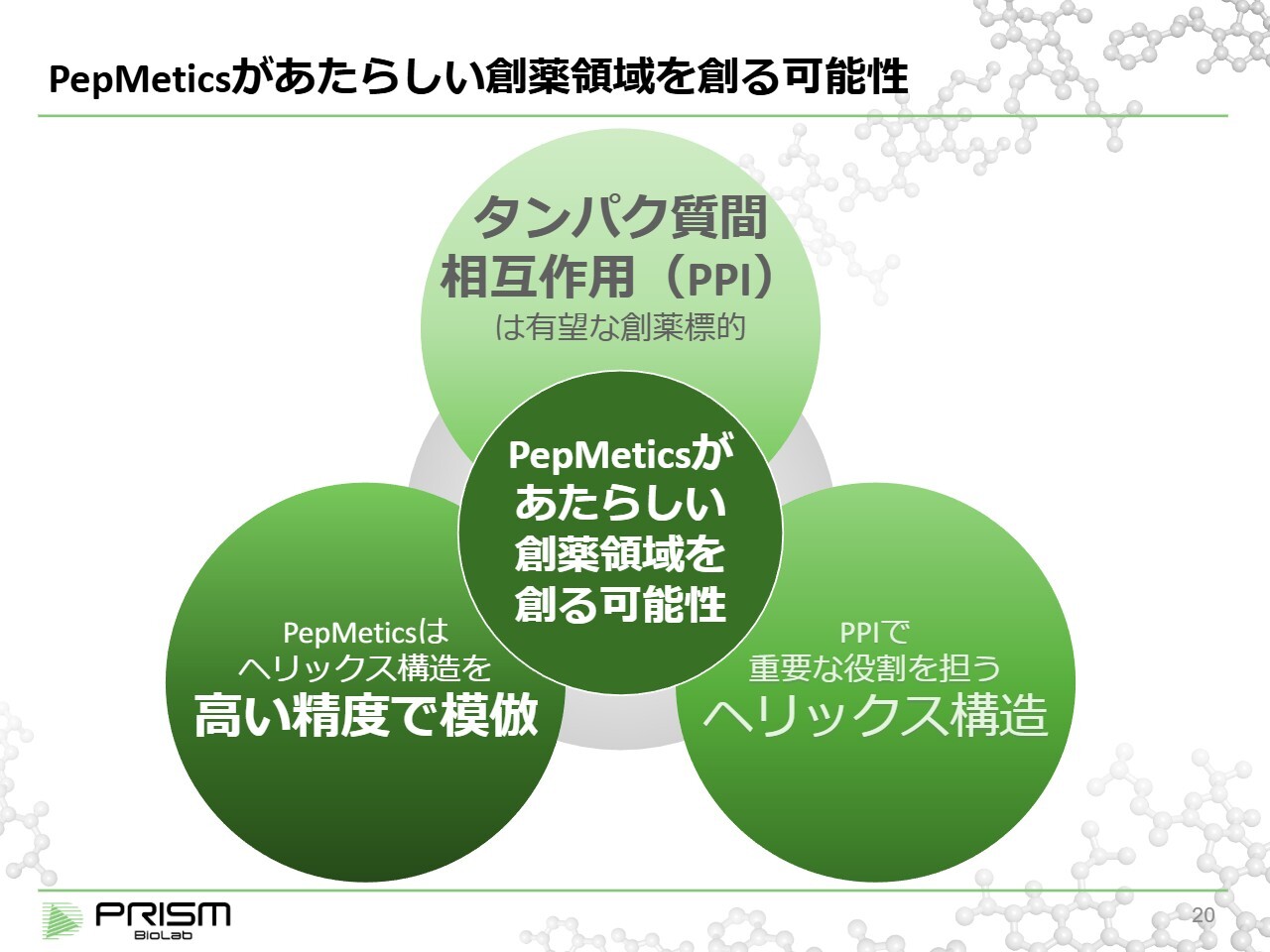
「PepMetics」は新しい創薬領域を創出する可能性がある技術であり、これを3つのステップでご説明します。
まず、タンパク質間相互作用(PPI)は非常に有望な創薬標的とされています。しかし、これは難しいと言われ、これまで薬として実用化されるケースが少ないのが現状です。もしこれを薬にすることができれば、さまざまな治療に結び付くと考えられています。このPPIにおいて重要な役割を果たしているのがヘリックス構造です。これは、タンパク質の一定の構造を示すもので、後ほど詳しくご説明します。
ヘリックス構造を模倣すればPPIを制御できるとされてきましたが、従来の低分子では困難でした。一方、「PepMetics」は低分子でありながら高い精度でヘリックス構造を模倣することが可能です。この技術の活用により、従来は困難とされていたPPI、特に細胞内でのPPIにおいて、新たな創薬領域を切り開く可能性があることをご説明します。
タンパク質間相互作用(以下「PPI」)は有望な創薬標的
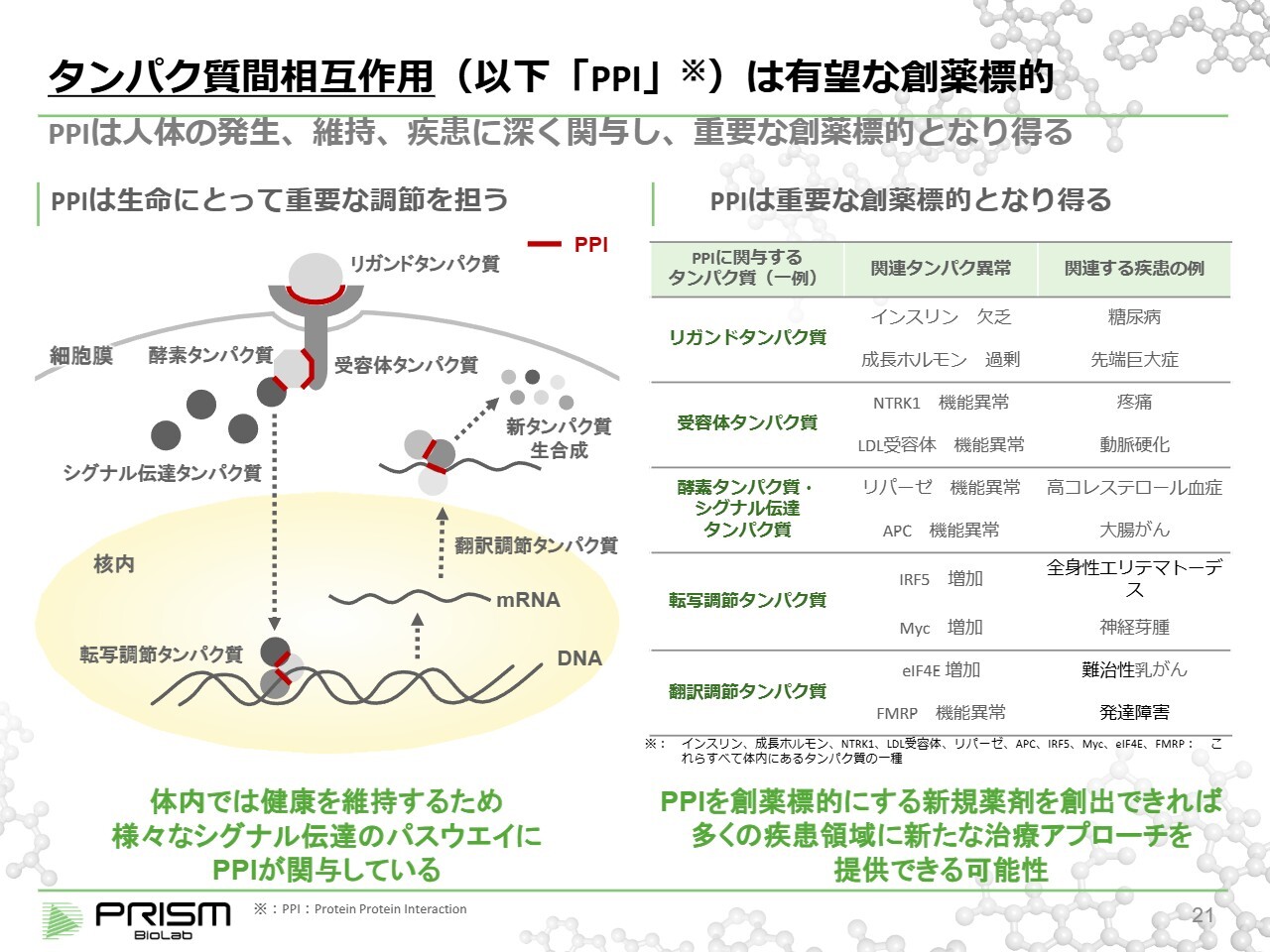
このタンパク質相互作用についてですが、人の体は6割から7割が水で構成されていますが、それ以外のほとんどはタンパク質、骨、脂肪が占めています。骨や脂肪は細かい制御に関与しないため、基本的にはタンパク質が人間の体におけるさまざまな制御を担っています。筋肉や脳、臓器の形成はもとより、正確な信号を伝える機能も果たしています。
例えば、新しいタンパク質を生成する場合、リガンドタンパク質(細胞外から信号を運ぶタンパク質)が受容体タンパク質に結合し、その信号が細胞内部に伝えられます。この過程はタンパク質とタンパク質の結合、いわゆるPPIです。
細胞内においても、受容体タンパク質が酵素タンパク質やシグナル伝達タンパク質といったさまざまなタンパク質に適切に信号を送ることで、伝達タンパク質が細胞核内に入り、DNA(タンパク質の設計図である遺伝子)から作るべきタンパク質の設計図をmRNAとして読み出します。
この過程は「転写」と呼ばれ、いくつかのタンパク質が集まり構成される「コンプレックス」によって、機械仕掛けのようにDNAから正確に読み出しが行われます。
さらに、読み出されたmRNAからタンパク質を合成する過程は「翻訳」と呼ばれます。この翻訳もまたコンプレックスによる機能であり、そこから新しいタンパク質が作り出されます。
ご覧のように、タンパク質を1つ作るにも、さまざまなPPIが正確に作用することでようやく実現します。このような仕組みによって、人間の身体は成長したり、病気と闘ったり、恒常性を維持したりすることができています。
こういったさまざまな種類のタンパク質が適切に機能しなくなると、さまざまな疾患が発生する原因となります。こうしたタンパク質を標的にしてそれを正常に作用するように変え、病気を治療することがPPIの制御です。
ほぼすべての疾患にPPIが関与していると言っても過言ではないと思います。
PPIで重要な役割を担うヘリックス構造
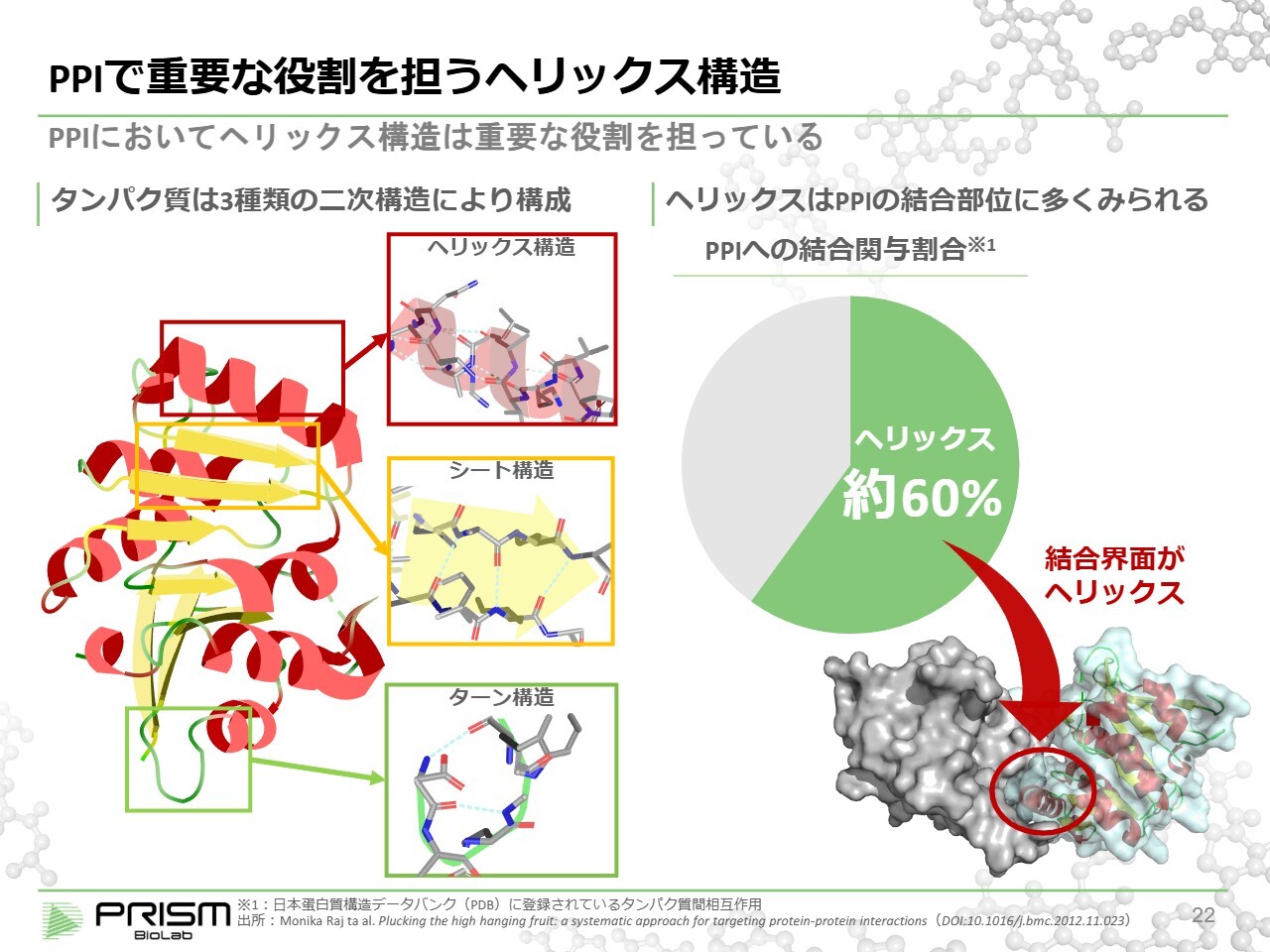
タンパク質の制御方法についてです。タンパク質は20種類のアミノ酸から成る長い一本の紐のようなもので、数百から数万ものアミノ酸が連なって作られています。このタンパク質が機能するためには、正確な形に折りたたまれる必要があります。
タンパク質は非常に正確に折りたたまれており、その折りたたみを正確に制御するため、まず安定した構造である2次構造を形成します。2次構造には、ヘリックス、シート、ターンという3種類があり、これらはそれぞれ単独でもある程度安定した構造です。
これを作成した上で、それらが組み合わさることで複雑な形状がどんどん形成されていきます。このシンプルな3種類の中で、実はPPIに最も関与しているのがヘリックスであると言われています。約6割のPPIでヘリックスが重要な役割を果たしています。
そこで、このヘリックス構造を模倣し、例えばポケットを埋めてしまうことでPPIを制御できるのではないかと考えられています。
当社のプラットフォーム基盤技術「PepMeticsテクノロジー」
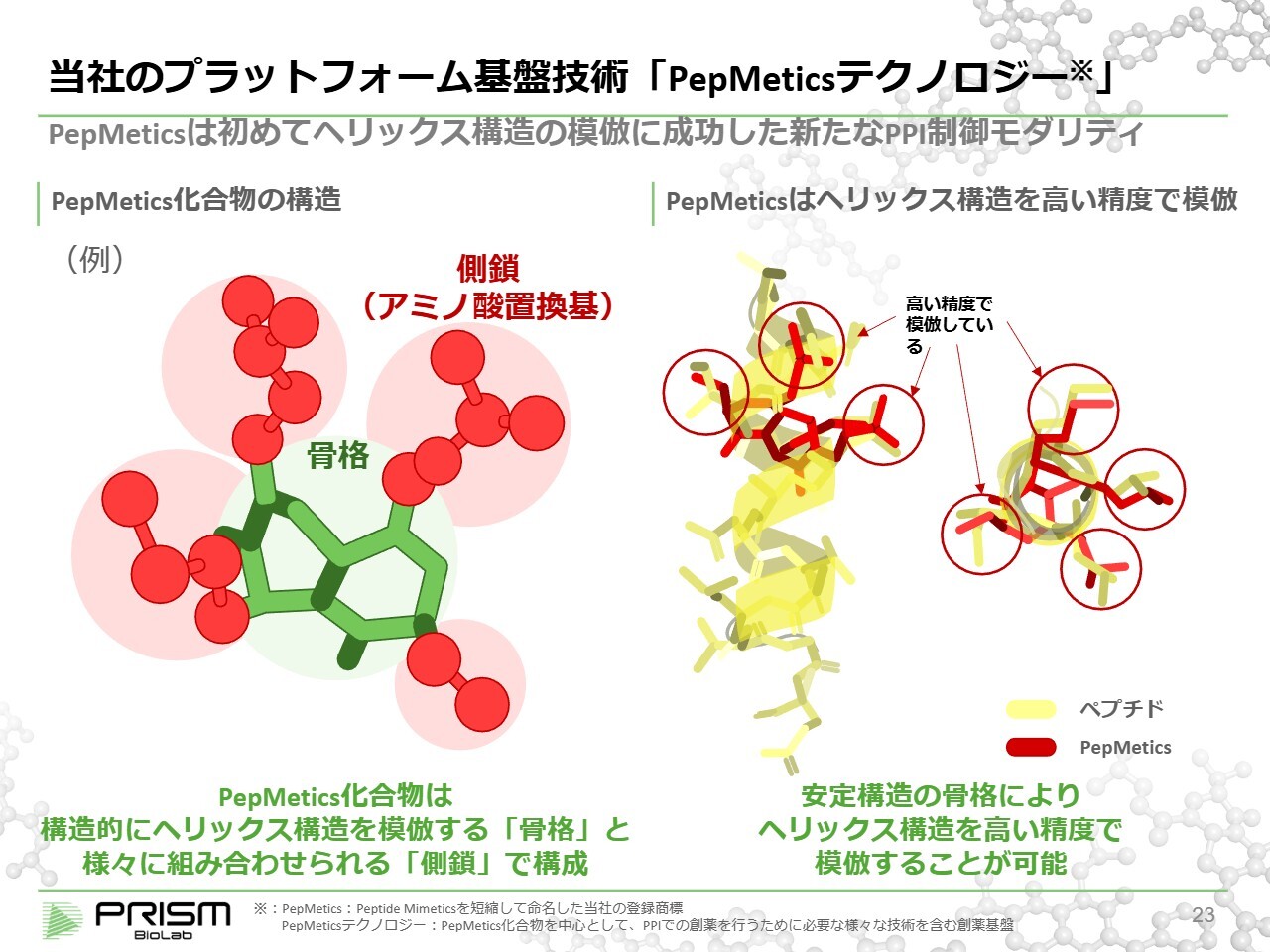
ヘリックス構造とはその名のとおり、螺旋状をしています。アミノ酸は3.6個で約1回転します。これを模倣しようとすると、四方八方へ立体的にさまざまな方向に手を生やす必要があります。
しかしながら、従来の低分子化合物はほとんどが平面的、フラットな形状、もしくは棒状のもので、このような3次元的なボールのような形状をした低分子化合物を作ることは極めて難しいとされています。天然物の中にはそのような構造を持つものが多く存在しますが、人工的に合成された低分子化合物はほとんどが平面的なものとなっています。
我々は、2つの環が一定の角度を持ちながら安定した形を保つ骨格を作り出しました。この2つの環は角度を持つことで、必然的に3次元的な構造となります。また、この骨格から手をさまざまな方向に生やすことができ、従来の低分子とは異なる骨格を形成しています。
これにより、ヘリックスの骨格の付け根と同じようなところにアミノ酸の付け根の部分を生やすような構造を持つ化合物を作り出しました。アミノ酸を自由にさまざまなパターンで組み合わせることにより、ヘリックス構造を模倣する低分子化合物を作ることに成功しています。
「細胞内」PPIをターゲットとする創薬の課題
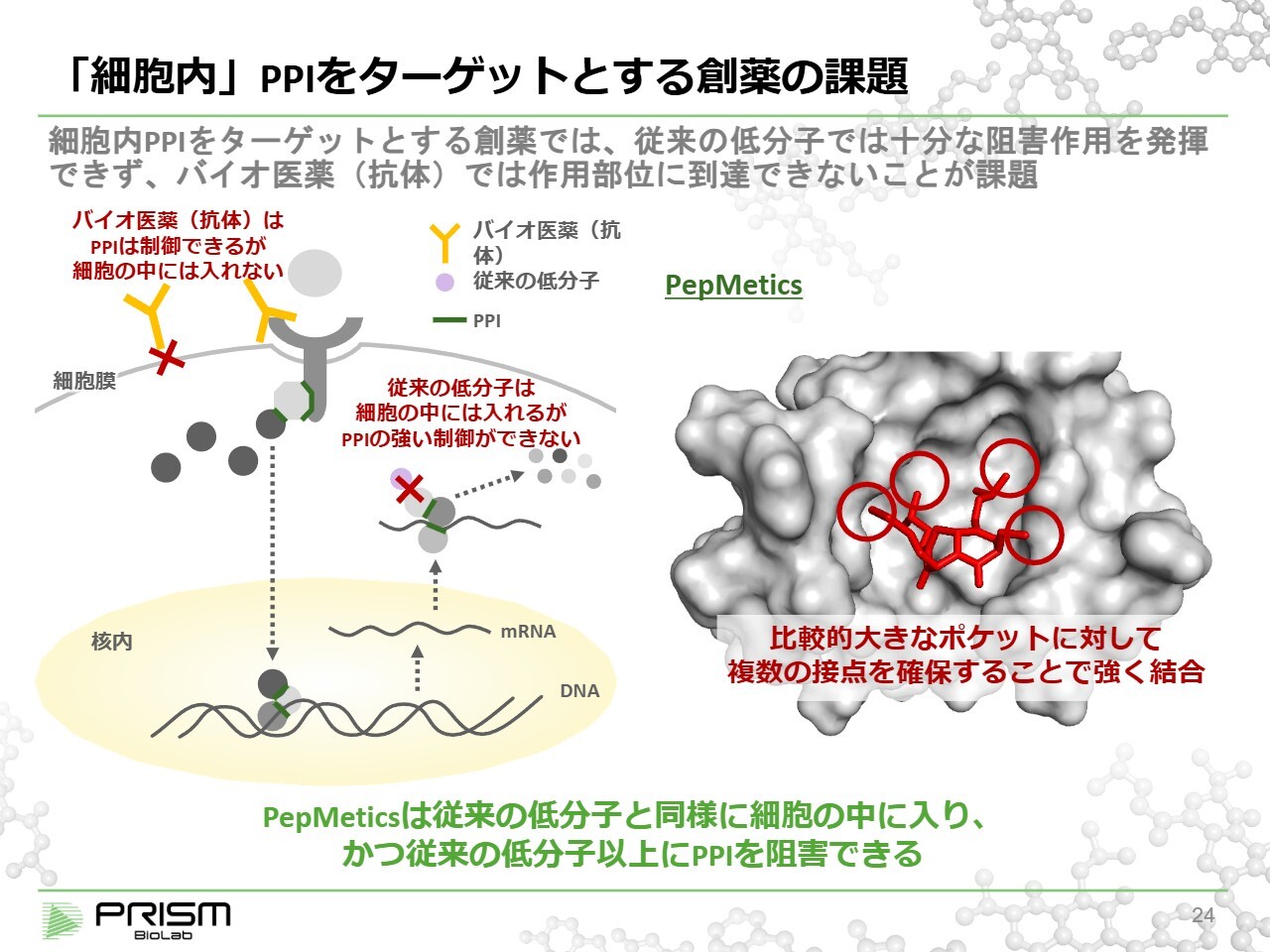
従来、PPIは低分子で制御することが難しいため、抗体やタンパク質医薬などの高分子を用いて制御されてきました。例えば、細胞外でのリガンドと受容体の結合は、抗体などの高分子によって制御ができるのですが、高分子は分子が大きいため細胞膜を通過できず、細胞内のPPIを効果的に制御する方法はこれまで見つかっていませんでした。
細胞内にはさまざまな重要なPPIが存在しており、それらが適切に調整されていますが、現状では多くが創薬標的とされてきませんでした。例えば、このグレーのポケットは、1つのタンパク質の一部分であるポケットになっており、ここにヘリックスがはまるような大きな穴となっています。
我々の化合物は、従来の低分子にとっては大き過ぎて狙いどころがなかったヘリックスの大きな穴に対し、先ほどご説明したように、4つの手がヘリックスと同様に結合することで、従来の低分子とはまったく異なる結合様式で強く結合することができます。その結果、PPIの制御が可能となっています。
細胞内PPIに対する他モダリティとの比較優位性
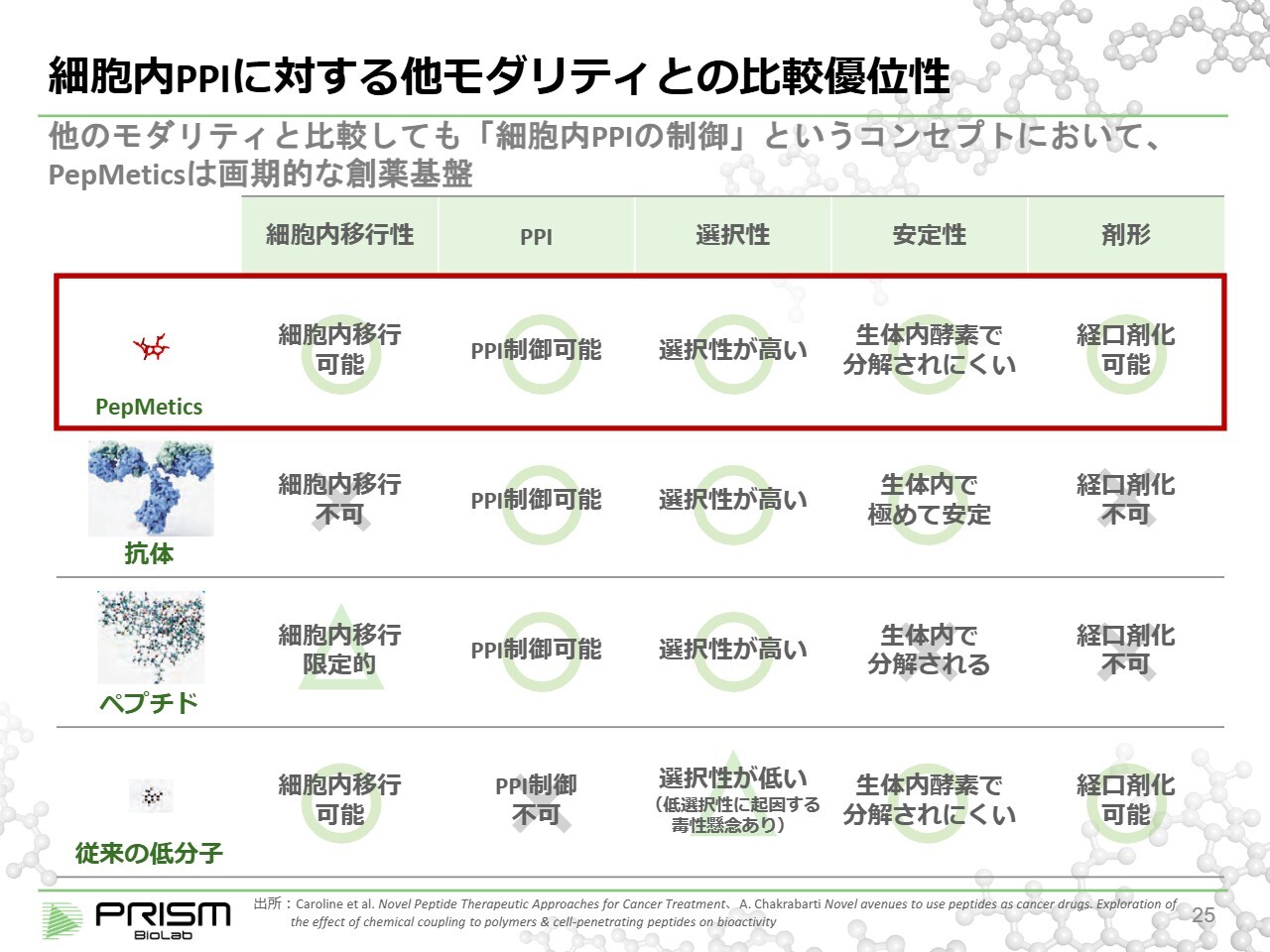
まとめますと、従来の低分子は細胞内には入るものの、PPIを制御することができません。一方で、PPIを制御できるような大きな化合物、抗体やペプチドはなかなか細胞内に入っていきません。またそれらは安定性の問題もあり、経口剤として利用するまでに多くの課題があるのが実情です。
それに対して「PepMetics」は、細胞内に入ってPPIを制御するとともに、選択性が高く、経口剤としても利用可能な新しいモダリティとして可能性を秘めています。
化合物の設計におけるPepMeticsの柔軟性
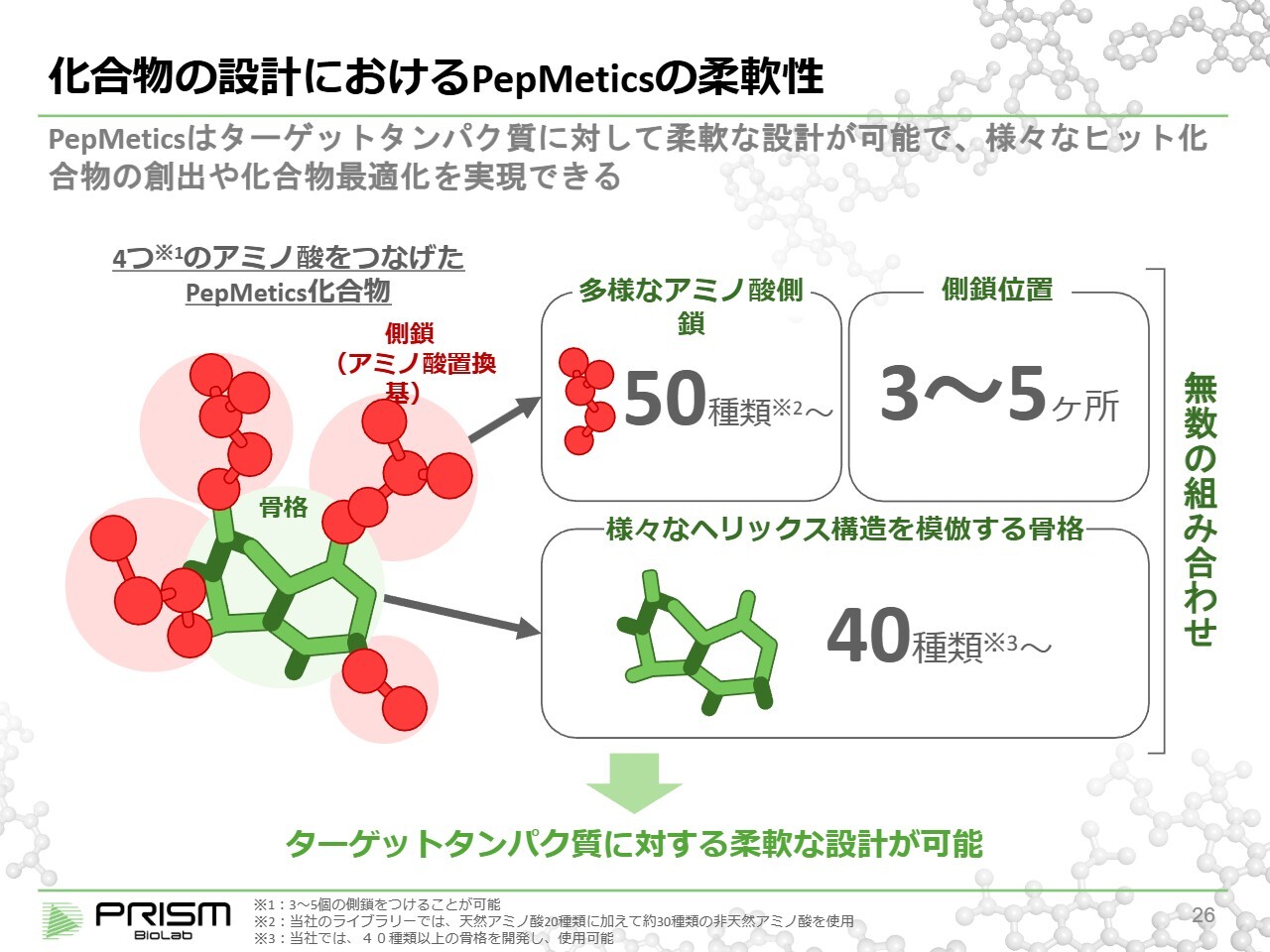
当社は「PepMetics」を40以上の骨格で構成しております。この数は今後も増加しています。また、20種類の天然アミノ酸を含む50種類以上のアミノ酸を標準的に用意しており、例えば、4つの側鎖を合成すると、40掛ける50の4乗で、約2億5,000万通りの設計が可能です。その中で約3万の化合物をライブラリとして確保し、それを基に創薬を進めています。
プログラムの進捗:自社開発
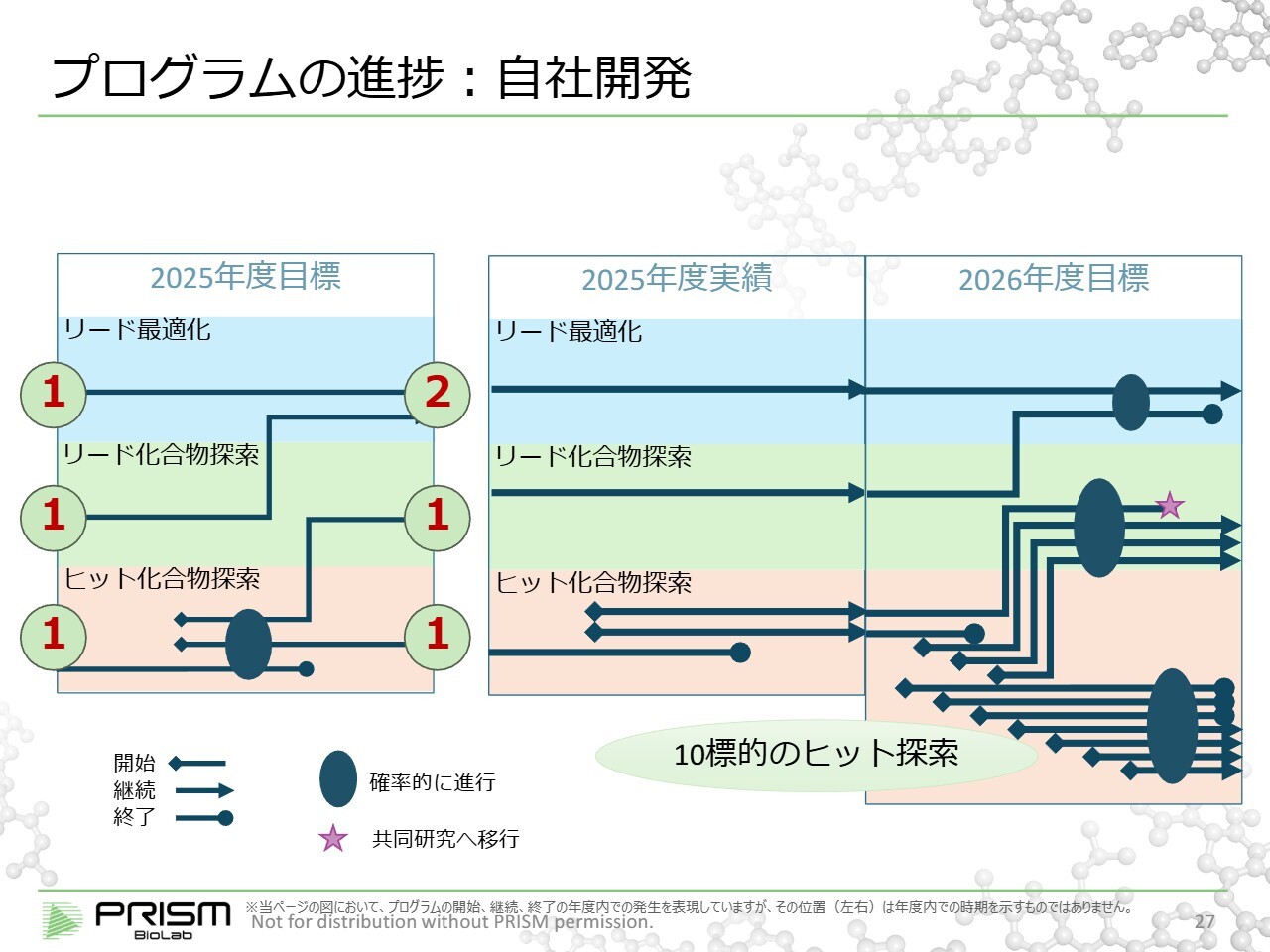
「自社開発」で進行中のプロジェクトについてご説明します。2025年度の目標として期首にご説明した内容がスライド左側で、標的に対してヒット化合物を生み出すステージがスライドのピンク色の部分の「ヒット化合物探索」です。ヒット化合物が出てくると、「リード化合物探索」(スライド緑色の部分)に移行します。リード化合物が動物でも適切に確認できれば、「リード最適化」(スライド青色の部分)に進み、最終的に薬として整えていく作業となります。
2025年の期首においては、スライド左に赤字で「1、1、1」と示したとおり、それぞれのステージで1つのプログラムが進行していました。今期目標として上から「2、1、1」と、プログラムのステージを引き上げるべく努力を重ねてきましたが、残念ながら今期はステージアップには至りませんでした。それでもなおこれらのプロジェクトを継続しています。
当社では、成功確率をさらに高めるために、先ほどご説明したHTS(ハイスループットスクリーニング)の技術を活用し、それをより加速させていくために、これまで2つ程度と設定していた「ヒット化合物探索」を、2026年度には一気に10個の標的に増やしてHTSで推進する計画です。
「ヒット化合物探索」の中で、およそ半分の確率で次のステージに進む状況ですので、10標的中4つは期中では結果が出ないとしても、その他の6つのうち3つが「リード化合物探索」のステージへ進むと見込まれます。加えて2025年度に開始している2つのうち1つが進むとすれば、2026年度の「リード化合物探索」のステージには合計で4つほどのプログラムが進行中となると見ています。
また、ヒット化合物が得られたプログラムを共同研究へ移行させる試みを進めていく予定です。これには背景があり、現在、5社の製薬会社とさまざまな標的に対して取り組んでいますが、先ほどもご説明したとおり、細胞内のPPIを低分子で制御するのは難しいとされており、低分子でそのようなプログラムを持つ製薬企業は比較的少ないのです。
すなわち「良い標的があれば興味を持つ」というパートナー候補が多くあり、さらに、優れた標的に対する化合物がそろえば、より一層関心を引くことができます。そのため、標的を製薬会社から提案していただくのではなく、当社から標的と化合物を組み合わせたヒット化合物を提案することで、共同開発の数を増やしていきたいと考えています。
プログラムの進捗:共同開発
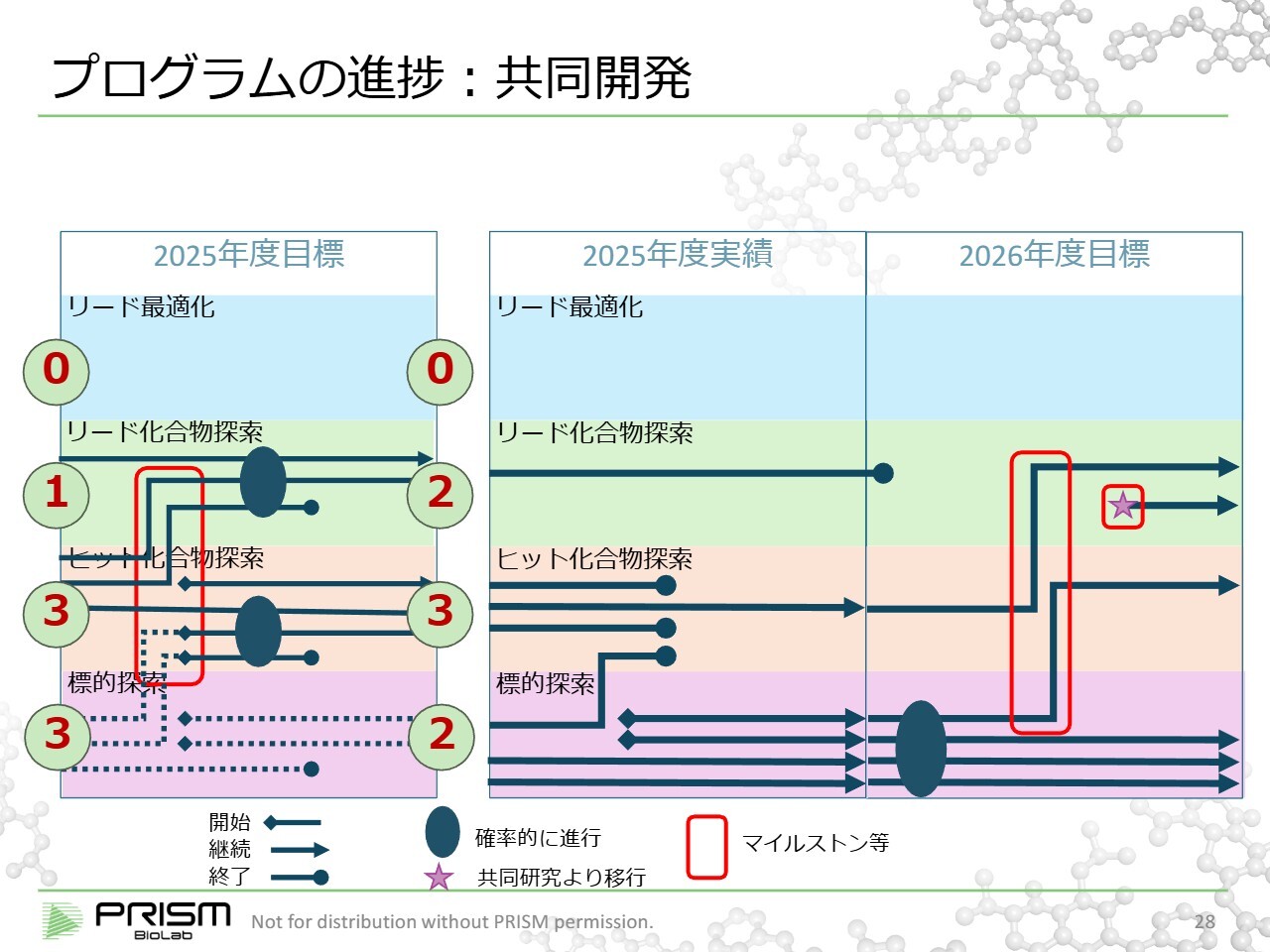
「共同開発」については、先ほどと同じダイヤグラムで、標的探索の段階から進めています。今期の目標は「0、2、3、2」という状態を目指していましたが、残念ながらステージアップはありませんでした。しかし、当期に入り、小野薬品工業に関するリリースのとおり、マイルストンを達成し、その進捗が見えてまいりました。
これは当社にとって大変自信につながるものであり、結果が出つつあるとお考えいただければと思います。
今期は、2つのステージアップと、先ほどお話しした「自社開発」から「共同開発」につなげる契約を進めていくことを目標としています。
創薬基盤ベンチャー ⇒ PPIの総合的先端技術をリードする創薬企業
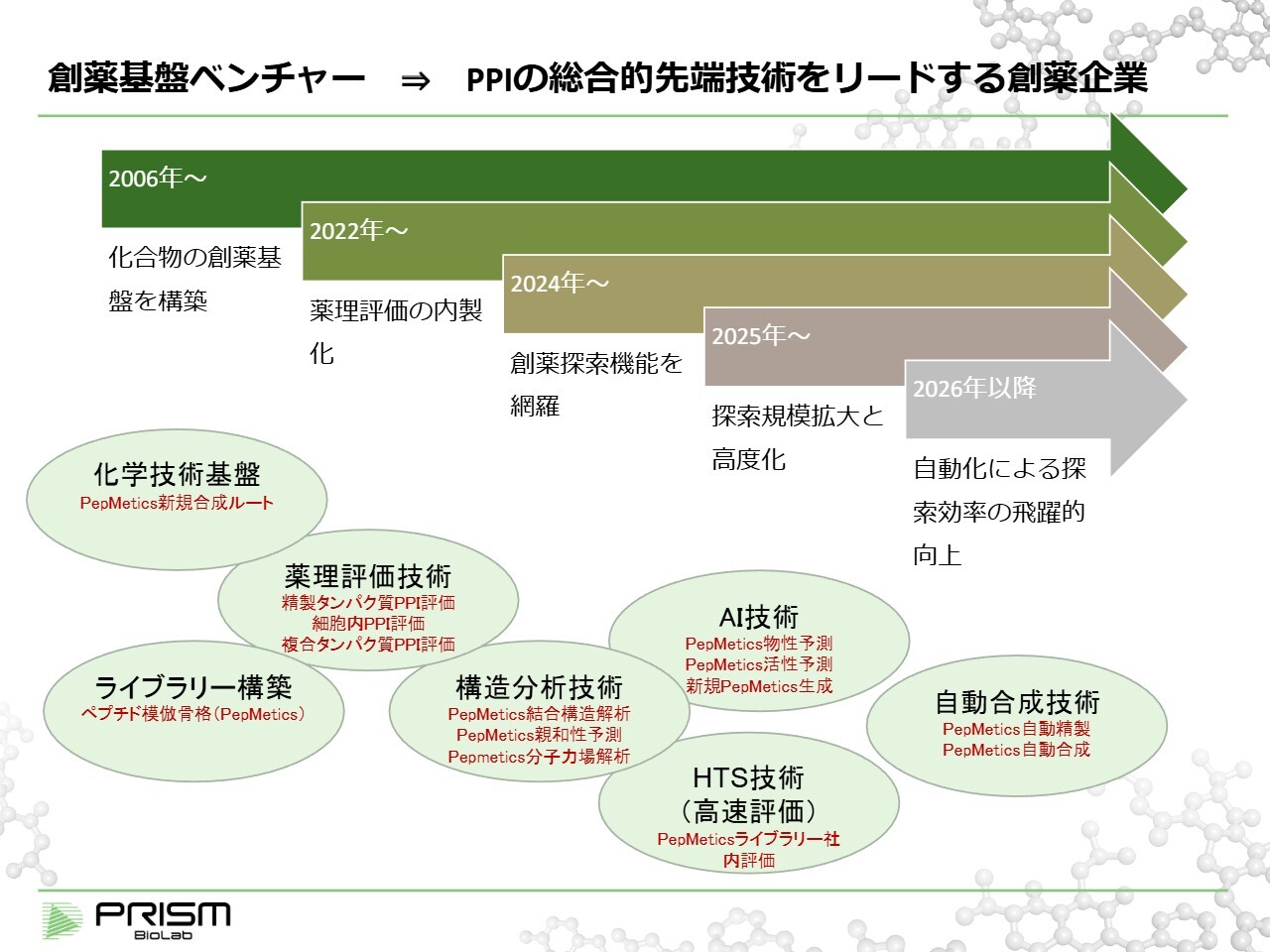
このようなプログラムの進捗を支えるため、創薬基盤への継続的な投資を行い、より強固にしています。
当社が2006年に設立された当初は、有機合成を通じて新しい骨格を創出する合成技術が中心でした。それを数年前からさまざまな機能を拡充する取り組みを進めてきました。
具体的には、バイオロジーや薬理評価技術、構造分析、2025年にはAI技術、さらに先ほどご説明したHTSも含め、創薬に関するプロセスを自社内で完結できる体制を構築してまいりました。
今後、さらなる加速を図るため、自動合成技術の導入など、今後も拡張を進めていきたいと考えています。
PPI創薬を加速する2つの戦略
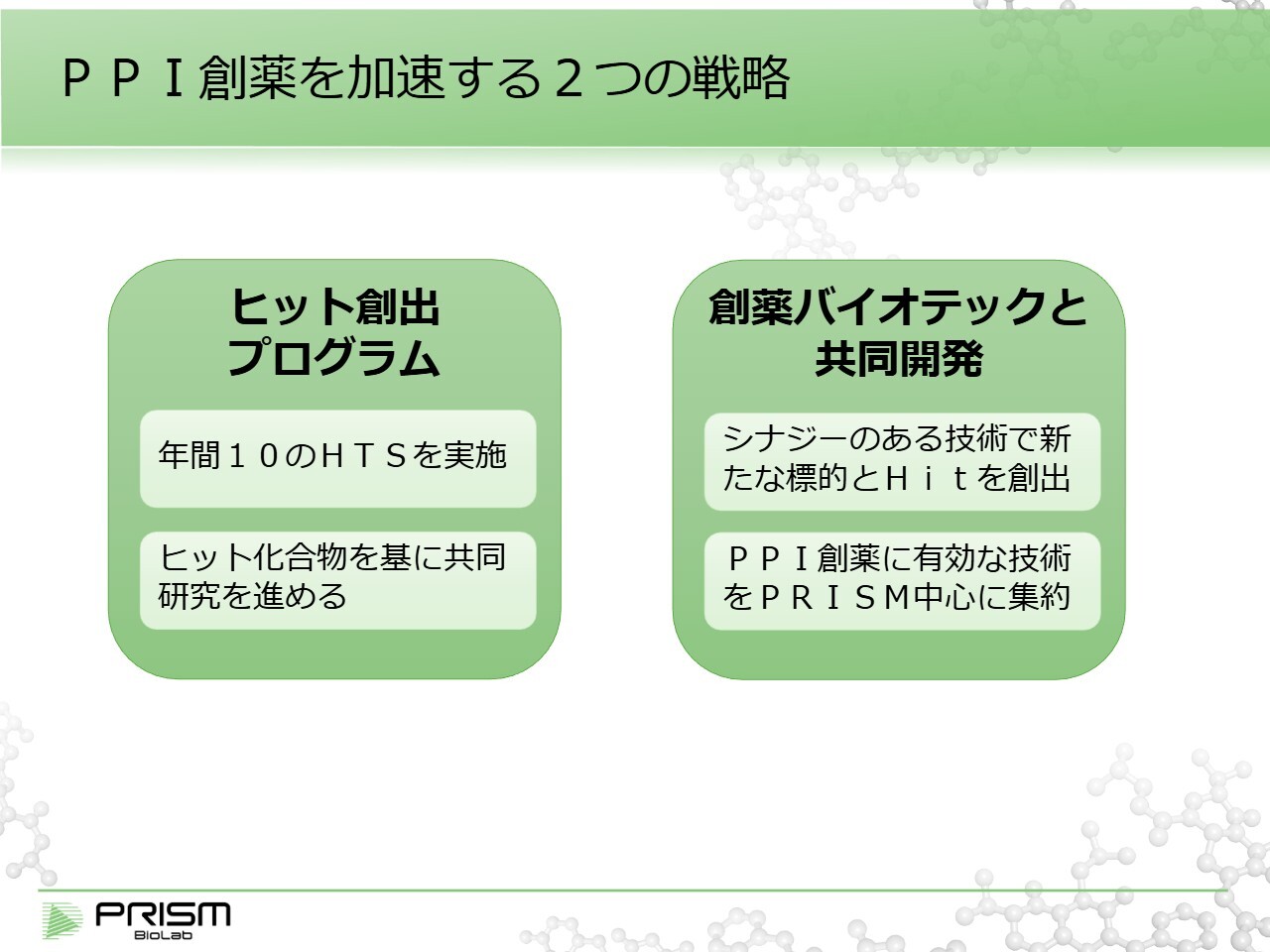
これらの基盤が整ってきたことを受け、2026年度に新たな飛躍を遂げるため、2つの戦略を策定しました。
1つ目は、先ほどもご説明しましたが、HTSの数を増加させ、多くのヒットを生み出すことです。自社で開発する場合もあれば、共同研究に進める可能性もあります。
2つ目は、創薬バイオテックとの共同開発です。2025年度にさまざまな企業と話し合いを進めてきた結果として、この軸を設定しました。
我々は、PPI創薬において極めて優秀な化合物を開発しており、その可能性を信じています。
しかし、創薬は非常に難しく、とりわけ新しい分野である細胞内PPIでは、化合物だけでは解決できないさまざまな課題が存在します。
例えば、標的の選定や評価方法といった点でPPI特有の課題がありますが、このような課題を解決する技術を持つベンチャー企業は、グローバルに見ると一定数存在します。
そのような企業との交渉を複数進めており、共同で取り組むことで、1社単独で行うよりも効率的に創薬を進めることを目指しています。シナジーのある技術同士を組み合わせて共同で成果を創出することを積極的に促進していきます。
その中で、当社はPPI創薬に関してさまざまな技術を集約していくことを目指しています。
PPI創薬コンソーシアム構想を始動
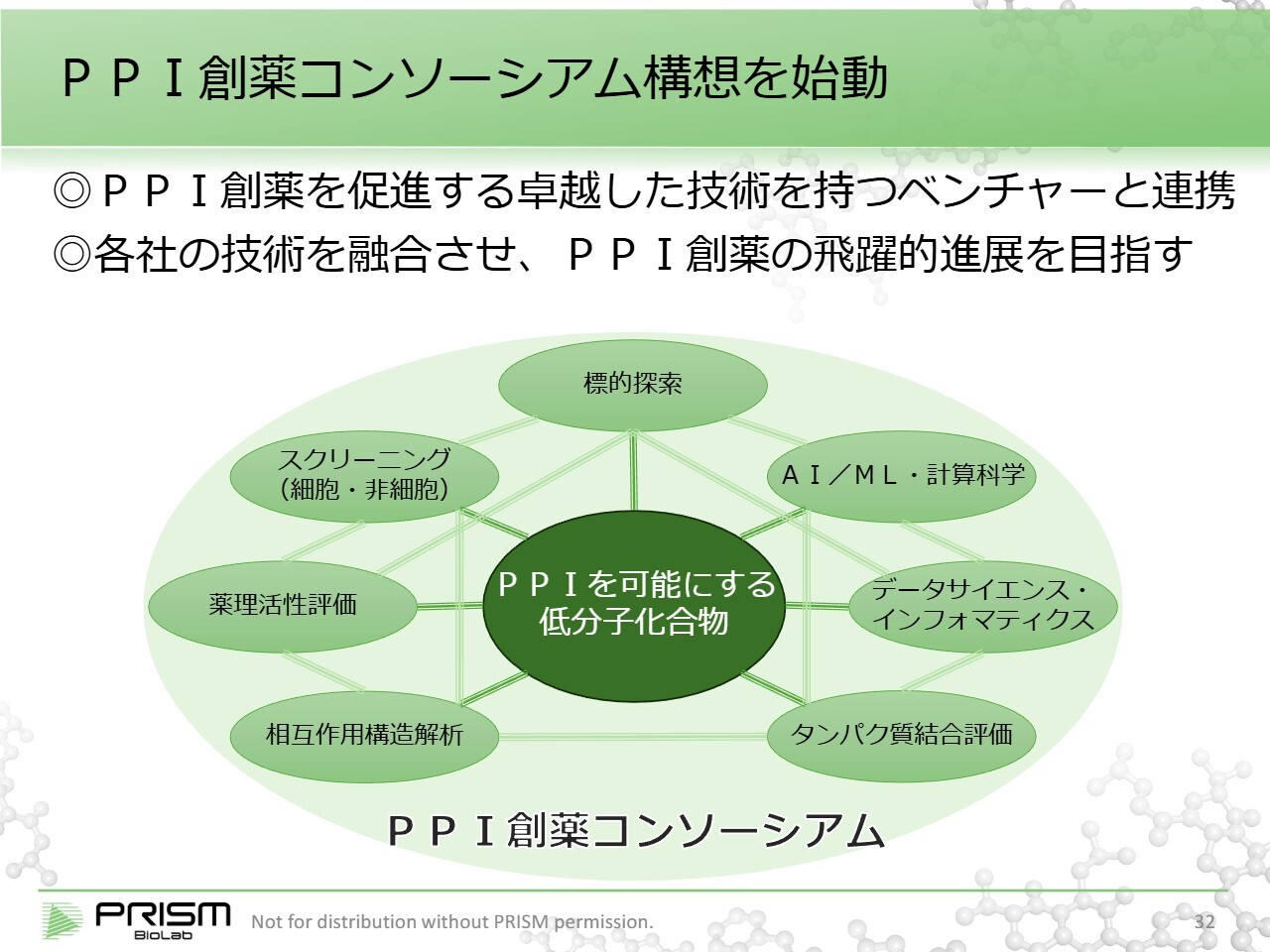
これは最終的な構想ですが、当社が保有するPPIを可能にする低分子化合物や、PPIに必要なさまざまな技術を持つ創薬ベンチャーとの連携を考えています。
当初は1対1の共同プロジェクトから始まると思いますが、将来的にはこれらが有機的に融合することで、質の高い創薬プラットフォームになると考え、「PPI創薬コンソーシアム」と名づけました。
このコンソーシアムを今年から構築することを目標に進めていきたいと考えています。
創薬業界のパラダイムシフト

これまでご説明してきたように、創薬の世界は、連続的に成長するのではなく、新しい技術の開発によって飛躍的に変化し、多くの薬が一度に生み出される、という特徴があります。
例えば、低分子化合物が薬になることが解明され、その合成が可能になると、20世紀には低分子医薬品が数多く作られました。また、バイオ医薬の分野では、タンパク質医薬が注目され、バイオ医薬の開発に集中する企業も現れました。さらに、抗体やキナーゼ阻害剤も多くの薬を生み出しています。
このような状況の中で、私たちが目指す細胞内のPPIも、新しい創薬分野を創出する1つの技術になると確信しており、その技術を生み出していきたいと考えています。
以上で説明を終わります。ご清聴いただき、ありがとうございました。
質疑応答:保有する知的財産と特許戦略について

司会者:「これまでに取得した特許があれば教
新着ログ
「医薬品」のログ