【QAあり】クリングルファーマ、米国に子会社設立し海外開発を展開 国内声帯瘢痕第Ⅲ相の進捗により試験終了に目途
アジェンダ

安達喜一氏(以下、安達):みなさま、本日はお集まりいただき誠にありがとうございます。クリングルファーマ株式会社代表取締役社長の安達喜一です。これより、2025年9月期通期の決算説明会を開催します。
こちらが本日のアジェンダです。はじめに、2025年9月期のトピックスをまとめてお話しします。続いて、各開発パイプラインの進捗状況として、脊髄損傷急性期、声帯瘢痕、筋萎縮性側索硬化症(ALS)についてご説明します。
続いて、成長戦略、2025年9月期通期の決算概況および2026年9月期の業績予想についてご説明します。
会社概要

当社は「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに対して画期的な治療手段を提供し、社会に貢献すること」を企業理念とする大学発の創薬バイオベンチャーです。
現在、再生創薬シーズHGFの医薬品開発に注力しています。このHGFは、日本で発見された体内に存在するタンパク質です。もともと肝臓の再生を担うタンパク質として日本で発見されましたが、その後の研究により、肝臓だけでなく、さまざまな組織や臓器の再生や修復、保護を担う非常に重要なタンパク質であることがわかっています。
左図にありますように、HGFは非常に複雑な構造を持ち、692個のアミノ酸がつながり、19個の分子内架橋による複雑な立体構造を形成しています。当社はこのHGFを組換えタンパク質として工業的に大量製造し、医薬品開発を進めています。
当社のHGFは、国際一般名称がすでに決定しており、「Oremepermin Alfa(オレメペルミン アルファ)」という名称となっています。
2025年9月期のトピックス(後発事象を含む)

こちらは、2025年9月期におけるトピックスを、後発事象を含めてまとめたものです。
まず、国内におけるレイトステージの開発パイプラインについてです。脊髄損傷急性期に関しては、国内で第Ⅲ相試験を終了し、PMDAと約1年間協議を継続してきました。当社としては承認申請に進む意向でしたが、PMDAから追加試験の実施が求められました。そのため、追加試験を実施した上で承認申請を行う方針を今年7月に決定しました。
もともと2025年9月期に承認申請を行う予定で、そのための医薬品製造販売業許可を今年の1月に取得しました。しかし、承認申請が後ろ倒しとなったため、業許可を8月にいったん返納しています。承認申請のタイミングが来た際には、再び業許可を取得した上で承認申請を行う予定です。
声帯瘢痕については、第Ⅲ相臨床試験を国内で進めており、現在8施設で患者さまの組入れを継続しています。今年の12月までに目標症例数に到達する見込みがほぼ明確になったため、新しい情報としてこちらに掲示しています。
第3のパイプラインであるALSについては、第Ⅱ相試験の追加解析を進めており、バイオマーカーを解析しています。バイオマーカーの測定はすでに終了しており、現在、第Ⅱ相試験の臨床データとの突き合わせを行いながら解析を進めています。
海外展開については、米国での脊髄損傷急性期に関して、FDAから希少疾病用医薬品指定(オーファン指定)を取得しました。日本ではすでに希少疾病用医薬品指定を取得済みであり、これで日本および米国の両国でオーファン指定を取得したことになります。
今期は米国での開発をさらに加速するため、100パーセント子会社のKringle Pharma USAを米国に設立しました。こちらについては、後ほどお話しします。
最後に適応拡大の話題です。3件の共同研究を新たに開始しました。1件目は、神戸大学との共同研究で線維化疾患の一種であるペロニー病への応用研究に関するものです。2件目は、慶應義塾大学との共同研究で末梢神経障害への応用研究です。3件目は、京都大学との共同研究で徐放性創傷治療剤の開発に関するものとなっています。
開発パイプラインの概要

各開発パイプラインの進捗状況についてお話しします。こちらは、臨床段階にあるパイプラインの概要を示しています。内容は前回の決算説明会から変更はありません。脊髄損傷急性期の追加治験については、後ほど詳細をお話しします。
クリングルファーマの成長戦略
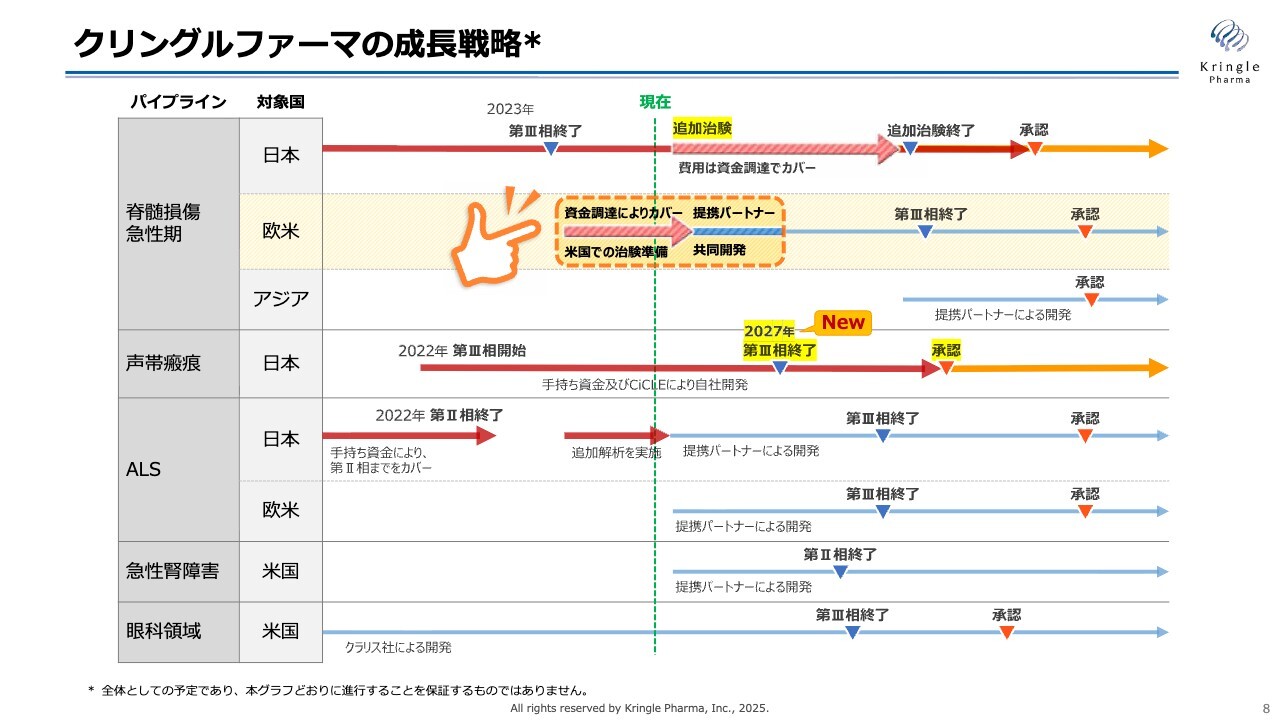
こちらも、毎回示している成長戦略です。脊髄損傷の国内については、追加治験の矢印を新たに加えました。また、声帯瘢痕に関する新たな情報として、患者さまの組入れ終了の目処が立ってきました。その後、1年間の経過観察を行うため、第Ⅲ相試験の終了タイミングとして2027年を新たに加えています。
脊髄損傷の追加試験の内容にもよりますが、順調に進めば、声帯瘢痕の承認申請および承認のほうが早くなる見通しです。
開発パイプライン -脊髄損傷急性期-

脊髄損傷急性期についてお話しします。国内では現在、年間で約6,000人が新たに脊髄損傷を負うと言われています。脊髄損傷急性期には、薬剤や手術による根本的な治療法が存在しないため、アンメット・ニーズが非常に高い疾患です。この疾患は患者さまのみならず、ご家族や介護をされる方にも大きな負担を強いるため、新しい薬剤を社会実装することは、非常に意義のあるプロジェクトです。
脊髄損傷急性期にHGFに期待する治療効果
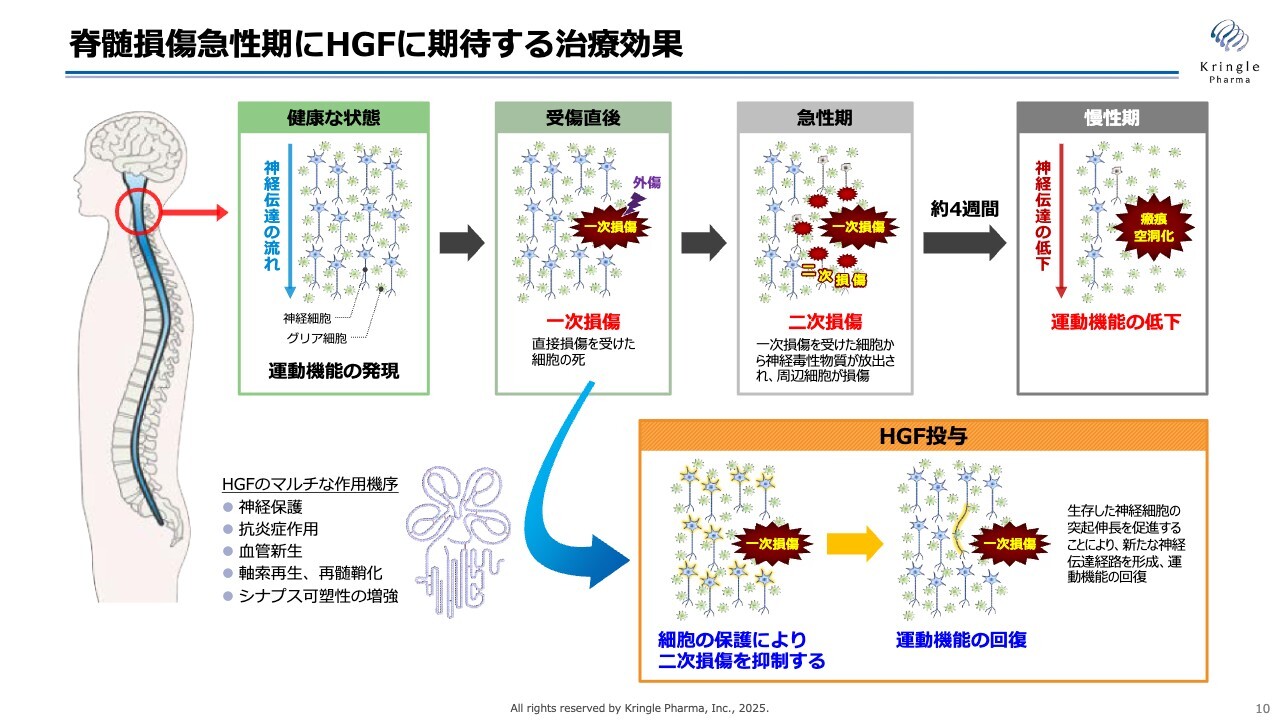
こちらは振り返りとなりますが、脊髄損傷の急性期におけるHGFに期待される治療効果をまとめたものです。脊髄損傷は、さまざまな原因によって一次損傷が生じた後、受傷後の約2週間から1ヶ月程度の間に二次損傷が進行し、損傷範囲が拡大するというイベントが起こります。
この損傷範囲の拡大が進むと、慢性期に瘢痕化や空洞化が生じ、神経伝達が上から下へとつながらなくなるため、運動機能が低下します。
したがって、急性期の二次損傷を可能な限り抑えることで患者さまの予後を改善できることがわかっていますが、現時点でこの二次損傷を抑える薬剤はありません。
急性期には炎症だけでなく、さまざまなイベントが多発的に同時に起こります。それをいかに抑えるかが課題ですが、HGFには神経保護、炎症の抑制、血管新生、軸索の再生といった多面的な作用があります。これらの作用により急性期の二次損傷を抑え、患者さまの予後の運動機能の回復につながることを期待しています。
脊髄損傷急性期 第III相試験 -重症度の改善、第I/II相との比較-
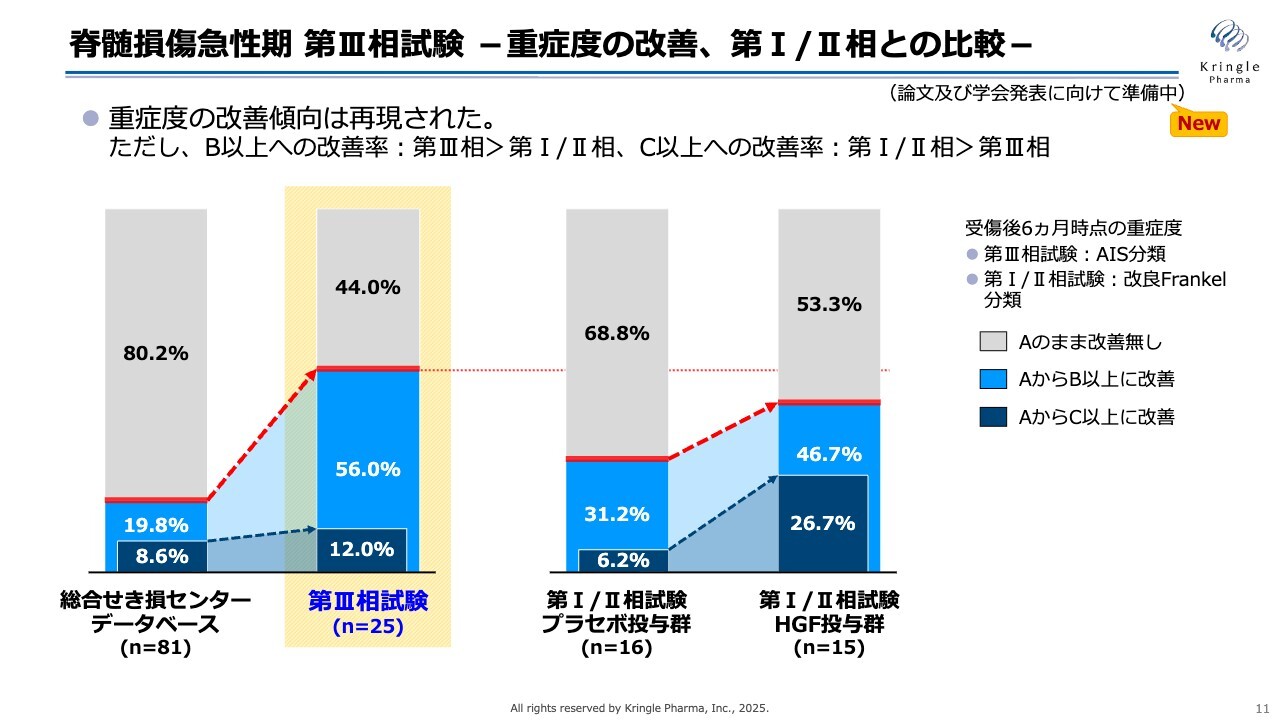
当社は国内ですでに2つの臨床試験を終了しています。第Ⅰ/Ⅱ相試験はプラセボ対照二重盲検比較試験として実施しました。その後、第Ⅲ相試験は単群非盲検試験として実施しています。
スライドの4つのバーは、左から順に、総合せき損センターにある患者さまの過去のデータベース、第Ⅲ相試験の結果、第Ⅰ/Ⅱ相試験のプラセボ群と実薬群という並びです。
色が付けられている部分は、重症度の改善を示しています。濃い青い部分は重症度AからC以上、2段階以上改善した方を示し、薄い青い部分は重症度AからB以上、1段階以上改善した方を示しています。どちらの試験も、非常に重度な脊髄損傷の患者さまにご協力いただいています。
このような重度の患者さまの場合、データベースの数値を見てもわかるとおり、ほとんどの方は重症度Aが改善しません。しかし、第Ⅲ相試験でHGFを投与した群では、半数以上の方が1段階以上改善しており、薄い青い部分で示されているとおり、データベースと比較しても非常に大きな改善が見られました。
一方、第Ⅰ/Ⅱ相試験のデータを確認すると、HGFを投与した群で重症度が改善する傾向は同様ですが、2段階以上改善した割合が第Ⅰ/Ⅱ相試験では非常に高かった点が特筆されます。
第Ⅲ相試験では、データベースと比較して数値は大きくなっているものの、統計的な有意差は認められませんでした。一方で、1段階以上の非常に大きな改善が見られたことが特徴です。
現在、この第Ⅲ相試験の結果と第Ⅰ/Ⅱ相試験のデータとの比較について、慶應義塾大学を中心に論文としてまとめており、来年には論文が発表される予定です。また、国内および海外の学会でも発表を行う予定で、現在その準備を進めています。論文や学会発表の日程が具体的に決まり次第、開示します。
脊髄損傷急性期 第III相試験 -患者背景に関する考察-

先ほど示したとおり、国内で実施した第Ⅰ/Ⅱ相試験および第Ⅲ相試験では、重症度の改善傾向が再現されています。しかし、細かく見ると、1段階の改善と2段階以上の改善で傾向に差があることがわかってきました。これに関しては、患者さまの背景を詳細に分析し、このスライドに示したような考察を行っています。
具体的には、第Ⅰ/Ⅱ相試験では、高齢者の転倒や転落、いわゆる中心性頚髄損傷といった症例が多く見られました。このような患者さまの場合、下肢が回復しやすく、重症度分類がAからCへ改善する症例が多かったという特徴があります。また、スライドには記載していませんが、motor scoreが10点以上改善した症例が非常に多かったことも特徴的でした。
一方、第Ⅲ相試験についてですが、まず、第Ⅰ/Ⅱ相試験との最大の違いとして挙げられるのは、この試験がコロナ禍に実施された点です。おそらく、コロナ禍において高齢者ほど行動制限を徹底された影響により、第Ⅲ相試験で組み入れた患者さまは、壮年層で交通事故など高エネルギー外傷を伴う重度な症例が多かったと考えています。
もともと重度の脊髄損傷の患者さまをリクルートしている中で、第Ⅲ相試験ではさらに重度の症例が組み入れられました。重症度で言えば、1段階Bまで改善する症例が多かったものの、さらにCまで改善する症例や、motor scoreで5点以上改善した症例はありましたが、そこからさらに10点以上改善する症例には至らなかったと考察しています。
これら2本の試験に加え、オーファン指定を受けている薬剤の有効性を示す資料として、事後解析の結果も含め、PMDAとの協議を進めてきました。しかしながら、追加の臨床試験を実施することになり、追加試験で有効性データを取得した上で承認申請を目指す方針となりました。
PMDAもHGFの効果を否定しているわけではありません。そのため、追加試験によってデータを積み上げることで、承認申請に向けた確度がより高まったと考えています。
脊髄損傷急性期 追加治験のコンセプト
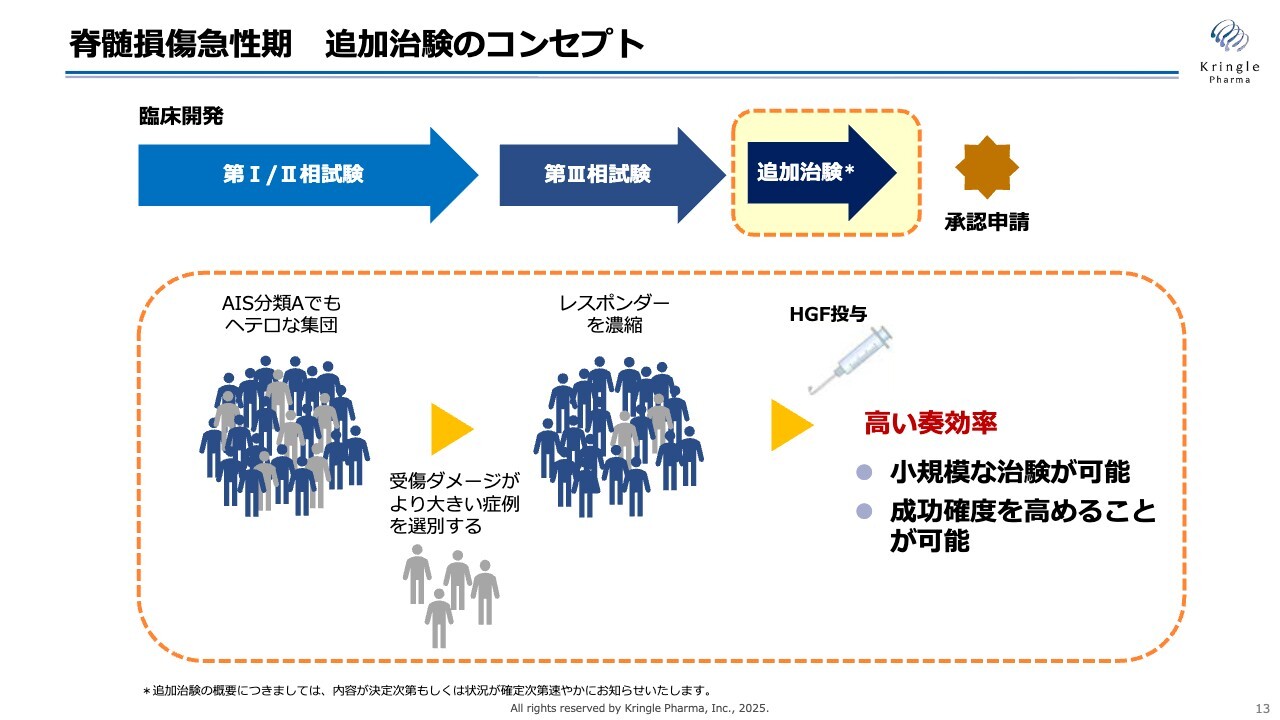
こちらは追加試験のコンセプトをまとめたものです。今回の試験および前相の試験から、重症度Aといっても非常にヘテロな集団であることがわかってきました。
スライドでは灰色で示していますが、重症度Aの中でも、より受傷ダメージが大きい症例が存在します。例えば、脊髄が完全に断裂しているような症例では、HGFを投与しても効果が見えづらいことがわかってきました。
そのため、次の追加試験では、受傷ダメージが大きい症例をなんらかの基準で除外し、レスポンダーを濃縮することでHGF投与による高い奏効率を得ることを目指します。このアプローチにより、小規模な治験が可能となり、成功確度も高まると考えています。基本的には、前相第Ⅲ相試験と同じく、単群非盲検試験を実施し、データベースと比較することで薬剤の効果を検証する方針です。
追加試験のデザインの骨子は以上のような内容となります。詳細については現在、PMDAと協議を進めています。
脊髄損傷急性期 薬事承認後のサプライチェーン
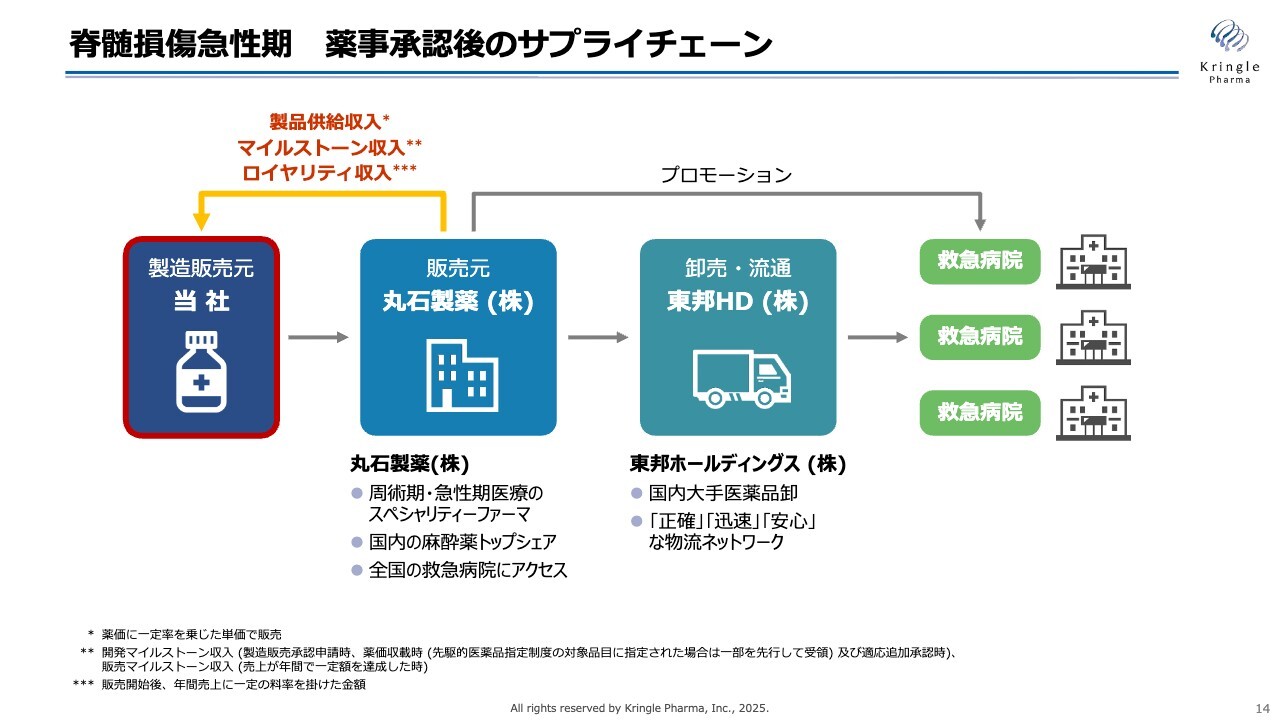
当社は、追加の試験を実施して製造販売承認を取得する方針に変更はありません。また、承認後のサプライチェーンについても、スライドに記載されているとおり、丸石製薬さまが販売元となり、東邦ホールディングスさまが卸売・流通を担うという体制も変更ありません。さらに、丸石製薬さまおよび東邦ホールディングスさまとの契約も維持されます。
開発パイプライン -声帯瘢痕-

続いて、第2パイプラインである声帯瘢痕についてご説明します。声帯は非常にデリケートな粘膜構造を持つ組織ですが、なんらかの原因で線維化し、正常に振動しなくなると、初期段階では声が出にくくなり、重症化すると声が出なくなる疾患です。
現在、有効な治療法や治療薬はありません。国内では約1万人が声帯瘢痕に罹患していると推測されていますが、治療薬や治療法がないことから、医療機関を受診しない潜在的な患者さまがさらに多いのではないかと考えられます。
発声障害の患者さんの声

こちらは前回の説明会でも示しましたが、声が出なくなることは、患者さまにとっては非常につらく、QOL(生活の質)を損なうことです。私たちは声が出ることを日常当たり前のこととして捉えていますが、それが不自由になることのつらさは、なかなか理解しにくいものです。
発声障害の患者会に私も参加しましたが、患者さまとお話をすると、日々の生活に大きな不自由を感じており、自分の意見を積極的に言えなくなることがあるとうかがいました。みなさま、非常に悩んでおられるという状況です。
声帯瘢痕に対するHGFの作用機序
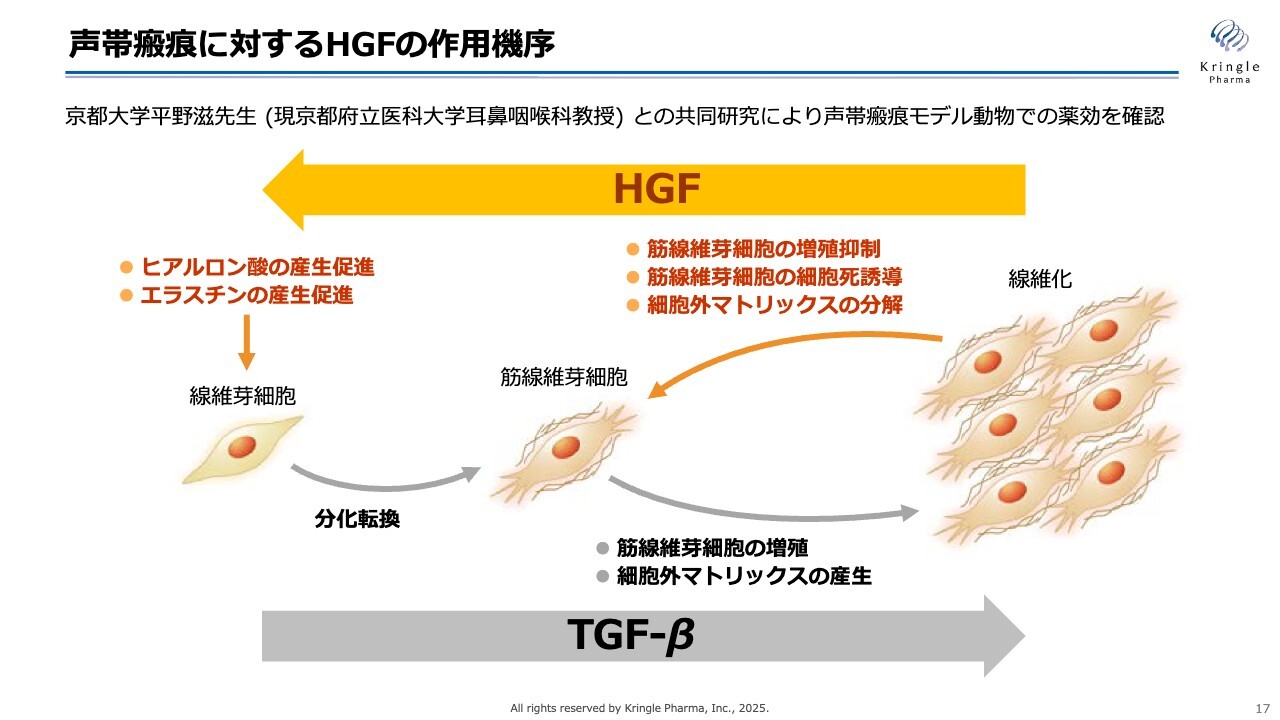
こちらも振り返りですが、声帯瘢痕に対してHGFがどのように作用するかをスライドにまとめています。線維化とは、このスライドの左から右へと線維芽細胞が筋線維芽細胞に分化し、それが増殖する現象です。これにはTGF-βという声帯内のタンパク質が関わっていることがわかっています。
HGFは、この線維化の左から右へ進む過程を逆向きに戻す働き、すなわち抗線維化の働きを持ちます。生体内のグロースファクターの中でも抗線維化作用を有するという点は、HGFの非常に特徴的な作用といえます。
筋線維芽細胞の増殖を抑えたり、細胞死を誘導したり、硬い成分であるコラーゲンを分解する酵素を多く生成するようになります。また、柔らかい成分であるヒアルロン酸やエラスチンの産生を促進する作用もあります。
声帯瘢痕 第I/II相試験の結果
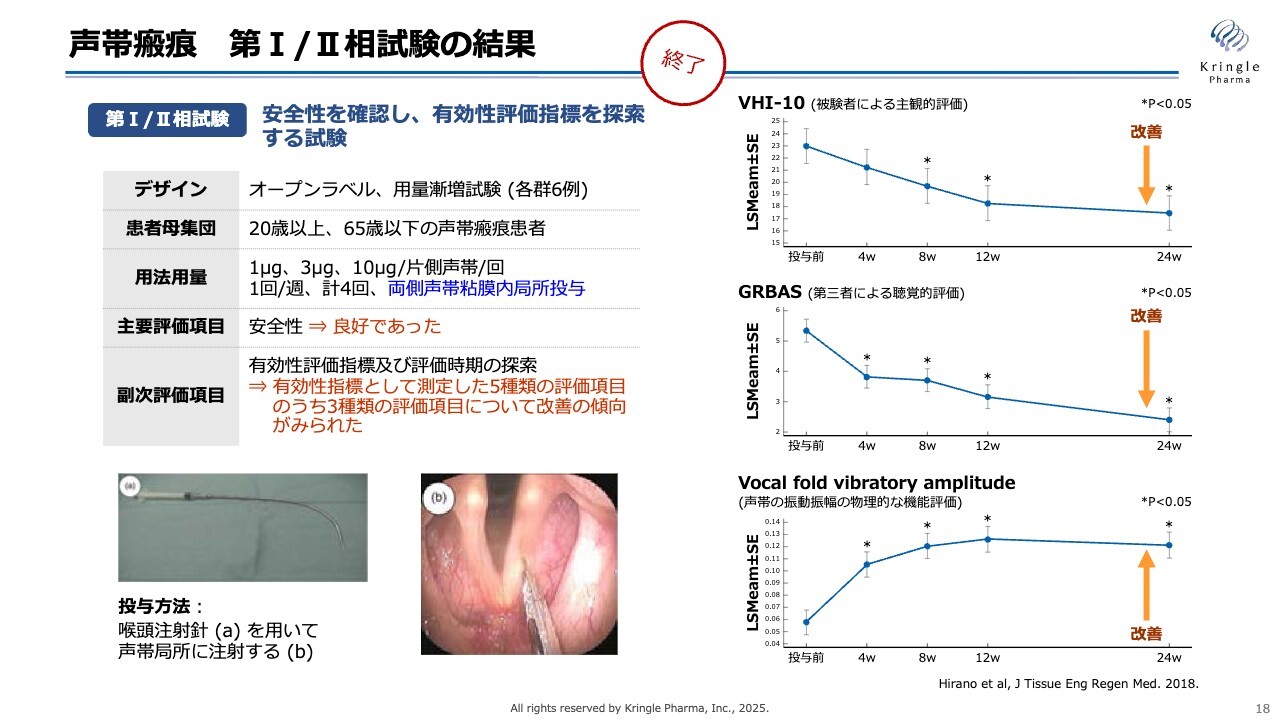
当社はすでに国内で第Ⅰ/Ⅱ相試験を終了しています。この試験はオープンラベルで実施し、患者さまを対象に行いました。声帯瘢痕については既存薬がないため、臨床試験の前例も世界的にほとんどありません。
したがって、臨床試験において何を評価項目とするかが定まっていない状況でした。そのため、この第Ⅰ/Ⅱ相試験では複数の評価項目を測定し、その中でスライドの右側に挙げられた3つの項目で改善傾向が見られました。
声帯瘢痕に対しては、スライドの左下に示した特殊な注射針を用いて、写真のように声帯の両側にHGFタンパク質を直接注射で投与します。この投与は、週に1回、計4回繰り返すという用法になっています。
声帯瘢痕 第III相試験(医薬品開発の最終段階)

前述の試験後、第Ⅲ相試験を国内で開始しました。この第Ⅲ相試験は、プラセボ対照二重盲検比較試験として実施し、目標症例数は62症例、HGF群とプラセボ群でそれぞれ31症例という設計です。
用量用法は前相と同じで、二重盲検期では週1回の投与を4回行い、その後6ヶ月間の経過観察を行います。継続を希望する患者さまには、継続投与期として必ずHGFを週1回、4回投与し、その後さらに6ヶ月間観察を行います。最長で1年間、この治験にご協力いただくという内容です。主要評価項目は6ヶ月目の「VHI-10(被験者の主観的な評価)」を設定しています。
現在、8施設で患者さまの組入れを進めていますが、冒頭でお伝えしたとおり、12月中に目標症例数である62に到達できる見込みがほぼ確実となりました。そのため、到達見込みとして新たに記載しています。
患者さまには1年間の経過観察を含めてこの治験に参加いただくこととなります。そのため、最終症例の経過観察は2026年末まで続き、2027年にはトップラインデータとともに試験が終了する予定です。
開発パイプライン -ALS-

続いて、第3のパイプラインであるALSについてご説明します。ALSは神経難病を象徴する疾患であり、体が徐々に動かなくなり、最終的には呼吸ができなくなって死に至るという非常に重篤で過酷な疾患です。既存薬はいくつかありますが、その効果はまだ限定的です。そのため、患者さまだけでなく介護者を含めて新たな薬が望まれています。
ALS 第II相試験(医師主導治験)

当社は国内において、第Ⅰ相試験および第Ⅱ相試験の2つの試験を終了しています。第Ⅱ相試験は、プラセボ対照二重盲検比較試験として東北大学で医師主導治験として実施しました。
本試験では、主要評価項目および副次評価項目に統計的有意差は見られませんでしたが、進行が抑制された症例が確認されたため、これをさらに詳細に解析することとし、東北大学との共同研究としてバイオマーカーの測定解析を行いました。
神経変性および神経炎症に関連するバイオマーカーについては、ALSにおいてすでにいくつか有望なものが存在しています。これらを測定し、HGFの投与と相関があるかどうかを、実際の臨床データを用いて検証する内容となっています。
バイオマーカーの測定自体はすでに終了し、データが出ています。現在、このデータを第Ⅱ相試験の臨床データと突き合わせ、詳細な解析を進めているところです。
クリングルファーマの成長戦略:3本の矢
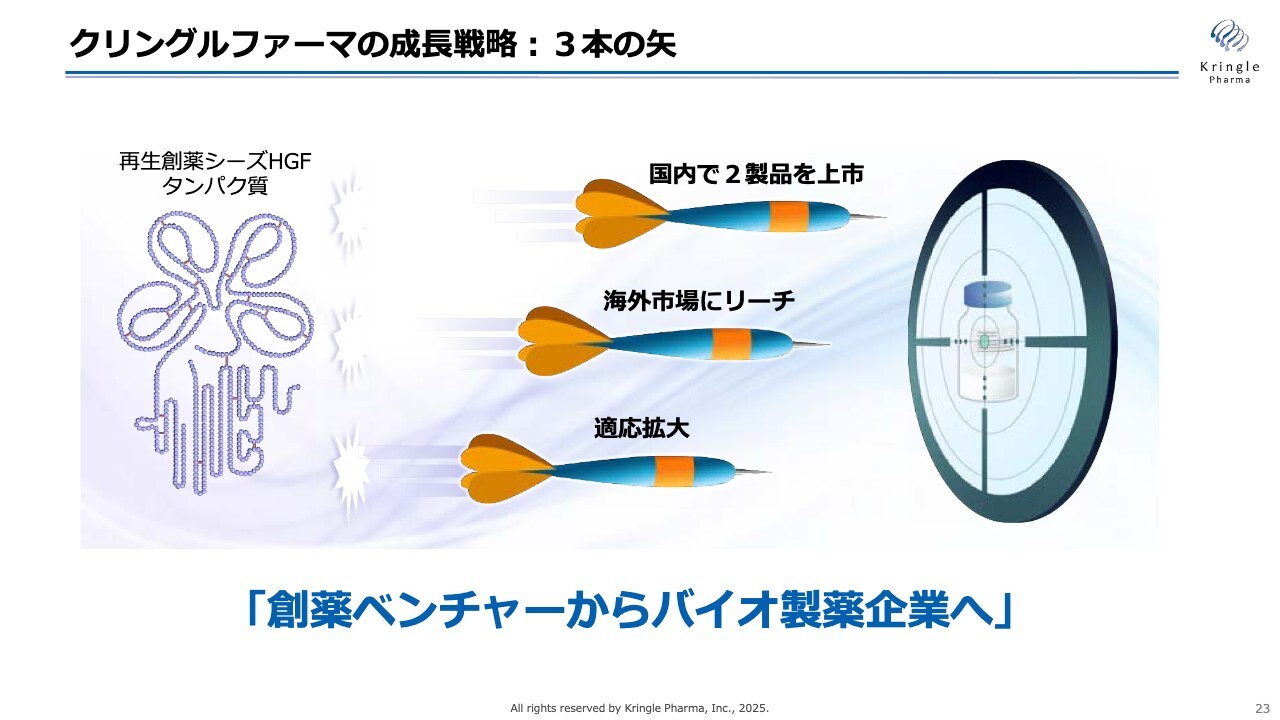
当社の成長戦略についてお話しします。この後、成長戦略として3つのポイントをお話しします。それを象徴的に「3本の矢」というかたちでスライドにまとめました。
まず、第1の矢は国内で2製品を上市すること、第2の矢は海外市場にリーチすること、そして第3の矢は適応拡大を図ることです。これにより、再生創薬シーズHGFの社会実装を目指します。
当社は、「創薬ベンチャーからバイオ製薬企業へ」と成長する未来を見据え、国内のみならずグローバルに展開していきます。
成長戦略1:国内で2製品を上市する
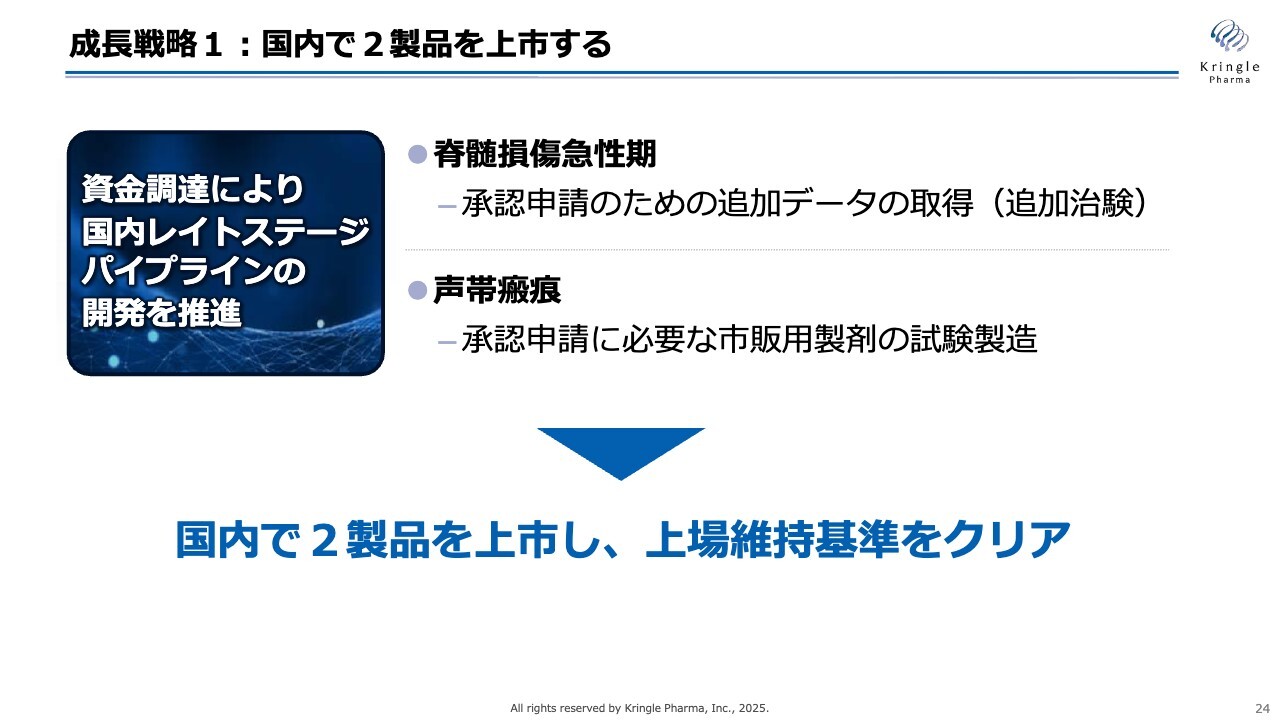
まず、成長戦略の一の矢として、レイトステージのパイプラインである脊髄損傷急性期および声帯瘢痕の2剤について、国内で承認申請し上市する計画です。当社が製造販売承認を取得し、製品を保有することとなります。
脊髄損傷急性期については追加治験を行った後に承認申請を行い、声帯瘢痕に関しては現在進行中の第Ⅲ相試験が終了後、その結果をもとに承認申請を進める予定です。
声帯瘢痕での承認申請のため、市販用製剤の試験製造がこれから開始されます。脊髄損傷の追加治験および声帯瘢痕の承認申請に必要なデータ収集については、現在進行中の資金調達でカバーする予定です。
当社はグロース市場に上場しておりますが、上場維持基準が厳しくなるとの発表がある中、国内でこれら2製品を確実に上市することで、問題なく上場維持基準をクリアできると考えています。
成長戦略2:海外市場にリーチする
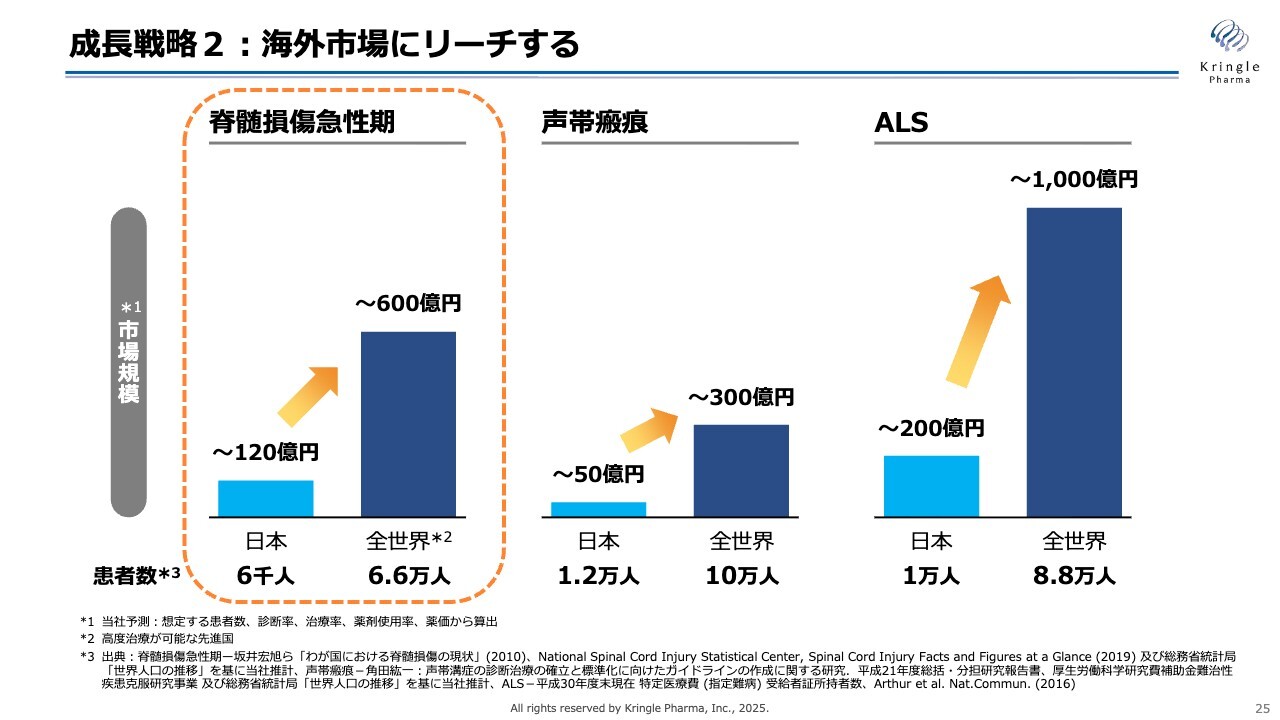
成長戦略の二の矢にあたるのが海外市場へのリーチです。脊髄損傷急性期、声帯瘢痕、ALSはいずれも希少疾患であり、日本国内だけで考えると市場はどうしても限定的です。
一方で、海外に目を向けると、患者数は約10倍に増え、それに応じた市場が存在します。HGFは日本人だけに特有なものではなく、人種を問わず、すべての人間の体内に存在するタンパク質であり、医薬品として適用可能です。
そのため、いち早く海外展開を行うことは、当社の成長にとって必要不可欠です。まずは、脊髄損傷急性期の治療薬を海外市場に展開していきます。
海外市場開拓:脊髄損傷急性期を対象とする米国での臨床開発
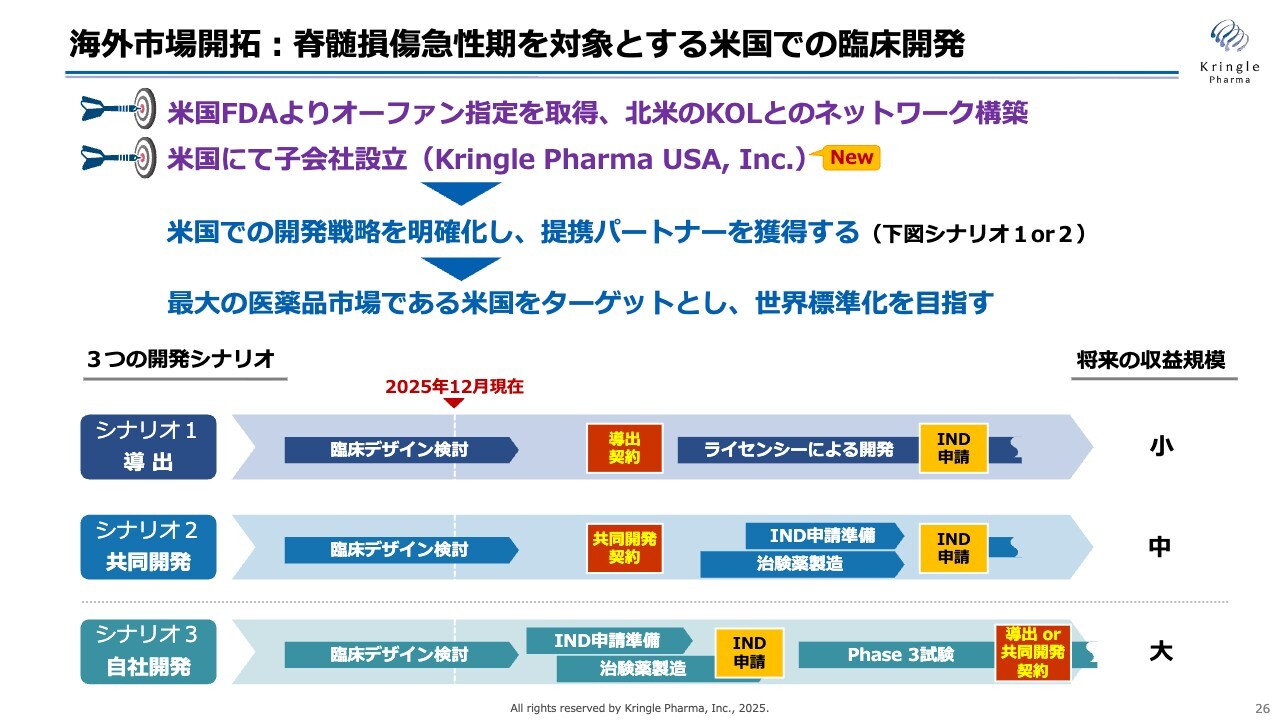
具体的には、米国での臨床開発を開始したいと考えており、すでに活動を進めています。米国のFDAからオーファン指定を取得しており、北米におけるキーオピニオンリーダーとのネットワーク構築も進めています。
今般、米国で子会社のKringle Pharma USAを設立し、今期はさらに米国での活動を加速させたいと考えています。米国での開発戦略が明確になるにつれ、現在進行中の提携パートナーとの交渉も進展する見込みです。なんとか提携パートナーを確保し、開発を実際に進めたいと考えています。
米国で承認を取得することができれば、それが世界標準化への最短の道となります。このようなかたちでグローバル展開を目指していきたいと考えています。
スライドの下には、3つの開発シナリオとして「導出」「共同開発」「自社開発」と記載しています。パートナーを得て導出する、あるいは共同開発するかたちを想定していますが、相手との交渉次第では、これらのハイブリッドのようなかたちも考えられます。
ただし、非常に開発の難しい疾患であるため、単純に製薬企業に導出するのではなく、当社も開発に関与する共同開発のかたちが望ましいと考えており、交渉を進めていきます。
成長戦略3:適応拡大する
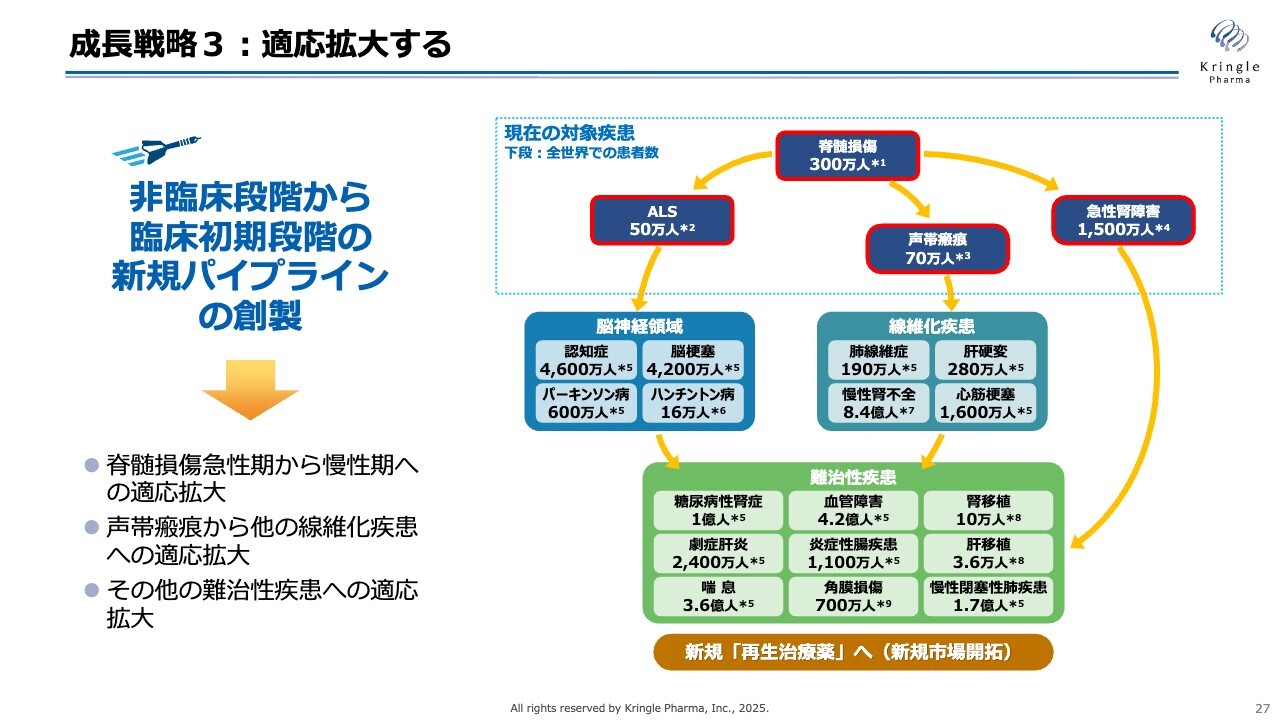
成長戦略の三の矢は適応拡大です。スライド右側には、これまでHGFが動物モデルで効果を示した症例と、グローバルでの患者数が示されています。現在、私たちが開発しているのはスライド上部の四角で囲まれた部分ですが、HGFの可能性は非常に幅広いため、今後は適応拡大を巧みに進め、HGFの価値を最大化することが重要です。
適応拡大に向けたアカデミアとの共同研究

当社は、適応拡大に向けて、アカデミアの先生方と共同研究を積極的に進めています。
慶應義塾大学との取り組みでは、脊髄損傷の亜急性期・慢性期における細胞治療と併用する療法について、動物モデルで成果を上げ、特許を共同出願しています。
継続中の案件としては、慶應義塾大学との共同研究によるバイオマーカーの探索や、HGFの特発性肺線維症への応用研究(金沢大学との共同研究)、岐阜大学との共同研究である特発性大腿骨頭壊死症への応用研究が進められています。
また、今期から新たにスタートした案件として、神戸大学とのペロニー病(線維化疾患の一種)への応用研究、慶應義塾大学との末梢神経障害への応用研究、そして京都大学との徐放性創傷治療剤の開発があります。
これ以外にも、MTA(物質移転契約)というかたちでHGFを複数の大学に提供しており、現在は動物モデルの段階ですが、非常に有望なデータも得られています。
また、いくつかのプロジェクトでは、研究を行う先生方と臨床に向けた協議が本格化しており、今期中の進展が見込まれます。臨床試験に入る段階になりましたら、あらためてお知らせします。
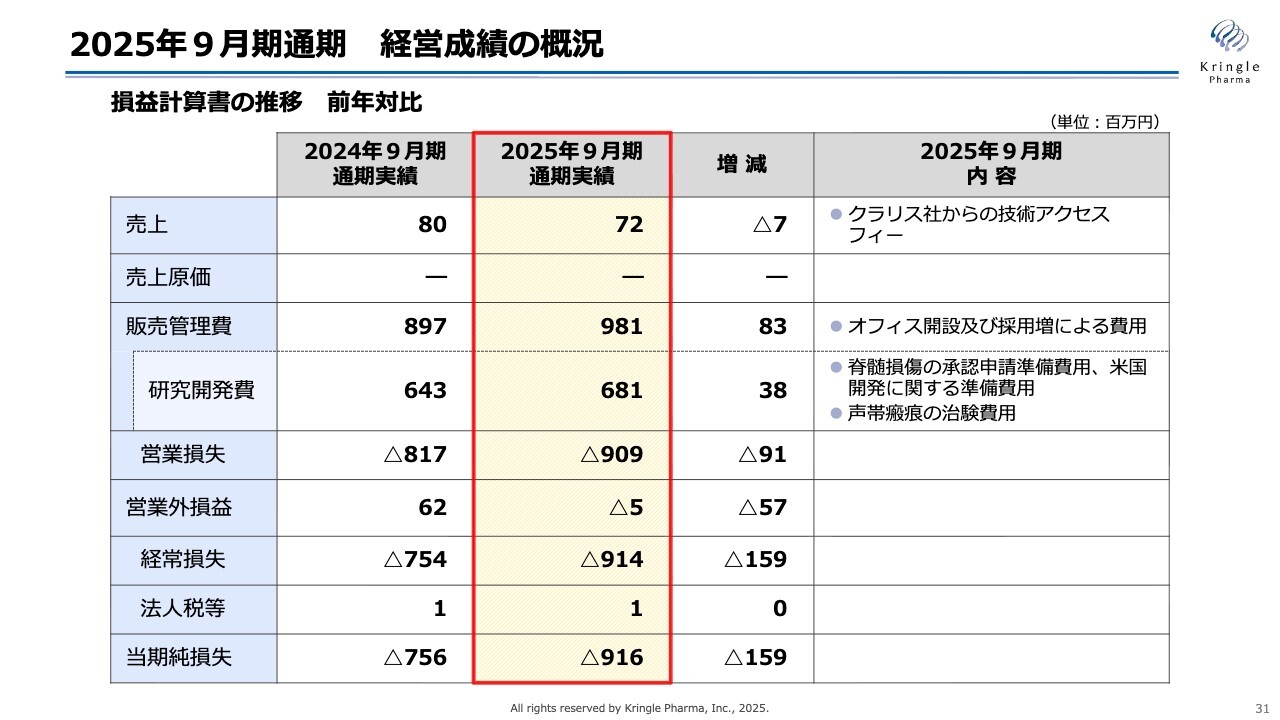
2025年9月期通期 経営成績の概況
2025年9月期通期の決算概況および2026年9月期今期の業績予想についてご説明します。
スライドには、2025年9月期通期の経営成績について、損益計算書の前年対比で示しています。赤枠で囲った部分が今期の実績となります。
売上はクラリス社からの技術アクセスフィーとして7,200万円です。研究開発費は前年とほぼ同じ6億8,100万円であり、主な内容は脊髄損傷の申請に向けた米国での準備費用や声帯瘢痕の治験費用です。
販売管理費については、前年に比べて8,300万円の増加となりました。これは「Nakanoshima Qross(中之島クロス)」へのオフィス移転や、医薬品開発の進展に伴う採用増による費用が主な要因です。
営業損失はマイナス9億900万円、経常損失はマイナス9億1,400万円、当期純損失はマイナス9億1,600万円となっています。
2025年9月期通期 経営成績の概況
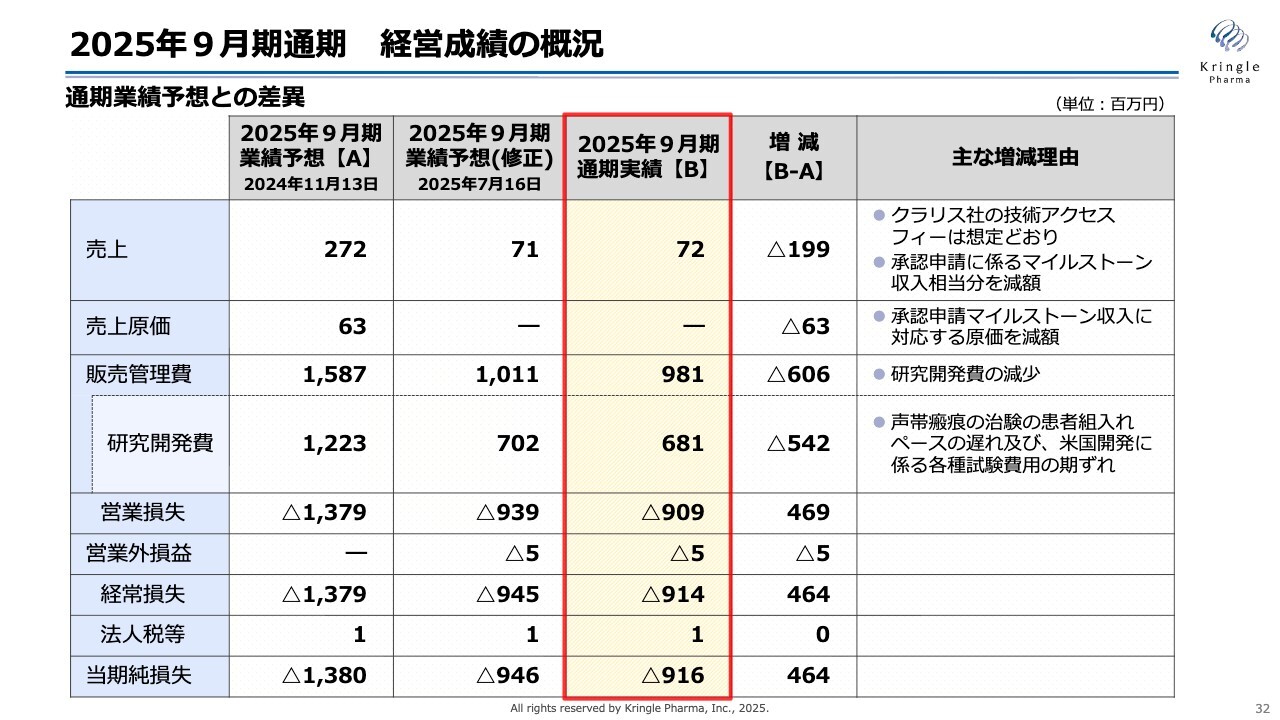
こちらは、業績予想との差異を示しています。2024年11月の業績予想(1年前のもの)が左側、その右側が今年7月に修正したもの、赤枠で囲った部分が今期通期の実績です。
売上面の減少は、もともと2025年9月に承認申請を予定していたものの後ずれが発生し、これに伴い承認申請に係るマイルストーン収入が減少したことが大きな要因です。
研究開発費についても、承認申請に伴って計画していた予算が実際には後ずれとなり、数値として減少しています。
2025年9月期通期 財政状態の概況
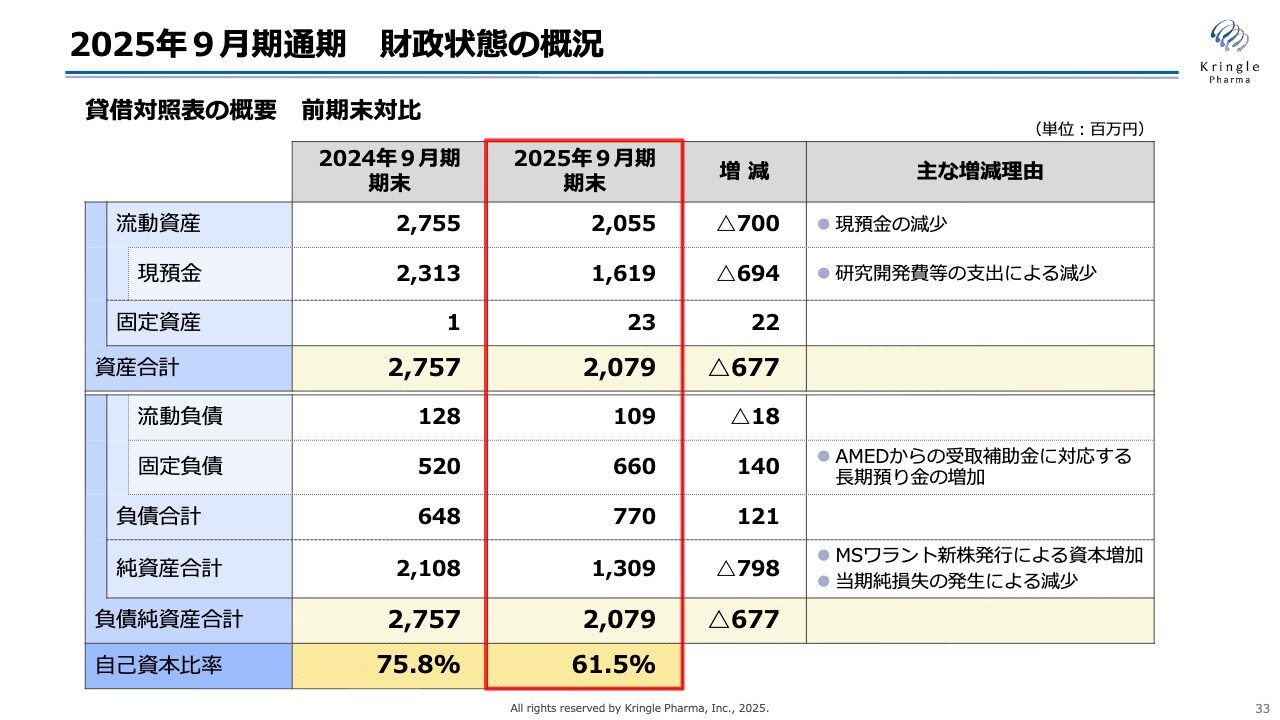
財政状態の概況です。こちらは貸借対照表を前期末対比で示しています。
主なポイントとしては、開発に伴い現預金が前期末に比べて約7億円減少したことです。これに伴い、資産合計もその減少分が反映され、20億7,900万円となっています。
一方で負債については、固定負債が毎年増加しています。これは、AMEDによるCiCLEという制度で、声帯瘢痕のプロジェクトに関する補助金を受領しているためです。この制度では、受領した補助金と同額の定期預金を作る必要があり、その分が長期預り金として計上され、負債が増加するかたちとなっています。
純資産合計は13億900万円、負債純資産合計は20億7,900万円です。自己資本比率は前期末と比較して61.5パーセントに減少していますが、現在資金調達が進行中であり、それに伴って調達が増加すれば、こちらの数値も上昇すると考えています。
2025年9月期通期 キャッシュ・フローの概況

営業活動によるキャッシュ・フローはマイナス7億5,500万円で、内訳は右側の項目に記載されています。
投資活動によるキャッシュ・フローはマイナス1億5,400万円で、主な要因として定期預金のほか、新しいオフィスの敷金などがあります。
財務活動によるキャッシュ・フローは、2024年9月期には非常に大きな数字が計上されていましたが、これは資金調達の金額が含まれていたためです。現在も資金調達を進めていますが、まだ始まったばかりであり、2025年9月期は8,400万円となっています。
現金及び現金同等物は、期首で18億円ありましたが、現時点では9億9,100万円となっています。
2026年9月期 業績予想
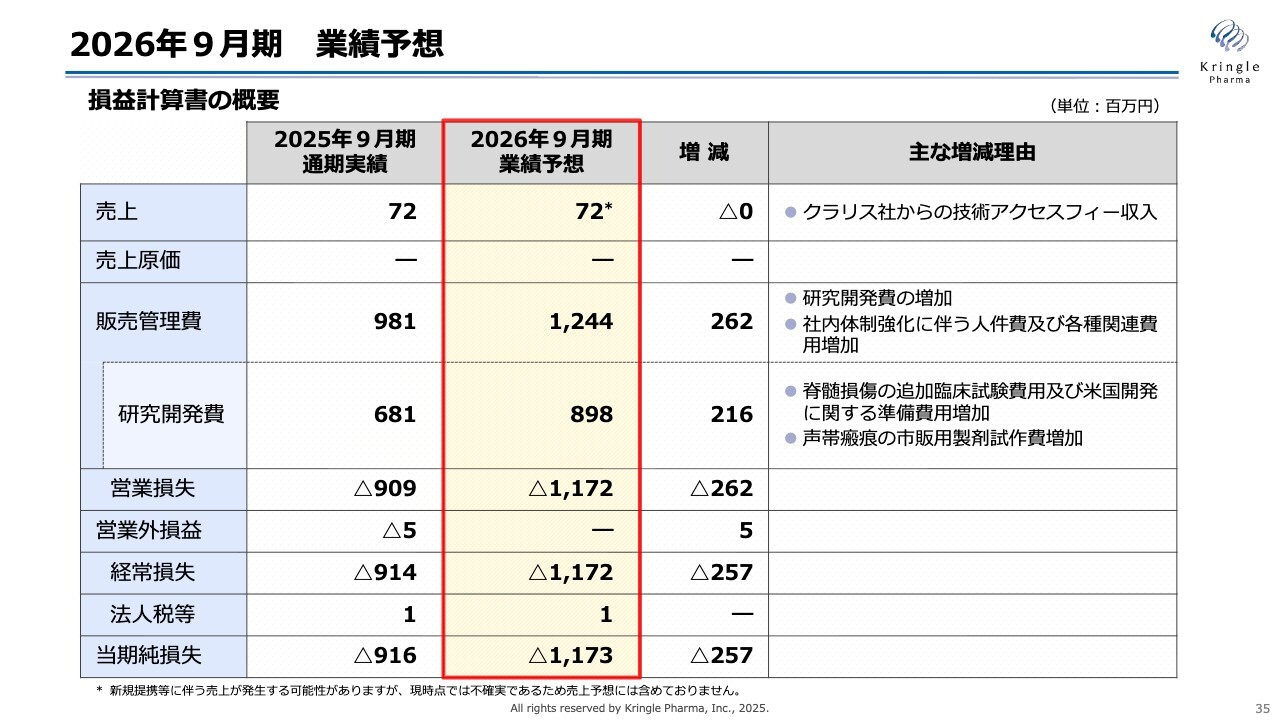
今期の業績予想です。まず、売上についてですが、毎年クラリス社からの技術アクセスフィーが続いていて、今期もこれが入ってくる予定です。不確実な要素は予想に含めていないため、数字としてはクラリス社からの技術アクセスフィーのみを計上しています。
研究開発費については、脊髄損傷に関する追加試験や米国での開発費用、さらに声帯瘢痕の承認申請に向けた試作製造費用などが含まれており、8億9,800万円と前期より増加しています。
また、営業損失はマイナス11億7,200万円、当期純損失はマイナス11億7,300万円を予想しています。
2026年9月期 業績予想 -研究開発費の内訳-
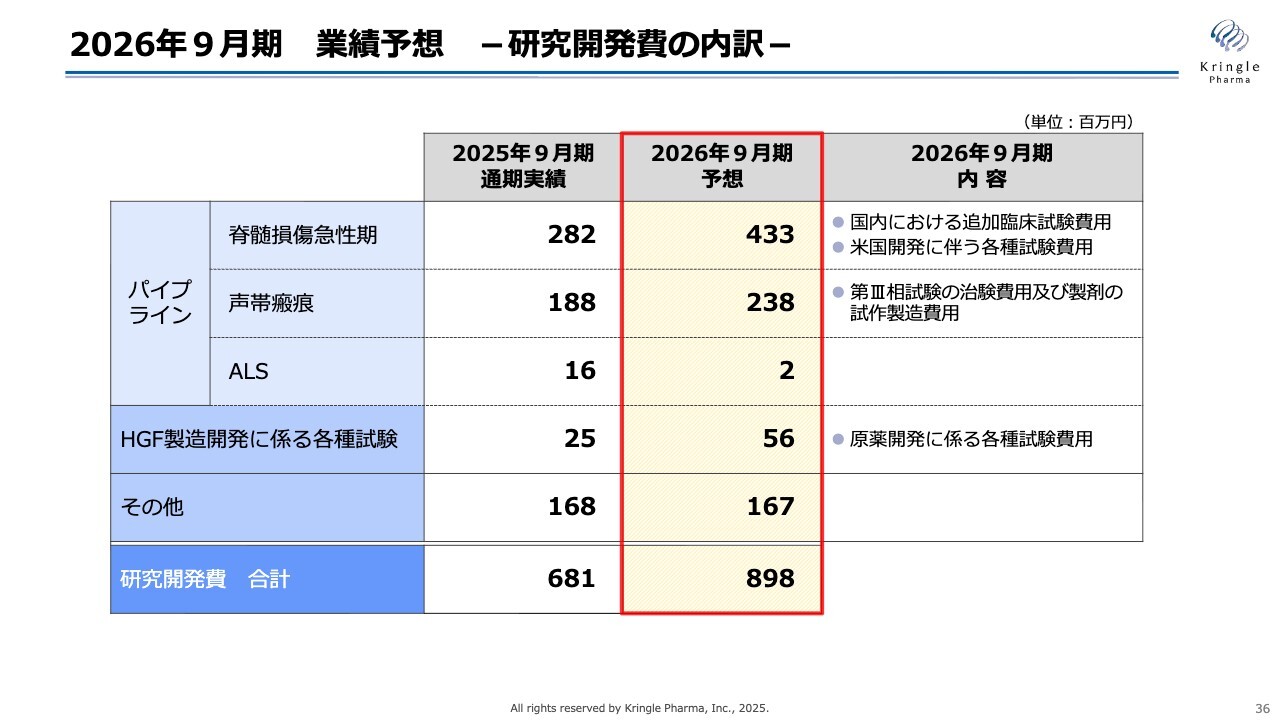
先ほどの研究開発費の内訳を詳細に分解すると、大きな項目としては、脊髄損傷急性期に関する費用が4億3,300万円となっています。これには、国内での追加試験費用および米国での各種準備費用が含まれています。
声帯瘢痕については、前期よりも費用が増加しており、これは承認申請に向けた商業用製剤の試作製造に関するものです。
そのほか、HGFに関連する各種試験費用を合わせて、8億9,800万円を予想しています。
クリングルファーマのビジョン
こちらは、最後のスライドで毎回示している、私たちのビジョンです。「患者さんに新薬を、人々に笑顔と」を掲げて進めていきます。
国内におけるHGFの脊髄損傷急性期については、投資家のみなさまの期待に応えることができず、承認申請が後ずれとなりました。しかし、必ず追加試験を実施し、承認申請を行います。それに先立ち、声帯瘢痕の承認申請という大きなマイルストーンも控えています。
また、海外での展開も積極的に進めていきます。今期には大きな発表ができるよう、取り組んでいきたいと思います。
現在は創薬ベンチャーですが、ここから製薬企業へと成長し、社会に確実に価値をもたらす会社となれるよう、精進していきます。
質疑応答:脊髄損傷急性期の国内追加治験開始時期について

司会者:「脊髄損傷急性期の国内開発については、追加治験を実施することをPMDAと合意したとのことですが、いつ頃追加治験が始まるの
新着ログ
「医薬品」のログ





