【QAあり】Chordia Therapeutics、2026年中頃「rogocekib」米国試験中間成績を公表予定 2028年末までに販売承認申請を目指す
目次

三宅洋氏(以下、三宅):Chordia Therapeutics株式会社代表取締役の三宅洋です。本日は、2025年8月期決算についてご説明します。どうぞよろしくお願いします。
本日の内容はスライドのとおりです。
当社は武田薬品工業からスピンアウトした低分子抗がん薬創薬企業

当社は2017年10月、国内最大手の製薬会社である武田薬品工業からスピンアウトし、創業しました。低分子抗がん薬の研究開発を行うバイオテックスタートアップです。2024年6月に東証グロース市場に上場しており、証券コードは190Aです。
本社は神奈川県藤沢市の湘南ヘルスイノベーションパーク(湘南アイパーク)にあります。従業員数は23名、そのうち12名が博士号の学位を有しており、少数精鋭で新しい抗がん薬の開発に取り組んでいます。筆頭株主は出身母体である武田薬品工業で、約15パーセントのシェアを有しています。
臨床POCを確立したパイプラインをもとに高利益なビジネスを目指す
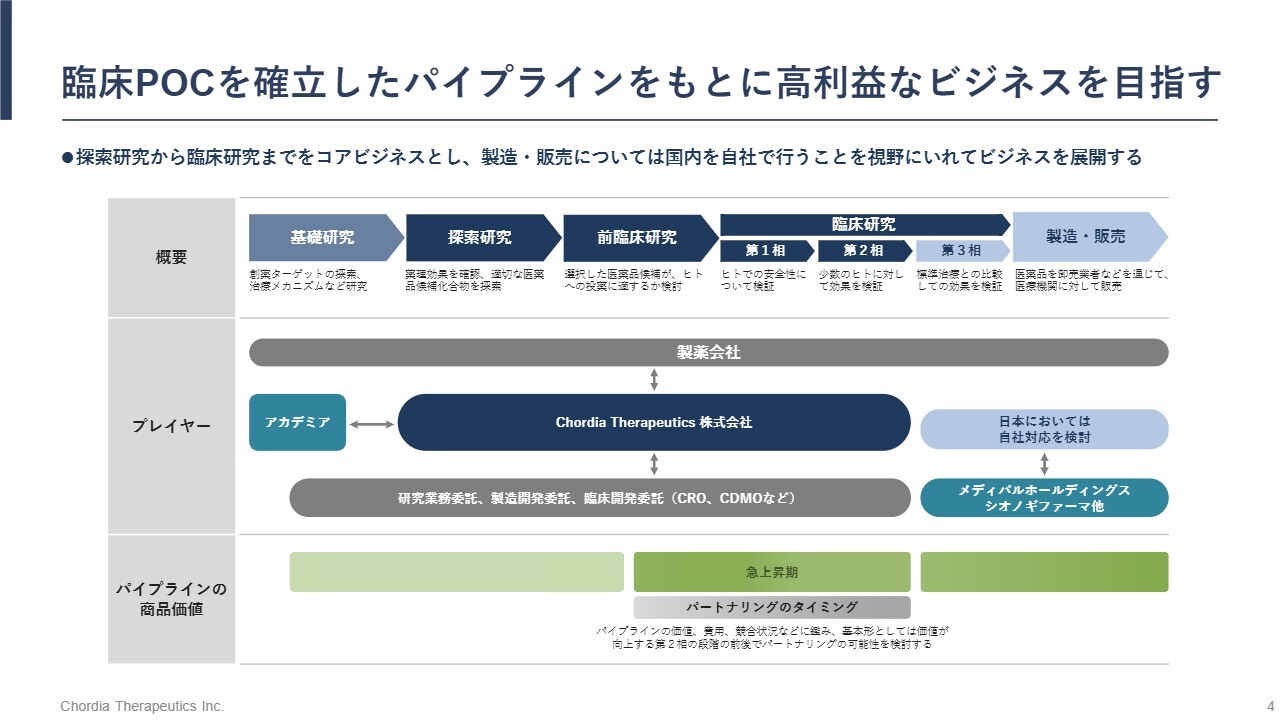
新薬の誕生には、約20年の歳月が必要です。前半の10年ほどは、大学などでの基礎研究から始まり、探索研究や前臨床研究を経て、ようやくヒトへの臨床試験が開始されます。後半の10年は、臨床試験を通じて安全性と有効性を確認し、承認・薬価決定を経て、ようやく販売に至ります。この長い道のりは、まさにマラソンのような挑戦といえます。
この20年のプロセスの中で、当社は探索研究から第2相臨床試験までを自社で行う戦略を採用しています。この戦略の背景には、開発期間の短縮と価値創出の加速という明確な狙いがあります。
具体的には、基礎研究を日本の大学に委託し、共同研究を通じて最先端の知見を取り込んでいます。日本の大学の科学技術レベルは世界トップクラスであり、今年もノーベル賞を受賞していることはみなさまもご存じのとおりです。当社は、この強みを最大限に活かしています。
また、希少がん領域に集中することで、第2相臨床試験の結果で迅速承認を得られる可能性が高まり、通常よりも早く市場に到達できます。さらに、第2相臨床試験で良好な結果が得られれば、パイプラインの価値が大きく跳ね上がり、導出による収益化が可能となります。
一般的な創薬ビジネスはハイリスク・ハイリターン型ですが、当社はリスクをコントロールし、成功確率を高める体制を整えています。メンバーの半数以上が博士号の学位を有し、大手製薬会社並みの開発力を誇る少数精鋭チームです。
意思決定のスピードと柔軟性を兼ね備え、科学的優位性を確保しつつ迅速に開発を進めています。この体制により、当社はハイリスク・ハイリターンでありながら、より確度の高い価値創出を目指しています。
2025年8月期の財政状態(貸借対照表)
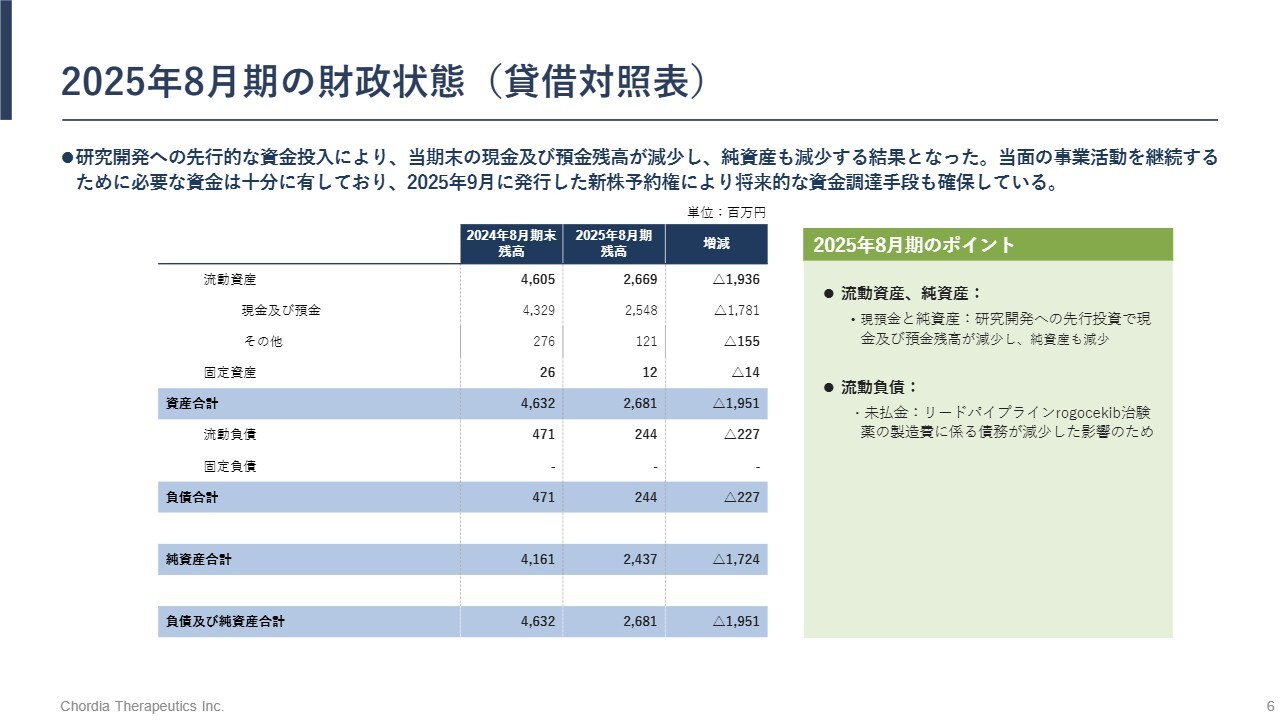
2025年8月期の業績です。財政状態は、8月末時点で約25億円の現金および預金を保有しており、当面の事業活動を継続するための資金は十分に確保しています。また、リードパイプライン「rogocekib」の開発資金を中期的に確保するため、新株予約権による資金調達も進めています。
2025年8月期の経営成績(損益計算書)
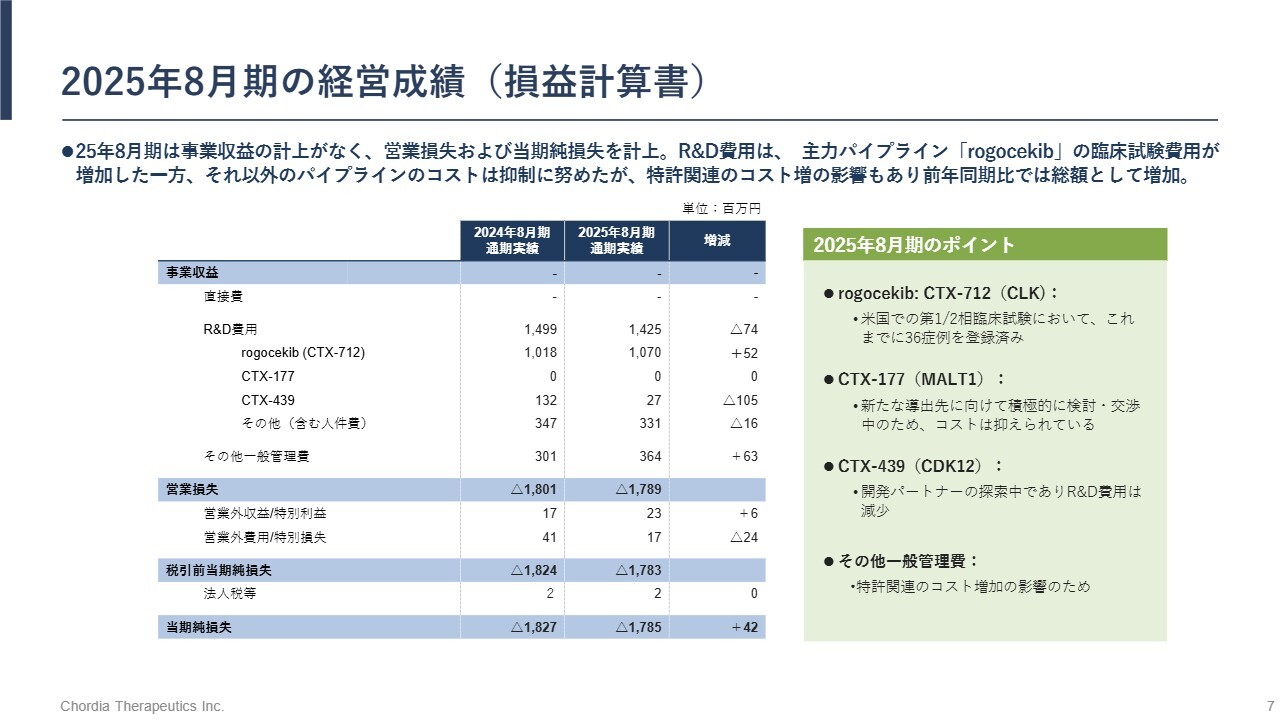
経営成績についてご説明します。2025年8月期は事業収益がありませんでした。研究開発費(R&D費用)は約14億円で、そのうち約10億円を「rogocekib」の研究開発に充てています。
米国での臨床試験の症例組入れはほぼ計画どおりに進捗しており、8月末時点で36症例への投与を完了しています。その結果、17億8,500万円の当期純損失となりました。
2026年8月期の業績見通し
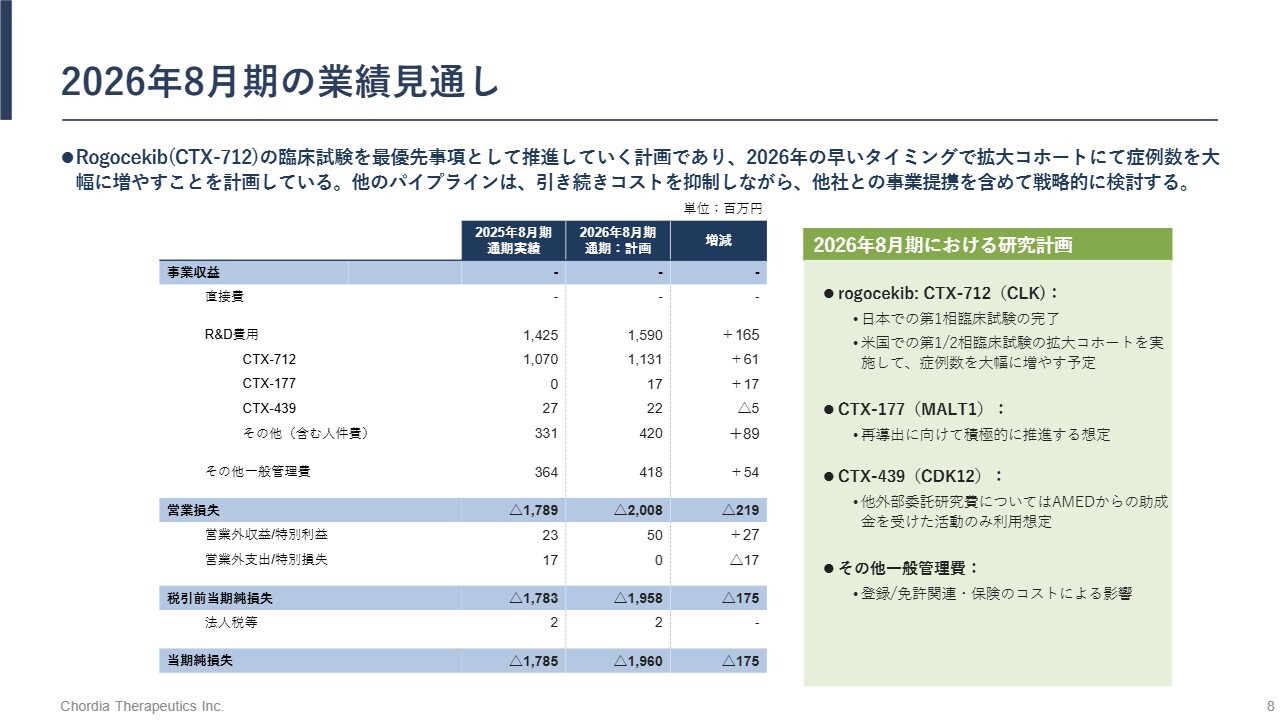
2026年8月期の業績見通しです。引き続き「rogocekib」の開発を最優先で進め、2026年の早いタイミングで拡大コホートを開始し、症例数を大幅に増やす計画です。その他のパイプラインに関しては、コストを抑制しつつ、他社との事業提携を含めて戦略的に検討していく予定です。
以上を踏まえ、研究開発費に15億9,000万円を充て、19億6,000万円の当期純損失を計画しています。
RNAの生成プロセスと当社のパイプラインが作用する各過程
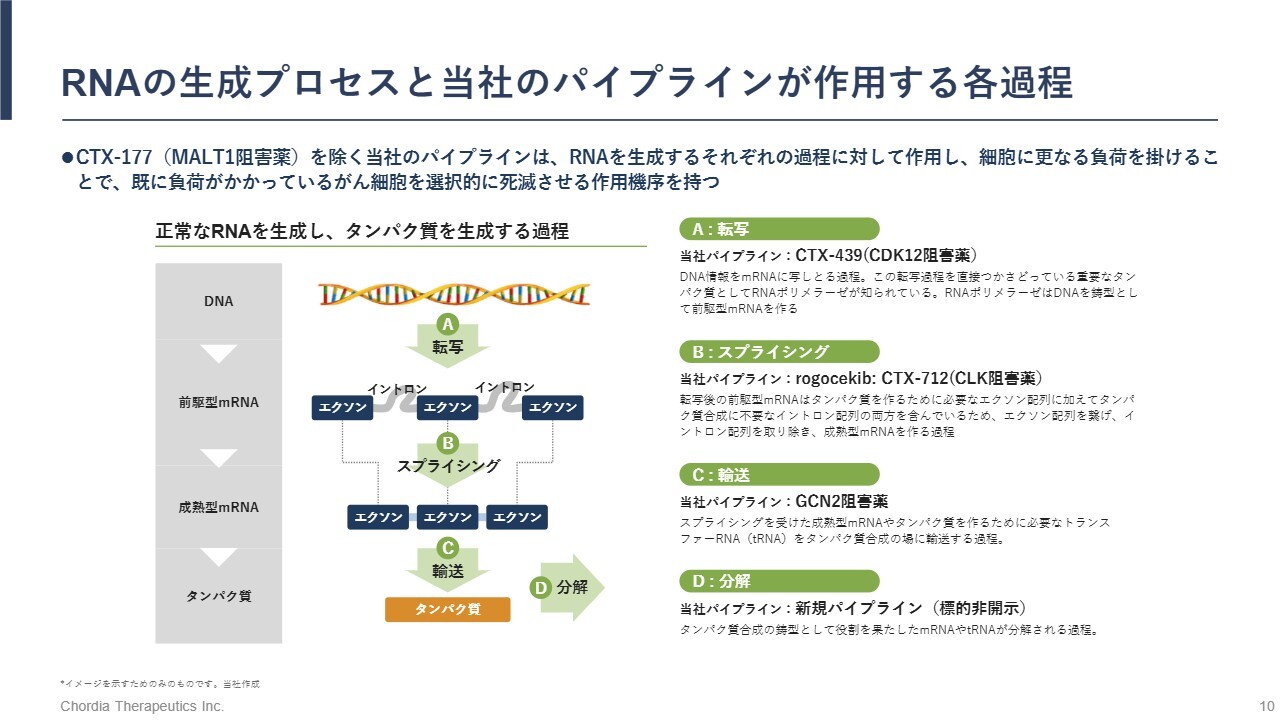
パイプラインの進捗状況についてお話しします。当社は、がんの弱点であるRNA制御ストレスに着目して研究開発を進めています。RNA制御ストレスとは、RNAが生成される過程で異常が生じることで、細胞に負荷がかかる現象です。この過程は、スライドに示しているとおり、転写、スプライシング、輸送、分解に分けることができます。がん細胞ではこれらの過程が乱れることでストレスが蓄積しています。当社のパイプラインは、このストレスをさらに高めることで、がん細胞を選択的に死滅させる仕組みです。
RNA制御ストレスは14年前の2011年に、当社の科学アドバイザーである京都大学の小川誠司教授によって発見されました。その後、2018年に当社が臨床試験を開始し、現在7年目となります。今後3年以内に承認申請を目指しており、約20年にわたる研究開発の最終段階に今まさに差しかかっている状況です。
当社が手掛ける抗がん薬のコンセプト
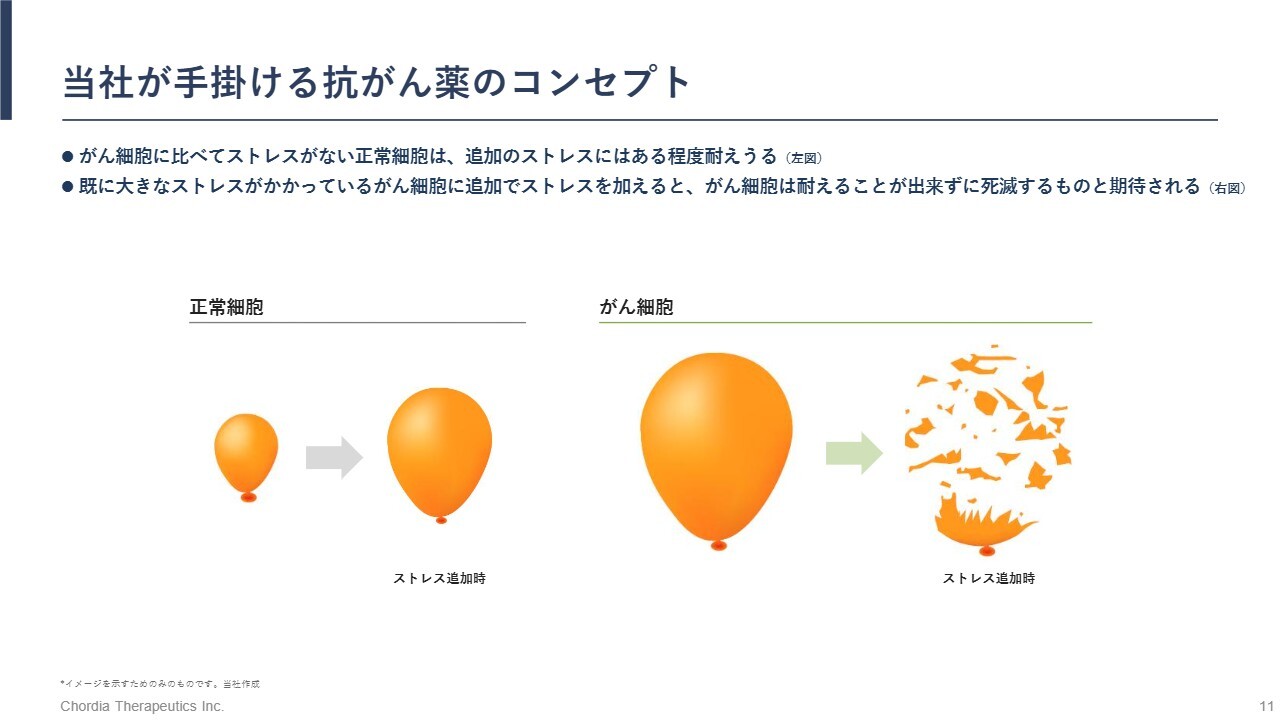
スライドは、細胞が抱えるストレスの大きさを風船の大きさで表しています。当社のパイプラインの特徴は、ストレスを高めることでがん細胞を死滅させる一方で、正常細胞はストレス耐性があるため、影響を受けにくいという点です。
がん細胞はストレスを蓄積しており、風船が膨らんだ状態です。一方、正常細胞はストレスを受けない状態で生存しているため、風船は小さいです。ここに当社のパイプラインが追加のストレスを加えると、正常細胞はそのストレスに対処できますが、がん細胞は追加のストレスに耐えきれず、風船が破裂するように死滅していきます。
このコンセプトは、武田薬品工業のブロックバスター抗がん薬「ベルケイド」で臨床的に実証されています。当社は、RNA制御ストレスという新しいメカニズムで同様の成功を目指しています。
5つのパイプラインのうち、2つは臨床ステージ~市場性の高いrogocekibに集中し、価値創出を加速~

スライドは当社のパイプラインです。5つの低分子パイプラインを有しており、そのうち「rogocekib」と「CTX-177」の2つは臨床試験を実施しています。
特に「rogocekib」は市場性が高く、迅速承認の可能性を踏まえて開発リソースを集中させている状況です。一方、他のパイプラインについては、提携や導出を視野に入れつつ、コストを抑制しながら価値創出を進める戦略を取っています。
当社は、この集中と分散のアプローチを通じて、リスクを管理しながら複数の収益機会を確保することを目指しています。
未充足市場に挑む革新的低分子抗がん薬「rogocekib」~急性骨髄性白血病(AML)2次治療以降の市場規模2,000億円以上×年率10%超の成長市場~
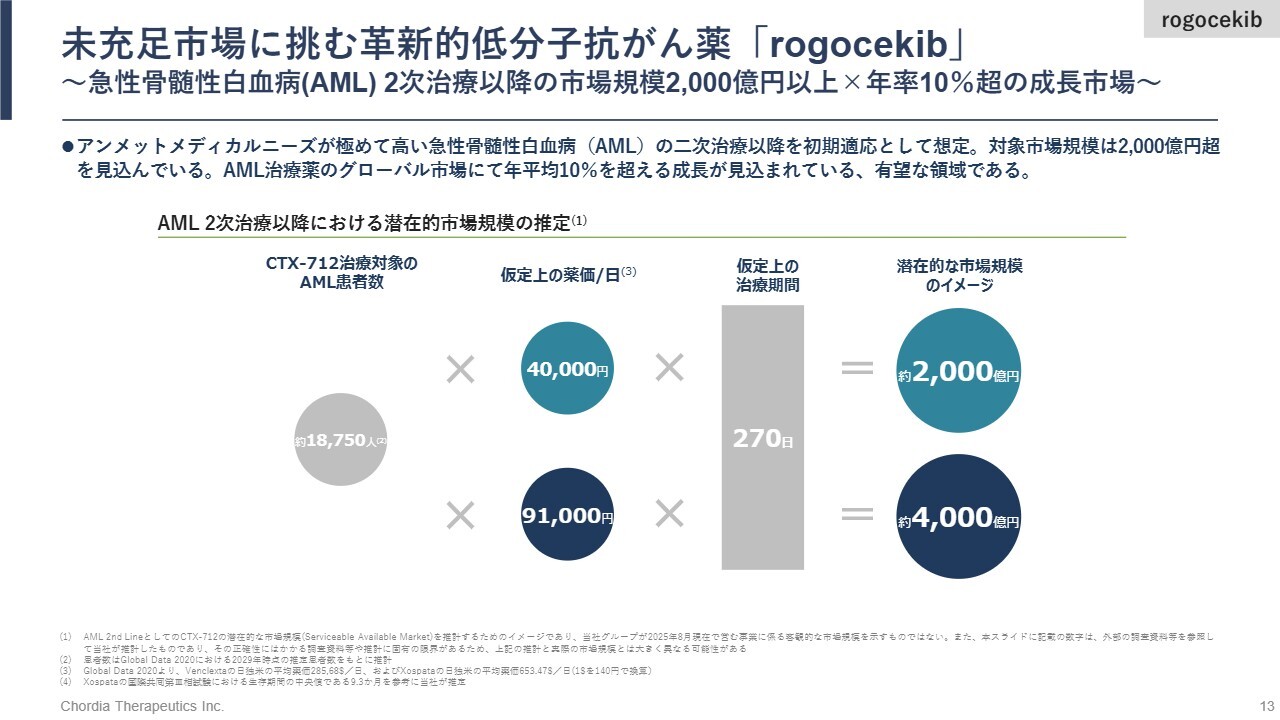
「rogocekib」に関しては、再発難治性急性骨髄性白血病(AML)における最初の承認取得を目指し、臨床試験を進めています。スライドはその市場性を示しています。
1次治療に失敗し、2次治療が必要となるAML患者さまのうち、既存の抗がん薬の対象とならない患者さまは、日本、米国、ヨーロッパで年間1万8,000人程度存在します。そのような患者さまに対して、約9ヶ月間「rogocekib」が処方される場合、その際の薬価を他のAML治療薬を参考に1日あたり4万円から9万円と仮定すると、年間売上高で2,000億円を超える市場が存在すると当社は考えています。
さらに、AML治療薬市場はグローバルで年率10パーセント以上の成長が予測されており、今後も拡大が期待される有望な領域です。もちろん、そのすべてを「rogocekib」が獲得できるわけではありませんが、例えばその半分を獲得するだけでも、ピークセールスは年商1,000億円を超える、いわゆるブロックバスター医薬品に成長する可能性があります。
低分子抗がん薬「rogocekib」日本第1相試験にて有望な成績~直近のFDA承認薬との比較でも遜色ない競争力~
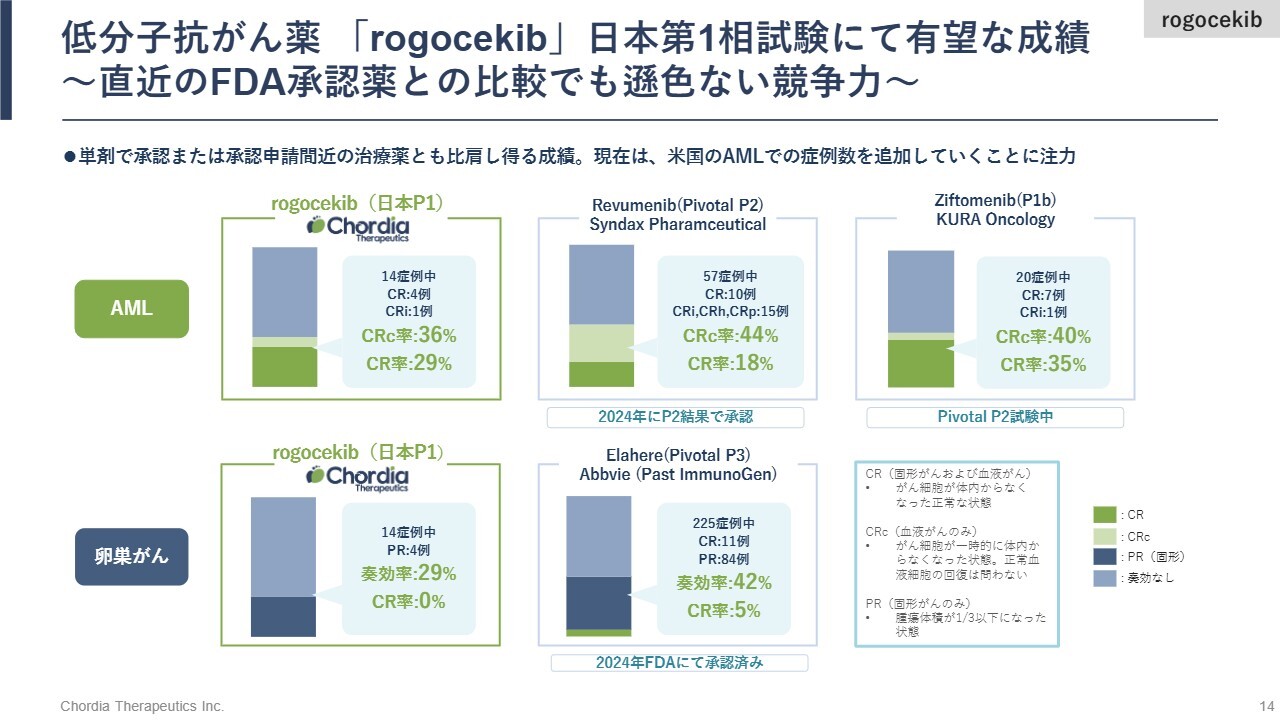
日本で実施した第1相臨床試験における「rogocekib」の成績です。AMLと卵巣がんにおいて有効性が認められています。特にAMLについては、14人中4人で完全寛解、すなわち一時的ではありますが、患者さまの体からがんが消えた状態を達成しており、良い成績であったと考えています。この結果は、直近で米国食品医薬品局(FDA)からAML適用で承認を受けた他社の単剤と同等水準であると当社では見ています。
現在、世界最大の医薬品市場である米国において、第1/2相臨床試験を実施しています。なお、本日の決算発表と同時にプレスリリースを行いましたが、日本での血液がんに関する試験成績について、論文として発表しています。
Rogocekibの開発マイルストン~日米96名症例登録と臨床試験のプロセスが着実に進捗~

「rogocekib」の開発マイルストンについてご説明します。2025年8月期における主な達成マイルストンは、大きく3つあります。
1点目は、「CTX-712」の国際一般名称として「rogocekib」が使用可能になった点です。2点目は、FDAからオーファンドラッグ指定を受けたことです。3点目は、米国の試験で36症例を積み上げ、日米合計で96症例への投与を行った点です。
今後想定されるマイルストンとしては、2026年の中頃に進行中の米国試験の中間成績を発表する予定です。また、2027年の中頃には第2相臨床試験を開始し、2028年の年末までに販売承認申請を行いたいと考えています。
これらのマイルストンは、FDAが提唱するProject Optimusへの対応として、当初の予定を見直した結果です。米国での承認申請に向けて、Project Optimusへの対応は必要なものと認識しており、「rogocekib」の価値最大化を目指した戦略的な判断と考えていますので、ご承知おきください。
CTX-712の国際一般名称はrogocekibに決定

「rogocekib」の名前の由来についてご説明します。頭の「r」はRNAの「R」、真ん中の「c」はCLKの「C」から取っています。また、中にある「o」をイントロンとみなして、「rogocekib」という単語全体でスプライシング反応をイメージさせています。「rogocekib」という名前をぜひ覚えていただければと思います。
当初予定通りに米国での希少疾病用医薬品指定を受領

オーファンドラッグ指定(Orphan Drug Designation:ODD)についてご説明します。オーファンドラッグ指定とは、希少疾病用医薬品指定のことで、この指定を受けると、承認申請手数料の免除や税制優遇、さらに承認後最長7年間のデータ保護といったメリットがあります。
当社は、この指定を単なる優遇措置の獲得と捉えておらず、規制当局、特に米国のFDAとしっかりコミュニケーションを取りながら「rogocekib」の価値を示すことができている良い実例になっていると考えています。
FDA Guidance Project Optimusへの対応
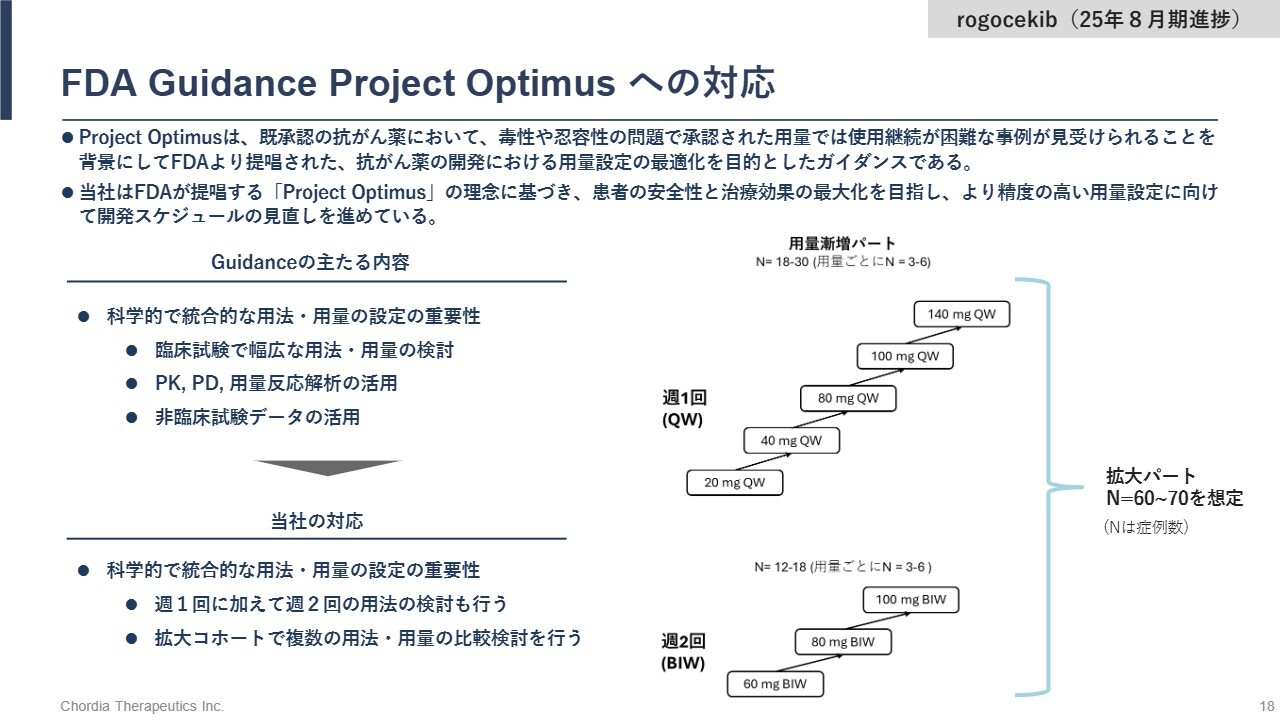
FDAのProject Optimusは、「抗がん薬の用量設定を、臨床試験の早期からしっかり行ってください」というガイダンスです。当社では、週1回の投与に加え、週2回の投与スケジュールの検討を進めています。また、用量漸増後の拡大パートも当初予定より規模を拡大し、60症例から70症例を組入れ、複数の用法・用量を比較する計画です。
この対応は、一時的に開発期間を延長することになりますが、承認申請が受理されないリスクを低減します。また、臨床試験において十分に薬効と安全性を評価することで、その臨床的価値を高めることができ、承認獲得後の薬価設定や市場浸透において競争優位性をもたらします。Project Optimus対応は、「rogocekib」の価値最大化につながる戦略的判断に基づくものです。
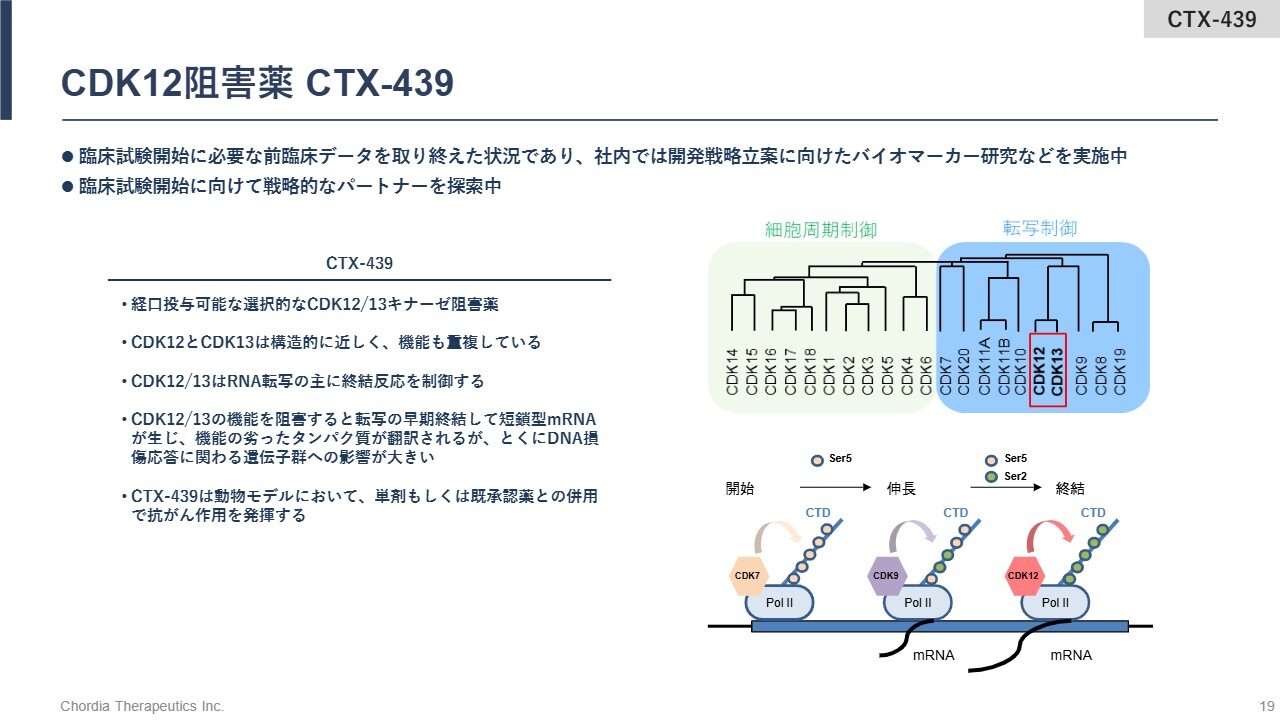
CDK12阻害薬 CTX-439
ここからは、RNA制御ストレスパイプラインであるCDK12阻害薬およびGCN2阻害薬、すなわち当社の第3号および第4号パイプラインについてご説明します。
CDK12阻害薬は「CTX-439」という化合物の前臨床データを取り終えています。CDK12はRNAの転写反応における主に終結ステップを制御するキナーゼです。「CTX-439」がその活性を阻害することで、転写が早期に終結し、異常なRNAが生じます。これがストレスとなり、がん細胞が死滅するという仕組みです。現在、臨床試験の開始に向けて提携先を探しています。
GCN2阻害薬 CRD-099
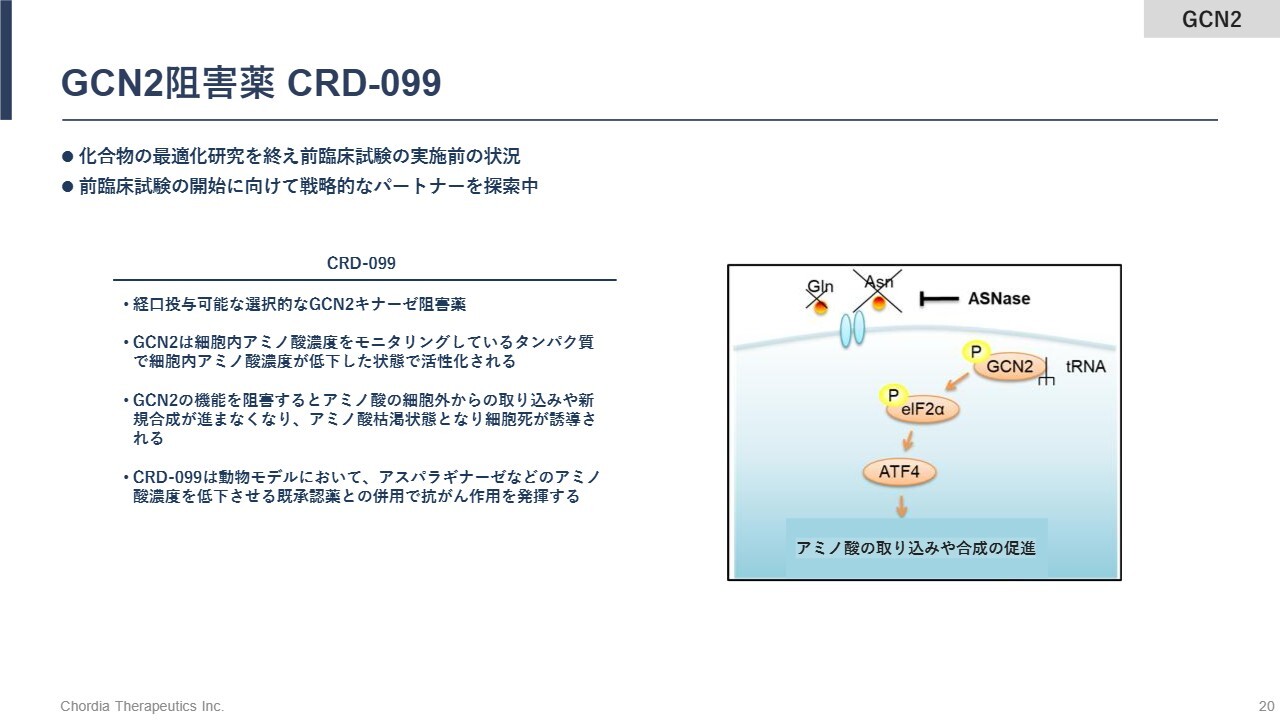
GCN2阻害薬は、細胞内のアミノ酸濃度をモニタリングしているキナーゼです。その活性を阻害すると、RNAからタンパク質が生成される翻訳反応に異常が生じ、細胞にストレスが発生します。その結果、がん細胞が死滅します。このプロジェクトはまだ探索研究の段階ですが、「rogocekib」にリソースを集中させているため、提携先を探しています。
DWTIとの共同研究
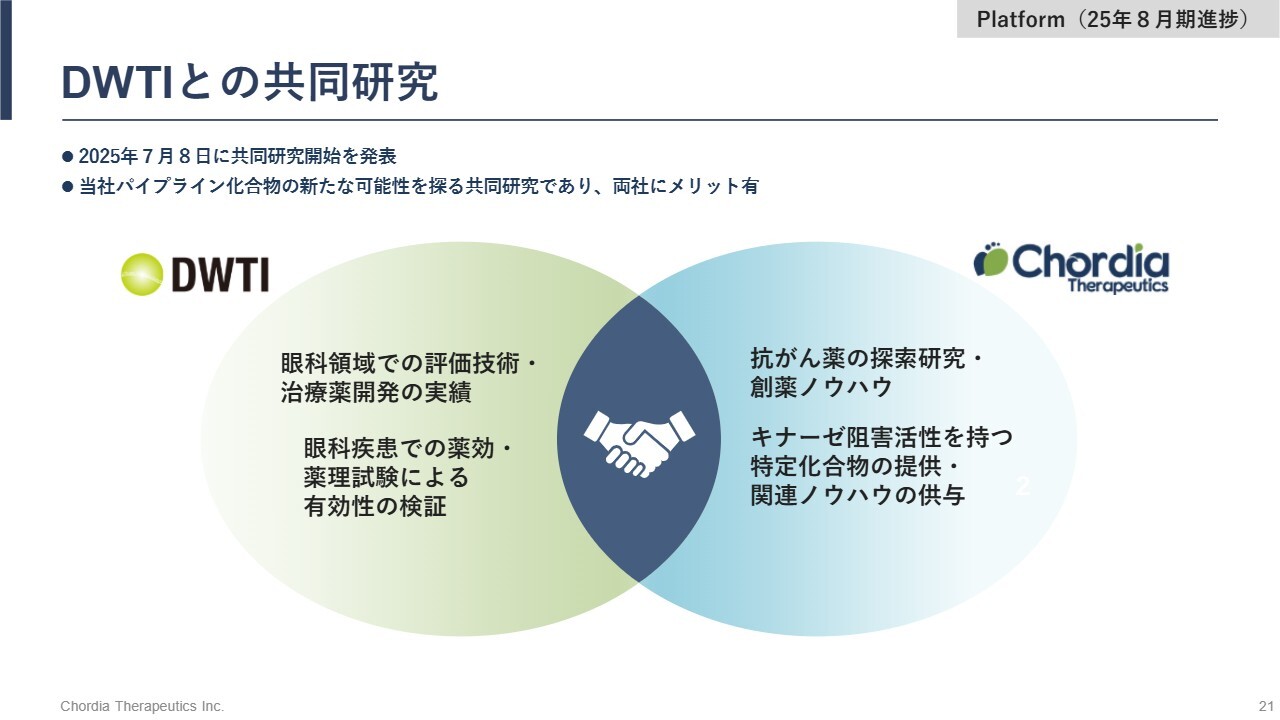
「rogocekib」以外のパイプラインについては、がん以外の適応可能性も共同研究を通じて探索しています。デ・ウエスタン・セラピテクス研究所(DWTI)とは、当社化合物の眼科領域、すなわち眼の疾患への活用可能性を共同で研究しています。
千寿製薬との共同研究
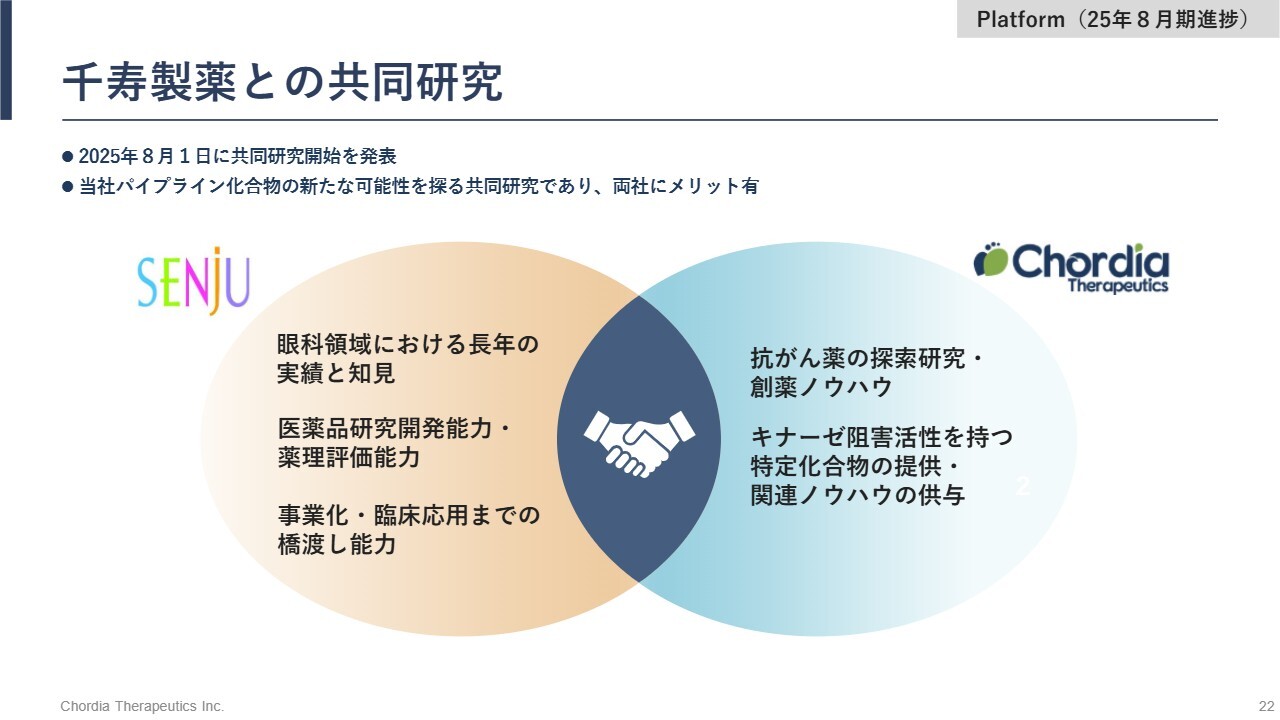
千寿製薬とは、GCN2阻害薬の共同研究を進めています。この研究では、眼科領域での適応可能性を検討しています。
このように、当社は「rogocekib」に集中しつつ、複数のパイプラインで新たな価値創出に向けた取り組みを進めています。
4件の物質特許とそれを支える複数の用途特許・製法特許
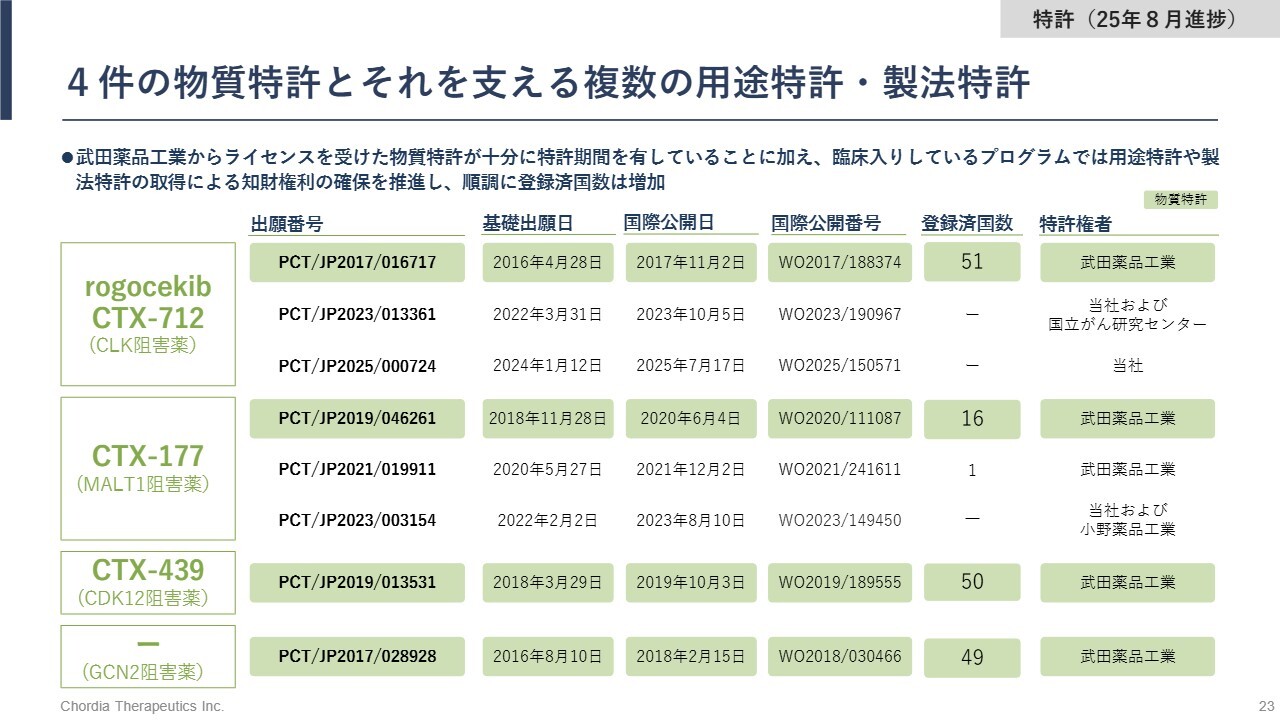
特許の状況です。「rogocekib」「CTX-177」「CTX-439」およびGCN2阻害薬の物質特許に関しては、各国や地域での登録が順調に進んでいます。また、臨床段階にある「rogocekib」と「CTX-177」については、用途特許や製法特許なども出願し、知財権利の確保を進めています。
特許は、承認後の薬価設定やライセンス交渉において競争力を高めるだけでなく、導出時の条件を有利にする重要な要素です。当社は、グローバル市場での競争優位性を確保するため、知財ポートフォリオの強化に引き続き注力していきます。
研究開発・コーポレート活動ともに順調に進行
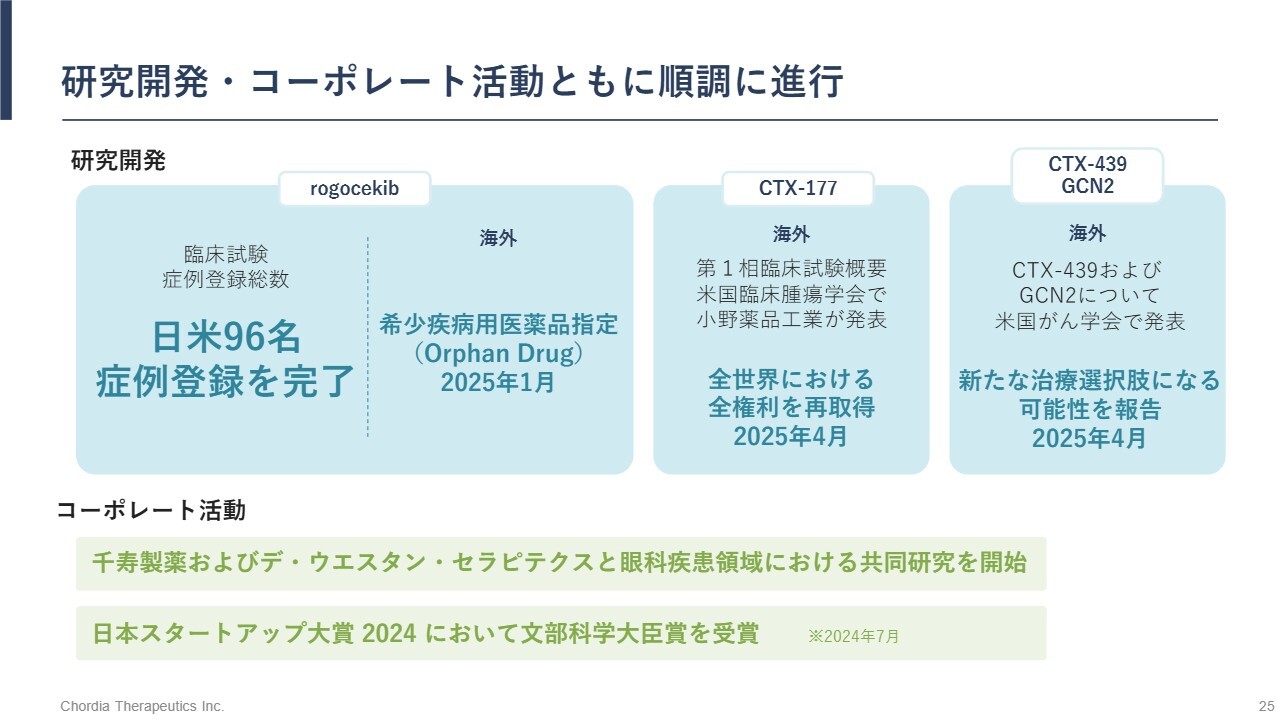
事業の振り返りと今後の見通しについてです。「rogocekib」の開発に関しては、Project Optimus対応に伴い米国試験の開発スケジュールを変更しましたが、臨床試験の症例組入れ自体はおおむね計画どおりに進んでいます。8月末時点で、36症例に加え、日本での60症例を含めて、これまでに96症例に対する投与を実施しています。また、FDAからのオーファンドラッグ指定も獲得しました。
「CTX-177」については、小野薬品工業から権利を再取得しました。当社としては臨床試験を早期に再開すべく、導出先を鋭意探しています。
その他の前臨床パイプラインについては、研究結果を国際学会(米国がん学会)で発表しており、共同研究を通じて新たな価値の探索を進めています。
2026年8月期に向けての優先事業目標

2026年8月期の優先事業目標です。まず、「rogocekib」の開発を着実に進めていく方針です。また、事業開発活動は「CTX-177」を中心に進めていきます。こちらについては、小野薬品工業が実施した臨床試験のデータのすべてを受領しており、このデータを活用して臨床試験の早期再開に向けた交渉を進めていきます。
これらの進捗については、適切なタイミングで株主および投資家のみなさまに発信します。
当社の経営理念と2030年ビジョン

最後に、当社の経営理念についてです。当社は、日本に本社を有するバイオテック企業として、既存薬とは異なる働きをする新しい抗がん薬を世界中のがんと闘う患者さまに届けることで、患者さまやそのご家族が「明日になれば、今日よりも良い治療を受けられる」と、明日に希望を感じられる社会の実現を目指しています。
多くのみなさまに支えていただきながら、新薬を創出し、世界的なバイオテック企業として成長していきたいと考えています。新薬を生み出すまでには長い期間が必要で、承認申請まであと3年が必要な状況ですが、引き続き応援のほど、どうぞよろしくお願いします。
質疑応答:「CTX-177」の導出先の探索状況について
新着ログ
「医薬品」のログ





