クリングルファーマ、脊髄損傷急性期治療薬の追加治験開始 米国FDAの希少疾病用医薬品指定を取得、海外開発を加速
アジェンダ

安達喜一氏:みなさま、こんにちは。クリングルファーマ株式会社代表取締役社長の安達喜一です。本日は2025年9月期第3四半期の決算についてご説明します。
本日のアジェンダをご紹介します。最初に、2025年9月期第3四半期のトピックスをまとめています。次に、各開発パイプラインの進捗状況について、脊髄損傷急性期、声帯瘢痕、筋萎縮性側索硬化症(ALS)についてお話しします。
続いて、2025年9月期第3四半期の決算概況についてご説明します。業績予想の修正について触れた後、経営成績と財政状態の概況についてお話しします。
最後に成長戦略についてお話しします。よろしくお願いします。
会社概要

当社は「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに画期的な治療手段を提供し、社会に貢献すること」を企業理念とする大学発の創薬バイオベンチャーです。現在、私たちは生体内に存在する「再生創薬シーズHGF」というタンパク質の組換えタンパク質医薬品の開発に注力しています。
このHGFタンパク質は、692個のアミノ酸が連なっている上、1つの分子内に19個の架橋を有しており、非常に複雑な構造をしています。
もともと日本で肝臓の再生に関わるタンパク質として発見されたHGFですが、その後の研究により、さまざまな組織・臓器の再生や修復、保護を担う非常に重要なタンパク質であることが明らかになっています。
HGFは、細胞を増殖させるだけでなく、細胞死の抑制や血管新生、抗線維化といった非常に多岐にわたる生物学的機能を持つことが特徴です。そのため、脊髄損傷急性期のような非常に重篤な疾患の治療薬として、最も適したマルチな作用を持つタンパク質であると考えています。
2025年9月期第3四半期のトピックス(後発事象を含む)

2025年9月期第3四半期のトピックスです。まず、第1パイプラインである脊髄損傷急性期における国内の状況についてです。追加試験を実施して承認申請を行う方針を7月に決定し、適時に開示しました。
これまで第Ⅰ/Ⅱ相および第Ⅲ相の2本の試験を完了し、PMDAとの間で承認申請に向けた協議を続けてきましたが、残念ながらPMDAと合意に至らず、追加試験を実施する方向へと舵を切りました。
株主のみなさまのご期待に沿うことができず、大変申し訳なく思います。しかし、私たちはこの開発を断念したわけではありません。後ほど述べるような確度の高い追加試験を実施し、承認申請を目指していきたいと考えています。
一方、脊髄損傷急性期については、現在アメリカでの開発も進めています。今年6月には、FDAから希少疾病用医薬品指定を取得しました。すでに日本では同様の制度での指定を受けていますが、今回アメリカでも指定を取得できたことで、今後の開発に大きなプラスとなり、さらにアメリカでの提携先との交渉を加速する推進力になると考えています。
第2パイプラインの声帯瘢痕は、前回の決算説明でお伝えしたとおり、第Ⅲ相臨床試験の組入れを今年末まで継続予定であり、現在は患者さんの組入れのラストスパートに入っている段階です。
第3パイプラインのALSは、第Ⅱ相試験の検体を用いたバイオマーカーの追加解析が2025年9月まで継続予定で、こちらもまもなく終了を迎えます。
また、この6月に神戸大学との新たな共同研究が開始されました。対象となるのはペロニー病という線維化疾患の一種で、陰茎硬化症という難病に対する応用研究に関する共同研究です。
最後の成長戦略でも述べますが、当社の成長においてHGFの適応拡大は非常に重要な項目です。そのため、現在さまざまな大学と共同研究を進めており、新たな神戸大学との共同研究も将来の適応拡大につながる研究です。
開発パイプラインの概要
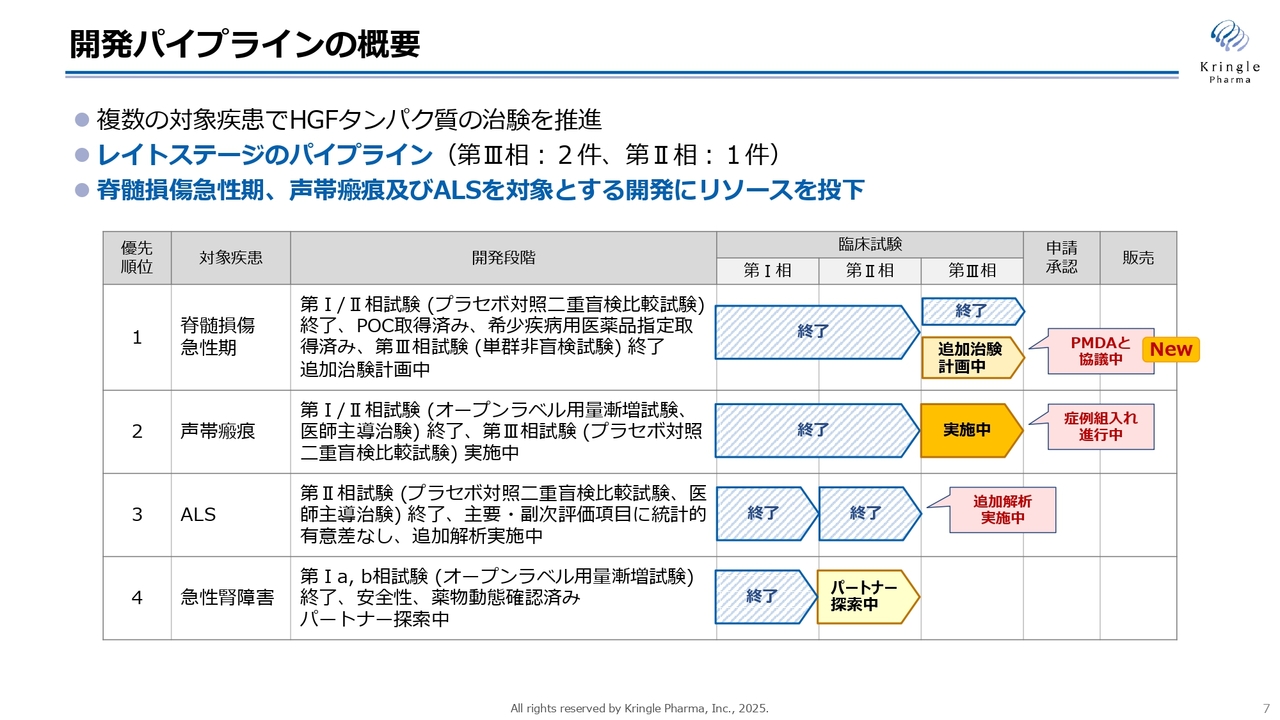
各開発パイプラインの進捗状況です。スライドの表は開発パイプラインの概況をまとめたものです。大きな変更点としては、第1パイプラインの脊髄損傷急性の第Ⅲ相試験に関して、以前は終了の矢印のみでしたが、今回新たに治験計画中の矢印を追加しました。
この追加の治験については後ほど詳しくお話ししますが、現在PMDAとの協議が始まっており、この協議を終了した後に治験申請を行う計画です。
第2のパイプラインである声帯瘢痕は、現在第Ⅲ相試験の症例組入れが最終段階に入っている状況です。
第3のパイプラインであるALSは、追加解析が進んでおり、9月には終了する予定です。
第4パイプラインの急性腎障害は、アメリカで第Ⅱ相試験を終了しており、現在もパートナーの探索を継続しています。
開発パイプライン-脊髄損傷急性期-

第1パイプライン、脊髄損傷急性期についてご説明します。現在、日本では年間約6,000人の方が、さまざまな原因で新たに脊髄損傷になるといわれています。この疾患では、運動神経や感覚神経に障害が生じ、損傷部位が脳に近いほど広範な麻痺が残るという特徴があります。
急性期に関しては、現在使用可能な薬剤は実質的になく、手術などによる根本的な治療法も存在しない状況です。そのため、基本的にはリハビリテーションのみが対応策となっています。
患者さんだけでなく、介護する方の負担も非常に大きく、医療経済効果が大きく期待される疾患です。
脊髄損傷急性期にHGFに期待する治療効果
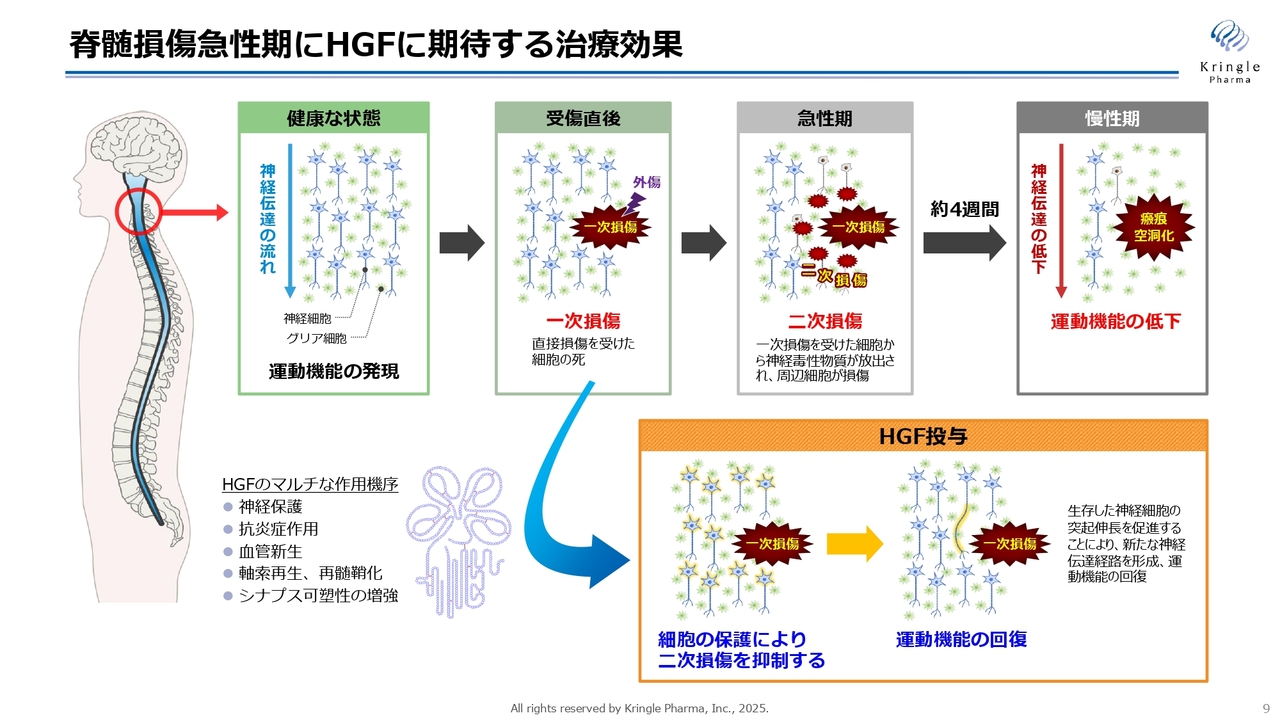
この脊髄損傷の急性期においてHGFに期待していることは、最初の損傷である一次損傷から急性期に進行する二次損傷が周囲に広がるのを、HGFの多面的な作用によって抑制することです。
損傷範囲を小さく抑えることができれば、慢性期には損傷範囲がより限定的になり、それによって神経伝達が可能な領域が増加し、運動機能の低下を防ぐ効果が期待されます。
HGFには多岐にわたる作用機序があり、神経保護だけでなく、抗炎症作用や血管新生、軸索再生、再髄鞘化、シナプス可塑性の増強といった機能を備えています。これらのマルチな機能を活かし、脊髄損傷の急性期という非常に激烈で重篤な疾患の治療薬を目指しています。
脊髄損傷急性期 第III相試験-重症度の改善、第I/II相との比較-
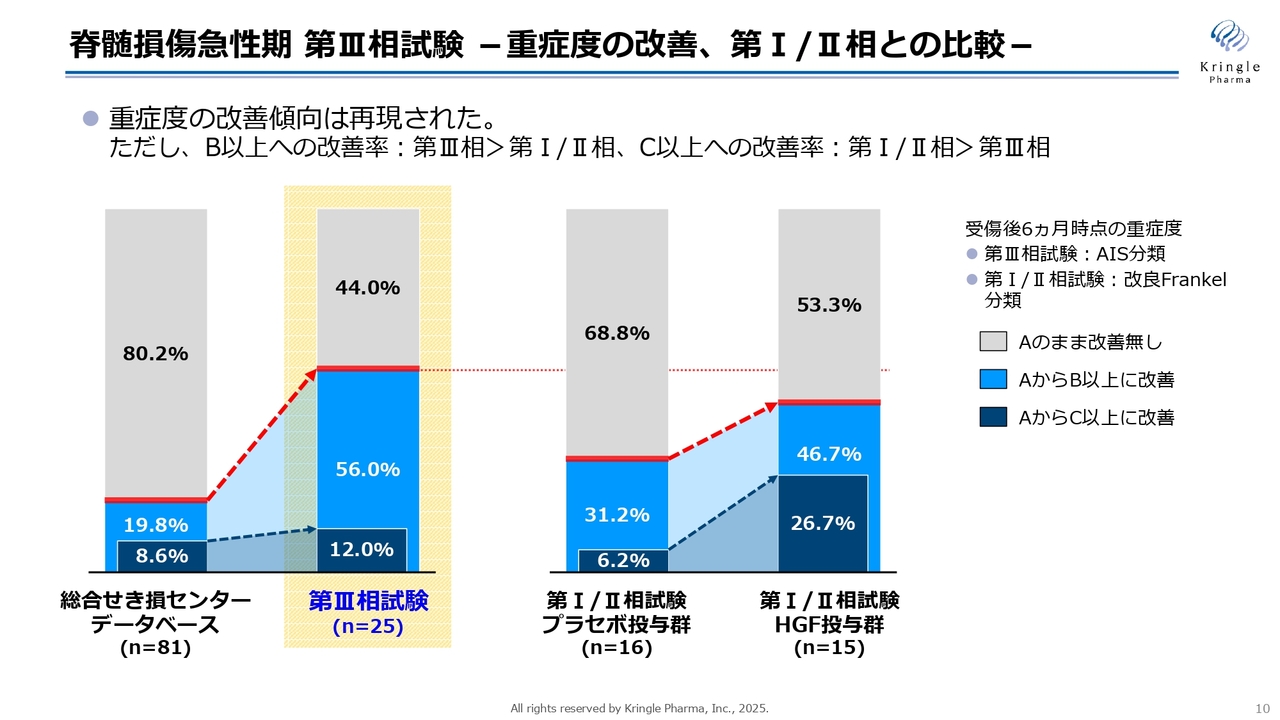
当社は、国内で2つの臨床試験をすでに終了しています。第Ⅲ相試験および第Ⅰ/Ⅱ相試験です。スライドでは、その重症度改善のデータを示しています。
黄色で囲っている部分は、第Ⅲ相試験の結果です。この試験は、HGF実薬群のみを投与する非ランダム化試験として実施しています。比較対象として使用しているのは、一番左側に表示されている総合せき損センターに保管された患者さんのヒストリカルデータベースです。
スライドのバーは、重症度の改善を色分けして示しています。この試験では、重症度Aという完全麻痺の患者さんをリクルートしていますが、6ヶ月の時点でも重症度Aのまま変化がなかった方をグレーで表しています。また、重症度AからB以上に1段階以上改善した方を薄い青色で、2段階以上改善した方を濃い青色で示しています。
この第Ⅲ相試験では、主要評価項目として2段階以上の改善を設定しました。この項目について、データベースでは8.6パーセントに対し、第Ⅲ相試験では12パーセントと数字は増加しましたが、統計的な有意差は得られませんでした。
一方で、1段階以上改善した方を示す薄い青色の部分については、データベースが19.8パーセントであったのに対し、第Ⅲ相試験では56.0パーセントと、非常に多くの症例で改善が見られました。この点については統計的な有意差が認められています。
一方、スライド右側には、以前行われた第Ⅰ/Ⅱ相試験の結果が棒グラフで示されています。この第Ⅰ/Ⅱ相試験は、プラセボ対象の二重盲検比較試験として実施されました。
右側の2本の棒グラフは、プラセボ群とHGF実薬群における重症度Aの方だけを抽出した部分解析の結果を示しています。第Ⅰ/Ⅱ相試験では2段階改善、すなわち濃い青色の部分が非常に高い割合を占めていました。
この結果を受け、第Ⅲ相試験では主要評価項目として2段階以上の改善を設定しました。全体として、重症度の改善傾向は両試験で一貫して再現されているものの、詳細に見ると、1段階以上改善した方および2段階以上改善した方の割合については、第Ⅲ相試験と第Ⅰ/Ⅱ相試験で若干異なる結果となっています。
脊髄損傷急性期 第III相試験-レスポンダーの割合、第I/II相との比較-
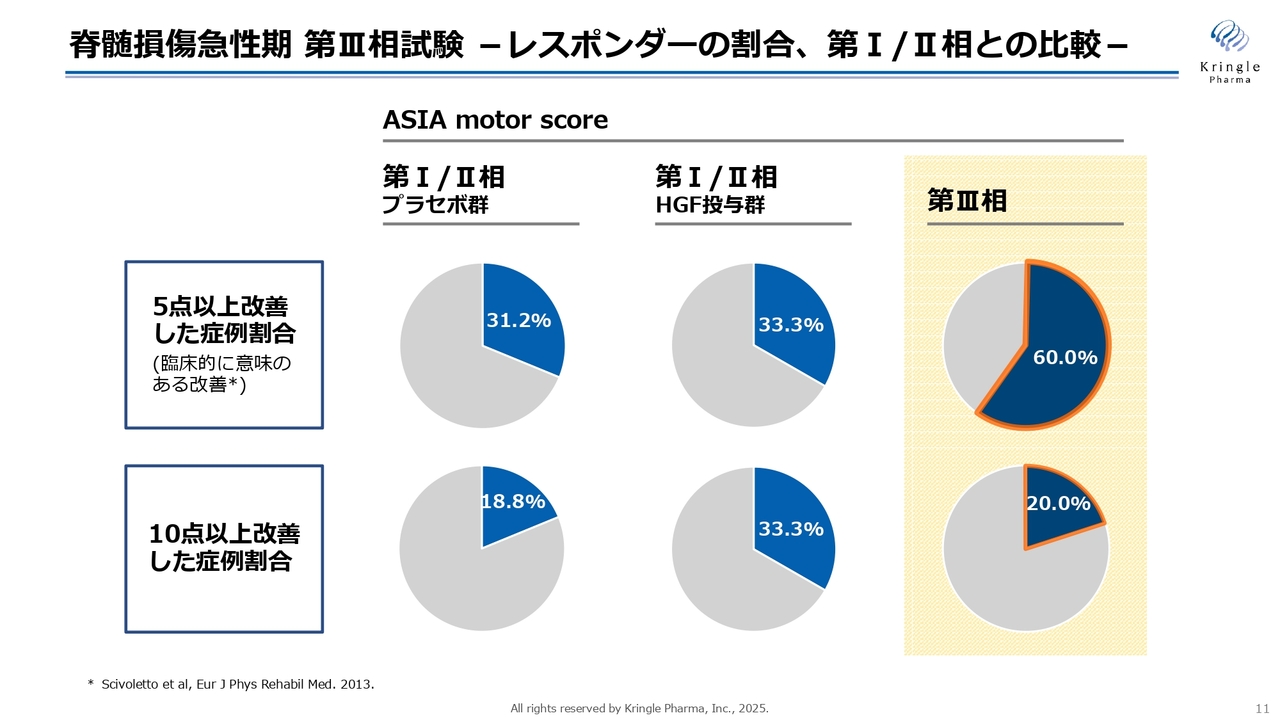
このことは、モータースコアで同様に観察されています。このスライドでは、モータースコアで臨床的に意味がある改善とされる、5点以上改善した方と、さらに10点以上改善した方の割合を円グラフで示しています。
黄色い部分が第Ⅲ相試験の結果を示しており、5点以上改善した方の割合は第Ⅲ相試験で60.0パーセントと非常に高い割合でした。一方で、10点以上改善した方の割合は20.0パーセントであり、これは前相のプラセボ群との数値差があまりない状況です。
一方で、前相ではHGFを投与することで、10点以上改善する方が非常に増加し、プラセボと比較しても非常に大きな数字の変化が見られました。
このように、重症度の改善やモータースコアの改善を検証すると、第Ⅲ相試験と第Ⅰ/Ⅱ相試験では、同じ重症度Aの完全麻痺の方を対象にしたデータであるものの、患者背景がやや異なるのではないかということが明らかになってきました。
脊髄損傷急性期 第III相試験-患者背景に関する考察-

2つの試験に組み入れた患者さんの背景を詳細に調べた結果、いくつかのことが判明しました。その結果を基にした考察がこのスライドです。
第Ⅰ/Ⅱ相試験では、ご高齢の方における転倒や転落による脊髄損傷が多く、このような脊髄損傷は中心性頚髄損傷と呼ばれる場合が多いようです。このタイプの脊髄損傷では、下肢が回復しやすい傾向があり、重症度分類でCまで改善する症例や、モータースコアが10点以上改善する症例が多いことがわかりました。
一方、第Ⅲ相試験は新型コロナウイルス感染症の流行下、行動制限が課される中で実施しました。その結果、患者背景に違いが生じたと考えられます。
具体的には、コロナ禍によって行動制限がかかる中で、お年寄りはその制限を守る傾向が強かったと推測されます。一方で、相対的に非常にアクティブな壮年層が交通事故やスポーツなどによる高エネルギー外傷を伴う重度の脊髄損傷を負い、そのような方々が多く組み入れられたのが、この第Ⅲ相試験だったということです。
このような重症度Aの中でも、より重度な患者さんにおいては、重症度分類でBまで改善した症例や、モータースコアが5点以上まで改善した症例が増加しました。しかし、さらにもう一段階上のC以上、あるいはモータースコアが10点以上改善するまでには至らなかったのではないかと考察しています。
当社としては、この2つの独立した臨床試験で改善傾向が再現できたことを踏まえ、これを基に承認申請に向けてPMDAと協議を進めてきました。
しかし、残念ながらPMDAとの協議において承認申請に至る合意を得ることはできませんでした。そのため、このたび追加の治験を実施した上で、承認申請を行う方針に切り替えることとなりました。
脊髄損傷急性期 追加治験のコンセプト
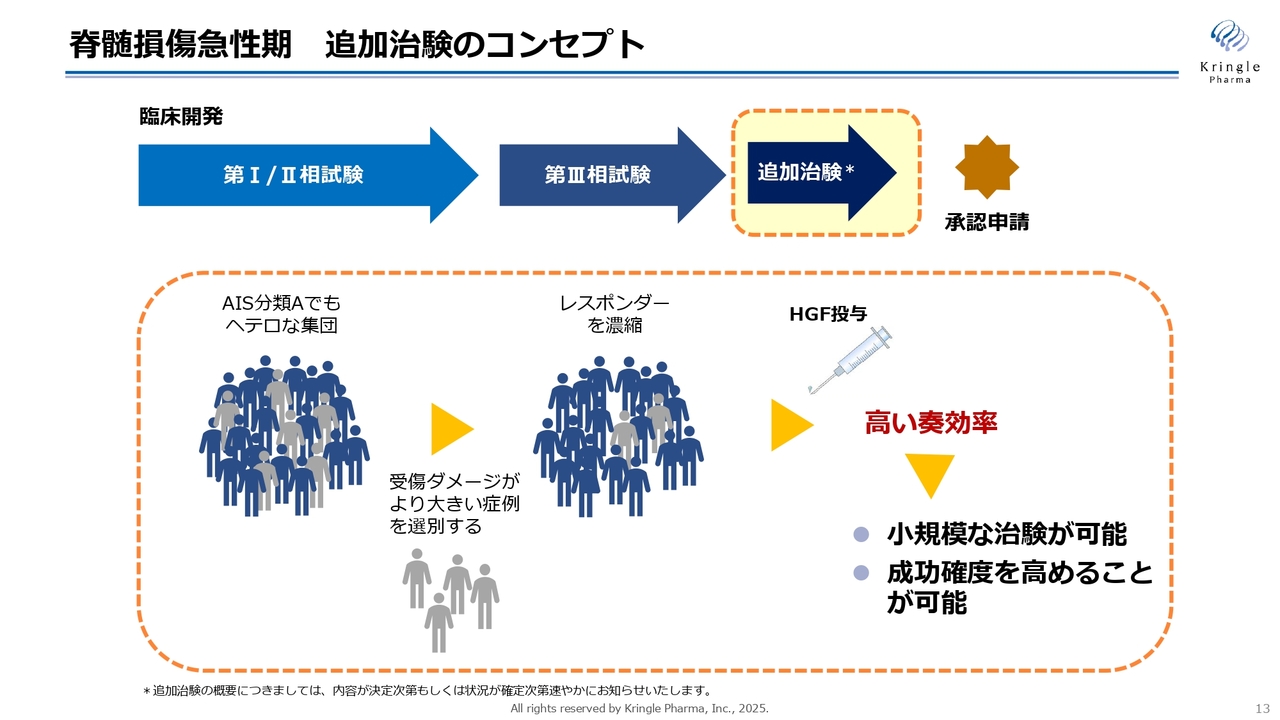
こちらのスライドは、今後予定している追加治験のコンセプトをイメージとして図示したものです。申し上げたように、重症度Aの完全麻痺の患者さんと一言で表しても、実際には非常に多様な集団であることがわかってきました。
具体的には、第Ⅰ/Ⅱ相試験では中心性頚髄損傷が多かったお年寄りの患者さんが中心でしたが、第Ⅲ相試験では、高エネルギー外傷を伴うような、さらにダメージが大きい患者さんが多く含まれていました。
今までの2本の臨床試験を通じて明らかになったのは、重症度Aの中でも特に重度な患者さんにおいては、HGFの効果がなかなか見えにくいということです。
逆に言えば、そのような重度のダメージを持つ症例を、なんらかの基準で選別してレスポンダーを濃縮することができれば、HGFの投与によってより高い奏効率が期待できます。この高い奏効率を得られることで、非常に小規模な臨床試験のデザインが可能になるだけでなく、なによりも成功確度を高めることができるのです。
当社としては、できるだけ小規模で成功確度の高い臨床試験をデザインし、PMDAと合意を得た上で追加の治験を実施したいと考え、現在PMDAとの協議を開始したところです。
脊髄損傷急性期 薬事承認後のサプライチェーン
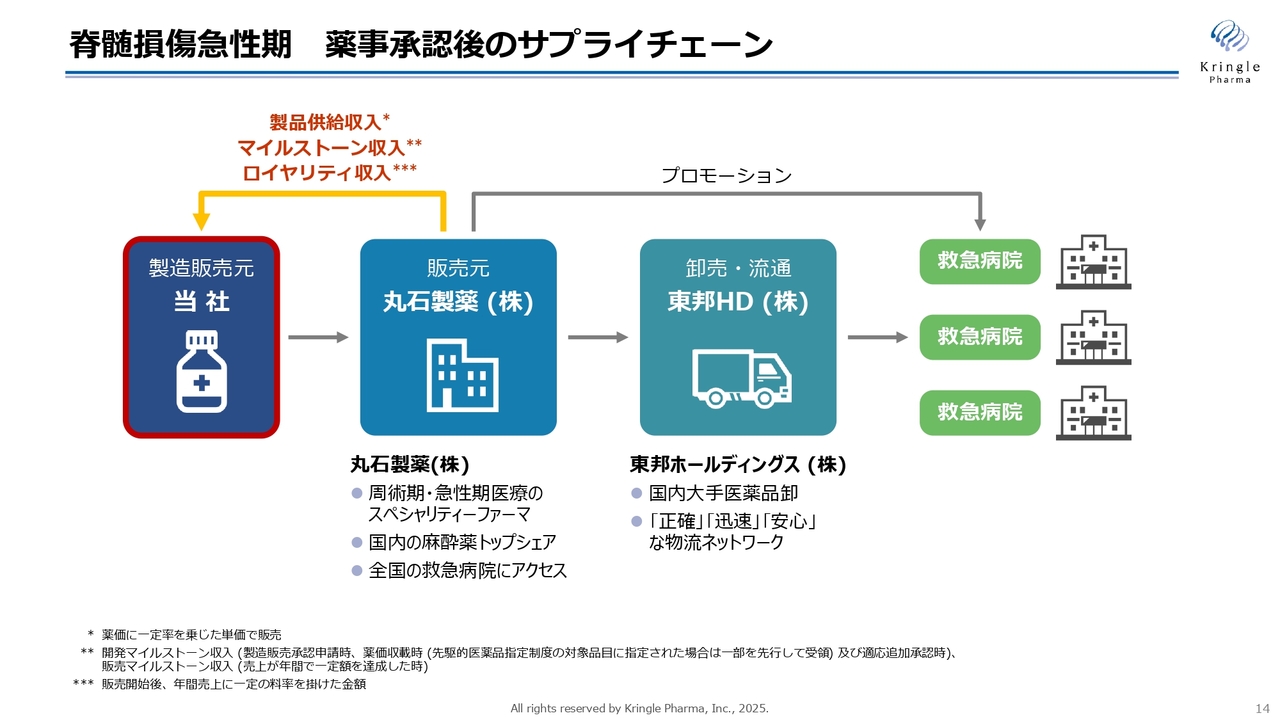
スライドは、当社が薬事承認を取得後のサプライチェーンを示したものです。今回、脊髄損傷急性期の追加治験を行い薬事承認を取得する予定ですが、薬事承認後のサプライチェーンに変更はありません。
当社が製造販売元となり、販売元である丸石製薬に製品を供給します。丸石製薬からは、卸売流通を担う東邦ホールディングスを通じて、全国の救急病院に薬が搬送されるというサプライチェーンです。
開発パイプライン-声帯瘢痕-

第2のパイプラインの声帯瘢痕についてです。声帯瘢痕は、声を出す喉の奥にある声帯の疾患です。声帯は非常にデリケートな粘膜構造を持つ組織ですが、これがなんらかの原因で線維化して硬くなると、声が出にくくなり、さらに進行すると声が出なくなってしまうという希少疾患です。こちらも有効な治療法や治療薬がない、いわゆる難病です。
発声障害の患者さんの声

こちらのスライドは、発声障害の患者団体が発行しているリーフレットから、患者さんの声を転載したものです。
声の障害は命に直結する疾患ではありませんが、患者さんご本人にとってはQOLを著しく損なう疾患です。そのことが、この患者さんの声からも理解できるかと思います。
声帯瘢痕に対するHGFの作用機序
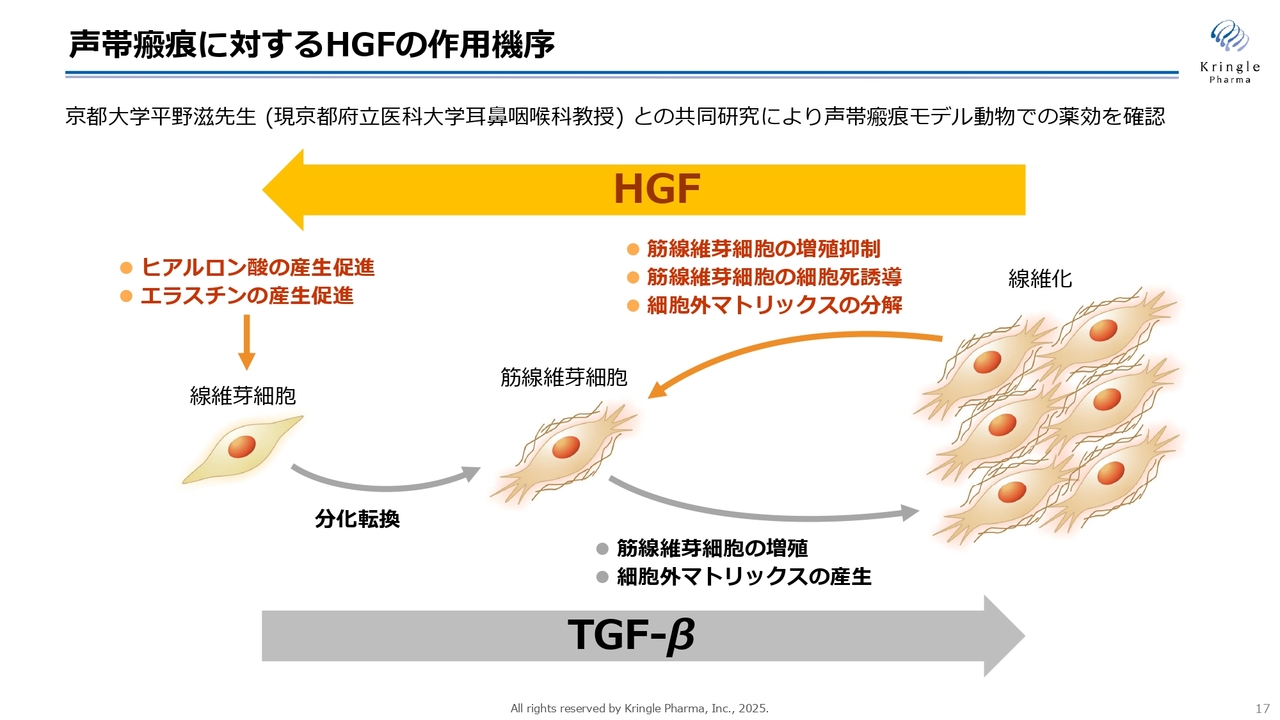
こちらのスライドは、HGFに期待される作用機序を示したものです。線維芽細胞が線維化し筋線維芽細胞に分化、その後増殖していくことが、線維化のメカニズムです。
この過程には、TGF-βという声帯内のタンパク質が関与していることがわかっています。一方で、HGFにはスライドの図で右向きに進む線維化を逆向きに動かす、抗線維化の働きがあります。
具体的な作用としては、筋線維芽細胞の増殖を抑制したり、細胞死を誘導したりすること、さらにはコラーゲンのような細胞外マトリックス、いわゆる硬い成分を分解する酵素を多く産出することが挙げられます。一方で、ヒアルロン酸やエラスチンといった細胞を柔らかくする成分の産生を促進するなど、複数の働きを通じて抗線維化効果を発揮します。
声帯瘢痕 第I/II相試験の結果
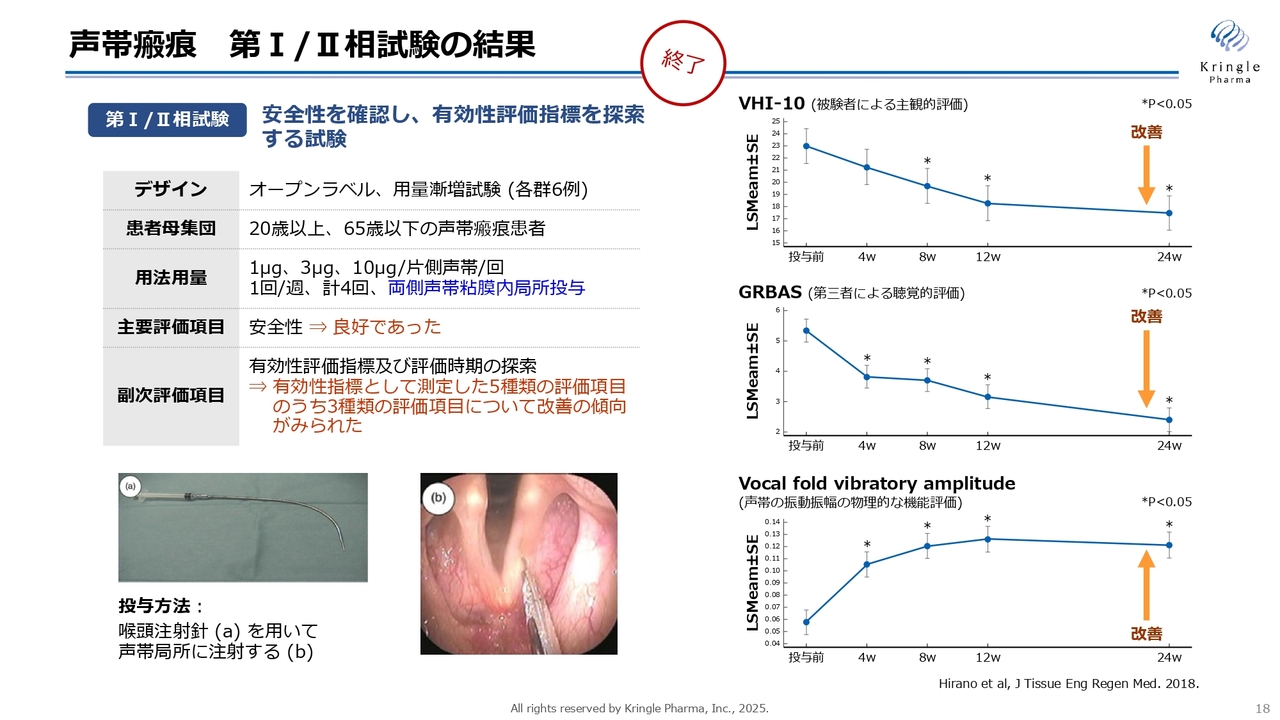
当社はすでに第Ⅰ/Ⅱ相試験であるオープンラベルの用量漸増試験を終了しています。スライド左下の写真(a)の注射針を用いて声帯局所にHGFを注射する投与方法を採用した結果、スライド右側に記載の3つの指標で有効性を示唆する改善傾向が観察されました。
異なる3つの指標で改善傾向が得られたことは、HGFが治療薬として非常に有望であることを示唆するデータとなっています。
声帯瘢痕 第III相試験(医薬品開発の最終段階)

現在実施中の第Ⅲ相試験は、医薬品開発の最終段階にあたります。スライドではその概要を示しています。本試験はプラセボ対照二重盲検比較試験で、目標症例数は62症例です。
すでに患者さんの組入れを着々と進めており、今年末の組入れ終了に向けてラストスパートに入っている状況です。
二重盲検期として6ヶ月、その後の継続期として6ヶ月、最長1年間にわたり患者さんにご協力いただきます。今年末までに組み入れが終了すると、2026年末にLast Patient Outが完了し、2027年前半に総括報告書が出るというスケジュールです。
現在、全国8施設で治験を進めています。声帯瘢痕のための少量製剤についてはすでに検討を終え、市販スケールでの製造検討を加速し、承認申請に備えたいと考えています。
開発パイプライン-ALS-

第3パイプラインのALSについてです。ALSは神経難病の象徴的な疾患であり、国内では約1万人の患者さんがいるといわれています。体が徐々に動かなくなり、最後には呼吸ができなくなり死に至るため、5年以内に8割以上の患者さんが亡くなるという非常に過酷な疾患です。
既存薬もいくつか承認されていますが、効果は限定的であるため、引き続き効果のある薬が求められており、医療経済効果の高い疾患とされています。
ALS 第II相試験(医師主導治験)

当社は、すでに東北大学と共同で第Ⅱ相試験を医師主導治験として実施しています。この試験は、プラセボ対照二重盲検比較試験で、HGF投与群とプラセボ群を比較しましたが、ALSFRS-Rという主要評価項目において統計的な有意差は得られませんでした。
しかしながら、実薬群で進行抑制が認められた症例もあったため、さらなる解析が必要と判断し、現在バイオマーカーの測定解析を進めています。
ALSに関しては、神経変性のバイオマーカーであるニューロフィラメント軽鎖(Neurofilament Light Chain)が、すでにアメリカのFDAや日本のPMDAにも認められています。現在、ALSの開発においてこのニューロフィラメント軽鎖を測定することがスタンダードとなりつつあります。
今回の共同研究においても、ニューロフィラメント軽鎖を含む複数のマーカーを選び、それらを測定することで、ALSFRS-Rのスコアでは検出できなかったHGF投与の効果を検出できるかどうかを調べています。この共同研究は2025年9月まで継続予定であり、まもなくデータが得られる見込みです。
2025年9月期業績予想の修正
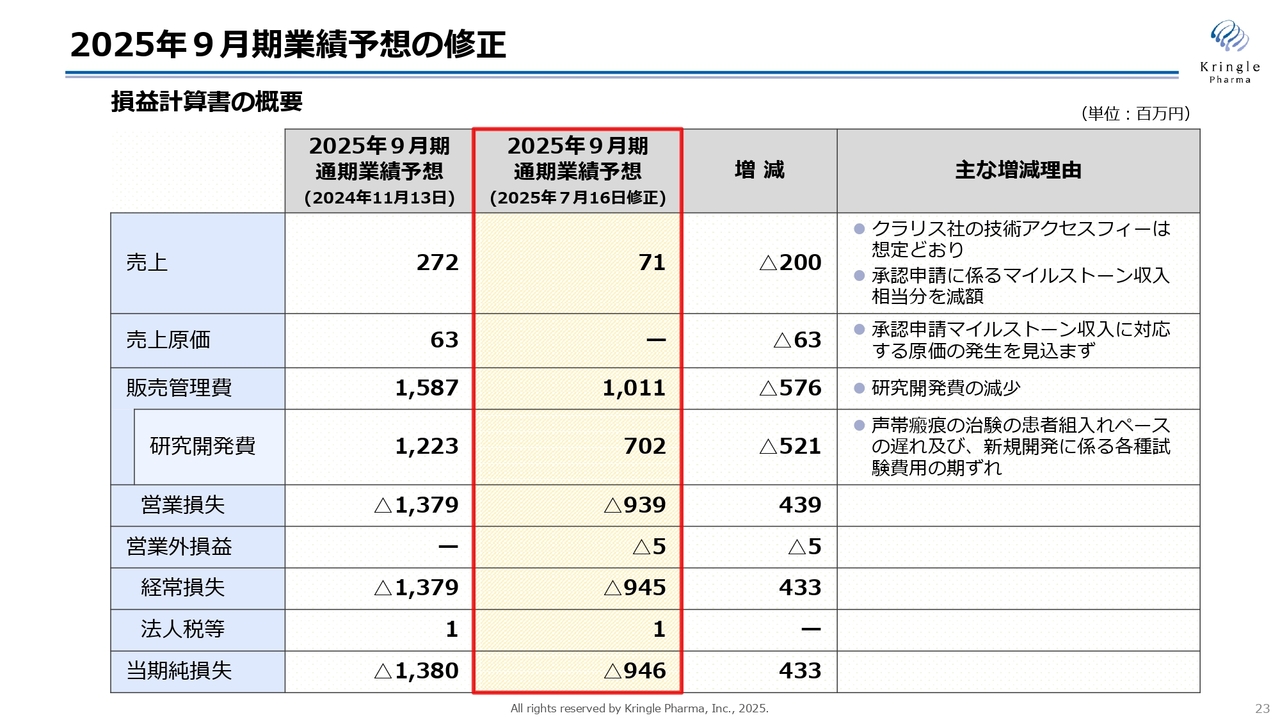
2025年9月期第3四半期の決算概況についてご説明します。スライドは2025年9月期業績予想の修正内容をまとめたものです。今期の業績予想の修正については7月16日に開示しましたが、それをさらに詳しく示しています。
期初に発表した今期の業績予想はスライドの一番左側、真ん中の黄色の背景部分が7月16日に修正したものです。修正の大きな点は売上で、当初は2億7,200万円と予想していましたが、今回の修正で7,100万円に減額しました。
クラリス社からの技術アクセスフィーは想定どおりでしたが、脊髄損傷の承認申請が遅延したため、承認申請に関わるマイルストーン収入の分が減額となっています。
修正点の大きな部分としては研究開発費です。期初の予想では12億2,300万円を見込んでいましたが、今回の修正では7億200万円に減額しています。主な理由として、声帯瘢痕の治験の組み入れペースが遅れたこと、さらに新規開発に関わる各種試験費用の期ずれが挙げられます。
これにより、販売管理費は当初予想していた15億8,700万円から10億1,100万円に減額しました。あわせて、営業損失は今回の修正でマイナス9億3,900万円、経常損失はマイナス9億4,500万円、当期純損失はマイナス9億4,600万円へと修正しています。
2025年9月期第3四半期 経営成績の概況
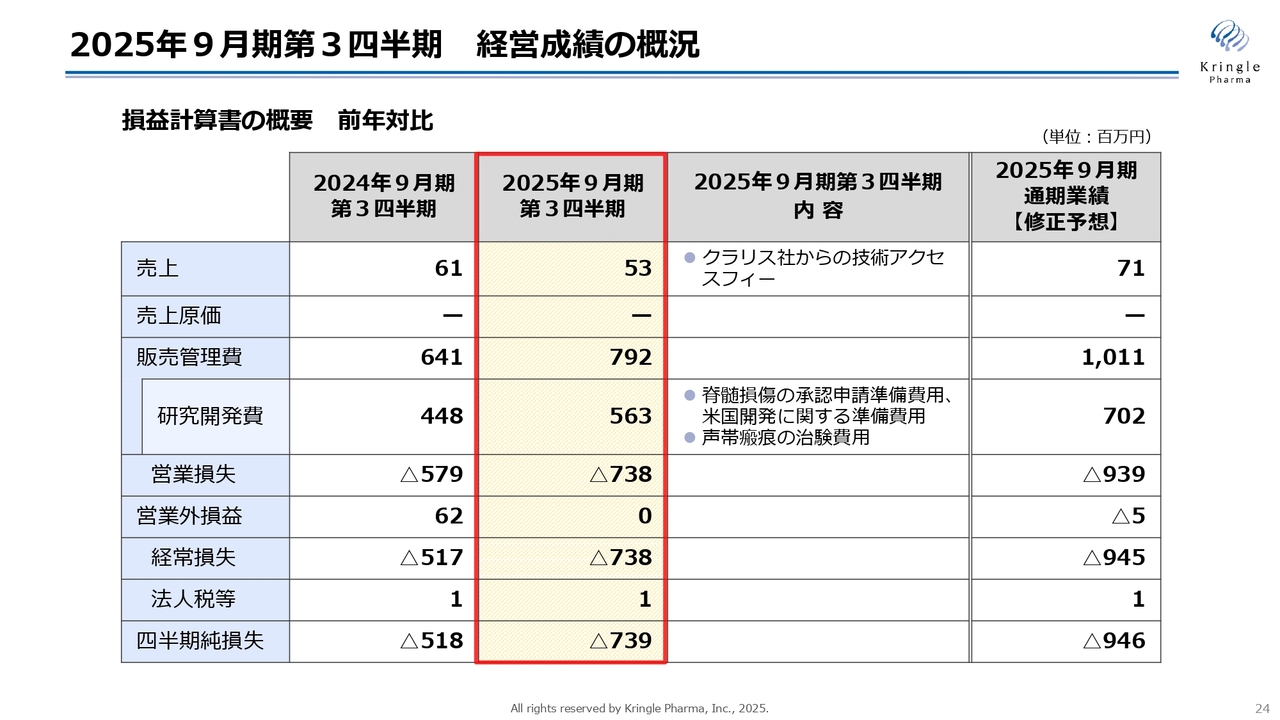
経営成績の概況を損益計算書の前年対比で示しています。まず売上についてですが、前期とほぼ同じ額です。これは、クラリス社からの技術アクセスフィーによるものです。数字の差異は為替変動によるものです。
研究開発費は前期と比べて増加し、5億6,300万円となりました。これは脊髄損傷の国内承認申請準備費用や、アメリカでの開発に関する準備費用、声帯瘢痕の治験費用によるものです。
販売管理費は7億9,200万円となり、営業損失は前期第3四半期のマイナス5億7,900万円から、今期第3四半期ではマイナス7億3,800万円に拡大しました。経常損失も同じくマイナス7億3,800万円となり、四半期純損失はマイナス7億3,900万円となっています。
前のスライドで修正した業績予想をスライドの右端に記載していますが、現時点でその約4分の3を消化した数字となっています。
2025年9月期第3四半期 財政状態の概況
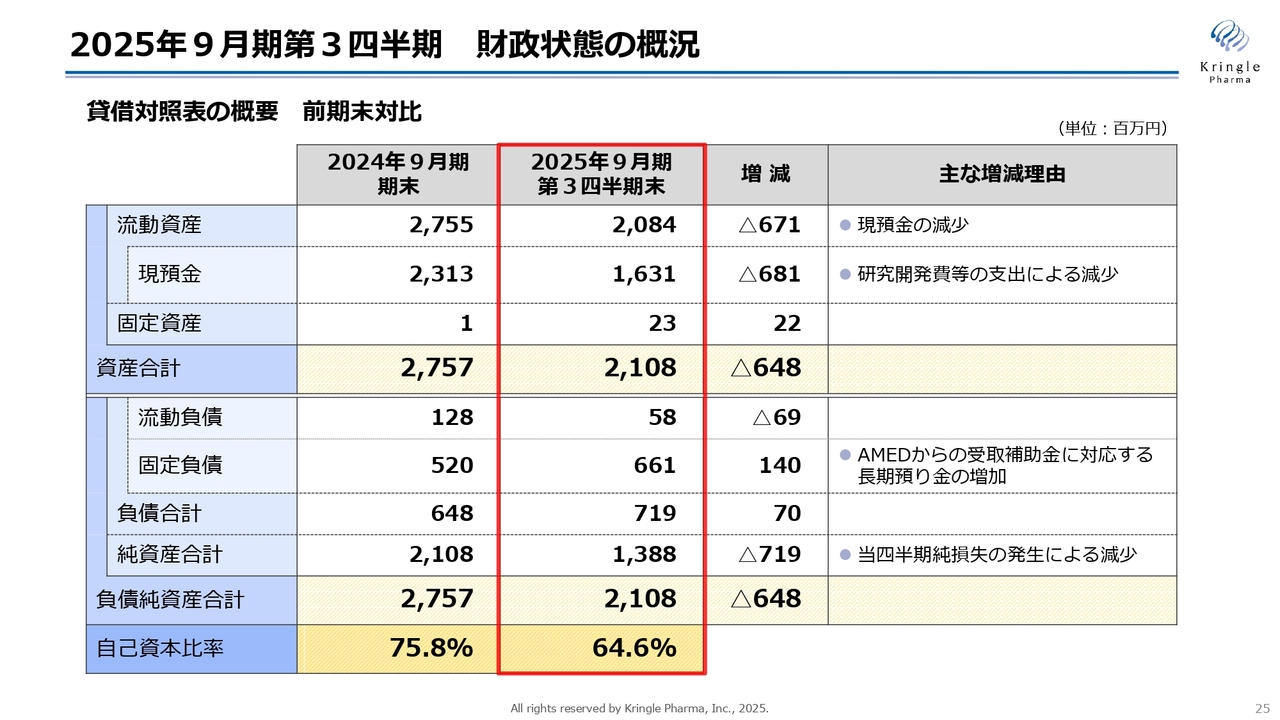
財政状態の概況を貸借対照表の前期末対比で示しています。まず、流動資産は20億8,400万円で、そのうち現預金が16億3,100万円です。前期末からの減少分は、研究開発費等の支出によるものです。資産合計としては21億800万円となっています。
一方、負債については、負債合計が7億1,900万円となっています。このうち固定負債が1億4,000万円増加しています。これは、AMEDの「CiCLE」という補助金制度により声帯瘢痕のフェーズⅢを現在進めており、補助金相当額を毎年定期預金として積み立てることが求められているため、長期の預かり金として増加したものです。
純資産合計は13億8,800万円で、自己資本比率は前期末の75.8パーセントから今期第3四半期末では64.6パーセントに減少していますが、引き続き安定した財政状態を維持しています。
クリングルファーマの成長戦略
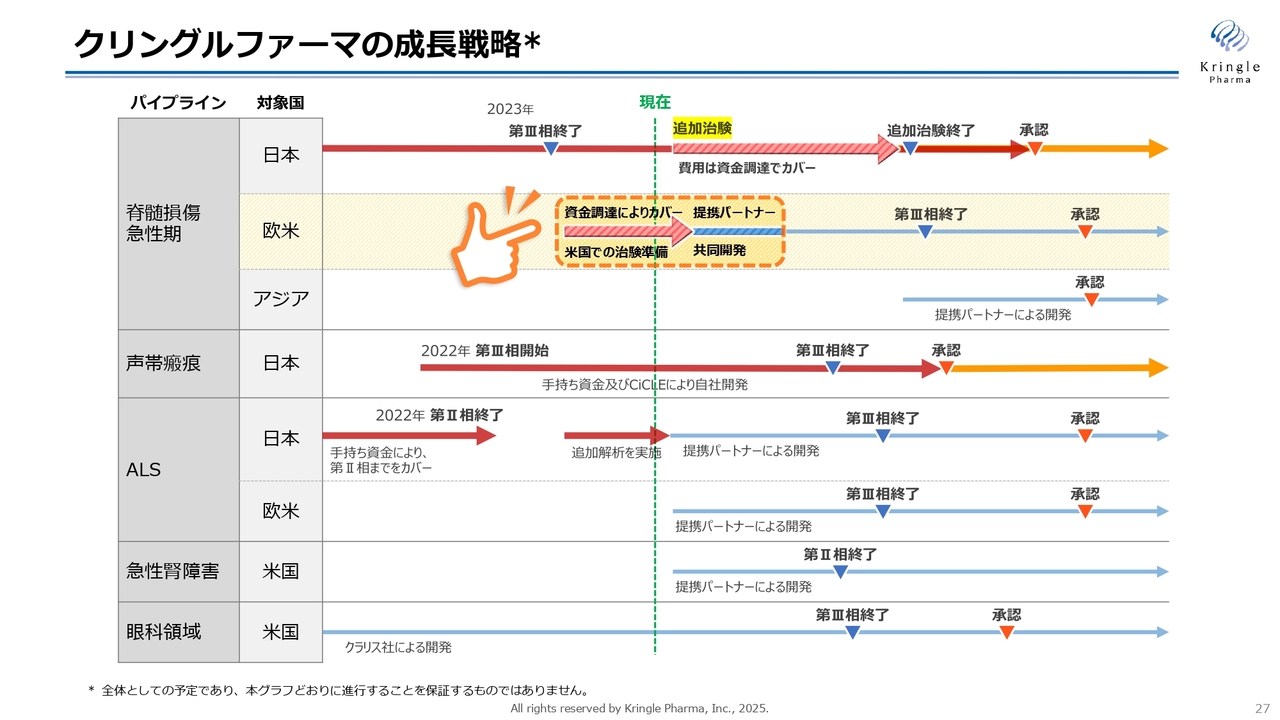
当社の成長戦略についてお話しします。こちらのスライドは、いつも示している成長戦略の内容です。一番大きな変更点は、グラフ最上部にある脊髄損傷急性期の国内での開発について、新たな治験を表す矢印を追加した点です。これに伴い、治験の終了と承認がグラフ右側に遅れる見込みとなっています。
追加の治験費用については、現在進行中の資金調達でカバーする予定です。
一方、アメリカにおいては治験開始に向けた準備を進めています。これについては、前回の資金調達で対応済みです。アメリカで希少疾病用医薬品指定を取得しましたので、今後、共同開発に向けた提携パートナーとの交渉をさらに加速し、進展させていくことができると考えています。
第2パイプラインの声帯瘢痕については、第Ⅲ相試験の患者さんの組入れがラストスパートに入っています。第Ⅲ相試験が終了した後に承認申請を行う予定ですが、現時点では脊髄損傷よりも承認が早まる可能性が出てきました。こちらについても自社で開発を進め、国内で承認を取得するという方針に変更はありません。
第3パイプラインのALSについては、追加解析を実施し、その結果を基にグローバルの提携パートナーを得る計画です。
成長戦略1:国内で2製品を上市する

成長戦略1・2・3の3点についてお話しします。まず成長戦略1は、国内で脊髄損傷急性期の治療薬と声帯瘢痕の治療薬の2つの製品を上市することです。これら2つの製品を上市するための開発資金として、現在資金調達を進めており、これにより両製品の上市までの費用をカバーできる見込みです。
脊髄損傷治療薬については、追加の治験費用を確保します。また、声帯瘢痕治療薬については、承認申請が脊髄損傷治療薬よりも早くなる可能性があることから、承認申請に必要な市販製剤の試験製造も粛々と進めていきます。
国内で2つの製品を上市することができれば、当然ながら企業価値を向上させることができ、当社が初めから掲げている「創薬ベンチャーからバイオ製薬企業へ」という目標を達成するための第一歩となります。
成長戦略2:海外市場にリーチする
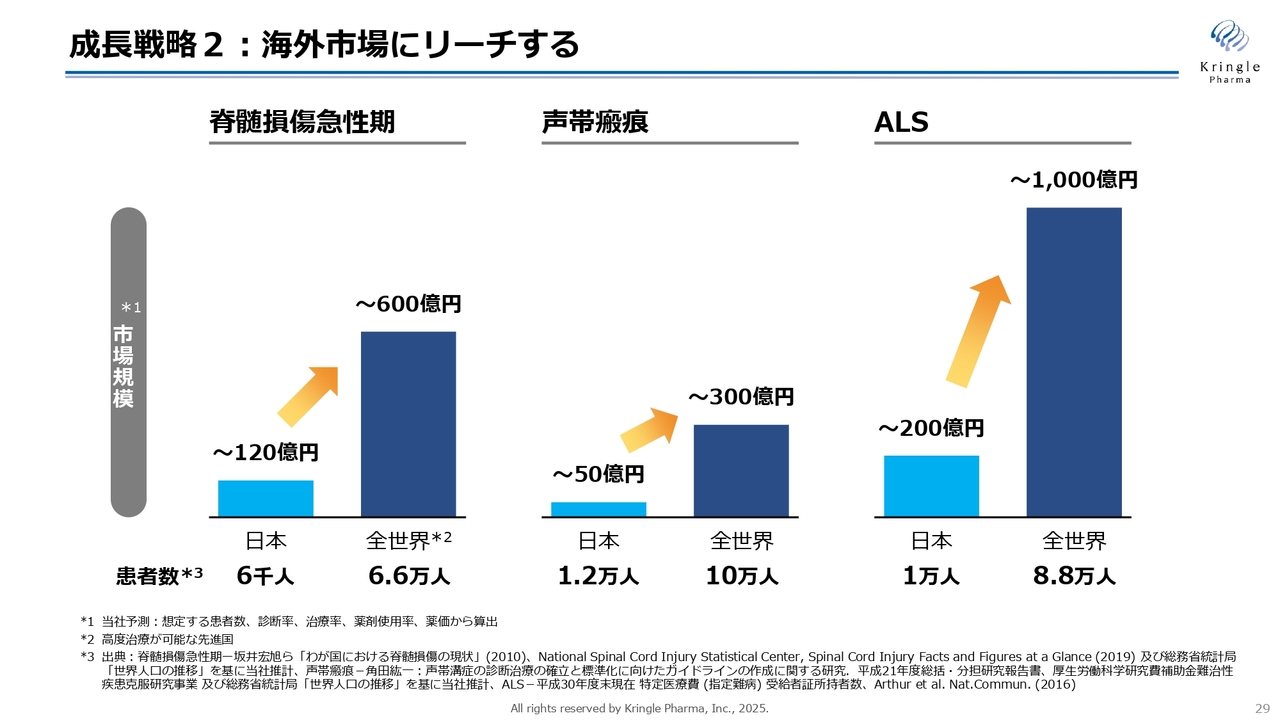
成長戦略2、海外市場へのリーチについてです。当社が対象としている希少疾患は患者数が限られるため、国内市場だけではどうしても規模が限定的にならざるを得ません。一方で、海外には約10倍の患者さんが存在し、それに対応する大きな市場があります。そのため、いち早く海外市場に進出することが当社の成長に非常に大きな影響を与えると考えています。
まずは脊髄損傷急性期治療のアメリカにおける開発を進め、アメリカでの承認を取得します。これによりグローバルスタンダードを確立し、全世界の市場獲得に注力していきます。
成長戦略3:適応拡大する
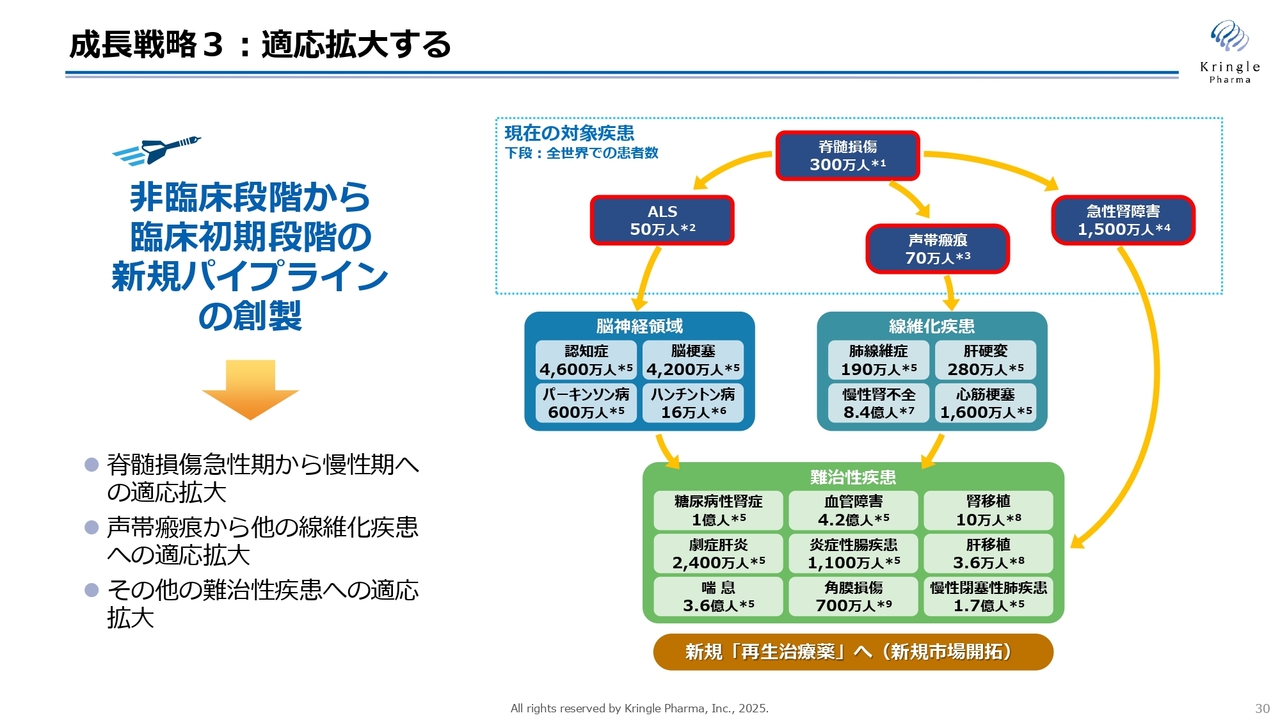
成長戦略3は、適用を拡大することです。HGFについては、多くの基礎研究が発表されており、スライド右側にあるように、当社が開発している疾患以外にもさまざまな適用拡大の可能性が論文で報告されています。適用拡大を効率的に進めることで、HGFの価値を最大化することが、当社の成長に大きく影響すると考えています。
現在、当社では脊髄損傷の急性期から慢性期への適用拡大、声帯瘢痕を端緒としたその他の線維化疾患への適用拡大、新たな難治性疾患への適用拡大という3つの大きな柱を掲げ、これに資する共同研究を国内のアカデミアと積極的に推進しています。
クリングルファーマのビジョン
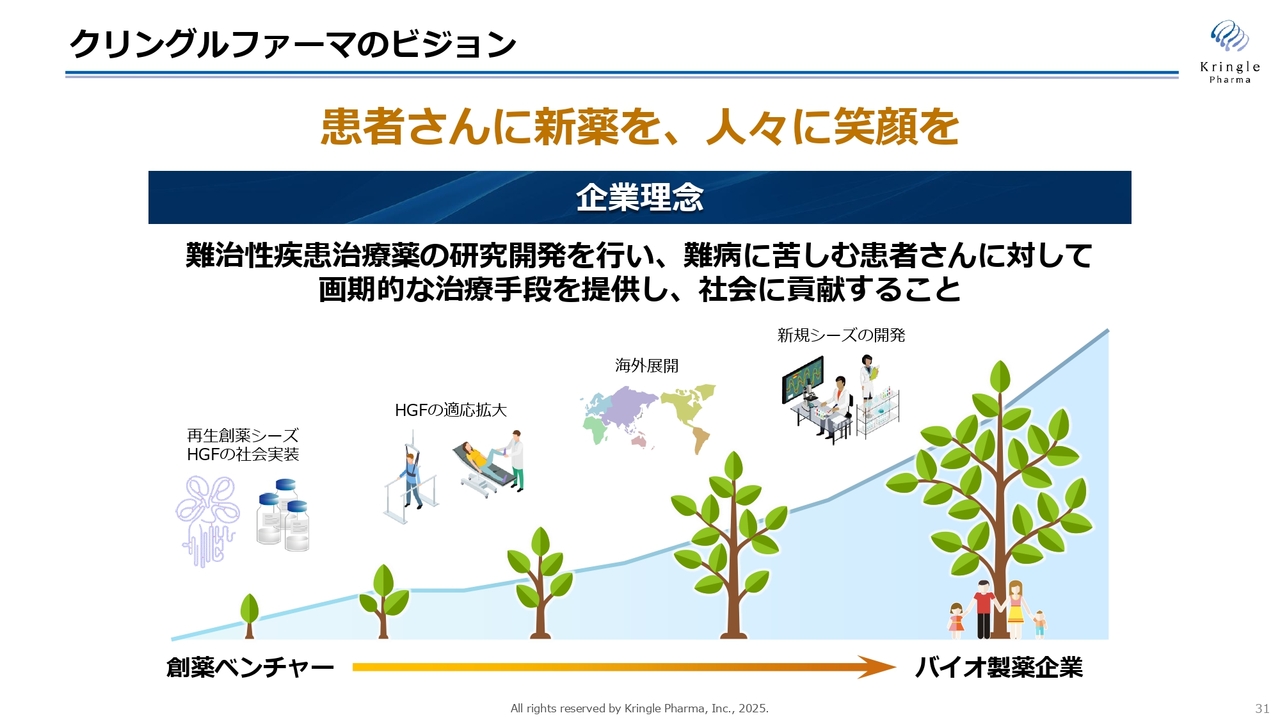
最後に、当社のビジョンを1枚のスライドにまとめています。「患者さんに新薬を、人々に笑顔を」を届けることが私たちの使命です。まずはHGFタンパク質を脊髄損傷急性期と声帯瘢痕の2つの疾患に対する治療薬として確実に社会実装し、同時に海外展開と適用拡大を図っていきます。
最終的には、日本初の優れた創薬シーズを「クリングルファーマ」という創薬エンジンを通じて社会実装し、これを国内から海外へ発信することで、持続的な成長を実現したいと考えています。また、これが実現すれば、創薬ベンチャーからバイオ製薬企業、さらには国内にとどまらずグローバルなバイオ製薬企業へと成長できると固く信じています。
新着ログ
「医薬品」のログ





