【QAあり】オンコリス、OBP-301の2025年承認申請に向けて順調に進行、26年販売開始後を見据える
目次 Agenda
浦田泰生氏(以下、浦田):代表取締役社長の浦田です。よろしくお願いします。
本日は、決算のハイライトについてご説明した後、上半期のパイプラインの進展状況や、今後の方針についてお話ししたいと思います。それでは、財務状況などについて秦からご説明します。
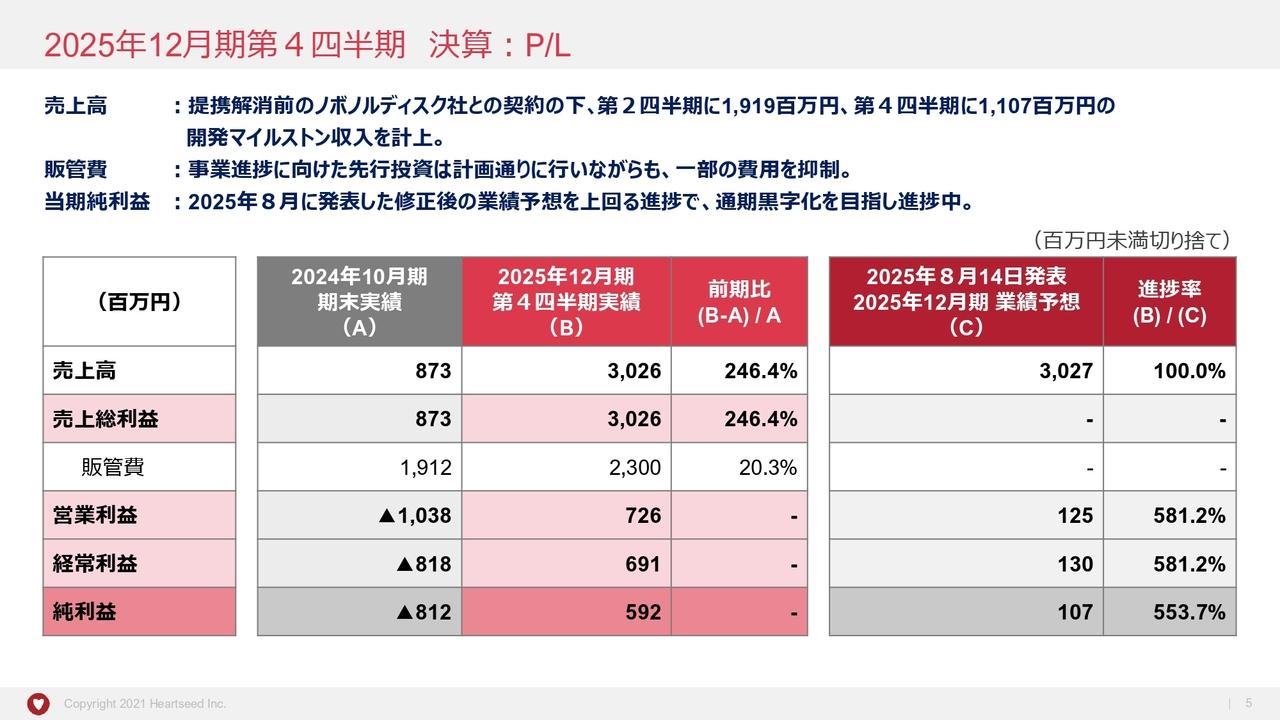
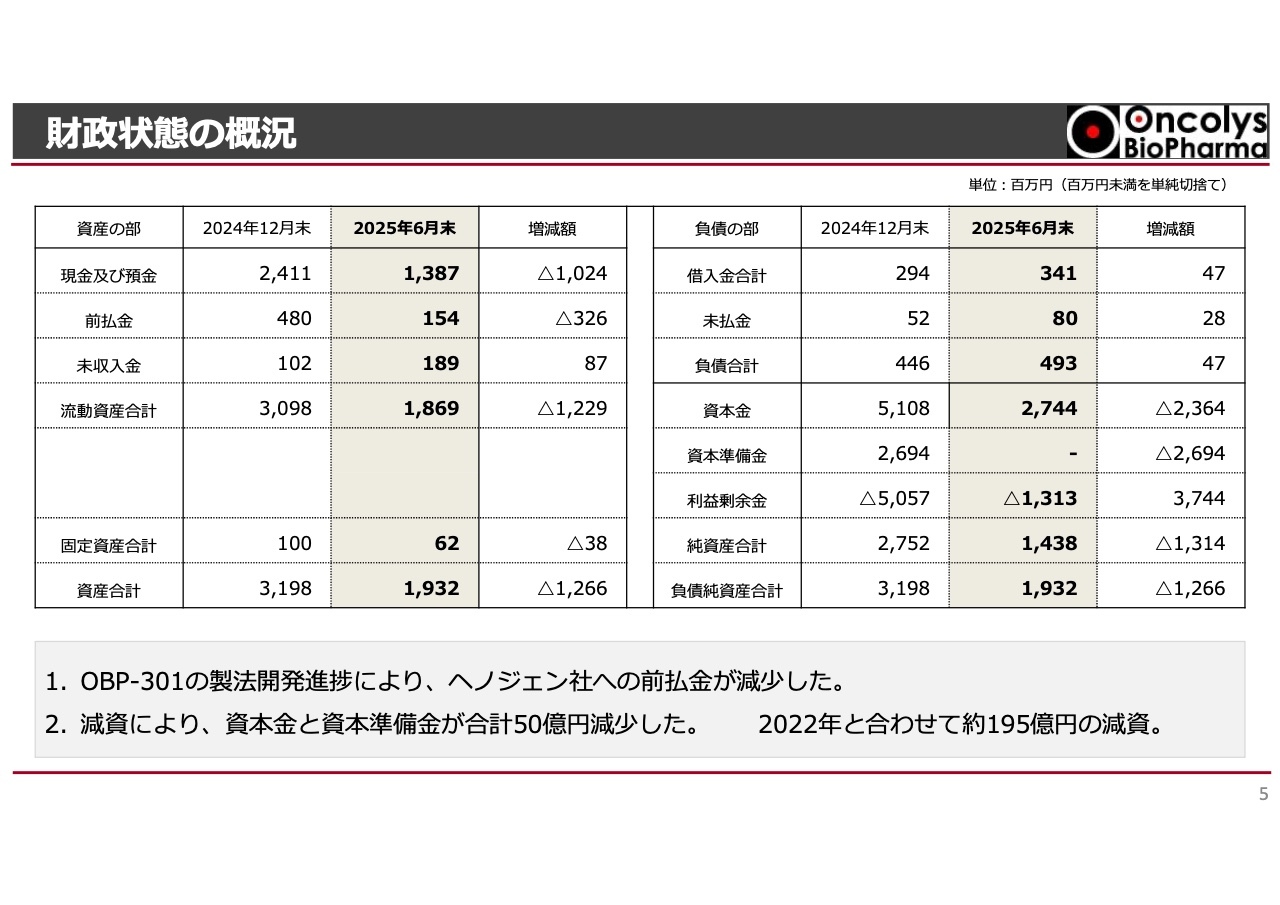
財政状態の概況
秦耕平氏:執行役員の秦です。まず、バランスシートの状況についてご説明します。
本日発表した中間決算において、2024年12月末と比較して大きなポイントとなるのは、ヘノジェン社に以前から支払っていた前払金が4億8,000万円から1億5,400万円へ減少したことです。後ほど損益計算書のご説明でもお話ししますが、この減少は研究開発の進展に伴うものです。それにより、資産の部では3億2,000万円ほど前払金が減少しています。
また、減資に関しては今年3月の株主総会でご承認いただき、5月に実行しました。今回、約50億円の減資を行い、2022年に実施した減資と合わせて合計195億円ほどの減資を実施しました。これにより、外形標準課税の支払いが約1億円減少する見込みです。こうした資金を当社の成長のための資金に充当していきます。
経営成績の概況
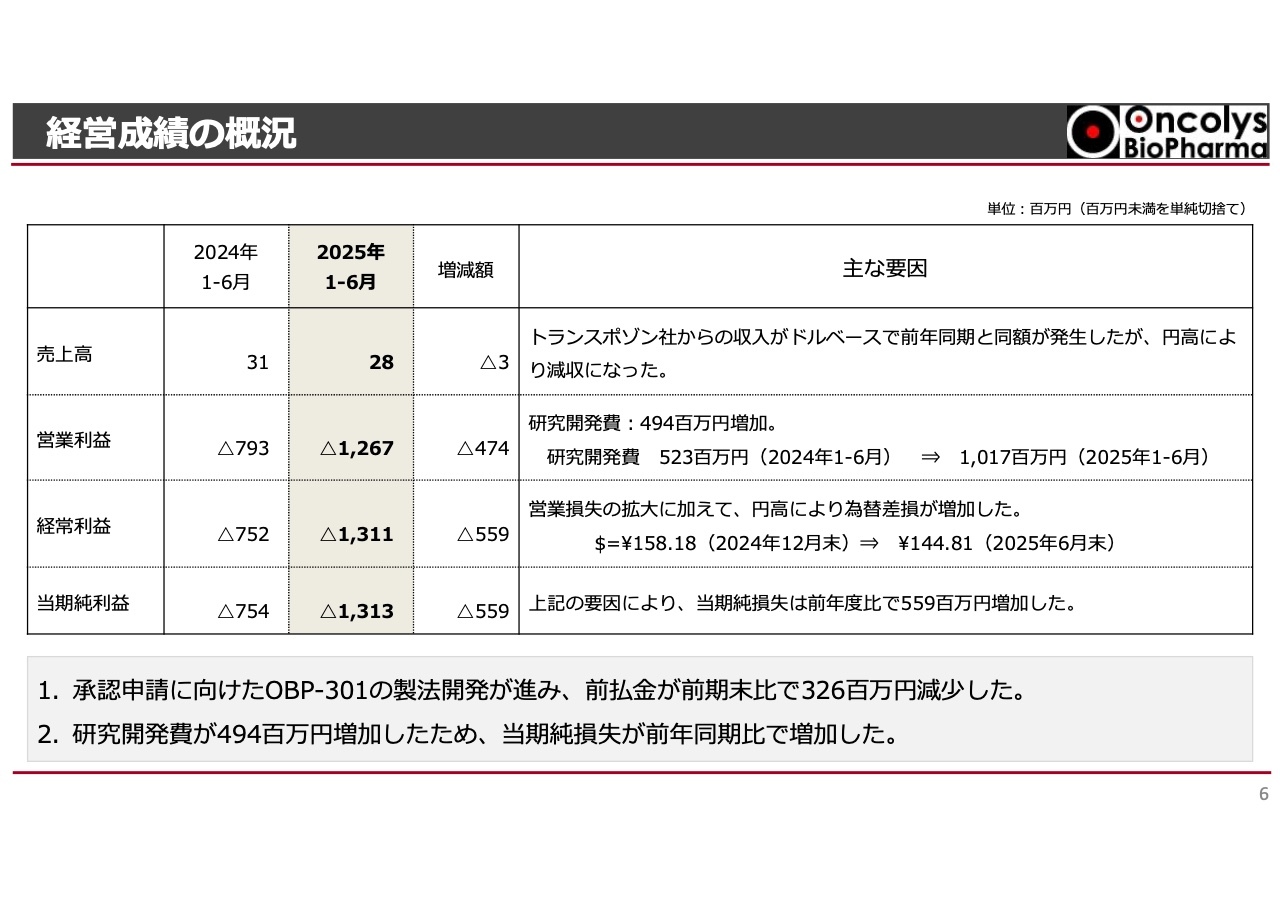
損益計算書についてご説明します。売上高は前年同期と比較して300万円ほど減少しましたが、これは為替の影響によるものであり、実質的な変化はありません。
また、先ほど前払金の減少についてご説明しましたが、その分が研究開発費の増加に直結しており、研究開発費は昨年比で約5億円増加しました。それに伴い、販管費も増加し、営業損失は昨年比で約5億円増加しています。
キャッシュ・フローの概況
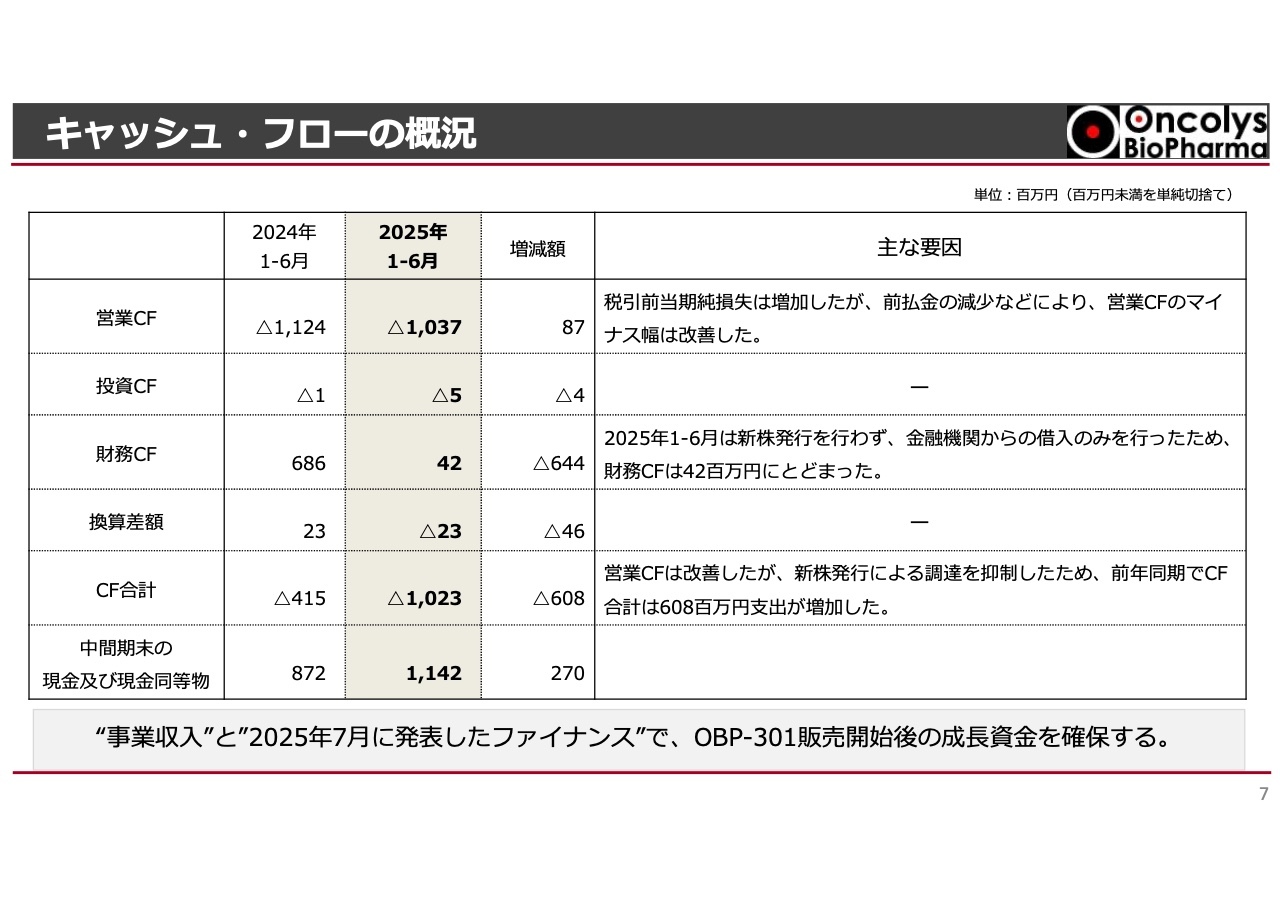
キャッシュ・フローについてご説明します。前払金の減少に伴う研究開発費の増加により、キャッシュ・アウトを伴わない損失が拡大しました。その結果、税引前の当期純損失は増加しましたが、営業キャッシュ・フローのマイナス幅は昨年の11億2,400万円と比較し、本年度中間期には10億3,700万円と8,700万円ほど改善しています。
また、財務キャッシュ・フローについては、昨年の上半期にエクイティファイナンスを行いましたが、今期の上半期では長期借入金など、金融機関からの借入のみを行いました。そのため、財務キャッシュ・フローは約4,200万円にとどまっています。
その結果、キャッシュ・フロー全体では、昨年の約マイナス4億円から、今期は約マイナス10億円となり、中間期末の現金及び現金同等物の残高は約11億円となりました。
今後の成長資金については、今後予定されている事業収入と、今年7月に発表したファイナンスにより確保し、それをどのように活用するかについては後ほど浦田からご説明します。
2025年12月期の業績見通し

樫原康成氏:常務取締役の樫原です。私からは2025年度の業績見通しについてご説明します。
当社の業績は、「OBP-301(テロメライシン)」、「OBP-601」などの提携契約に基づく契約一時金やマイルストーン収入に依存している状況であり、それらの有無により大きく変動する可能性があります。現時点では、その収入がいつ、どのような額で、どのタイミングで発生するのかが不透明な状況です。
このような状況を踏まえ、当社は現時点で合理的な業績予想を開示することが困難であると考えています。したがって、業績に関する見通しについては開示を控えています。
2025年6月末のパイプラインの状況
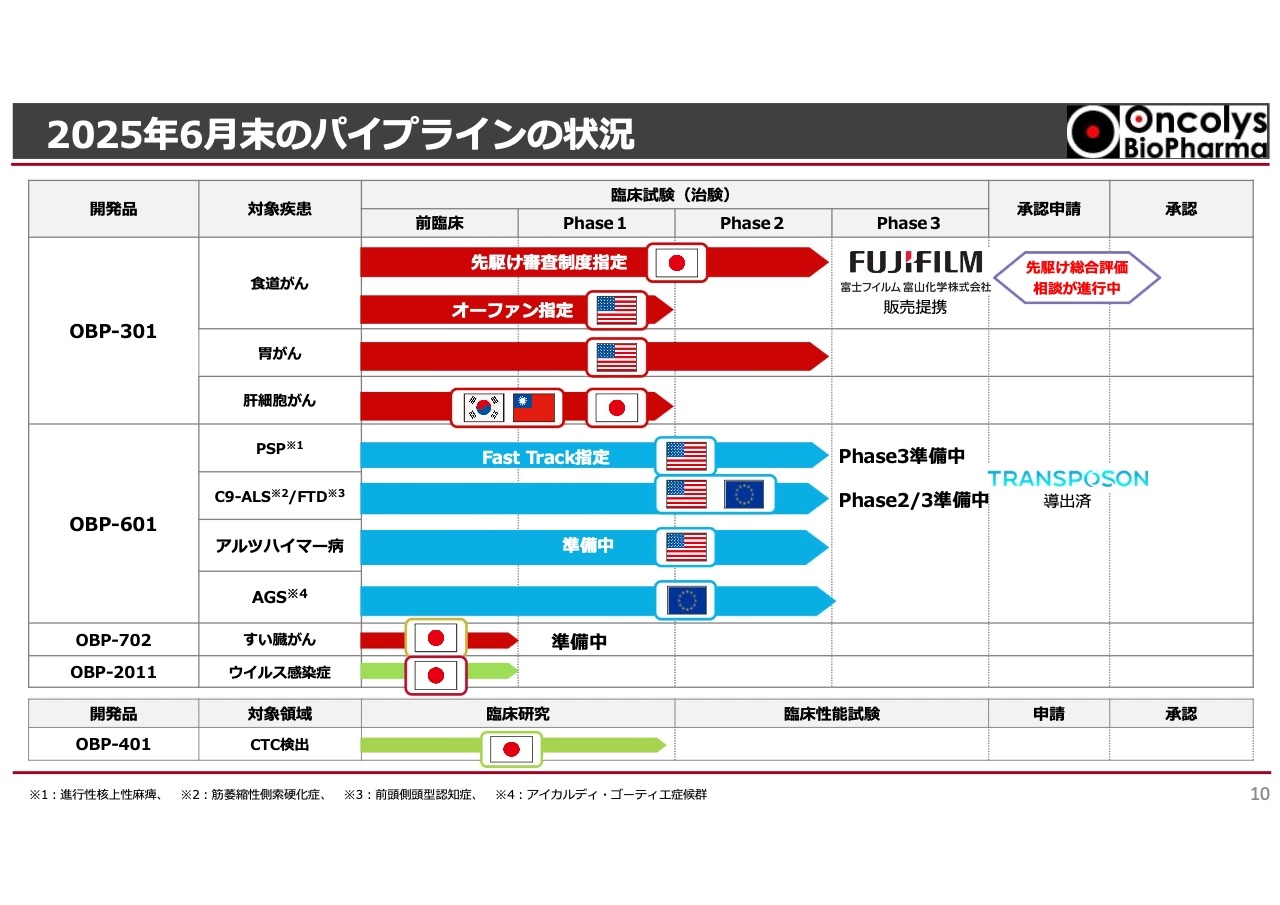
浦田:私からは2025年上半期の進捗についてご説明します。株主総会でもお話ししましたが、今年は「ラストスパート」という標語のもと、スライドのパイプライン表の一番上にある、食道がん治療薬「テロメライシン」の先駆け審査制度を利用した承認申請に向けて全力で取り組んでいます。
先ほどキャッシュ・フローのお話がありましたが、そのほとんどが「テロメライシン」の開発及び商用製造に投入されていることがおわかりいただけたと思います。また、「テロメライシン」はアメリカでオーファン指定を受けた食道がんの臨床試験のPhase1が終了し、非常に良い結果が得られたことをすでにご報告済みです。
「OBP-601」については後ほどお話ししますが、今期はほとんどの試験がPhase2に入っています。アルツハイマー病に対する臨床試験の準備がいよいよ大詰めを迎えており、年内にもPhase2が開始される予定です。
また、トランスポゾン社についても後ほどお話ししますが、開発パイプラインに対する資金の配分がどのように行われていくかという状況になっています。いずれにしても、当社は現在「テロメライシン」の食道がんに関する日本国内での承認申請に向けてラストスパートをかけています。
OBP-301の概況

「テロメライシン」の概況です。1番目に、先駆け総合評価相談が順調に進んでいます。2番目の臨床については、既存の治療法である放射線単独療法よりも、当社が主張する治療のほうが格段に良い成績を得られたことについて、PMDAの理解が得られたと考えています。
3番目に、品質や製造に関するやり取りは引き続きPMDAと行っていますが、この期間中に新製剤の12ヶ月の安定性が担保されたという結果が得られました。以前は6ヶ月あるいは9ヶ月の安定性でしたが、今回は1年間の安定性が確認されました。
現在、新製剤に切り替えていますが、大きな変更があったわけではありません。食品添加物を少し加えることで、安定性が非常に向上しました。現在はこの新製剤で承認申請を目指しています。
4番目は我々にとって初めての取り組みであり、非常に苦労している部分ですが、商品の運送・流通に関する試験を行っています。ベルギーにあるヘノジェン社で「テロメライシン」が作られ、日本国内に運ばれた後、最終製剤化を行うプロセスにおいて、潤滑な運送及び国内での流通方法について、さまざまな試行錯誤が進められています。
5番目に、特筆すべき点として、食道がんに対するKey Opinion Leaderを組織化しました。今年10月に学会が神戸で開催される際、その期間中に第1回「食道癌局所療法研究会」を開催予定です。この研究会では、マーケットにおける「テロメライシン」の理解を深め、臨床における「テロメライシン」の適正な使用方法や将来の適応拡大について検討される予定です。
食道がん放射線単独療法に関する学会報告
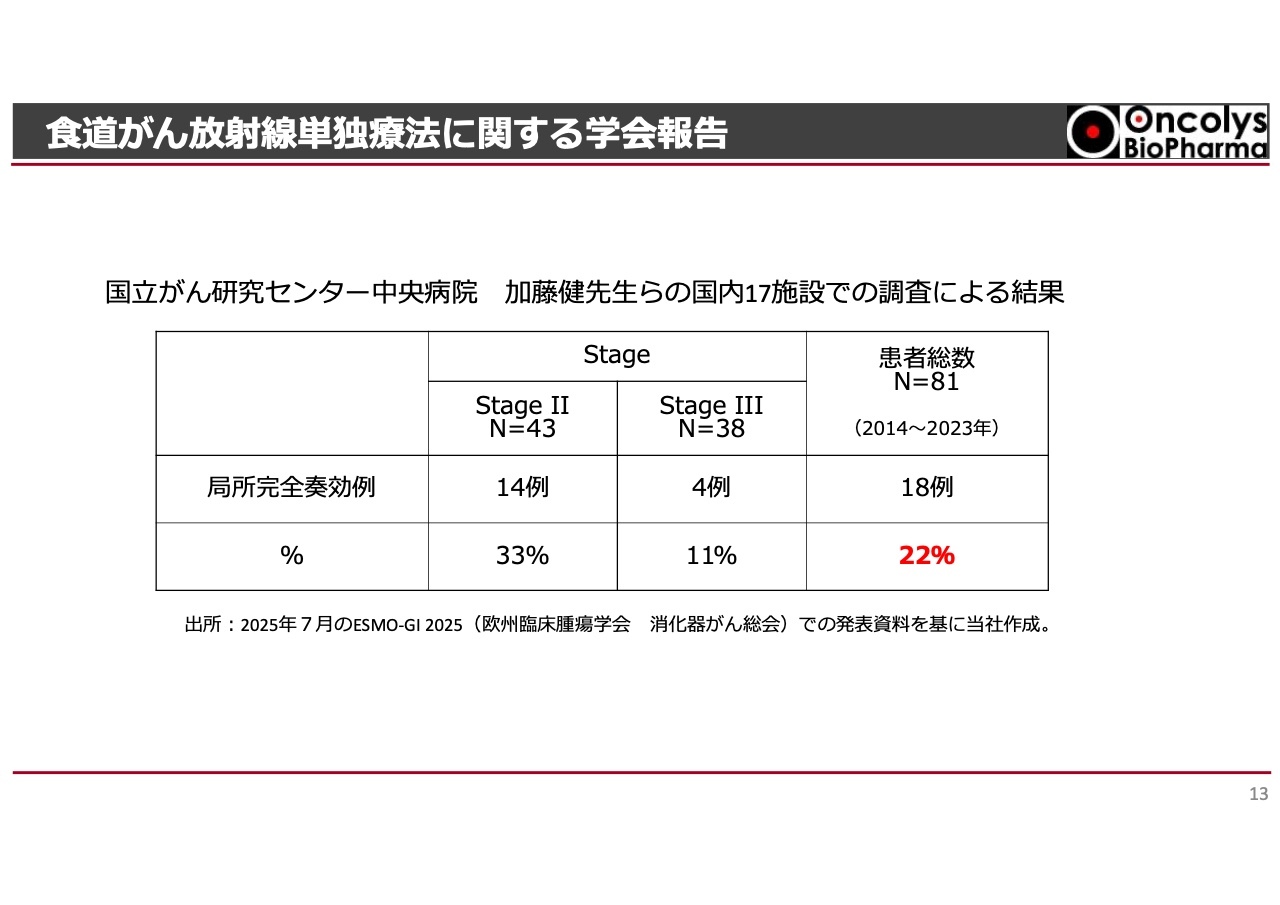
臨床試験の結果や「テロメライシン」による食道がん放射線単独療法に対する上乗せ効果について、PMDAがどのような観点で評価してきたのかをご説明します。すでにご報告していますが、国立がん研究センター中央病院を中心に、「テロメライシン」の国内臨床試験を実施した施設にご協力いただき、過去10年間の放射線単独療法の成績を調査していただきました。各施設からさまざまな症例報告が集まりました。
スライドの表には、StageⅡ及びStageⅢの食道がん患者に対し、放射線単独療法によって局所にどの程度効果があるのかという数字が示されています。右下に赤字で記載されているように、放射線単独療法では22パーセントという結果が出ました。この結果を、当社では「リアルワールドデータ」だと認識しており、この考え方がPMDAにも理解されたものと捉えています。
食道がん放射線併用Phase2試験有効性:局所完全奏効率
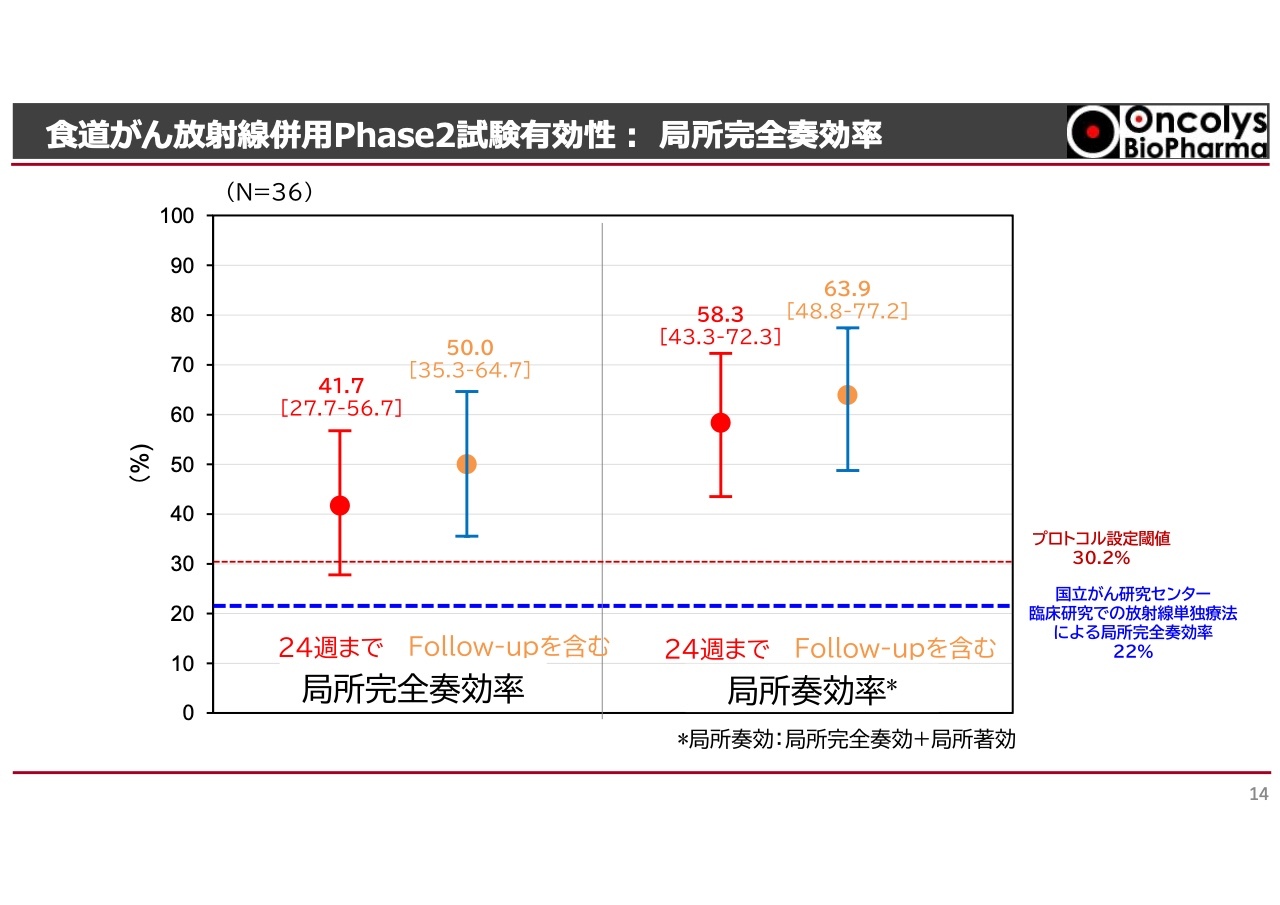
こちらのスライドは当社の臨床試験の結果です。図の左半分に示されている局所完全奏効率というのは、内視鏡でバイオプシーまで行った結果、完全にがんが消えた比率のことです。先ほどの22パーセントというリアルワールドデータに対し、当社の試験結果では41.7パーセントとなっています。フォローアップ期間を1.5年ほど見ると、約50パーセントの患者が局所で完全に治癒しています。
臨床試験を開始した当初は、図の赤い点線にあるとおり、20年以上前の食道学会におけるコントロールされていない調査結果の数字を基にしていました。しかし、直近の調査結果では、非常に厳正な食道がんの生検に基づき、放射線単独療法は22パーセントという数字のほうがより正確であることがわかってきました。
これらの結果を踏まえ、当社の治療結果は既存の治療である放射線単独療法を大幅に上回るものであることが証明されています。
図の右半分に示されている局所奏効率は、バイオプシーでがんがほぼ消失していると確認されたものです。ただし、がんの局所を放射線や「テロメライシン」によって治癒する際、ケロイドのような小さな肉芽が生じることがあります。それでも、このような症例も含めて問題がないことが確認されました。
その結果、治療開始から24週、つまり半年以内に60パーセント弱の治療成績が得られるという、非常に優れた結果を示しており、この点はPMDAからも認められています。
OBP-301の生存率
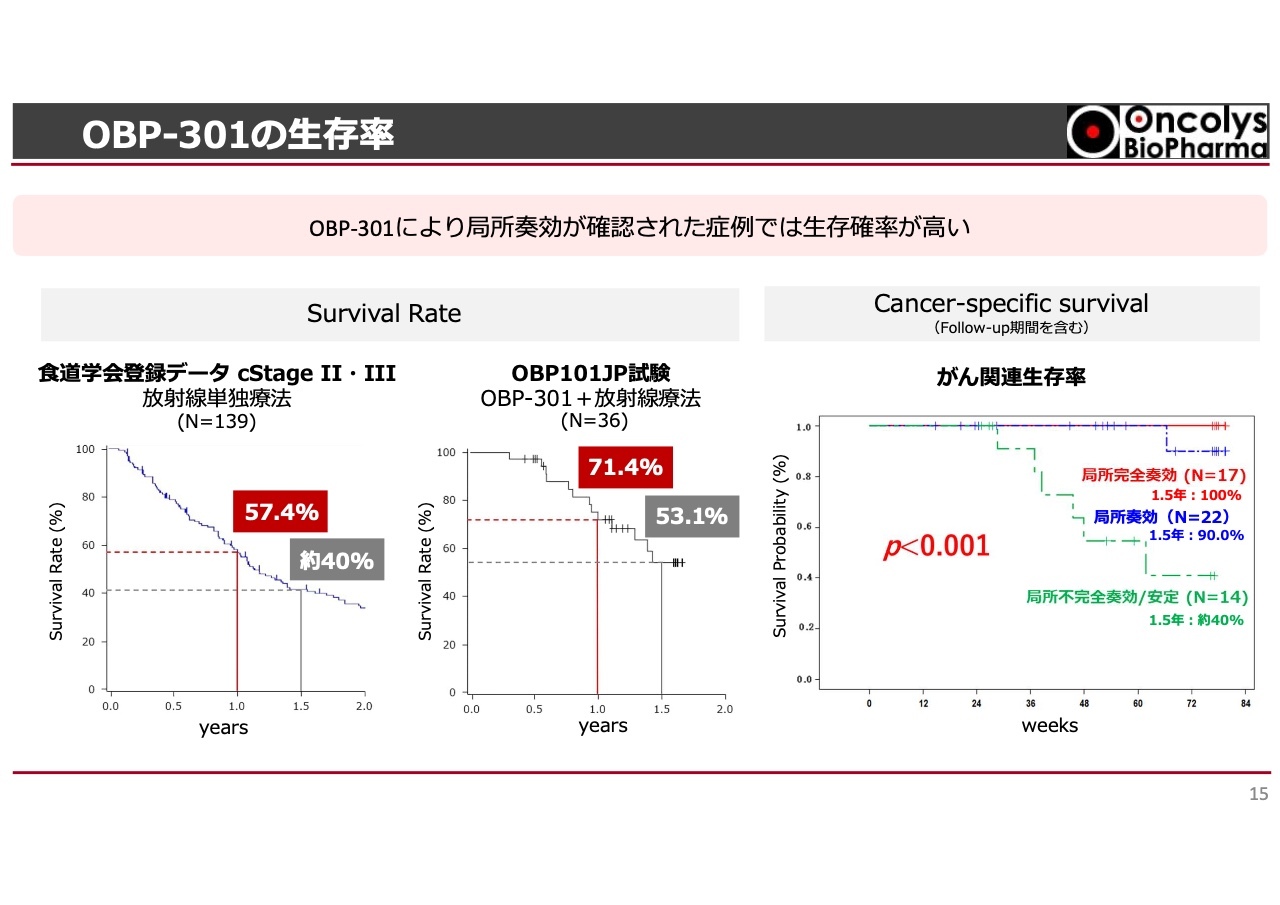
局所でがんが消えることが主眼であるとPMDAにも認めていただいていますが、がんの試験では生存率が非常に重視される中で、我々の試験でもそれに付随して最終的な生存率の結果を出しています。
スライドの一番左に記載されているのは、20年以上前に実施された食道学会でのデータです。このデータでは、1年生存率が57パーセント、1.5年生存率が40パーセントという結果が示されています。
一方、当社の試験結果はスライド中央に記載されているとおり、それぞれ71パーセント、53パーセントと、生存率が全体的に向上していることがわかります。
さらに、スライドの一番右にある図に示されているように、今回半数近くの方のがんが完全に消失しました。このような患者群を追跡した結果、赤字で書かれているとおり、1.5年経過後でも100パーセントの生存率が確認されるという結果が得られています。
また、緑色の破線を見ると、放射線単独では十分な効果が得られなかったことがわかります。この曲線は食道学会登録データとほぼ同様の挙動を示しており、なおかつ局所で「テロメライシン」が食道がんに有効であることが、生存率にも影響を及ぼしているという結果を示しました。
これらの結果から、新規性と有用性が非常に高いと評価される可能性があると感じています。このような結論は、これまでのPMDAとの対話を通じても認識されつつあると考えています。
まとめ

以上のことから、局所の結果及び生存率の結果がともに優れたものであることがわかります。
ただし、スライドの6番目に記載されているように、主な副作用としては風邪に関連する症状、例えば熱が出る、体の節々が痛むといった症状が51パーセントの方に見られました。また、リンパ球数が明らかに低下している方が48.6パーセントに達しました。なお、このリンパ球数の低下は、放射線単独療法でも見られる症状です。
これらの副作用が「テロメライシン」特有の結果かどうかについては、今後の精査が必要です。市販後にこのような調査を行う必要があると考えており、今回のファイナンスの目的の1つです。
販売開始後を見据えたスケジュール
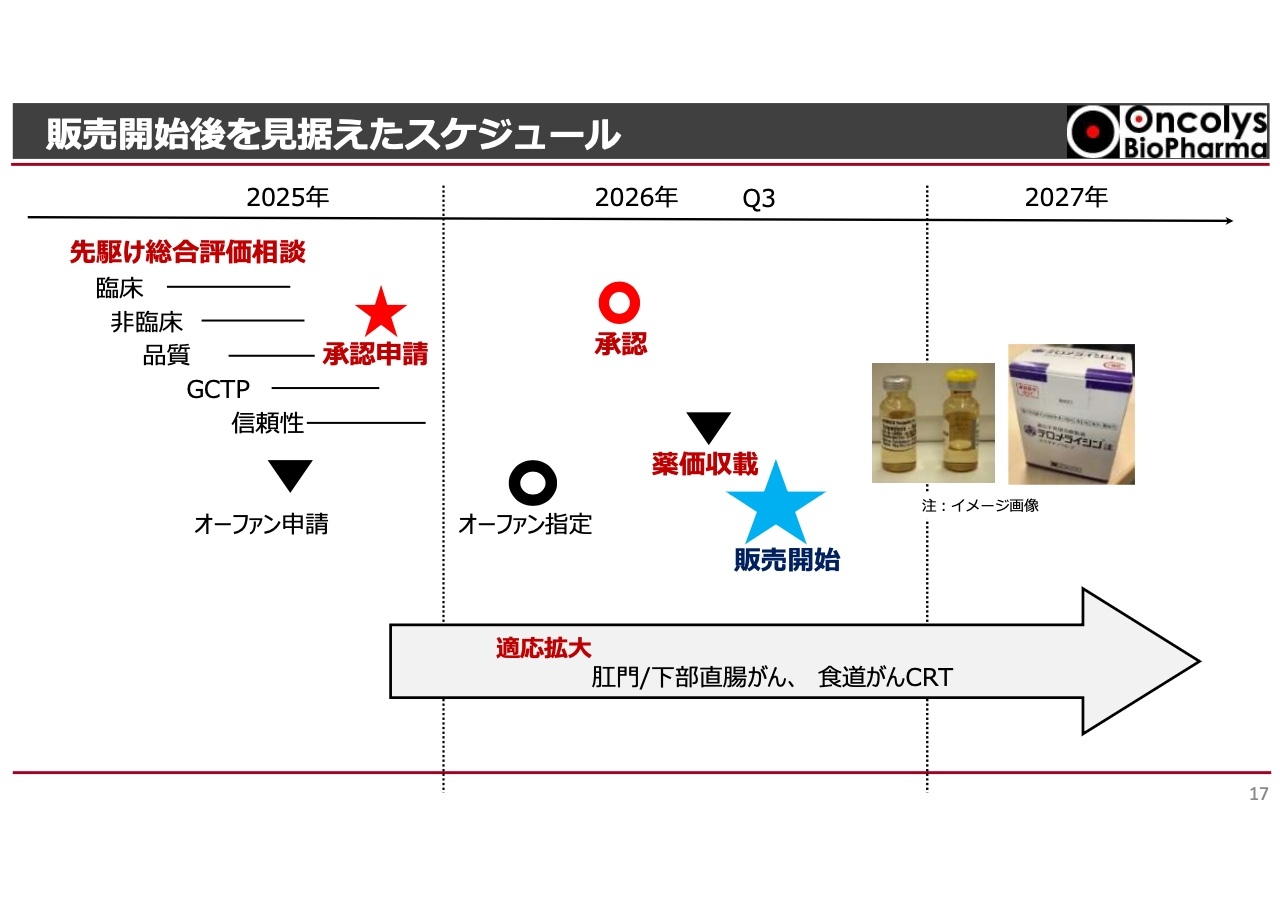
このような結果から、今後は品質に関してPMDAからいろいろと問い合わせが出てくると思いますが、これらが順調に進むと仮定すると、現段階では「テロメライシン」の承認申請は年内に可能と考えています。また、先駆け品目であることを踏まえると、来年の半ば頃には承認が得られる可能性が高いと思います。
スライド左側をご覧ください。2025年度の表に「オーファン申請」と記載されていますが、こちらについては、厚生労働省との打ち合わせをすでに行っており、年内のオーファン申請が確実な状況になっています。この状況から推測すると、来年の比較的早い段階でオーファン指定を得られる見込みがあり、「テロメライシン」の承認段階ではオーファンでの承認となる予定です。
また、スライド中央に下向きの三角形で示された「薬価収載」についてですが、承認後およそ2ヶ月間で、画期性の加算が可能かどうかを確認し、薬価収載される予定です。さらに、原価に関してもさまざまな数値が精査されることになります。
それ以外にも有用性加算が適用されるかなどが話し合われる中で、来年の第3四半期頃には薬価が収載される可能性が高くなっています。収載されれば直ちに販売を開始することになります。
その結果、2026年中に施設や病院によるさまざまな手続きを経て、実際の売上が立ってくる可能性が高い状況です。新たな適応に向けても、適応・効能拡大試験を行う計画を立てています。
資金調達の目的

商品を発売し、売上を伸ばしていくために、資金調達がどうしても必要であると判断しました。さらなる成長のために、資金調達を始めています。大きな理由は、スライドに記載の3つです。
1つ目は、条件付き承認になる可能性があるため、市販後臨床試験を行い、先ほどお伝えしたような有効性が再現できるかどうかを確認するよう指示される可能性がある点です。また、発売後には全例調査を実施し、副作用のパターンが風邪の症状やリンパ球数低下だけでなく、「テロメライシン」に特有の副作用があるかどうかも確認する必要があります。
これらの付帯事項はおそらく早期に提示されると思われるため、こうした臨床試験を実施するための資金が必要になります。
2つ目は、先ほどお話しした適応拡大です。適応追加試験については、肛門・下部直腸がんへの適応拡大や、食道がんの化学放射線療法との併用、さらに将来的には現在広く使用されているチェックポイント阻害剤との併用も視野に入れて進める必要があります。そのための資金が必要な時期にすでに来ています。
3つ目は、承認された際に品切れや製造の遅れによる供給停止が起きることは、社会的通念上からも大きな問題となります。そのため、安定供給ができるよう、現時点から多くのロットを積み重ねる体制を構築し、運送や卸を通じた各医療機関へのデリバリーを円滑に行える体制作りが必要です。
さらに、この中には安全性の調査だけでなく、有効性や品質の調査も網羅した包括的な体制を整備しなければならないという課題も含まれています。このような課題は、1つ目や2つ目の理由にも含まれています。
資金使途① OBP-301の販売開始後に必要な調査など

資金使途の1つ目、市販後臨床試験及び調査などについてです。市販後臨床試験は、当社がすでに実施した「101JP試験」という試験に基づいています。この試験は、多施設で実施された非常にコントロールが行き届いた試験であり、有効性の判定は各施設の担当者ではなく、中央判定として内視鏡の専門家が行います。また、放射線が適切に当てられていたかどうかをモニターする専門機関が設置されるなど、品質管理も徹底されています。
先ほどの放射線単独で局所完全奏効率20パーセント程度という報告を基に、これをリアルワールドデータとして考え、市販後臨床試験を統計的に詳細に分析すると、試験規模はおそらく25例から28例程度になると推測しています。さらに、この試験が本当に検証試験として必要かどうかについては、今後PMDAと話し合っていきたいと考えています。
市販後全例調査については、「テロメライシン」が投与された症例全例において、主に副作用と実際の有効性を調査します。典型的な副作用をチェックするためには、100例以内で完了するのではないかと考えています。
これらに関しては、すでにPMDAと話し合いを行っており、最終的には厚生労働省からの指摘によって実施の是非が判断されます。
資金使途② OBP-301の適応拡大

資金使途の2つ目、適応拡大についてです。現段階では2つの領域で検討しています。
現在、食道がんを適応症としていますが、今後もし放射線の併用が求められる場合に適応範囲が限定される可能性があります。当社としては食道がん全体に使えるよう、PMDAと話し合いを進めている段階です。
また、保険償還を取得するために、スライド下段に記載のとおり放射線化学療法にも使用できるようにするための臨床試験を検討しています。特に、食道がんにおける放射線領域では、放射線単独療法との併用で適応となる患者は5パーセントから10パーセント程度です。
これに対して、当社では「食道がんと言えば『テロメライシン』」というブランディングを考えています。先ほどの「食道癌局所療法研究会」の立ち上げを通じて、どのように活用すれば「テロメライシン」というブランドが食道がん領域で効果的に浸透するのかを検討しています。この点についても「食道癌局所療法研究会」という枠組みを利用し、さらなる進展を図っていきたいと考えています。
この研究会では、日本食道学会の理事長である浜松医科大学上部消化管外科の竹内裕也教授が代表を務め、内科・外科の先生方10名ほどにご参加いただき、「テロメライシン」に関してさまざまなご意見をいただいています。このような活動を通じて、2030年までに放射線単独療法との併用だけでなく、化学放射線療法との併用治療にも対応できるよう努力していきます。
このように、食道がんという1つのカテゴリの中で「テロメライシン」をブランドとして浸透させるとともに、適応も拡大していく戦略を考えています。
肛門・下部直腸がんについては、現在、パイロット・スタディを計画中ですが、放射線を併用する患者が約2,000名おり、むしろ食道がんよりも大きな市場になる可能性を秘めています。ただし、適応を取得しなければならないため、年内に30例のパイロット・スタディを開始し、来年以降には本試験を50例ほど実施する予定です。
こちらもおそらくオーファン領域になると考えていますが、2030年までに承認取得を目指した適応拡大を進めていきたいと考えています。
特に、肛門・下部直腸がんは放置すると手術が必要になり、人工肛門を造設しなければならないケースがあるため、治療方法の開発が求められています。人工肛門の造設は患者にとって多くの負担を伴います。おなかの下部に穴を開けるため、周囲の処理やかゆみ、ヒリヒリ感といった症状が現れるほか、臭いも気になります。
これらを避け、「テロメライシン」と放射線を用いることで肛門を残したまま便をきちんと出せるようになることは、臨床的な意義が非常に大きいと考えています。そのため、効能の追加をできるだけ早く実現したいと思っています。
資金使途③ OBP-301の販売開始後に必要な製造・販売・流通

資金使途の3つ目、安定供給については潤滑な製造・販売・流通を実現します。「テロメライシン」はベルギーにあるヘノジェン社から神戸の三井倉庫ホールディングス社まで運ばれますが、この間の温度管理が非常に重要です。多くの会社を経由してベルギーから神戸まで運ばれるプロセスの中で、ヘノジェン社から空港までは陸路で運ばれ、空輸は航空会社が担います。
日本国内に入ってからは、成田空港を経由して神戸まで陸路で輸送されます。温度管理は非常に困難ですが、三井倉庫ホールディングス社を中心に、適切な温度管理が可能なシステムを構築している段階です。
さらに、最終工程として製品が箱詰めされます。当社は再生医療等製品製造販売業者の免許を取得しており、この免許の下で最終的な製品の箱詰め作業を行っています。1バイアルずつ製品が箱詰めされ、それが卸業者を通じて全国の医療機関に滞りなく届けられるようにする必要があります。販売開始から1年間は試行錯誤しながら進めていきます。
さらに、商品が途切れることや在庫がなくなることは、がん治療を受けている患者にとって重大な問題です。そのため、販売開始後3年間で10ロットほどの原薬や製剤の製造を見込んでおり、それに伴う費用も発生します。
当然、商品が販売される際には、日本に輸送された「テロメライシン」を富士フイルム富山化学が買い取るかたちになりますが、それが円滑に進むようになるまでには、製造に対して初期投資が必要になることをご理解いただければと思います。
このような点を踏まえ、まずは年内の承認申請、来年半ばの承認を目指し、そして来年の第3四半期での発売に向けて、まさにラストスパートで取り組んでいきたいと考えています。この部分に関する資金調達について、何卒ご理解を賜りますようお願いします。
トランスポゾン社の今後の展開

もう1つのパイプラインである「OBP-601」については、これまでにも何度もみなさまにお話ししています。PSP(進行性核上性麻痺)に関しては、すでにPhase3の準備が十分に整っています。あとはトランスポゾン社が資金調達を実施し、pivotal studyに年内に移行するのを待つ状況です。
ALS(筋萎縮性側索硬化症)については、すでに発表していますが、ヒーリーALSプラットフォームを活用して治療薬の治験を行い、どの薬が効果を持つかを確認します。このプラットフォームには「OBP-601」も含まれており、開始時期については現在調整中と聞いています。
上半期に進捗したのは、アルツハイマー病です。有効性の見込みについては、これまでに十分なエビデンスが得られています。PSPやALSの臨床試験で得られたように、Tauタンパク質の沈着に対して効果があり、TDP-43というアルツハイマー病に特有のバイオマーカーも抑制していることが確認されているため、アルツハイマー病に効果を示す可能性が高いと考えています。
こうした背景のもと、アルツハイマー病創薬財団の資金を活用しており、5ミリオンドルの資金が調達されました。おそらく年内には治験が開始される見込みです。
トランスポゾン社については、資金調達を進めると同時に、パートナリングや事業提携も模索しています。こうした取り組みが順調に進めば、おそらく年内には調整が完了し、さまざまなプロジェクトが一斉に動きだすと想定しています。
1. 継続的な黒字化を目指して

今後「テロメライシン」が発売されることで、継続的な黒字化を目指していく必要があります。これに伴い、その基盤となる市場をどのように捉えるかについても、ここで少しお話ししたいと思います。
すでにお伝えしているように、黒字化を実現するためには「テロメライシン」の売上拡大が不可欠です。特に、食道がん分野でのブランディングに注力する必要があると考えています。「ゴホン!といえば龍角散」という表現もありますが、食道がんといえばまず「テロメライシン」が臨床現場で広く使われるような状況を目指し、この分野でのブランディングを推進していきたいと考えています。
この基本にあるのは、「切らずに食道がんを治療できる」という状況を医療現場に広く認識していただくことが重要だという考えです。
また、これまであまり触れていませんでしたが、高薬価取得戦略というものがあります。現在、多くのコンサルタントの方々から意見を聞きながら進めていますが、現状を見る限り、画期性加算、有用性加算、オーファン指定における加算はすべて適合しているのではないかと考えています。ただし、この加算に関しては、さまざまな情報を厚生労働省に開示する必要があります。
特に製造においては、ベルギーの会社からの細かい情報をどれだけ開示できるかが、高薬価取得戦略において非常に重要な課題となっています。当社もデータの開示について、最大限の努力を行う考えです。高薬価を取得できれば、当然ながら売上も上がり、黒字化に向けて現実味を帯びてきます。
それに加え、肛門・下部直腸がんに対しても「テロメライシン」を幅広く使用できるように取り組んでいきます。最初は放射線との併用治療が主になると予想されますが、それをいかに拡大していくかについて、有名な先生方と話し合いを重ねながら、売上増加につながる適用拡大を進めていきたいと考えています。
2. OBP-301の想定市場規模
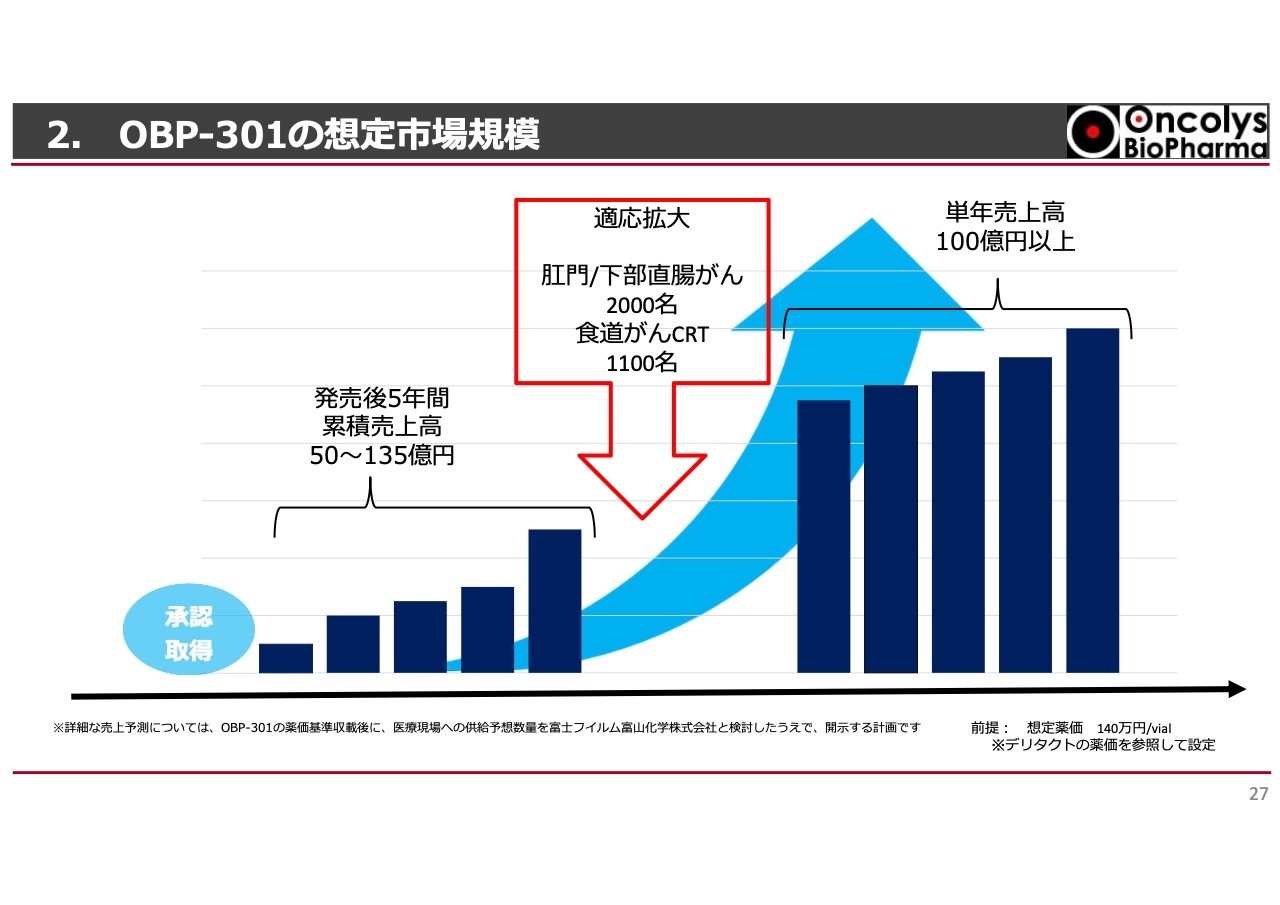
現在の想定売上については、薬価がまだ決まらない段階で具体的に「いくら売れます」と確約することは難しい状況です。ただし、先行している脳腫瘍治療薬「デリタクト」が1バイアル140万円程度の薬価を取得している実績があります。
当社としても、同様の価格が取れるかどうかは予測が立っていませんが、仮にそのような価格が取得できた場合、累計売上が最低でも50億円、可能であれば130億円以上を目指しています。その後、適応拡大により食道がんをはじめ、肛門・下部直腸がんにも適応されるようになれば、単年度売上が100億円以上に達することも見込んでいます。
また、2035年までにはこのような状況が達成されることで、当社としては安定的な黒字基盤の構築を実現できると考えています。
そのため、こうした状況を見据え、次世代薬「OBP-702」のローンチ計画も進めています。製造に関しては、現在ベルギーの1チャンネルのみで行っていますが、将来的にはオンコリス独自で国内でも製造し、製造原価の圧縮を目指す取り組みを進めていきたいと考えています。
「2025年にご期待頂きたい事項」の見込み

こちらのスライドは、株主総会などでいつもお話ししている内容です。右側にチェックマークがあるとおり、8項目のうちすでに4項目を達成しました。先駆け総合評価相談の開始、再生医療等製品製造販売業の許可取得、新製剤が凝集せずに12ヶ月間の安定性試験をクリアしたこと、内視鏡投与などに関する知的財産権の獲得の4つです。
特に、知的財産権の獲得は非常に重要なものでした。最近、日本では他のベンチャー企業が腫瘍溶解アデノウイルスに関するライセンスを成功させたことが報じられていましたが、そのような企業も食道がんの領域には進出できない状況です。なぜなら、当社が「テロメライシン」を含めた腫瘍溶解アデノウイルスを内視鏡で投与する特許を有しているためです。これは非常に大きなことだと考えています。
他にも、国内承認申請及び国内オーファン申請については、年内達成が可能な見通しとなっており、なんとか達成したいと考えています。
「OBP-601」については、必ずしも我々の努力だけでは達成できるものではありません。しかし、いずれかの領域でpivotal studyが開始され、さらにアルツハイマー病の新たな治験が始まれば、我々の計画の達成率も100パーセントになると考えています。
下半期についても、特に「テロメライシン」に関してはラストスパートをかけて全力でチャレンジしていきたいと思っています。
1年後のパイプラインの見通し
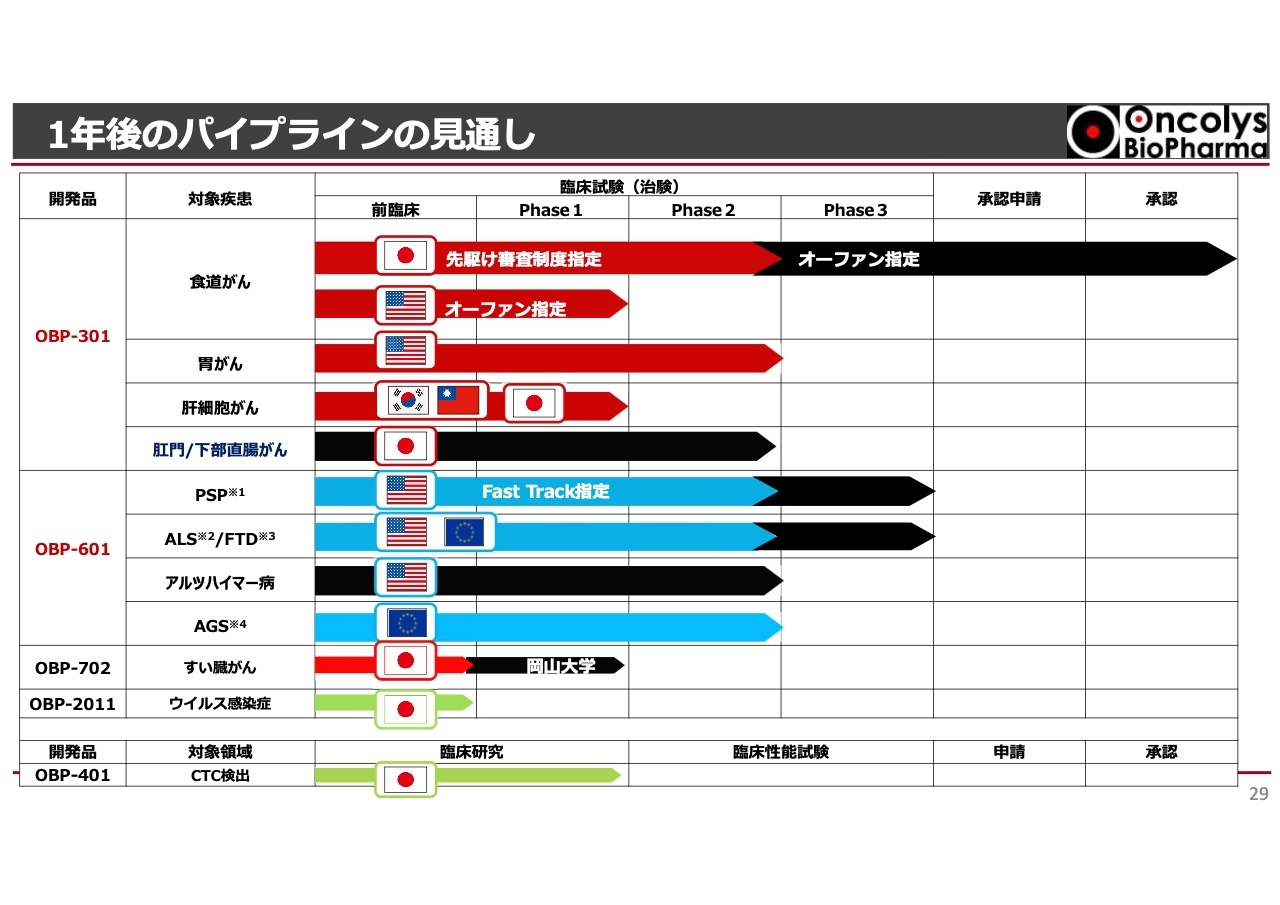
1年後のパイプラインについてですが、スライドでは現状から右に矢印が伸びており、来年の今頃には承認に向けた状況が見えている、あるいは達成できていることが想定されています。
「OBP-301」の一番下に黒い線が示されていますが、肛門・下部直腸がんにおいて臨床試験のPhase2が開始されています。さらに「OBP-601」では、pivotal studyが複数開始される可能性があり、これらの状況が達成されると考えています。
この上半期、当社は「テロメライシン」の承認申請に向けて全力で取り組んできました。今後もラストスパートとして、今お話ししたような目標を実現できるようがんばっていきますので、引き続き、当社にご注目ください。
ご説明は以上です。ご清聴ありがとうございました。
質疑応答:「OBP-301」の承認申請について
司会者:「『OBP-301』に関して、先駆け総合評価相談が5つの区分すべてで進行しています
新着ログ
「医薬品」のログ