クリングルファーマ、脊髄損傷急性期の承認申請に向けPMDAとの協議を継続へ
アジェンダ

安達喜一氏:みなさま、こんにちは。クリングルファーマ株式会社代表取締役社長、安達喜一です。よろしくお願いします。
こちらが本日のアジェンダです。3部構成になっています。まずは会社概要です。当社の特徴、ビジネスモデル、成長戦略についてお話しします。
続いて、開発パイプラインの進捗状況として、第1四半期のトピックス、第1パイプラインの脊髄損傷急性期、第2パイプラインの声帯瘢痕、第3パイプラインの筋萎縮性側索硬化症(ALS)についてご説明します。
最後に、2025年9月期第1四半期の決算概況についてご説明します。
会社概要

当社は、「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに対して画期的な治療手段を提供し、社会に貢献すること」を企業理念とする、大学発創薬バイオベンチャーです。
当社は現在、再生創薬シーズHGFの医薬品開発に注力しており、最終的にスライドの写真にあるような、ヒト用の医療用医薬品を社会実装するべく、事業を進めています。
私たちが開発しているHGFですが、国際一般名称がすでに決定しています。「Oremepermin Alfa(オレメペルミン アルファ)」です。
HGF(肝細胞増殖因子) 〜難治性疾患の再生治療薬〜
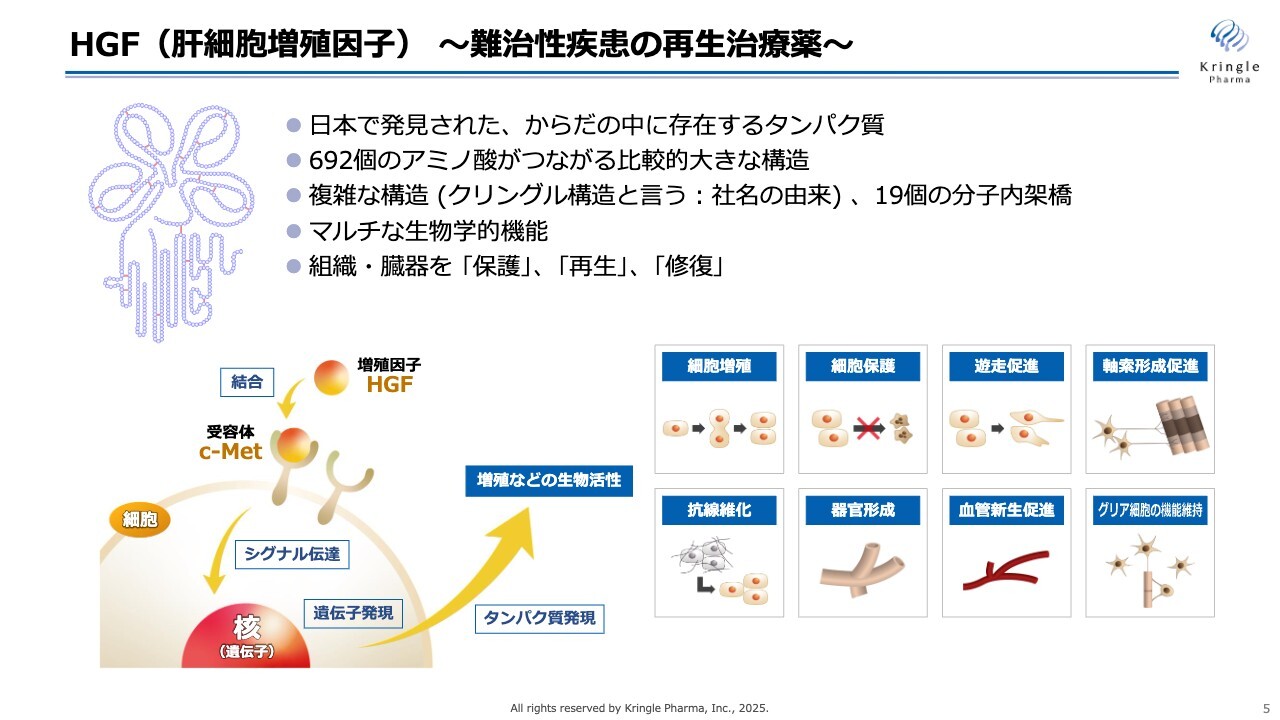
HGFは、日本語では「肝細胞増殖因子」という名前がついています。肝細胞の肝は肝臓の肝で、再生能力の高い肝臓の細胞を増殖させるタンパク質として、日本で発見されました。つまり、誰もが体の中に持っているタンパク質ということになります。
スライド左上のような非常に複雑な構造を取っています。692個のアミノ酸がつながっており、1つの分子内にある19個の架橋によって複雑な立体構造を保っています。
上のほうにクローバーのような形がありますが、これは「クリングル構造」というタンパク質のモチーフの名前で、これが当社の社名の由来にもなっています。
このHGFについてはこれまでにたくさんの基礎研究がなされています。肝臓だけではなく、さまざまな組織・臓器の「再生」「修復」「保護」を担う、生体内のタンパク質であるということがわかっています。
スライドにあるように、細胞を増殖させるだけではなくて、細胞死を抑えて細胞を保護する働き、あるいは線維化を抑える働き、血管新生を促進する働き、中枢系にも強く作用して軸索の形成を促進し、グリア細胞の機能維持にも関わっているということがわかっています。
すなわち、1つのタンパク質でマルチな生物学的機能を持つということが、HGFの大きな特徴です。
HGF再生治療薬のプラットフォーマー:HGFタンパク質の量産体制
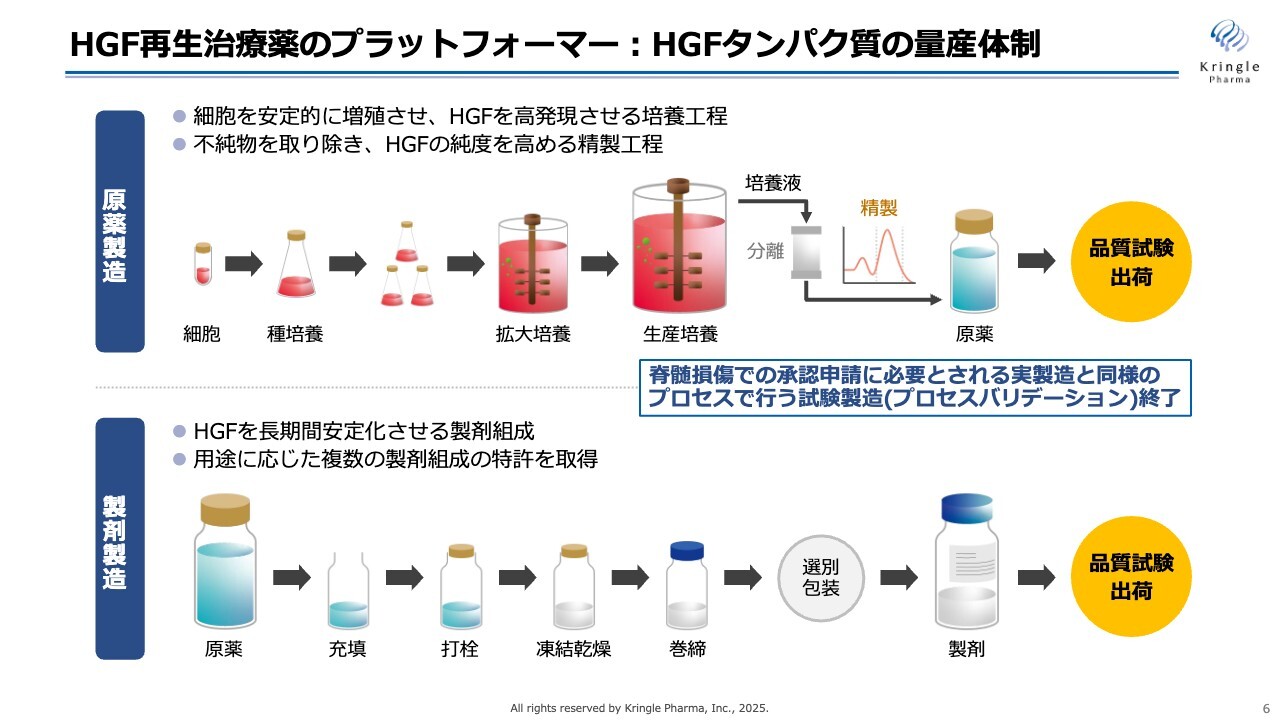
私たちクリングルファーマの強みは、このHGFという非常に複雑な構造を持つタンパク質を、人に投与できる医薬品のグレードで、すでに大量製造する生産体制を確立しているということです。
製造については大きく2つのプロセスがあります。原薬製造と製剤製造です。このHGFは化学合成で作ることはできないので、遺伝子操作により細胞にヒトのHGF遺伝子を組み込み、その細胞を大量に培養して、培養液の中に出てくるヒトのHGFを複数の工程で精製し、原薬を得ることになります。
得られた原薬をガラスバイアルに充填して凍結乾燥することで、最終製品、最終製剤となります。
スライドでは簡単に図示していますが、実際の製造工程は非常に複雑で、多岐にわたります。それらの製造工程はすべて、私たちが持っているノウハウということになります。
現在、このHGFというタンパク質を医薬品のグレードで製造し、かつヒトでの臨床開発を積極的に進めている会社は、世界中でもクリングルファーマだけです。
私たちは第1パイプラインの脊髄損傷の承認申請の準備を進めていますが、承認申請のためには原薬製造、製剤製造それぞれにおいて、実製造と同様のプロセスで、安定的に高い品質のタンパク質を製造できるということを証明する必要があります。いわゆるプロセスバリデーションといわれていますが、これらについてもすでに終了し、承認申請に向けて準備を進めているところです。
HGF再生治療薬のプラットフォーマー:希少疾病を対象とする戦略
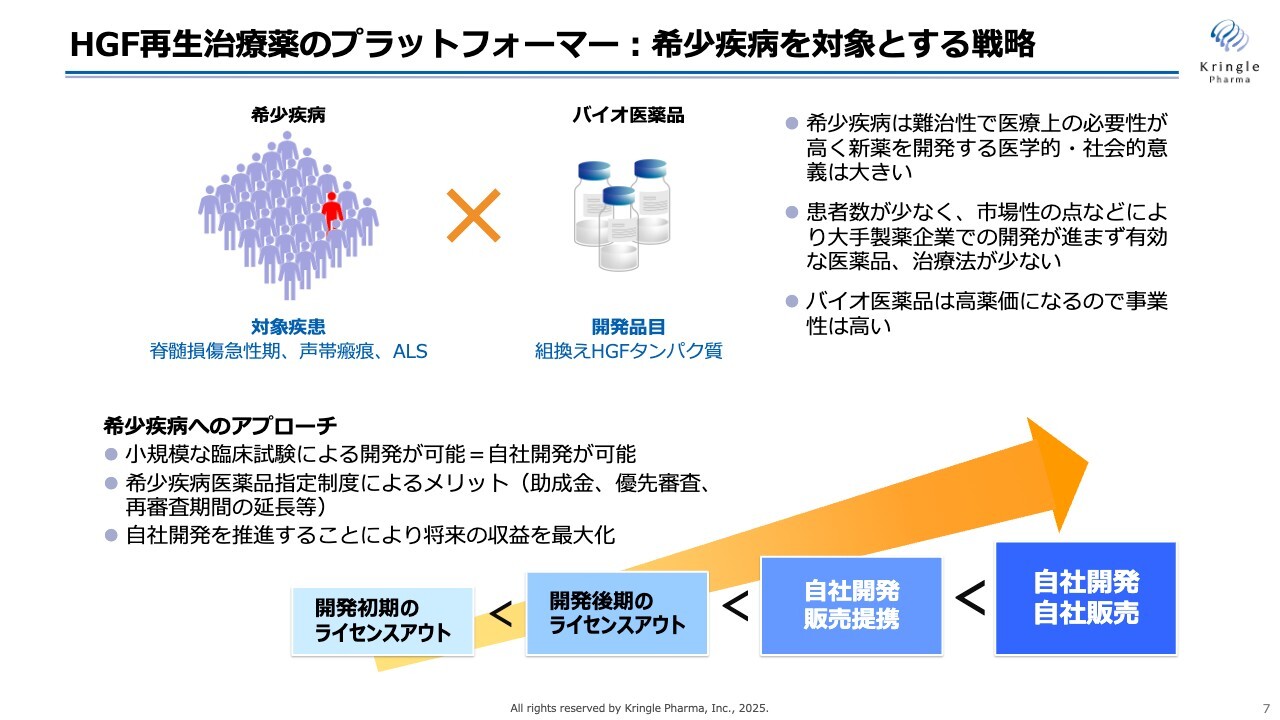
当社のビジネスモデルをご説明します。私たちは「希少疾患を対象に自社開発を推進する」という方針で開発を進めています。希少疾患というのは文字どおり、患者数の少ない疾患のことですが、当社が対象としている脊髄損傷急性期、声帯瘢痕、ALSは、希少疾患です。
このような希少疾患の場合、患者数が少ないため、市場性の点などから、これまで大手製薬企業での開発があまり進められてこなかったという経緯があります。これに対して、私たちは組換えHGFタンパク質をバイオ医薬品として開発し、バイオ医薬品の高い薬価を期待して事業性を確保するという戦略を取っています。
希少疾患に対しては各国で指定制度があります。日本でも希少疾病用医薬品指定制度があり、当社の第1パイプラインである脊髄損傷急性期については、すでに希少疾病用医薬品指定を受けています。
この指定を受けることにより、助成金を得る、あるいはPMDA審査が優先審査になる、再審査期間が延長される等のメリットがあります。このようなメリットを享受することで、できるだけ効率的に開発を進めていきます。
通常、多くのバイオベンチャーは開発の途中で製薬企業にライセンスアウトするというビジネスモデルを取ることが多いのですが、私たちはあえてライセンスアウトを第一に考えずに、自社製品を持つ、すなわち自社で開発し、自社で薬事承認を取るということに重点を置いています。
なぜかと言うと、ライセンスアウトするということは、その後の開発を製薬企業が担うため、財務的な負担が軽減されるという一番大きなメリットはありますが、将来得られる収益の大半を製薬企業に先にお渡ししてしまうということに他なりません。
つまり、将来の収益を最大化するということを考えると、最後まで自社で開発するほうが取り分が多くなりますし、さらに言えば、自社で販売するところまでできれば収益を最大化できます。
今、私たちは販売体制を社内に持っていませんので、国内での脊髄損傷急性期・声帯瘢痕については、自社で開発し、薬事承認を取るところまで行い、自社の製品を持って、その販売については日本の製薬企業と提携をするという戦略を取っています。
開発パイプラインの概要
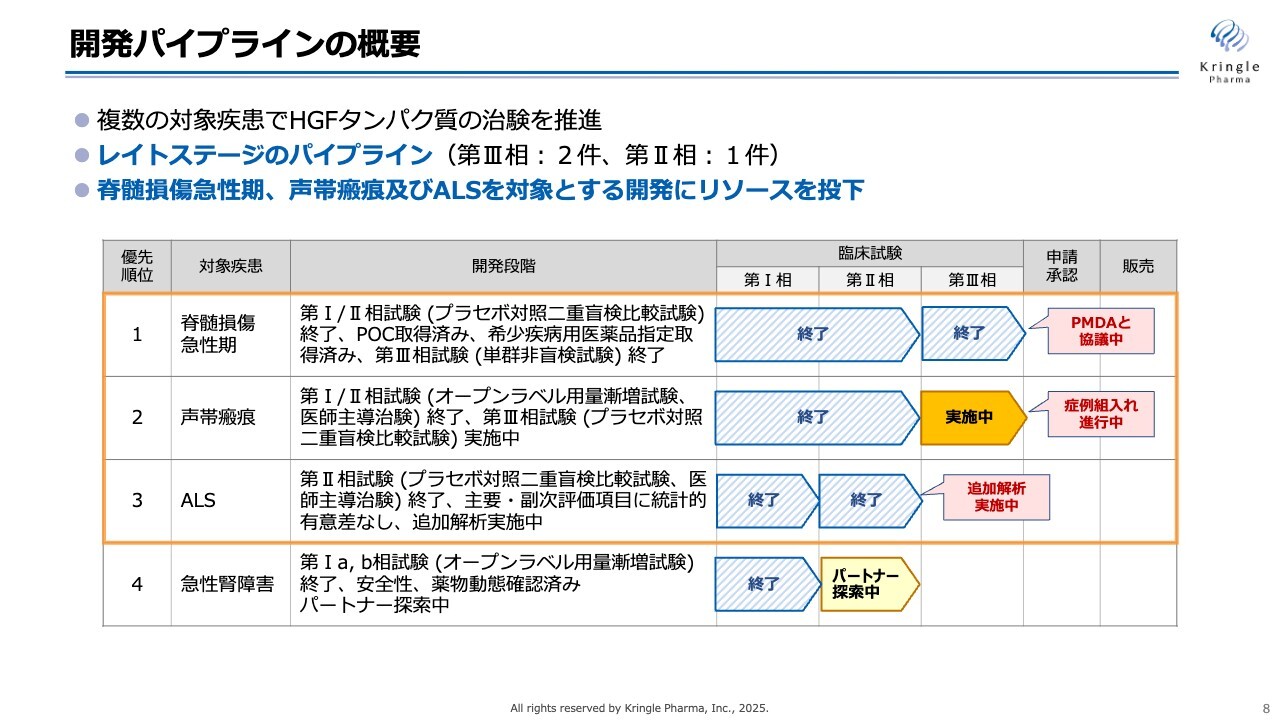
私たちが現在開発している4つの疾患をまとめたものです。臨床段階にある4つの疾患です。第1パイプラインの脊髄損傷急性期は、国内で第Ⅲ相試験が終了しており、現在、承認申請に向けてPMDAと協議を進めています。
第2パイプラインの声帯瘢痕については、国内で第Ⅲ相試験を実施しており、症例組入れを進行中です。第3パイプラインのALSは、国内で第Ⅱ相試験が終了し、現在、バイオマーカーの追加解析を行っているところです。第4パイプラインの急性腎障害は、第Ⅰ相試験が終了しており、第Ⅱ相試験を行うためのパートナーを探索しているところです。
クリングルファーマの成長戦略

当社の短期的な成長戦略を示しています。赤い矢印に注目していただきたいのですが、まず第1パイプライン、脊髄損傷急性期の国内での開発については、2025年に承認申請を行い、2026年9月期に薬事承認を得て、薬を上市するという計画です。
この製品販売により、恒常的な売上が立っていきますので、これをきっかけに早期の黒字化を達成したいと考えています。
第2パイプラインの声帯瘢痕については、第Ⅲ相試験を完了し、薬事承認を取るまで自社で行います。脊髄損傷急性期・声帯瘢痕どちらも国内の開発については、すでに手持ちの資金、あるいはAMEDの「CiCLE」という補助制度により資金を確保しています。
第3パイプラインのALSは現在、追加解析を行っていますが、こちらについては、この追加解析のデータをもって提携パートナーを得る方針です。
また、脊髄損傷急性期は、現在、欧米での開発、具体的にはアメリカでの治験準備にも着手しています。こちらに関して昨年、資金調達を行い、その得られた資金によって、現在、治験の準備を進めています。治験の準備を進めることで欧米での提携パートナーを得て、こちらについては共同開発というかたちで開発を進められればと思っています。
患者数と市場規模
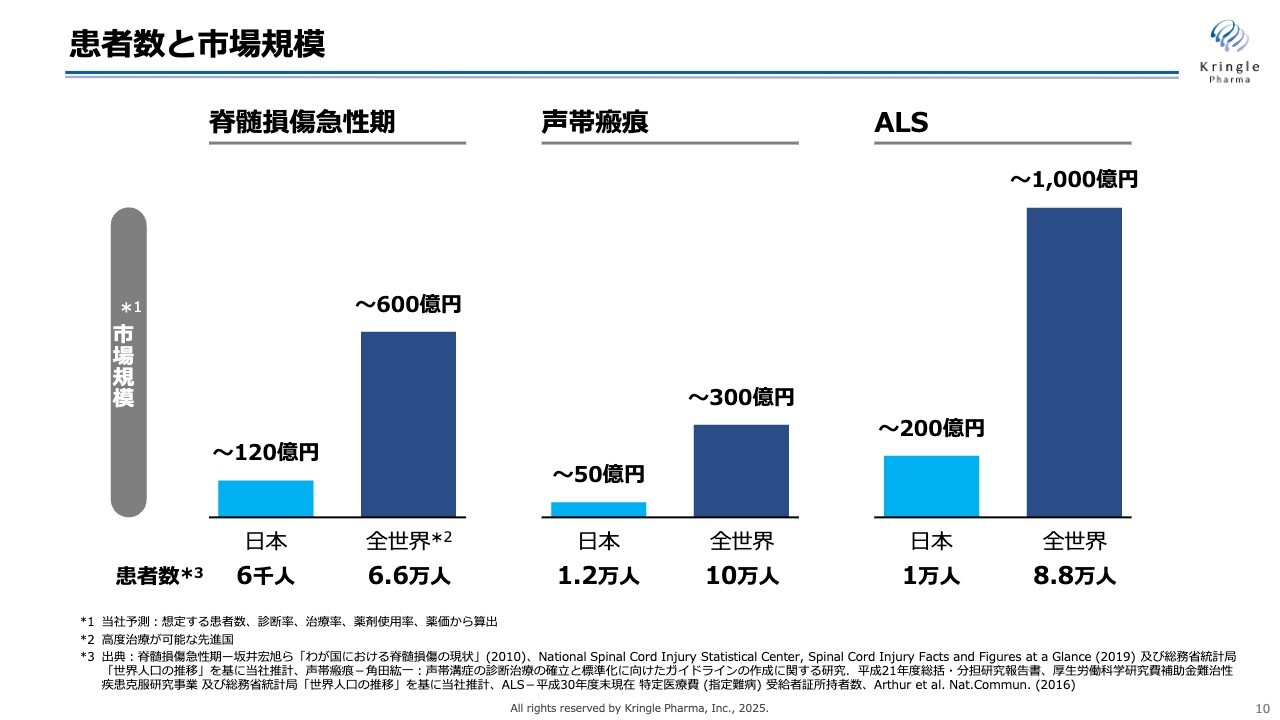
「なぜ海外を目指すのか?」の理由は明確で、「海外のほうが市場が大きいから」です。スライドは、脊髄損傷急性期・声帯瘢痕・ALSについて、国内およびグローバルでの患者数・市場規模を示しています。
希少疾患では、国内だけの市場ではどうしても限られてきます。一方で、グローバルを見ると国内の約10倍の患者さまがおられて、市場規模もそれに相応した大きな市場があります。
当社が中長期で成長していくにあたっては、このグローバルな市場にできるだけ早くリーチするということが非常に重要なポイントになってきます。
適応拡大:新規パイプラインの創製
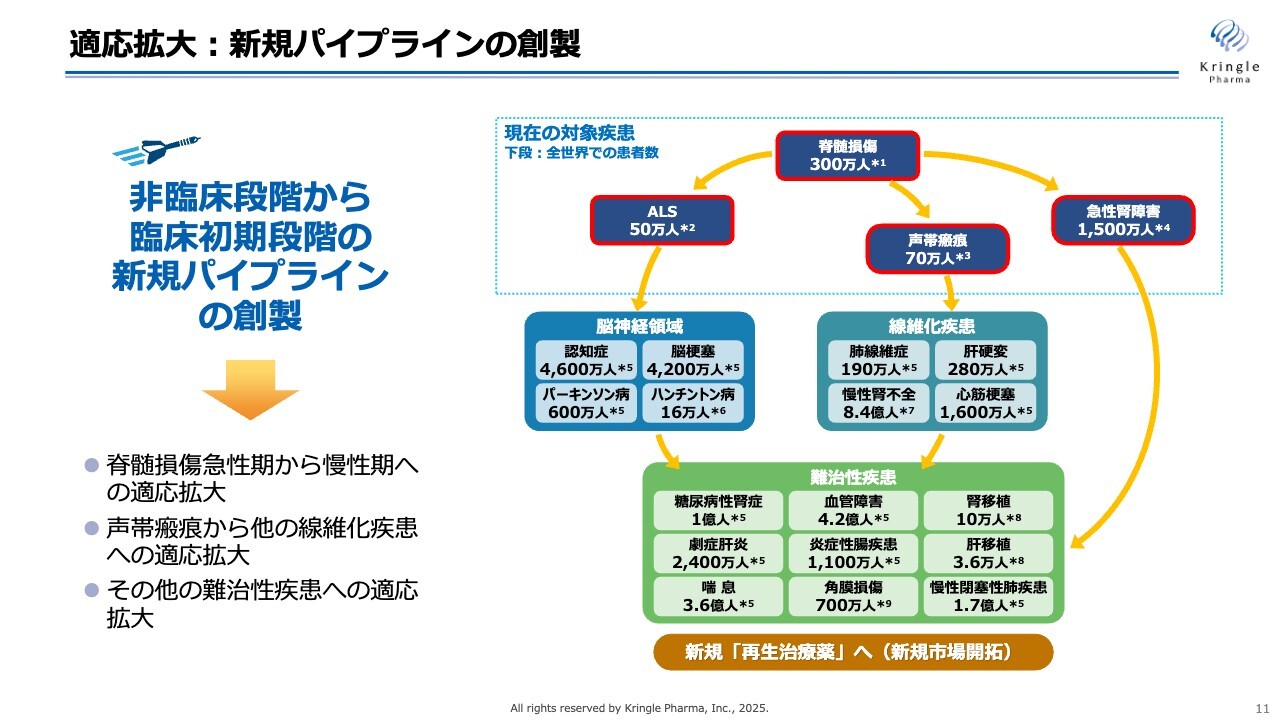
もう1つ、中長期の成長戦略に欠かせないのが適応拡大です。HGFはこれまでたくさんの基礎研究データがあります。スライド右にあるように、多くの難病・難治性疾患の動物モデルでのHGF投与による効果が論文として発表されています。
すなわち、1つの物質でさまざまな難病の薬になるポテンシャルがありますので、HGFの価値を最大化する、適応拡大をできるだけ早く進めていくということが、当社の中長期の成長に欠かせません。
具体的には、現在、脊髄損傷急性期での開発を行っていますが、細胞治療と併用することによって慢性期へ展開することと、声帯瘢痕を入口として、その他の線維化疾患に適応拡大することです。また、この後のスライドで示しますが、大学との共同研究を通じて、新たな難治性疾患をパイプラインとして加えていくことです。
これらのことを同時並行で進めていき、できるだけ早く臨床段階の新規パイプラインを創生したいと考えています。
新規「再生治療薬」による新規市場開拓へ 〜アカデミアとの共同研究〜

このスライドは、現在、私たちが日本のアカデミアの先生方と行っている共同研究を一覧表にしたものです。すでに継続している案件から新規の案件、終了している案件がありますが、慶應義塾大学とはこれまで長きにわたり、共同研究しています。
脊髄損傷に関係するさまざまな研究で特許も出願していますし、現在、急性期のバイオマーカーを新たに探索する共同研究も進めています。
また、金沢大学とは特発性肺線維症への応用研究、岐阜大学とは特発性大腿骨頭壊死症への応用研究を実施しており、どちらも動物モデルを使った薬効試験を進めています。
これらの結果を踏まえ、今後、臨床試験のデザインを立案していきたいと考えています。
収益イメージ図
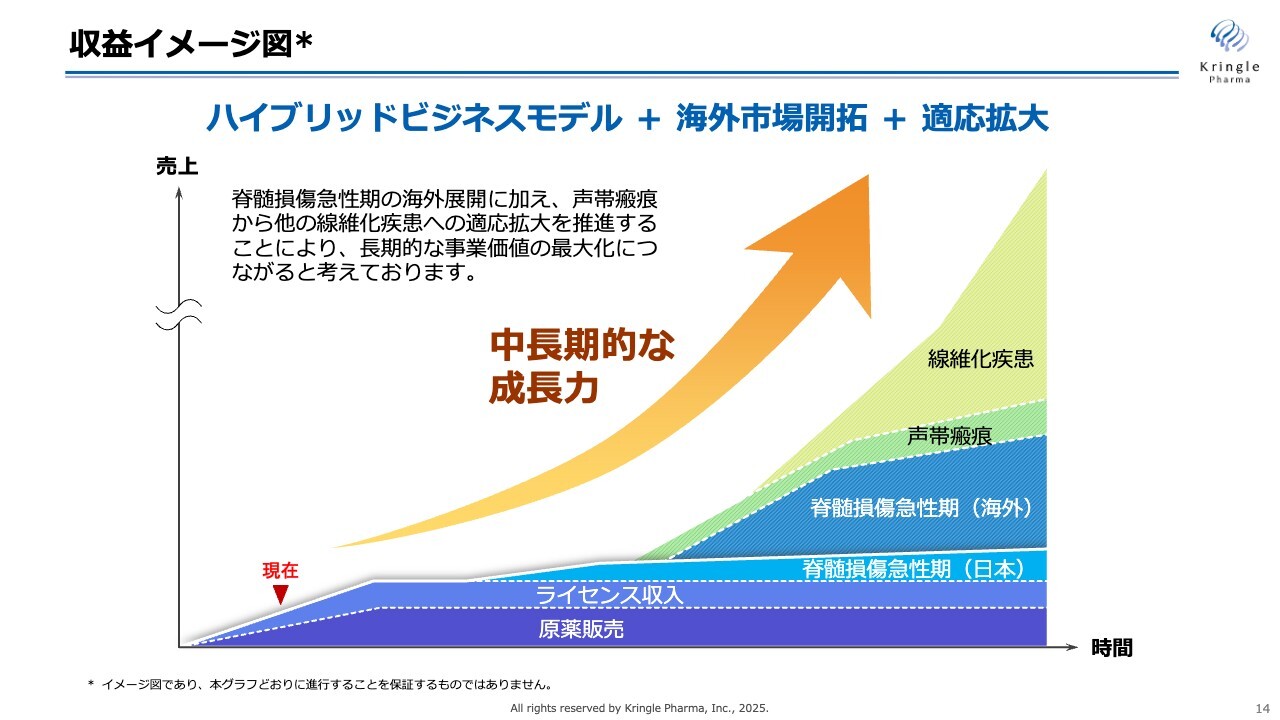
収益イメージ図です。私たちは現在、HGFを単剤として開発していますが、これを海外にも展開します。また、線維化疾患や、その他の疾患への適応拡大を行っていくことで、中長期的に成長していくことを考えています。
2025年9月期第1四半期の主なニュースリリース(後発事象を含む)

続いて、開発パイプラインの進捗状況についてご説明します。
スライドは、第1四半期の主なニュースリリースをまとめたものです。昨年10月に、第一種医薬品製造販売業許可の申請に向けて、社内に三役体制を構築しました。これにより、同年11月、大阪府に「第一種医薬品製造販売業」の業許可申請を行い、今年1月に大阪府から業許可が得られました。
一方、昨年11月には、慶應義塾大学と新たな共同研究をスタートしています。こちらは脊髄損傷の自然回復を予測する、急性期のバイオマーカーを新たに探索する内容です。
また、今年1月には、第2パイプライン、声帯瘢痕の第Ⅲ相臨床試験において治験実施施設をさらに2施設追加し、症例組入れの加速を図っています。
医薬品製造販売業の法令遵守体制
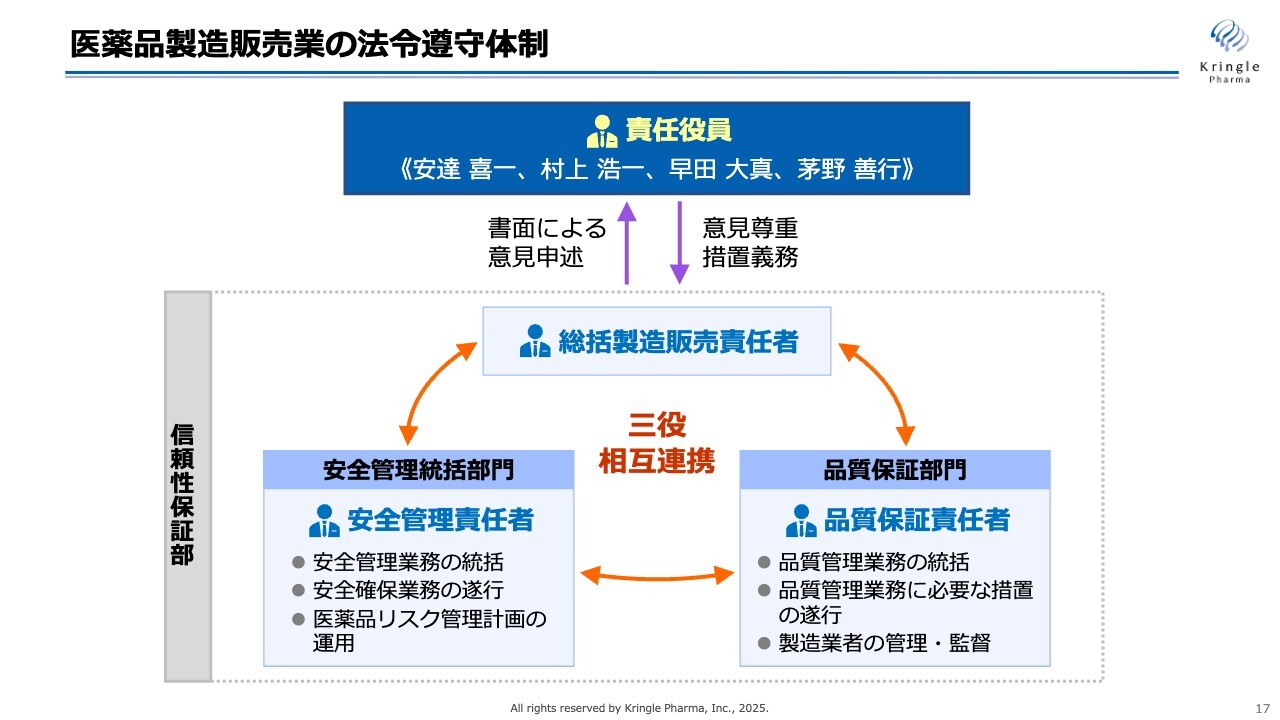
医薬品製造販売業の法令遵守体制を示したものです。先ほどお話しした三役とは、「総括製造販売責任者」「安全管理責任者」「品質保証責任者」の3名です。この三役が相互に連携し、責任役員に書面による意見を述べるということが求められます。
当社の場合、責任役員には私を含めた常勤の取締役4名が当たることになります。責任役員は三役からの意見を尊重し、必要となる措置を必ず取らなくてはなりません。これが法令遵守体制です。
このような体制を整えること、そして関連する手順書をきちんと揃えること、これが業許可を取るために必須となります。これを行って昨年11月に業許可申請を行い、今年1月に業許可を取得できました。
この製造販売業許可の取得は、これから医薬品の承認申請をするためにも必須ですので、先んじて体制を整え、業許可を取ったということです。
開発パイプライン ー脊髄損傷急性期ー

続いて、開発パイプラインについて順番にお話しします。まずは脊髄損傷急性期です。現在、日本では年間約6,000人の方が新たに脊髄損傷になるといわれています。特に日本では高齢化社会が進んでいますので、お年寄りの転倒・転落による脊髄損傷が増えている状況です。
損傷部位が脳に近いほど広範な麻痺が残りますが、薬剤・手術などによる根本的治療法がないのが現状です。患者さまの苦労は非常に大きなものとなりますし、介護するご家族、介護者の負担も非常に大きな疾患です。したがって、アンメットニーズの高い、医療経済効果の高い疾患であるといえます。
脊髄損傷急性期にHGFに期待する治療効果
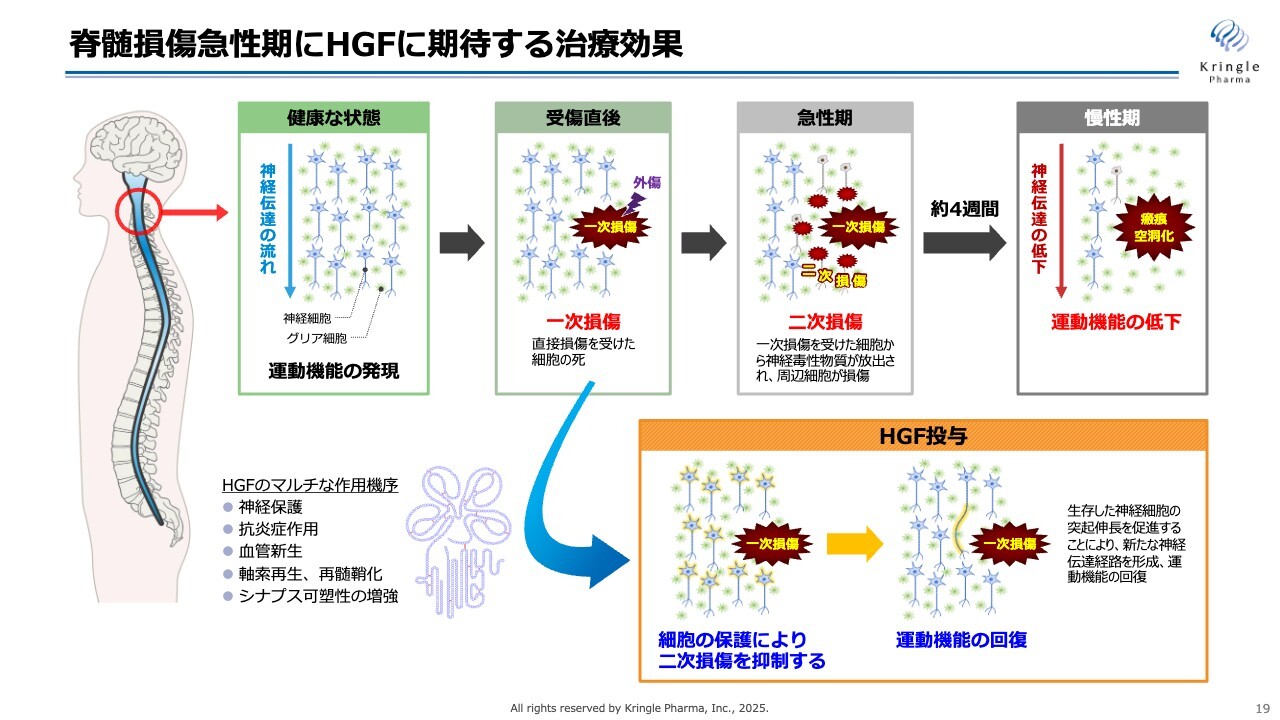
振り返りになりますが、脊髄損傷急性期にHGFに期待する治療効果をまとめたものです。さまざまな原因で脊髄損傷になることを一次損傷と呼びますが、急性期では、一次損傷の周りの細胞が次々と損傷を負って、損傷範囲がどんどん広がっていくということが起こります。いわゆる二次損傷と呼ばれているものです。
時間が経って慢性期になると、損傷範囲が瘢痕化し、空洞化してしまいます。これによって神経伝達が上下に伝わらなくなって、運動機能が低下するというのが脊髄損傷です。
一方、HGFを急性期に投与すると、HGFのマルチな作用機序によって、この二次損傷の拡大を抑制するという効果が期待されます。二次損傷の範囲を抑制することができると、最終的に瘢痕化し空洞化するエリアが狭くなりますので、これによって運動機能の回復が期待できるということです。
脊髄損傷急性期 第I/II相試験の結果
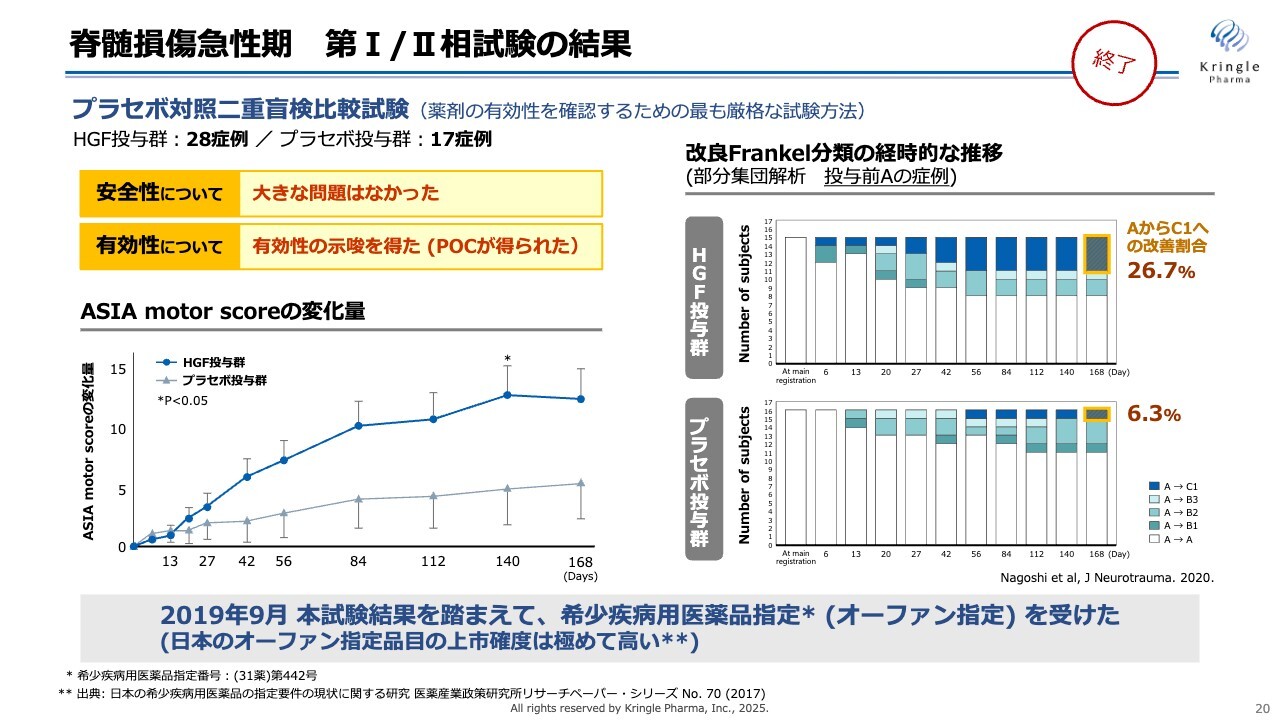
当社は、すでに人での第Ⅰ/Ⅱ相臨床試験を終了しています。こちらはプラセボ対照二重盲検比較試験として、HGF群28例、プラセボ群17例を比較したものです。安全性については大きな問題はなく、有効性を示唆する非常に良好な結果を得ることができました。
左側のグラフは、ASIAのmotor scoreをHGF群とプラセボ群で比較したものです。この試験では、HGFまたはプラセボ(偽薬)を髄腔内に週1回投与し、これを5回繰り返し、その後6ヶ月まで経過観察しています。
このASIA motor scoreを見ると、HGF投与群では6ヶ月にわたり高い数値を獲得していることがわかります。Day140では統計的な有意差も得られています。
スライド右側の棒グラフは重症度の経時的な推移を表しています。この試験では、重症度Aという最も重度である完全麻痺の患者さまが、どれぐらいの割合で重症度AからB、または重症度AからCの不全麻痺に改善したかを、色分けして経時的に示しています。
棒グラフの濃い青い部分について、プラセボ投与群ではAからCへの2段階の改善割合が6.3パーセントでした。一方で、HGF投与群では26.7パーセントと、非常に大きな改善割合を見ています。
これらの結果を踏まえ、2019年9月に厚生労働省より希少疾病用医薬品指定、いわゆるオーファン指定を受けることができました。日本においてオーファン指定を受けることは非常にハードルが高いことです。オーファン指定を受けると、その後上市する確度が高くなることが統計的にも示されています。
脊髄損傷急性期 第III相試験(医薬品開発の最終段階)
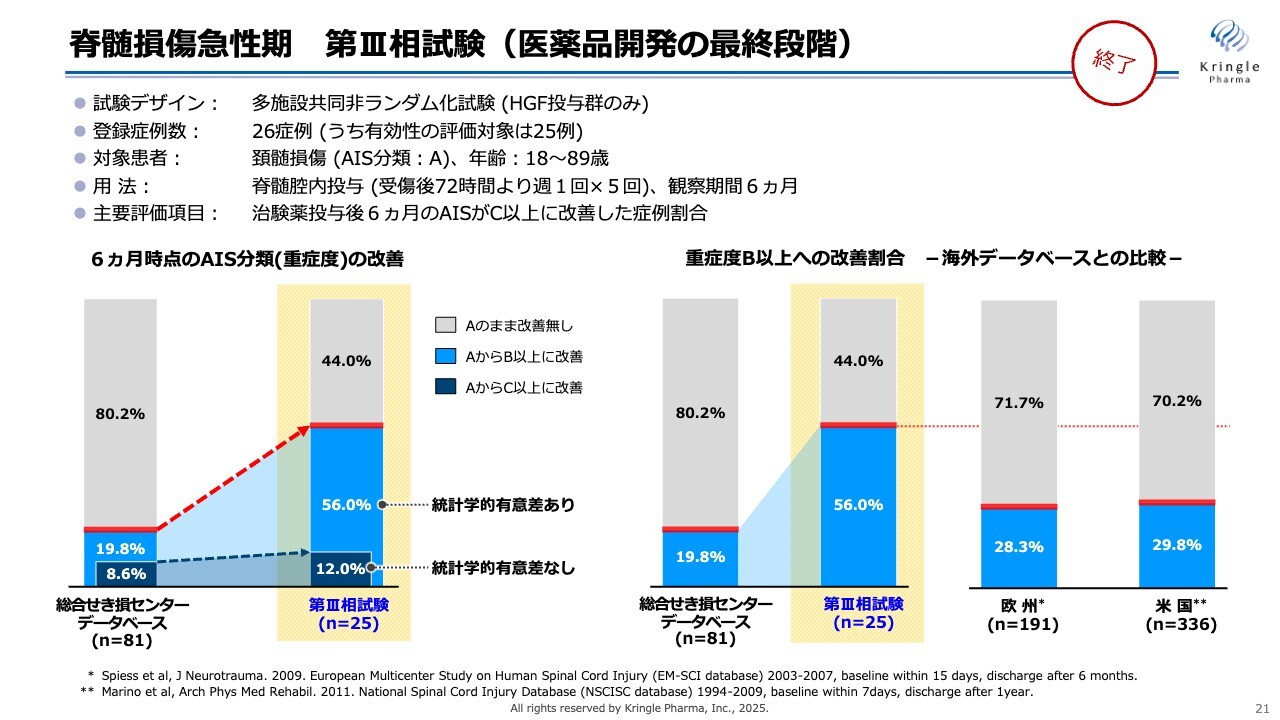
オーファン指定を受けた後に第Ⅲ相試験を実施しています。この試験はHGF投与群のみの非ランダム化試験として行い、頚髄損傷の完全麻痺(重症度A)の患者さまのみを組み入れ、最終的に25例の評価対象を得て終了しています。用量用法は前相と同じで、主要評価項目は治験薬投与後6ヶ月時点での重症度がAからC以上、すなわち2段階以上改善した症例の割合を設定しています。
この試験ではすべての患者さまにHGFを投与しました。脊髄損傷の専門病院である総合せき損センターの過去10年間にわたる患者のヒストリカルデータベースの数字を参照し、その数字と比較して評価するという試験デザインです。
スライド左側のグラフのうち、濃い青い部分が2段階以上改善した症例の割合を示しています。データベースでは8.6パーセントであるのに対し、黄色でハイライトをしている今回の第Ⅲ相試験では12パーセントと数値は上がっていますが、統計学的な有意差はありませんでした。
一方で、薄い青色で示した部分がAからB以上、すなわち1段階以上改善した症例割合で、データベースでは19.8パーセントであるのに対し、今回の試験では56パーセントと非常に大きな改善率を見ています。ここについては統計学的な有意差がありました。
これらはすべて日本のデータになります。論文として発表されている海外のデータベースでは、アメリカや欧州のいずれにおいても、頚髄損傷で重症度Aの方のうち7割が慢性期でも重症度Aのままであり、残りの3割が1段階以上改善すると報告されています。
それと比較しても、今回の第Ⅲ相試験で56パーセント、すなわち半分以上の方が1段階以上改善したという結果は、非常に優れた成果であると考えています。
急性期完全麻痺患者に対するHGFの効果
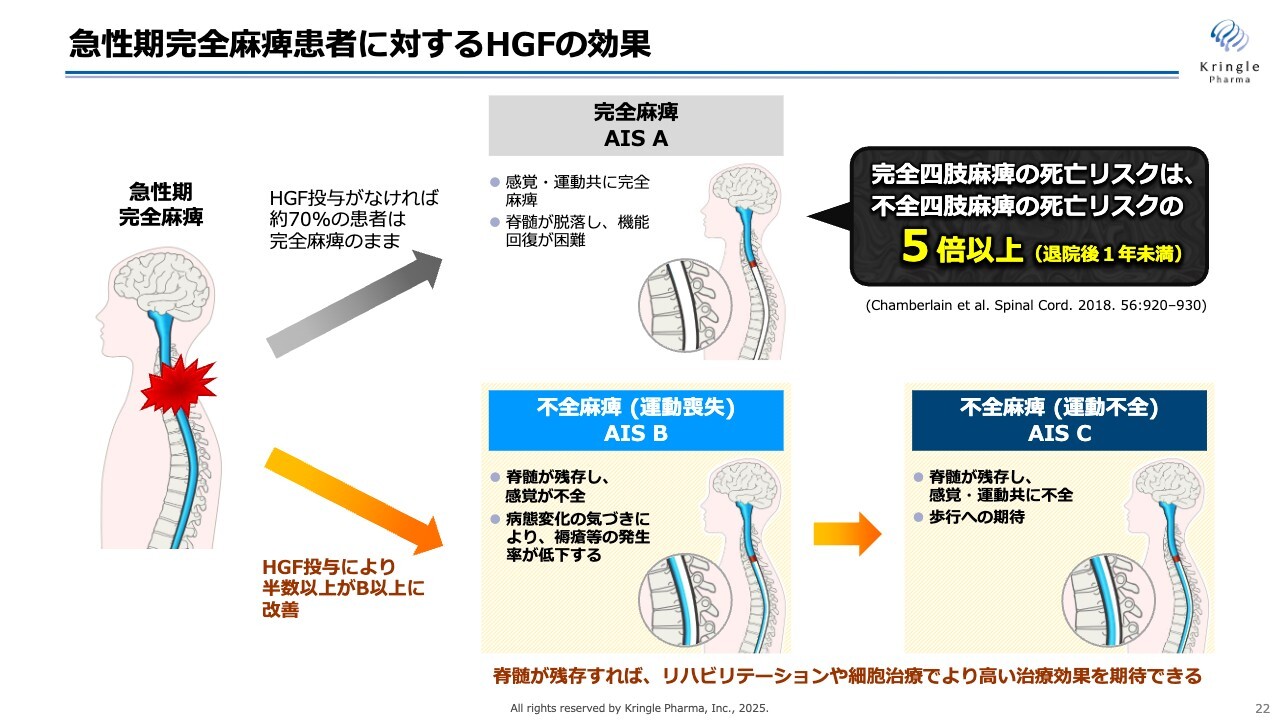
1段階以上改善することがどのような意義を持つのかについて、こちらのスライドでご説明します。先ほどお伝えしたとおり、頚髄損傷で完全麻痺(重症度A)の方は、なにもしなければ7割の方が完全麻痺のまま慢性期を迎えることになります。その場合、イラストに水色で示した脊髄が脱落し、その後の機能回復がほとんど困難になります。
一方で、急性期に完全麻痺の方を不全麻痺(重症度B以上)に改善させることができれば、重症度Bの方は感覚が戻り、重症度Cの方になると運動機能も回復してくるということで、脊髄が残存していると見なすことができます。その後のリハビリや現在開発中の細胞治療を施すことで、さらに高い治療効果が期待できます。
重症度Bの方は重症度Cに、重症度Cの方は重症度Dに改善する可能性が期待されるわけです。つまり、脊髄損傷の急性期においては、完全麻痺の方が完全麻痺のまま慢性期を迎えさせることなく、できるだけ多くの方を不全麻痺、すなわちスライド下部のような重症度B以上にもっていくことが非常に重要です。
今回の第Ⅲ相試験で、急性期にHGFを週1回×5回投与することで、半分以上の方がスライド下部のような不全麻痺に改善するということがわかりました。これは急性期の脊髄損傷治療において非常に大きな意義があります。
完全四肢麻痺の死亡リスクと不全四肢麻痺の死亡リスクを比べた文献によると、完全麻痺のままですと、不全麻痺に比べて5倍以上死亡リスクが大きくなるとのことです。
脊髄損傷急性期 承認申請に向けた準備状況

こちらは、第Ⅲ相試験終了後の承認申請に向けた準備状況のアップデート図です。
第Ⅲ相試験の総括報告書は作成が終了しています。現在、PMDAとの協議が継続中で、事前面談はすでに終了しており申請前相談のステップに入っています。
前回の決算説明時に承認申請のタイミングを2025年3月とお伝えしましたが、現在も申請前相談の協議が継続しているため、3月の承認申請は困難な状況になっています。
したがって、現時点では2025年4月以降と修正しました。具体的に4月以降のいつなのかというご質問については、今後のPMDAとの申請前相談の協議内容によるため、現時点では明確なスケジュールが想定できません。承認申請のタイミングが見えてきましたらご報告します。
承認申請のパッケージの作成は着実に進めています。先ほどご説明したように、製造販売業許可については社内体制の整備が終了し、業許可申請を行い、今年の1月に製造販売業許可を取得することができました。
開発パイプライン ー声帯瘢痕ー

第2パイプラインの声帯瘢痕についてです。声帯瘢痕とは、声を出すための声帯がなんらかの原因で線維化し、声帯がきちんとバイブレーションをしなくなることにより声が出にくくなり、最終的には声が出なくなってしまうという難治性の疾患です。
現在有効な治療法はなく、だいたい日本では約3,000人から1万2,000人の方がこの声帯瘢痕だといわれています。声帯瘢痕というのは命を脅かす疾患ではないのですが、症状が進行すると、誰もが当たり前にできる声を出すということが困難になるため、患者さんのQOLを非常に大きく損なうことになり、アンメットニーズが高い疾患といえます。
声帯瘢痕に対するHGFの作用機序
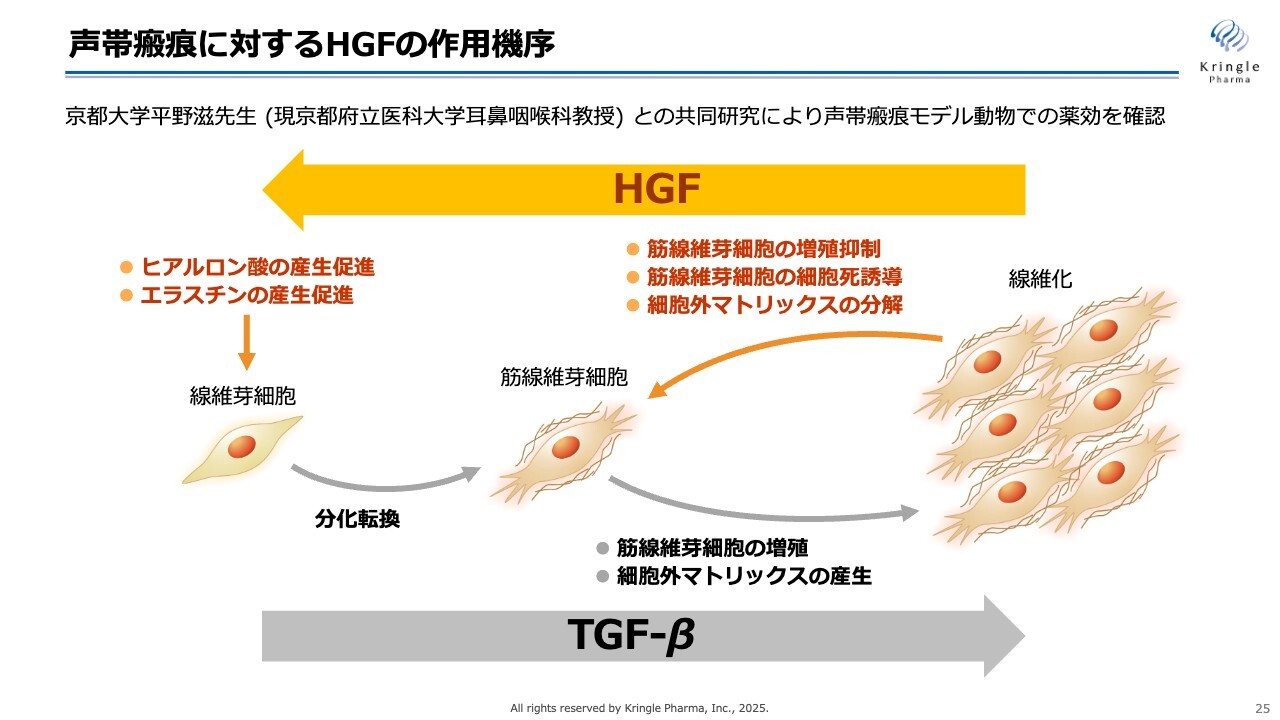
振り返りとなりますが、こちらのスライドにHGFの作用機序をまとめています。
線維化とは、筋線維芽細胞がスライド右の図のように線維化していくことを指します。この過程には、TGF-βという生体内のタンパク質が関与しているということがわかっています。線維化すると、コラーゲンのような硬い物質をたくさん作ることになりますが、HGFはこの線維化を逆方向に進めて線維化を解除する、いわゆる抗線維化の働きをすることが知られています。
具体的には、筋線維芽細胞の増殖を抑制したり、コラーゲンのような細胞外マトリクスを分解する酵素をたくさん作るようになったり、またはヒアルロン酸やエラスチンといったいわゆる柔らかい成分を産生促進することで線維化を元に戻すという働きです。
生体内にはグロースファクターが何種類か存在していますが、このような抗線維化はHGFに特有の働きです。
声帯瘢痕 第I/II相試験の結果
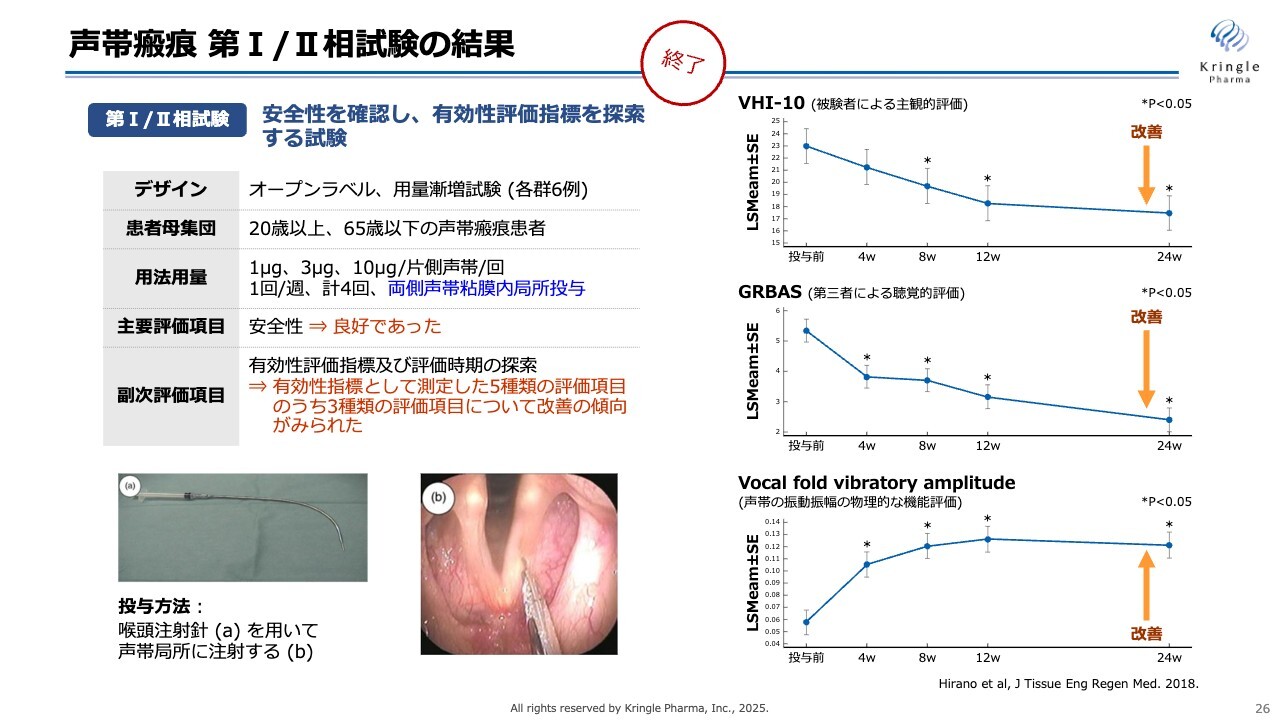
当社はすでに第Ⅰ/Ⅱ相試験を終了しています。この試験では、声帯瘢痕の患者さまにご協力いただき、オープンラベルで実施しました。用量を3段階に分け、声帯の局所に週1回の投与を4回繰り返すという用量用法で行っています。その結果、スライド右側に記載した3つの異なる指標において、それぞれ統計的な有意差をもって改善傾向が確認できました。
声帯瘢痕 第III相試験(医薬品開発の最終段階)
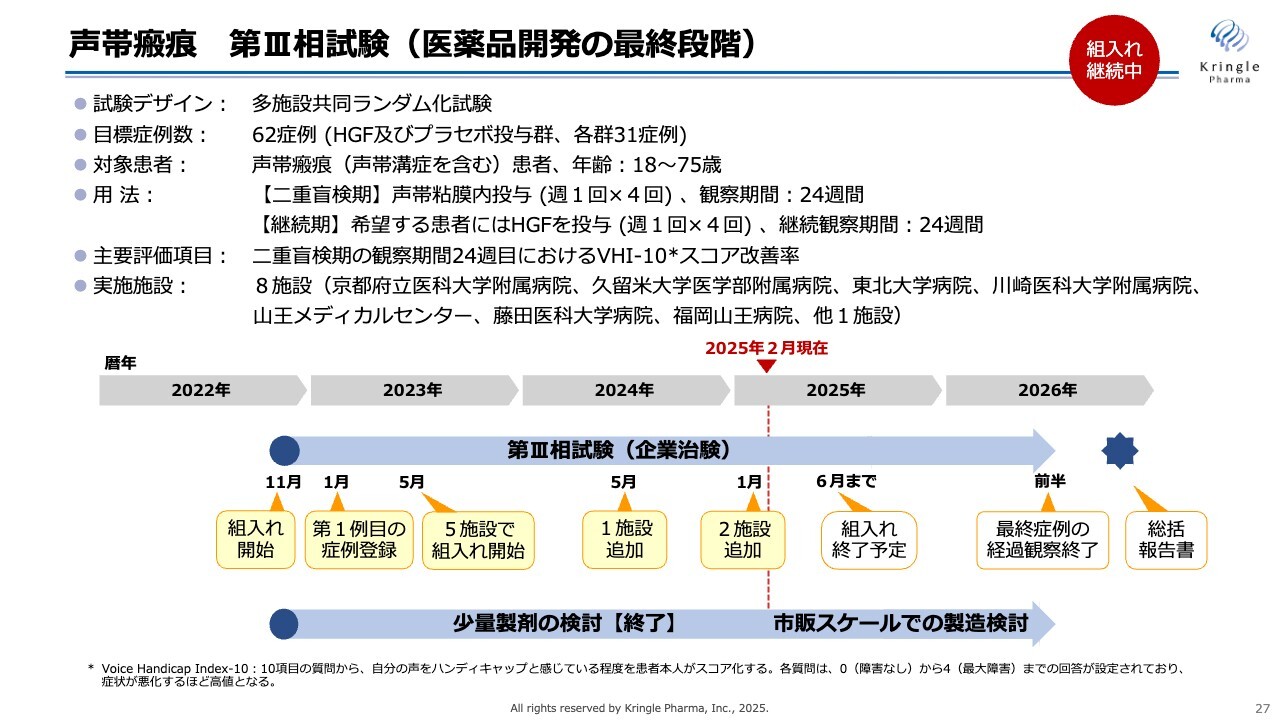
この結果を踏まえ、現在、第Ⅲ相試験を行っています。前相の試験がオープンラベルで行われたため、この試験では多施設共同ランダム化試験として、HGF群とプラセボ群とを比較するデザインで実施しています。まずは二重盲検期として、前相と同じように声帯の局所に週1回×4回の投与を行い、6ヶ月観察をします。
希望する患者さんにはその後、継続期としてさらにHGFを週1回×4回の投与を行い、6ヶ月観察します。二重盲検期と継続期を合わせると、約1年間ご協力いただくことになります。
スライドに記載されているとおり、主要評価項目は、二重盲検期6ヶ月時点でのVHI-10のスコア改善率です。VHI-10では、患者さま本人がご自身の声の状態について評価します。
この試験は2022年にスタートし、2023年にはトータル5施設で患者さんの組入れを行いました。2024年に1施設、今年の1月にさらに2施設を追加しました。これにより、現在はトータル8施設で患者さんの組入れを行っています。
今年の1月に追加した2施設もすでに稼働しているため、患者さんの組入れの加速を期待しています。今のところ、今年の6月までに組入れを終了し、2026年前半に最終症例の経過観察を終了後、総括報告書を取りまとめる予定です。
開発パイプライン ーALSー

第3パイプラインのALSについてです。ALSは、運動神経が原因不明のまま細胞死を起こし、体がどんどん動かなくなっていくという神経難病の象徴的な疾患です。患者さまは最後は呼吸ができなくなって死に至るという、非常に過酷な疾患です。
現在、日本では約1万人の方がALSといわれています。既存薬は何剤かありますが、その効果は限定的であり、引き続き効果のある薬が望まれています。
ALS 第II相試験(医師主導治験)

当社はすでに国内で第Ⅱ相試験を終了しています。この試験は、プラセボ対照二重盲検比較試験として実施し、HGF群とプラセボ群を比較しました。主要評価項目として設定したALSFRS-Rいう患者さまのスコアについては統計的な有意差がありませんでした。
しかし、HGFを投与した患者さまの中には進行が遅くなった方もいました。今回、新たなバイオマーカーを検討する目的で、東北大学と共同研究を実施しています。
ALSにおいては、近年、このバイオマーカーが非常に大きな注目を集めています。特にニューロフィラメントのライトチェーンが、このALSFRS-RのサロゲートマーカーとしてFDAに認められたという前例もあります。今回、このニューロフィラメントも含めて神経変性および神経炎症に関する複数のバイオマーカーを測定し、HGF投与との相関関係を検証しています。
昨年4月にスタートした共同研究は、今年の3月で終了予定です。こちらのデータがまとまってきた段階で、またご報告します。
2025年9月期第1四半期 経営成績の概況

最後に、2025年9月期第1四半期の決算概況です。スライドには損益計算書の概要を前年対比で示しています。まず売上は1,800万円で、こちらは前年同様、クラリス社からの技術アクセスフィーでした。
販売管理費が2億3,000万円、うち研究開発費が1億6,100万円ということで、こちらは前年に比べて増加していますが、これは脊髄損傷の承認申請準備費用、または米国開発に関する準備費用、声帯瘢痕の治験費用の増額によるものです。
営業損失がマイナス2億1,200万円、経常損失および四半期の純損失もマイナス2億1,200万円となっています。
2025年9月期第1四半期 財政状態の概況
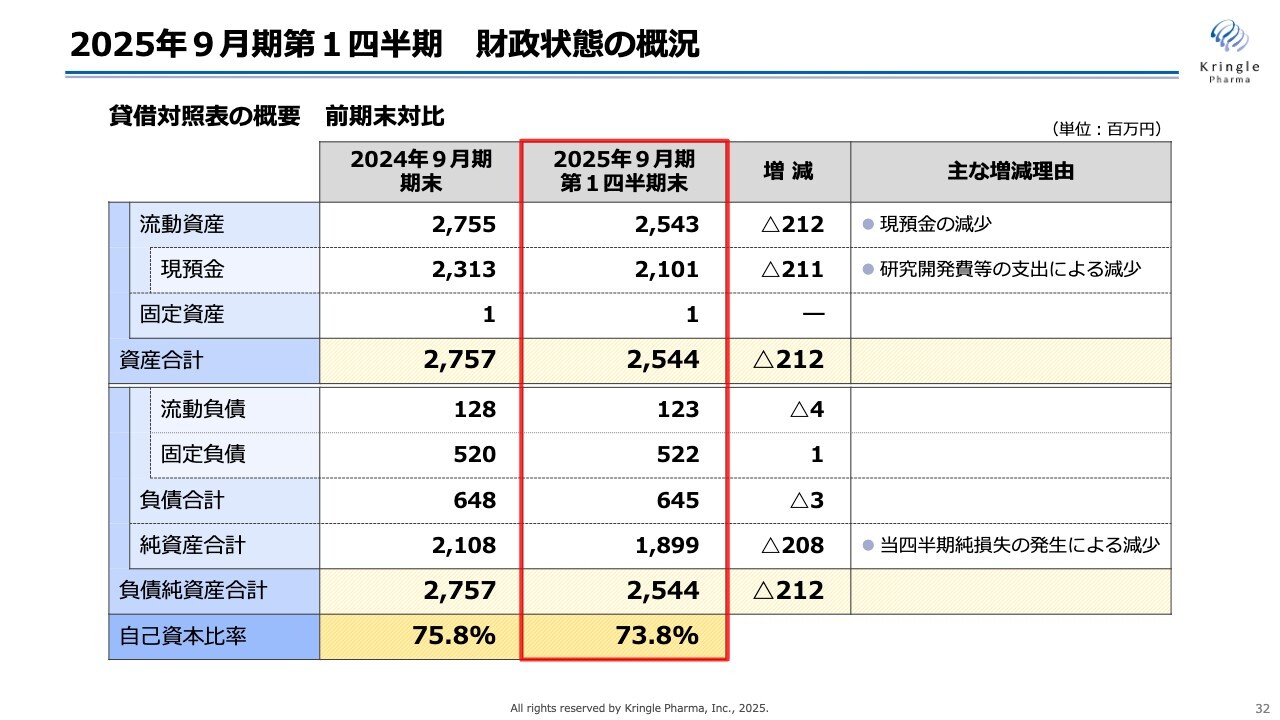
続いて、財政状態の概況です。スライドに、貸借対照表の概要を前期末対比で示しています。
流動資産25億4,300万円、うち現預金が21億100万円となっています。前期末と比べて減少していますが、こちらは研究開発費等の支出によるものです。資産合計としては25億4,400万円です。
一方、負債は流動負債、固定負債を合わせて6億4,500万円、純資産合計が18億9,900万円で、負債純資産合計が25億4,400万円となっています。
自己資本比率で見ると、前期末75.8パーセントのところ、この第1四半期末で73.8パーセントと若干数字が減っていますが、引き続き健全な財政状態をキープしています。
成長を遂げたバイオベンチャーの共通項
本日は最後のスライドの前に、「成長を遂げたバイオベンチャーの共通項」というタイトルのスライドを1枚入れています。こちらに掲げている会社は、アメリカでもともとバイオベンチャーからスタートし、巨大な製薬企業に成長した会社、あるいはメガファーマに買収された会社です。アムジェン、バイオジェン、ジェネンテック、リジェネロン、ギリアド、モデルナ、みなさまどこかで一度は名前を聞いたことがある会社ばかりかと思います。
これらの会社の共通項を考えると見えてくるものがあります。これらの会社が成長していく中で、自社製品を持つということが、中長期の大きな成長を遂げる要因であるということです。
もちろん、それぞれの会社は事情や対象疾患が異なりますし、モダリティも異なったりします。しかしながら、自社製品を持ち、中長期の収益を最大化することによって成長を遂げているということは、これらの会社に共通しています。
本日、最初の会社概要で当社のビジネスモデルについてご説明する時に、当社がこだわっていることは自社製品を持つということだとお話ししました。国内の脊髄損傷、あるいは声帯瘢痕については、自社で薬事承認を取り自社製品を持つということを方針として掲げています。
それは中長期の収益を最大化するためです。それを達成することにより、アメリカの前例と同じように、中長期の大きな飛躍的な成長を遂げたいと考えています。
クリングルファーマのビジョン
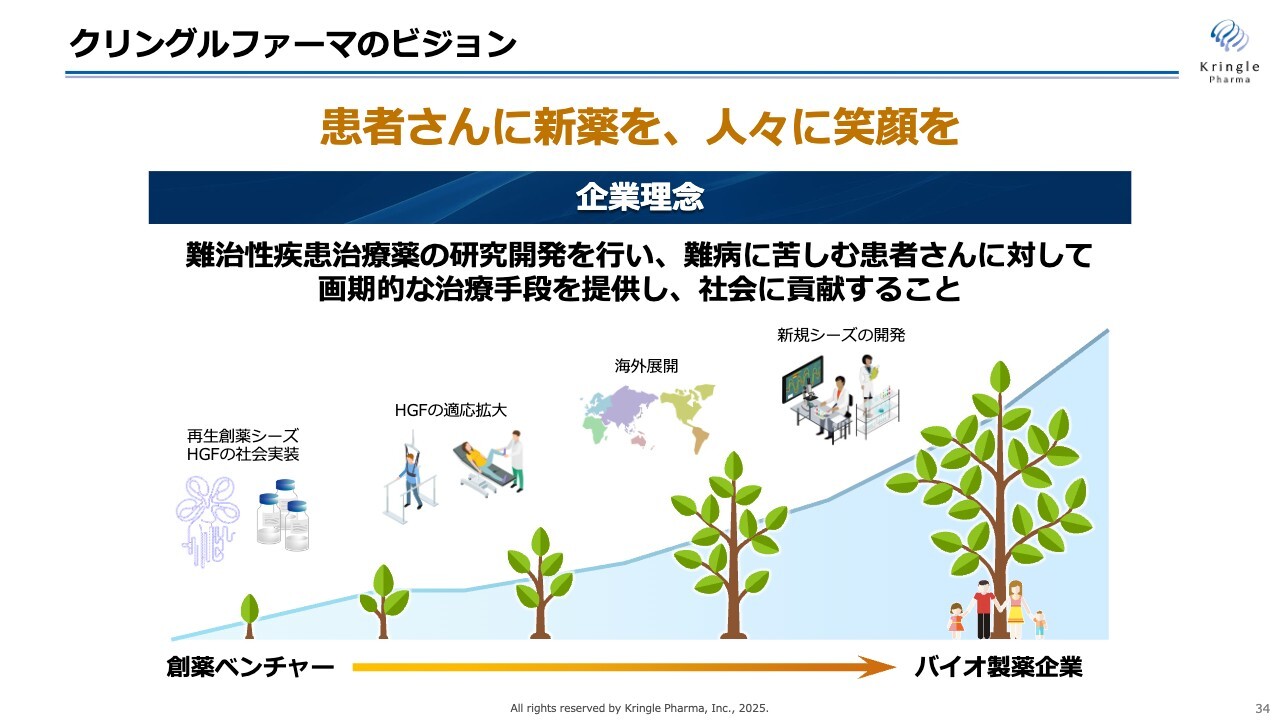
最後のスライドです。当社のビジョンは「患者さんに新薬を、人々に笑顔を」です。当社はまだ創薬バイオベンチャーであり、HGFは現在、臨床開発の最終段階に来ていますが、まだ薬として世の中には出ていません。まず、脊髄損傷および声帯瘢痕の治療薬としてこのHGFをきちんと社会実装し、承認を取得して医薬品としてご提供します。
その後、HGFの価値を最大化すべく適用拡大を図り、海外展開により大きな市場にいち早くリーチし、さらにはHGFの次の新規シリーズの開発にも着手します。スライドに木の成長のイラストを描いているように、最終的には私たち自身が、1つ前のスライドにあるようなアメリカの成功事例のように大きなバイオ製薬企業へと成長していきたいと考えています。
新着ログ
「医薬品」のログ