【QAあり】Delta-Fly Pharma、「DFP-10917」米国臨床第3相試験は着実に進行 DSMB審査を経てFDA承認申請に向けた準備継続
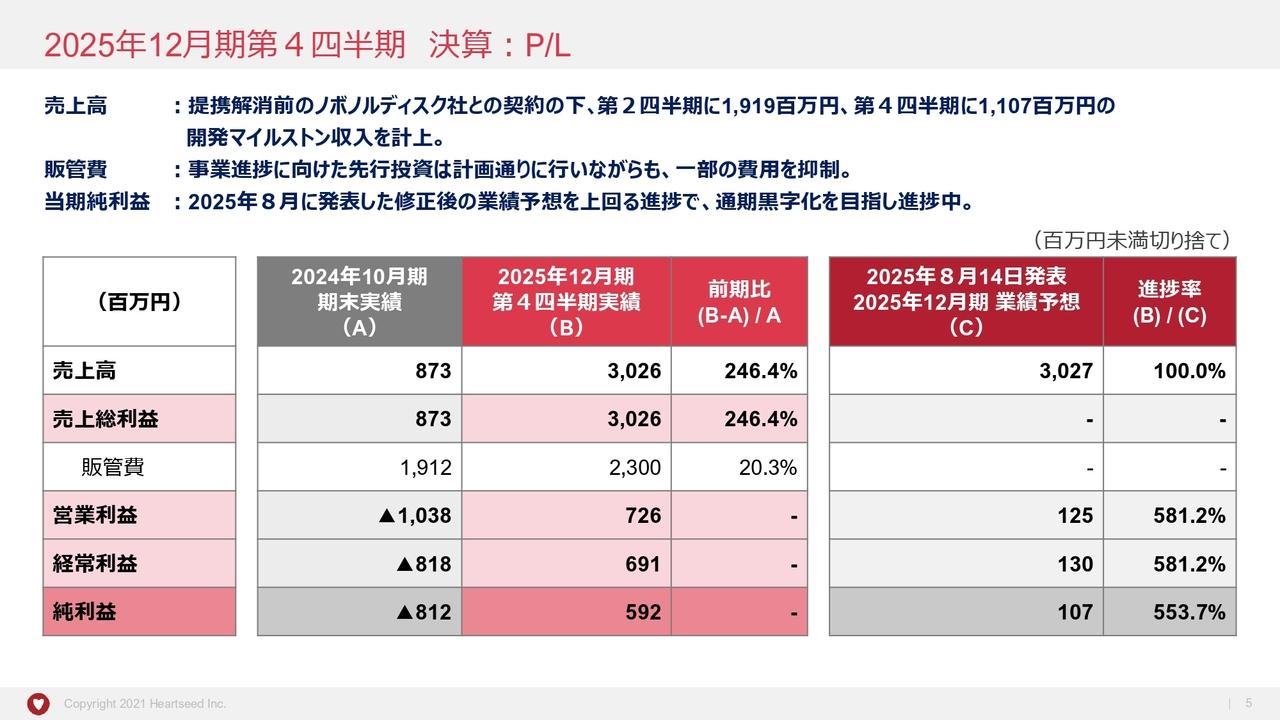
2026年3月期 第2四半期決算の概略
黒滝健一氏(以下、黒滝):Delta-Fly Pharma株式会社取締役管理部門担当の黒滝です。2026年3月期第2四半期の決算説明を行います。
はじめに損益計算書です。11月14日に決算短信を提出していますので、ご覧いただいた方もいらっしゃるかと思います。事業収益については、今年5月の決算発表時に示した計画と変わらず、現時点では事業収益はありませんでした。
事業費用の内容についてですが、トータル8億3,100万円のうち、研究開発費が約7億円を占めています。一般管理費は前年同期と変わらず、1億3,300万円です。営業損失、経常損失、当期純損失は、いずれも8億3,000万円から8億4,000万円の範囲で着地しています。
2026年3月期 第2四半期決算の概略
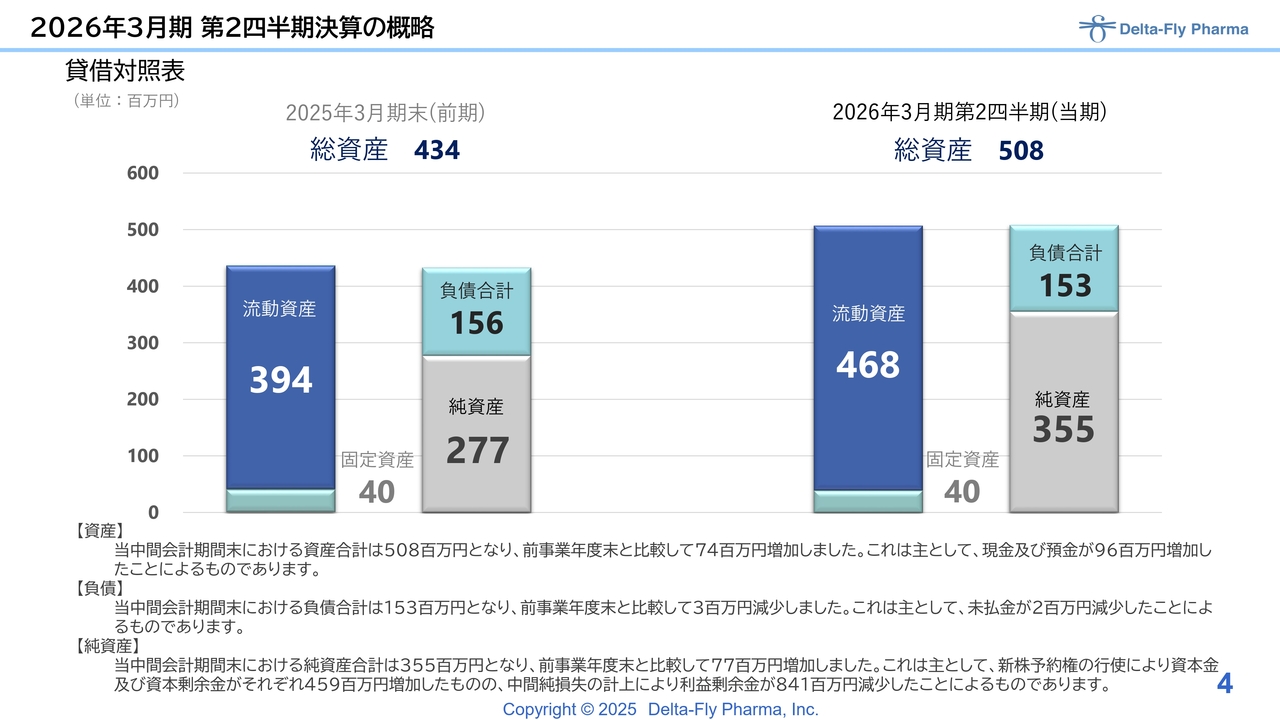
貸借対照表です。今年3月末の状況から4月に新株予約権を発行したことで、権利行使が進み、現預金などが増加しています。その影響で純資産と流動資産が増額しており、第2四半期は総資産が5億円強で着地しています。
事業計画(2026年3月期予想)
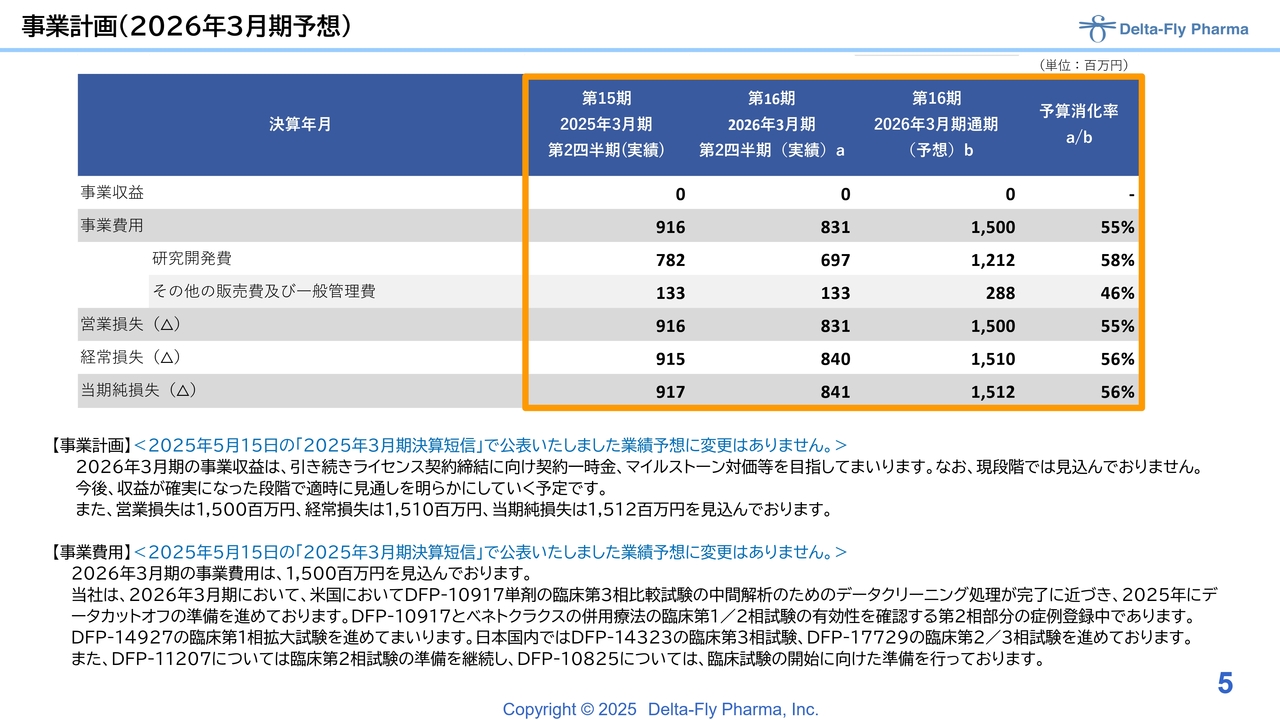
事業計画です。今期3月末の予想に関しては、5月15日に発表した計画から変更はありません。
事業費全体の15億円のうち、研究開発費として12億円強、その他一般管理費として3億円弱を予定しており、最終的に当期純損失として15億1,200万円を見込んでいます。現在の予算消化率は、予算をわずかに上回って推移している状況です。
今後、なんらかのかたちで売上に寄与する動きがあれば、その段階で適時開示を行い、予算修正を検討する必要があると考えています。
2026年3月期 第2四半期決算の概略
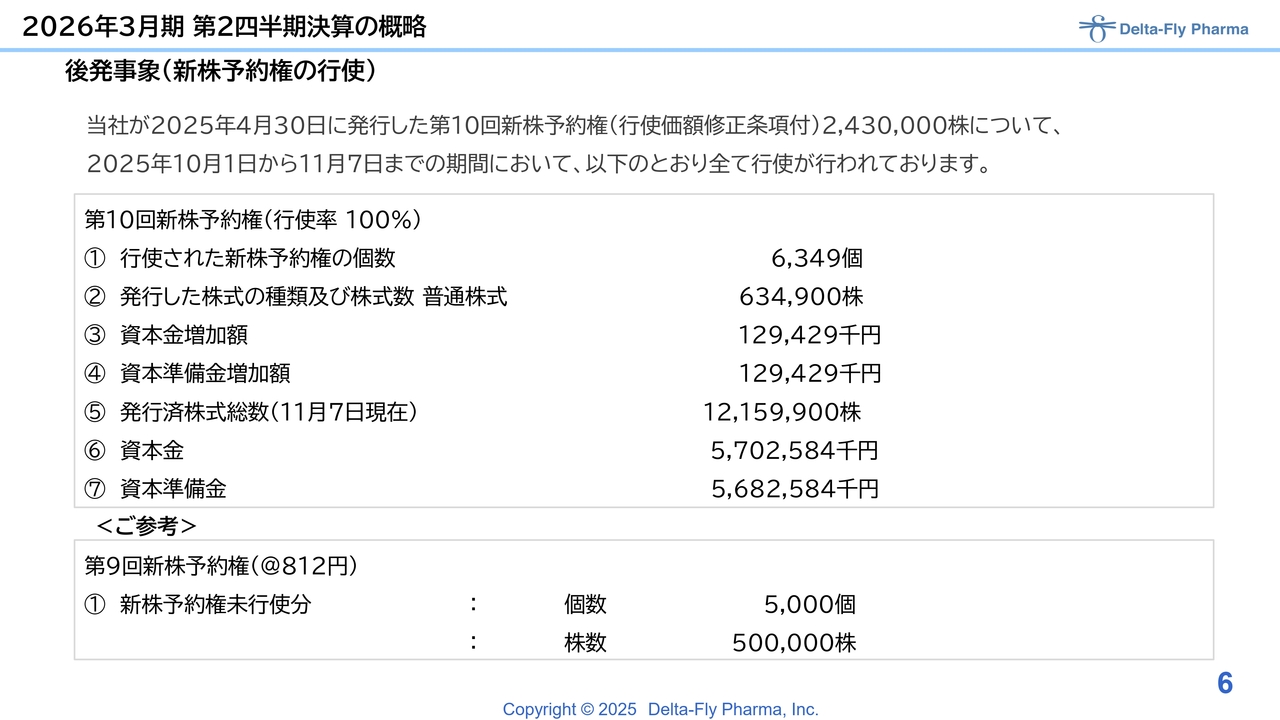
加えて、今回は後発事象となりますが、10月1日から足元までの状況についてお伝えします。9月までの権利行使以降、10月1日から11月7日までに第10回新株予約権の権利行使がすべて完了しました。
10月以降の状況については、スライドに記載しているとおりです。また、昨年発行した第9回の固定型については、5,000個、50万株分が残っています。権利行使価格は4月に850円から812円に修正しています。
〈ご参考〉
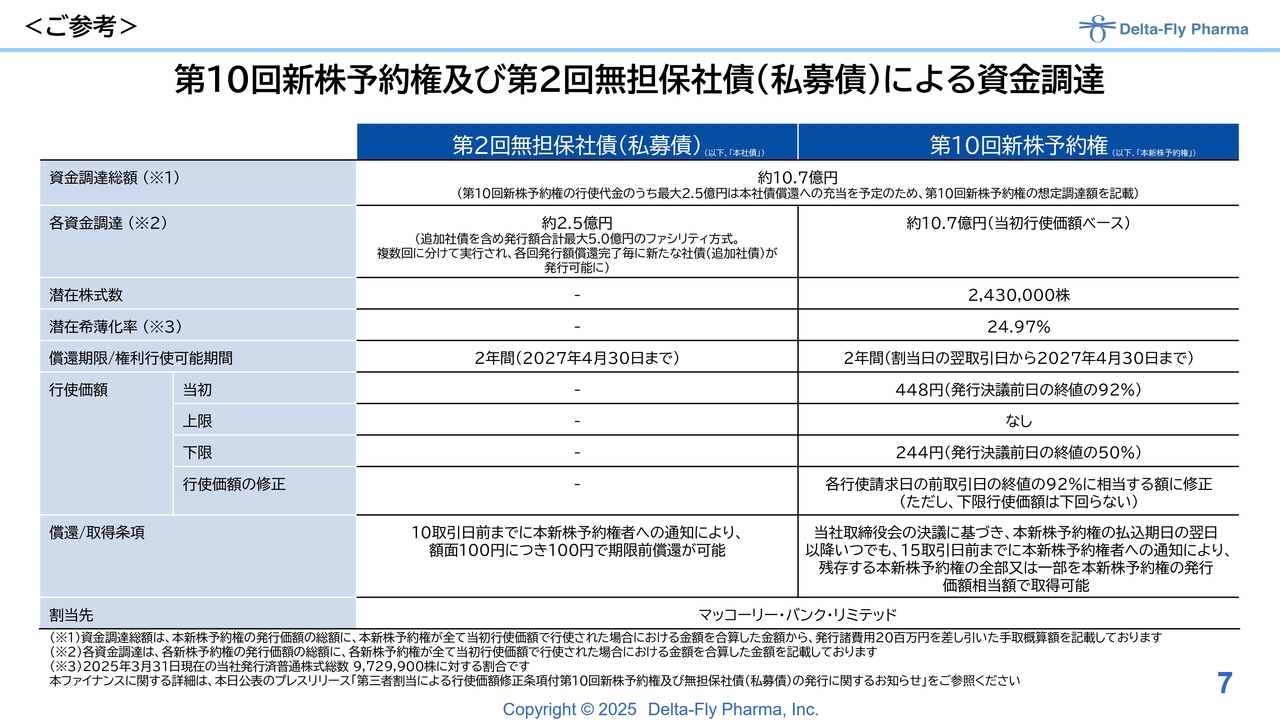
スライドは、今年4月にローンチした内容の参考資料です。
調達資金の充当状況
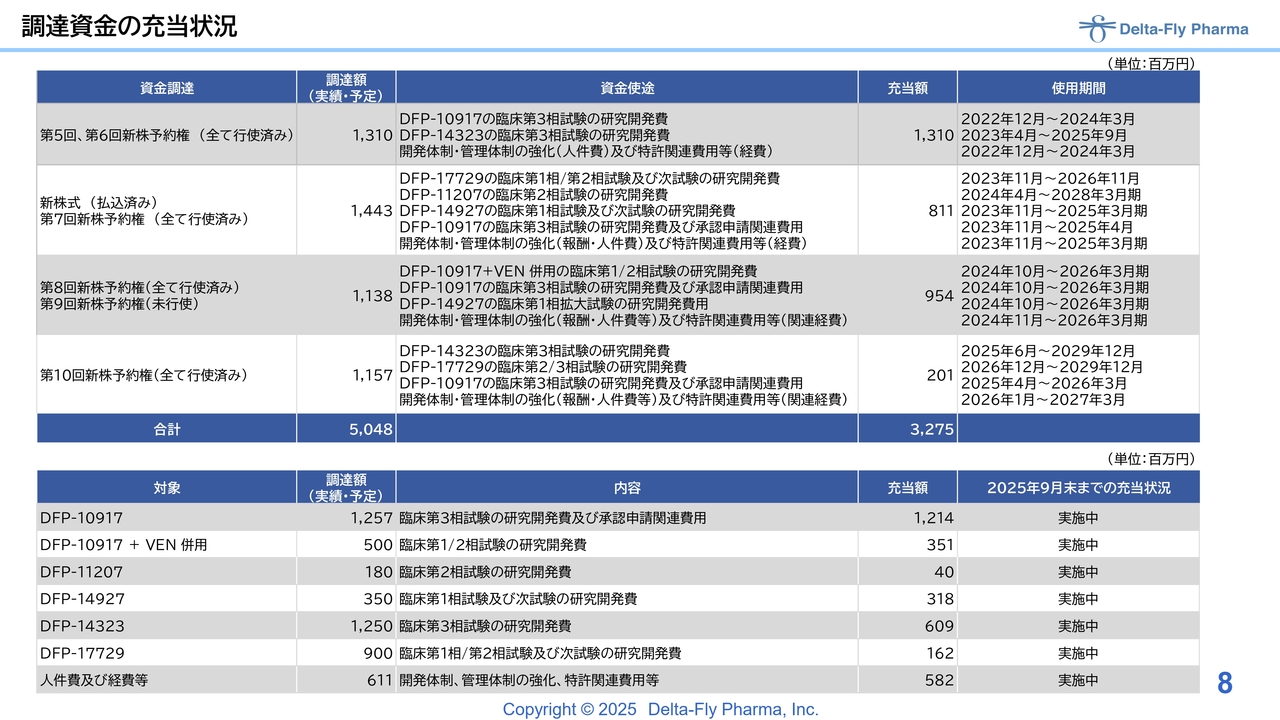
9月までの調達資金の充当状況です。「DFP-14323」の臨床第3相試験の研究開発費において、第5回および第6回の新株予約権残額は、第2四半期までにすべて消化され、資金使途はすべて充当済みです。
第7回については、「DFP-17729」「DFP-11207」は若干残っていますが、それ以外のものは消化済みです。「DFP-17729」に関しては、次試験である臨床第2相試験/臨床第3相試験に順次充当している状況です。
昨年の秋に発行した第8回と第9回についてですが、第8回は「DFP-10917」と「ベネトクラクス(VEN)」の併用試験の開発費や「DFP-10917」の単剤による臨床第3相試験に充当しており、消化率は比較的高いと考えています。
今年4月に発行した第10回については、現在のところ「DFP-10917」と「DFP-14323」が先行しており、そちらに費用を充当している状況です。スライドには、各パイプラインにおける調達予定額・実績と充当額の状況を記載しています。
私からは以上です。
開発パイプラインの状況と今後のスケジュール (現状において、計画に変更ありません)
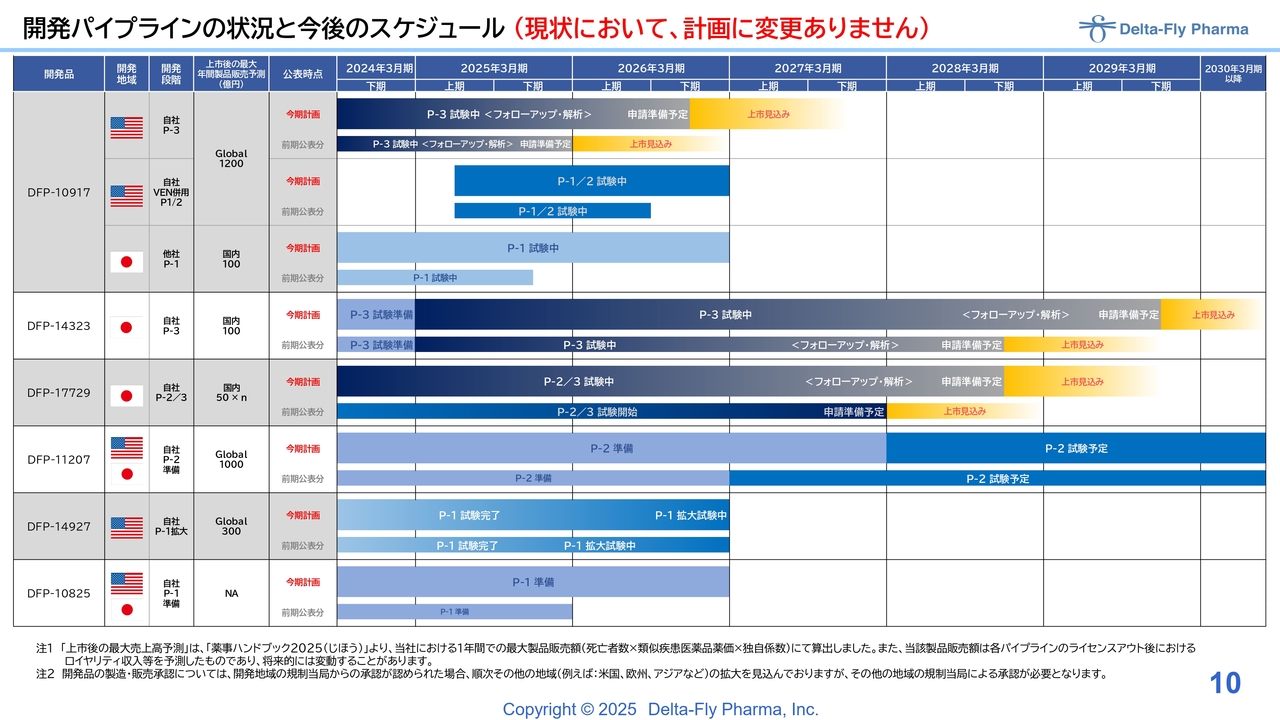
江島淸氏(以下、江島):代表取締役社長の江島です。パイプラインの状況と今後のスケジュールについてご説明します。
スライドに記載しているとおり、現状で計画に変更はありません。パイプラインは6つありますが、一番進んでいる「DFP-10917」と「DFP-14323」に関しては、最近プレスリリースを発表したところです。
開発パイプラインの状況と今後のスケジュールの概要①
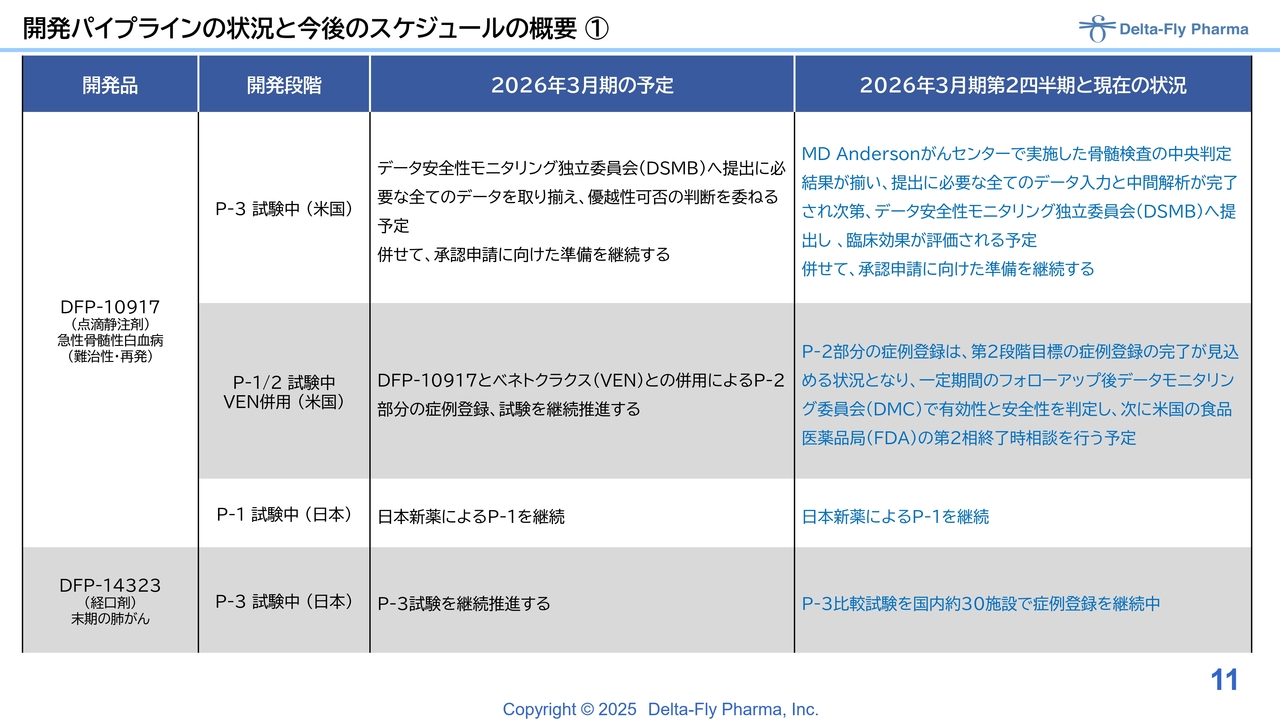
スライドは、プレス等の内容を集約したものです。「DFP-10917」は、急性骨髄性白血病の難治性・再発患者を対象に、米国で臨床第3相試験を実施しています。2026年3月期の予定についてはスライドに記載のとおりであり、現状では基本的に予定どおり進捗しています。
具体的には、米国のテキサス州にある巨大な大学、MD Andersonがんセンターで実施された骨髄検査の使用判定について、臨床治験に参加した先生方の判定結果とこの治療判定の結果をあわせて、効果と安全性を総合的に評価する必要があります。
現在、このデータを統計解析担当者が入力中であり、入力と中間解析が完了され次第、データ安全性モニタリング独立委員会(DSMB)へ提出します。この結果をもとに、FDAへの承認申請可否について判断が下される予定です。
この単剤試験に加えて、「ベネトクラクス(VEN)」との併用で臨床第1相試験/臨床第2相試験も実施していますが、今期の試験予定と照らし合わせて、基本的には予定どおり進んでいます。臨床第2相試験部分の症例登録が完了する見込みとなりましたので、評価判定を行うために、1年、2年といった長期ではありませんが、一定期間のフォローアップが必要です。
その後、データモニタリング委員会(DMC)による有効性・安全性の判定を行い、次の臨床第3相試験への移行を判断するための臨床第2相試験終了相談を米国食品医薬品局(FDA)との間で調整する予定です。
日本においては、ライセンスパートナーである日本新薬が日本人患者を対象に臨床第1相試験を実施しており、計画どおりに進行しています。
「DFP-14323」の臨床第3相試験は、がん免疫療法の一環として経口剤を用い、末期の肺がん患者を対象に実施しています。今期の計画どおり進行しており、国内の主要ながんセンター30施設において症例登録を行っています。
開発パイプラインの状況と今後のスケジュールの概要②
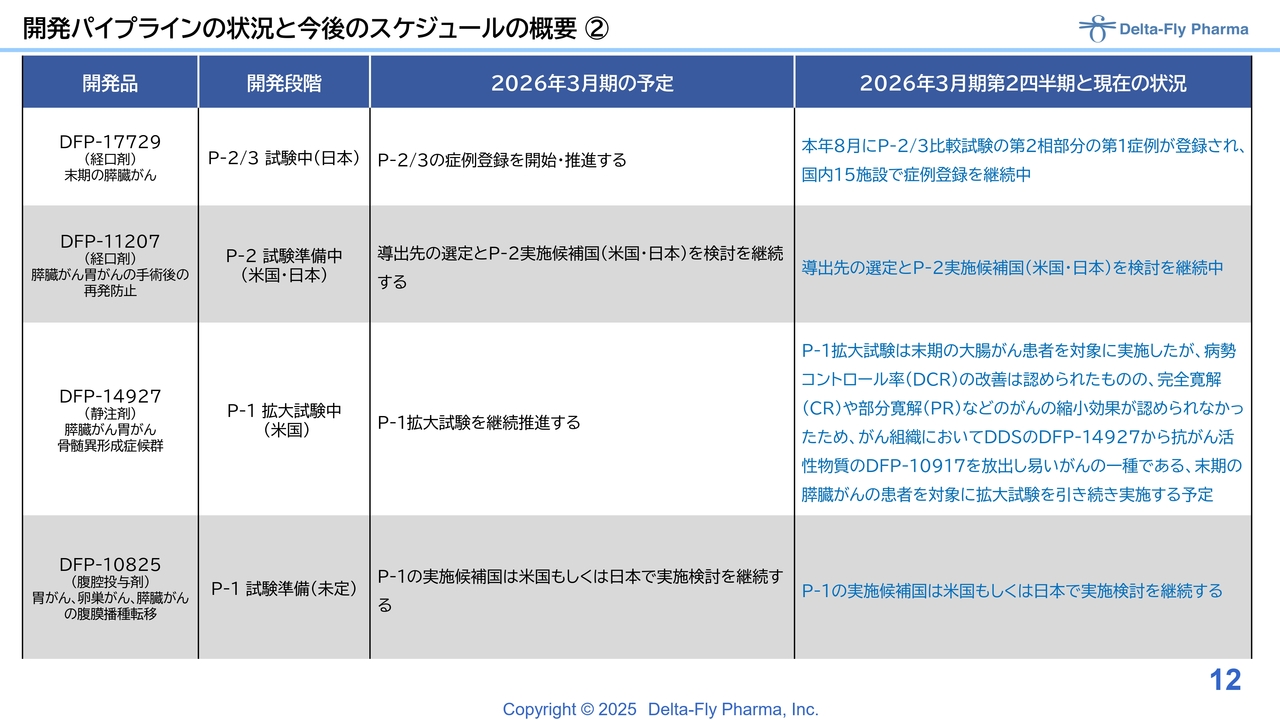
「DFP-17729」は経口剤であり、末期膵臓がんの患者を対象に、臨床第2相試験/臨床第3相試験を実施する計画です。
先日第1例目の症例が入り、それを受けてプレスリリースを行いました。現在は15施設で症例登録を実施中です。
「DFP-11207」についても経口剤ですが、膵臓がんや胃がんの手術後の再発防止を目的とした患者を対象に臨床第2相試験を実施するための準備を進めています。現在、計画どおり順調に進んでいる状況です。
「DFP-14927」は、「DFP-10917」のいわゆるドラッグデリバリーシステム(DDS)に該当するもので、「DFP-10917」の場合、2週間連続で投与する必要がありますが、「DFP-14927」は週1回の投与で同等の効果が得られる可能性があります。
この物質については、米国、特にテキサス州のMDアンダーソンがんセンターおよびカリフォルニア大学ロサンゼルス校において臨床第2相試験を実施しています。
なお、大腸がんを対象に拡大試験を行いましたが、基本的にCR(完全奏効)やPR(部分奏効)といった縮小効果は認められませんでした。
併せて実施した基礎試験などを通じて、DDSの「DFP-14927」から活性物質「DFP-10917」が放出されやすいかどうかが重要であることが確認されました。そのため、大腸がんの試験はいったん保留とし、膵臓がんの患者を対象にした拡大試験を引き続き実施する予定です。
「DFP-10825」については、臨床第1相試験を米国または日本で実施するための準備を継続して進めています。
詳細は参考資料として次のスライド以降に記載していますので、ご確認ください。
以上、主なパイプラインの現状と見通しについてご説明しました。
質疑応答:「DFP-10917」の米国臨床第3相試験の進捗状況について

質問者:「DFP-10917」の米国での臨床第3相試験についてです。データ安全性モニタリング独立委員会(DSMB)へのデータ提出のタイミングはどのくらいでできそうですか? 年内、また
新着ログ
「医薬品」のログ