【QAあり】Delta-Fly Pharma、多くのパイプラインで臨床試験が順調に進捗 新株予約権・無担保社債による資金調達実施、研究加速へ
2025年3月期 通期決算の概略
黒滝健一氏(以下、黒滝):Delta-Fly Pharma株式会社取締役管理部門担当の黒滝です。2025年3月期の通期決算の状況についてご説明します。
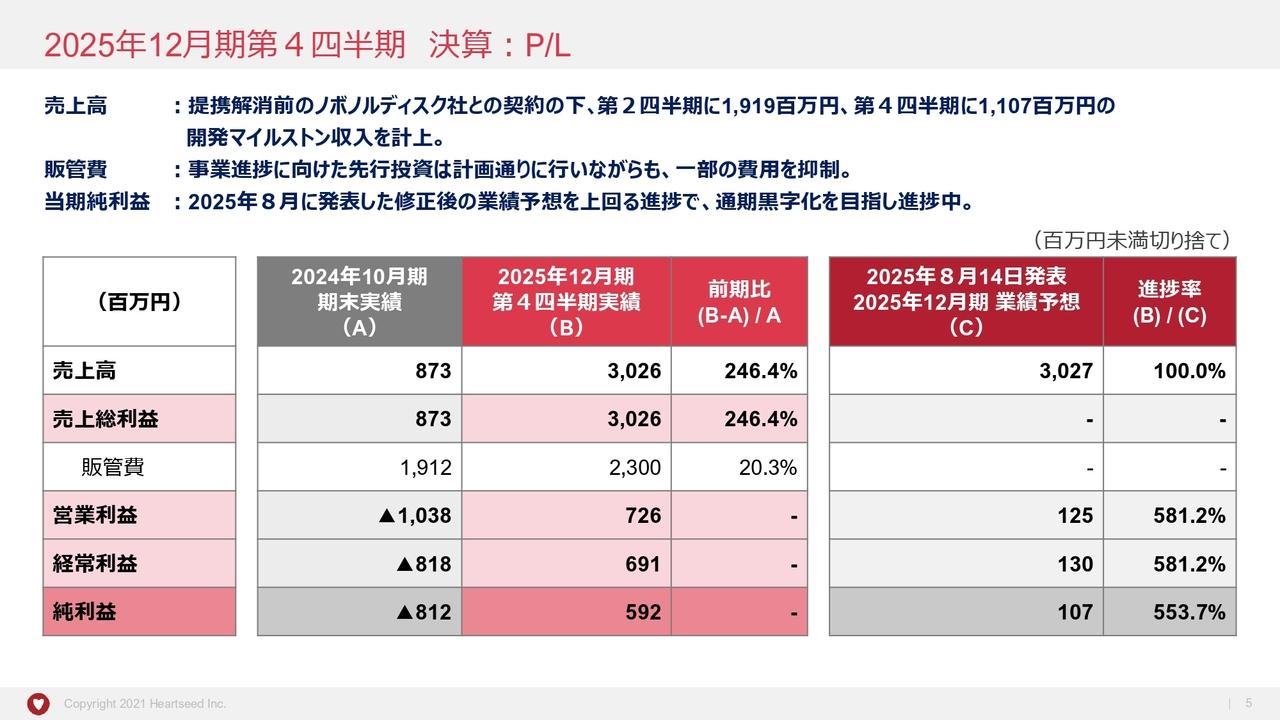
はじめに損益計算書です。前期は事業収益はありませんでした。事業費用については約18億円の計画に対し、17億円強の着地となりました。
研究開発費については、数多くのパイプライン、特に臨床第3相試験を多く実施したことから、当初の見積もりに比べ若干少なくなったものの、ほぼ計画どおり消化し、14億3,700万円となりました。一般管理費は2億7,000万円となっています。営業損失、経常損失、当期純損失ともに17億円強で着地しています。
2025年3月期 通期決算の概略
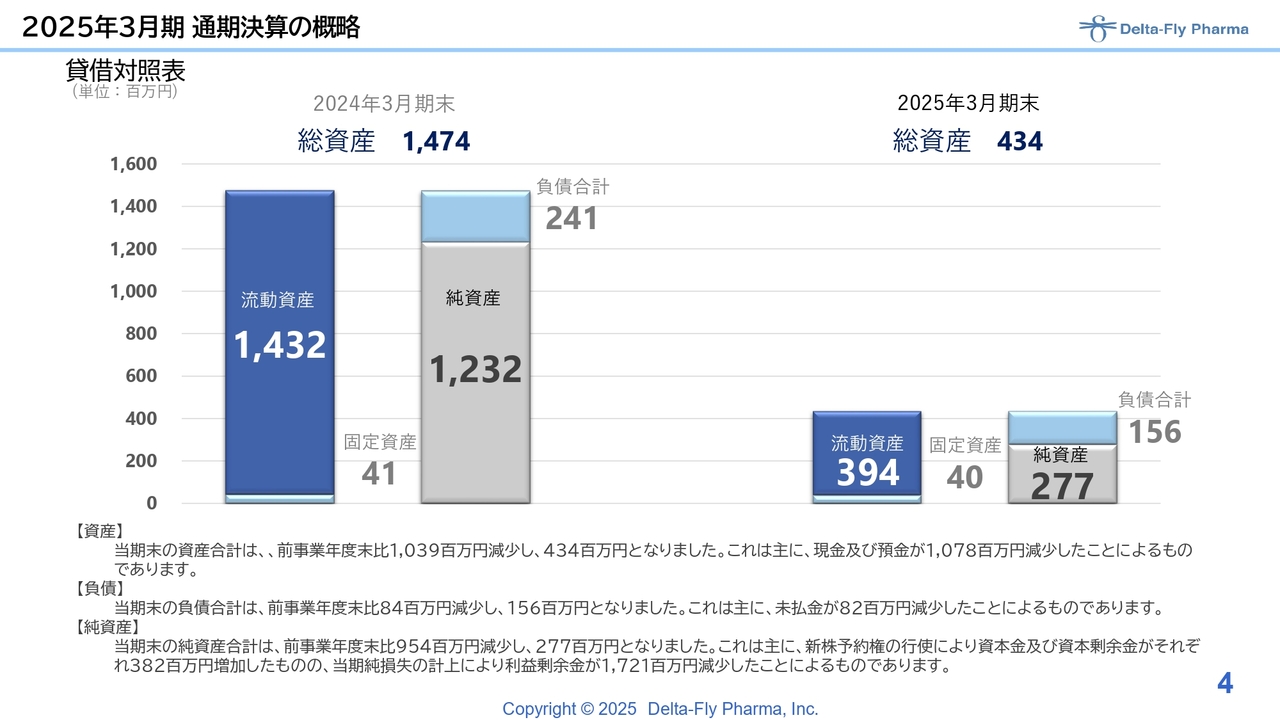
貸借対照表です。前期は非常に厳しい状況でした。2024年3月期の流動資産は約14億円ありましたが、先ほどご説明したとおり研究開発費に傾注した結果、前期の最終総資産は4億3,400万円と落ち込みました。
後ほどご説明しますが、2025年4月にファイナンスを仕掛けているため、今期の開発資金については調達可能と見込んでいます。
2025年3月期 期決算の概略
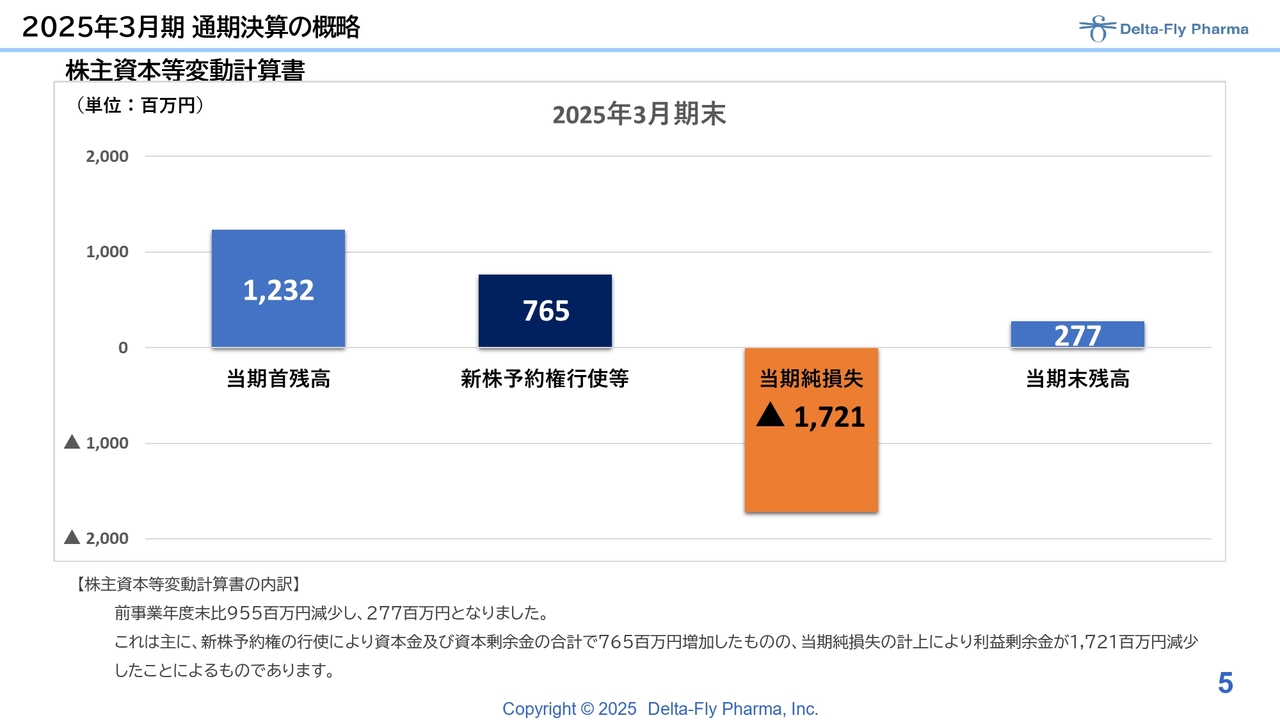
株主資本等変動計算書については、先ほどご説明したとおりです。
事業計画(2026年3月期予想)
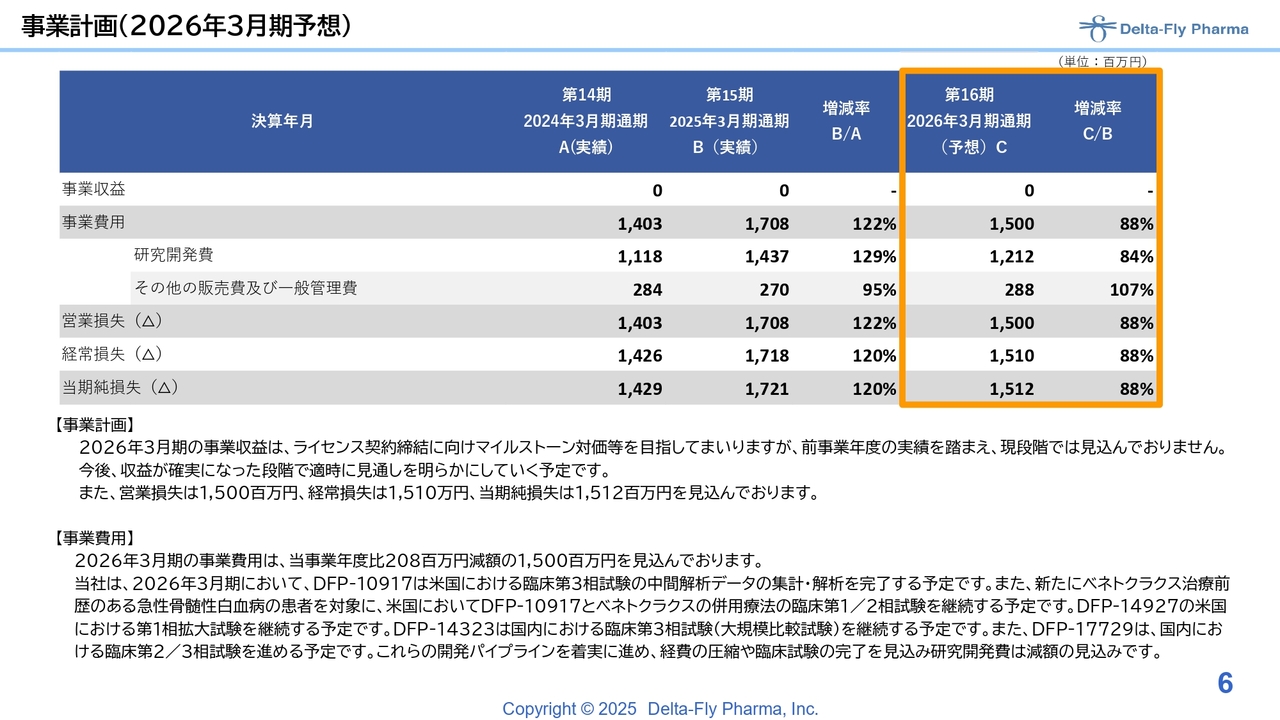
今期予算の見込みです。新たなライセンスアウトは、現時点ではまだ水面下にあります。また、今後予定されているイベントに伴うマイルストーン収入の発生にも時間を要することから、今期も事業収益はゼロからのスタートとなります。
今後、「DFP-10917」や「DFP-14323」といった海外ライセンスが収益につながる見込みが立った場合は、確定したタイミングで開示したいと考えています。
事業費用は、前期比約12パーセントダウンとなる15億円を見込んでいます。研究開発費は12億円1,200万円、販管費は2億8,800万円を想定しています。ただし、これらの金額は多少変動する可能性もあります。また、特許関連費用については、特に欧州において値上げが相次いでいることもあり、その費用計上も考慮して今回の金額を見積もっています。
営業損失、経常損失、当期純損失は今期15億円強と予想しています。今期の事業費用の主な内訳については、現在実施している「DFP-10917」単剤の臨床第3相試験の中間解析を完了すること、また「ベネトクラクス」との併用療法の臨床第2相試験相当部分を十分に固めていくことに使いたいと考えています。
アメリカにおける「DFP-14927」の臨床第1相試験拡大の継続についても、今期しっかりと推進していきます。さらに肺がんを対象にした国内の「DFP-14323」については、長期にわたる試験となりますが、計画どおり進めていきたいと思っています。
膵臓がんを対象にした国内の「DFP-17729」についても、2025年3月にリリースしました。臨床第2相試験/臨床第3相試験の第2相試験部分を今期から始める計画であり、こちらについても推進してきたいと考えています。
行使価額修正条項付第10回新株予約権及び第2回無担保社債の発行(2025年4月14日発行決議)

先ほど貸借対照表のスライドでお話ししましたが、2025年4月14日付けで発行決議した「第10回新株予約権及び第2回無担保社債の発行」について、実施しています。新株予約権で約10億円強の資金調達を見込んでいます。
主な資金使途としては、「DFP-14323」の国内臨床試験の研究開発費に6億5,000万円、「DFP-17729」の臨床第2相試験/臨床第3相試験の研究開発費に2億5,000万円、「DFP-10917」単剤の最終開発費および承認申請関連費用に1億円を追加したいと考えています。
本ファイナンスの概要
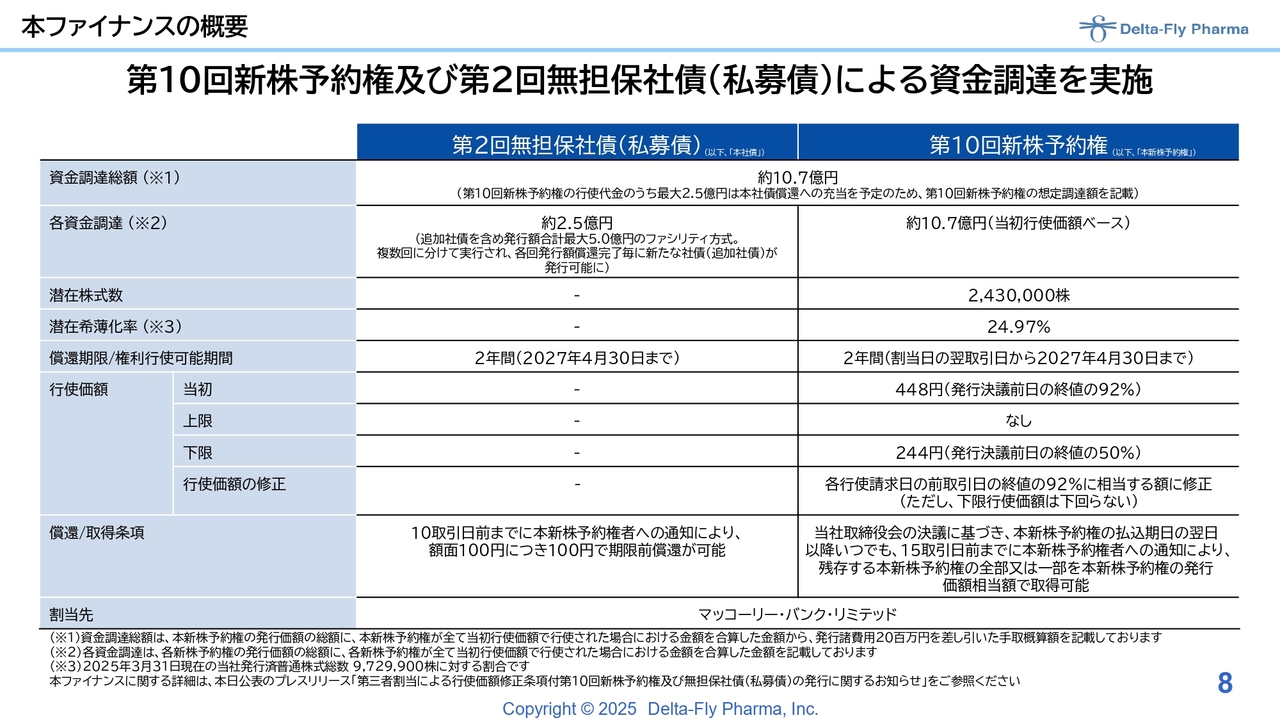
こちらはすでにリリースした内容になるため、ご承知おきいただいていると思います。第2回無担保社債は、発行額合計最大5億円の社債枠に対してファシリティ方式を採用しており、2回に分けて実行されるものになります。そのうち、1回目となる2億5,000万円については、2025年4月30日の効力発生時にすでに入金が完了している状況です。こちらの発行額償還完了次第、再度2億5,000万円の発行を予定しています。
本ファイナンスに関する背景と目的及び特徴

過去の実績と安定感があるという理由から、これまでに複数回取引しているマッコーリーキャピタル証券会社、およびオーストラリアにあるマッコーリー・バンク・リミテッドに今回のスキームを設計していただき、本ファイナンスを発行しました。
無担保社債については、現在の手元資金の状況を踏まえ、今回は社債を組み合わせたものにしています。
また、希薄化に対する合理的な判断として、希薄化率25パーセント未満にすることで第三者委員会を置かないギリギリのラインで設計しています。さらに今回は固定式ではなく、基本的には行使価額変動方式のムービング・ストライク・ワラントで調達することで、機動性を担保するという判断をしました。
本ファイナンスによる調達の仕組み 【資金調達のスキーム図】
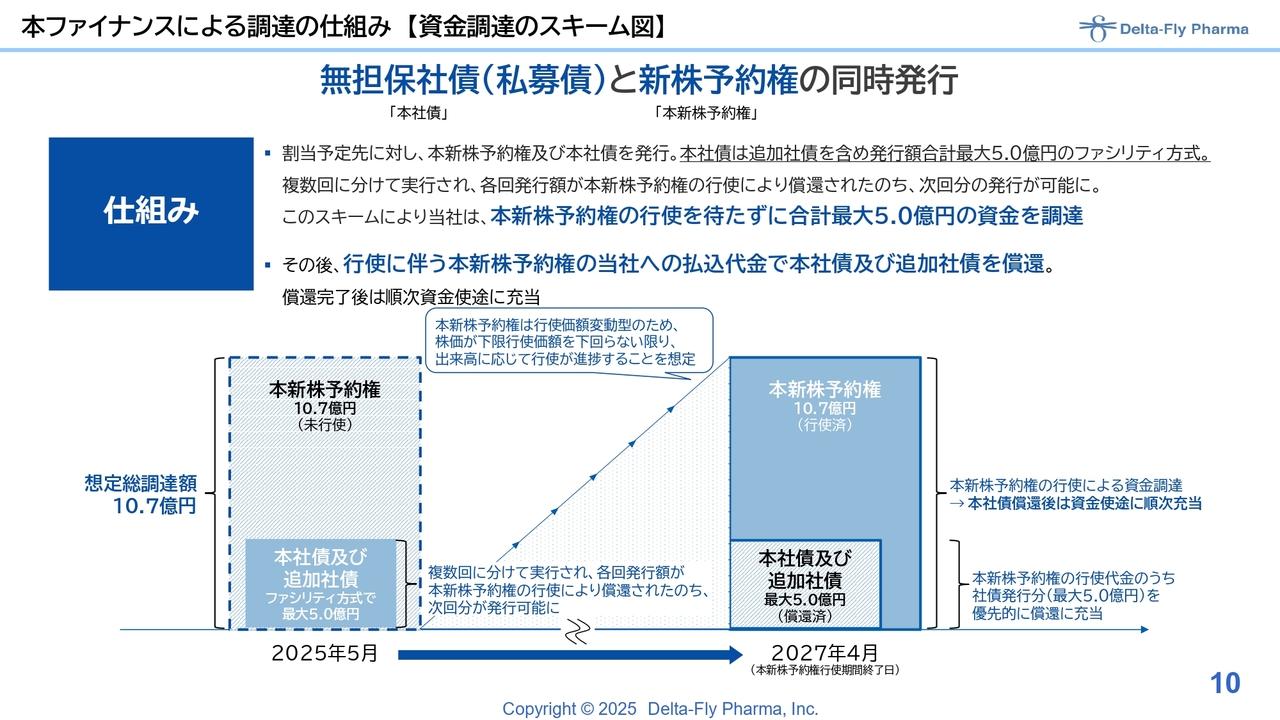
スライドは、先ほどご説明した2つのスキーム図です。
調達資金の充当状況
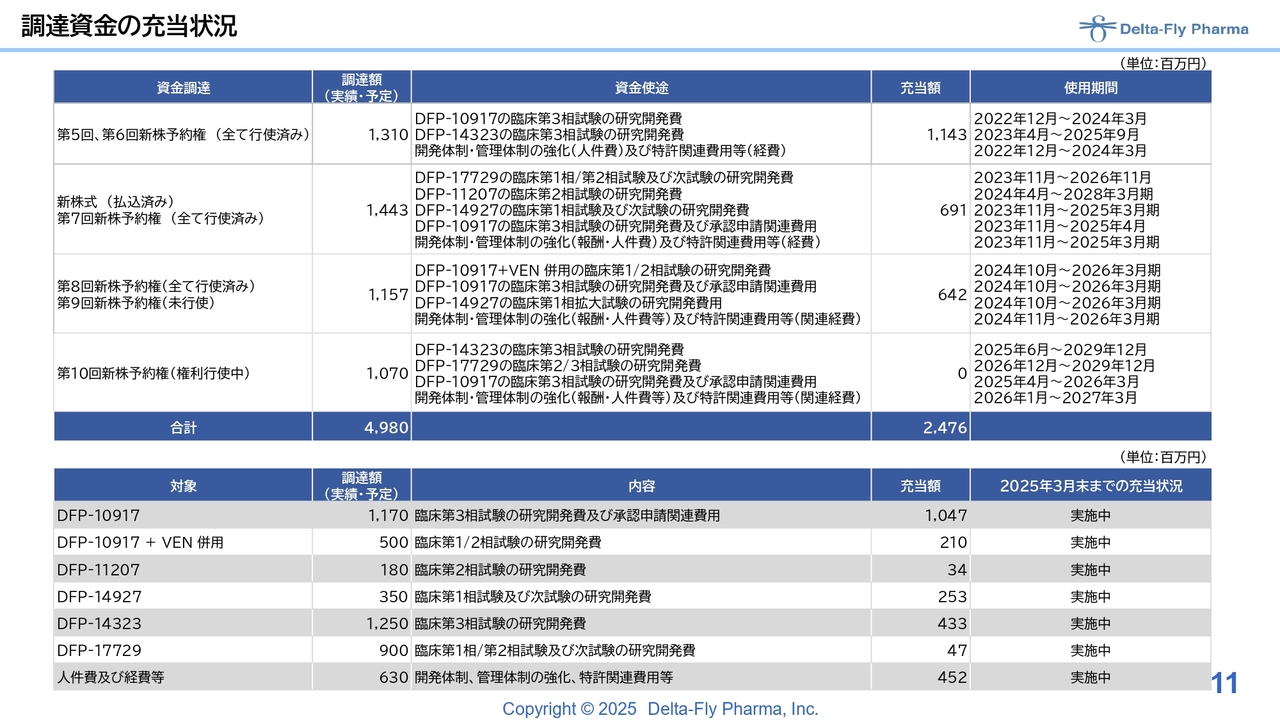
資金調達の充当状況です。ローンチの際は、2025年2月末時点の情報を開示していましたが、今回は2025年3月末時点の充当額や第10回新株予約権発行について追加した内容になります。
すべての調達額に対して、充当額は時期の関係もありますが、ほぼ使ってしまっているものや、まだ十分な余裕があるものもあります。開発の時期に応じた金額の調達をさせていただいており、これらはすべて実施中の内容です。
事業開発投資について
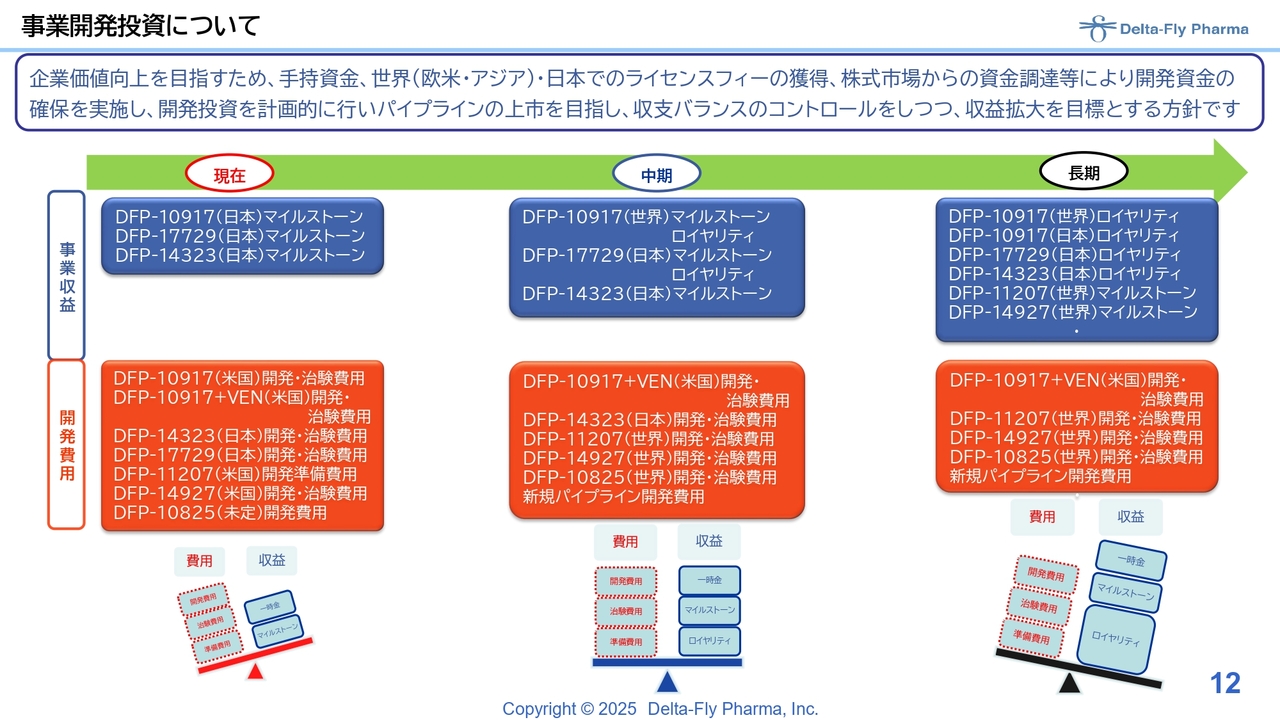
事業開発については、スライドのような状況で進めています。決算状況や今期の予想数値、資金使途の充当状況についてのご説明は以上のとおりです。
開発パイプラインの状況と今後のスケジュール
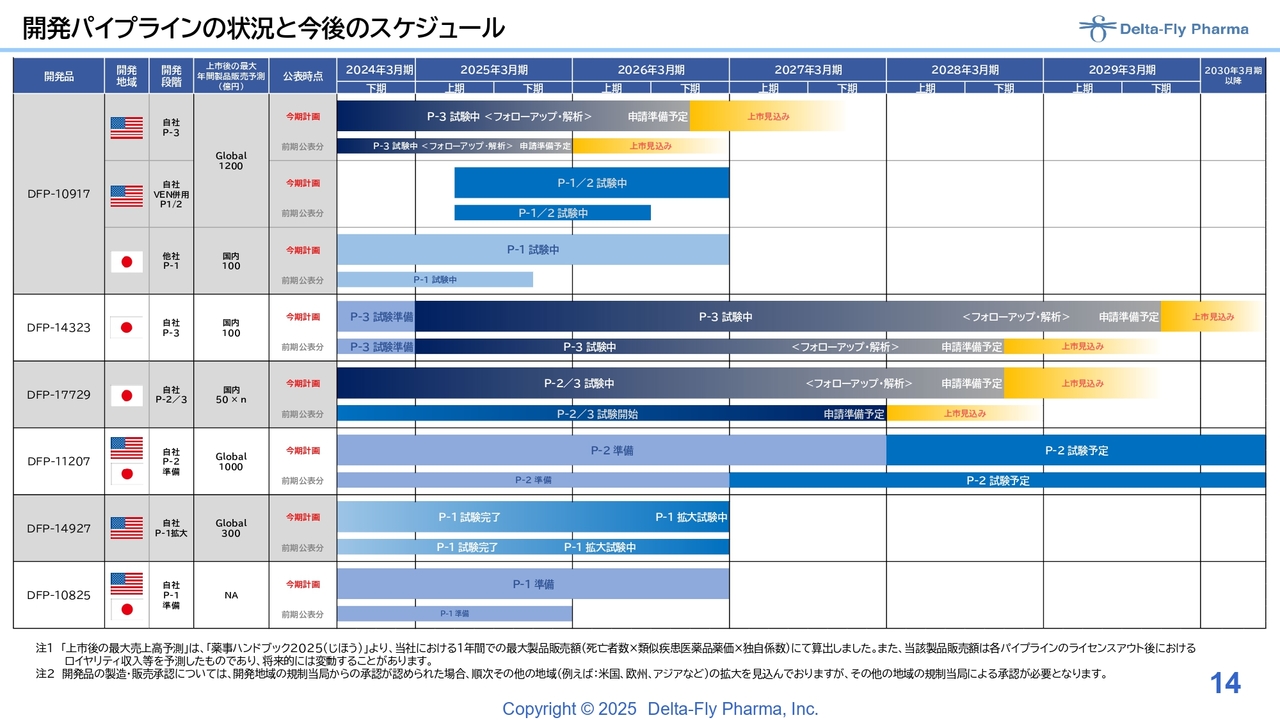
江島淸氏(以下、江島):代表取締役社長の江島です。開発パイプラインの状況と今後のスケジュールについてご説明します。
全体で6つの開発パイプラインが推移していますが、1点だけご説明します。「DFP-10917」については長期生存の患者さまが何名かおられたため、解析スケジュールが若干ずれていますが、遅れているということではありません。
開発パイプラインの状況と今後のスケジュールの概要
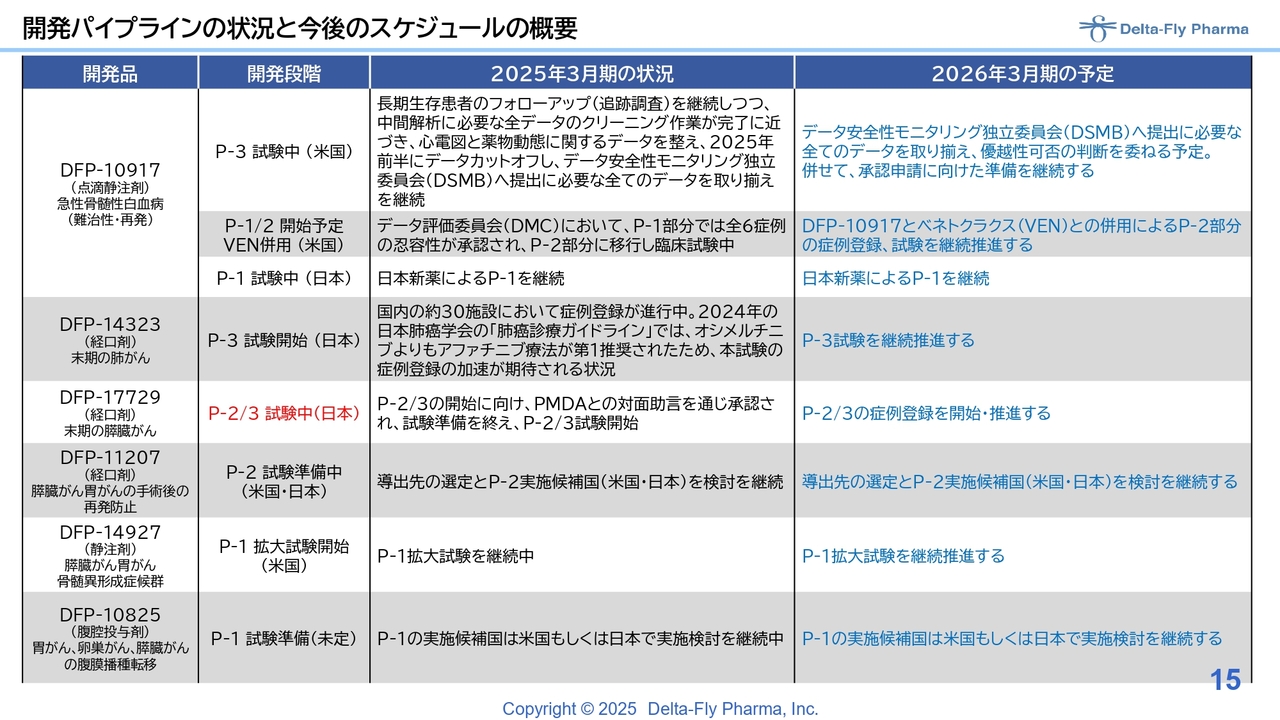
詳細はスライドに記載の通りです。「DFP-10917」については、長期生存者のフォローアップに時間を要したため、中間解析に必要なデータの回収とクリーニング作業に若干余分に時間がかかっています。
2025年前半をめどにデータカットオフし、データ安全性モニタリング独立委員会(DSMB)へ提供し、データの優越性について可否判断いただく予定にしています。
さらに、単剤の試験だけではなく、急性骨髄性白血病(AML)の標準療法として承認されている「ベネトクラクス」との併用を踏まえた臨床第1相試験/臨床第2相試験を実施しています。後ほどご説明しますが、臨床第1相試験は順調に進み、すでに臨床第2相試験に入っています。日本国内においては、パートナーである日本新薬株式会社が臨床第1相試験を進めています。
「DFP-14323」については、症例数が多いため、国内の約30施設で症例登録を進めています。2024年に出された日本肺癌学会の「肺癌診療ガイドライン」では、「オシメルチニブ」よりも「アファチニブ」が第1推奨されたため、本試験の症例登録の加速が期待される状況であると考えています。ここ最近の症例登録が大変速やかに進んでいることも影響したかと思います。
今回特に大きな変化があったのは「DFP-17729」で、末期の膵臓がんの患者さまを対象とした試験について、臨床第1相試験/臨床第2相試験の解析を進めていましたが、その結果について、日本の審査当局であるPMDAとの対面助言を通じ、臨床第2相試験/臨床第3相試験実施の許可をいただきました。臨床第2相試験に必要な約15施設についてもほぼ了承いただいたため、各施設のIRB(治験審査委員会)で承認され次第、症例登録が順次開始される見込みです。
「DFP-11207」については、従来と大きく変わっていません。アメリカで臨床第1相試験の良いデータが出ているため、日本もしくはアメリカで臨床第2相試験を実施する方向で、鋭意検討を進めています。
「DFP-14927」は、ポリエチレングリコールの4本鎖に「DFP-10917」を結合させたDDS(ドラッグ・デリバリー・システム)です。週1回投与で「DFP-10917」と同等以上の効果が期待できる薬剤になります。臨床第1相試験の用量設定試験が終わって、臨床第2相試験に相当する拡大試験に入っており、その中で症例登録が進んでいます。
「DFP-10825」は、がん患者さまの腹水を減らす作用のある薬剤です。新型コロナウイルスの影響でサルなどの動物が取得できず進捗が遅れていましたが、ようやく事態も収束してきたため、次の臨床第1相試験に入れる状況になりました。コロナの影響も踏まえ、アメリカもしくは日本で臨床第1相試験を実施したいと考えています。
研究開発~DFP-10917

「DFP-10917」の詳細な状況です。先ほどの内容と重複するため、説明は割愛します。
DFP-10917~米国における急性骨髄性白血病の状況
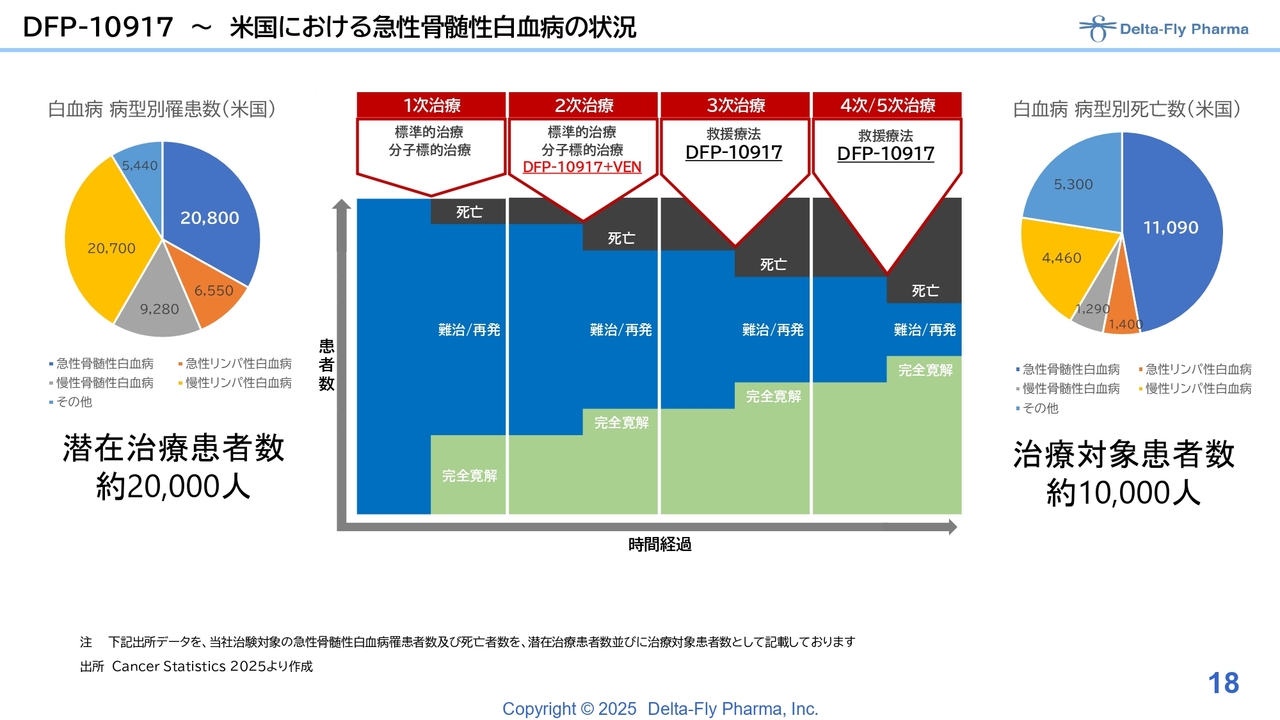
「DFP-10917」の単剤と「ベネトクラクス」との併用では、何がどう異なるのかというご質問を多くの方からいただいています。「DFP-10917」と「ベネトクラクス」の併用療法は、既存の標準療法に対し、特に2次治療の患者さまを対象とした承認を得る試験です。
「DFP-10917」単剤の試験は3次以降の治療方法として承認を取るべく、現在、中間解析を進めています。
DFP-10917+VEN及びDFP-10917の臨床試験状況に関するお知らせ

2024年12月9日にプレスリリースした状況です。「ベネトクラクス」の前治療(1次療法)が無効もしくは再発した急性骨髄性白血病の患者さまを対象に、スライドには「アメリカの5施設」とありますが、現在は4施設で「DFP-10917」と「ベネトクラクス」の併用の臨床第1相試験/臨床第2相試験を進めています。
ある程度時間がかかると思われましたが、最初の3例のデータが良かったため、早めにその後の臨床第2相試験に入れるのではないかと思っています。
DFP-10917+VENの臨床試験状況に関するお知らせ
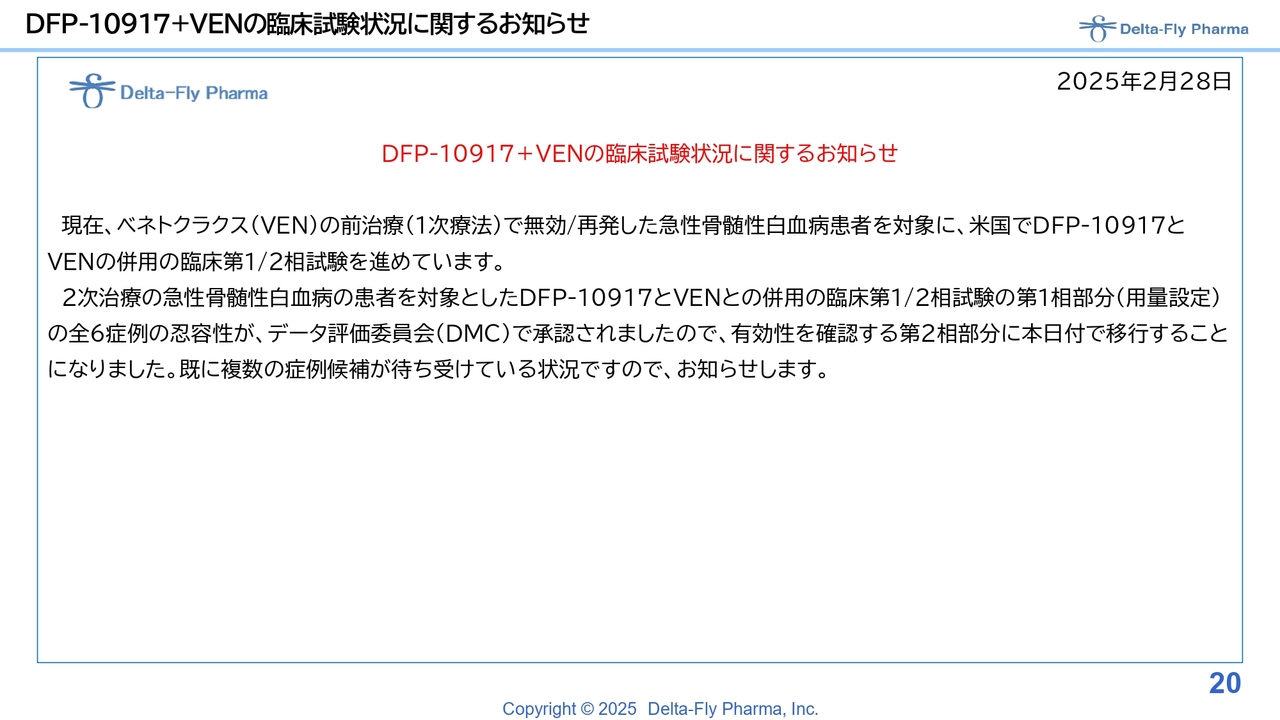
その状況は、こちらの2025年2月28日付のプレスリリースでご覧いただけます。「ベネトクラクス」の1次療法を終わった患者さまを対象にして、「DFP-10917」と「ベネトクラクス」の併用の臨床第1相試験/臨床第2相試験を進めています。
臨床第1相試験では、比較的早く6例の忍容性が認められたということで、データ評価委員会でも承認いただき、このプレスリリースの時点では、複数の症例が待ち受けている状況だとご説明しました。その後、かなりの数の患者さまに症例登録していただき、データも良さそうな様子です。解析結果が出次第、またご説明したいと思います。
研究開発~DFP-14323
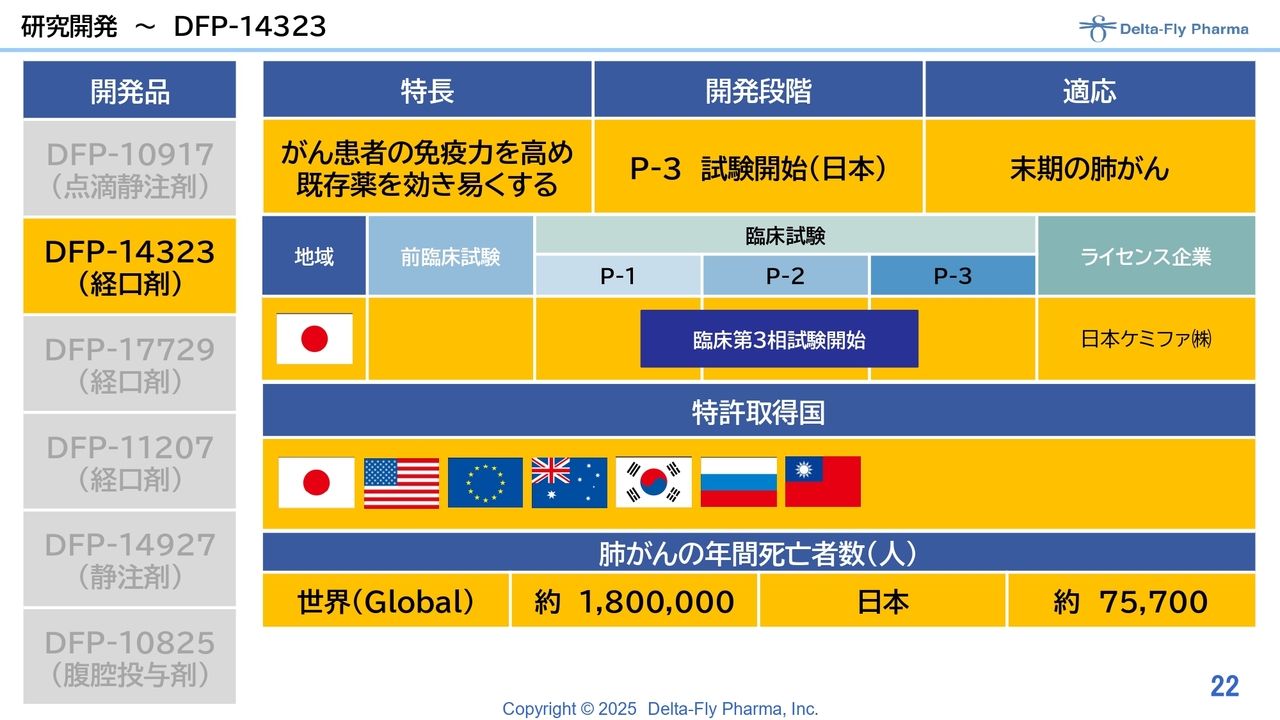
「DFP-14323」は、がん患者さまの免疫力を高めて、既存薬を効きやすくするという経口剤で、昨今注目されている「オプジーボ」等の免疫療法剤とはメカニズムが違います。もともと別の企業の努力によって、がんの患者さまの免疫力を高めて状態を良くするというデータが出ていましたので、当社としては、これで肺がんの大きな市場で戦える可能性があるのではないかと考え、今、日本のファンドの一部について日本ケミファにバックアップしていただいて、スライドに示した状況で開発を進めています。
DFP-14323 日本における肺がんの状況
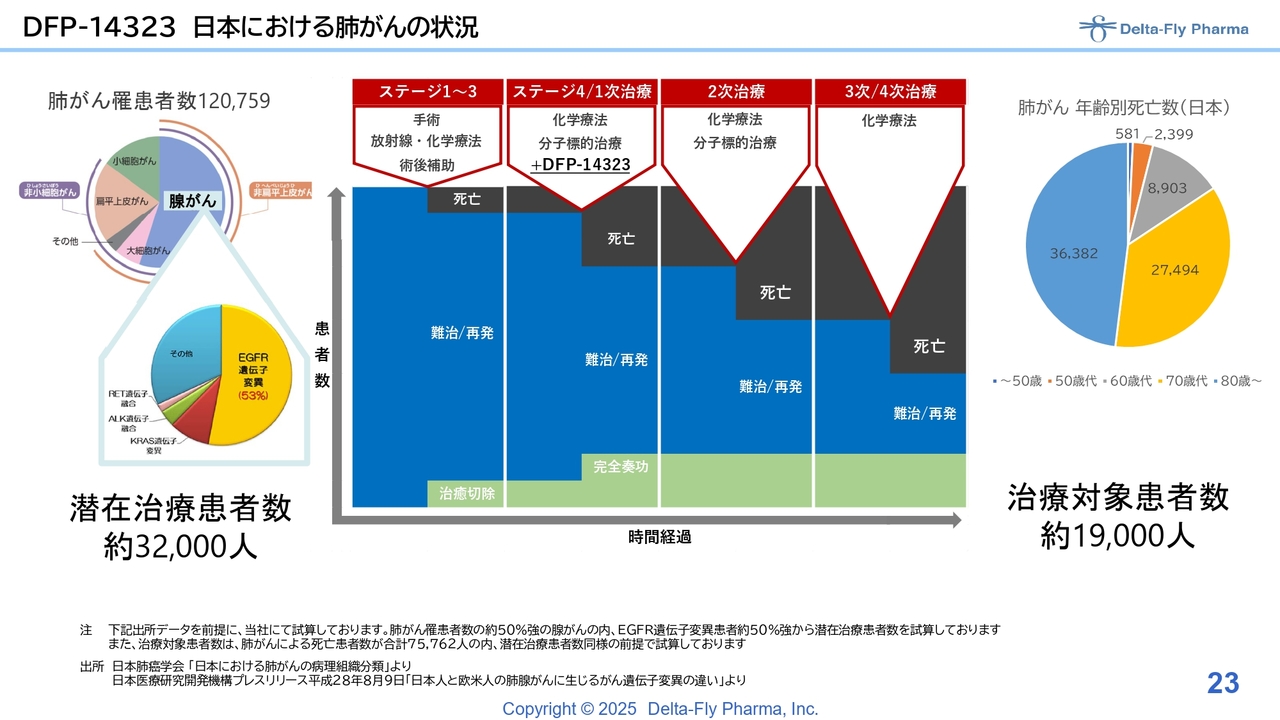
「DFP-14323」については、ステージ4の1次治療の対象薬として、既存の分子標的薬との併用で、肺がんの臨床試験を進めています。
DFP-14323の臨床第3相比較試験に関するお知らせ

「DFP-14323」の臨床第3相比較試験の内容についての、2024年11月26日のプレスリリースです。「上皮成長因子受容体(EGFR)遺伝子変異陽性Uncommon mutation」とありますが、common mutationと比べるかなりレアな症例ということで、最初は我々もちゅうちょしていました。その後、「肺癌診療ガイドライン」で、このUncommon mutationの非小細胞がん(NSCLC)は、「オシメルチニブ」よりも「アファチニブ」が強く推奨される治療薬として認定されたということで、その影響を受けて、症例登録が予定どおり進んでいます。
(ご参考)研究開発~DFP-14323 臨床第3試験の施設紹介
「DFP-14323」の臨床第3相試験を行う施設はスライドの全30施設で、日本全体でこの臨床試験が進んでいます。
研究開発~DFP-17729
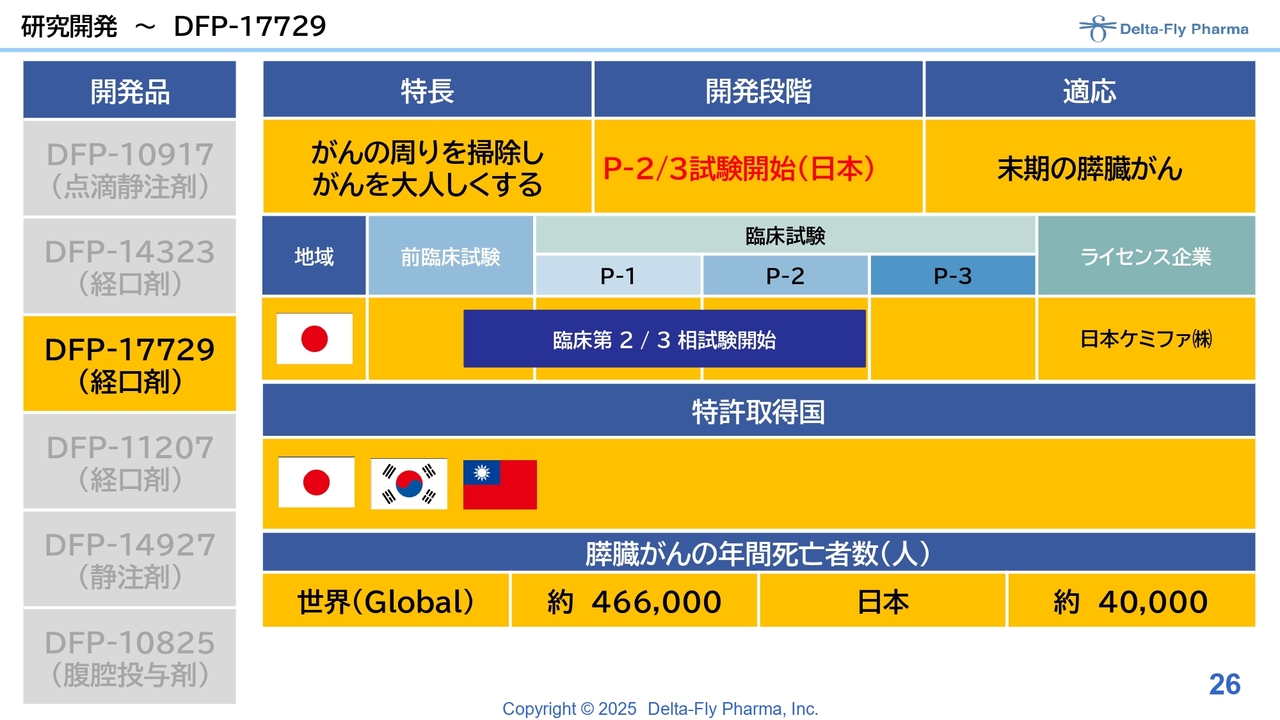
「DFP-17729」は、先般、臨床第2相試験/臨床第3相試験に入りましたので、ご説明します。
研究開発~DFP-17729 日本における膵臓がんの状況
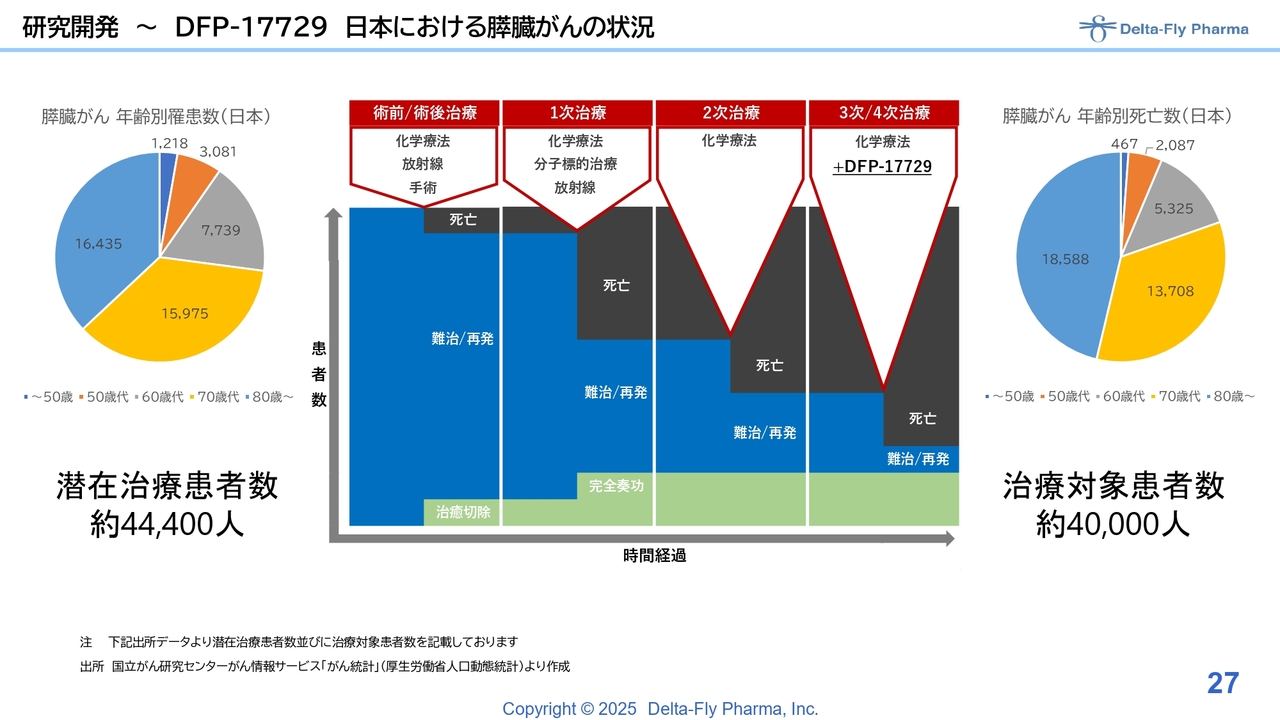
「DFP-17729」は、既存の化学療法がなかなか効かない、ないしは再発した膵臓がんの患者さまのための経口剤です。特に3次/4次治療の薬剤はまったくないため、既存の化学療法剤との併用で、この薬剤の開発を進めています。
DFP-17729の開発状況に関するお知らせ
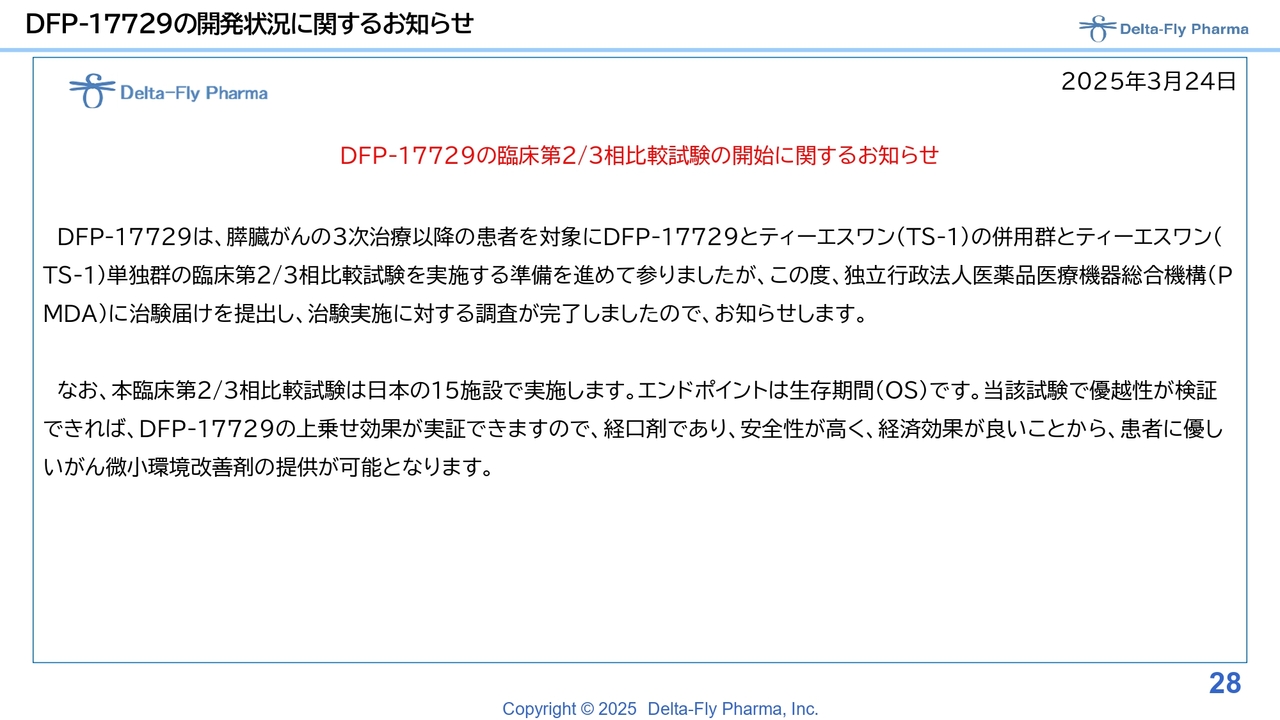
「DFP-17729」の臨床第2相試験/臨床第3相試験については、スライド28ページの上段にあるように、基本的には臨床第1相試験/臨床第2相試験のデータを踏まえて、層別解析の結果が良かったため、日本国内の15施設で臨床第2相試験/臨床第3相試験を実施する運びとなりました。
DFP-17729の欧州臨床腫瘍学会 消化器癌会議(ESMO GI)2024の年次報告会で発表

臨床第2相試験/臨床第3相試験が実施できる運びとなったバックグラウンドには、先般の欧州臨床腫瘍学会の消化器癌会議(ESMO GI)で、臨床第1相試験/臨床第2相試験の結果を発表したところ、脚光を浴びたという出来事があります。
「DFP-17729」と、既存の抗がん剤「TS-1」の併用療法における、層別解析後の生存期間の中央値は9.0ヶ月となり、「TS-1」単剤療法の6.1ヶ月と比べると大きく伸びています。この結果をベースにして、PMDAから、臨床第2相試験/臨床第3相試験を実施してもかまわないと了解をいただいています。
研究開発~DFP-11207

「DFP-11207」については、製剤そのものはかなり前から製造準備していました。新型コロナウイルス感染症の影響もあった中で、米国での臨床第1相試験で安全性の高いデータがせっかく出ているため、日本でなんとか開発できないかと取り組んでいます。
研究開発~DFP-11207 日本における膵臓がんの状況
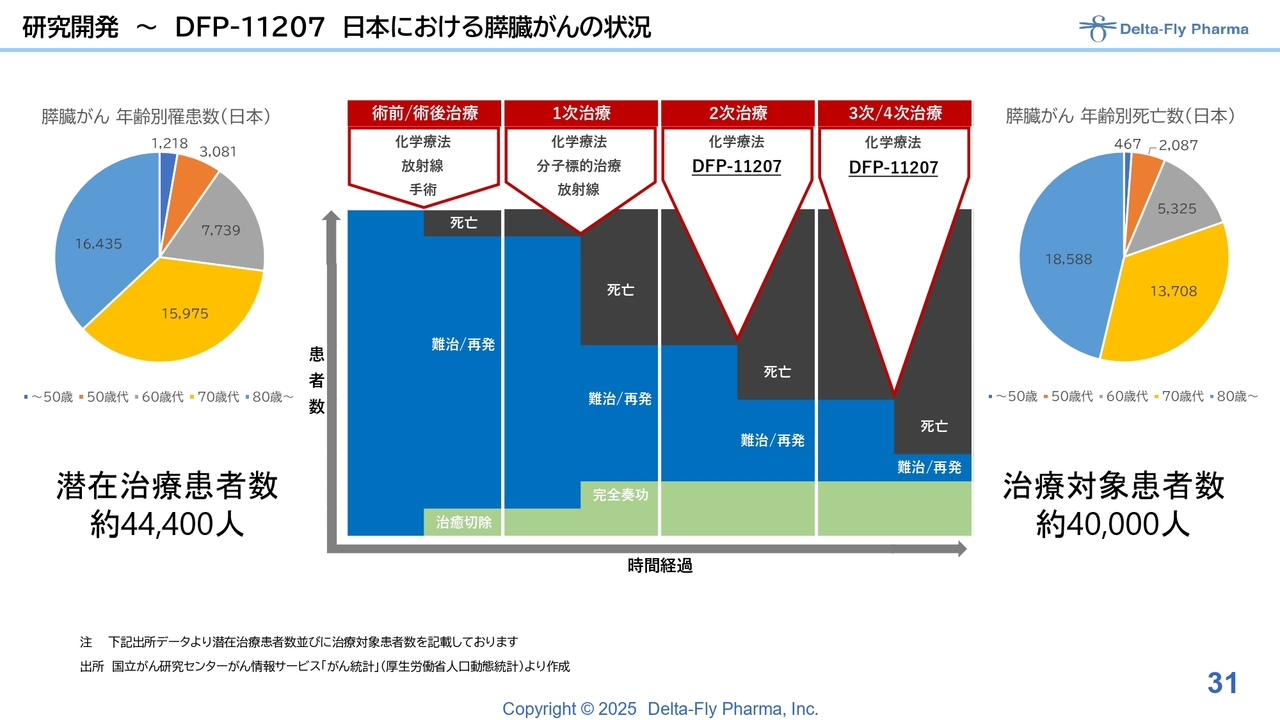
「DFP-11207」は、2次治療、および3次/4次治療の膵臓がんの患者さまを対象にして実施する予定です。
(ご参考)研究開発~FP-11207の臨床第1相試験での安全性確認

スライドの右上の表に、米国での「DFP-11207」の臨床第1相試験の結果を載せています。安全性の高いデータとなっており、副作用も少なく、抗腫瘍効果が認められ、延命効果が期待できます。米国のMDアンダーソンがんセンター(MDACC)で実施したデータをもとに、今後、新たな展開をする予定です。
研究開発~DFP-14927

「DFP-14927」は「DFP-10917」のDDSで、週1回投与であれば、血液がんの患者さまだけではなく固形がんの患者さまにも活用していただける可能性があることから、固形がんを適応の対象にしています。
臨床第1相試験の用量設定試験はすでに終わり、今は前期臨床第2相試験部分を拡大臨床第1相試験という位置づけで、末期の大腸がんの患者さまを対象に実施しています。
DFP-14927の拡大臨床第1相試験の進捗状況について
こちらに、「DFP-10917」関係のまとめを記載しています。「ベネトクラクス」との併用試験は順調に進んでいます。また、「DFP-10917」単剤は臨床第3相試験の中間解析の真っただ中です。そして、先ほど申し上げたとおり、「DFP-10917」のDDSということで「DFP-14927」の開発も進めています。
(ご参考)DFP-14927の基礎試験における抗腫瘍効果 欧州の薬理系科学雑誌「Eur J Pharmacol」に掲載
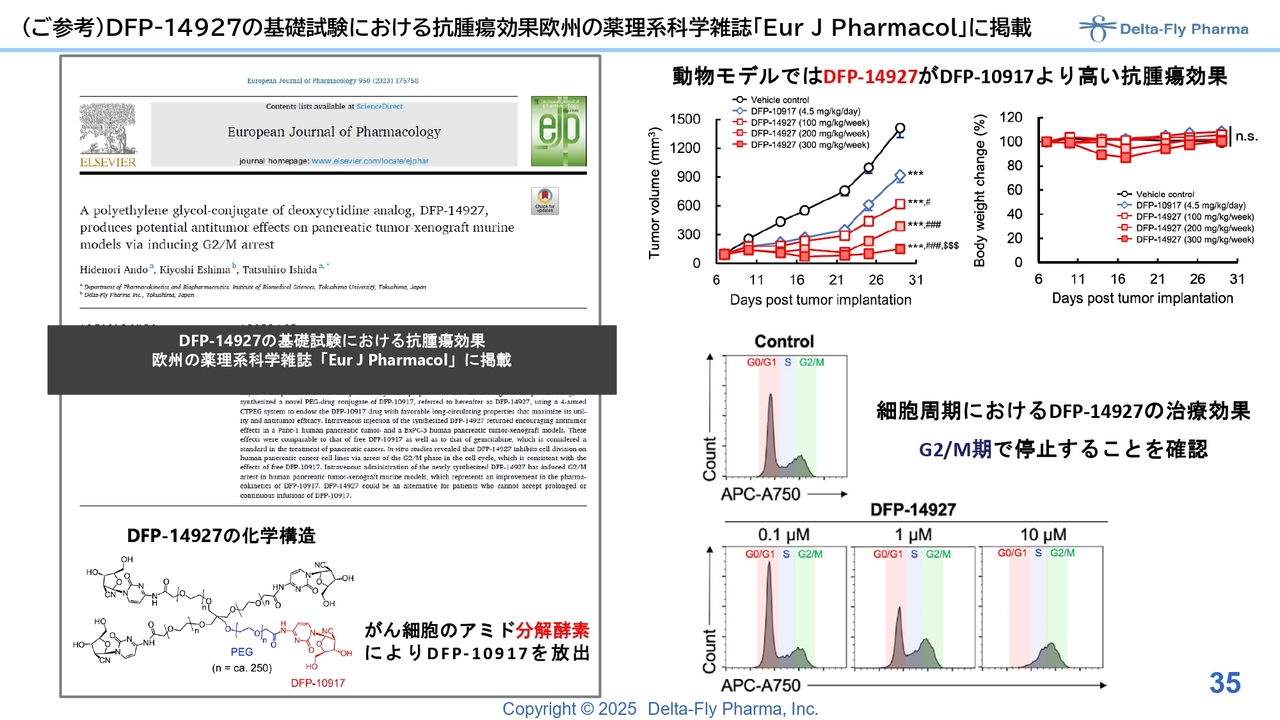
「DFP-14927」の動物試験の結果は、こちらに示したとおりで、非常に良いデータが出ています。
研究開発~DFP-10825
「DFP-10825」はいわゆる核酸医薬と言われる物質で、がん患者さまの腹水を止める腹腔内投与製剤です。腹膜播種転移となった胃がん、卵巣がん、または膵臓がんの患者さまは、症状として腹水が出やすくなります。このような患者さまに対して、腹水を止める、ないしは減らすという効果が期待できる薬剤です。
(ご参考)DFP-10825のRNA干渉による抗腫瘍効果の総説薬学系雑誌「Adv Drug Delivery Rev」に掲載
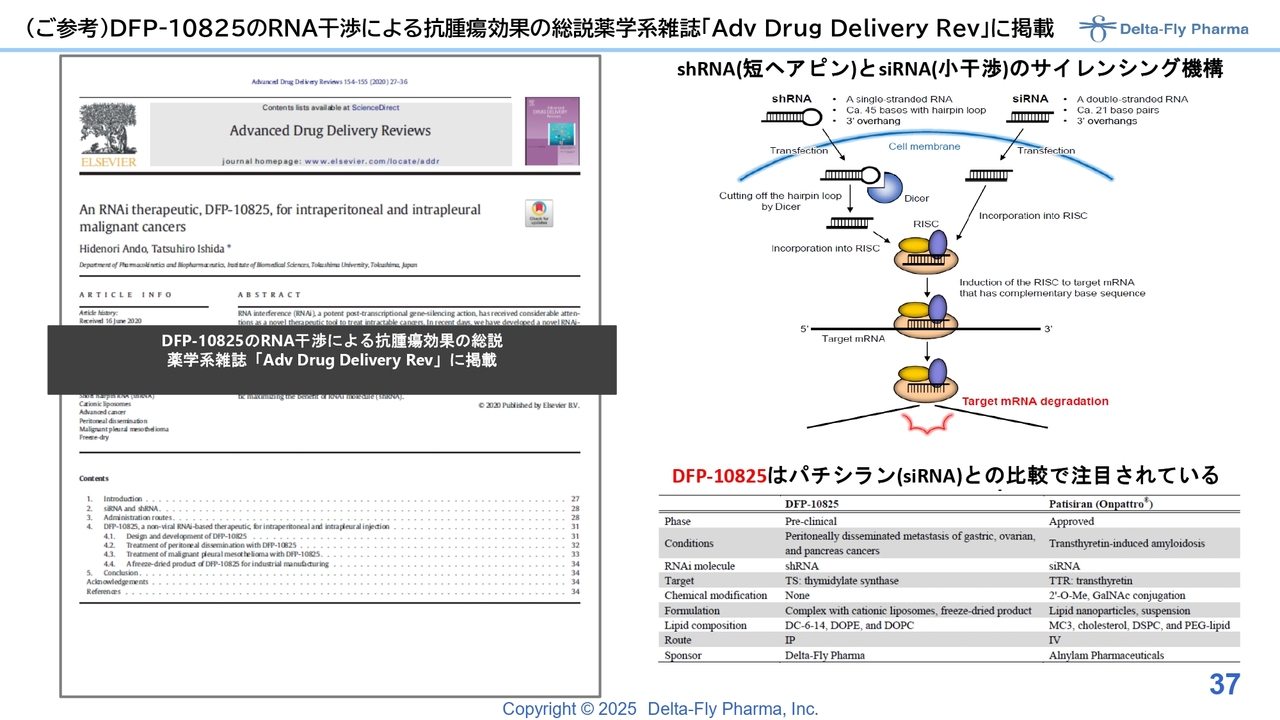
このスライドは、技術的になかなか説明しづらい内容ですが、「DFP-10825」はRNA干渉を活用した抗がん剤です。
質疑応答:「DFP-10917」と「ベネトクラクス」との併用試験における提携状況について
質問者:「DFP-10917」について、米国の単剤の臨床第3相試験も進捗し
新着ログ
「医薬品」のログ