協和キリン、北米での増収や「ロミプレート」の適応拡大等主要アイテムの売上増加で2Qは増収増益
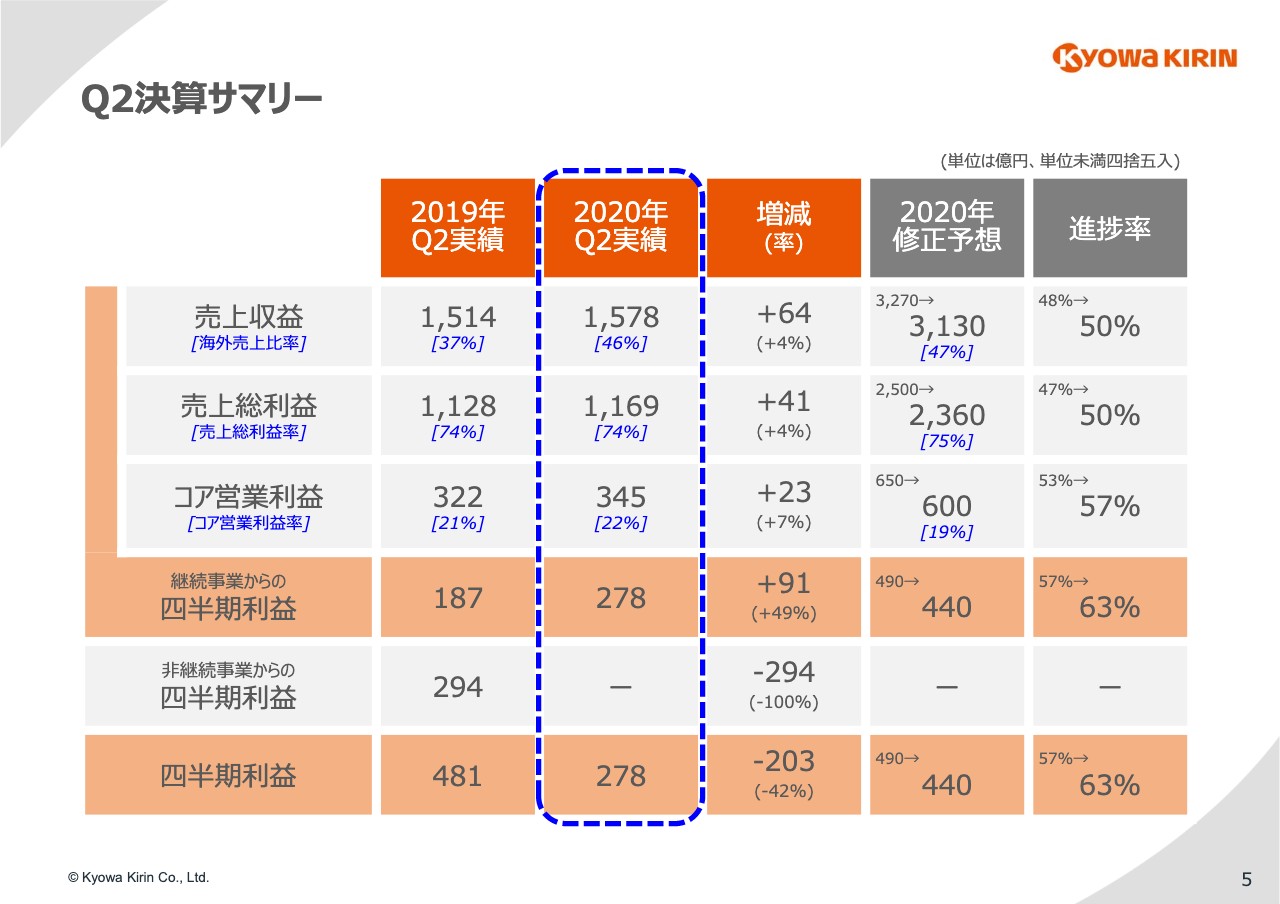
Q2決算サマリー
宮本昌志氏:みなさま、おはようございます。ご参加ありがとうございます。まず、この場をお借りしまして、最近の水害に遭われて亡くなられた方々のご冥福をお祈りしますとともに、被害に遭われた方々に心からお見舞い申し上げます。また、1日も早い復旧をお祈りしております。
加えまして、新型コロナウイルス感染により亡くなられた方々のご冥福をお祈りするとともに、この状況下に懸命にご対応いただいております医療関係者のみなさまを含め、関係の方々の努力に心から感謝したいと思います。
それでは、私から2020年12月期第2四半期の決算についてご報告を申し上げます。5ページのスライドで全体のサマリーをご紹介します。
1月から6月の累積実績は、売上収益が1,578億円で4パーセントの増収、コア営業利益が345億円で、7パーセントの増益です。医薬事業の四半期利益は278億円で、49パーセントの増益となりました。
日本では薬価改定があり、またご存知のように「ネスプ」の特許切れに伴う「ネスプ」AGの発売、さらに「ネスプ」のBSの参入、またグローバルでは新型コロナウイルスの感染の蔓延など、経営環境的には厳しかった上半期ですが、医薬事業でこのように増収増益を達成することができたという点では非常に満足しています。
一方で、通期の計画に対しての進捗で見ると、新型コロナウイルスの影響でやや遅れているところがあります。
その点を加味して、この期央のタイミングで業績予想のアップデートをすることになりました。修正額についてはスライドにお示ししているとおりです。
売上収益で140億円、4パーセント、コア営業利益で50億円、8パーセント、そして当期利益で50億円、10パーセントの下方修正です。この想定は今の状況がこのまま年末まで続くという前提のもとで出しています。従って、とくに新型コロナウイルスの影響が大きく変化した場合は、これも大きく変わることになると思っています。
それではこの後のスライドで、前年同期との比較および計画の修正内容についてご説明していきます。
前年対比分析~売上収益~
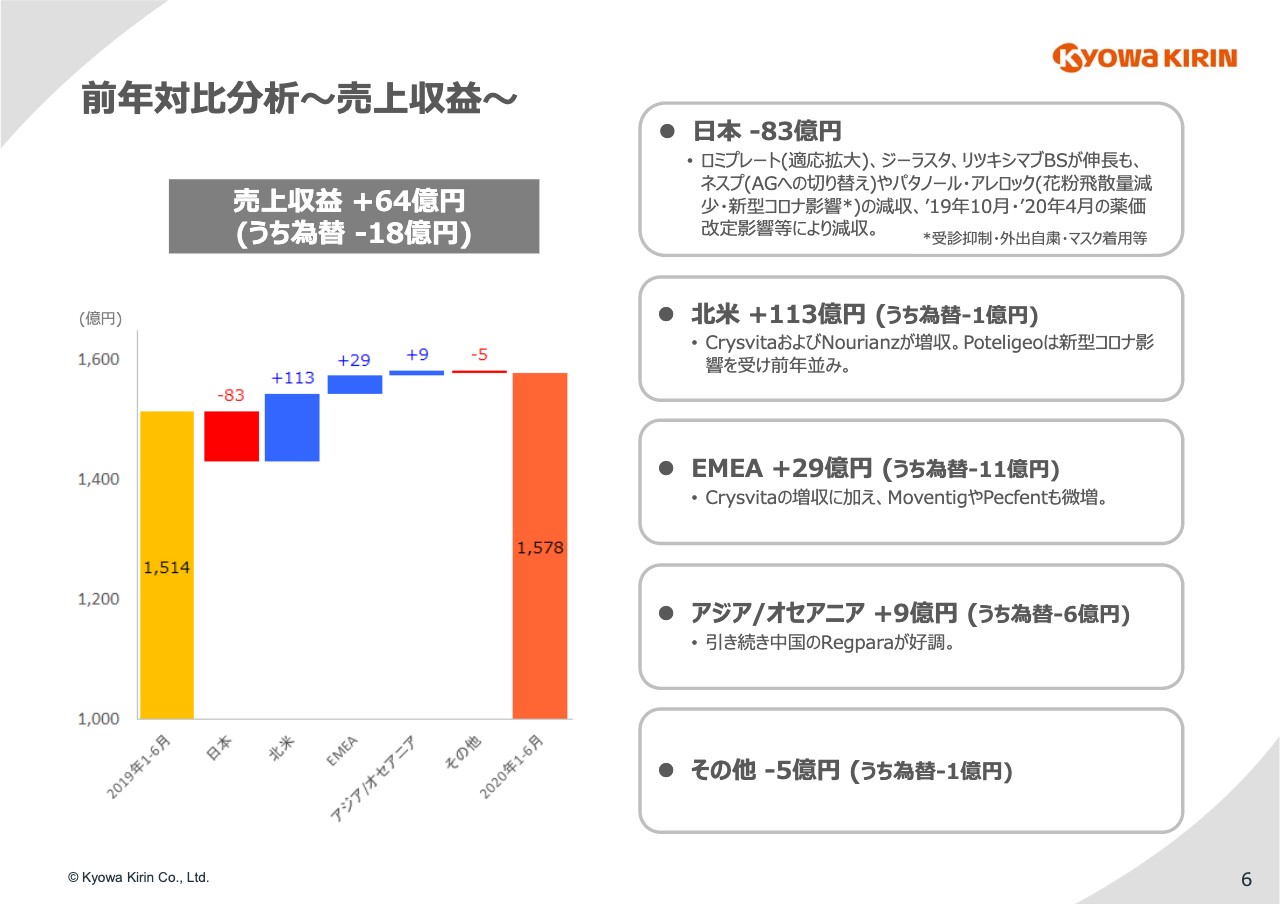
6ページをご覧ください。まず、売上収益の前年対比分析です。日本は、先ほどお話ししたような環境に加えて、今年は花粉の飛散が非常に少なかったため、83億円の減収になっています。
一方で、北米とEMEAに関しては、グローバル産製品が着実に伸長したため北米で113億円、EMEAで29億円の増収を確保しました。
アジア/オセアニアも比較的順調で、とくに中国の「Regpara」が好調です。これに伴い9億円の増収ということで、トータルで64億円の増収を確保しました。
主要アイテムの売上収益(日本)
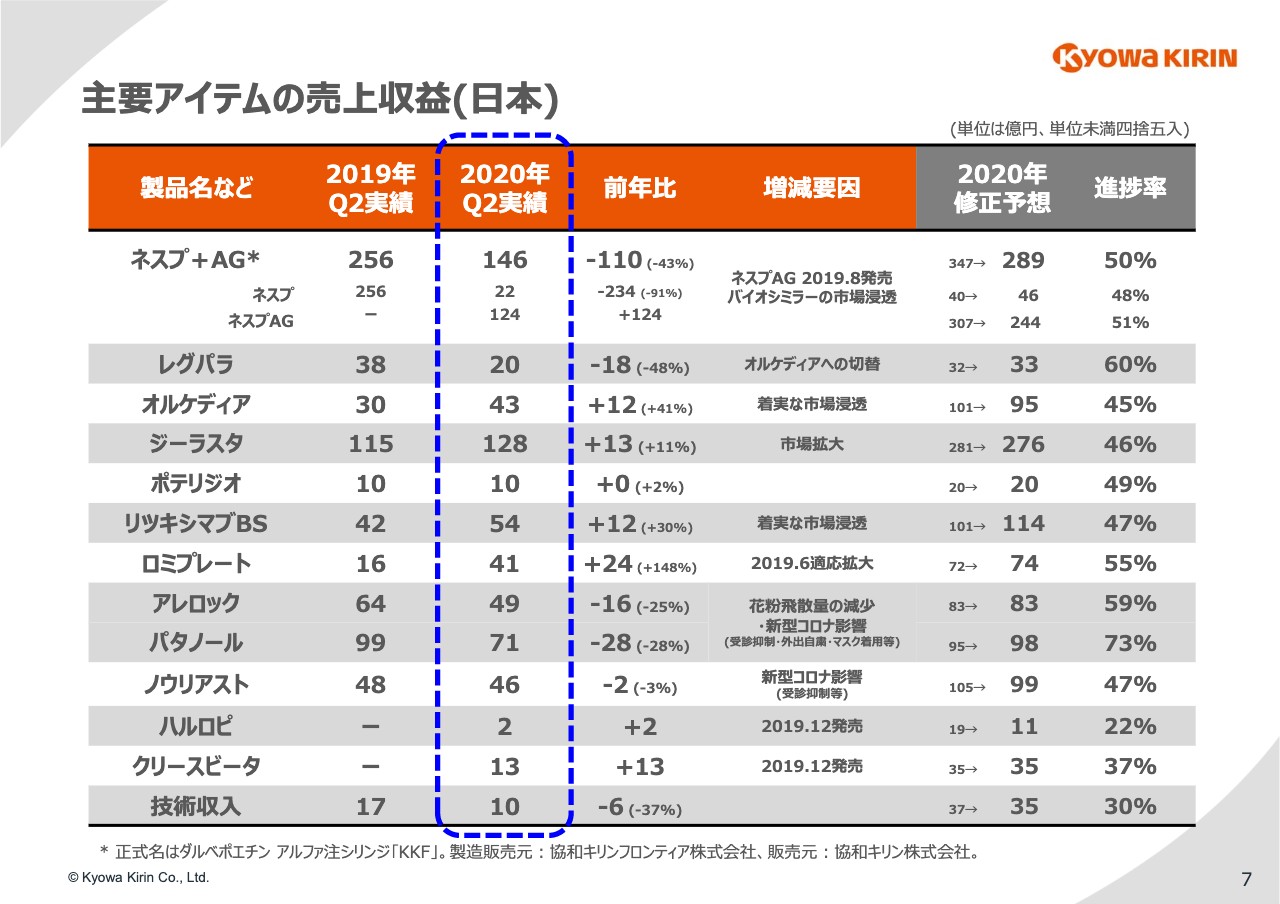
7ページでは製品別にご覧いただきます。まず日本では、「ネスプ」と「ネスプ」のAGの合計で110億円、43パーセントの減収となりました。これはもちろん「ネスプ」の特許切れに伴うAGの発売が大きなポイントです。
加えて、他社のバイオシミラーの攻勢を受けており、シェアをそこで奪われるという状況が出てきています。こういった状況を鑑み、通期計画に対しては60億円ぐらいの下方修正をしました。
「リツキシマブBS」「ジーラスタ」「ロミプレート」については、引き続き成長を続けていますが、通期計画には若干の調整を入れました。
「アレロック」「パタノール」は先ほどご説明したような状況で、対前年で大きくマイナスです。「ノウリアスト」は、ここも少しコロナウイルスの影響が出ていると思われますが、若干の減収となっています。
それから「クリースビータ」は、発売直後の第1四半期には若干立ち上がりが心配でしたが、第2四半期まで見ると順調に伸びてきており、これは計画の範囲で動けるのではないかと想定しています。
主要アイテムの売上収益(海外)
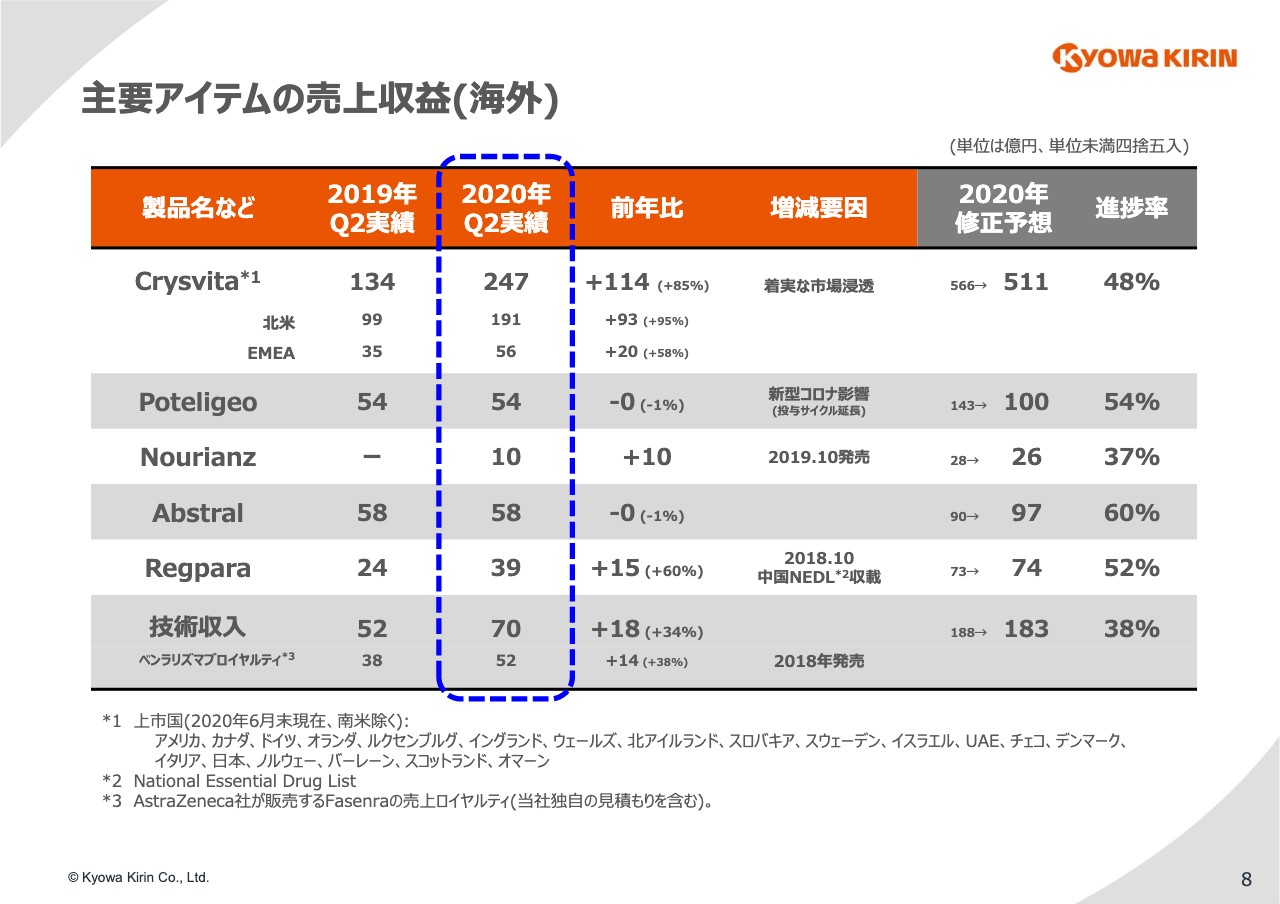
続いて、海外製品です。8ページをご覧ください。「Crysvita」ですが、ご覧のとおり着実に市場に浸透しており、前年比プラス85パーセントと成長しています。
一方で、新型コロナウイルスの感染蔓延の影響が少しずつ出てきており、欧米ではどちらにおいても新規関連の増加がやや鈍っている状況です。
また、とくに欧州で、当局の都合等により薬価交渉等が遅れているところもあって、発売国がまだ年初の予定より少ないということも影響しています。
一方で、既存患者については新型コロナウイルスの影響をほとんど受けておらず、投与をはじめた患者については順調に投与を続けています。
おそらく今朝、Ultragenyxの発表でもあったかと思いますが、ほとんどの患者がステイで治療を続けているということになります。
このような状況を見て、年初計画で566億円と見ていたところを、10パーセントほど下方修正して511億円を目標とすることにしました。
発売国に関しては、スライドの脚注「1」に出ていますが、第2四半期と第1四半期を比べると、スコットランドとオマーンが増えています。スコットランドは実は第1四半期には既に発売しており我々のミスですが、スコットランドとオマーンが新しく加わったということです。
「Poteligeo」については、やはり新型コロナウイルスの影響を受け、昨年とほぼ同じレベルの売上収益となりました。
NCCNのガイドライン等いくつかのガイドラインで、COVID-19すなわち新型コロナウイルスの感染リスクと治療のベネフィットのバランスを見た上で、来院頻度や投与間隔を少し延ばすことを考えるようレコメンデーションが出ました。それを受けて、投与間隔が若干延びており、その影響が出ています。
また、これも「Crysvita」と同じですが、ヨーロッパの国々で年初で予定していたより発売が遅れるところが出てきており、通期の見通しとしては43億円の下方修正をすることになりました。
「Nourianz」に関しては、第1四半期でもご説明しましたが、今のところアメリカの先生方から非常に高い評価を受けており、計画でもほぼインラインで進捗しています。
しかし、新規患者の獲得という面では、少しコロナウイルスの影響が出ており、通期見通しとしては若干の下方修正を入れたということになります。
「Regpara」は中国で引き続き好調です。
それから技術収入については「ベンラリズマブ」の販売ロイヤルティが増加しています。こういった売上収益の結果を踏まえて、コア営業利益の前年対比分析を次の9ページでご覧いただきます。
前年対比分析~コア営業利益~
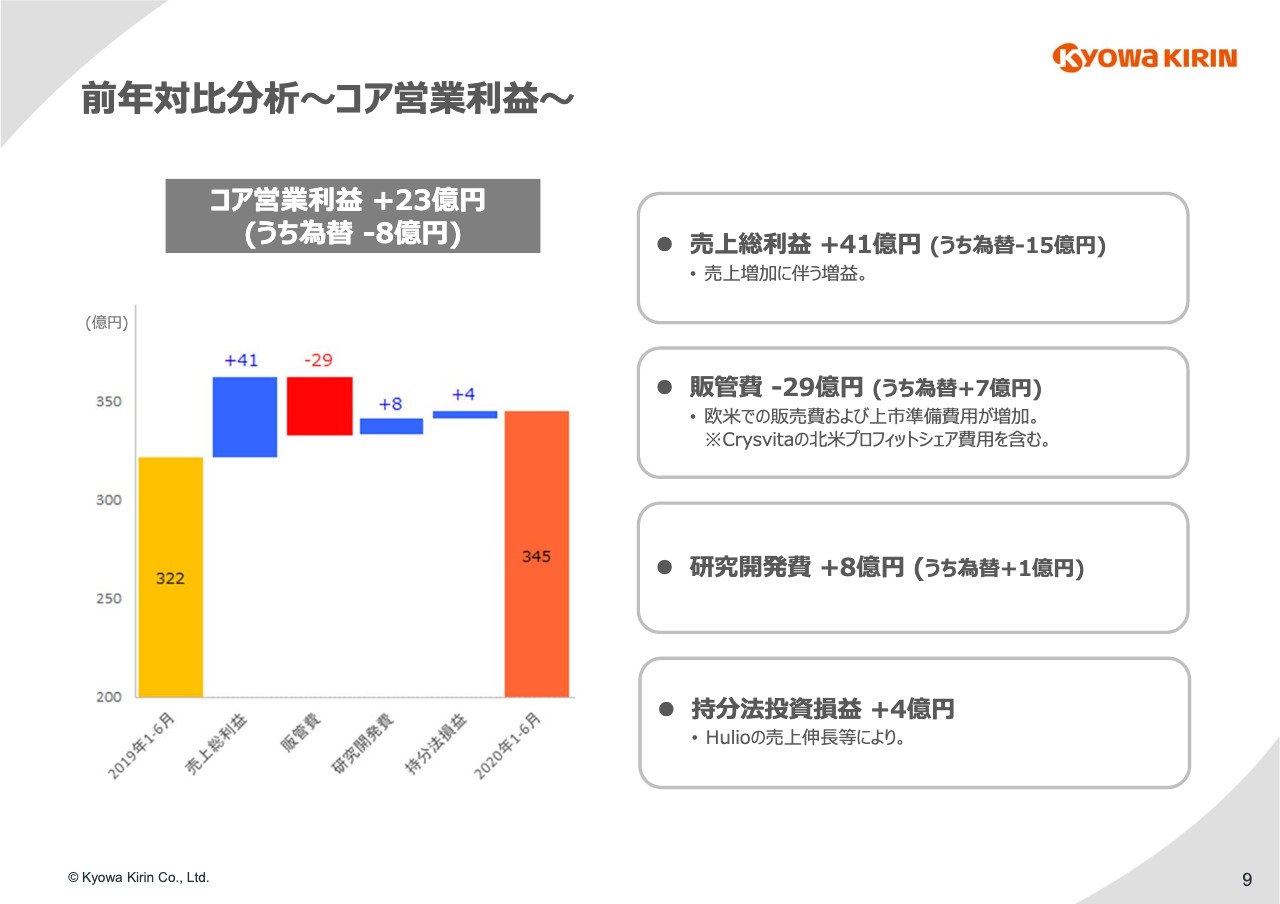
売上総利益については、売上収益が64億円増加したのを受けて41億円の増益です。販管費が29億円増加して減益要因となっていますが、これは例の北米の「Crysvita」のUltragenyxとのプロフィットシェア支払いが入ったということです。それから加えて、海外での発売準備費用等が増加した結果です。
一方、研究開発費は若干減少して増益要因となっています。それから持分法投資損益の部分は若干のプラスでして、トータルとして、営業利益は23億円の増益となりました。
前年対比分析~四半期利益~
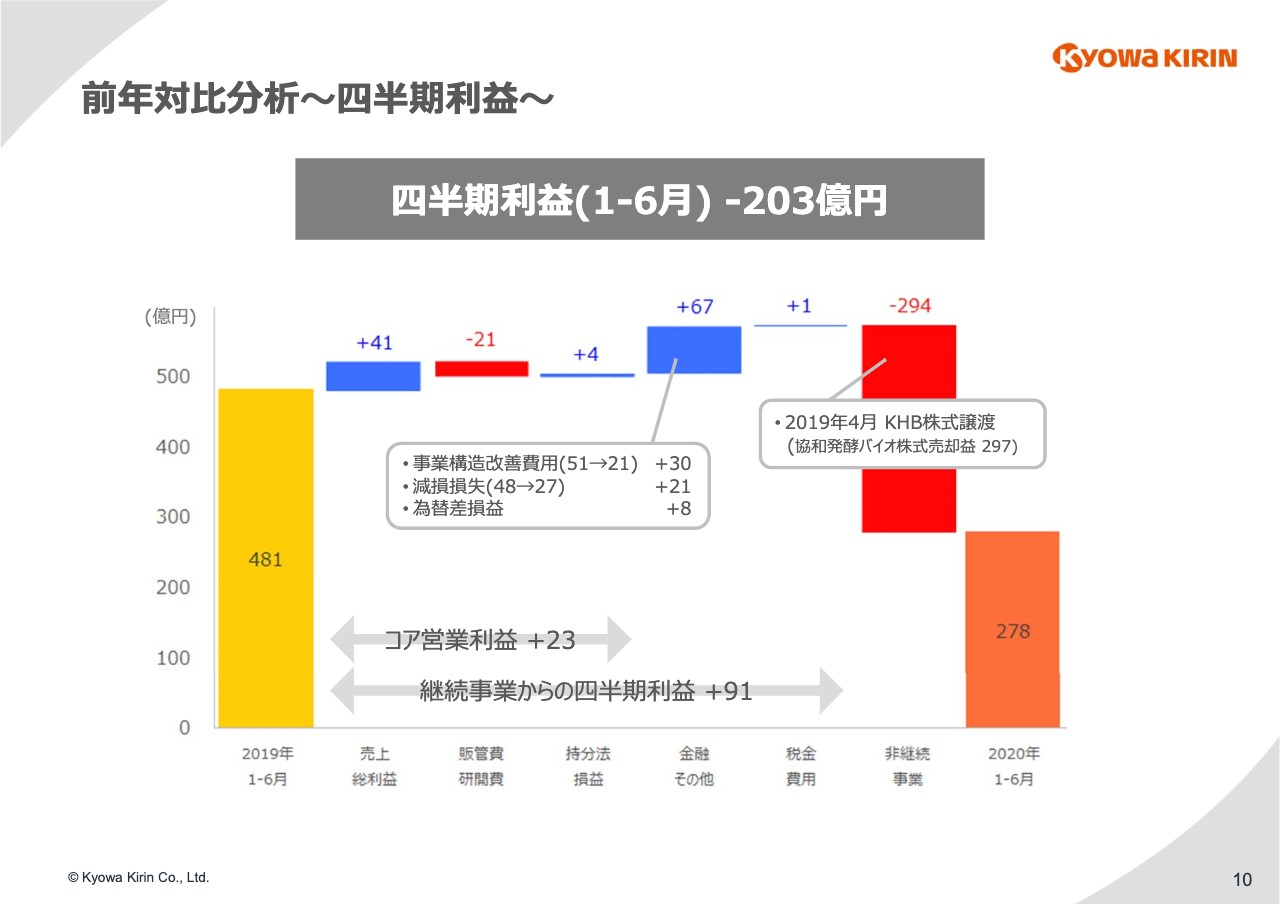
金融関連及びその他の収益費用ですが、スライドの吹き出しに記載のとおりです。事業構造改善費用は30億円減少ですが、これは昨年はご存知のとおり国内の希望退職に関わる特別退職金などの51億円があったためです。
今年の分は、EMEAの統括子会社で大きく事業の構造変革をはじめており、そのための改善費用です。
それから減損損失が21億円減って、これも増益要因となっています。
昨年の減損はヨーロッパで導入した「Moventig」という薬の減損でした。
今年は、既に3月に、我々の導入元であるSyndaxが、乳がんの薬である「KHK2375」すなわち「Entinostat」についてフェーズ3が失敗したと発表しました。これを受け我々が開発を続けていく可能性が極めて低くなったということで、減損を入れました。
それから為替の影響が8億円ぐらいの増益要因です。税金費用については第1四半期にイギリス子会社の繰延税金資産を積み増ししたため、前年並みです。
非継続事業については、昨年あった協和発酵バイオの株式譲渡益約300億円が今年はないということで、1月から6月の着地としては203億円の減益になりました。
新旧業績予想対比分析
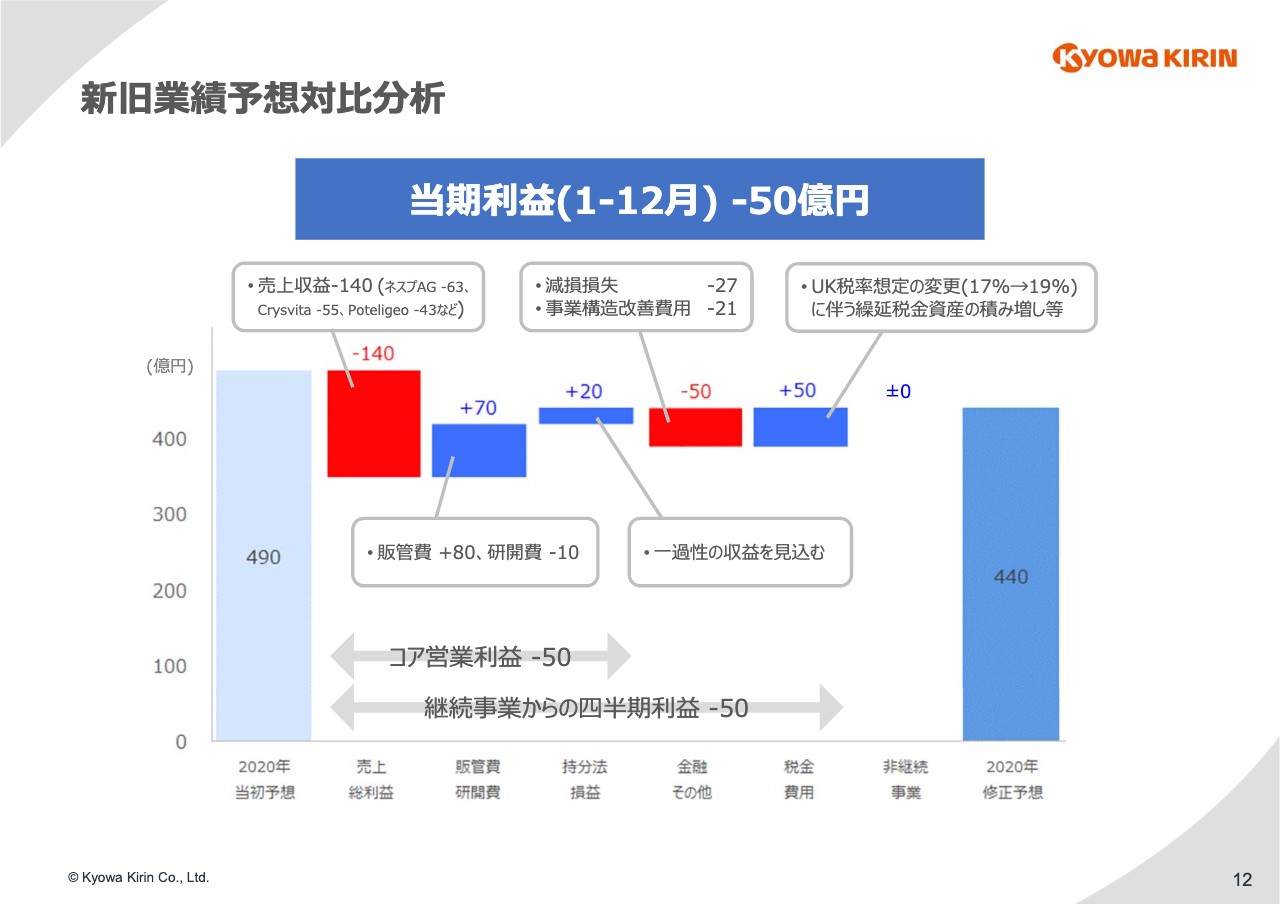
12ページは業績予想についてです。冒頭でご説明したような状況で、売上収益を4パーセントマイナス、それをカバーするかたちで販管費、研開費のところは70億円をプラス要因として入れました。
コロナウイルスの影響で活動がかなり抑えられているため、そこでかなりプラスを出しています。それに加えてコストをしっかりコントロールするということで、販管費プラス80億円が入っています。
一方、研開費は年初予定していなかった新しい開発がはじまるため、マイナス10億円と入れています。それから、持分法の損益のところでは一過性の収益を新たに見込んで20億円の上方修正です。これらの結果、コア営業利益でマイナス50億円、8パーセントの下方修正になりました。
金融その他のところは、減損損失や事業構造改善費用が発生して、50億円の下方修正です。一方、税金費用のところは、先ほどご説明したイギリス子会社の繰延税金資産の積み増しも反映して、50億円の上方修正をしました。
当期利益の下方修正50億円の内訳はこのようになっています。下方修正ということで、投資家のみなさまには大変ご迷惑をおかけすることになるかと思いますが、ご理解をいただければと思います。
2020年第2四半期のトピックス

それでは、第2四半期におけるR&Dの進捗について簡単にご説明します。14ページには4月から6月の間に発生したイベントのうち、主なものを記載しています。
まず、1点目ですが、「KRN23」のXLHを適応症とした販売承認を香港で取得しています。この他、中国、韓国でも今レビュー中ですので、そちらについても近いうちにご報告ができればと期待しています。
2つ目、3つ目はいずれも学会の発表についてで、「ME-401」と「KHK7791」です。この後、簡単にご説明します。4つ目、5つ目は中国における販売承認を得たという話で、まず「ネスプ」(KRN321)は腎性貧血を適応症として承認を受け、「ルミセフ」(KHK4827)は乾癬を適応症として承認をいただいています。最後は「クリースビータ」(KRN23)ですが、これはアメリカで腫瘍性骨軟化症を適応症とした追加承認を得たということです。
ME-401:B細胞悪性腫を対象としたフェーズ1b試験の結果
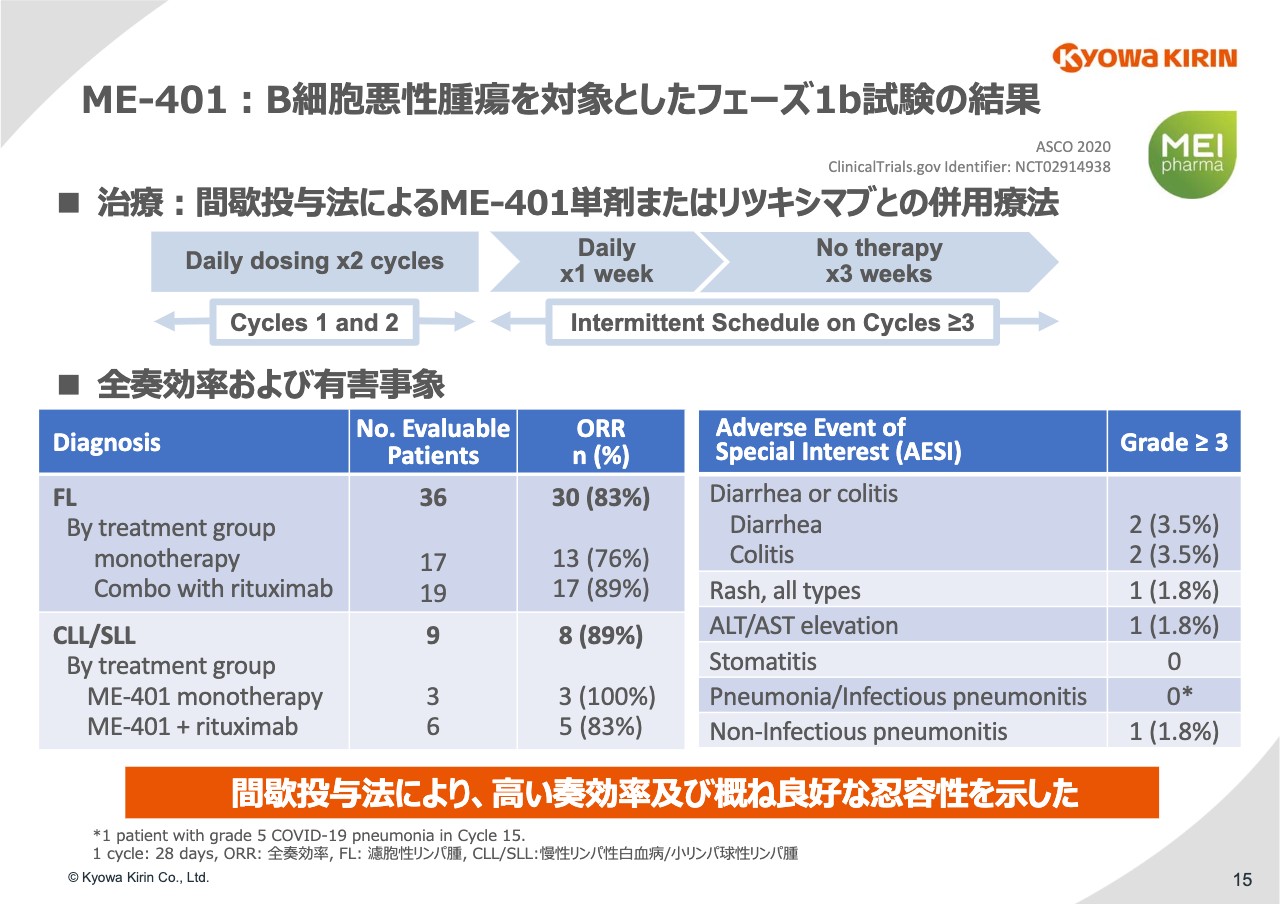
次の15ページは「ME-401」のフェーズ1bの概要と結果です。再発または難治性のB細胞悪性腫瘍の患者57名を対象として、「ME-401」単剤もしくは「リツキシマブ」との併用で間歇投与を行ないました。
プライマリーエンドポイントになるのは全奏効率すなわちORRですが、FLでは83パーセント、CLL/SLLでは89パーセントという高いORRを得ています。
また、ご存知のように本来のモードアクションからいうと副作用が気になるところですが、この薬物でこういったスケジュールで通したところ、有害事象による中止例は7パーセント、つまり57名のうち4名が中止しただけにとどまったということでした。
高い奏効率と良好な忍容性を示すことがわかったということを学会で発表しています。
ME-401:再発/難治性の濾胞性リンパ腫患者を対象としたフェーズ2 TIDAL試験

次のスライドは、現在フェーズ2をMEI Pharmaが行なっているTIDAL試験についてです。日本試験では記載のような患者を対象として単剤の間歇投与法による治療効果を調べています。
デザインは先ほどご説明したものとほぼ同じで、120例のエントリーを目標としてグローバルで試験を行なっています。プライマリーエンドポイントは全奏効率です。
これは本年4月にプレスリリースが出ていますが、FDAからファスト・トラックの指定を受けており、もちろん試験の結果次第ですが、結果がよければこの試験の結果をFDAに提出し迅速承認(accelerated approval)を目指します。
また、今後MEI Pharmaと共同で、本剤と他剤との併用を含めて、さまざまなB細胞悪性腫瘍における有用性を広く評価するように開発を進めるプランを作っています。
もちろん結果次第ですが、うまくいけば非常に大きな製品に育ってくれるのではないかと期待しています。
KHK7791:Ph2試験(リン吸着薬からの切替え試験)デザイン
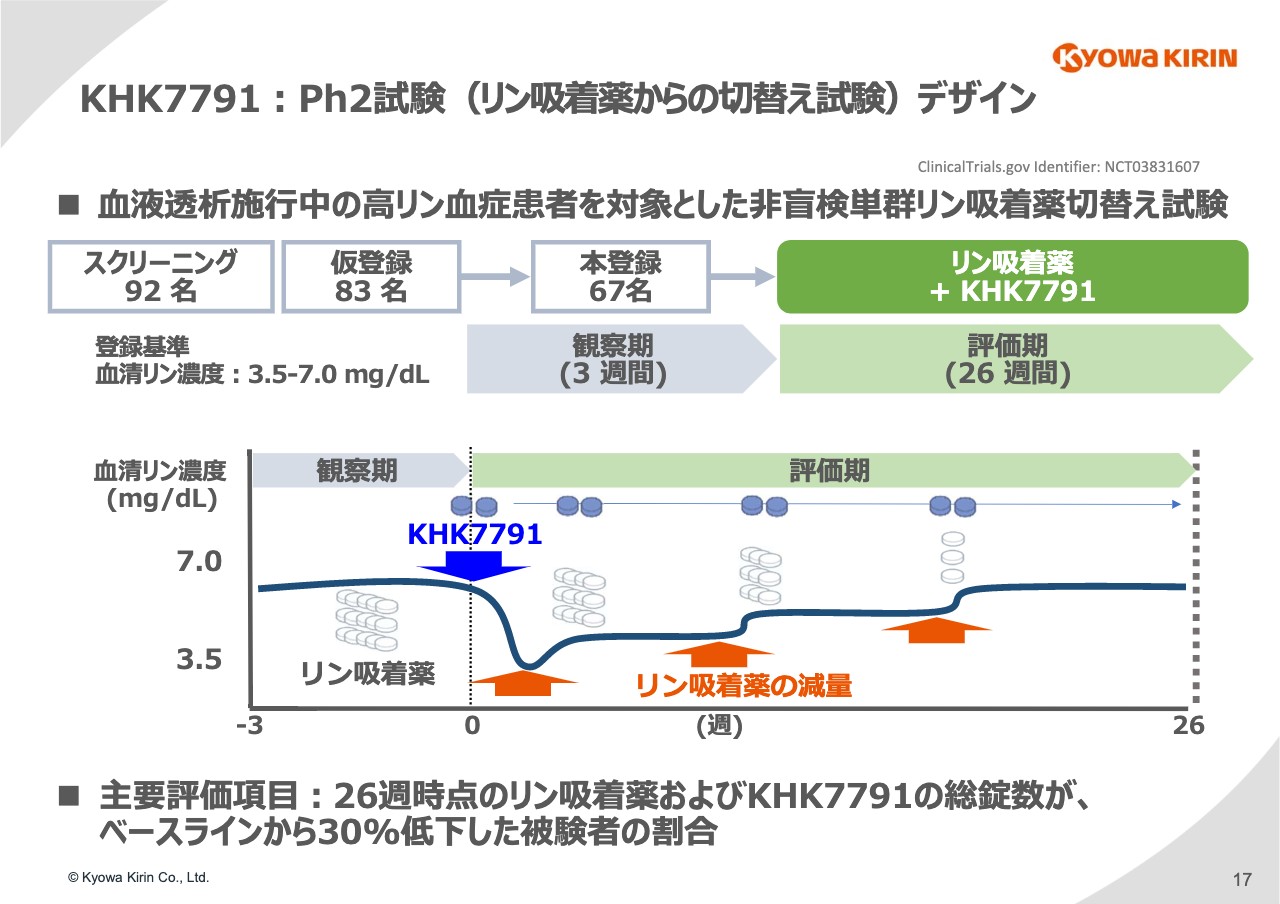
17ページは「tenapanor」のフェーズ2の試験の概要を示しています。「tenapanor」に関しては、国内でフェーズ2を3本行なっており、そのうちの1本のリン吸着薬からの切替え試験についてご説明します。
ご存知のように、リンが高い透析患者はかなりの錠数のリン吸着薬を飲んでいます。そのような患者が「tenapanor」を使うことによって、どれだけリン吸着薬の錠数を減らすことができるかという試験を行ないました。
「tenapanor」は1日2錠飲んでもらい、その後、リン吸着薬を徐々に減薬していくというプロトコールで行ない、26週目で結果を見ました。
KHK7791:Ph2試験(リン吸着薬からの切替え試験)結果
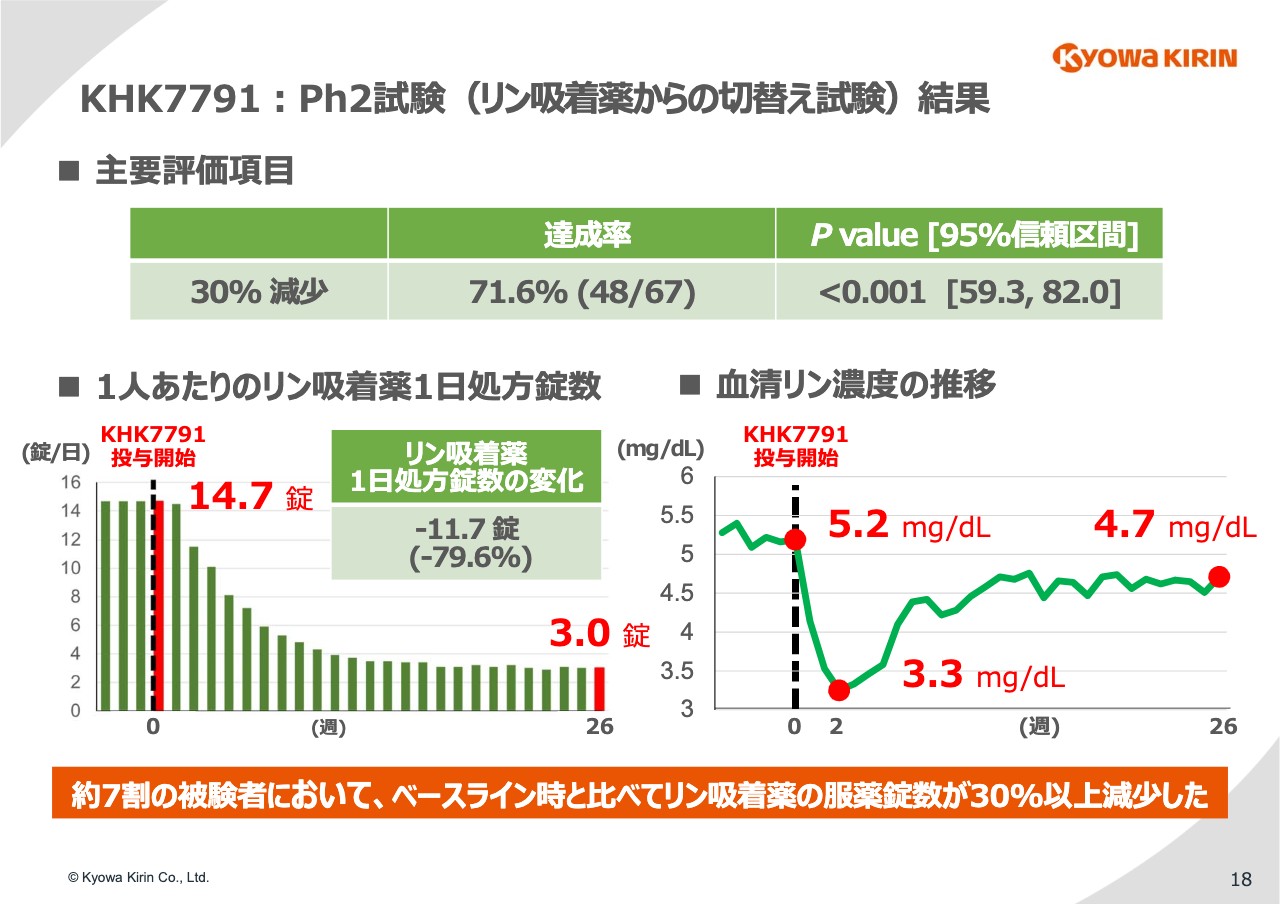
18ページは試験結果です。30パーセント以上錠数が減ったという患者が71.6パーセントでした。
錠数はどれぐらい減ったのかというと、スライド左側の棒グラフに示していますが、「tenapanor」を飲む前は1日だいたい15錠、1日3食とすると1食あたり5錠ずつです。そうした患者さまが1日3錠、つまり1食あたり1錠まで減らすことができました。非常に素晴らしい結果だと思っています。
また、その間のリンのコントロールはどうだったかというのがスライド右側の折れ線グラフですが、非常に素晴らしくコントロールできています。
他のフェーズ2の結果も、順次発表を予定していますので、ニュースリリース等でご報告できればと思います。
2020年7月以降のトピックス

これは7月27日に発生したイベントになります。「KRN23」について、欧州医薬品評価委員会(CHMP)から成人のXLHを適応症とした販売承認に対して、肯定的なレコメンデーションをもらったということです。順調にいけば9月ぐらいには最終的な結果をいただけるのではないかと期待しています。R&Dについては以上です。
COVID-19の事業に対する影響と対策

21ページはCOVID-19の我々の事業に対する影響と対策です。
サプライチェーンに関して、感染が急速に広がった3月4月には、みなさまもご存知のようにとくにヨーロッパで国境を越える物流が非常に困難でした。
しかし現在は問題なく動いていますし、当社の製品に関する原材料の供給等にもまったく問題はありません。ただし、1つだけ注視しないといけないのが、物流費が上昇してきているところです。ここは今後見ていかないといけないと思ってます。
続いて、各極でどうかということです。まず日本では、営業は在宅勤務を原則としていますが、2ポツ目に書いてあるような重要な情報提供に関しては、医療機関の意向に配慮した上で訪問するなどしています。とは言え基本は電話やメール、Web会議というところで情報提供活動をしている状況です。
それから北米は、これも各州でだいぶ動きが違うとは聞いていますが、基本的にはリモートワークを中心としています。北米の本社も閉鎖状態で、まだ完全にリモートワークですね。ここもデジタルを使ってかなり動き出しています。
それからヨーロッパ地域ですが、こちらは国ごとでだいぶ状況が違います。やはり基本はリモートワークで行なっているということです。
一部、業務の再開に向けてオフィスにビジットするためのオンラインのトレーニングなどをしており、日本から比べても非常に感覚が厳しくて、かなり厳しいトレーニングをした上でないとオフィスに戻れないというようなことで今取り組んでいます。
アジア/オセアニア、これも国ごとに感染状況がだいぶ違いますが、例えば中国や韓国はかなり通常に戻っている状況です。両国とも、もともとデジタルが強い国でもあり、基本的にデジタルプロモーションへの移行が急激に進んでいるということです。
シンガポール等はまだまだ厳しい制限をしており、基本的にはもうオフィスには行かないということで業務をしていると聞いています。
国内ですが、国内も基本的には出社の制限をしています。緊急事態宣言が出ている時よりは少し緩くしましたが、その時とほぼ同じ状況で働いてくださいという状況です。大手町本社も30パーセントを上限として出社してもいいようにはしていますが、今は多くても10パーセントぐらいという印象です。
研究所、それから工場等は感染に十分注意しながら業務を遂行しています。開発も、施設を訪問する必要がありますが、ここもやはり施設の状況を鑑みながら慎重に対応しています。リモートでできるところは全部リモートで行なっています。
COVID-19に対する取り組み

22ページは弊社の取り組みです。まとめてご紹介すると、中国、ヨーロッパ各国、米国、シンガポール、それから日本でお示ししたような寄附をしています。
日本においては、国立感染症研究所のコロナウイルスの治療のスクリーニングとして、弊社が扱っている薬の原薬をいくつか提供しました。
ビジネス トピックス

23ページにはR&Dのセクションで触れなかったその他のビジネストピックスを記載しています。まず「Poteligeo」の欧州での販売開始ですが、6月15日に最初の国としてドイツから発売を開始することができました。
それから2つ目ですが、これはみなさまご存知のとおりで、グラクソ・スミスクラインが「ダーブロック」の腎性貧血を効能とした販売承認を取得しました。
ということで、グローバルで日本が1番最初に承認を得ていますが、ここから先は我々が流通と販売業務を行ないます。これはプロモーション活動も我々が行ないますが、MSLの活動に関してはグラクソ・スミスクラインと共同で行なうということです。
皮膚分解の阻害剤としては非常に素晴らしいプロファイルを持っていると私自身は思っていますし、我々がもともと強い領域でもありますので、ここはこの素晴らしい薬を患者にしっかりとお届けできるように、グラクソ・スミスクラインと共同して取り組んでいきたいと考えています。
それから、その後は協和キリン富士フイルムバイオロジクスのバイオシミラーの事業に関して3つトピックスがありました。
まず6月に「ヒュミラ」のバイオシミラーが国内で製造販売承認を取得しました。これは、「ヒュミラ」のバイオシミラーとしては国内初だと思っています。
それから7月にFDAから承認を得たということで、欧州はご存知のとおり既に発売していますから、これで日米欧そろって承認を取得した「ヒュミラ」のはじめてのバイオシミラー製剤となりました。
それから「アバスチン」のバイオシミラーですが、これも7月に入ってCHMPから承認勧告を受領したということです。
このような状況で、バイオシミラーの事業もここまで順調に進んでいると考えています。
腎領域のラインナップ・パイプライン(2020年7月時点)
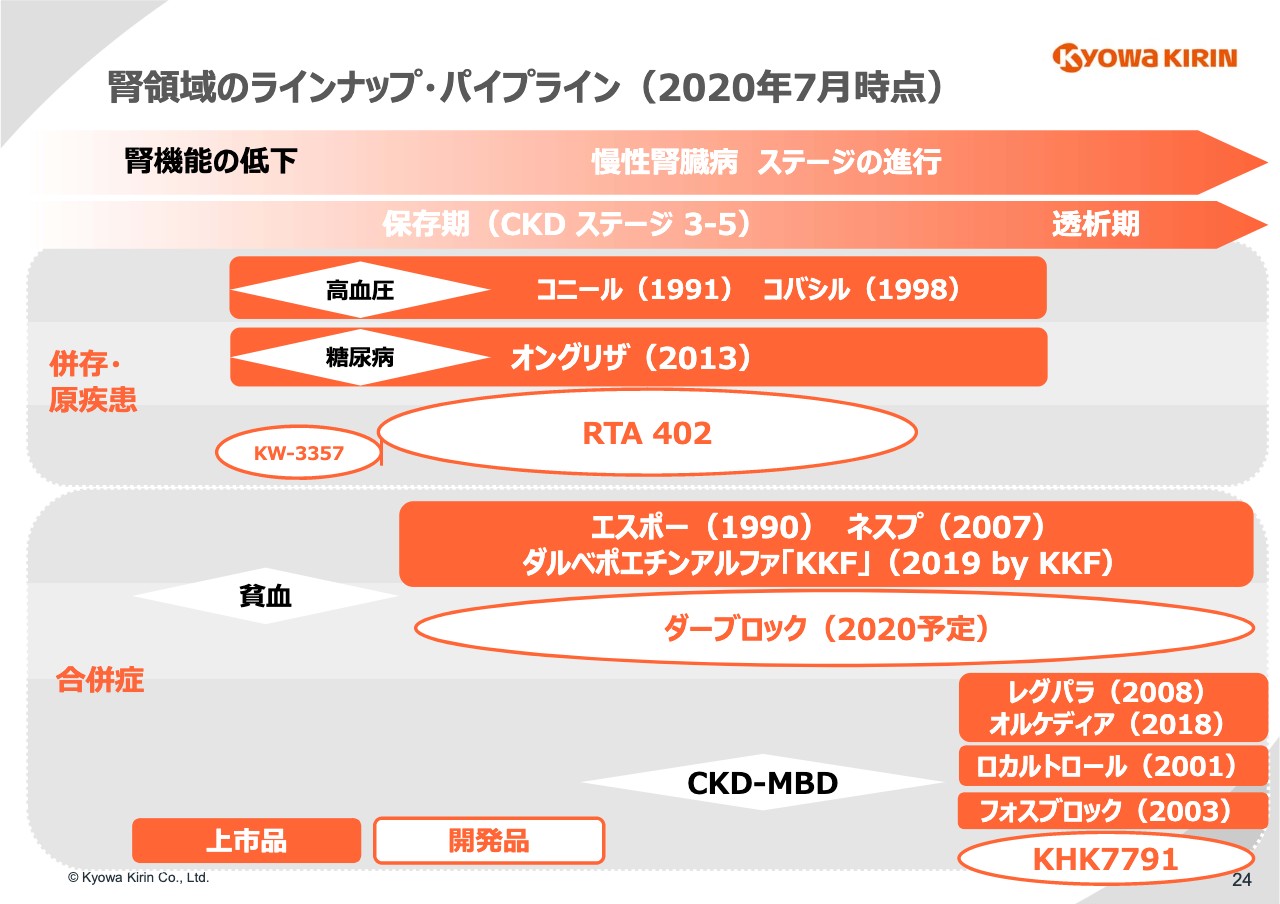
ちなみに腎領域のパイプラインに関しては、みなさまもご存知かと思いますが、次の24ページにお示ししています。
以上、ビジネストピックスをお伝えいたしました。以上で私からの説明を終了させていただきます。
新着ログ
「医薬品」のログ




