リボミック、「RBM-007」の治験を2Qに開始 グローバル企業との提携視野に
2019年3月第2四半期 エグゼクティブ・サマリー

中村義一氏:リボミック代表の中村でございます。今日はご参集いただきまして、ありがとうございます。それでは、これから2019年3月期第2四半期の決算説明をさせていただきます。
こちらは、今日お話ししたいことのまとめでございます。それほど項目は多くございませんけれども、かねてご説明させていただいていました、我々の自社製品の「RBM-007」が、加齢黄斑変性症の治験を米国で開始いたしました。すみやかに最初の患者さまに投薬が完了しています。
このプログラムは、私どもの一番大事な重点領域と考えていまして、このプログラムの進展に伴って、グローバルな企業との提携を視野に入れて開発を進めていきたいと考えています。そのために臨床開発試験として、すでに6億円の調達は完了していますし、転換社債10億円、新株予約権10億円の発行を済ませていますので、これらをすみやかに消化して資金に充当したいです。
この「RBM-007」の製品はもう1つの疾患、軟骨無形成症の治療薬としての効果が、私どもの研究開発から明らかになっていますので、これを実用化するための臨床試験を開始したいと考えています。
その目的で、AMEDから過去3年にわたって支援を受け、それから今後3年間にわたって支援を受けることが決定していますので、それらの公的な資金を注入しながら進めていきます。これを主導的に進める体制を作るために、先頃、臨床開発部長を決定いたしました。臨床開発部長に我々の会社に来ていただきまして、これを指導していただく体制を整えています。
その他、アプタマーの創薬です。最近の人工知能、AIを利用して、医薬品を作る新しいシステムを作っていきたいということです。これは科学技術振興機構(JST)のCREST事業に採択いただきましたので、これで進めていきたいというところが、大きな項目のサマリーでございます。
損益計算書の概要
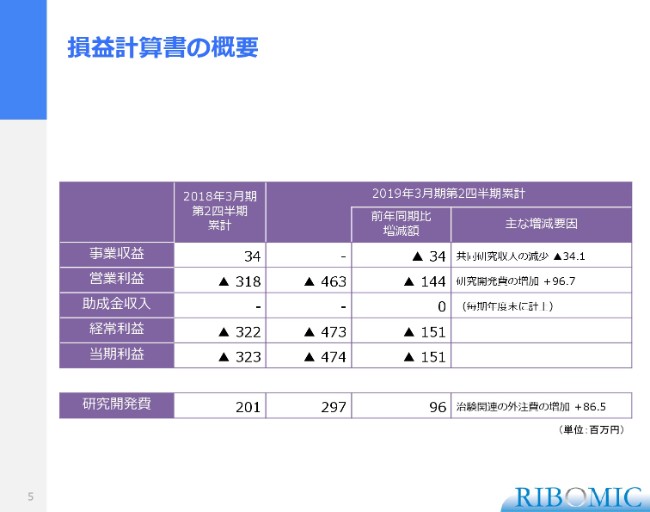
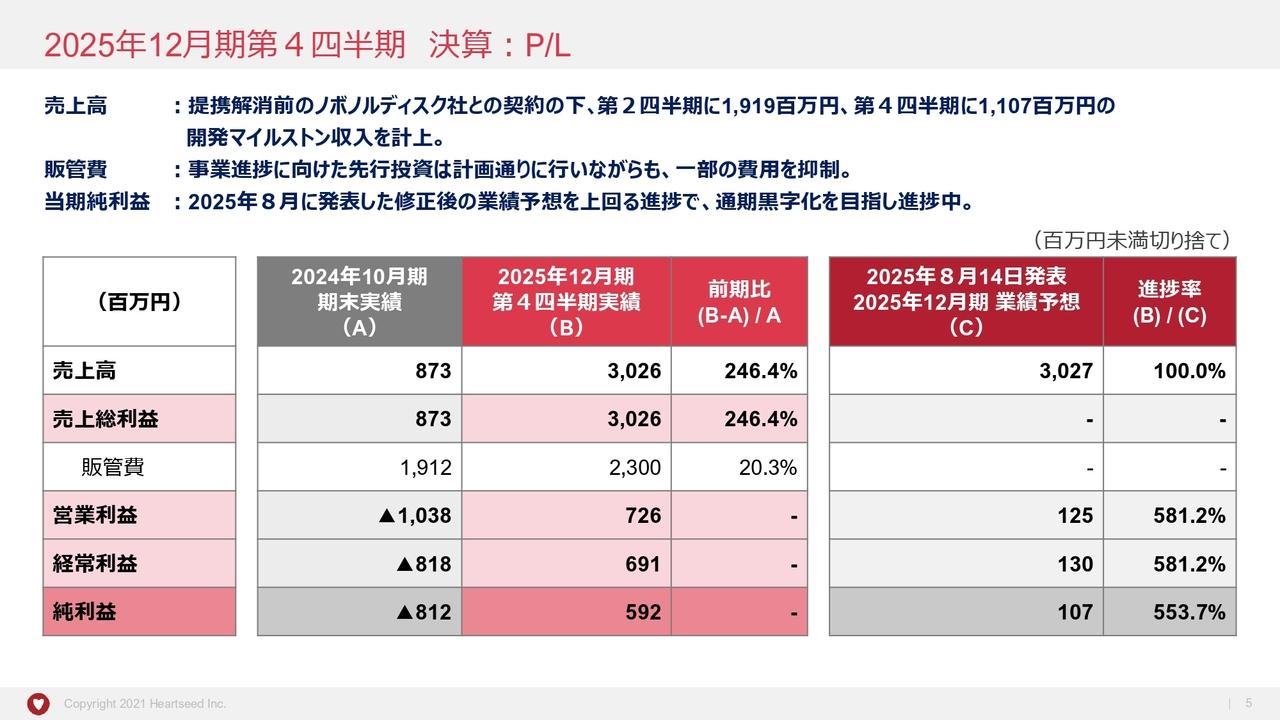
順を追ってご説明させていただきます。まず、第2四半期の決算説明でございますけれども、(このスライド)はまとめたものでございます。第2四半期で、前年度と比べて事業収益はまだ入っていませんけれども、これは年度末に相応のものが入る予定になっています。
それから、営業利益はこの数字です。助成金収入は年度末に計上する予定になっていまして、だいたい年度末に1億円の収入を予定しています。経常利益の数字(はスライドのとおりです)。当期利益では、今般、臨床開発に入りましたので、そのための研究開発費が多少増額して支出している状況でございます。
貸借対照表の概要
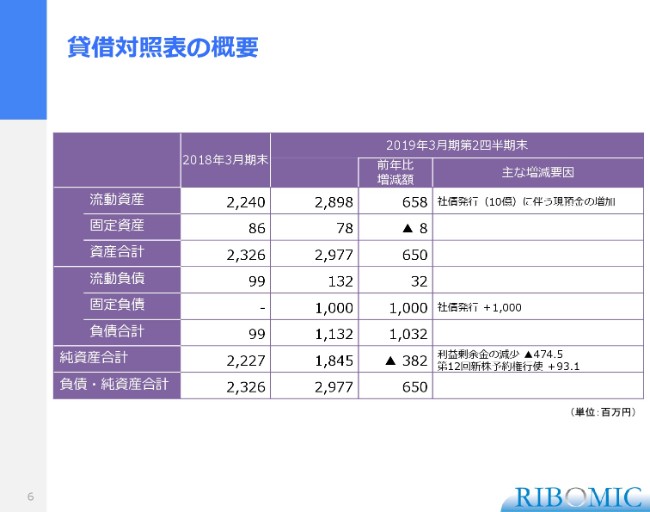
これは貸借対照表の概要で、流動資産としてはこの金額です。社債を10億円発行していますので、その金額が入っています。固定資産・資産合計、それから流動負債(はスライドのとおりです)。
固定負債には、10億円の転換社債の費用が入っていまして、ここでお示ししてありますとおり、負債・純資産合計で約30億円という数字になっています。こういう方向で大きく数字が乖離しないかたちで、あと半年後の年度末を迎えるだろうと考えています。
重点パイプライン

続いて、研究開発の進捗をご説明させていただきます。かねて私の説明でも当社のパイプライン……通番で1番から9番まで順を追って、進捗の度合いを矢印で示していました。今回、私どももいよいよ臨床開発に入って、私どもが最も重視している費目・項目をトップに並べ、これを最重点、その次を重点というかたちで(進めています)。
その他のものは、社内ではいくつかのプログラムが進んでいますけれども、そういうものは社内のプログラム中心に進め、今回正式にお出しするものは、実際の我々が臨床開発に入る、あるいはライセンスアウトを重点的に進めるところに照準を合わせて出させていただきますので、今後はこういうかたちで表示させていただきます。
「RBM-007(抗FGF2アプタマー)」ということで、加齢黄斑変性症で、いま、米国でフェーズ1・2aです。患者さんを使う試験なので、フェーズ2aまで入ってきている状況にございます。
それから「RBM-003」も我々が注力しているパイプラインで、キマーゼというターゲットに対する阻害剤で、これは心不全の治療薬です。大阪医科大学の高井先生のグループと共同で進めているもので、これは先週、Molecular TherapyのNucleic Acidsの雑誌に採択されました。みなさまにPR情報としてご覧いただけています。
これはキマーゼ阻害剤で、これまで内外の会社が注力して阻害剤開発を進めてきた中で、あまりうまく進んでいませんでした。現在は、バイエルが心不全の治療薬としてフェーズ2を進めているところにありますけれども、私どもの注力のしかたは、アプタマーの特徴を活かして、急性期で心筋梗塞を起こした直後に我々のアプタマーを注射すれば、救命効果が期待できる(というものです)。
そういう医薬品に仕上げていきたいと考えて、我々と高井先生との共同研究で、それに沿うデータを論文として発表させていただいている状況でございます。
アプタマーの最近の世界的な動向を説明させていただきますけれども、アプタマーの特徴を活かしやすい疾患は、もちろん薬がないところに新しい薬を作ること。それから、長期慢性の疾患ではなく、急性期で命に関わる疾患をターゲットにすることが、非常に重要だと思っています。
そういう意味で、急性の心筋梗塞は非常に重点的な疾患ですし、その他、例えば劇症肝炎や急性腎症に対する薬を開発する方向で取り組んでいきたいと考えているところです。
RBM-007(抗FGF2アプタマー)

「RBM-007」は、FGF2というタンパク質をターゲットにした阻害剤で、加齢黄斑変性症の治療薬としてスタートしていますけれども、また簡単におさらいをさせていただきたいと思います。
滲出型加齢黄斑変性症(wet AMD)の病理と治療
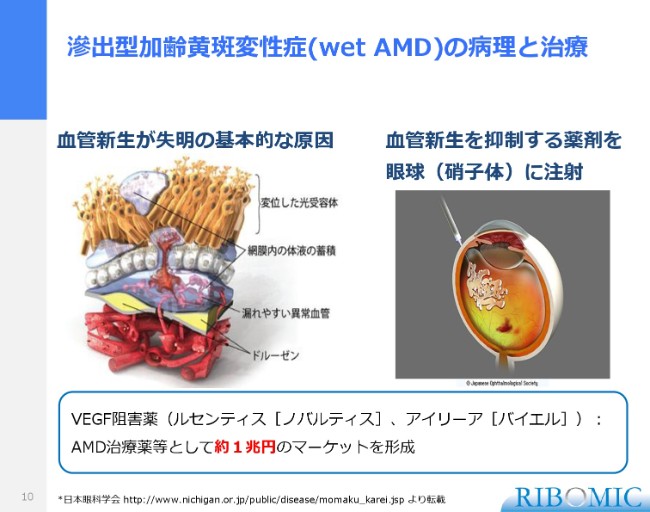
加齢黄斑変性症には、Wet型とDry型がございます。このWet型が滲出型加齢黄斑です。網膜の目の奥の構造で、視神経の非常に大事なところがあり、その下に血流が流れていて、ふだんはゴミが溜まれば、血流の中のいろんな作用でそのゴミを取り除くようになっています。しかし、いろんな障害があって傷がついたときに、血管が新しくできる、あるいは血が漏出するかたちで、傷口に出血するのが滲出型のWetな加齢黄斑です。それで視野を狭める、あるいは視力を落とすことになります。
現在まで、薬としては血管の新生を抑制する作用を持ちますVEGF阻害薬として、ノバルティスの「ルセンティス」、あるいはバイエルの「アイリーア」という2つの薬が、眼球に直接注射するかたちで世界で広く使われており、医薬品としては約1兆円の規模を持っている病気でございます。
私どもの年齢になりますと、加齢黄斑を発症するリスクが非常に高く、かつては薬がなくて失明するしかない病気だったわけですけれども、先ほどのような薬ができて、世界中の多くの患者さんに恩恵が届けられています。
しかし、その薬が効かない患者さんがおよそ3分の1ぐらいいらっしゃいます。薬が効かない患者さんが相当数存在するということと、月1回は眼球への直接注射という処置をしなければいけないため、患者さまは難儀で、(治療は)容易ではありません。
既存薬(抗VEGF阻害剤)の問題点
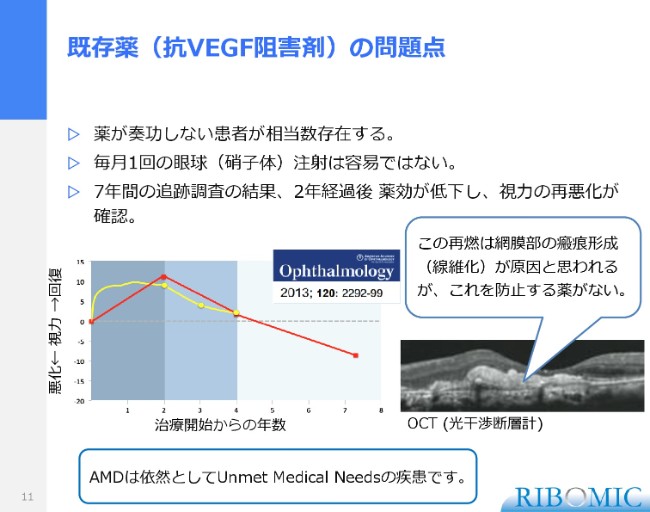
薬がどのぐらい効き目が続くのか、あるいは本当に根治療法になるのかを調べた追跡調査があります。これは有名な追跡調査で、その一部をデータとしてここにお示しさせていただきますけれども、治療から毎月1回の注射で、2年目までは視力がある程度回復しました。
ところが、2年を過ぎると視力が落ちて、4年を過ぎるとさらに悪化してきます。このままいくと失明するという展開になるため、世界的にも新しい、もっといい薬が求められるています。
視力をどんどん失うということは……スライドに瘢痕形成と書いてありますけれども、目は光干渉断層計といって、輪切りで断層写真を撮ることができます。それを3次元で組み合わせることができます。こういうところに出血した後に線維化、かさぶたですが、目の奥にかさぶたができて、これが視力を落としてくる原因になる。これを防ぐ薬がないということで、依然として加齢黄斑は非常に重く、新しい薬が求められる病気だと理解しています。
FGF2を標的とする理由:wet AMD発症の要因
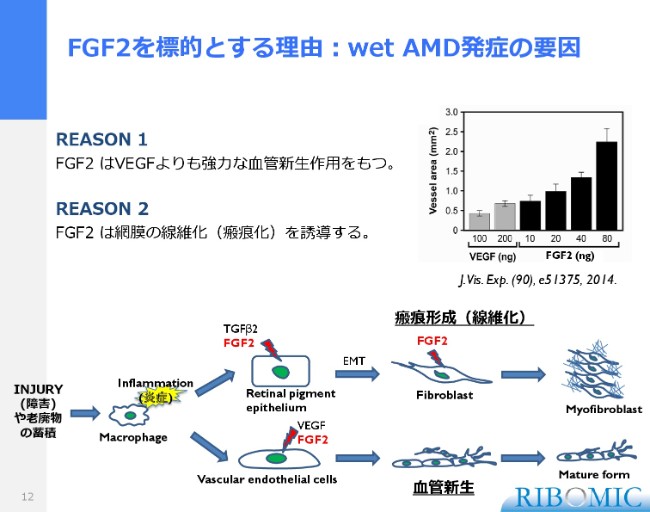
そこで私どもの「RBM-007」でターゲットとしているFGF2が、ここで登場します。FGF2は、実はVEGFよりももっと古くに発見された増殖因子で、血管の新生作用があるということで発見されたタンパク質です。
その作用は、ここに簡単に論文を用いていますけれども、VEGFとFGF2で、同じ量をウサギの眼球に注射して、どのくらい血管新生の作用が広まるのかを調べた図です。FGF2がVEGFよりも非常に強い血管新生作用があることが明らかになっています。
もう1つは、先ほどの線維化、かさぶたです。これは網膜の線維化なのですが、実は網膜の線維化は、FGF2が関与することが知られています。ここに簡単に図で示してありますけれども、傷をつけたり、いろんなゴミが目の網膜に溜まりますと、炎症だとして新しい血管を作るというシグナルが入り、そこにFGF2、それからVEGFが2つ作用して、血管ができる方向にいきます。
もう1つは、炎症が起きたかたちで……網膜の視神経のところですけれども、ここにFGF2とTGFβ2という2つが働いて、この線維化を起こしてくるという働きがあり、FGF2には血管を作る作用と線維化を起こす作用があります。こういうことがサイエンスとしては知られているところで、私どもは、1つの阻害剤で2つの作用が期待できるかたちで、医薬品開発へ入っていったわけであります。
RBM-007の特徴 ① 既存薬に対する優位性(Superiority)
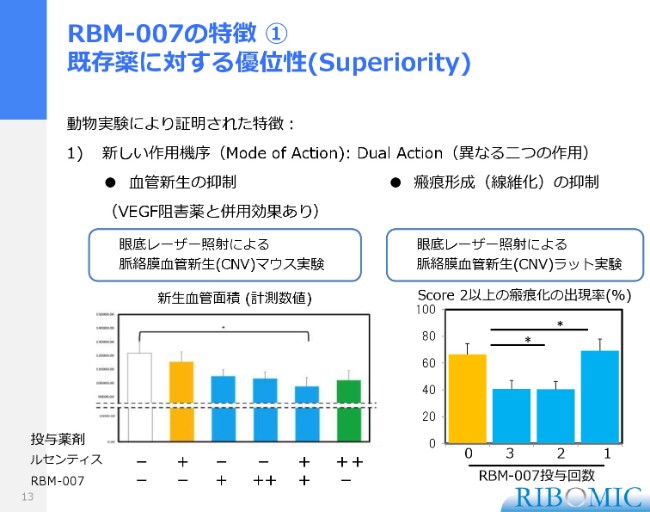
これまで動物実験で、確かにその2つの作用は、マウスやラットを使って実証できました。血管新生を抑制する。それは、VEGFの阻害剤よりもむしろ強いですし、VEGFルセンティスと我々の薬を併用すると、もっとよく効くというデータも取れています。
それから瘢痕形成に関しても、これは我々の実験ですけれども、2週間おきに2回、3回と加えると、瘢痕の形成が抑制されるという動物実験のデータも確かに取れて、我々が考えた作用機序が確かに動物実験で実証できています。
もう1つは、他の薬と比べて我々の薬の方が、ずっと使い勝手がいいかどうかです。使い勝手は先ほど(述べたとおりですが)、通常の薬ですと、1ヶ月に1回は病院に行って、眼球に直接注射して薬を入れなければいけません。1年間ぐらいは毎月行くということが実際にあります。
RBM-007の特徴 ② 既存薬に対する優位性(Superiority)
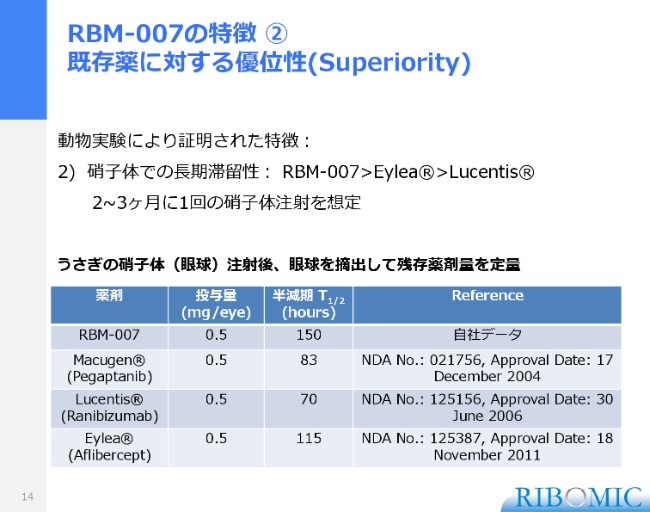
回数を減らすことができれば、患者さんにとっては非常に負担が少なくなることになります。回数を減らすというのは、薬がどれだけ眼球の中で長持ちしてくれるかということになります。
(スライドは)私たちの「RBM-007」を、実際にウサギの眼球に注射して、半分に減るまでの時間がどれだけかを調べたものですが、150時間でした。その他の「ルセンティス」は70時間。それから「アイリーア」は115時間で、いま使われている薬よりも半減期が長くできるかたちで、私どものものは2ヶ月、あるいは3ヶ月に1回の眼球硝子体注射で済むのではないかと考えています。これらはいずれも、私どもが開発している医薬品の優位性を示すものに他ならないと考えています。
データを付け加えさせていただきますが、それだけFGF2が大事なら、どうしていままで薬の開発がなされなかったのか、あるいはどうしてそういうことが調べられなかったのかという問題がございます。
その回答は非常にシンプルで、実はFGF2は、いい阻害剤を作るには難しいタンパクだったのです。これまでたくさんの抗体や阻害剤が開発されて、論文ではいくつも出てますが、それらは非常に効き目が悪い。シャープな阻害剤がいままでなかったのが大きな原因で、どなたも実際の動物実験、あるいは臨床で試験することがまったくなかったのが背景にあります。
AMD治療にRBM-007を用いる妥当性(Supportive evidence)
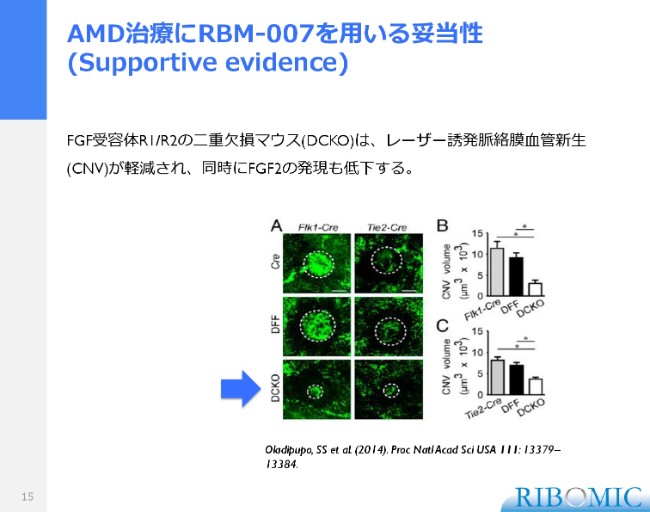
その中で唯一、FGF2の作用ではないものの、FGF2が結合すると、シグナル伝達といって、細胞の表面にあるレセプターに作用して、細胞の中にシグナルを起こす役目を持っています。ですからFGF2の作用は、レセプターを介して細胞に活性が伝わっていくわけです。
レセプターを欠失した欠損マウス、つまりレセプターのないマウスで、加齢黄斑変性症的な挙動がどうなるかを調べた論文が、2014年に米国のワシントン大学のグループによって唯一出されています。
レーザーで目に損傷を与えますと、損傷の箇所から血管がどんどんできてきて、血管ができたところに血流が入りますから、その面積をトレースすることができます。これは我々の実験と同じ方法です。
しかし、レセプターの2つを欠失させますと、この広がりがうんと抑えられるのです。これは我々のデータとも非常に一致するデータで、こうしたデータが我々の試験に対するサポートになってきます。そういうエビデンスが唯一あることを、ご紹介させていただきたいと思ってお話ししました。
RBM-007は各網膜疾患に適応の可能性

それからもう1つ。私どもがこういう臨床試験をやることを決定してから、あらためていろんな文献を調べました。驚いたことに、スペインの臨床医のグループ……ここに書いてありますDobesilate、ドベシル酸という低分子を使って、加齢黄斑変性の患者さんに直接硝子体注射するという臨床研究、ケーススタディを行っていることがわかりました。非常に驚きました。
FGFは22種類ありますけれども、それらはすべて4種類のレセプターに結合して、細胞の中にFGFのシグナルを起こすということがあります。一般的に広い意味でのシグナル遮断薬として知られていて、これは植物から抽出された低分子で、抗癌剤といった用途で臨床的にも使われているものです。
彼らは、これを実際に加齢黄斑の患者さんの目に直接注射して臨床経過を調べ、非常に有効性があるという報告を2012年に出しています。さらに展開して、DryのAMDにこれを試して同じような有効性があり、さらに他の3つの網膜疾患に関して、これを実際に硝子体注射して有効性を報告しています。
我々も非常に驚いたのですが、いずれも2012年、あるいは2013年のケーススタディで知られていることで、まだメジャーな網膜疾患の文献を見てもこういう事例がなかなか紹介されていない中で、スペインの先生たちのグループはこういう実験をおやりになっていた。こういうことも、我々のプログラムである「RMB-007」が非常に有効なのだということをあらためて示すデータでございます。
SUSHI Study(Phase I/IIa)
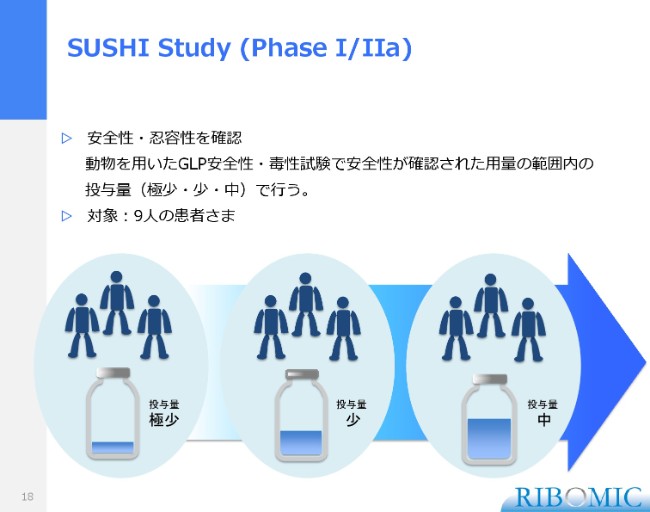
我々が進めています臨床試験の計画について、説明をさせていただきます。最初はフェーズ1・2aの試験で、これは安全性、それから忍容性を確認するものです。
低用量・中用量・高用量と、薬の量を極小から少ない、中用量というふうに増やしていきます。最初に3名の患者さんで実際に硝子体に注射して、一人ひとりの経過が安全だということを確認してゴーサインをいただいて、次の患者さんにというかたちで……こういうことをコホートスタディといいますが、3名の患者さんで一番少ない容量での効果・安全性を見ていきます。
その次は中用量、さらに一番多い量と順番に行い、安全性・忍容性を確認するというプログラムです。9名の患者さまのうち、最初の患者さまについて、10月の最後の週にスタンフォード大学で投薬が完了して、まったく異常は起きていないという状況でございます。
4ヶ所の治験施設(SUSHI Study)
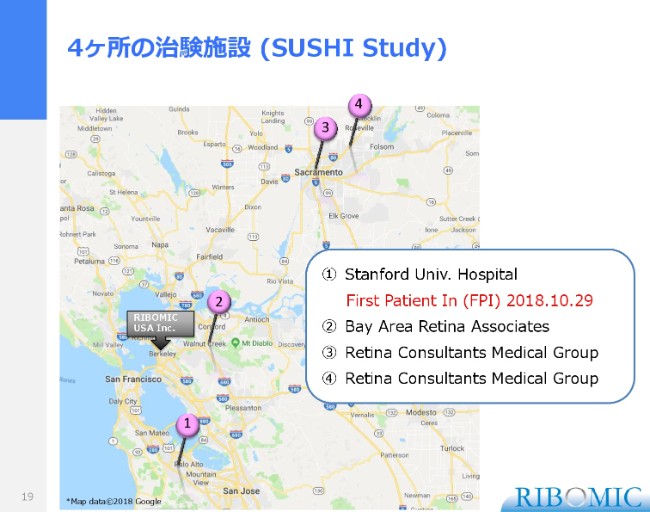
9名の患者さまですが、我々としては4ヶ所の治験サイトを選別しています。いずれも、RIBOMIC USAがありますバークレーの近くで、車で簡単に行ける距離内で、1ヶ所がスタンフォード大学の病院です。
ここで第1号の患者さまへの投薬が完了しており、現在はスタンフォード大学主導で進んでいます。他のサイトからも患者さまのリクルート・スクリーニングを進めていますので、我々の安全性・忍容性、とくに安全性の確認がすみやかに済めばその次の患者さんというかたちで、リレー方式でどんどん進めていけます。その準備がいま、この4ヶ所で整えられている状況にございます。
AMD臨床試験計画
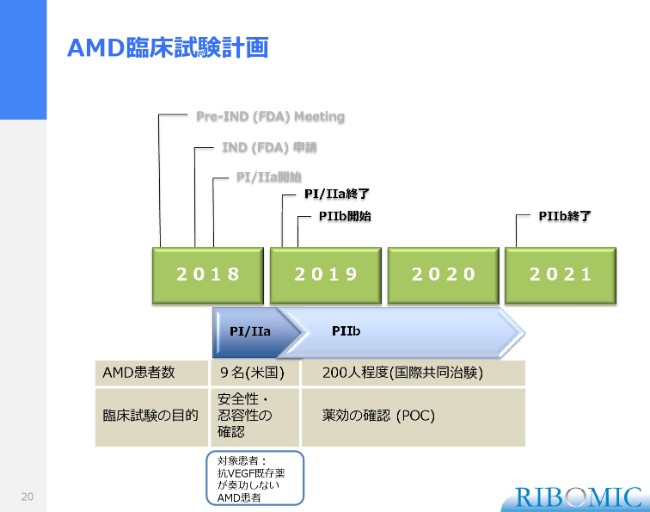
試験計画です。この試験は来年(2019年)の春ぐらいまでかけて、9名の患者さまの試験を完了します。我々としては、夏前ぐらいには次のフェーズ2bに入ることを考えています。最初のフェーズ1・2aは9名の患者さまで行っていますけれども、とくにここの特徴は、先ほどお話ししました既存薬、VEGF阻害剤の「ルセンティス」「アイリーア」という薬がなかなか効かない患者さまが、それなりにたくさんいらっしゃるということです。また、薬が効く患者さまも、だんだん使っていくと効き目が落ちていきます。
我々は、なかなか反応が鈍い患者さまをリクルートして、エンロールして、その9名の患者さまに充てます。ですから我々としては、既存薬が効かない患者さまで、我々の薬……1回だけの注射ですが、もし我々の薬に非常に強い薬効があれば、それらの中から何らかの方法で効き目が確認できる患者さまが出てくるのではないかと期待しています。
もちろん、安全性を確認することが一義的な目的ですから、すみやかに次の試験に入りたいという構えですが、ひょっとすると我々の薬のパワーによっては、そういう効き目がここで出てくる可能性があると考えています。
それからフェーズ2bです。我々としては非常に大掛かりな試験になりますけれども、約200名を超える患者さまに対して、実際に薬効試験を、統計学的な有意性を出せるかたちでデザインして進めていきます。200人の患者さまになりますと、米国だけではなかなか難しいため、リクルートします。
いま加齢黄斑は、いくつかの試験が米国でも進んでいて、患者さまの取り合いになっているためなかなか難しい状況です。米国はもちろん、我々としては国際的な共同治験という体制を組もうと思います。現在、恐らく米国以外に3ヶ国で、この共同試験の体制をとって進めていく予定で、これが2021年の初頭まで、約2年ちょっとかけて実際の効果を出したいと考えているのが、私どものいまの計画でございます。
米国での臨床試験の実施体制

米国での臨床試験の実施体制は、何回も申し上げていますけれども、バークレーに設置しましたRIBOMIC USAのヘッドのYusuf Ali、それからUCSFの眼科教授のRobert Bhisitkul教授。同じくスタンフォード大学の眼科教授でありますQuan Dong Nguyen、ダラスの網膜疾患研究所のヘッドでありますKarl Csakyで諮問会議を結成しています。
彼らに専門委員として実際の臨床計画のデザイン、セーフティに関すること、安全性に関することをチェックしてもらいながら進めていくかたちで、我々としてはこれ以上望めない体制のメンバーを揃えていると考えています。
米国におけるAMD患者数
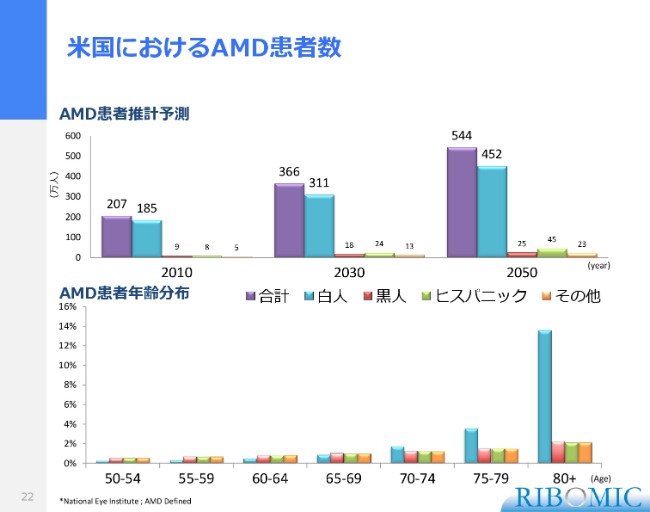
我々が米国で加齢黄斑の試験を始めたのは、それなりの理由があります。AMD患者の数を考えてみますと、実際に2010年、2030年、2050年と……これは米国の国立アイ研究所の統計数字ですけれども、圧倒的に白人の患者さまが多い。黒人、ヒスパニック、日本人はそれほど高くないのです。
ですから、加齢黄斑による失明率が米国では第1位です。日本は、加齢黄斑の失明率は第4位になっています。我々の人種的には、加齢黄斑に対して耐性がある。それから、とくに黒人の発症率は非常に低いということですから、先進国でも白人層に非常に多い(病気)ということがいえます。
年齢についても、高齢化になってきて、70歳・75歳・80歳過ぎが圧倒的に増えてきます。さまざまな原因がありますけれども、紫外線、タバコの煙といったものが、目に傷を与えることになります。それに伴って、その傷が加齢黄斑につながりやすい背景を持っている白人層に増えてくるという状況があるだろうと思います。
世界におけるwet AMD医薬品の市場規模
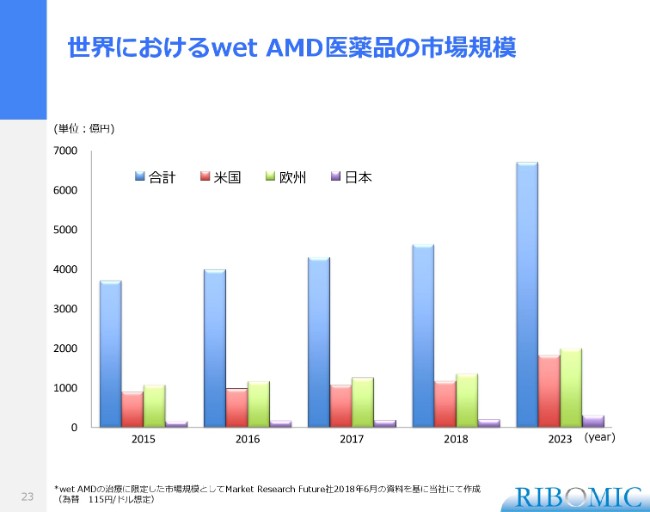
滲出型のwet AMDの医薬品の市場をまとめたものです。これは米国・欧州・日本というまとめ方で、2015年から2023年までの予測までまとめています。
2018年ぐらいですと、約5,000億円ぐらいのマーケットが世界にあります。日本もそれなりの市場性を形成していますけれども、やはり圧倒的に米国と欧州が多く、世界規模としては5,000億円ぐらい。それがWet単体でのマーケットです。
この他、VEGF阻害剤は医師の判断で網膜疾患に使われています。糖尿病性網膜症ですとか、その他の疾患に使われていますから、合わせて1兆円を超えている状況にございます。私どもが米国で加齢黄斑の試験を開始したのは、非常に整合性があると考えていますし、米国のマーケットにぜひ出て行きたい。米国・欧州に入っていくのが、非常に重要だと考えています。
Summary
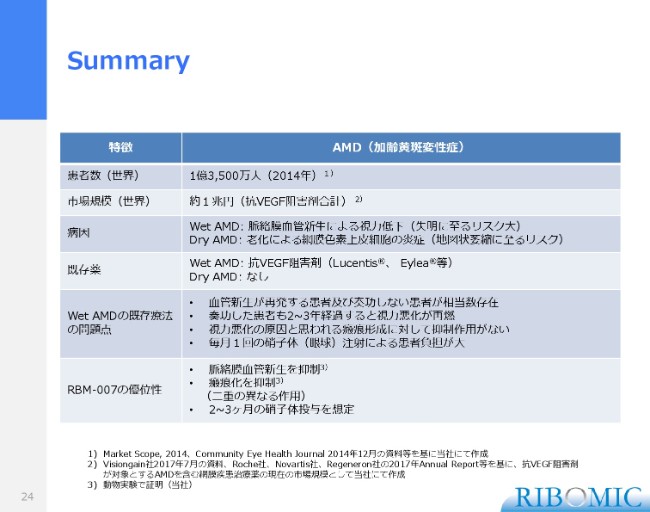
これらをまとめますと、2014年のデータでは、患者の数は(世界で)1億3,500万人。現在、たぶん2億人に達しています。それから、今後ますます加齢黄斑の患者さまの数は増えますから、現在1兆円を達成していますけれども、拡大基調にあると思います。
それから、加齢黄斑でもWet型とDry型とで区分けしていますが、Wet型は血管新生で出血する型で、失明に向かうものです。
もう1つのDryは、老化でいろんな老廃物が蓄積して、網膜の色素上皮細胞が炎症等でおかしくなってくるものです。別名、地図状萎縮……地図のどこかの部分がピースが抜けるみたいなかたちで、視野がおかしくなってくるものです。それがDry AMDで、患者数はWetの約10倍の数です。
Dry AMDに関しては、既存薬はまだありません。先ほどDobesilateの実験から、DobesilateがWetで効いて、しかもDryでも効いたというケースレポートがあるとご紹介しました。我々の「RBM-007」 も、Dryにも薬効が拡張できるのではないかとも期待しています。
何回も繰り返しになりますけれども、これまでの既存品は、効かない患者さまがいらっしゃいました。いったん効いても、2年経つと視力を落としてきますし、目の奥でかさぶたができる。これを抑える薬がないということがありますので、我々の「RBM-007」はそれらを克服する新薬になると期待して、開発を進めている状況です。
核酸医薬品(上市)
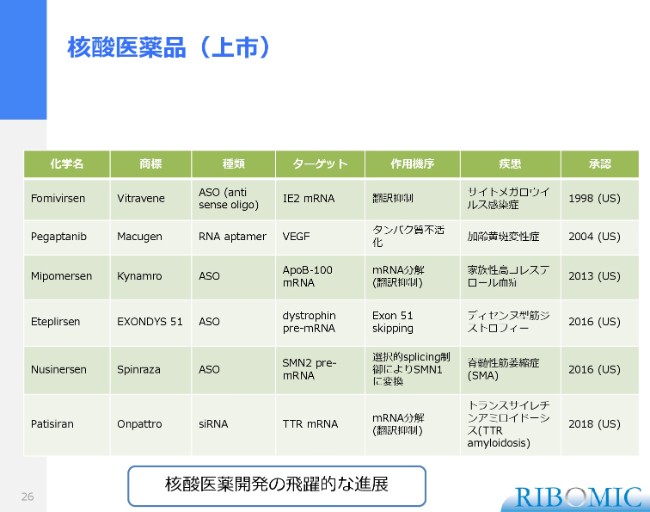
最後に核酸医薬について、3枚ほどのスライドで追加説明させていただきます。実は、今年(2018年)は核酸医薬にとって記念すべき年になっています。それは、Alnylam社が進めてきたRNA干渉を使ったsiRNAの医薬品が、FDAによって正式に承認されたからです。商標名は「Onpattro」です。
トランスサイレチンアミロイドーシス、肝臓のタンパクの凝集体を作るもので、非常に致命的になっていく疾患に対して、Alnylam社で進めてきたsiRNAが最終的に認可されたという、非常に顕著な進展がありました。
それから2年前は、anti sense型の2つの薬が希少疾患に対して承認されるかたちで、近年、核酸医薬が正式に患者さまに届けられるようになってきている状況にあります。我々にとっても、非常にエンカレッジングな進展だったと思います。
アプタマー医薬品開発の現状
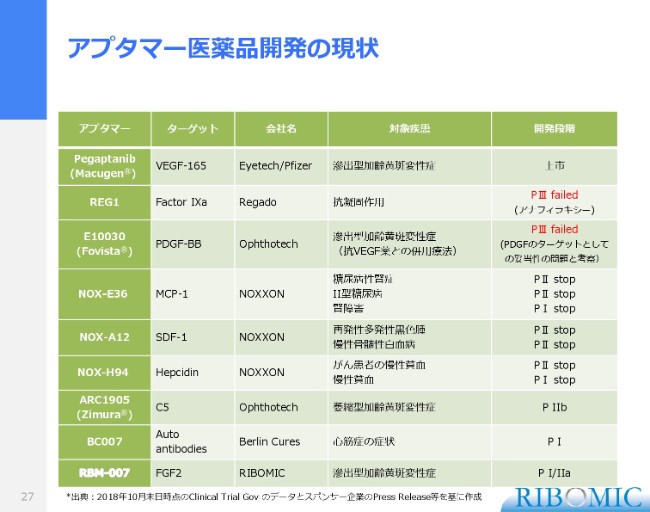
一方、アプタマーを改めて見ますと、2004年の最初の加齢黄斑変性症治療薬「MacugenⓇ」……Eyetech社とPfizer社によって上市されたものがございますが、それからアプタマー医薬で上市品が出てない。非常に長い空白がございます。
この間、当然いくつものトライアルが行われていて、非常に期待されたものが、Regado社が進めていた血液凝固阻止剤です。これはFactor IXaに対するアプタマーで、非常にうまくいってフェーズ3まで進展し、期待したのですが、千数百名の患者さまで試験した中で、アナフィラキシーが起きたのです。それから、過剰に免疫系が発動してしまいました。そのアナフィラキシーによって、こちらはドロップしています。
加齢黄斑に関しては、Ophthotechという米国のベンチャーが「FovistaⓇ」という薬(を出しており)、このターゲットはPDGF-BBというタンパクで、Wet AMDに関して進めてきたものです。
これはフェーズ1・2も非常に順調に進んで、合計で1,200名の患者さまに対してフェーズ3が終わったのですが、残念ながら既存薬を超える優位性が示せなかったということで、ドロップしています。この2つは、アプタマー医薬品開発に関して非常にネガティブなサプライズでございます。
その他、ベルリンにありますNOXXONが全身投与型の薬の開発を進めてきていますけれども、この3剤はいずれも、財政難で臨床がストップして、ここで止まっています。まだ進捗が見られそうにもありません。
その中で、最近Ophthotechが改めてDry AMDに対しての臨床試験を進めていて、いま、フェーズ2bの後半です。それから、Berlin Curesというベルリンにある1社がフェーズ1を完了しています。
我々の(「RBM-007」の)試験が今、フェーズ1・2aに入っています。この(スライドの表の下から)3つのプログラムがいま、世界のアプタマーで生きているプログラムということですから、私どもの責任は非常に大きいと認識しているところです。
Non-VEGF標的のAMD医薬品のライセンス契約(事例)

最後に、私どもが目指すところです。こういう事例になれば非常にありがたいと思っているのですが、VEGF以外のターゲットの加齢黄斑変性症医薬品の開発に関して、これまでどれだけ契約事例があるかをまとめたものになります。
1つは先ほどのもので、失敗してしまいましたけれども、Ophthotech社のものです。アメリカの会社で、この会社のターゲットはVEGF以外のPDGFで、これをフェーズ2bまで進めたところで、ノバルティスとライセンス契約が成立しています。
非常に大きなライセンス契約で、テリトリーは米国を除く全世界です。米国だけはOphthotechが権利を留保して、その他の全世界をノバルティスにライセンスしまして、アップフロントが200ミリオンダラーですから、230億円ぐらいのアップフロントです。
マイルストーンは、このアップフロントのお金も含めて1ビリオンダラーを超える、千数百億円です。そういう大きなディールとしてまとまっています。残念ながら、フェーズ3が頓挫しましたから、なくなりました。
もう1つ、つい最近ですが、実はこのanti sense医薬品開発を専門で進めてきましたIonisが、Rocheに対して、オプション権付きの共同開発契約を結んだというアナウンスがありました。
フェーズ1の段階ですが、やはりanti senseを使っており、ターゲットは免疫反応を媒介する補体系の調整因子、ファクターBに対してフェーズ1を進めており、狙っているのはDry AMD、萎縮型の加齢黄斑です。
全世界のテリトリーでのアップフロントで、フェーズ1ですが、アップフロントが75ミリオンダラー、約80億円です。それからマイルストーンをすべて合わせますと、684ミリオンダラー、七百数十億円。ロイヤルティも、10パーセント台後半というアナウンスがございました。
これはフェーズ2bが終わった段階で、すべての権利をRocheが引き受ける契約です。私から見ると、我々のステージ、フェーズ1が終わったところで仮にこういう契約が成立すると、会社にとっては嬉しいできごとになります。
我々が狙っていきたいライセンス契約は、こういうかたちを狙っていきたいですし、また、ここで扱っているターゲットの新規性から考えて、そういう可能性は十分にあるのではないかと期待していきたいと考えているところです。
以上、非常に簡単ではございますけれども、私どもの第2四半期の説明をこれで終わらせていただきます。ありがとうございました。
新着ログ
「医薬品」のログ