サンバイオ、慢性期脳梗塞薬の治験トップラインデータを20年に公表 市販見据え日立化成と提携
SB623の開発進捗:慢性期脳梗塞プログラム(米国)

森敬太氏(以下、森):改めまして、本日お越しいただきまして、どうもありがとうございます。サンバイオの森でございます。いつもたくさんの方にお越しいただき、しっかり報告しようと思っております。
今回はとくに、いよいよトップラインデータ、治験のデータが出る時期が見えてまいりましたので、そのへんも含めてしっかりとお伝えしたいと思っております。それでは、どうぞよろしくお願いいたします。
まずは、当社の再生細胞薬623の第1のプログラムである、慢性期脳梗塞のプログラムについてご報告したいと思います。
昨年の12月に、3ヶ月の予定より早いタイミングで、組み入れの完了が達成できております。この治験は163人という、再生医療としては大規模、かつ二重盲検の後期臨床試験のしっかりとした治験を行っております。
このプログラムをもう少し過去にさかのぼって、背景をご説明したいと思います。
みなさんもご存知のとおり、最初の治験はフェーズ1/2aということで、18例の治験をアメリカで行いまして、その結果につきましては、みなさまにこの説明会や論文、動画等でご報告をし、患者の方々が車椅子から歩けるようになったり、何年間も動かなかった手が動くようになったり、しゃべれなかった患者の方がもう一度しゃべれるようになるといった、すばらしい結果が出ております。
それに基づきまして、このフェーズ2bを行いまして、大日本住友製薬社と共同開発で、米国で実施をしております。
組み入れが完了いたしましたので、12ヶ月の経過観察を経て、来年の前半、2020年1月期前半に治験のトップラインのデータを公表する予定でございます。
この治験は全米で65ヶ所で実施をしております。そして、治験を実施していただいている先生方、関係者から、非常に多くの期待を感じております。結果として、この試験は予定より3ヶ月早く終わっておりまして、非常に手応えを感じているところであります。
SB623の開発進捗:慢性期脳梗塞プログラム(日本)

続きまして、同じ慢性期の脳梗塞のプログラムの、日本の状況になります。
(2018年)2月に、2009年から事業提携パートナーとしてやってきました帝人株式会社より合意解約をいただきまして、開発権および販売権を返還いただいております。
まずは、帝人株式会社に、本当に深く感謝しております。
2点ありまして、2009年という、治験が始まっていないところからパートナーとして長くやってきていただいたこと、そして、このタイミングで、患者の方からの要望が強い中、どうやったら日本の患者の方に早く届けることができるかを両社で討議いたしまして、その結果として、当社サンバイオで開発するのが良いであろうということで返還をしていただいたこと、非常に感謝しております。
バトンタッチして、もともとの開発責任者である私どもに戻ってきましたので、このプログラム、1日も早く患者の方に届けるよう、開発を行ってまいります。
SB623の開発進捗:外傷性脳損傷プログラム(日米)

脳梗塞に続きまして、2つ目のプログラムであるTBI、外傷性脳損傷ですが、これは、上場した後に始めた2つ目の臨床プログラムになっています。
特徴としましては、脳梗塞と同様、患者の方が困っていてまったく薬がないことに加えて、戦略的にはアメリカだけではなく、日本とアメリカで治験を行って、日本の優れた枠組みを活かして早期の承認を狙っていく戦略的なプログラムとして位置づけて進めてきております。
こちらも本日開示いたしましたが、52名の100パーセント組み入れを行ったところでございます。こちらも脳梗塞同様、日米40施設という多数の施設で行っておりまして、こちらも開発・治験が順調に進み、関係者からの強い期待をいただいております。
タイムラインにつきましては、今回このような進捗がありましたので、治験のトップラインのデータの予定時期が見えてまいりました。今期中、発表する予定にしております。そして、発表後速やかに、日本におきましては早期承認制度を活用し、患者の方に承認をもって販売し、1日も早く届けたいと考えております。
事業進捗:市販後体制構築

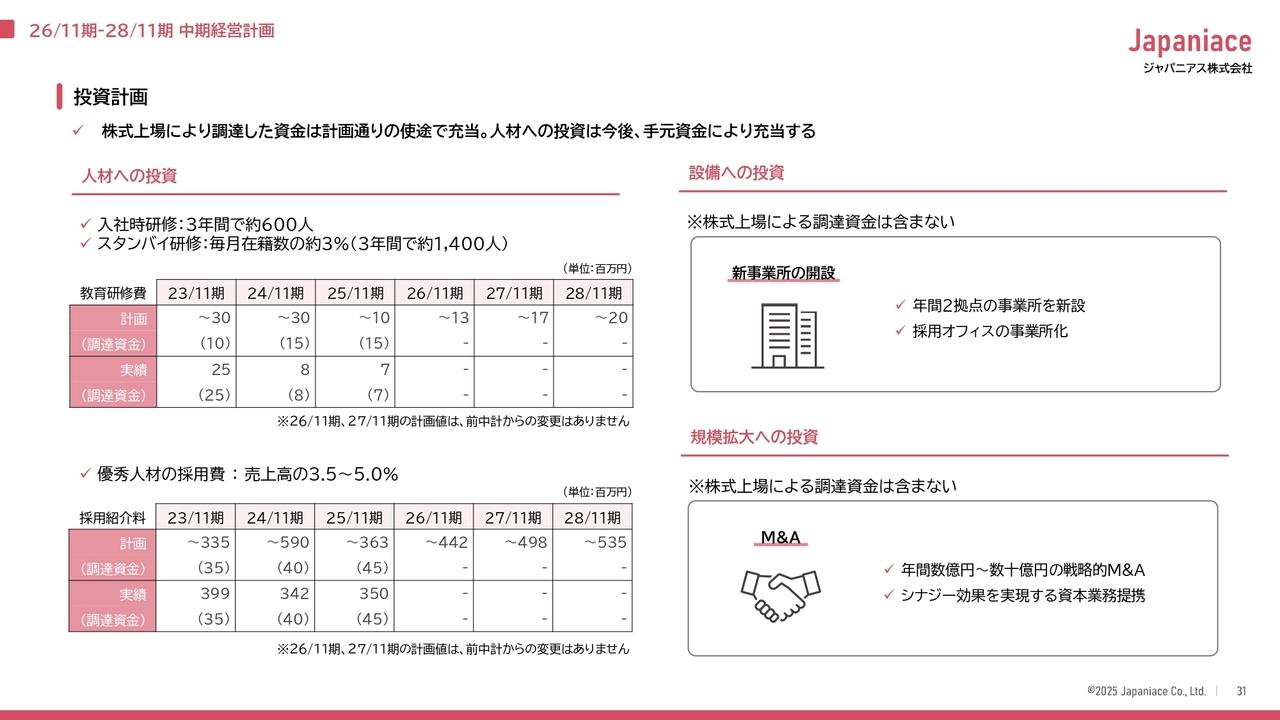
これまで、臨床プログラムとして脳梗塞、そして外傷性脳損傷とご報告をしてまいりました。ご報告したように、患者の方に届けるための承認も見えてきておりまして、現在市販後の体制を構築する準備に取りかかっております。
その目玉として量産化・安定供給が必要になりますので、この度、日立化成社と提携をいたしまして、今後の市販後の安定供給を実行してまいります。この製造について日立化成社のような非常に安定し技術力も高い会社と提携できたことは、患者の方々に安定供給する上で非常に嬉しく思っております。
事業進捗:共同研究

SB623の脳梗塞、そしてTBIと、フェーズ2のデータはもうすぐという話ですけども、それに加え弊社ではパイプラインとして、パーキンソン病、あるいはアルツハイマー病を見据えて開発を行っておりますが、さらに、今患者の方々からいろいろな要望が来ています。
私のこういった病気を治してほしい、細胞で、再生医療でこういったのも治せないかという話がどんどん来ております。私どもとしては、今までにない薬効を持つ可能性のあるものに関しては、非常に強い興味を持っています。そんな中で、パイプラインの拡大に向けて共同研究にも着手し、より多くの患者の方に対応していきたいと考えております。
実際には、今回京都大学の萩原教授が発見・開発をしてきております、「アルジャーノン」という化合物がございます。こちら、化合物としては珍しく、再生機能を持っている可能性が動物試験等で示されておりまして、当社の共同研究でその可能性を追求し、患者の方の新たな治療法を、開発を目指す第一歩にしていきたいと考えております。
以上が、この1年間の大きな開発事業の進捗になります。
SB623に対する好評1(再掲)

ここからは、トピックスとしまして、この1年間で、ありがたいことに当社の認知度が高まりまして、各種メディア、そして各種賞をいただきましたので、それぞれを簡単にご紹介したいと思います。
まずは、半年前の説明会でもご説明いたしましたが、アメリカ心臓協会より「イノベーション・アワード2016」を受賞しております。
SB623に対する好評2

そして、こちらは新しい内容になりますが、昨年の年末に、アメリカで非常に著名な「スミソニアン・アワード」も受賞に至っております。内容としましては、慢性期の脳梗塞で、今まで想像もできなかった治療法が今開発されていることをもって、私どもの治験を行っているスタンフォード大学のゲイリー・スタインバーグ教授にこの賞が出ております。
SB623に対する好評3

そして、こちらはみなさんにもご報告済みですが、もう一度ご紹介いたしますと、昨年の6月に再生医療の研究の研究助成金としては、世界最大規模かつ最もリーダーシップを持っている団体がカリフォルニアにありますが、こちらから20億円を超える研究補助金をいただくにいたっております。
金額もさることながら、やはりカリフォルニア州再生医療機構から助成金・補助金をいただいたこと自体が、私どもの技術や医療事業のバリュエーションになったというふうに考えております。
SB623に対する好評4

最後にこの一年間、メディア―得にテレビに数多く取り上げていただくことができております。
昨年の4月には、NHKの「クローズアップ現代+」で、大きな特集の中の目玉として取り上げていただいております(2017年4月21日放送)。
また秋にはBS-TBS「夢の鍵」という番組で、当社の製品を視聴者の方にお伝えいただくような内容になっているものを、9月に放映になっております(2017年9月9日放送)。
そして先月2月23日に、もう一度BS-TBSさんから今回は2時間の特別番組の中の、大きな一つの事例といたしまして、「健康科学ミステリー“若返り”医療最前線」という中でこの再生医療がどこまで進んできたか、患者の方も含めて紹介になっております。
このようなことで、非常にありがたく人気度が上がっております。結果として当社にも、脳梗塞、外傷性を超えて、他の脳の病気を持った患者の方からたくさんの問い合わせを日々受けて、この薬を早く出さなくてはいけないと、ひしひしと感じております。
開発スケジュール:慢性期脳梗塞プログラム

それでは、今後の今期の予定をまとめてご紹介したいと思います。昨年からの引き続き、基本的には継続になっております。
まずは慢性期脳梗塞のプログラム、フェーズ2bの結果、治験のトップラインデータは、いよいよ来年の前半に公表予定でございます。そして、帝人株式会社から戻ってきたプログラムの外傷性脳損傷の承認を日本で取得し、すみやかに世界に先駆けて承認を取っていくという、こういうコミットメントを持っております。
開発スケジュール:外傷性脳損傷プログラム

二つ目のプログラムとして、外傷性脳損傷のプログラムになりますが、こちらは二つ目のプログラムではありますが、脳梗塞を追い抜いて、SB623としては、最初の販売承認取得を目指していきます。
先ほども、その戦略的なプログラムということでご紹介いたしましたが、現在すでに52例の組み入れが完了しておりまして、これから結果発表につきましては、今期中のトップラインデータの開示を予定しております。そのデータを持ちまして、この日本での優れた早期承認制度を生かして速やかに申請を行って、承認を取得し、患者の方に早く届けていきたいと、こういった計画で進めております。
事業進捗:市販後体制構築へ

今申し上げました様に、日本でのTBI(外傷性脳損傷、フェーズ2・日本グローバル)はもう間近まで来ています。その中で今期、市販後体制の構築をやっておりまして、その中でまず重要なところとしまして、量産につきましては、日立化成グループさんとの提携を実際に実行いたしました。
これと並行して、流通、そして販売も現在、検討・取り組みを行っているところであります。
2018年1月期連結損益計算書の概要

ここで決算説明会ですので、財務的な内容をご報告したいと思います。
まず最初に、損益計算書、インカムステートメントです。大きな流れとしましては、開発が順調に今期進捗いたしまして、結果としてほぼ計画どおりの着地になっております。当期純利益をご紹介したいと思いますが、予想として39億円のマイナス、実績も39億円と、ほぼ予想どおりの着地になっております。
2018年1月期連結貸借対照表の概要

続きまして、貸借対照表、BSのほうになります。こちらやはり投資家のみなさま、現金のところが非常に気になるところかと思います。
一年前の2017年1月期末55億円を持ってスタートいたしました。この一年間で、先ほど示しましたように、かなりの開発の進捗を遂げました。かなり積極的な費用を計上し、ここに至っているわけですけれども、それにもかかわらず、今年1月期末、46億円のキャッシュをしっかり持って開発を継続しております。
こちらは内訳としては、入ってきたお金として大きかったところとして、カリフォルニアからの補助金20億円強があります。そして借入金もかなりの金額をコミットメントラインも含めて得ておりまして、十分な現金を確保しております。
現金及び現預金残高

キャッシュはみなさん、より注目しているところかと思いますので、もう少し詳細をご報告したいと思います。
こちら現在の46億円の資金になりますが、加えて先ほど申し上げた借入金は、みずほ銀行、そして三菱UFJ信託銀行からオフバランスのコミットメントラインも得ておりますので、あわせますと、かなりの金額を持って現在オペレーションを遂行している状況にあります。
2019年1月期連結業績予想

今期の予想に入ります。
今期も前期と引き続き、積極的に開発・事業課に向かっていく計画を立てております。具体的には市販後の体制構築、そしてエリア開発も含めて行っていこうという中、大体、事業費用を見ますと、前期同様のレベルの計画を立てております。トップラインデータがもうじき見えてきます。それを踏まえたところで、市販後の体制構築、エリア拡大とやっていきますので、期待をいただければと思います。
まとめ:開発パイプライン

最後にまとめになります。
やはり、開発型のバイオベンチャーですので、パイプライン、製品のパイプラインでご紹介を改めてするのが一番分かりやすいと思いまして、掲載しています。
私どもが開発している再生細胞薬は、ヘルスケアや薬の常識をくつがえす可能性を十二分に秘めている、非常に大きな取り組みであると考えております。その先陣をきっている製品がSB623です。その中のプログラムとして、脳梗塞、そして外傷性脳損傷ともに、治験のトップラインデータがいよいよ出てくるステージに入ってきております。
そこに、次に控えている臨床プログラム、次に入っていくものもたくさんございます。網膜色素編成ですとか、パーキンソン病、アルツハイマー病、そしてSB623に加えて、他の再生細胞薬のパイプラインを持っております。再生医療の会社として、非常に充実した製品のパイプラインを有しております。
まとめ:今後の取り組み

今後の取り組みとしましては、まずは1点として、現行プログラム、脳梗塞、それから外傷性脳損傷、これらをしっかりと開発を行っていきます。
2番目としましては、特に日本での条件付き承認を見据えて、市販を見据えた体系構築、量産化、流通、販売を行っていきます。
3番目としましては、さらにその先の成長をしていこうという中で、エリア、そしてパイプラインの拡大にも積極的に今期取り組んでまいります。
この3つの取り組みを行うことによって、より早くより良いかたちで、より多くの患者の方に、新しい薬を出して、そして企業価値をしっかり向上、最大化していきたいと考えております。
どうもありがとうございます。
新着ログ
「医薬品」のログ