【QAあり】オンコリス、OBP-301承認申請が最終段階へ OBP-601はPhase3への進展とアルツハイマー開始に期待
目次 Agenda

浦田泰生氏(以下、浦田):代表取締役社長の浦田です。よろしくお願いします。2024年度12月期の決算発表を行います。
現在、当社は主力開発品である「テロメライシン(OBP-301)」の承認申請に向け、最終段階に入っています。本日は目次に沿って、決算ハイライトのご報告に続き、「テロメライシン」の開発状況と、米国で開発されている「OBP-601」の進捗状況について詳しくご説明します。
財政状態の概況
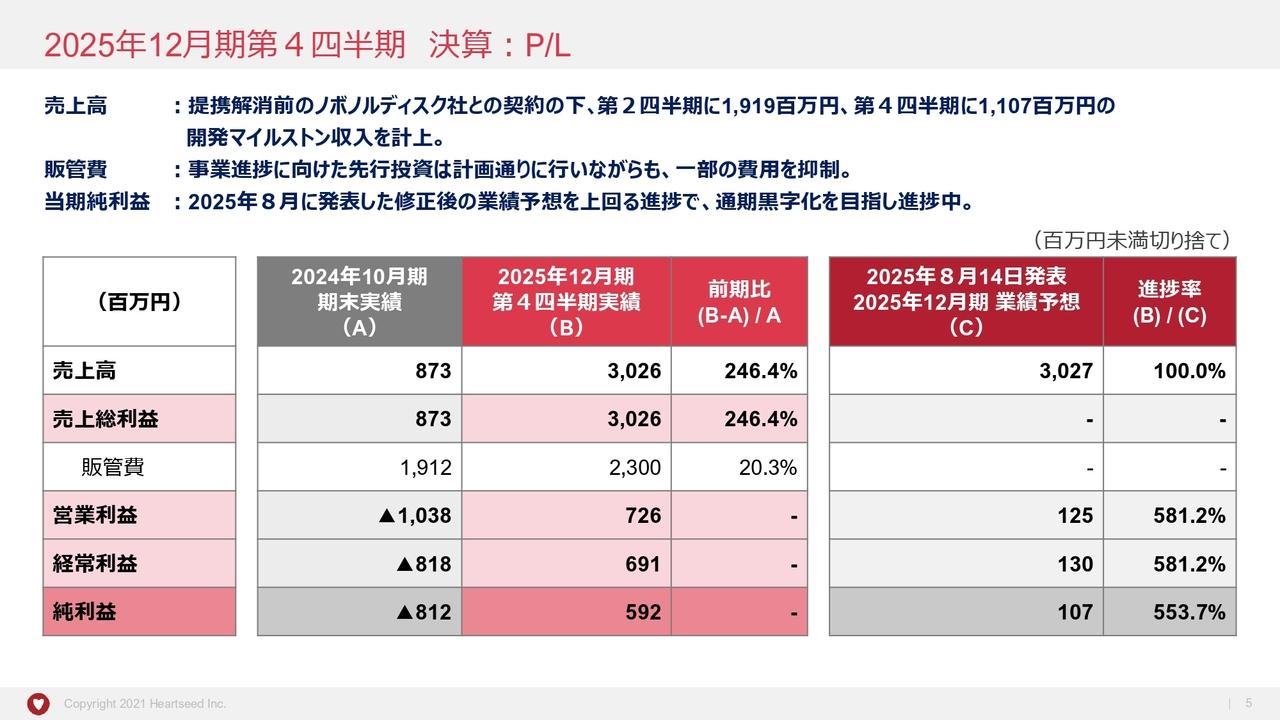
樫原康成氏:常務取締役の樫原です。決算ハイライトについてご説明します。
まずは、財政状態の概況です。スライド左側が資産の部です。2024年12月末の現金及び預金残高は24億1,100万円となり、2023年12月末の15億3,200万円と比較し、8億7,900万円の増加となりました。
現預金増加の要因としては、「テロメライシン」の申請準備や製造開発等への支払いがあった一方で、2024年に行った増資の影響が挙げられます。
現預金以外の資産のトピックとしては、前払金の増加があります。2024年12月末における前払金は4億8,000万円となり、2023年12月末と比較し、1億9,800万円の増加となりました。
これは、ウイルス製造を委託しているヘノジェン社への前払金の増加が主な要因です。なお、現預金と前払金を合わせると当社資産の93パーセントを占めています。
次に、スライド右側のように、純資産の部が86パーセント以上を占めています。純資産の部に関しては、資本金が51億800万円、資本準備金が26億9,400万円となっており、2023年12月末と比較し、それぞれ14億8,500万円の増加となりました。
これらの増加は、2024年に実施した合計30億円の資金調達によるものです。
経営成績の概況
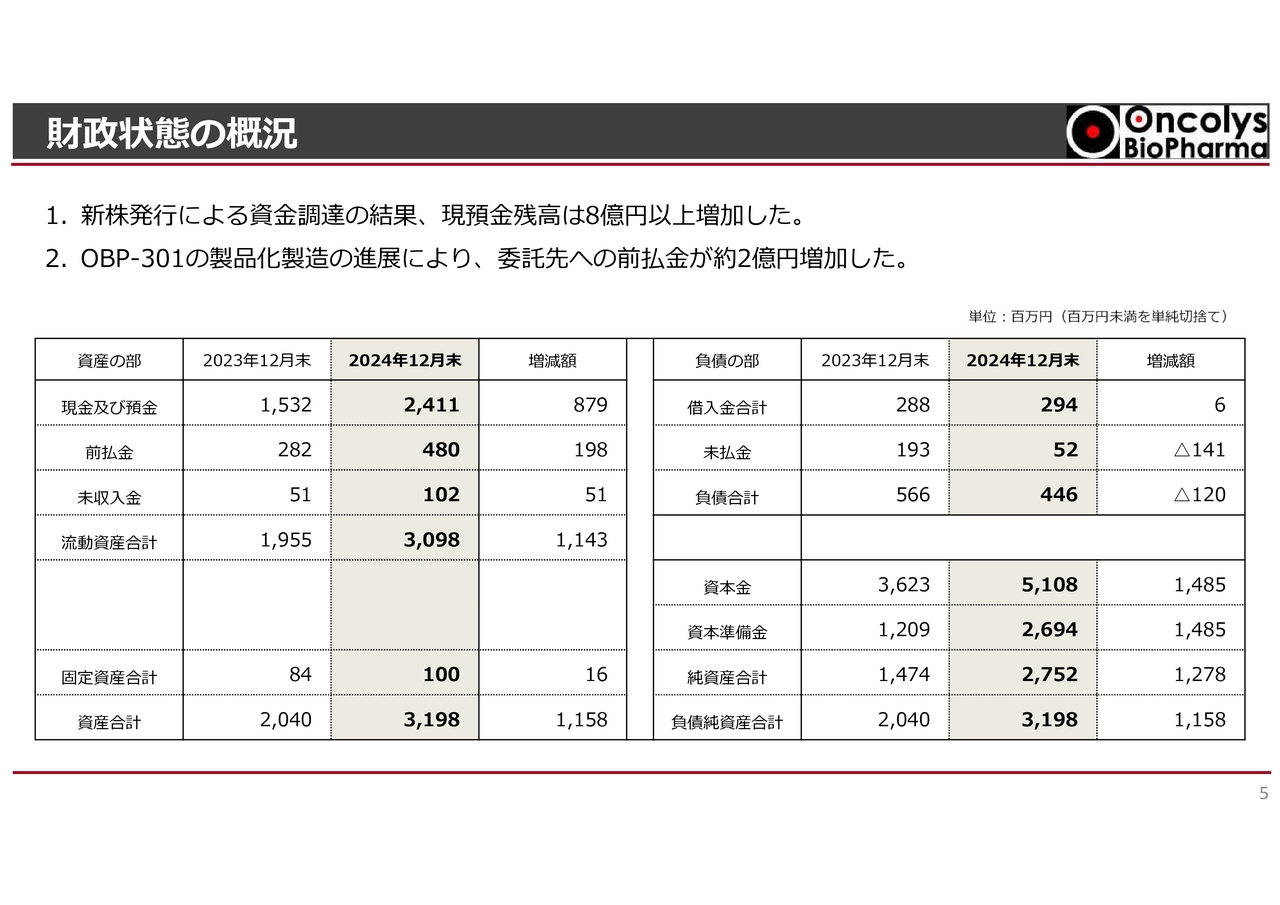
経営成績の概況です。2024年1月から12月の通期売上高は3,100万円で、2023年の6,300万円と比較し、3,200万円の減少となりました。
営業損失は、2024年は16億8,100万円であり、2023年の19億2,900万円と比較し、2億4,800万円縮小しました。これは、研究開発費が2億6,200万円減少したことが主な要因となっています。
研究開発費は会計上減少していますが、これは費用認識のタイミングのずれによるものです。実際の研究開発活動は、商用製造に向けたヘノジェン社での製造開発を中心に、引き続き積極的に進めています。
経常損失は、2024年は16億6,300万円であり、2023年の19億1,300万円と比較し、2億5,000万円縮小しました。これは、営業損失の改善に加え、1年間で16円ほど円安ドル高となり、外貨建て資産に関する為替差益が生じたことが主な要因となっています。
これらの要因により、2024年通期の純損失は16億8,400万円となり、2023年比で2億5,400万円の縮小となりました。
キャッシュ・フローの概況
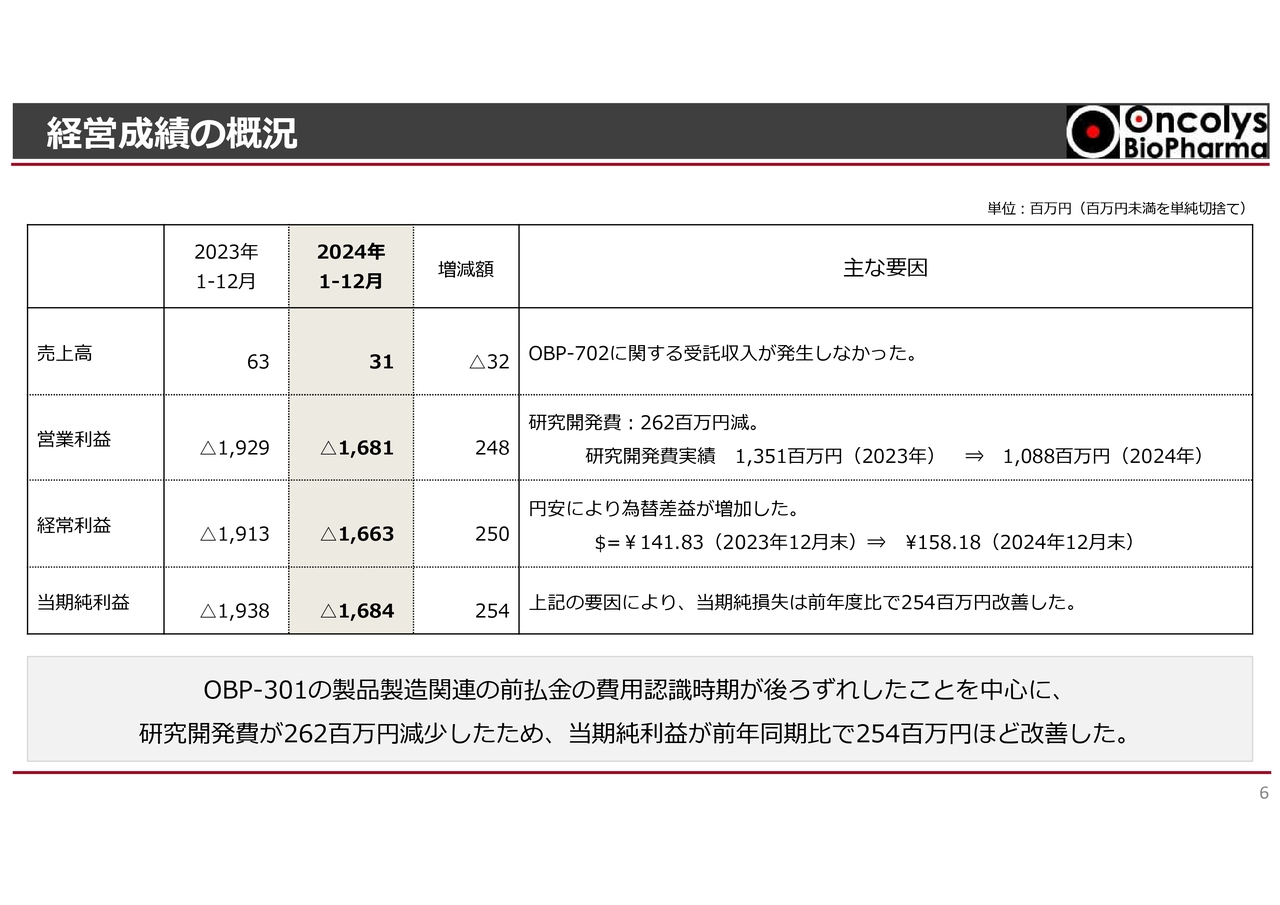
キャッシュ・フローの概況です。2024年の営業キャッシュ・フローは、20億2,000万円のマイナスで、2023年の13億3,600万円のマイナスと比較すると、6億8,400万円のマイナス幅の増加となりました。
税引前当期純損失は改善したものの、前払金の増加や未払金の減少などが主な要因となっています。
財務キャッシュ・フローについては、新株発行による資金調達の結果、2024年は28億7,900万円となりました。
営業キャッシュ・フローのマイナスを財務キャッシュ・フローの改善で相殺したことにより、合計キャッシュ・フローは2023年と比較し、10億5,600万円改善しました。
2025年12月期の業績見通し

2025年12月期の業績見通しです。2024年と同様に、当社の業績は未だ安定した収益を上げている状況になく、「OBP-301」に関する富士フイルム富山化学との販売提携契約や、Transposon社とのライセンス契約に基づくマイルストーン収入が主な収入源となっています。そのため、これらの収入の有無によって大きく変動する状況にあります。
したがって、現時点では、業績に与える不確定要素が高いと考えています。今年度の業績予想については、適正かつ合理的な数値の算出が困難と判断し、非開示とします。
また、第2四半期の業績予想についても、同様の理由から非開示とする予定です。以上、決算ハイライトについてご説明しました。
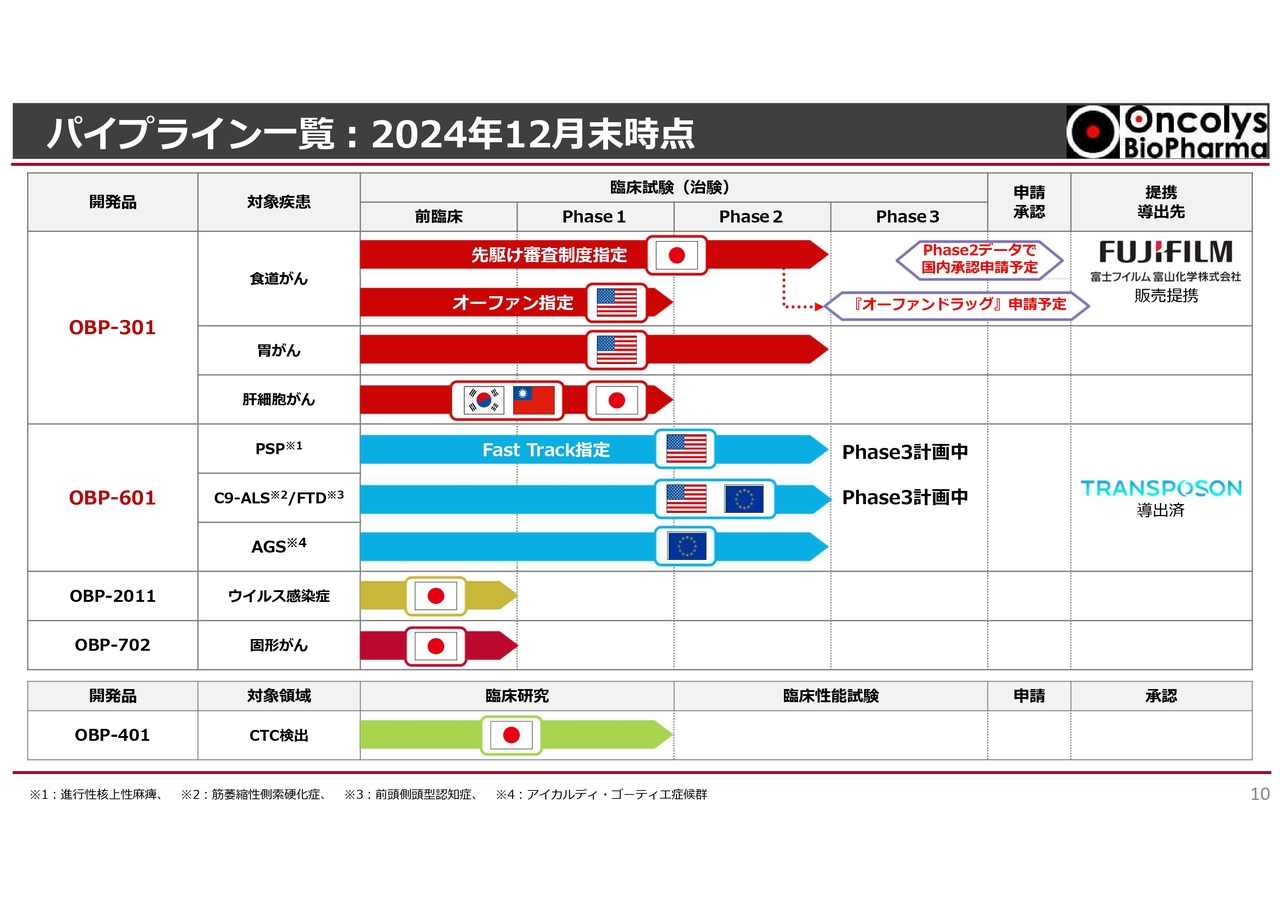
パイプライン一覧:2024年12月末時点
浦田:ここからは、「2024年にご期待頂きたい事項」を振り返りたいと思います。
まず、当社の事業の概括を知っていただくために、パイプライン一覧をご用意しました。スライド上部の赤いラインが「テロメライシン(OBP-301)」です。国内では食道がんの臨床試験がいったん終わったところで、今は承認申請の段階に来ています。
「テロメライシン(OBP-301)」は、米国においてもオーファン指定を受けており、昨今発表したように、放射線化学療法との併用において非常に良い結果が出ています。
スライド中央の「OBP-601」も順調に進捗しています。進行性核上性麻痺(PSP)を対象としたPhase2臨床試験も終わり、すでに優先審査、いわゆるFast Trackの指定を受けています。つまり、最終段階のPhase3に入る可能性が出てきたと言えます。
ALSを対象とした臨床試験についても、すでにPhase2/3の計画が立っており、いよいよ最終段階に入ります。
2024年のアチーブメント

昨年お約束したアチーブメントについてです。1番目の「テロメライシン」の承認申請は、残念ながら未達成に終わりました。
後ほど詳しくお話ししますが、PMDAの中で先駆け指定されたパイプラインに関して、非常に厳しい目が向けられるようになったという状況を反映し、事前相談がかなり長引いている状況です。
現時点では未達成ですが、非常に前向きに進み始めており、近い将来には、先駆けの総合評価相談に移行する予定です。
2番目は、商用製造の1バッチ完了です。十分な量を製造できましたので、達成としています。
3番目は、社内製造販売体制の構築です。製販業の許可申請も終わったため、達成できたと考えています。
4番目は、サプライチェーンの始動です。後ほどお話ししますが、製造場所から最後、臨床の現場まで届けるためのサプライチェーンが整いました。
5番目は、米国2nd Lineの「ペムブロリズマブ」併用胃がんPhase2臨床試験です。昨年スタートし、順調に症例の組み入れが進んでいる状況です。
スライド下部の青色で示した「OBP-601」については、PSP、ALSともにデータ解析が終わって、結果が発表できたため、すべて達成できたと言えます。
「テロメライシン」の承認申請に向けた動きは進んでいるものの、2024年に承認申請に一気に移行するという目論見は、残念ながら達成できませんでした。
①臨床データの総括 局所奏効率
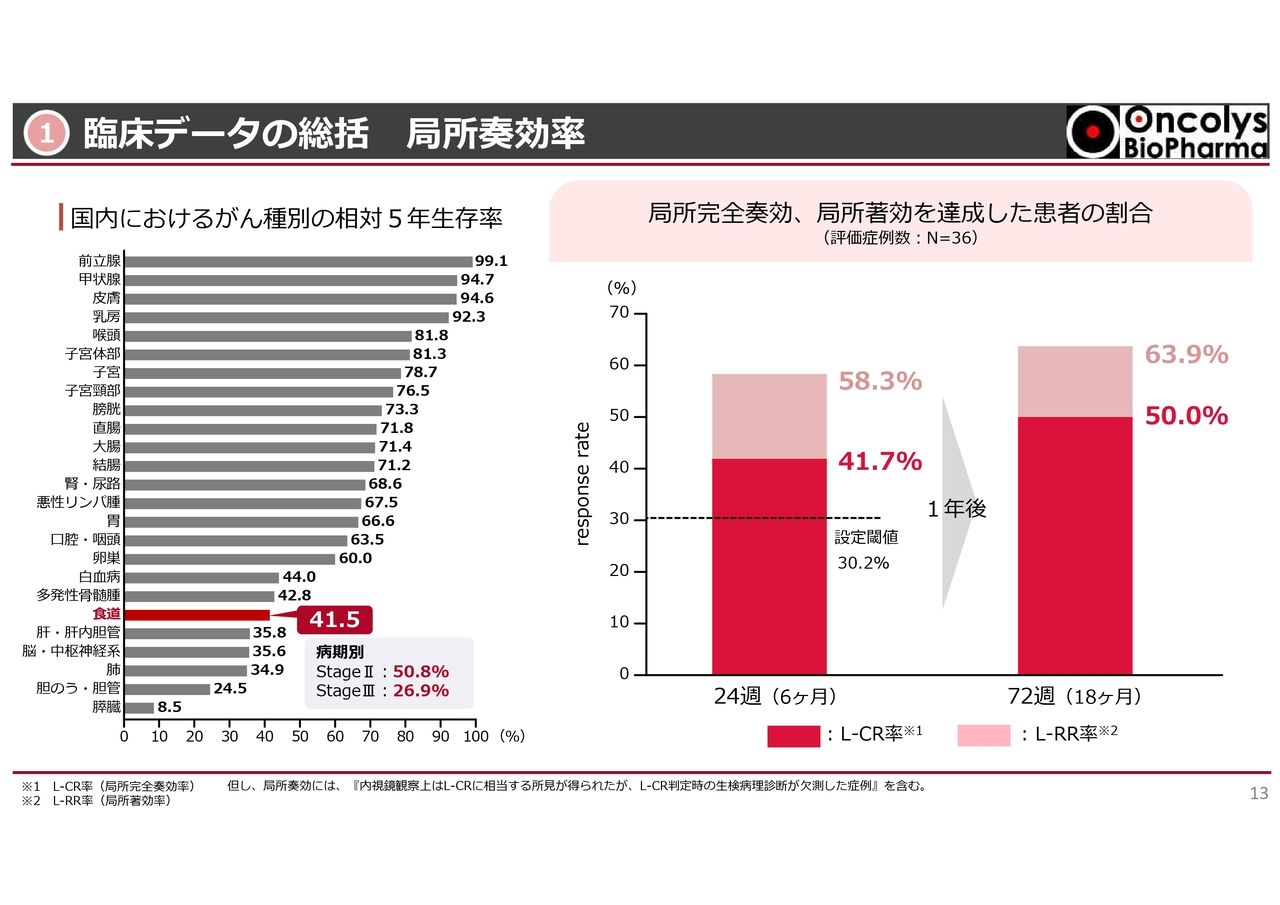
「テロメライシン(OB-301)」の臨床試験データの総括です。ご存じのように、食道がんは非常に生存率が悪いがんとされています。
その上で、当社の臨床試験では、Stage2またはStage3に進行した食道がんの患者さまで、なおかつ高齢で手術を受けられないような方や、臓器障害があって化学療法が受けられないような方を対象にしています。放射線単独治療に上乗せして、どこまで効果があるかを評価する臨床試験を行いました。
やや古いデータで、すべてが内視鏡で治療を確認したものではないため、若干信頼性が低くはありますが、2000年より前の食道学会でのレジストリデータによると、放射線単独で約30パーセントの効果が期待できるとのことでした。
この30パーセントを基準として臨床試験を行ったところ、スライド右側のグラフにて赤色で示したように、試験開始から24週(6ヶ月)後には41.7パーセントの患者さまで、局所完全奏効を示す「L-CR率」を達成しました。
スライドのグラフにピンク色で示した部分は、がんはほとんど消失したものの少し瘢痕が残っている症例です。放射線によるものか「テロメライシン」によるものかは不明ですが、ほぼ消えている症例も含めると、58パーセントという結果になりました。
さらに1年間フォローアップを行い、18ヶ月(1年半)になると、ほぼ半数の方で局所のがんが完全に消えたという非常に高い治癒率を示しました。
局所著効を示す「L-RR率」を含めると、約64パーセントの方で局所のがんがほぼ消失するという、非常に高い治癒率があったと評価しています。
①臨床データの総括 生存率
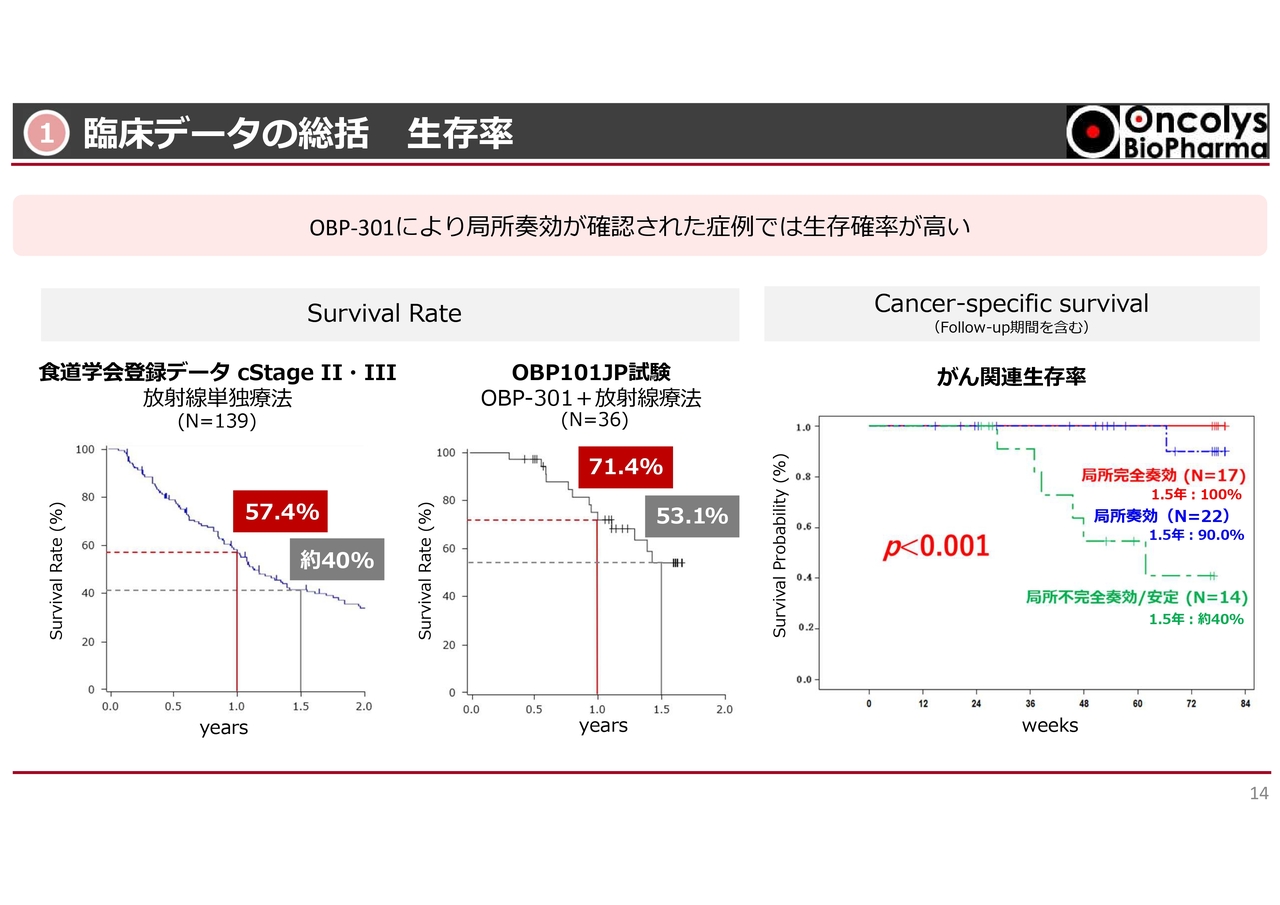
このような局所奏効は、食道がんにおける生存率にも影響を与えています。スライド左側に示した過去の食道学会の登録データによると、1年生存率が約57パーセント、1.5年生存率が約40パーセントとされています。
しかし、スライド中央に示した当社が実施した今回の臨床試験では、1年生存率が71パーセント、1.5年生存率が53パーセントと、過去の食道学会の登録データよりも高い生存率が得られています。
ただ、この生存率には、高齢の患者さまが多かったことも影響しており、合併症や他の要因で亡くなった方も含まれています。
スライド右側に示した「がん関連生存率」のグラフでは、食道がんによって亡くなった方の割合を示しています。緑色のラインは、今回の臨床試験で局所不完全奏効となった方の割合で、そのような方は1年から1年半にかけて、約半数の方が亡くなりました。
一方で、今回の試験で非常によく奏効したL-CRの方においては、1年半経過後も、100パーセントが生存していました。また、少し瘢痕が残っているL-RRを含めても、約90パーセントが生存していました。
これらの結果から、食道がんにおける局所治療が、がん関連生存率に非常に強く関連していることが示されたため、現在、このデータの詳細についてPMDAと話し合いを進めているところです。
①食道がん放射線Phase2試験の結論

スライドの5番目に記載しているように、全身のがんがどのようになったかを表す判定基準であるRECISTに基づく過去の臨床データを示した論文では、だいたい15パーセントから19パーセントの方において、放射線単独で全身のがんが消えました。
しかし、今回の当社が実施した臨床試験では41.7パーセントという結果でした。このことから、全身に対しても非常に良い結果が得られたのではないかと考えています。
主な副作用としては、ウイルス感染を引き起こすため、風邪のような症状が約半数の方に認められました。放射線治療の影響も否定できませんが、「テロメライシン」の作用により、リンパ球数の低下が49パーセント、すなわち約半数の方に認められました。
これらの副作用は、一過性のもので、治験が終わった後には全部元どおりに戻っていることが確認されました。臓器障害等の副作用は認められていません。
したがって、「テロメライシン」は高齢で手術が受けられない方や、化学療法を受けられないような方に対して非常に有効であり、かつ安全に投与が可能であることが示されました。
①承認申請に向けて
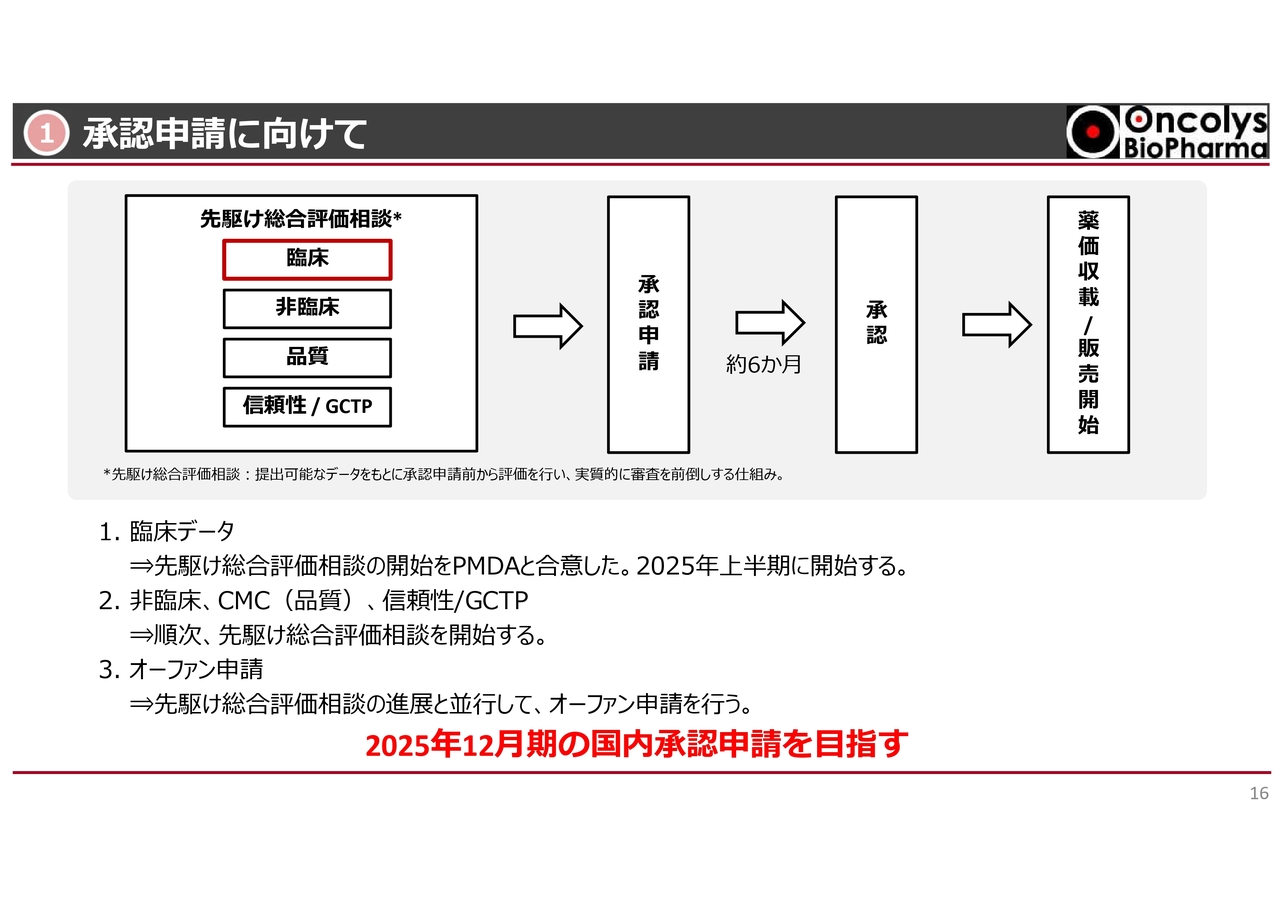
現在、PMDAと最後の調整を行っているところですが、いよいよおそらく4月までの間に、先駆け総合評価相談という段階に入ると考えています。
先駆け総合評価相談では、まず臨床データの評価が行われます。これまでお話ししたようなデータについては、PMDAも基本的に理解しているとのことです。それ以外にも、過去のPhase1の結果や、米国で実施した臨床試験の結果を含めて評価されることになります。
この評価が終わると、非臨床、品質(CMCなど)、信頼性を含め、順次ローリングで評価が行われることになっています。臨床データが受け入れられれば、年内にオーファン申請を行う予定です。このような段階が終わると、いよいよ本承認申請になります。
現在のスケジュールを踏まえると、年内に承認申請を行うことは十分可能であると考えています。年内に承認申請した場合、これまでの結果からみて、6ヶ月くらいで本承認が下り、その後、薬価収載が行われる見込みです。
これが実現すれば、「OBP-301」は来年に薬価収載が行われ、いよいよ発売となる予定です。国内承認申請を目指し、年内に目的を達成したいと考えています。
2025年の臨床開発の方針

「OBP-301」に対して、今年どのようなことが予定されているかをご説明します。通常、先駆け総合評価では、主に過去の臨床試験データを評価します。
しかし、今回は少し異例で、スライドに赤字で記載しているように、『市販後臨床試験計画』の提出をPMDAから要請されました。当社ではすでに研究会を行い、市販後臨床試験計画の詳細をほぼ固めています。
昨年、他社の製品ですが先駆け指定された2つの医薬品において、承認申請時に用いた有効性を市販後臨床試験において再現できなかったという事例がありました。
市販後臨床試験で良い結果が出ないのは、やはり問題となります。当社に対しても、市販後臨床計画を厳密に評価するとの指示が出ました。臨床試験計画書と併せてデータをまとめて、PMDAに提出し、先駆け総合評価の段階に移りたいと考えています。
さらに、当社としては、食道がん領域の研究会を発足させ、単独投与による腫瘍縮小の可能性等について検討します。
今後、主力になるであろう免疫チェックポイント阻害剤との併用についても、例えば食道の閉塞が止まらない方に「テロメライシン」を投与することで嚥下障害が改善するかを検討する試験も計画しています。
今後はこのような治療可能性を追求し、食道がん以外にも、例えば、口腔がんのような治療薬がない領域にもチャレンジしていきたいと考えています。
しばらく遠ざかっていた「OBP-702」についても、岡山大学と当社との共同で申請を検討し、助成金の獲得に向けた状況が少し進展しています。採択された場合、年内に助成金を獲得し、臨床試験が再スタートする可能性があります。採択されるかどうかはまだわかりませんが、その助成金次第で「OBP-702」の開発も進めていきたいと考えています。
②商用製造の状況
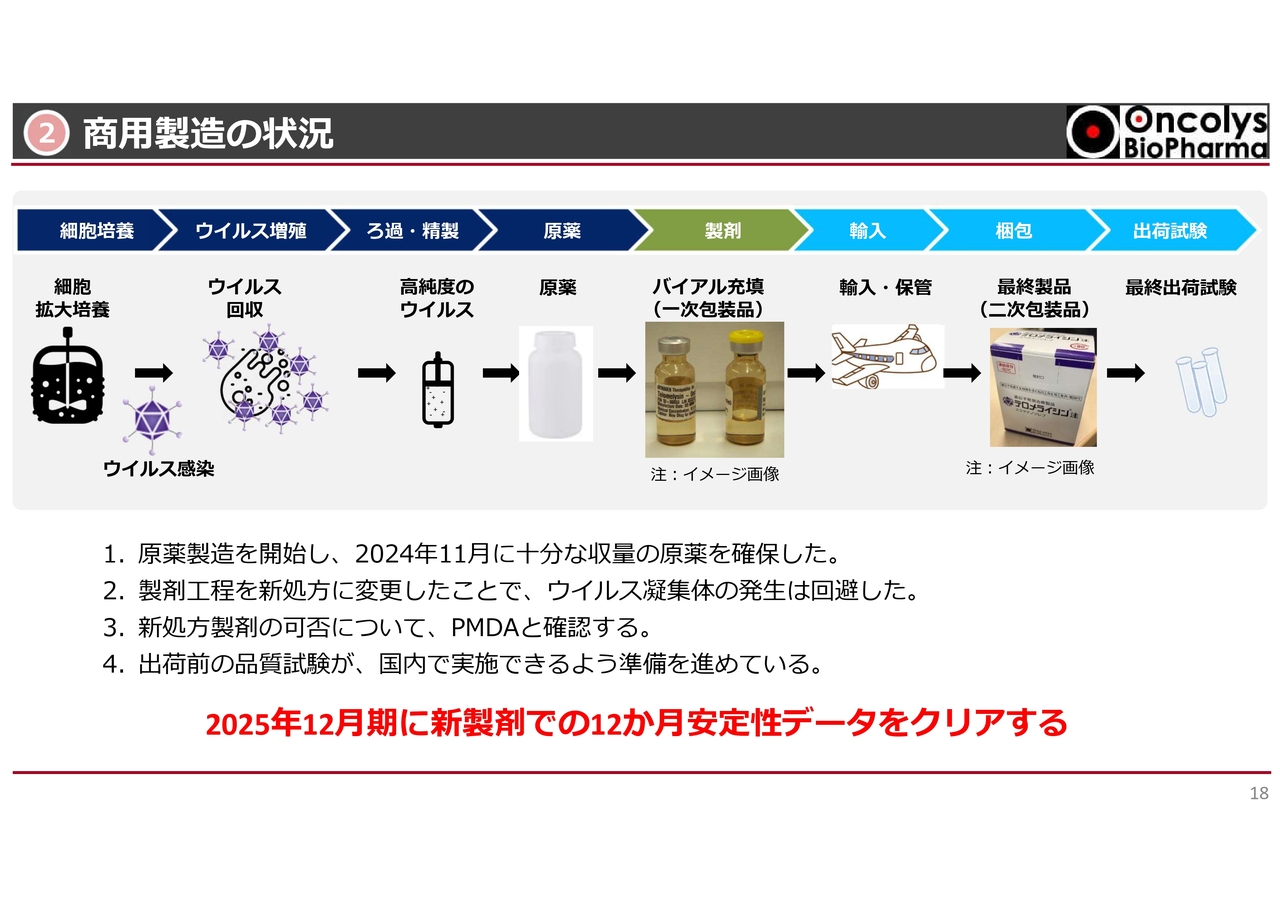
スライドの図は、商用製造の過程を示しています。左から順にご説明します。
まず、タンクで細胞を培養し、ウイルスを増殖させます。そこからカラムでウイルスを生成し、原薬を作ります。その後、中央のイメージ画像のように、バイアルに原薬を入れてラベルを貼り、国内に輸入され、箱詰めされます。この箱詰めは、三井倉庫ホールディングスで実施されます。
箱詰めして最終出荷のための試験も行わなければならないのですが、このような過程で、「テロメライシン(OBP-301)」製剤を製造します。
昨年、この「テロメライシン」の原薬については製造が終わり、十分な収量を確保できました。今年度は、このバイアル充填以降の過程を行っていく予定です。
昨年もお話ししましたが、もう1つ今年するべきことがあります。バイアル充填をした後にウイルスが凝集し、わずかに濁る事象がありました。こちらについては、スライドの3番に記載しているとおり、新処方製剤を開発しました。PMDAとも相談の上、本相談の際に評価する予定です。
ウイルス凝集体の発生を回避できることが確認できたため、すでに安定性試験も行っています。その結果、少なくとも半年くらいは凝集が発生することなく、安定した状態で保管できることがわかりました。
出荷試験についても、ほぼすべての出荷試験を国内でもできるように、現在準備を進めているところです。京都にあるユーロフィン社と共同で出荷試験を行う予定です。
これらを十分に行うことで、今年中に新製剤での12ヶ月安全性データをクリアできると考えています。
③製造販売体制の構築
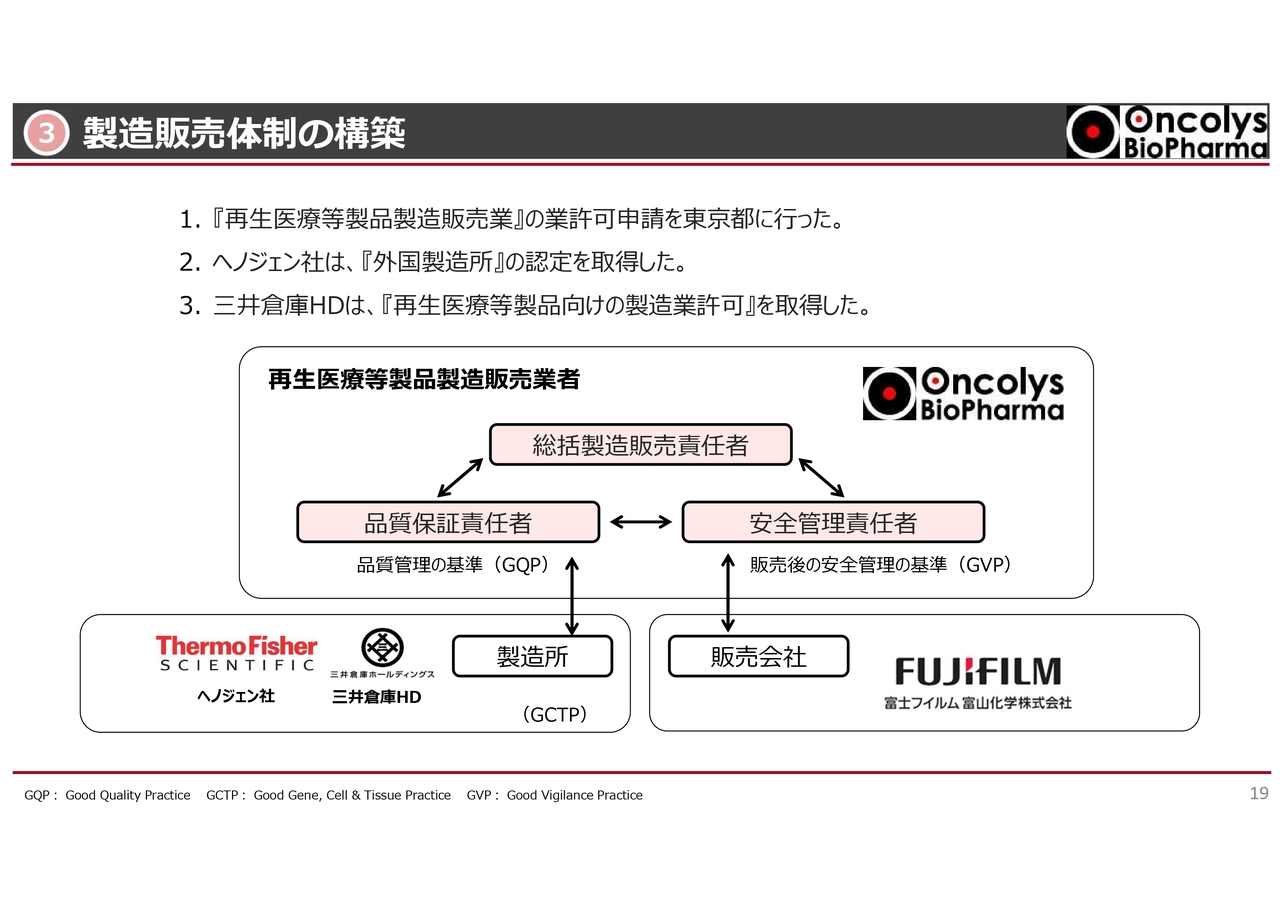
製造販売体制の構築についてです。スライドの1番に記載しているとおり、「再生医療等製品製造販売業」の許可申請を東京都に行いました。しかし、この許可が下りるかどうか、もう少し時間がかかりそうです。
2番のヘノジェン社は、Thermo Fisher(サーモフィッシャー)社に買収されているため、スライド左下の絵にはThermo Fisher社のロゴがありますが、このヘノジェン社が、日本国内において「外国製造所」の認定を取得しています。
3番の三井倉庫ホールディングスも、「再生医療等製品向けの製造業許可」を取得しています。
スライド中央にピンク色で示しているとおり、当社で総括製造販売責任者、品質保証責任者、安全管理責任者の三役を指名し、製造販売体制が出来上がりつつある状況です。
④サプライチェーン
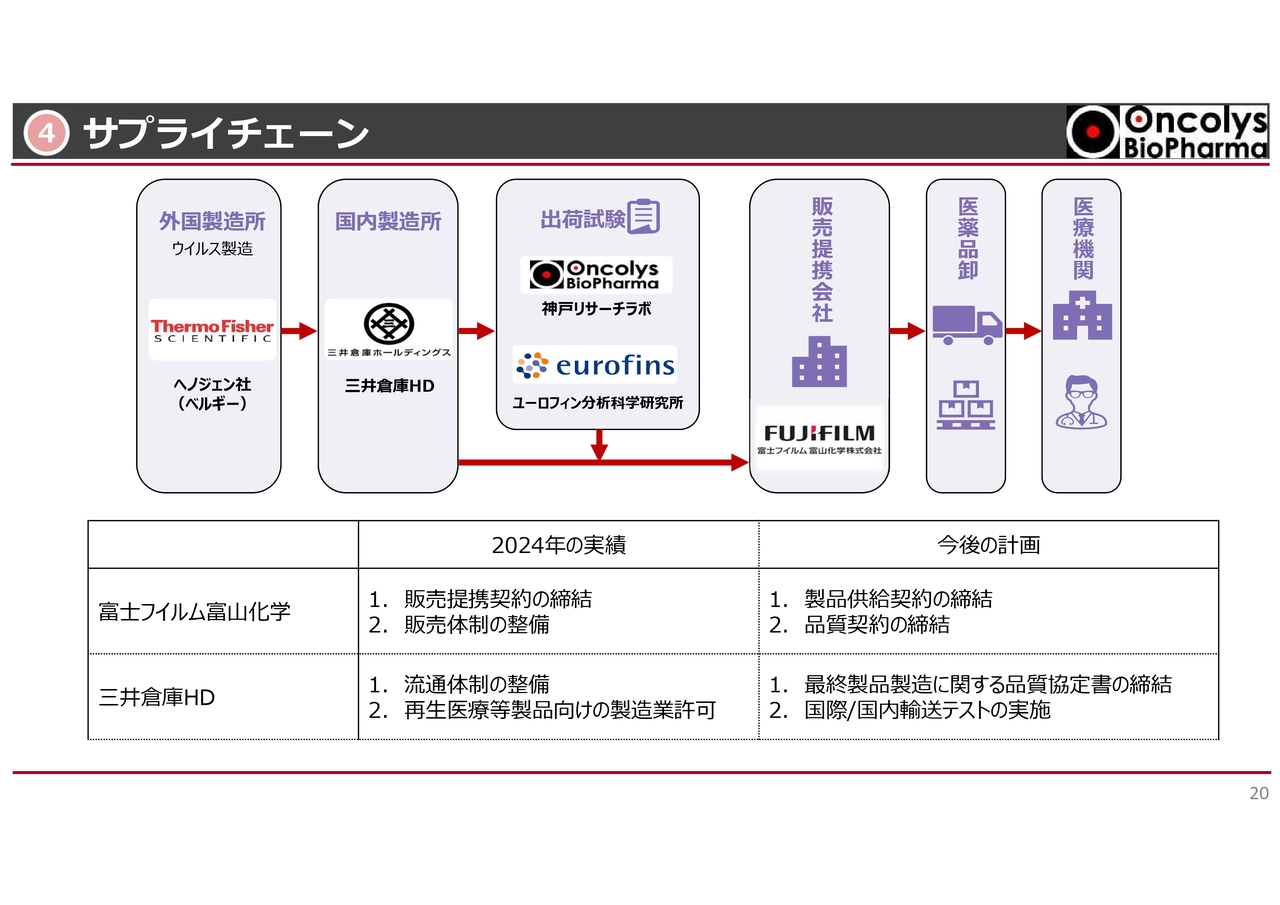
サプライチェーンについてです。ベルギーのヘノジェン社(現在はThermo Fisher社傘下)から国内の三井倉庫ホールディングスに入った後、京都にあるユーロフィン分析科学研究所と当社の共同で出荷試験を行います。
そして、「良し」と判断された場合には、富士フイルム富山化学を通じて卸業者を経由し、医療機関に運ぶという体制が整いつつあります。
そのような意味で、2024年の実績は下の表のとおりです。今年2025年に行わなければならないこととして、富士フイルム富山化学とは製品供給契約、あるいは品質契約を締結するという大きな仕事が残っています。
また、三井倉庫ホールディングスとも、最終製品製造に関する品質協定書の締結があります。さらに重要なこととして、実際に海外から国内まで輸送し、安全に滞りなく倉庫まで届くかどうかのテストも、今年は何度か回数を重ねて、より万全なものにしていきたいと考えています。
以上、国内での「テロメライシン(OBP-301)」の状況についてお話ししました。
化学放射線併用Phase1試験:ASCO-GIで発表

海外においてもいくつか進捗がありましたのでご報告します。
米国のNRGグループは、RTOG studyという論文にもよく出ており、米国でいろいろながん治療のガイドラインを作っています。スライド左の表は、このグループが中心になって実施した化学放射線併用のPhase1試験の結果で、ケモラジ(化学放射線療法)と「テロメライシン」が併用されて臨床で投与されました。
日本とは異なり、米国ではカルボプラチン、パクリタキセルが標準療法ですが、それに放射線を上乗せして「テロメライシン」を投与した、という臨床試験です。
15例が登録されましたが、2例については「テロメライシン」を投与する前に状態が悪くなったため試験を離脱された方や、途中で「テロメライシン」以外の原因によって離脱された方がいたため、安全性評価は15例ですが、有効性評価は13例で行われました。
この結果が100パーセントのclinical CR、要するに局所のがんが完全に消えたという、我々も予想しなかった結果が得られました。この1月にサンフランシスコで行われたASCO-GIという学会でその結果を報告し、注目を浴びました。
主な副作用においても、軽度の風邪関連の症状で、少なくとも「テロメライシン」で起こったと判断されたのが20パーセント程度でした。また、放射線では起こることではありますが、7パーセントくらいの方に見られた食道炎に「テロメライシン」も関連しているのではないかとみなされています。
スライド右側のRTOG 436は、ケモラジ(化学放射線療法)に抗体薬を上乗せするのが良いのかどうかという試験です。これも過去に大規模に行われましたが、差が出ませんでした。
しかし、今回の結果が出たことで、このような大規模スタディで「テロメライシン」を上乗せすると、この生存率曲線がもっと上にいくのではないか、と予想されます。
実際に、米国の研究の中心の施設になったスローンキャタリングがんセンターの先生方からは、ぜひとも大規模な臨床試験を行いたいとのことで、現在FDAと「End of Phase1 Meeting」を計画しています。今後、どのようなプロトコルで次の検証試験を行えば良いのかを話し合うことになっています。
こちらも資金はかなりかかりますが、臨床試験の計画だけはしっかり立てた上で、今後本当に行えるのかどうか、あるいはグラントなど外部資金を使って行えるのかどうかを検討していきたいと考えています。
⑤米国2nd Lineのペムブロリズマブ併用胃がんPhase2臨床試験
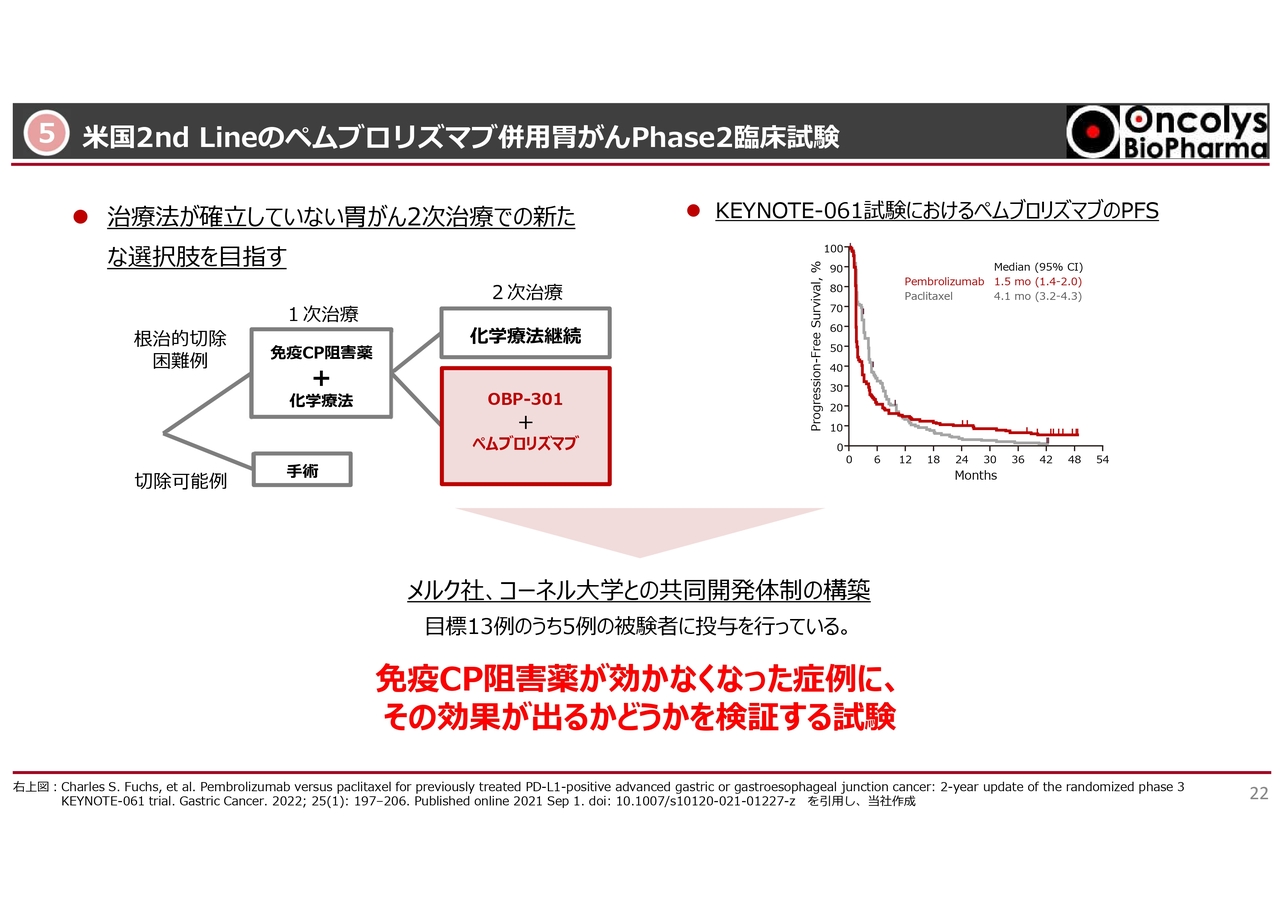
米国で行われている「ペムブロリズマブ」、免疫チェックポイント阻害剤の胃がんの臨床試験については、1次治療ではなく2次治療を狙って、臨床試験が行われています。
これは、当社とメルク社が費用を折半で行っている臨床試験です。米国のコーネル大学との共同開発体制をとっています。
スライド右側は、「ペムブロリズマブ」のPFS(Progression-Free Survival)の曲線ですが、やはり胃がんで手術もなかなかできない方の場合は、生存率が非常に悪くなります。
約8割の方はTreatment Failure、治療失敗したという結果になりますが、この大きなポピュレーションに対して、今回さらに「テロメライシン」と「ペムブロリズマブ」を上乗せし、さらに「ペムブロリズマブ」の効果が戻ってくるかどうかを検証しました。
実際、本試験よりも前に行った試験では、「ペムブロリズマブ」と併用して「テロメライシン」を上乗せで投与すると、「ペムブロリズマブ」が効かなくなった方もまた効くようになったという結果がありました。
今回もこの結果から、数十パーセントとは言いませんが何例かのレスポンダーが出れば、これは次のステージに進んでも良いくらいの非常に価値ある臨床試験になると思っています。
今後もまだ症例を積み重ねる予定になっているため、その後についてもまたご報告したいと思います。全部で27例まで進行する予定です。
メディジェン社に台湾の販売権を許諾
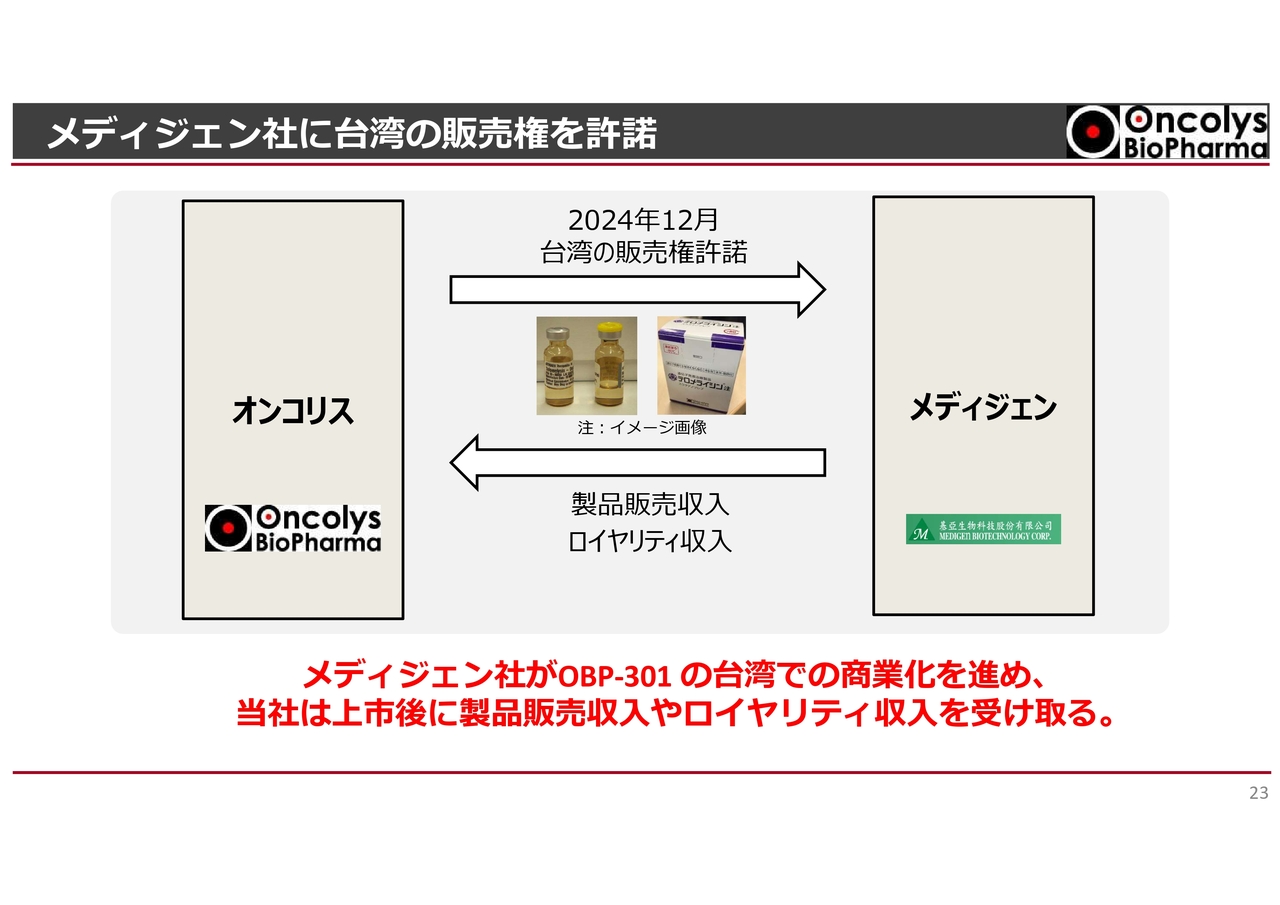
もう1つ、ビジネス上で進展がありました。当社は2008年からメディジェン社という台湾の会社と共同開発体制をとっており、コストシェア・プロフィットシェアの体制をとっています。
今回、メディジェン社との話し合いにおいて、「テロメライシン」の台湾における販売権を許諾する契約を結びました。それに伴い、当社が製品を販売し、将来ロイヤリティも入ってくる体制が整いました。
このように、国内で許可が取れれば、同様の契約をアジア、あるいはヨーロッパ諸国も含めて少しずつ広げていきたいと考えています。
⑥PSP(進行性核上性麻痺)Phase2

ここからは、「OBP-601」についてお話しします。
これは、もともと抗エイズ薬で開発していたものを難病治療薬に転化するというドラックリプロファイリングに入ると思いますが、ニューヨークのブラウン大学の先生方にリプロファイリングしていただき、今、臨床試験が続いています。昨年すでにファストトラック、つまり優先審査に指定されました。
PSP(進行性核上性麻痺)は、パーキンソン病と非常に似ていますが、手足が震えたり、歩いていて突然転んでしまったりというもので、ゆくゆくは認知機能にも影響が出てくる病気です。
これに対し、脳脊髄液中でのニューロフィラメントL(NfL)という神経の分解マーカーを抑制し、炎症マーカーであるインターロイキン6(IL-6)も抑制するという結果が出ました。昨年7月にはFDAと「End of Phase2 Meeting」を行い、Phase3への移行が強く推奨できると判断されたようです。
⑦C9-ALS(筋萎縮性側索硬化症) / FTD(前頭側頭型認知症) Phase2

C9-ALS(筋萎縮性側索硬化症)とFTD(前頭側頭型認知症)については、この両方の臨床試験を行いましたが、残念ながらFTDのほうはデータに非常にばらつきが多く、Transposon社でもまだ最終的な評価ができていないようです。
一方で、特殊な遺伝子変異によるALSであるC9-ALS、ALS全体の約33パーセントの患者さまがこちらに該当しますが、この臨床試験で非常に良い結果が出ました。
この患者さまは肺活量がどんどん減っていくのですが、だいたい1年間の投与で、肺活量低下の進行を50パーセントくらい抑制したという結果が出たため、単なるバイオマーカーだけの変化ではなく、器質的な変化もきちんとリリースすることができました。
こちらも昨年のALSの学会で報告を行い、少しインパクトが与えられたと聞いています。
この1月に「End of Phase2 Meeting」をFDAで行いました。こちらも次のステージ、少なくともピポタル試験、つまり最終臨床試験に移行する意味は十分あるだろうと判断されたと聞いています。
トランスポゾン社の今後の展開

PSPやALSは非常に難治性の神経疾患ですが、最終臨床試験に進むためにはかなり大きな臨床試験を行わなければならない状況です。
そのためにも、Transposon社としては、資金調達するか、グローバル製薬企業へライセンスするか、M&Aも含めたあらゆる可能性をいろいろと考えているようです。
現段階ではまだ教えてもらっていませんが、来月、向こうの社長と会談するため、将来どのような状況が見込まれるのか、あらためてもう少し詳しいご案内ができればと考えています。
ただ、ライセンスをされた場合でも、あるいはM&Aされた場合でも、当社とTransposon社のライセンス契約は引き継がれるためマイルストーンなども引き継がれます。いずれにしても、今後Transposon社での「OBP-601」の臨床試験が進めば、当社には大きな利益が入ってくる可能性が高いと考えています。
神経難病領域におけるディールサイズ

「OBP-601」は、特にALSに対して非常に期待されています。
みなさまもご存知かもしれませんが、スライド右上に記載のとおり、「Tofersen」(トフェルセン)という、バイオジェン社が開発している薬があります。これは、ALSの呼吸機能などにはあまり影響がなかったのですが、バイオマーカーに対しては効果があったということで許可になっています。
ただ、「Tofersen」は、腰の背骨の中に注射針を刺す腰椎穿刺で、最初は髄腔内に2週間おきに投与しなければならないため、非常に侵襲性が高く、リスクを含みながら注射しなければならない薬です。
一方で、当社の「OBP-601」は、長期間投与しても安全であることはHIVの試験でも確認されており、今回の試験でも1年間では安全です。脳内にも移行するため、1日1回の経口投与で済むという非常に大きなアドバンテージもあります。
この薬が早くPhase3に進み、許可にもっていけるようなパートナーが見つかると良いのではないかと個人的に思っており、大変期待しています。
特に、神経領域におけるベンチャー企業から大手製薬企業のライセンスは、1,000億円から数千億円という大きな金額で行われています。我々の「OBP-601」も、将来大きな数字になっていけばと個人的に期待しています。
2025年にご期待頂きたい事項

最後に、この状況を鑑みて、「2025年にご期待頂きたい事項」として、8項目を挙げました。
1番目に、「テロメライシン(OBP-301)」は、遅くても3ヶ月内くらいには先駆け総合評価相談を開始したいと思っています。
2番目に、それにより、年内に国内で承認申請を行います。
3番目に、同時に国内のオーファン申請も行いたいと思っています。
4番目に、まだ許可が下りていませんが、再生医療等製品の製造販売業の業許可もしっかり取得していきたいと思っています。
5番目に、新製剤での12ヶ月の安定性試験も、なるべく長期間評価していますが、年内には12ヶ月で十分安定であるという結果をクリアしていきたいと思っています。
6番目は少し毛色が違いますが、知的財産権に関することです。腫瘍溶解ウイルスを内視鏡投与するという特許ですが、我々が内視鏡を用いた腫瘍溶解ウイルスの投与を他社に先行して行っている状況であるため、この特許をなんとか獲得したいと考えています。これにより、当社の「テロメライシン」の地位を保全していきたいと思っています。
7番目に、「OBP-601」については、ALSあるいはPSPといった臨床試験の最終臨床試験、ピボタル試験と言いますが、これが年内にしっかり開始され、マイルストーンを受領できる状況にしていきたいと考えています。
8番目に、「OBP-601」は、アルツハイマー病での新たな臨床試験計画がすでに立ってきています。こちらも年内にPhase2を開始する可能性があると考えているため、こちらもご期待いただきたい事項に含めてご報告します。
2025年12月末のパイプラインの見通し
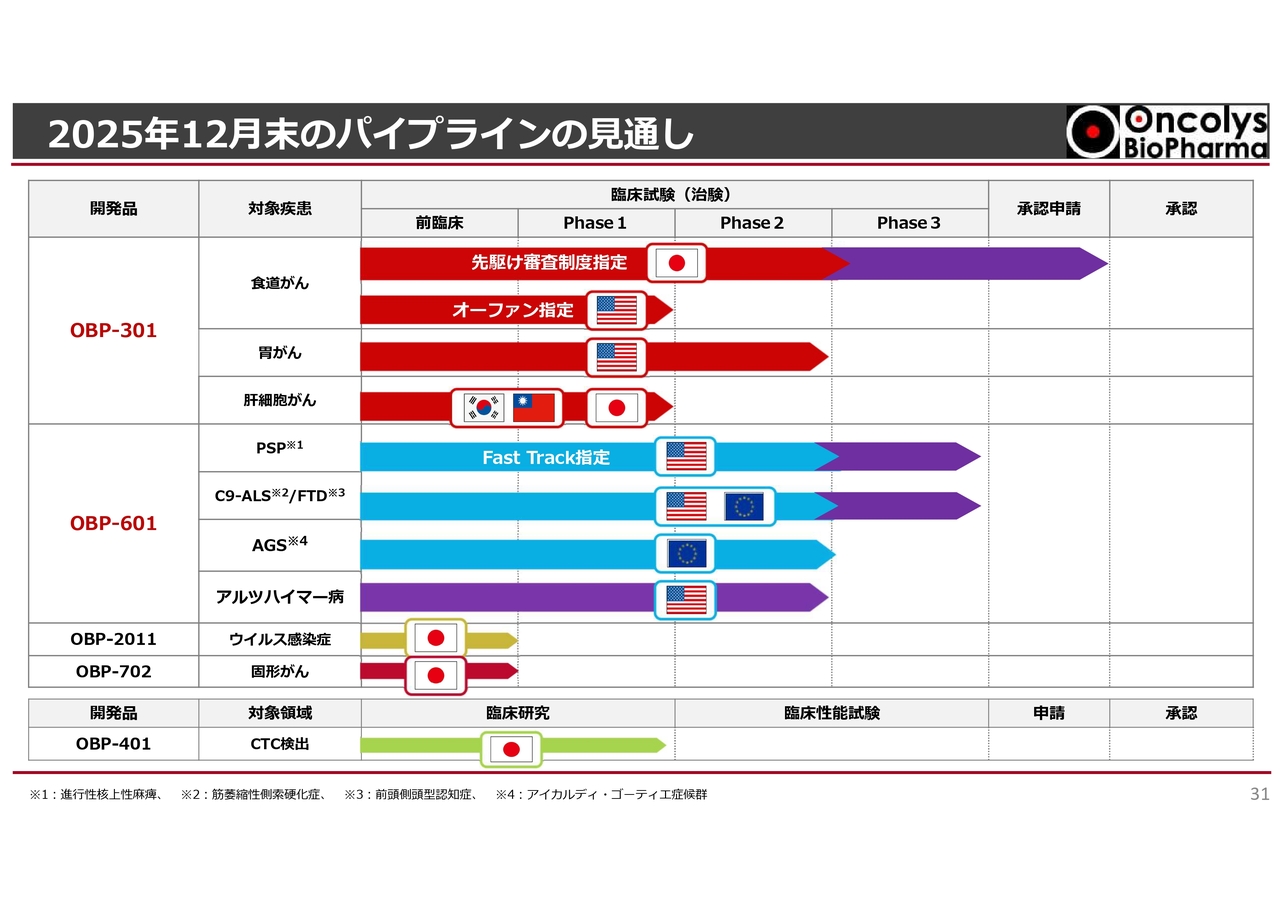
2025年12月末のパイプラインの見通しです。スライドの紫色の矢印のように、年内に進捗していくと考えています。
「テロメライシン(OBP-301)」はいよいよ最終段階に来ており、さらに大きな臨床試験も期待される状況です。「OBP-601」についても、最終段階の臨床試験という非常に大きな転換期を迎えているため、我々社員一同がんばっていきたいと考えています。
経営戦略

特に、今はライセンス型のモデルから製薬型モデルへの転換期で、人も多く入ってきています。なんとか製薬型のビジネスモデルを主体にできるようにがんばっていきたいと考えています。
以上で私からのご説明を終わります。
質疑応答:「テロメライシン」の製造状況(CMC)について
司会者:「テロメライシン」のCMCに関して教えてください。ウイルス凝集体に関しては問題が解決した
新着ログ
「医薬品」のログ