リボミック、当期純利益ベースで前年比38%の損失を改善 臨床試験が順調に進展、パイプラインの導出を交渉中
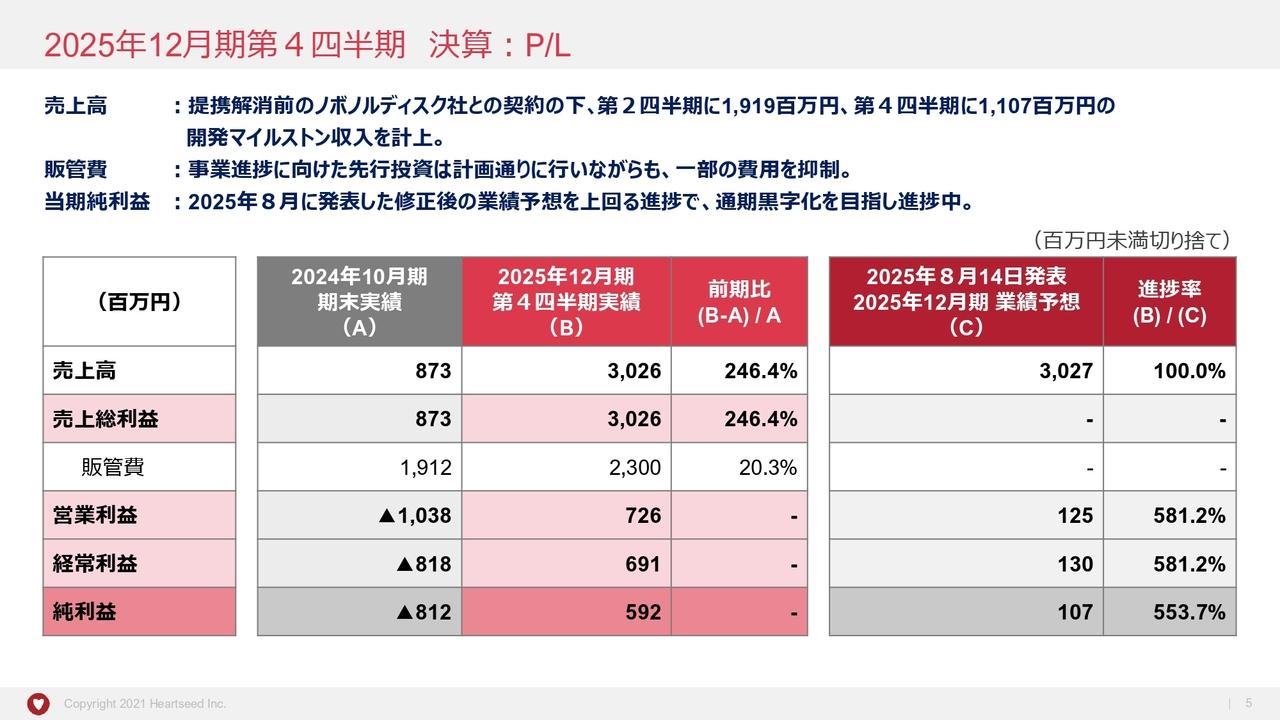
損益計算書の概要
中村義一氏:リボミック代表取締役社長の中村です。本日は、Webを通じて2024年3月期の決算説明会にご参加いただき、ありがとうございます。
2024年3月期決算についてご説明します。スライドには、損益計算書の概要をまとめています。2024年3月期は、当期純利益ベースで2023年3月期比38パーセントの損失を改善しました。2023年3月期は約16億円のマイナスでしたが、2024年3月期は約10億円に収めることができました。
研究開発における原薬や医薬品の合成に関して効率的な合成を行ったことにより、かなり節約ができたことが主な要因となり、38パーセントの損失改善につながりました。
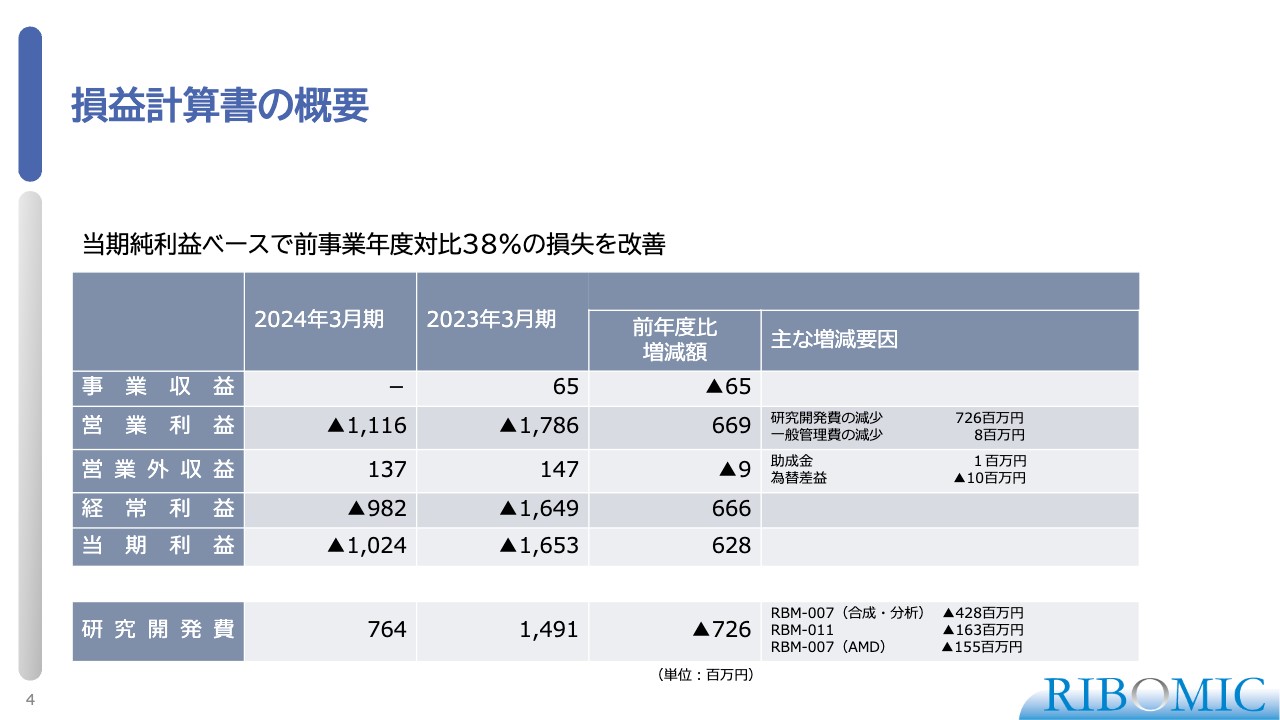
貸借対照表の概要
貸借対照表についてご説明します。スライドの表に示しているように、我々は現状で、資金として33億円強のキャッシュを保有していますので、今後十分に研究開発を進められる資金があります。
新しいプログラム「RBM-006」の臨床に向けて、研究開発を目的とした新株予約権を発行し、約9億円の調達を予定しています。我々のキャッシュの状況としては、目的どおりの推進のために十分にあると考えています。
資金調達

新株予約権に関しての資金調達について、2024年3月7日を割り当て日、SMBC日興証券を割当先として、約9億円の資金調達を行う決議をしました。
現在、株価の動静を見ながら行使を停止している状況で、約9パーセントを行使済みです。今後、株価がもう少し上昇したところを見計らい、再開する考えです。
公的研究助成金

これまで、公的な研究資金として、AMED等を中心に非常に多額の公的資金をいただきました。それらの主なプログラムが概ね終了し、現在はスライドに記載しているようなAIを使用したアプタマー創薬のプロジェクトを2件推進しています。
いずれも非常に高い評価をいただいており、特にJSTのプログラムでは例外的に延長を認められ、さらに資金をいただいています。
アプタマー(Aptamer)とは?

事業の進捗についてご説明します。何度もお話しする機会がありましたが、アプタマーとは聞き慣れない用語かと思います。
核酸RNAでもDNAでも、1本の鎖の核酸は、配列によってさまざまな形を作ることができます。その変幻自在な形作りの機能によって作られたものをアプタマーと呼んでいます。
これを利用することで、病気の原因になるタンパク質にジャストフィットし、その働きを阻害する医薬品を作るというものが、スライドの右図に示したような形の阻害剤です。
アプタマーは、今非常に大きく市場が広がっている抗体医薬に比べて、さまざまな利点があります。我々としては、アプタマーの特徴を活かし、抗体医薬をしのぐ市場に成長させていきたいと考えています。
アプタマー創製のプラットフォーム・テクノロジー
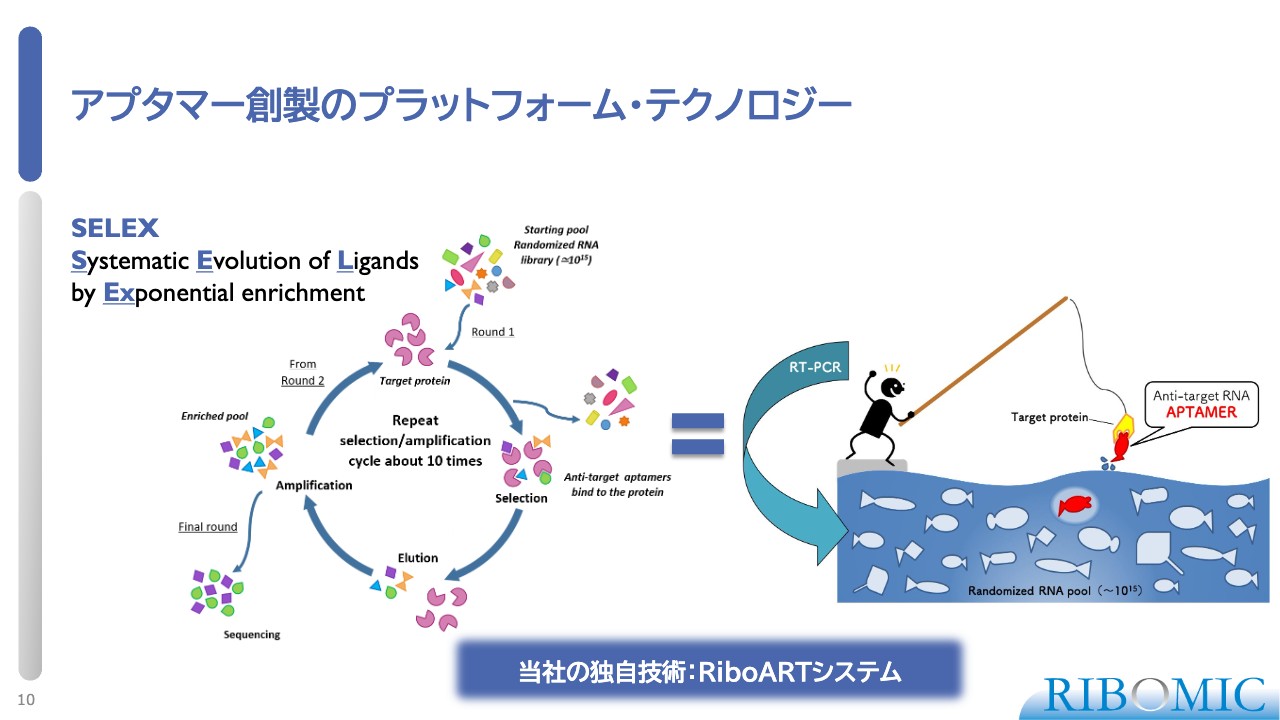
アプタマーを作る方法は、専門用語でSELEXと呼ばれています。非常に簡単なものですが、スライドに釣り堀で釣りをするイメージ図をスライドに掲載しています。
AUGCは、4種類の塩基の並び方によって核酸ができます。いろいろな並び方になっているプールを最初に作るのですが、これがいわゆるケミカルライブラリというものです。
この中から、釣りの餌にしている標的となるタンパク質にフィットするものを、配列によって釣り上げることが、この技術の本質です。この釣りを繰り返すことによって非常に強い特異的な結合体を作り、医薬品化するためにさまざまな技術を使用して実際の臨床現場に持っていきます。
我々は「RiboART」というシステムを独自技術として開発し、運用していますので、他では真似のできない医薬品化のアプタマーを作ることが可能です。
2024年3月期論文発表

2024年3月期においては、さまざまな活動を行ってきました。論文発表についてです。
当社の筆頭となる医薬品を使用した「RBM-007」は、滲出型加齢黄斑変性症(wet AMD)に対する臨床試験を米国で完了しました。その結果、実際のwet AMDに対して「RBM-007」が効くことを証明できました。
臨床的なPOCの確立をまとめた論文が、英国王立眼科学会の機関誌に2報採択をされ、非常に高い評価を得ることができました。
「RBM-006」に関して、増殖性硝子体網膜症(PVR)に対する予防効果を発表し、新型コロナウイルスに対する阻害性、結合性アプタマーをAIで作ることについても論文化し、非常に学術的にも成果を収めることができました。
2024年3月期学会発表

学会発表についてです。2024年3月に英国眼科学会誌で発表した成果に基づき、米国で最も歴史のある伝統的な学術集会であるゴードンリサーチ会議(Gordon Research Conference)に招聘されました。そこで、FGF2(線維芽細胞増殖因子2)に対する阻害性アプタマーが、臨床でPOCを確立したことを発表し、非常に高い評価を得ることができました。
主要なパイプライン
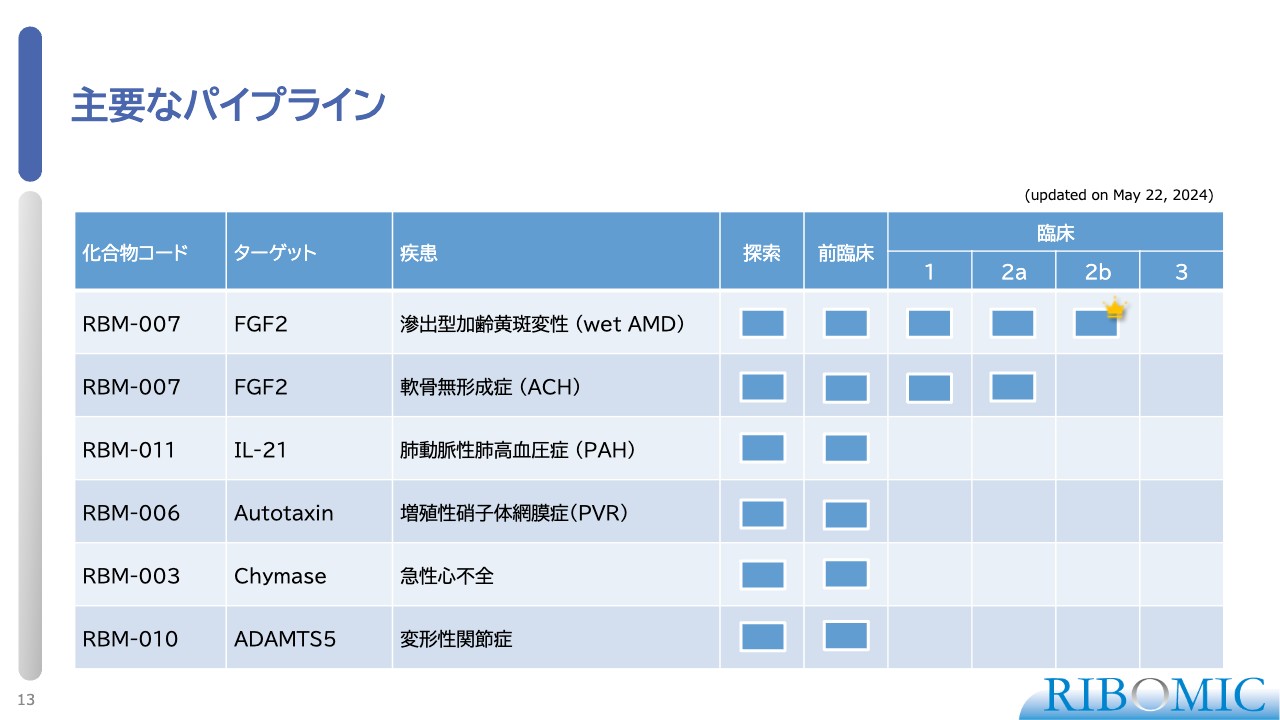
我々の現在のパイプラインは、探索から臨床にステージアップしています。スライドの表には、パイプラインをまとめています。
1例目は、wet AMDです。「RBM-007」のターゲットであるFGF2を標的にするアプタマーを使い、wet AMDに対する臨床試験を米国で実施、完了しました。
表の中に王冠をつけている部分がありますが、この王冠が非常に重要です。我々は、この臨床試験によって、本当に薬として効くというPOCを確立することができました。
この発表に関しては、試験が終わった2022年度初頭に発表を行っています。この試験では、我々の薬と現在標準治療薬になっているVEGF阻害剤を使用しています。特に、世界で1兆5,000億円規模のマーケットとなっている強力な競合品である「Eylea」との1対1の薬効比較を含めた試験を行いました。
2022年初頭の速報では、「Eylea」に対してなかなか優位性を示せなかった発表となりました。その開示により、みなさまにも落胆を招き、株価も大幅に下落する状況になりました。
しかし、薬剤そのものに対する信頼と、我々が感じている強い薬効力に関しては非常に揺るぎないものがありました。その後、臨床データを詳細に調べ、1年強の時間を使ってさらに解析を進めました。
その結果、実は「Eylea」と同等な薬効があることが明らかになりました。優位性を示せなかったのではなく同等である、つまり非劣勢であることが明らかになりました。
当初は、多くの方に「プログラムは失敗した」と思われましたが、実はそうではなく、我々の目から見れば「プログラムは成功した」と考えています。そのような意味も込めて、スライドには王冠をつけています。こちらについては、後ほどもう少し詳しくご説明します。
2例目は、希少疾患である軟骨無形成症(ACH)です。これに対する臨床試験が第2相試験として日本で進んでおり、現在のところ非常に順調に進んでいます。
3例目は、難病である肺動脈性肺高血圧症(PAH)です。「RBM-011」は、IL-21(インターロイキン-21)に対する阻害性のアプタマーで、臨床試験を開始できるすべての準備を整えている状況です。
以上の3品目が、我々が事業提携等でライセンスアウトするために品ぞろえを完了したものです。現在、複数の会社と秘密保持契約を結び、導出、提携協議を進めている状況です。
我々は、非常に長い時間をかけて、探索から臨床にステージアップすることを目論んできました。ようやく臨床ステージまで進み、実際の提携やライセンスアウトという果実に結びつけようとしている状況です。
軟骨無形成症(ACH, Achondroplasia)

ACHを対象にした臨床試験についてご説明します。ACHでは、スライドの写真のように、腕や脚の長さが短いまま発育が止まってしまっています。成人になっても、130センチメートルほどの身長しかありません。
この突然変異は、線維芽細胞増殖因子に対する4種類のレセプターの3番目、受容体FGFR3に起きた変異です。FGFR3から入ったシグナルには、骨の増殖にブレーキをかける役割がありますので、そのために身長の伸びが止まってしまう希少疾患です。
我々が作った「RBM-007」はFGF2に対する阻害剤です。FGF2は、FGFR3に作用する主要な成長因子ですので、FGF2を阻害すれば過剰なブレーキを解除できるのではないかという考え方で、これまでさまざまな実験を行ってきました。
研究成果:Science Translational Medicine 掲載

ACHのモデルマウス、あるいはACHの患者さま由来のiPS細胞を使った基礎的な薬理的研究の結果、我々の予想が正しいと照明することができました。つまり、我々の「RBM-007」という薬を使えば、骨の成長を元に戻すことができることを証明しました。
2021年に、米国のトップジャーナルである『Science Translational Medicine』に報告をしました。これに基づき、日本国内においてACHの臨床試験を進めています。
第1相試験はすでに終わり、現在は第2相試験のだいたい中間地点にあります。第2相試験は、4歳から15歳までの小児のACH患者さまに、低用量あるいは高用量の皮下注射を、1週間に1回、2週間に1回、4週間に1回と続ける臨床試験です。
大変長期にわたる試験となりますが、実際に身長の伸び率がどれだけ改善されるか測定します。現在の折り返し地点までに、合計140回程度の皮下投与を行っていますが、安全性の問題が生じたことはまったくなく、非常に優れた薬ではないかと考えています。
このスキームに従い、2025年暮れから2026年くらいにかけて、正式にライセンスアウトしたいと考えています。
実は、このプログラムに対して、海外から導入の引き合いがあります。臨床試験の途中から導入の意向が伝わってきており、現在2社とCDAを締結して提携の交渉を進めています。マーケットにおいて、ACHのニーズが非常に高いことを実感しています。
他社開発品との差別化
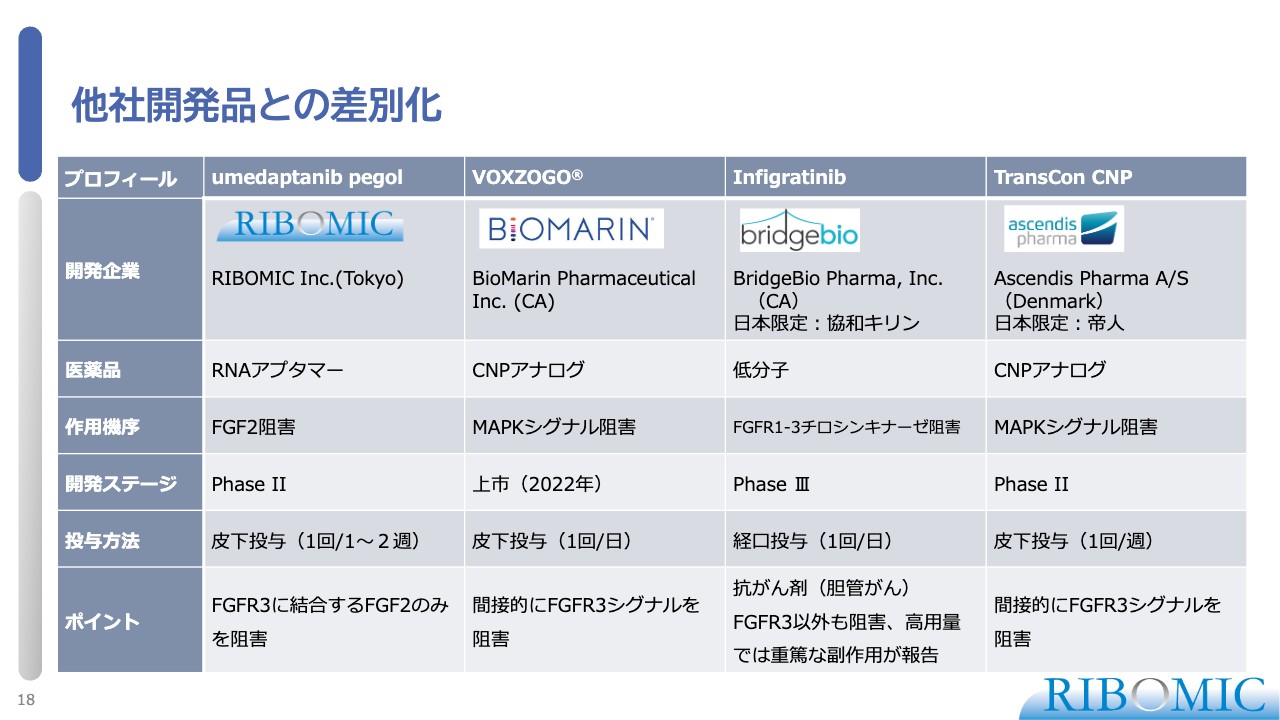
スライドの表は、他社競合品との比較です。当社製品が一番左側ですが、2週間に1回、長ければ4週間に1回の皮下投与で済ませたい考えで、非常にストレートな作用機序を持っています。
米国のBioMarin Pharmaceuticalが、長年にわたり「VOXZOGO」という新薬の開発に取り組んでいます。採用基準はまったく異なりますが、「VOXZOGO」がFGFR3のシグナルを間接的に阻害するのに対し、我々の薬は直接的に阻害します。
間接阻害によるCNPアナログの1日1回の皮下投与が承認され、日本でも1年前から臨床で小児に使われるようになっています。ただし、1日1回の皮下投与は、本人や親御さまへの負荷が非常に大きく、より利便性の良い薬の登場、開発が求められています。
そこで、BioMarinの「VOXZOGO」に対して、CNPアナログをもう少し安定化させた誘導体が、Ascendis Pharmaの「TransCon CNP」です。1週間に1回のみの投与で、作用機序はまったく同じものが開発されています。
「Infigratinib」は、米国のBridgeBio Pharmaが開発した製品です。専門的には、FGFR3はレセプターでチロシンキナーゼという活性を持っており、その阻害剤が抗がん剤として広く使われています。
その抗がん剤の用量を下げて、患者さまに1日1回飲み薬として与える臨床試験が進んでいます。こちらも作用としては効果が出ていますが、抗がん剤であることの懸念を払拭できないところがあります。
軟骨無形成症の治療薬に関するニュース

この状況下で、協和キリンと帝人が「Infigratinib」と「TransCon CNP」を日本に導入しました。スライドは、最近の導入に関するニュースです。
帝人は、「TransCon CNP」を含む3剤を合計70ミリオンダラー、約100億円で導入し、日本限定の開発を行います。協和キリンは、BridgeBioから「Infigratinib」のライセンスを100ミリオンダラー、約150億円で取得し、こちらも日本限定の導入をしています。
この薬に対するニーズ、市場性は非常に大きく、我々のほうが安全性・利便性に優れた効果を出すのではないかと期待しています。そのようなことから、現在第2相試験の途中ながら、引き合いのある企業と提携を進めていきたいと考えています。
世界におけるアプタマー医薬品開発の動向
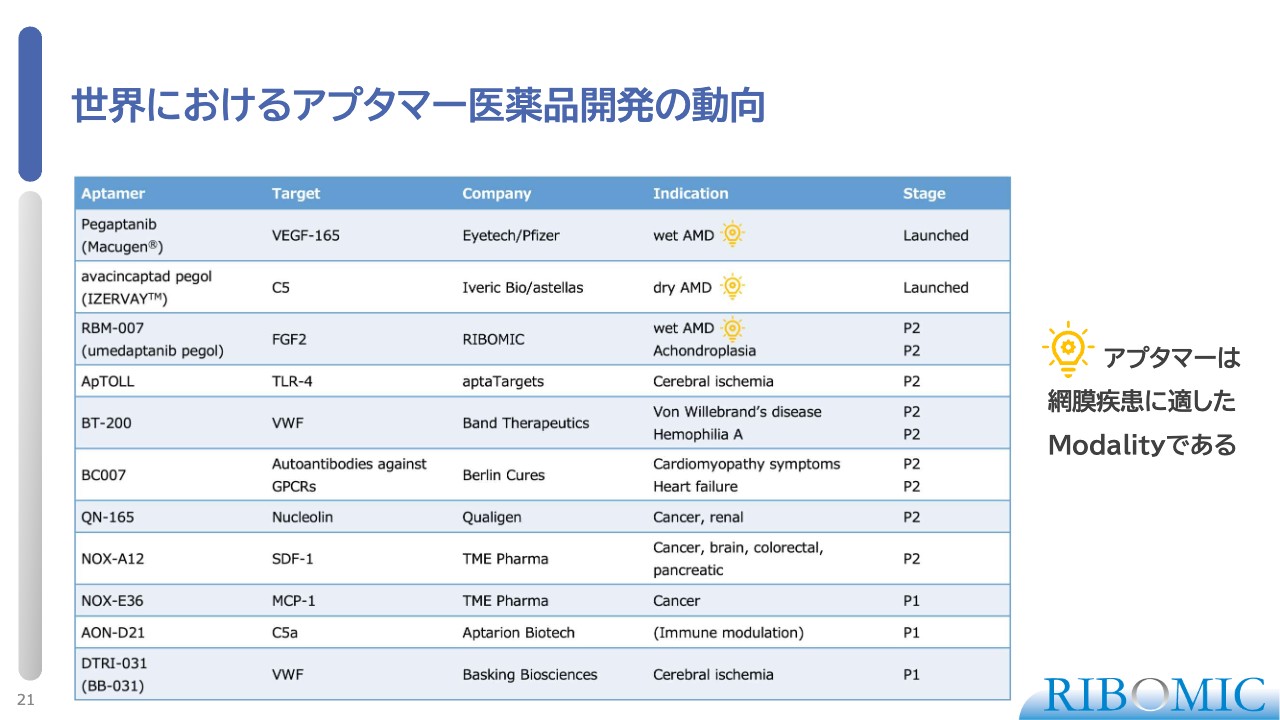
アプタマー医薬品は、核酸を使った医薬品の中では比較的早く登場したのですが、その後の大きな展開がなかなか難しかった印象があります。
我々もアプタマーに特化した医薬品開発を進めているため、あらためて世界の現状を俯瞰すると、最初にアプタマー医薬品を実現したのが、スライド一番上の「Macugen」です。wet AMDに対する硝子体注射薬で、EyetechとPfizerが共同開発しました。ターゲットはVEGFです。
こちらが最初に上市され、その後、VEGF阻害剤の代替品として、抗体を使った「ルセンティス」「Eylea」などが登場し、それらがマーケットを独占して1兆5,000億円規模に膨れている状況です。
2003年から「Macugen」の開発を始めましたが、そこから約20年間、アプタマー医薬品を上市できませんでした。しかし、昨年、アプタマー2号として「IZERVAY」を米国のIveric Bioが開発し、dry AMDに対する薬としてFDAが承認され、市場に入りました。
当社の「RBM-007」は、wet AMDに対して実際に薬効を持つことが自社試験で証明されました。スライドには、電球マークを記載しています。このことから、アプタマーは網膜疾患に非常に適したモダリティ(治療手段)であると考えています。
第二のアプタマー医薬品 IZERVAY

第2のアプタマー医薬品「IZERVAY」は、補体因子C5に阻害性のあるアプタマーで、2023年に承認・上市されました。承認直後から、アステラス製薬が「IZERVAY」取得のためにIveric Bioを8,000億円で買収し、完全子会社化しました。
非常に大きなニュースでしたが、まったく治療薬のないdry AMDに対し、アプタマーがそれだけ大きな商品価値を持っていることを端的に示しています。我々は、それに続くアプタマーを自社で開発していきたいと考えています。
当社の重点領域 アプタマーというModalityが適した疾患

このような経緯から、アプタマーは疾患を選ぶ必要があり、眼科(網膜疾患)に非常に適したモダリティがあるのではないかと考えています。
当然ながら、大手製薬会社が扱わないような希少疾患に対して、我々の技術を展開していくのは重要です。そのほか、アプタマーに適した疾患領域として、網膜疾患を考えるべきだと思っています。
目というのは閉鎖系の器官であるため、高い安全性、全身に薬がリークしない、硝子体内投与であるため少量の薬剤量で済む、という利点を十分に活かしていきたいと考えています。
滲出型加齢黄斑変性(wet AMD)
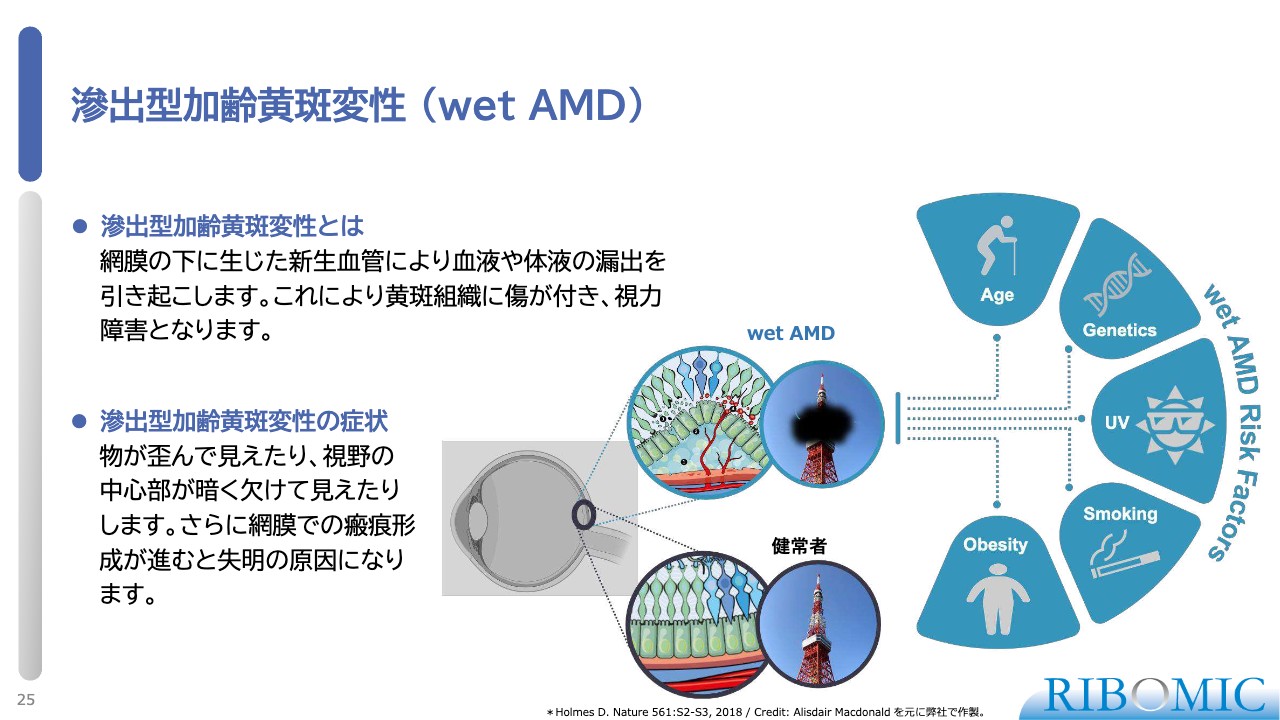
そのような基盤で、我々は「RBM-007」というFGF2に対する阻害性アプタマーを、wet AMDに対して最初に適用する臨床試験を実施し、すでに報告しています。
wet AMDは、さまざまな刺激・炎症により、網膜の下に新生血管が生じる疾患です。スライド中央の図のように、血液や体液が漏れて溜まりやすくなり、きれいな網膜の光受容体の層構造が破壊され、進行すると視力を失うことがわかっています。
そのため、世界標準の治療薬では、新生血管を抑える薬としてVEGF阻害剤が1兆5,000億円のマーケットを形成しています。
標準治療(抗VEGF薬)の Unmet Need 網膜の線維化(瘢痕形成)リスク

VEGF治療薬は標準治療となっていますが、さまざまな弱点があります。スライド左側には、報告された文献を掲載しています。傷がかさぶたになるのと同じように、網膜の奥にもかさぶたができます。これを線維化(瘢痕形成)と言いますが、VEGF治療薬の一番のリスクは、標準治療でも瘢痕形成を予防できず、治せないことです。
スライド右側のグラフは、標準治療でVEGF治療薬を硝子体に注射しても、1年から5年で瘢痕が形成されていくことを示したもので、この現象は非常に大きな問題として認識されています。
また、4分の1の患者さまには、はじめからVEGF阻害剤が効かないことがあります。そこで、このような弱点を補完・補強するため、まったく作用機序の異なる薬の開発が望ましいとされています。
米国における wet AMD に対する 臨床試験
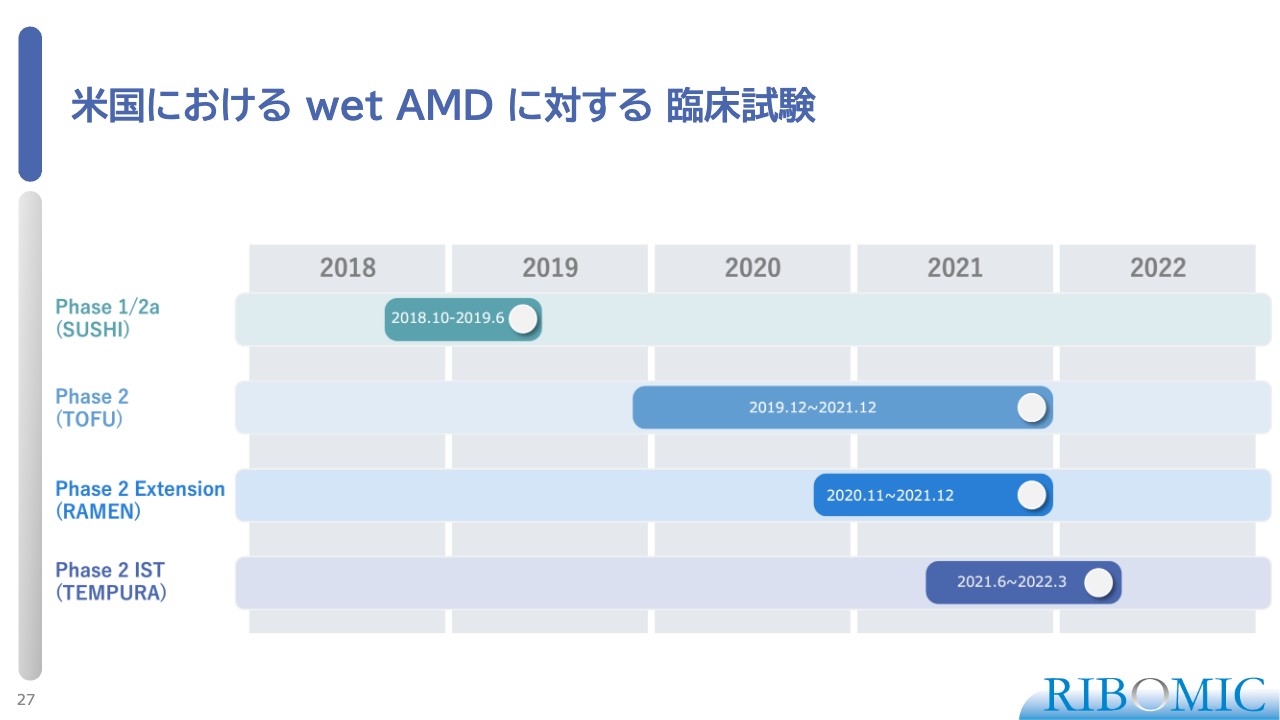
当社のFGF2阻害剤は、新生血管にも線維化にも関与することがすでに証明されており、1剤で2つの問題を解決できる可能性があることから、米国で臨床試験を実施しました。
メイン試験はTOFU試験と呼ばれるもので、2018年に第2相試験を開始しています。ランダム化した二重盲検試験で、標準治療を受けても改善しない86名の高齢患者さまを対象としています。
試験終了後、そのうちの一部の方に「RBM-007」を追加で硝子体内に投与し、効果をさらに調べる試験も行いました。TOFU試験やRAMEN試験には、標準治療を受けてもなかなか改善しない患者さまにご参加いただきました。
医師主導治験で、まったく治療を受けていない5名の患者さまを対象に、我々の薬を月1回、合計3回硝子体に注射した治療成績を見たものがTEMPURA試験です。
冒頭でお伝えしたとおり、2022年初頭にTOFU試験が完了した段階で、我々は比較薬の「Eylea」に対し優位性を示せなかった報告を開示したことで、株価が暴落しました。その後1年半をかけ、専門家を交えて実際の臨床データを非常に詳細に検討しました。
その結果、患者さまの群分けに問題があったことがわかりました。標準治療を受けていると、「RBM-007」のような新薬に対する感受性が変化してしまうことがわかりました。我々は、「Eylea」に比べて非劣性、つまり「Eylea」と同じ薬効を持っていると結論づけました。
そのようなことを含めて、標準治療を受けていない患者さまに対しての効果が非常に重要だと気が付きました。実際に、医師主導治験で未治療の患者さまに対しての効果を見ると、劇的な視力回復効果があることも明らかになりました。
これらを踏まえ、我々の薬は臨床的にwet AMDを治療する力があることを証明し、『Clinical proof of concept for anti-FGF2 therapy in exudative age-related macular degeneration (nAMD): phase 2 trials in treatment-naïve and anti-VEGF pretreated patients』という論文において、臨床的なPOCを確立したと報告し、非常に大きな反響を呼んでいます。
英国王立眼科学会の機関誌『Eye』は、非常に難しい雑誌ですが、こちらに我々のフェーズ1・フェーズ2の2本の論文が採択されました。その間、専門家のエディターと何度もやり取りがあり、我々の試験結果を正しく評価していただきました。
この結果に基づいて、2024年9月にポルトガルのリスボンで開催される、Retina International World Congress(世界網膜学会議)という当該分野でもっとも権威のある学会で、我々の仕事を口頭発表してほしいと招聘されました。
世界網膜学会議は、日本人の登壇者がほとんどいないセレクティブな学会で、我々がお話しできるということは非常に光栄です。
このような状況下で、「RBM-007」に対するニーズが非常に高まってきており、実際の提携協議も進んでいます。既存薬「Eylea」に比べて非劣性だということが非常に大きいです。
いろいろな医薬品の業界で、「先行品に比べて非劣性を示せれば、日本の薬の開発は成功」と言われています。その上で新しい薬効が積み重なれば、それは「ピカ新」という評価になります。そのような意味で、「RBM-007」は医薬品化のルートが固まってきています。
我々が考えている網膜の瘢痕抑制の効果が、未治療の患者さまで証明できれば画期的な薬になり、世界を大きく変えることができると確信しています。今後も、その方向で開発を進めていこうと思っています。
RBM-006 (抗Autotaxin アプタマー) Autotaxin と RBM-006 について
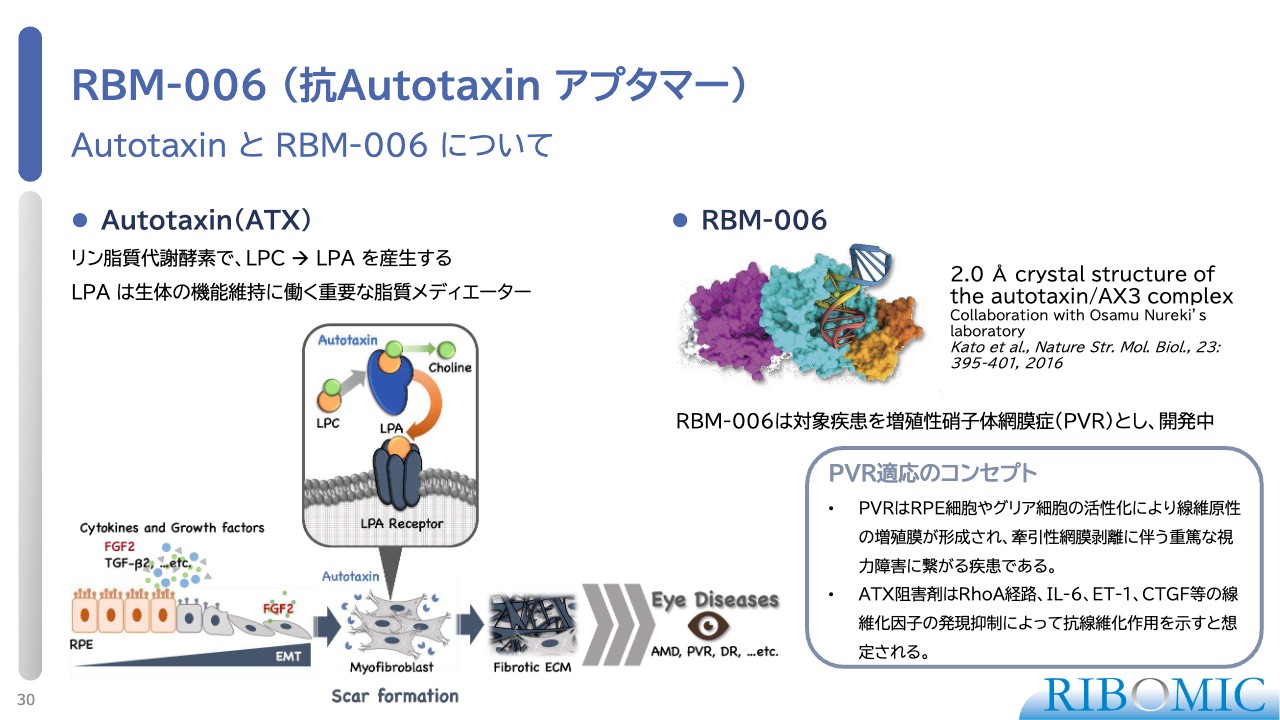
Autotaxinに対するアプタマー「RBM-006」についてご説明します。Autotaxinはリン脂質代謝酵素で、LPCからLPAという生体のいろいろなところに働いている脂質メディエイターを再生するものです。この働きが強すぎると、肺線維症や眼科疾患など、いろいろなところで線維化の症状が出てきます。
その1つに、PVRがあります。当社では、Autotaxinに対する優れたアプタマーを作っており、「RBM-006」を用いてさまざまな薬理実験を行うことが可能です。特に眼科に関しては、LPAあるいはAutotaxinの働きが非常に重要だとわかってきています。
RBM-006 (抗Autotaxin アプタマー) In vivo Preclinical data と 他網膜疾患への展開

一例として、日本大学医学部医学科から旭川医科大学の教授に転出された中岡教授との共同研究で、PVRのブタのモデルを使って「RBM-006」の効果を調べる実験を行いました。
PVRは、網膜剥離が進む病気です。スライドに眼底写真を掲載していますが、左側は正常、右側は網膜剥離が進行していく状態で、中にひらひらとしたヒダのようなものが見えます。これが増殖膜で、増殖膜が眼底から網膜を引き剥がす作用をし、網膜が完全に剥がされると失明に至ります。
まったく薬のない病気ですが、ブタのモデルに我々の「RBM-006」を適用すると、顕著な予防効果があることがわかりました。我々は「RBM-006」、ひいてはAutotaxin阻害剤がいろいろな目の病気に役立つと強く考えています。
弊社パイプラインと網膜疾患

弊社のパイプラインを俯瞰すると、目の疾患は、増殖因子、炎症系因子、免疫系因子といったさまざまな因子が絡み合って、不都合が目の病気に発展することが明らかになってきています。
主な作用機序として、血管新生あるいは線維化、炎症が起きるということがあり、我々のパイプラインはこれらを標的にするものです。「RBM-007」をはじめ「RBM-006」「RBM-011」「RBM-008」と薬のレパートリーが多くそろっており、スライドに記載したような眼科疾患で予想される作用機序を1つあるいは複数持っています。
これを適用して、wet AMDだけではなく、dry AMD、PVR、糖尿病網膜症(PDR)、緑内障(Glaucoma)といった網膜疾患に対して、網羅的に効くのではないかという検索を開始しました。
自社でモデル動物を外注して調べると同時に、主要なアカデミアの眼科の研究室とタイアップしながら効果を調べることを始めています。このような方向で、展開していきたいです。
次世代型アプタマー医薬品の体内動態抑制に向けた新規技術開発
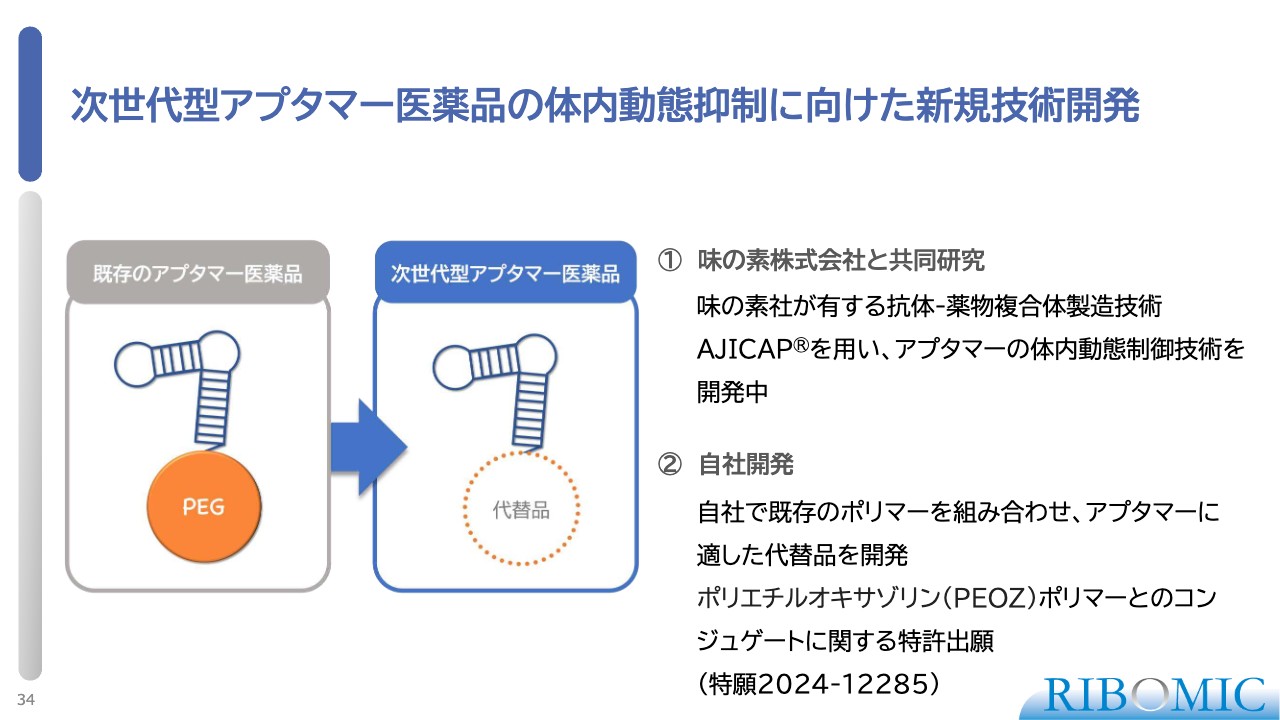
次世代型アプタマーは、我々にとって非常に大事な方向性です。最初は次世代型アプタマーとして、体内動態に優れた新しい技術を開発します。アプタマーはそのままでは核酸で、体内での代謝が非常に速く、半減期も非常に早く10分から20分ぐらいで消失します。
それを長持ちさせるために、末端にポリエチレングリコール(PEG)という付加体をつけます。これによって、アプタマーの寿命は10数時間、あるいは2日と長持ちします。
このような技術が必要ですが、PEG体にはいろいろな問題や使いにくさがあります。粘性が高くなるため、細い注射針で微量を取り扱うことには不向きです。そこで、もう少し親水性の溶けやすい代替品が必要だと考え、現在、味の素と共同で開発しています。
また、自社でも他のポリマーを探し、ポリエチルオキサゾリン(PEOZ)というポリマーをPEGの代替にすると体内動態が非常に改善することを発見し、すでに特許出願しています。
AI アプタマーのコンセプト
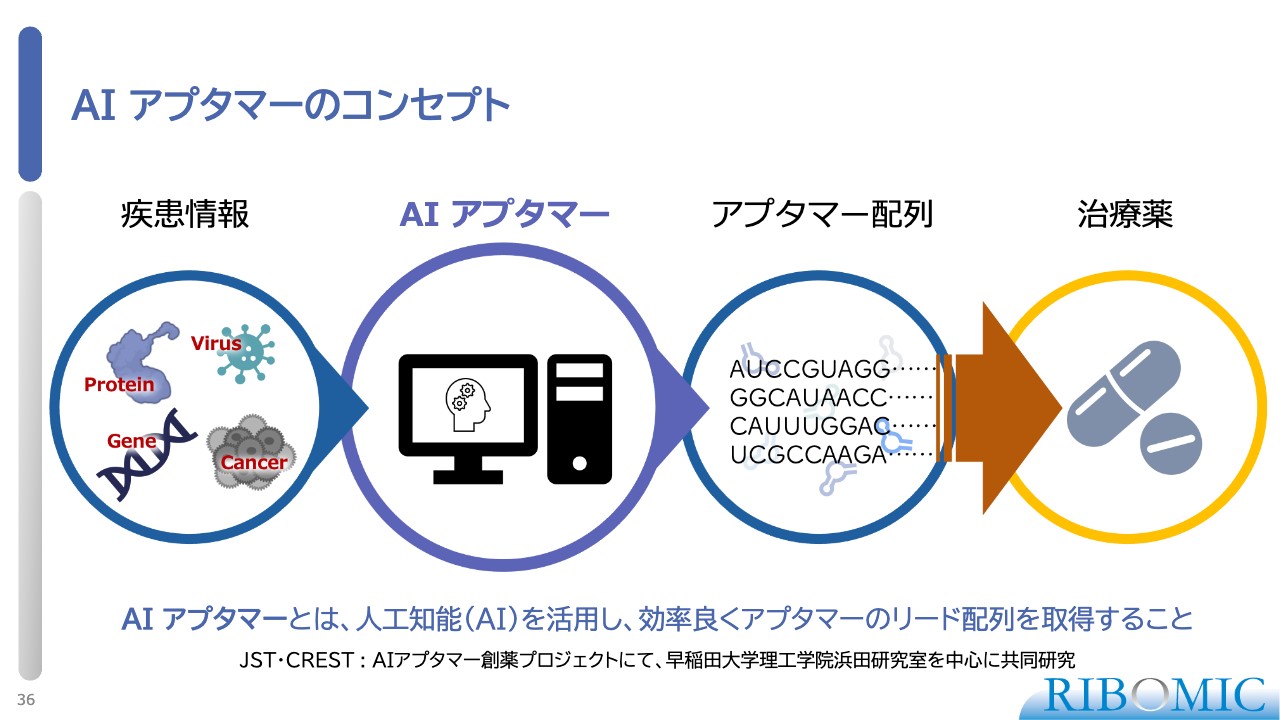
我々のアプタマー技術にも、昨今話題のAIを取り込んでいます。AIアプタマーは、いろいろな疾患に対し、実際に実験しなくてもアプタマーを探索する技術です。
スライドは、コンセプト図です。アプタマーは、単純な4種類の配列の繰り返しのため、膨大な過去のデータがあります。それらを深層学習して、コンピュータの中で新しい配列を見つけ出す試みを、早稲田大学理工学術院の浜田研究室と進めています。
AI アプタマーの進捗
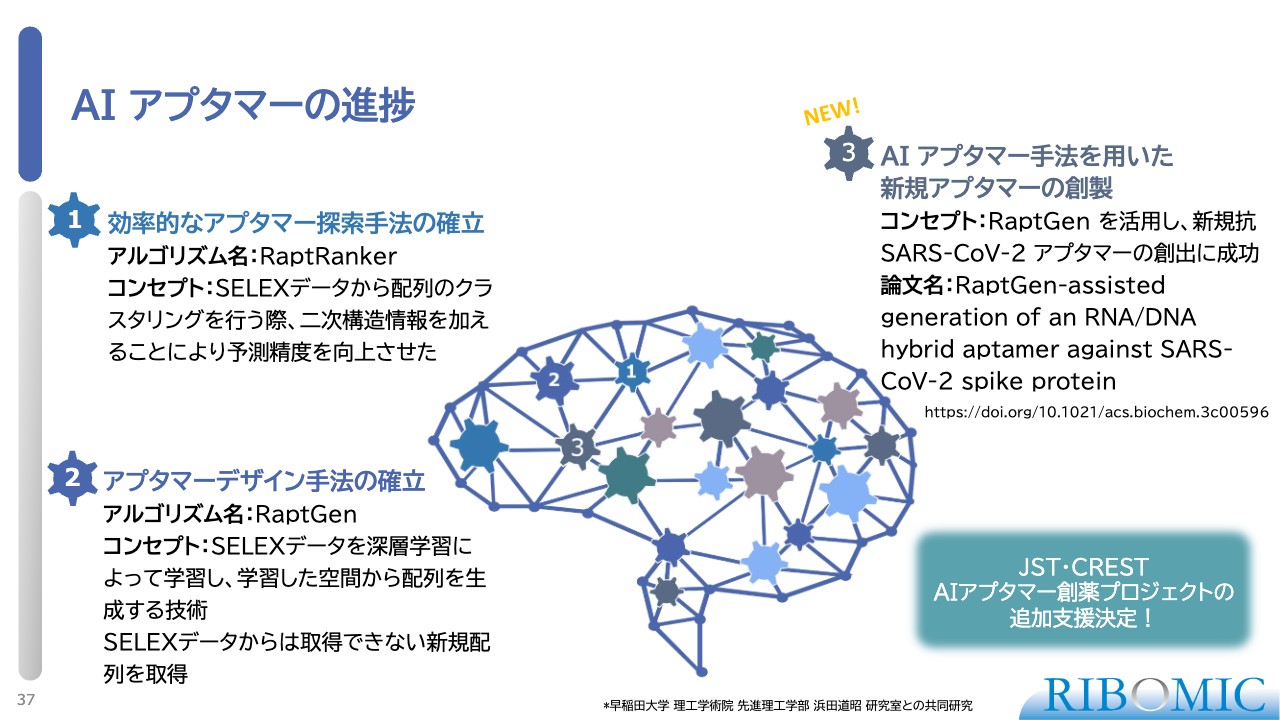
AIアプタマーとして、アプタマーの2次元構造を探索する手法を最初に確立し、「RaptRanker」と名づけ、論文を発表しました。
また、実験に頼らなくてもAIを使った深層学習によって、新しい配列を抽出する技術を確立し、「RaptGen」と名づけました。2年前に、業界トップのジャーナルである『Nature Computational Science』で発表しました。
その手法を通じて、昨年暮れに新型コロナウイルスに対する結合性アプタマーの創出に成功し、論文で発表しました。AIを使ったアプタマー創薬は、いろいろな方から注目され、我々の大事なプログラムになっている状況です。
革新的DDSアプタマー技術開発の展望
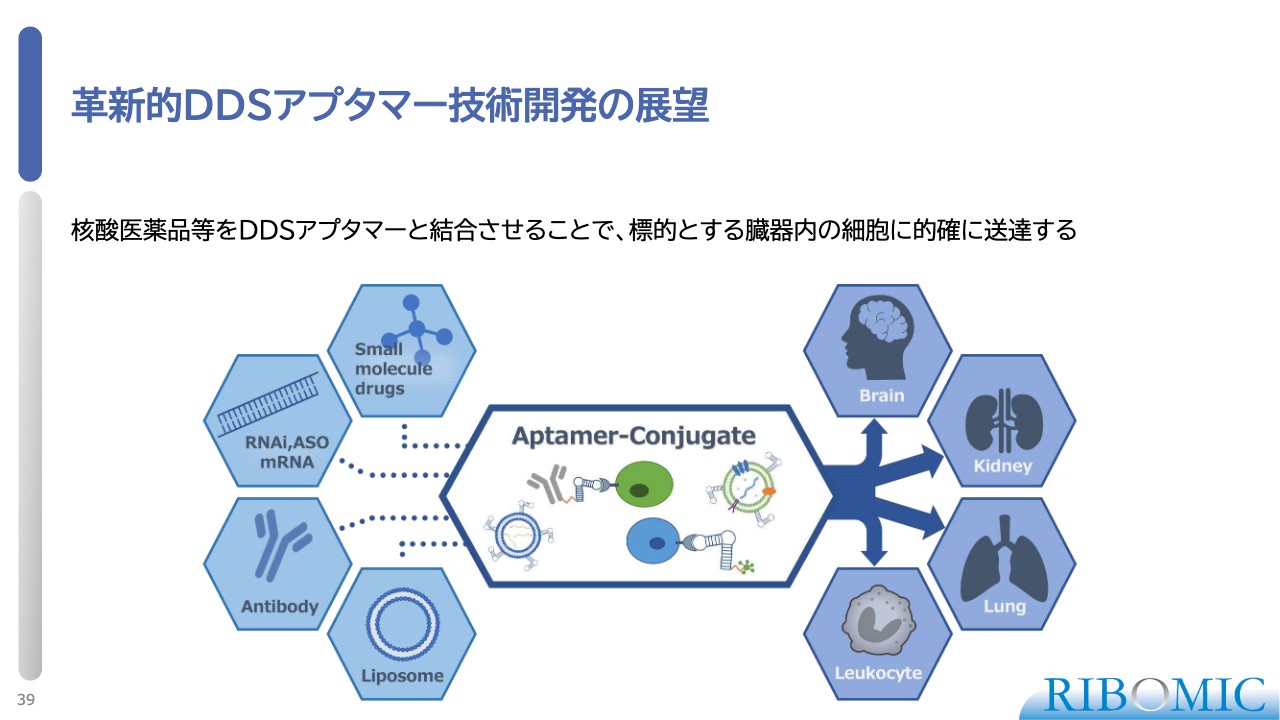
DDSアプタマーについてです。薬物送達システム(DDS)は、核酸医薬品で非常に広く使われ出していますが、泣き所があります。
実は、核酸医薬品は放っておくと肝臓に集積するため、肝臓の薬を核酸医薬品で作るとそのままで送達できるのですが、核酸医薬品をその他の脳、腎臓、肺、白血球などの血球細胞といった到達目標別に有効に送達する技術がありません。
そのため、アプタマーを使ってDDSを実現することが、今の我々の大きなテーマです。スライドの図のように、いろいろな臓器に特異的なレセプターやマーカーに結合するアプタマーを作り、薬に結合させます。そして、体中のいろいろな臓器に能動的にそれを送達させることが重要です。
これは、ドローンに目的指向性をつけて薬剤を運び、薬剤を投下するような考え方をしています。
具体的な応用例としては、光免疫療法で、アプタマーに光感受性物質を結合します。光感受性物質は、光に感作されると結合している細胞を破壊し、細胞死が誘導されるような性質があります。この方法で、がんに対して光免疫療法を開発します。
現在、1例が開発されていますが、いろいろな臓器に対して積極的に誘導するシステムがないため、我々はそこを補完していきたいです。また、光感受性物質に代えて放射性物質をつければ、放射性療法が可能になることについてもプログラムを進めています。
サステナビリティの取り組み
社会に対する企業価値の創出についてです。我々は「Environment 環境」、「Social 社会」「Governance 企業統治」に配慮しながら、事業を進めていきたいと考えています。
新着ログ
「医薬品」のログ