【QAあり】ティムス、JIXINGと提携し、グローバル開発に進展、TMS-007及びJX09の国内開発販売権を取得
企業理念

若林拓朗氏(以下、若林):株式会社ティムス代表取締役社長の若林です。本日はお時間をいただき、誠にありがとうございます。当社の2024年2月期決算説明会を始めます。
スライドに、当社の企業理念を記載しています。
アジェンダ

本日のアジェンダです。ハイライト、業績概要、パイプラインの順にご説明します。
ハイライト(1/4)

ハイライトを3点ご説明します。1点目は、当社が開発しているSMTP化合物に関するパートナーが、Biogen社からJi Xing Pharmaceuticals(JIXING)社へ移行したことについてです。
これまでの経緯も含めてご説明します。2018年に当社とBiogen社でオプション契約を締結し、2021年にBiogen社がオプション権を行使しました。その後、昨年3月にはClinicalTrials.govに次の臨床試験の概要が登録されましたが、昨年4月にBiogen社からこの試験の開始を一時停止し、再検討するという発表がありました。
それから約8ヶ月半後の今年1月に、SMTP化合物全般に関する契約上の地位がBiogen社からJIXING社へ譲渡されました。これに伴い、SMTP化合物の開発販売権がJIXING社へ移りました。
また、開発コードがBiogen社の「BIIB131」からJIXING社の「JX10」へ変更されました。ちなみに当社では、引き続き「TMS-007」を併用していきます。
現在はJIXING社を中心に、「TMS-007」の次の臨床試験を計画中です。
ハイライト(2/4)
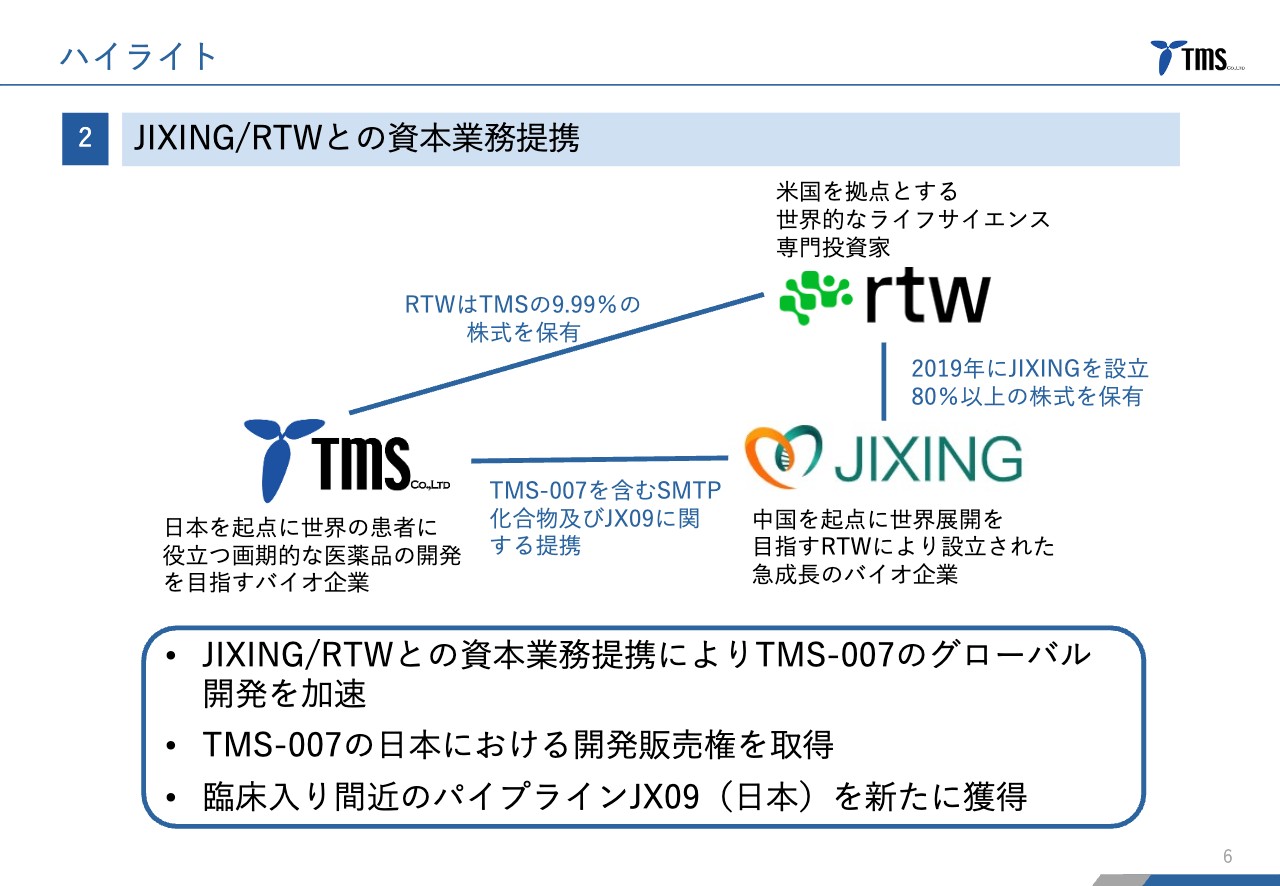
ハイライトの2点目は、JIXING社およびRTW社との資本業務提携についてです。先ほどお伝えしたように、SMTP化合物に関するBiogen社の権利がJIXING社へ移りました。これに伴い、当社とJIXING社の提携関係がBiogen社との関係とは少し違ったものに変更されました。
また、JIXING社を設立し80パーセント以上の株式を現在も保有している投資会社RTW社と当社との直接の関係も生まれました。このような提携関係をもとに、資本業務提携に伴い、「TMS-007」のグローバル開発を加速していく体制が構築できました。
加えて、「TMS-007」の日本における開発販売権が当社に戻ってきたという変更もありました。さらに、JIXING社が開発を進めている、治療抵抗性高血圧の治療を適応とした化合物「JX09」の日本での開発販売権も当社が取得しました。
ハイライト(3/4)
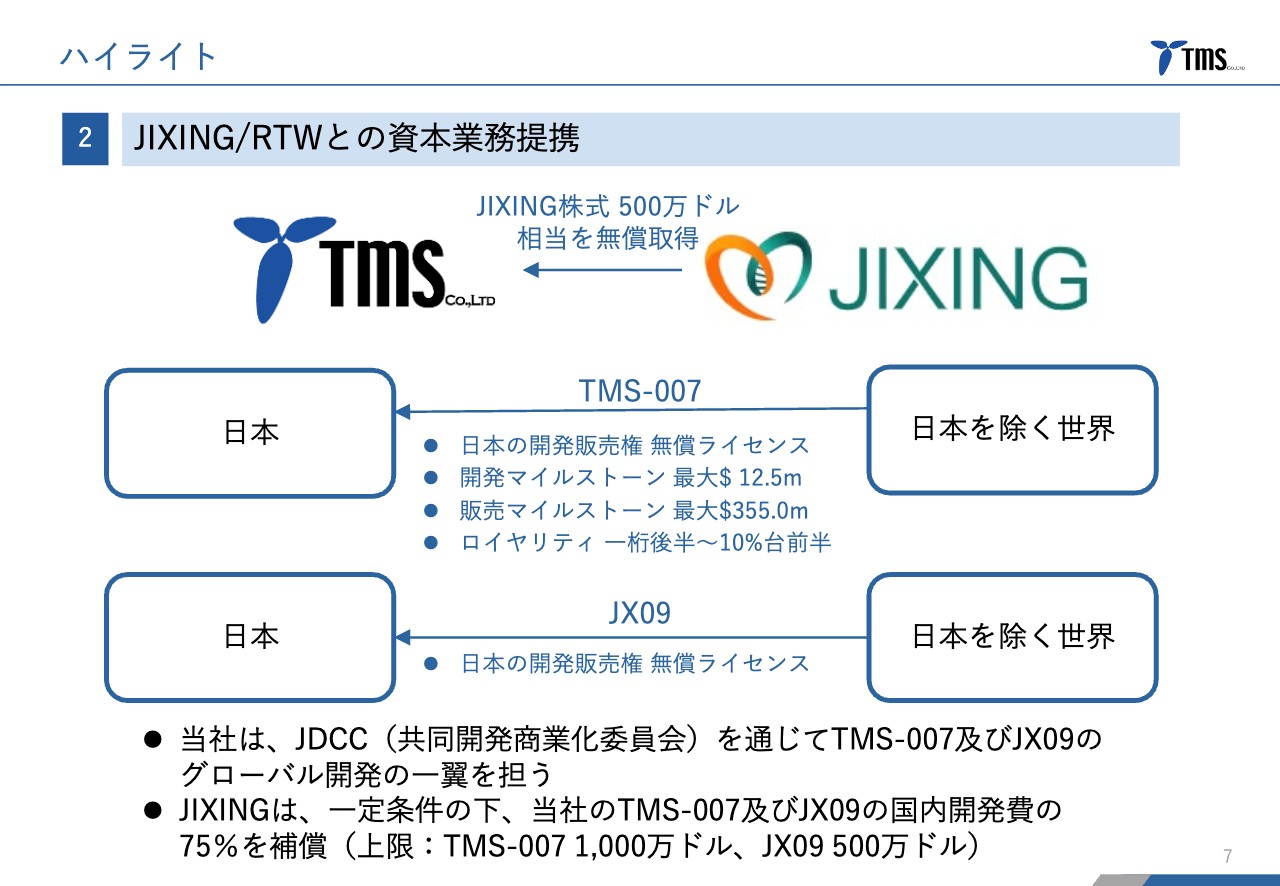
当社とJIXING社との関係についてです。契約関係について、当社はアップフロントとしてJIXING社の株式500万ドル相当を無償取得しました。
「TMS-007」に関しては、先ほどお伝えしたとおり、日本における開発販売権を当社が無償で取得しました。
さらに、日本を除く世界において、「TMS-007」の開発販売状況に応じ、開発マイルストーンとして最大1,250万ドル、販売マイルストーンとして最大3億5,500万ドル、さらに、販売額に応じて1桁台後半から10パーセント台前半のロイヤリティーが当社に入ってくる可能性があります。
「JX09」については、先ほどお伝えしたとおり、日本における開発販売権の無償ライセンスを取得しています。
このような提携関係で、当社はJDCC(共同開発商業化委員会)を通じて「TMS-007」及び「JX09」のグローバル開発の一翼を担います。
さらに、当社が「TMS-007」及び「JX09」の日本での開発を行うにあたり、一定条件のもと、JIXING社から国内開発費の75パーセントの補償を受けられるという契約内容になっています。上限としては、「TMS-007」が1,000万ドル、「JX09」が500万ドルと設定されています。
ハイライト(4/4)
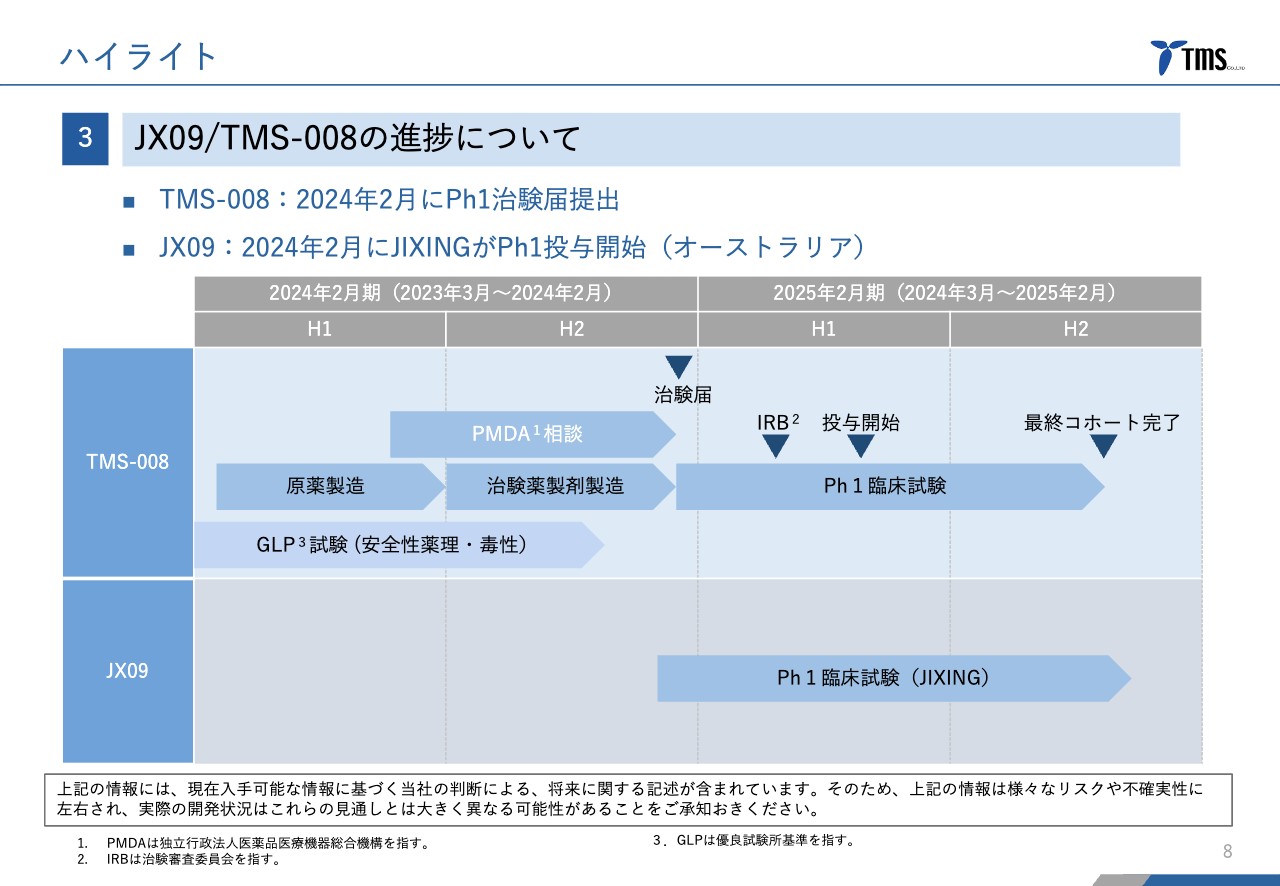
ハイライトの3点目は、「JX09」と「TMS-008」の進捗についてです。当社が開発を進めている「TMS-008」に関しては、今年2月に第Ⅰ相臨床試験の治験届を提出しました。今期中に第Ⅰ相臨床試験を完了する予定です。
入手したばかりの「JX09」についても、今年2月にJIXING社がオーストラリアで第Ⅰ相臨床試験を開始しています。
2024年2月期の業績概要_損益計算書
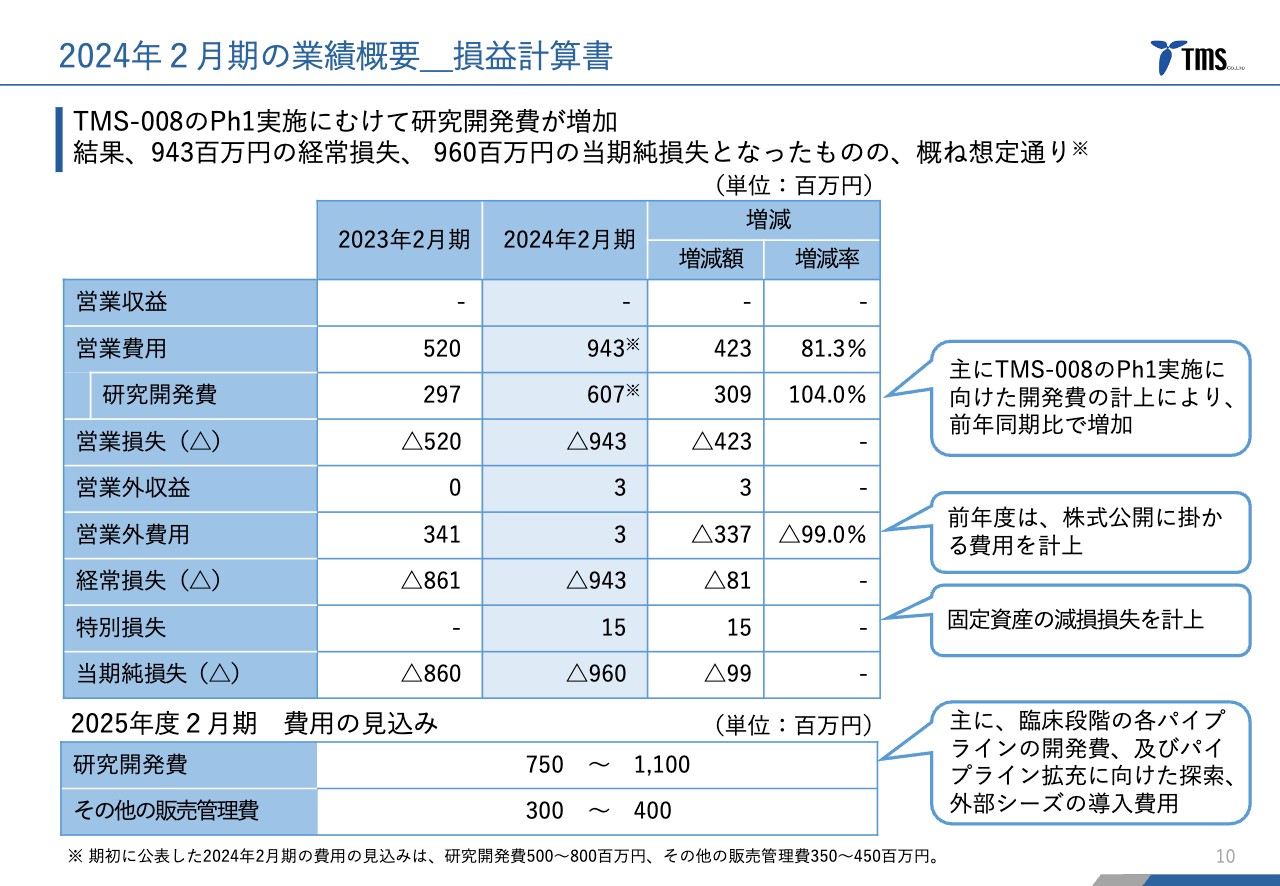
続いて、業績概要についてご説明します。まず、損益計算書です。営業損失として9億4,300万円、当期純損失として9億6,000万円を計上しました。
主だったものとしては、まず「TMS-008」の第Ⅰ相臨床試験の実施に向けた開発費の計上により、研究開発費が大幅に増加しています。
営業外費用については、2023年2月期は株式公開の費用がかなりかかっていましたが、今回はそれがなくなったため非常に少なくなっています。
また、特別損失として固定資産の減損損失を1,500万円相当計上しています。
これらを受けて、2025年2月期の費用の見込みとしては、研究開発として7億5,000万円から11億円、その他の販売管理費として3億円から4億円を開示しています。2024年2月期の研究開発費とその他の販売管理費については、期初に公表した額の範囲内にとどまっています。
2024年2月期の業績概要_キャッシュ・フロー
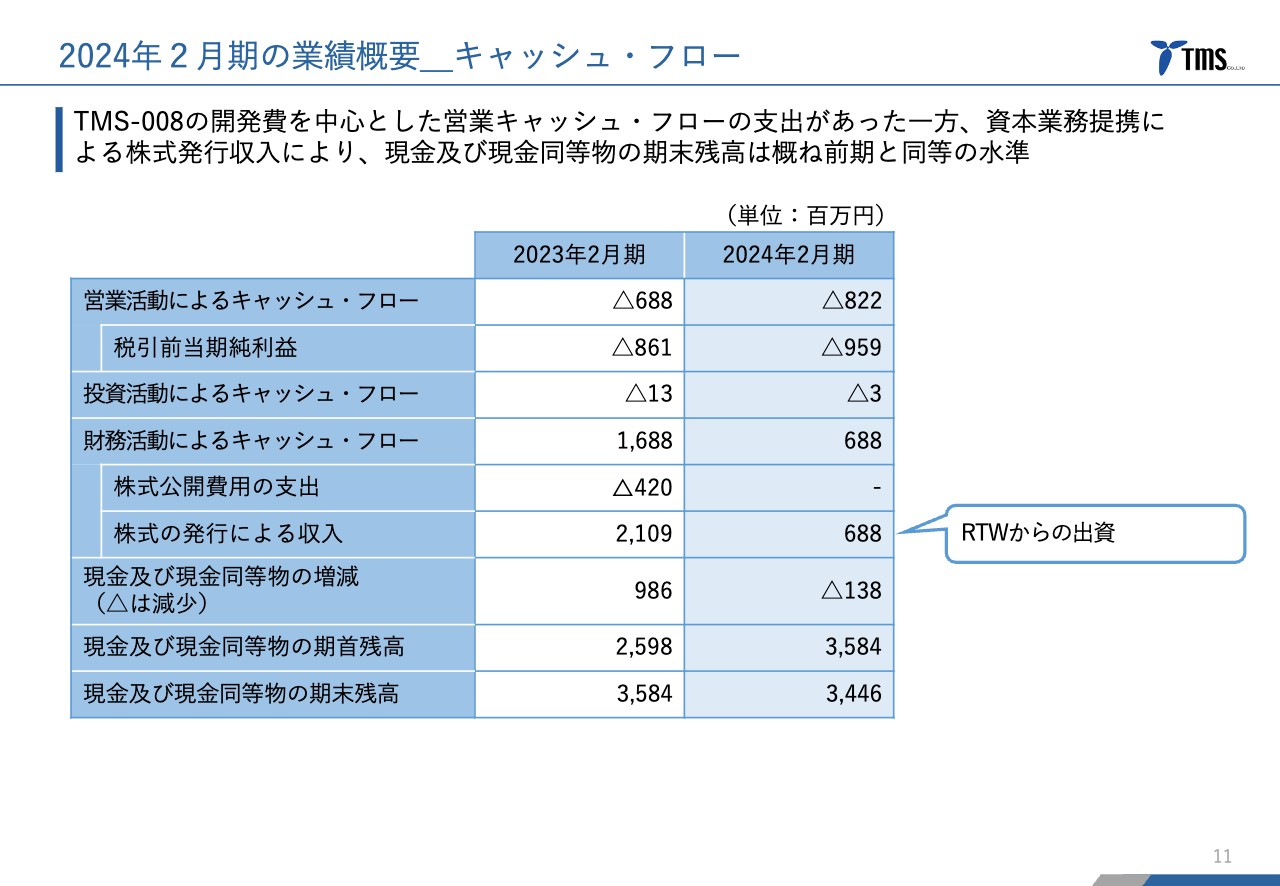
キャッシュ・フローです。営業活動によるキャッシュ・フローは8億2,200万円となりました。財務活動によるキャッシュ・フローは、RTW社からの出資で6億8,800万円が計上されています。
結果として、現金及び現金同等物の期末残高は、2023年2月期の残高とほぼ同水準となりました。
2024年2月期の業績概要_貸借対照表
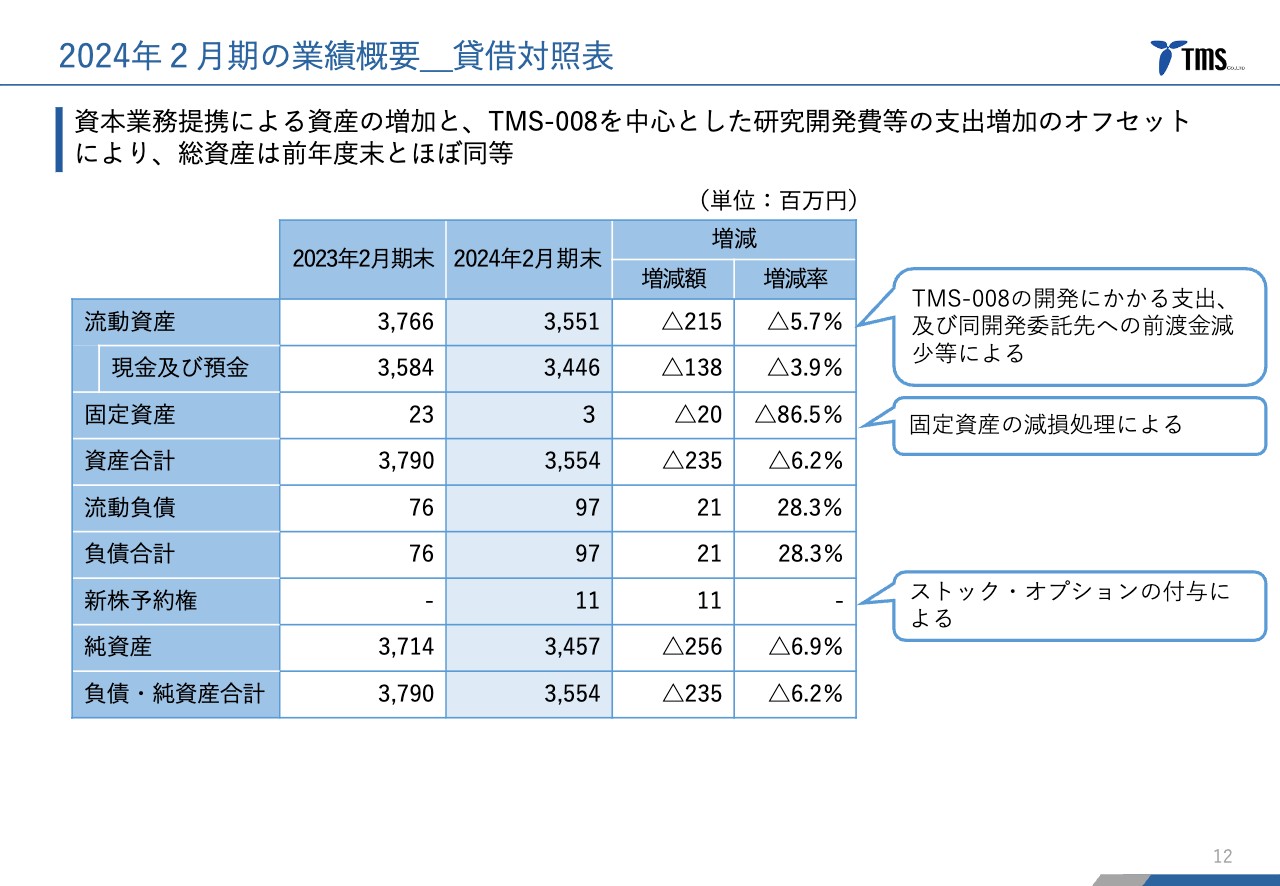
貸借対照表です。当社の資産はほとんどが現預金のため、先ほどのキャッシュ・フローと非常に似た状況になっています。2023年2月期と比較して、資産・純資産ともに微減となりました。
パイプライン

続いて、パイプラインの状況です。スライドに記載のとおり、2023年2月期末の状況としては、当社が「TMS-007」の前期第Ⅱ相臨床試験まで完了し、Biogen社が次の臨床試験を始めるのを待っている状況で、「TMS-008」は前臨床段階でした。現時点(2024年2月期末)においては、「TMS-007」についてはJIXING社が計画中であり、新たに臨床入りのパイプラインとして「JX09」と「TMS-008」が加わり、臨床入りのパイプラインは3本になりました。
急性期脳梗塞は重要なアンメット・メディカル・ニーズ
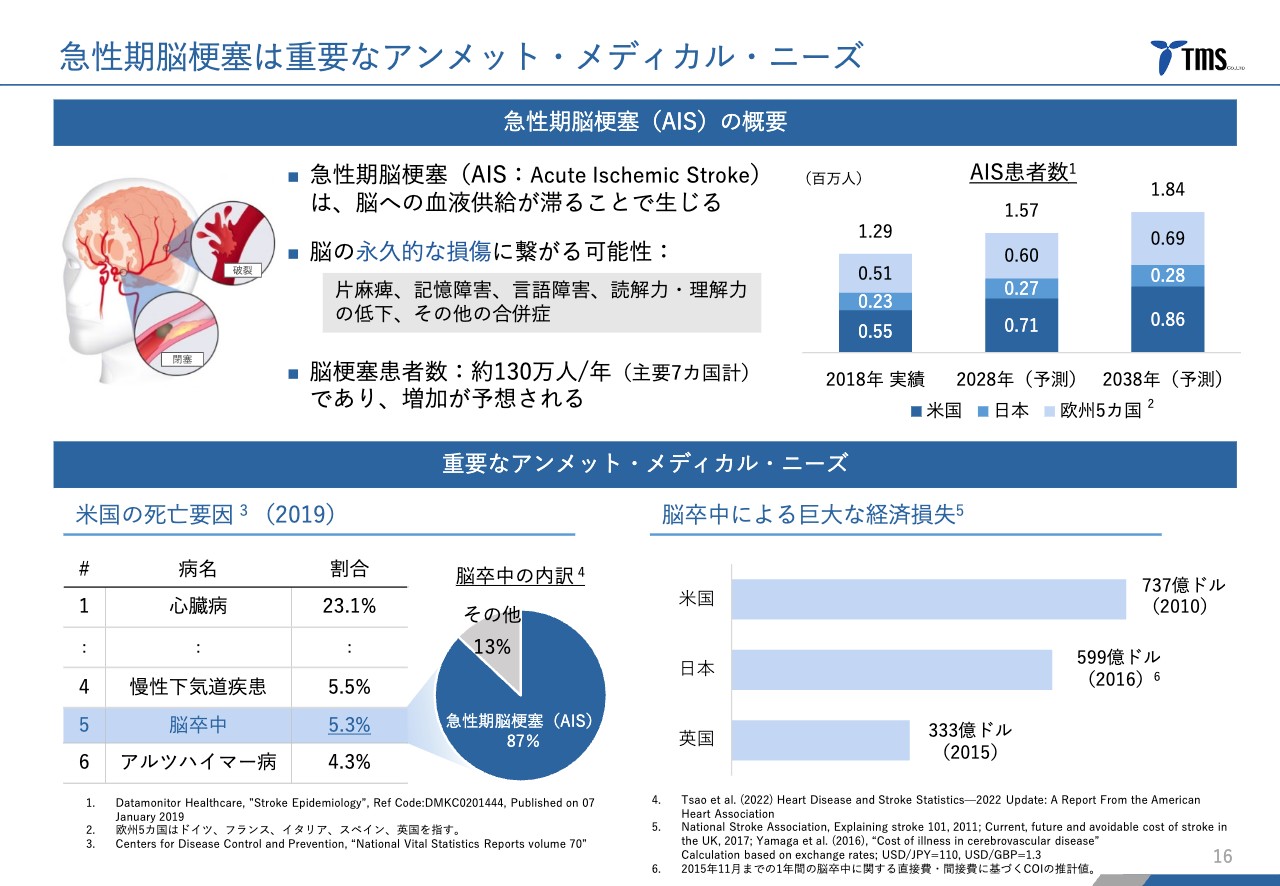
当社のリードパイプラインである「TMS-007」についてご説明します。これまでのご説明とかなり重複している部分がありますが、初めてご覧になる方もいらっしゃるため、簡潔にご説明します。
まず、「TMS-007」が対象としている急性期脳梗塞という疾患についてです。主要7カ国で年間約130万人から140万人が罹患し、死亡原因の割合としてもかなり高い疾患です。死に至らない場合も重い後遺症が残る場合が非常に多く、重大な疾患となっています。
FDAによる唯一の承認薬t-PA
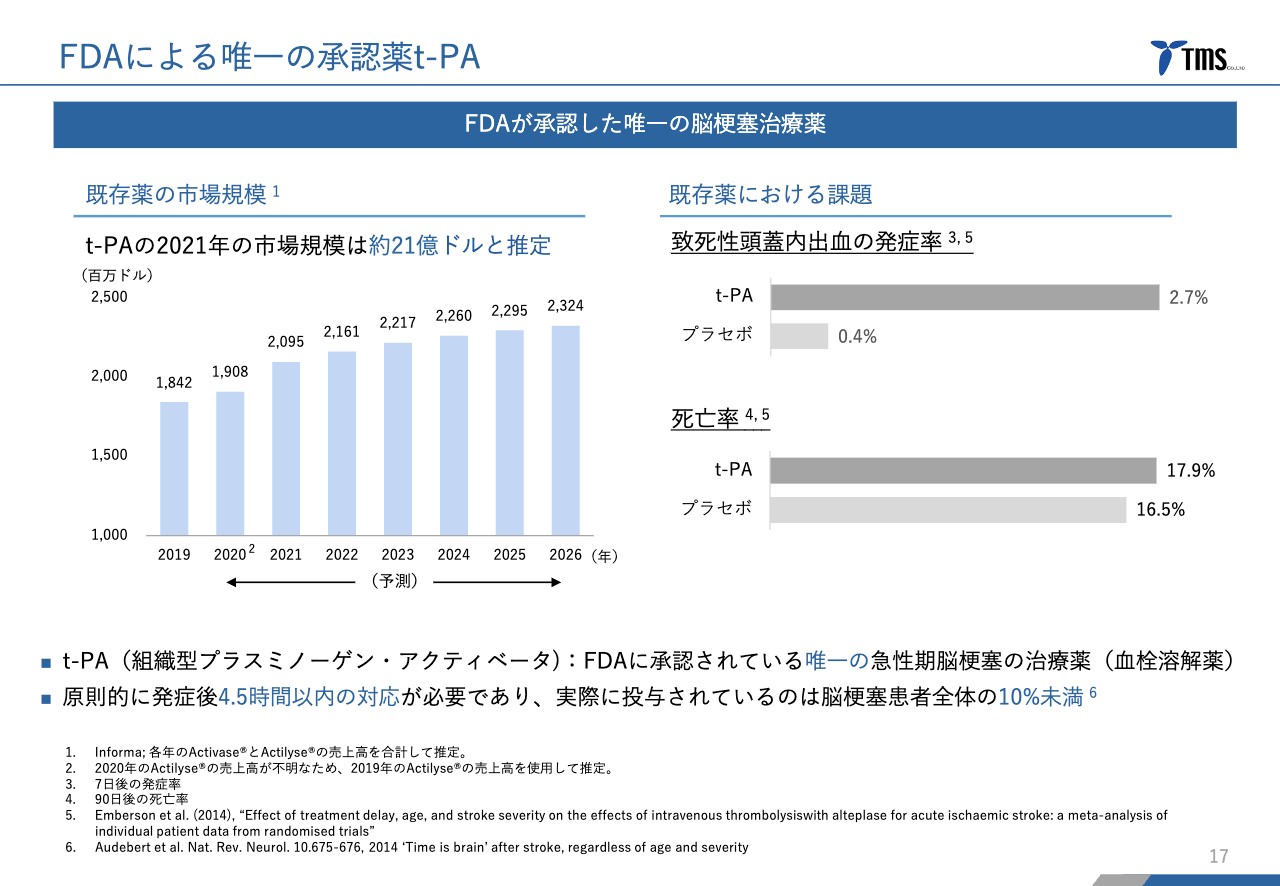
急性期脳梗は非常に重大な疾患であるにもかかわらず、先進各国で共通に承認されている薬は「t-PA」の1つしかありません。こちらは、年間で約20億ドル強販売されています。
ただし、この薬は脳梗塞の原因である血栓を溶かす機能がある一方で、脳出血の発症を助長してしまうという課題が指摘されています。プラセボと比較したデータでは、致死性頭蓋内出血による発症率が約7倍に上がっています。
先進各国で唯一承認されている薬ですが、このような理由から脳梗塞患者の10パーセント未満にしか使われていません。
TMS-007の作用機序
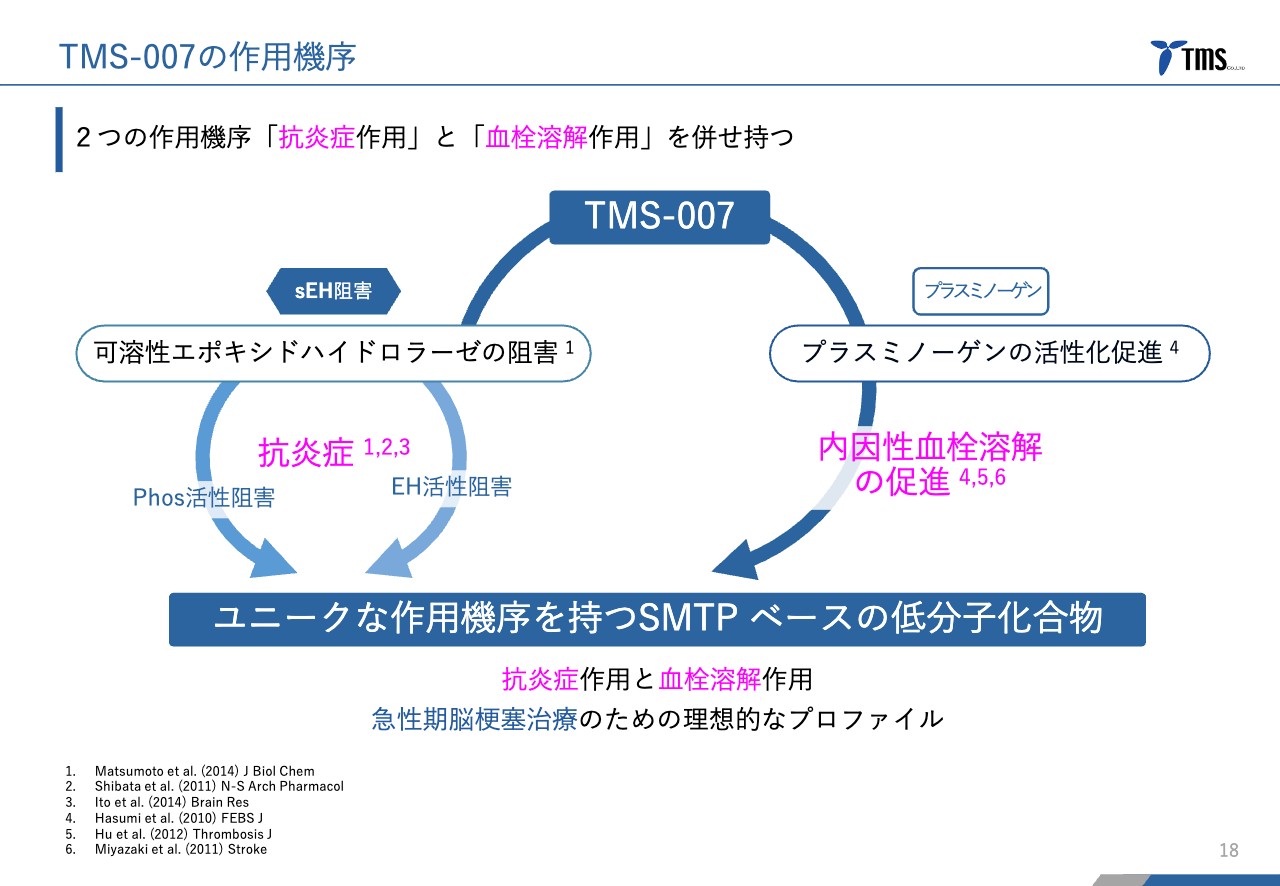
当社は「t-PA」を上回る薬として、「TMS-007」を開発しています。作用機序としては、血栓を溶かす「血栓溶解作用」と炎症を抑える「抗炎症作用」の2つを併せ持つという特徴があります。
これまで開発されてきた脳梗塞の治療薬は、炎症を抑えるか、血栓を溶かすかのどちらかの機能を持つものしかありませんでした。しかし、「TMS-007」はその両方の機能を併せ持っており、これは世界で初めての化合物だと考えています。
TMS-007:Ph2a 臨床試験は良好な結果
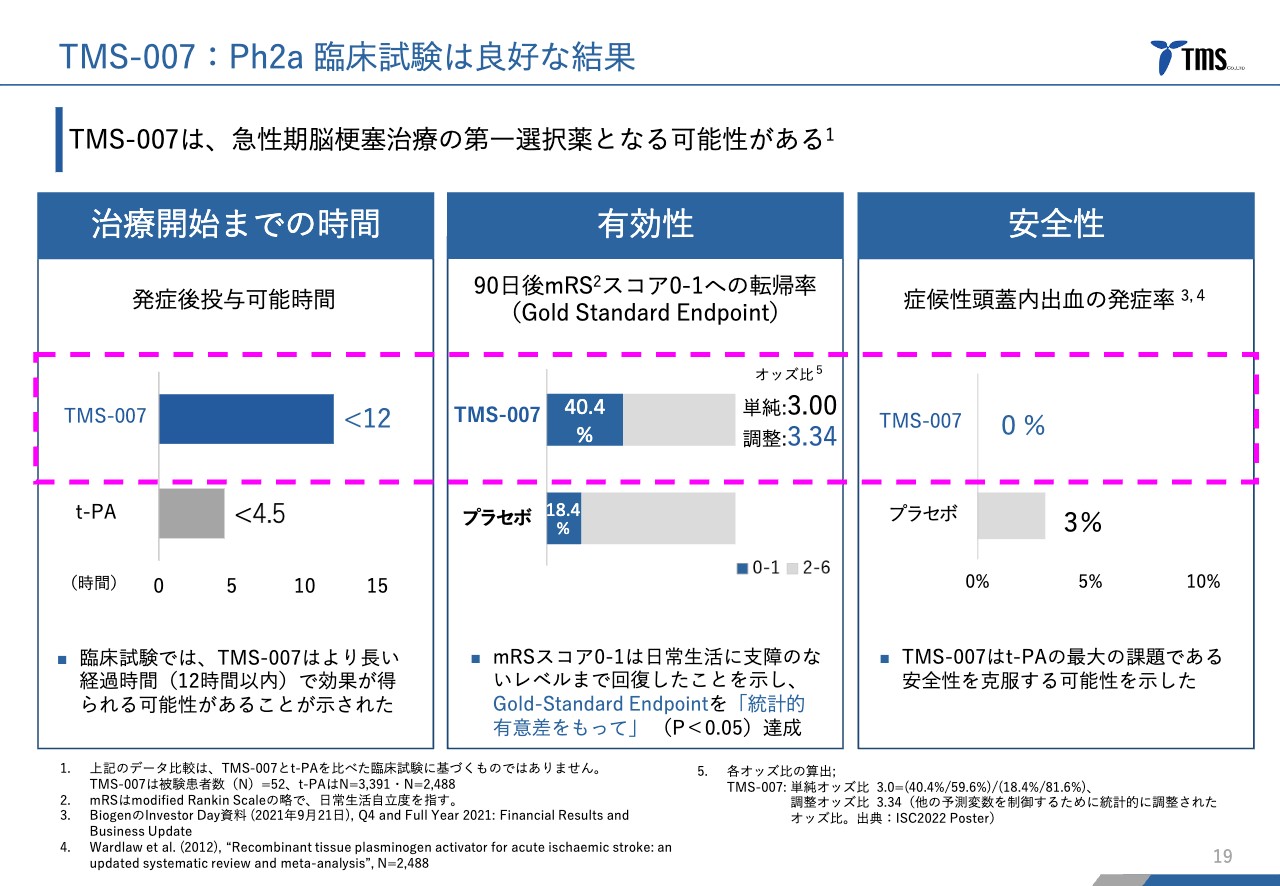
「TMS-007」について、当社が日本国内で行った前期第Ⅱ相臨床試験の結果です。治療開始までの時間が「t-PA」より長く、高い有効性と高い安全性を示すことができたと考えています。
特に治療開始までの時間は、「t-PA」は発症から4.5時間以内に投与しなければならないという非常に厳しい制限があります。しかし「TMS-007」は、当社の臨床試験では発症から12時間まで投与可能です。
実際に90例の患者さまのうち、4.5時間以内に投与された患者さまはたった2例で、ほとんどの患者さまは4.5時間以降の投与となっており、平均発症後投与時間は9.5時間となっています。
TMS-007:Ph2a 臨床試験結果_Gold-Standard Endpoint(mRS0-1転帰率)達成
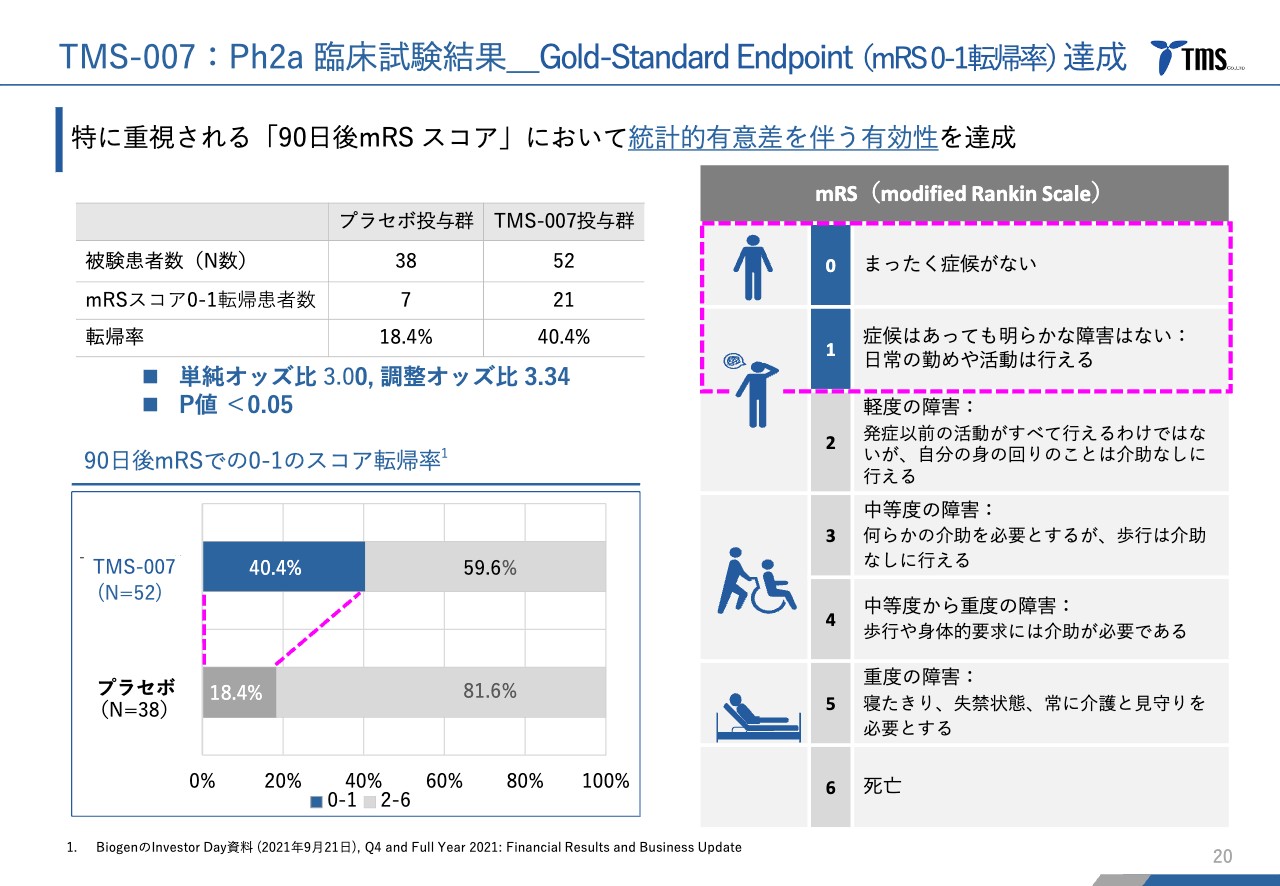
有効性についてです。Gold-Standard Endpointは、mRSという指標において「0」から「1」の結果になった患者さまの比率を示しています。これは、これまでの脳梗塞を対象とする第Ⅲ相臨床試験の有効性評価項目として非常に多く使われてきた指標です。
スライド右側にmRSスコアの概要を示しています。「0」から「6」の7段階の非常にシンプルなもので、「0」はまったく症状がなく、「1」は多少の症状はあっても日常生活にまったく支障がないというスコアです。
スライド左下のグラフをご覧いただくと、「0」から「1」になった患者さまは、「TMS-007」投与群では全体の40.4パーセント、プラセボ投与群では18.4パーセントと非常に大きな差がつきました。
全体で90例という比較的小さな試験ですが、結果として統計的な有意差がついたことで、有効性を達成しました。
TMS-007:Ph2a 臨床試験結果_有効性 - 血管再開通効果
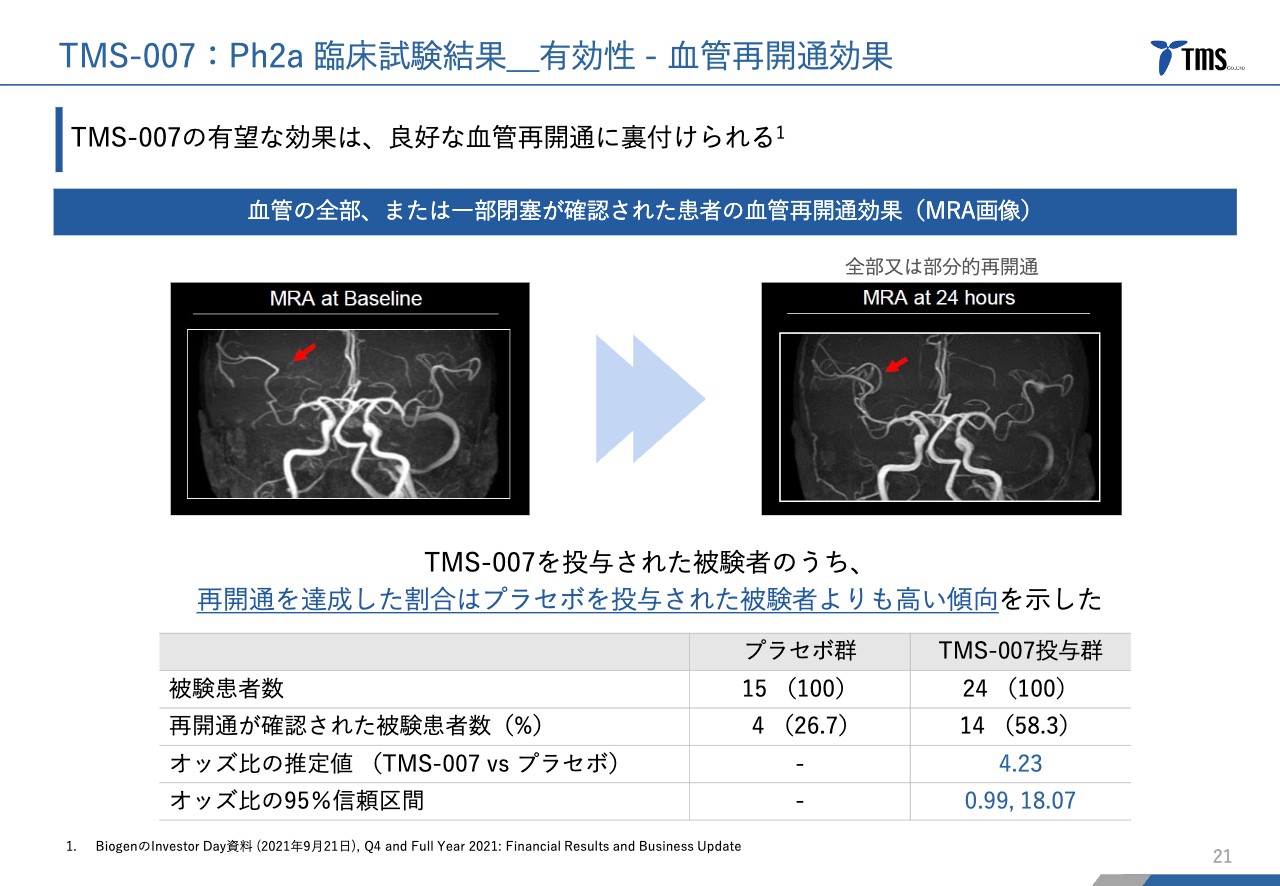
実際に投与された脳梗塞の患者さまのうち、MRAという撮像機能を使って脳血管のどの部分が詰まっているかがわかった患者さまに対し、24時間後に血管が再開通しているかどうかを確認しました。
90例のうち39名の患者さまについて、脳血管が詰まっている場所の把握ができました。39名の患者さまのうち、プラセボ投与群が15名、「TMS-007」投与群が24名です。
再開通率は、プラセボ投与群が26.7パーセントであったのに対し、「TMS-007」投与群は58.3パーセントと、非常に大きな差をつけることができたと考えています。
このような脳血管の再開通の結果もあり、先ほどのmRSをベースにした症状のスコアも非常によい結果が出たのだと考えています。
TMS-007:Ph2a 臨床試験結果_安全性
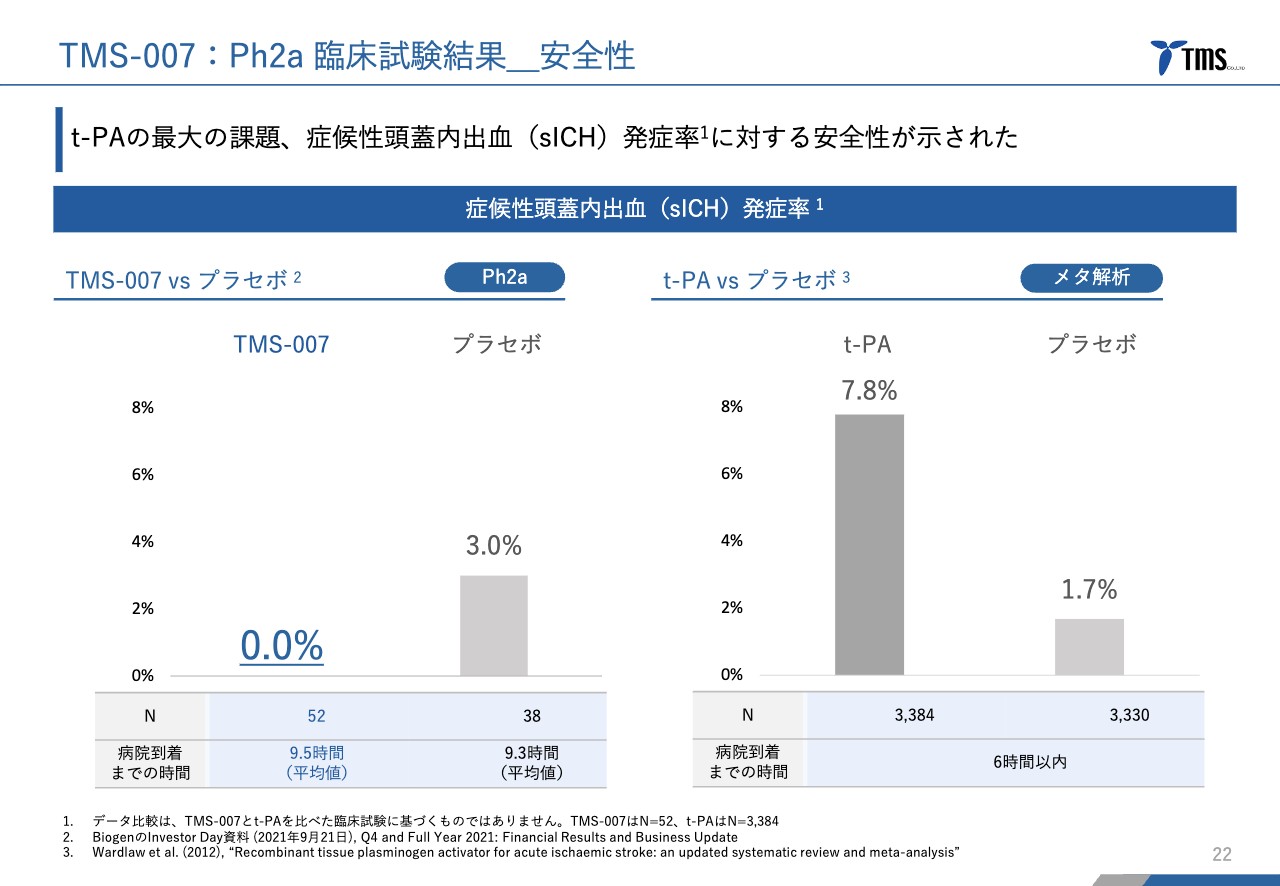
症候性頭蓋内出血の発症率における安全性についてです。スライドのグラフは、非常に微小な脳出血を除き、症状の悪化を伴う脳出血がどの程度の患者さまに発症したかを示しています。
スライド左側のグラフのとおり、「TMS-007」投与群ではそのような患者さまは1人もいませんでした。
一方で右側のグラフは、同じ試験ではないため厳密な比較にはなりませんが、「t-PA」を投与すると約7パーセントの患者さまが症候性頭蓋内出血を発症すると言われています。こちらと比較すると、安全性もかなり高いことを示唆する結果となりました。
TMS-007の可能性:潜在的な市場規模
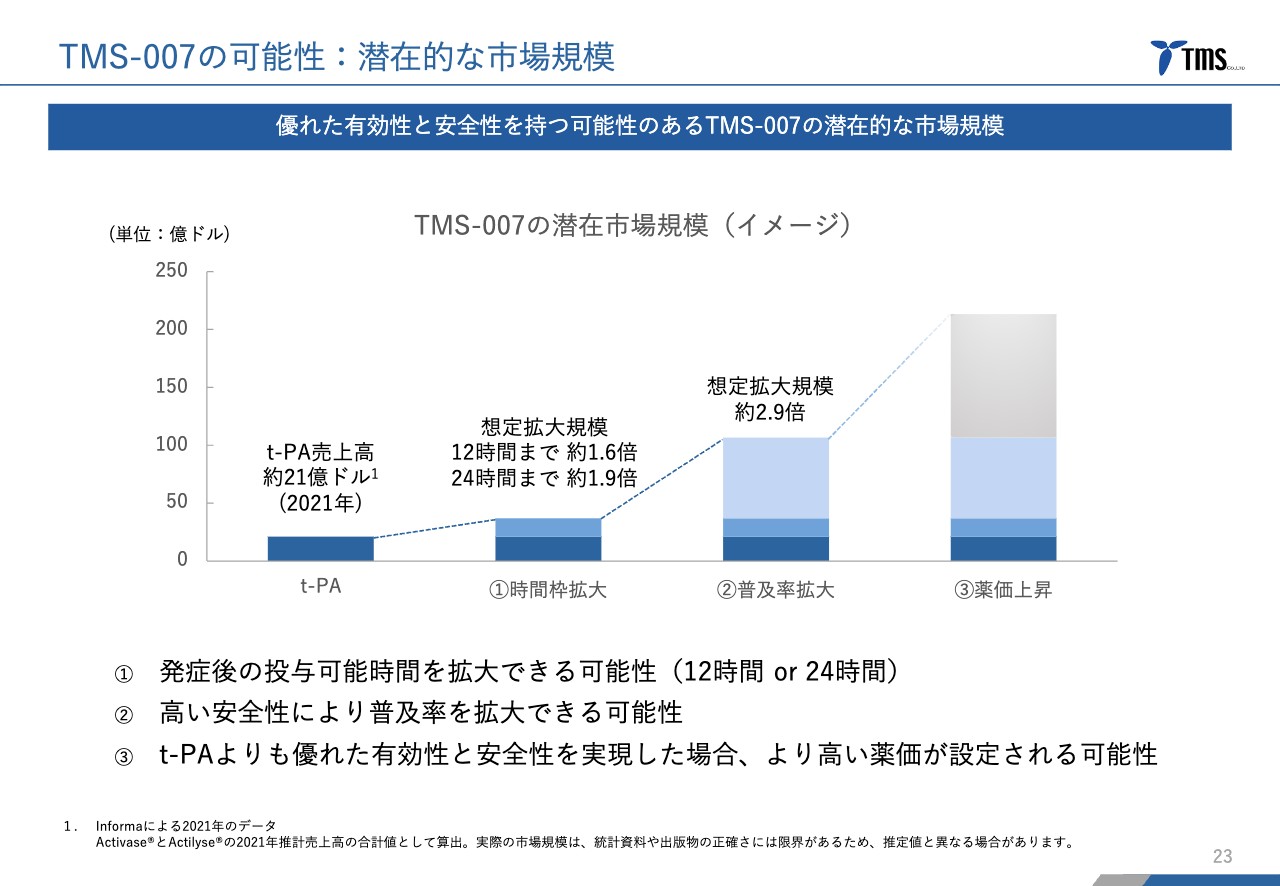
「TMS-007」の可能性と潜在的な市場規模についてです。「t-PA」は脳梗塞患者の全体の10パーセント未満にしか使われておらず、20億ドル強の売上があります。
当社としては、まず時間枠拡大として、12時間まで拡大できた場合には想定患者数が約1.6倍となると考えています。また、あくまでも可能性の話ですが、24時間まで拡大できた場合には約1.9倍に増えると予想しています。
そして、高い安全性により普及率を拡大できる可能性もあり、さらに上乗せで最大約2.9倍の患者数の拡大が期待できると考えています。
また、「t-PA」と比較して高い有効性と高い安全性の両方を実現できた場合には、より高い薬価を訴求することも可能で、市場規模の拡大がさらに期待できると考えています。
TMS-007の可能性:発症後投与可能時間の拡大
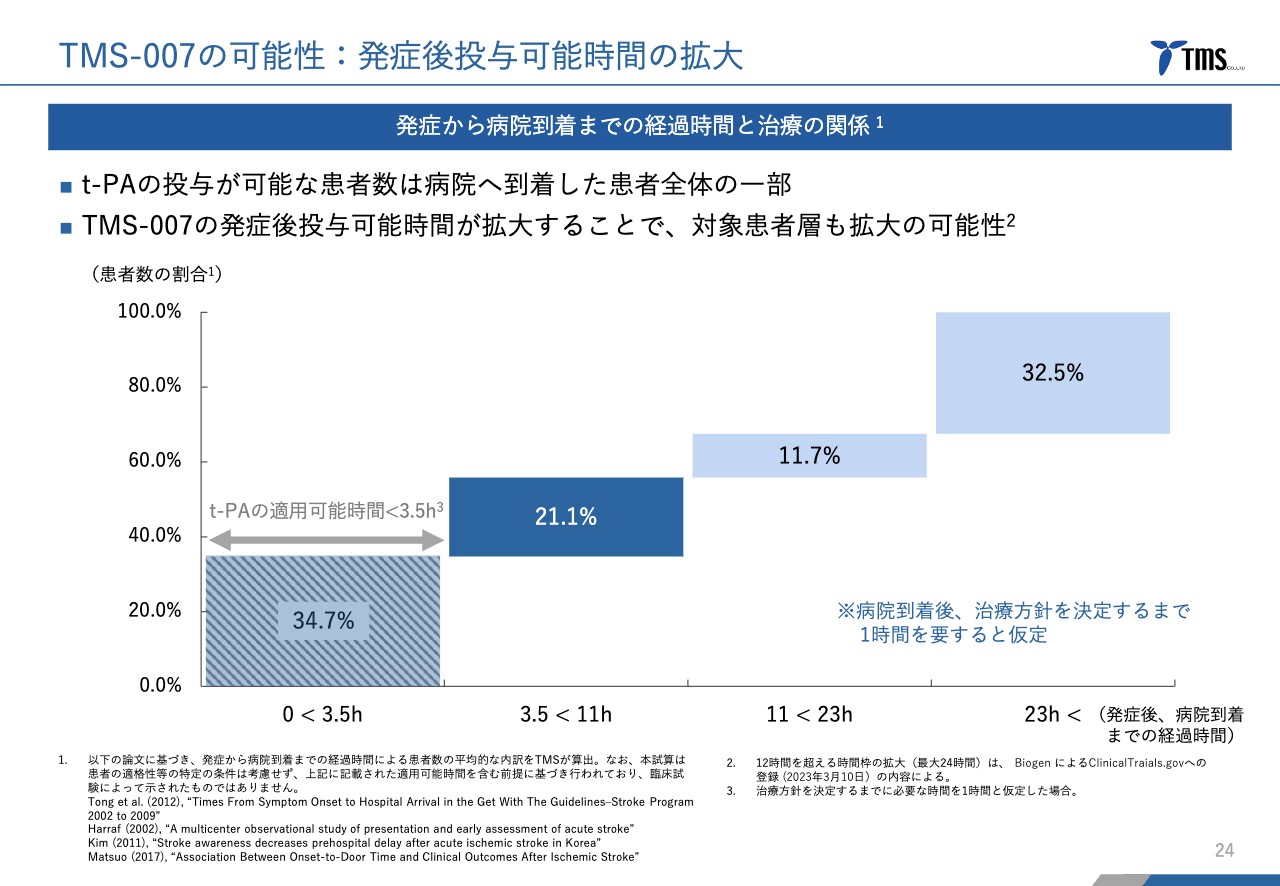
発症後投与可能時間の拡大に関するグラフです。発症から病院到着までの時間毎でみると、「t-PA」の投与が可能な時間帯に病院へ到着した患者数は、全体の3分の1くらいだと考えています。
TMS-007の可能性:普及率の拡大
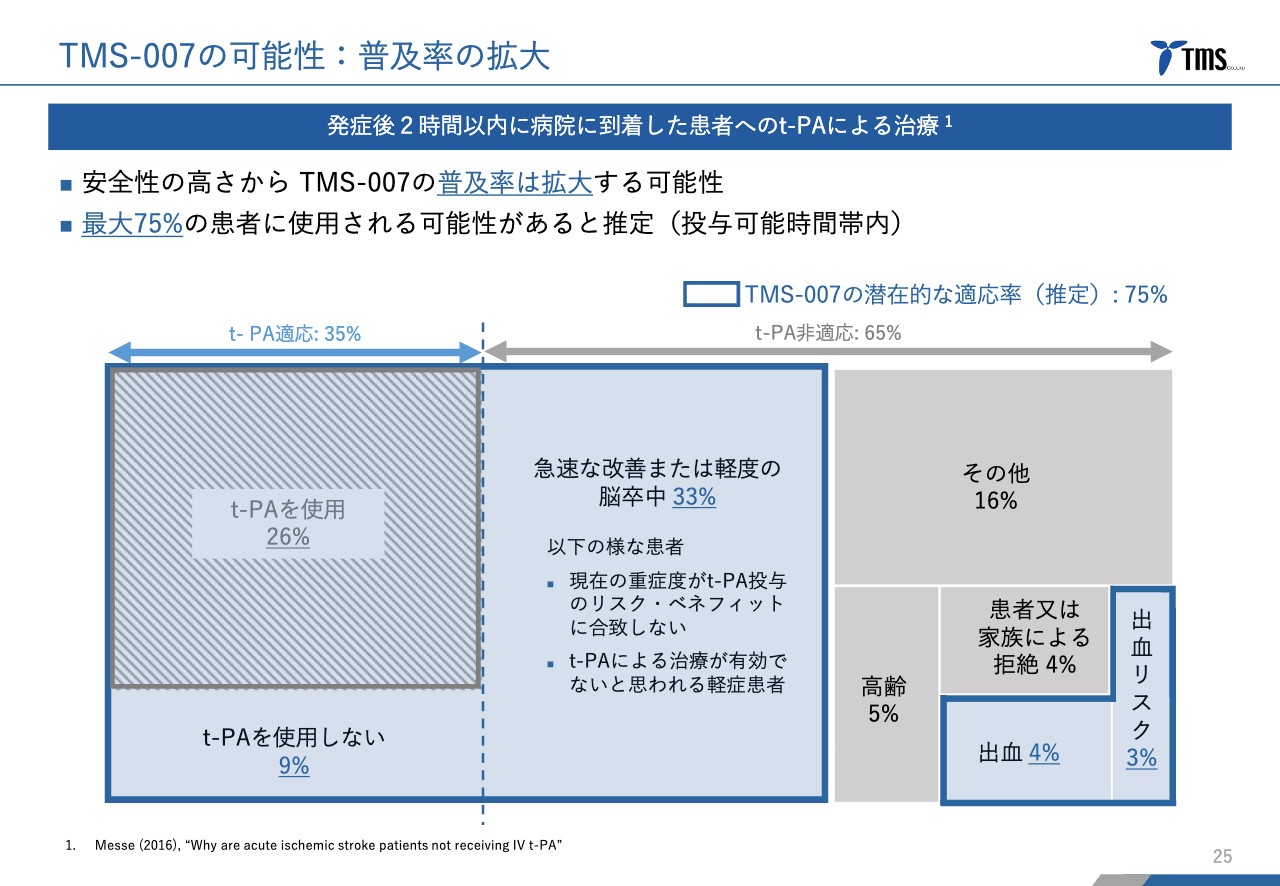
普及率の拡大についてです。スライドのグラフは、発症から2時間以内(t-PA投与可能時間内)に病院に到着した患者さまへの「t-PA」の適用に関して、実際にどれくらいの方に「t-PA」を使用しているか、あるいは使用されなかった患者さまはどのような理由によるものなのかを示しています。
「t-PA」の使用は26パーセント(斜線で示す枠)に対し、青枠で囲った全体の75パーセント程度が「TMS-007」の投与可能な対象層になるのではないかと考えています。
JX09について(1/2)

「JX09」についてです。JIXING社との提携により、当社が日本における開発販売権を取得したアセットです。「JX09」は治療抵抗性高血圧を対象とし、「ベスト・イン・クラス」のポテンシャルがあると考えています。
治療抵抗性高血圧というと言葉に馴染みがないかもしれませんが、治療下の高血圧患者さまのうち10パーセントから20パーセント程度の方は治療抵抗性であり、一般に使われている降圧剤ではなかなか効果が得られないと考えられています。
このような患者さまに対し、アルドステロン合成阻害といった作用機序を持つ化合物が有効ではないかということで、当社やJIXING社に限らず、複数社で開発が進められています。
アルドステロン合成阻害剤のポイントとして、標的であるアルドステロン合成酵素「CYP11B2」を選択的に阻害し、よく似た構造を持つ「CYP11B1」というタンパク質に対しては阻害しないという特性がこの薬剤を成功させるために重要であると考えられています。
「JX09」は、「CYP11B1」と比較して「CYP11B2」に対して300倍以上の選択的阻害活性を持っているという結果が得られています。
さらに霊長類を対象とした動物実験において、90パーセント以上のアルドステロン低下を達成しました。つまり、アルドステロンの量が10分の1以下になるということで、これは非常に期待できるのではないかと考えています。
JX09について(2/2)
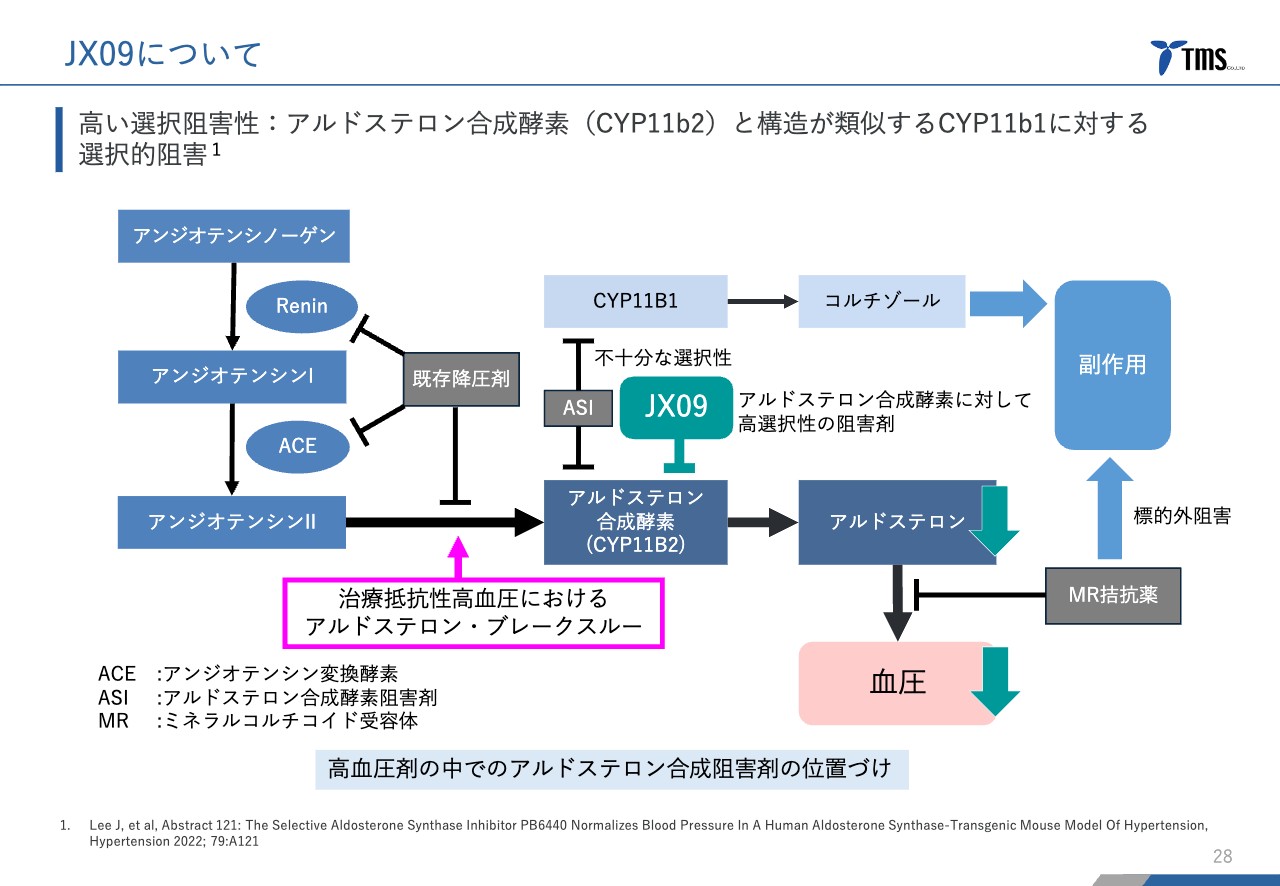
作用機序の図です。「JX09」は、「CYP11B1」を阻害せず「CYP11B2」だけを阻害することで、アルドステロンの量が下がり、血圧が下がるという作用機序を持っています。
JX09について:日本市場
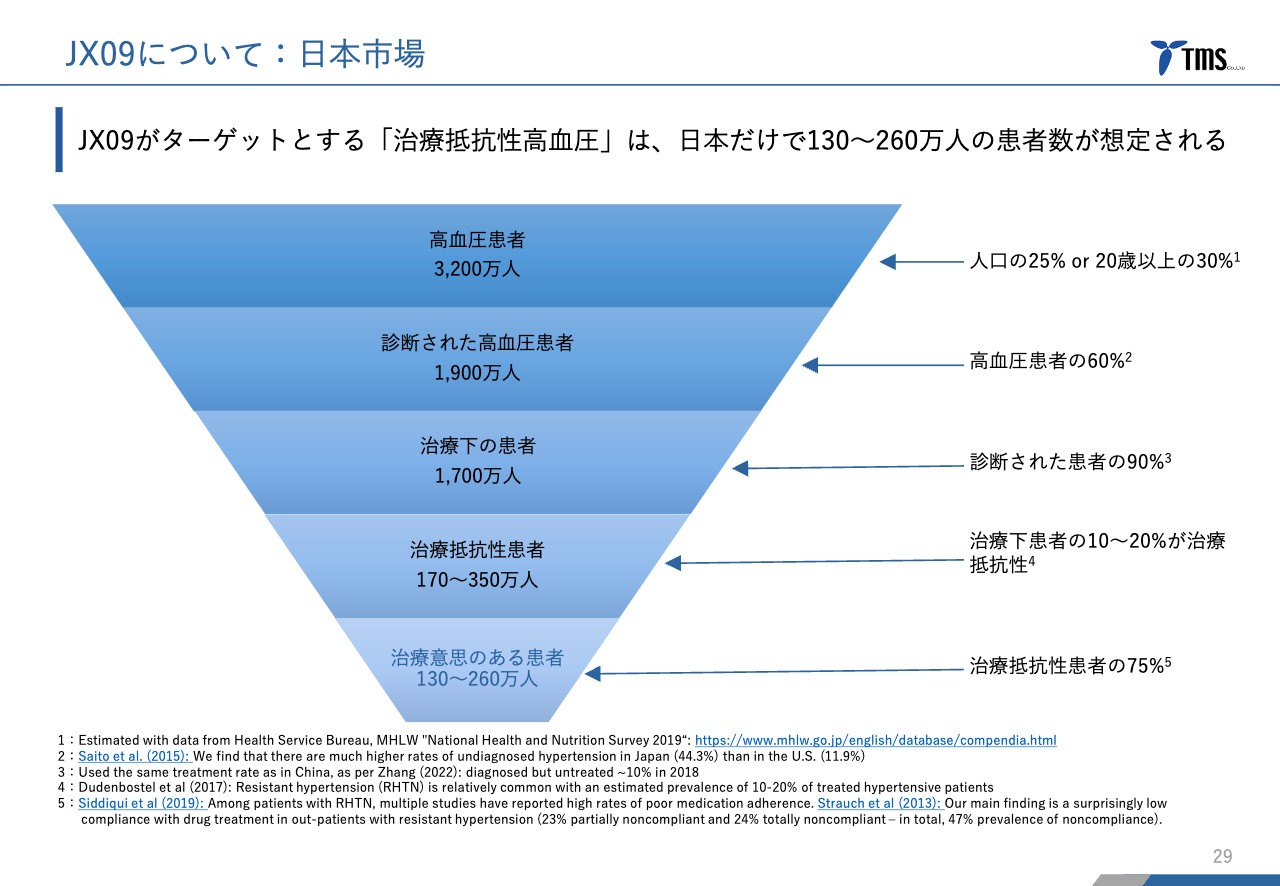
市場規模について、患者さまの数で示しています。図の一番下をご覧ください。治療抵抗性かつ治療意思のある患者さまは、日本では130万人から260万人程度が見込まれると考えています。
TMS-008:広範な適応症が期待できる抗炎症作用
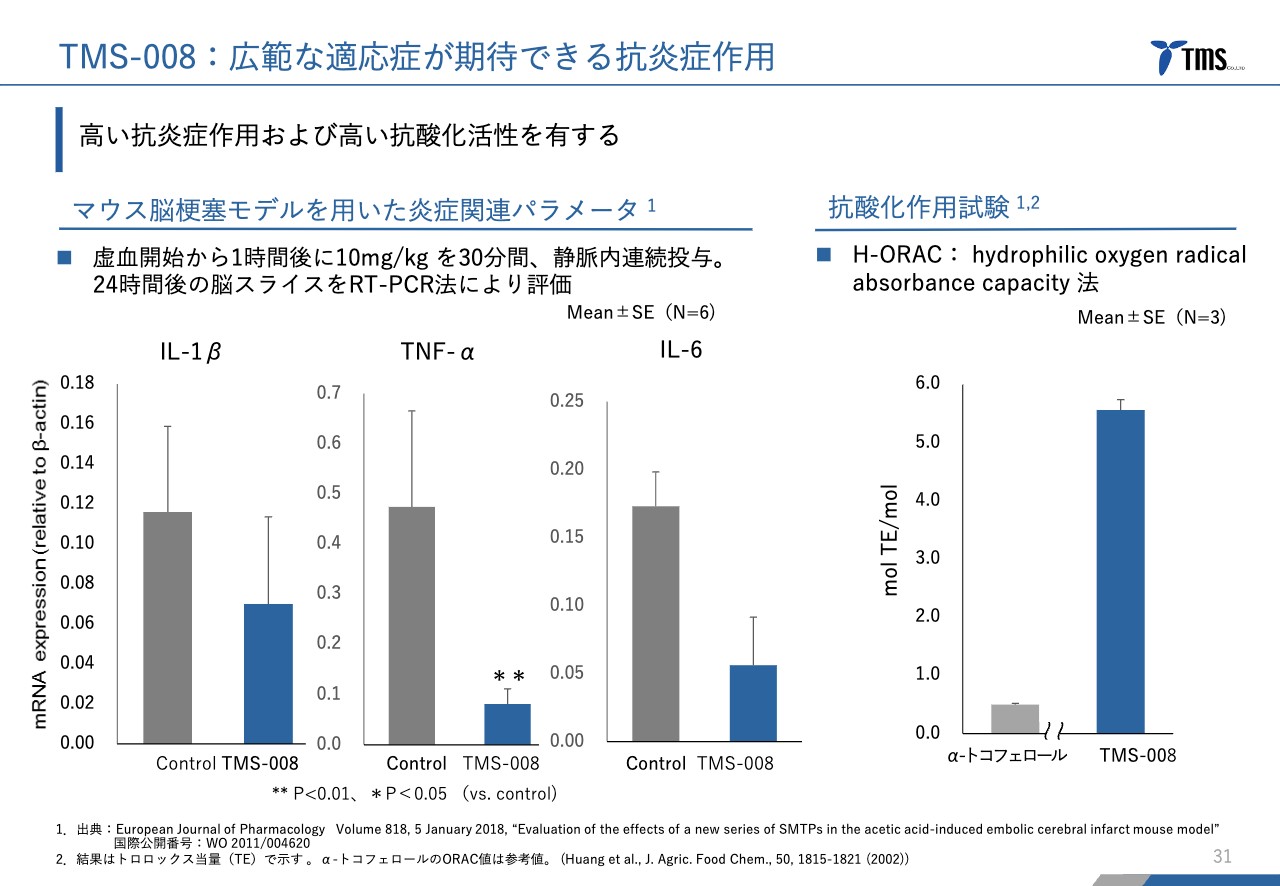
「TMS-008」「TMS-009」についてです。「TMS-008」は「TMS-007」と同じSMTP化合物のファミリー化合物です。違いとしては、「TMS-007」は血栓溶解作用を持っていますが、「TMS-008」と「TMS-009」は血栓溶解作用がなく、抗炎症作用を持つ化合物です。
スライド左側のグラフは、マウスの脳梗塞モデルを用いた炎症関連パラメータを示しています。「IL-1β」「TNF-α」「IL-6」を抑えているのが見て取れます。
さらに、かなり強い抗酸化作用も持っており、スライド右側のグラフをご覧いただくと、ビタミンEの「α-トコフェロール」と比較しても非常に強い結果が得られています。
TMS-008:適応症_急性腎障害(AKI)(1/2)
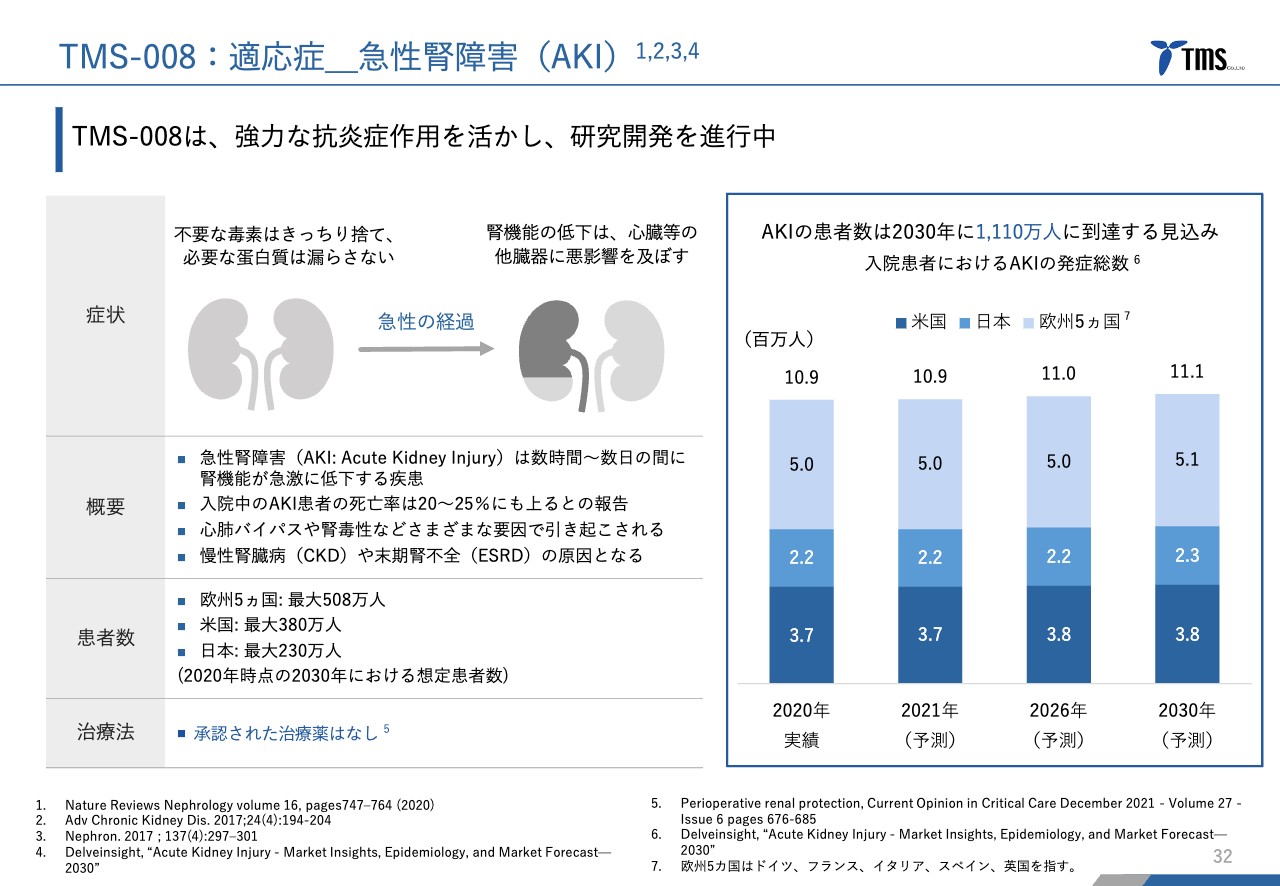
当社は「TMS-008」の強い抗炎症作用を活かし、まずは急性腎障害という疾患を対象に治験を進めていきたいと考えています。
急性腎障害は、読んで字のごとく急速に腎機能が低下する疾患です。入院中の急性腎障害患者の死亡率は20パーセントから25パーセントにも上るという報告もあり、非常に重要な疾患です。
ただし、急性腎障害を対象とした治療薬がないため、大きなアンメット・メディカル・ニーズであると考えています。
TMS-008:適応症_急性腎障害(AKI)(2/2)
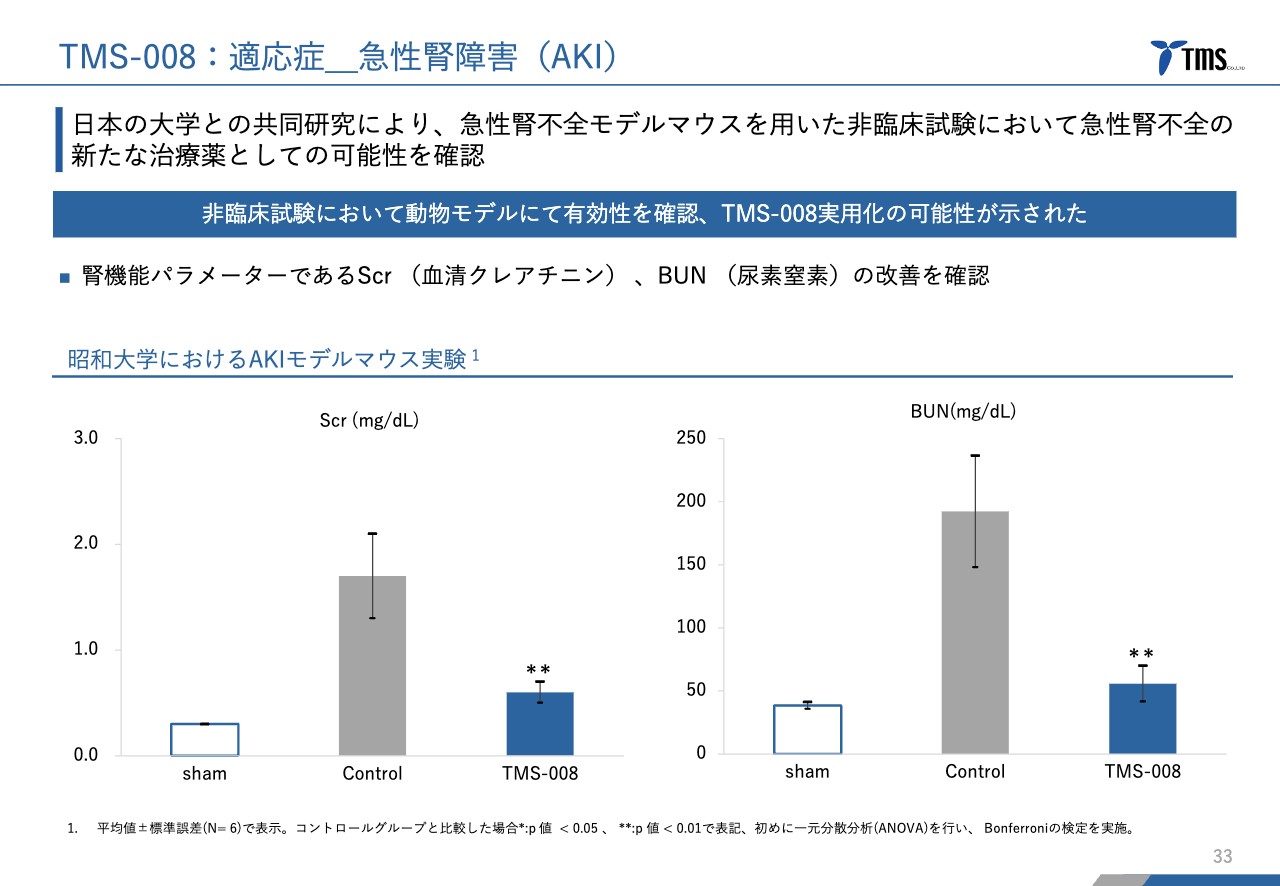
当社は「TMS-008」に関して第Ⅰ相臨床試験を始めるところであり、有効性のデータは動物実験のものになります。スライドのグラフは、急性腎障害を模したモデルマウスの実験データです。
スライド左側のグラフが血清クレアチニン、右側のグラフが血中尿素窒素を示しており、腎機能では非常に重要なマーカーです。これらを大きく改善したという結果が得られています。
TMS-008:Ph1 臨床試験概要
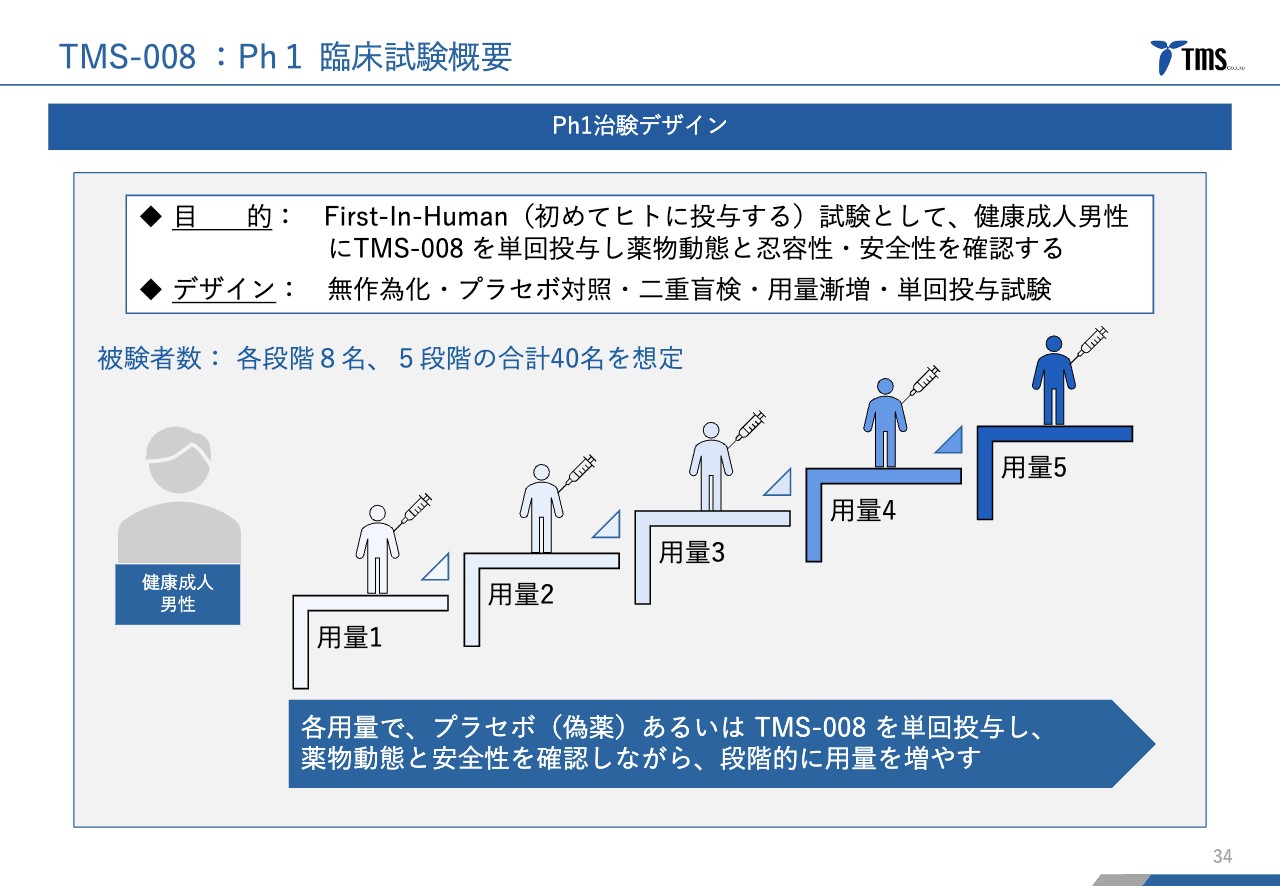
第Ⅰ相臨床試験は、健康な成人男性を対象に、容量を徐々に増やしながら安全性と忍容性を確認するというものです。
TMS-009:TMS-008のバックアップ
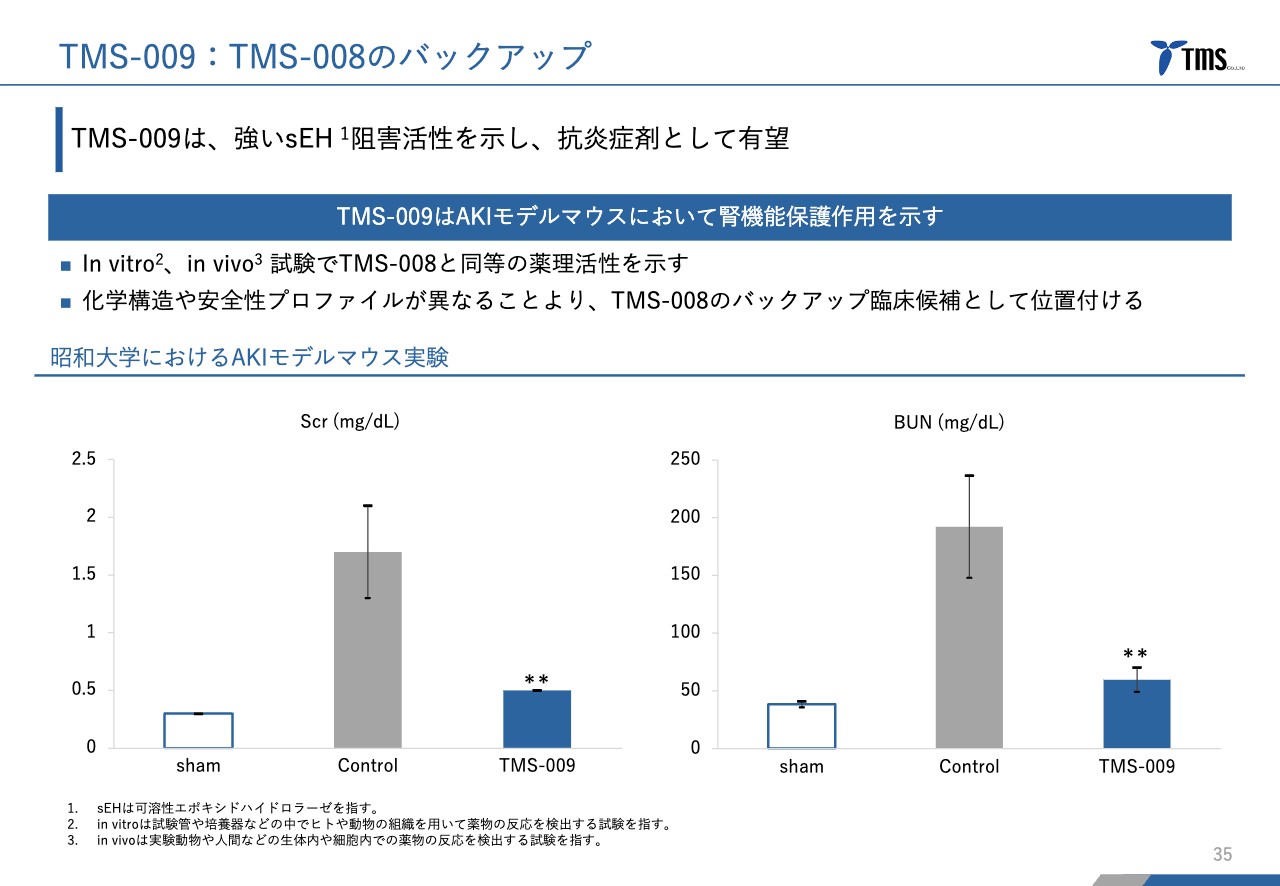
「TMS-009」です。「TMS-008」のバックアップとして準備を進めています。スライドのグラフのとおり、「TMS-008」と非常に似た活性を持っています。
社内と社外の両輪によりパイプラインの充実を図る
最後に、今後のパイプライン拡充の方針についてお伝えします。当社は、大学で発見されたSMTP化合物について研究から臨床開発まで行ってきました。さらにグローバルの製薬会社と提携を実現したという経験もあります。
これを活かし、これまでのシーズに限らず、大学を中心としたいろいろな研究機関からシーズを取得したり、社内での研究活動から新しいシーズを創出しながら、グローバル市場に展開していくビジネスモデルを考えています。
新規シーズの研究開発状況
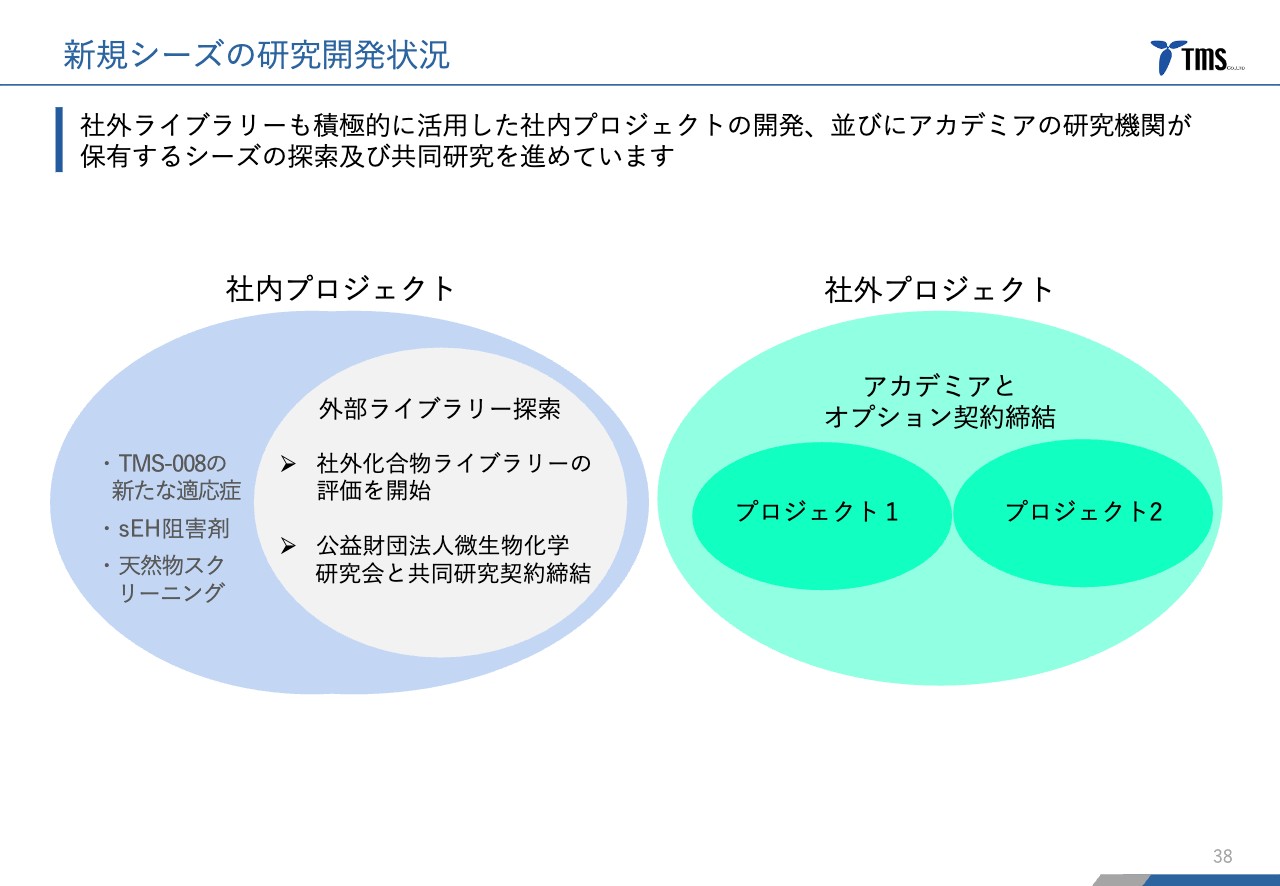
新規シーズの研究開発状況です。まだ研究段階のものであり詳細をお伝えすることはできませんが、社内のプロジェクトのほか、社外のプロジェクトとしては、アカデミアとオプション契約を締結したものが2件あり、評価が進んでいます。
社外プログラムのアプローチ
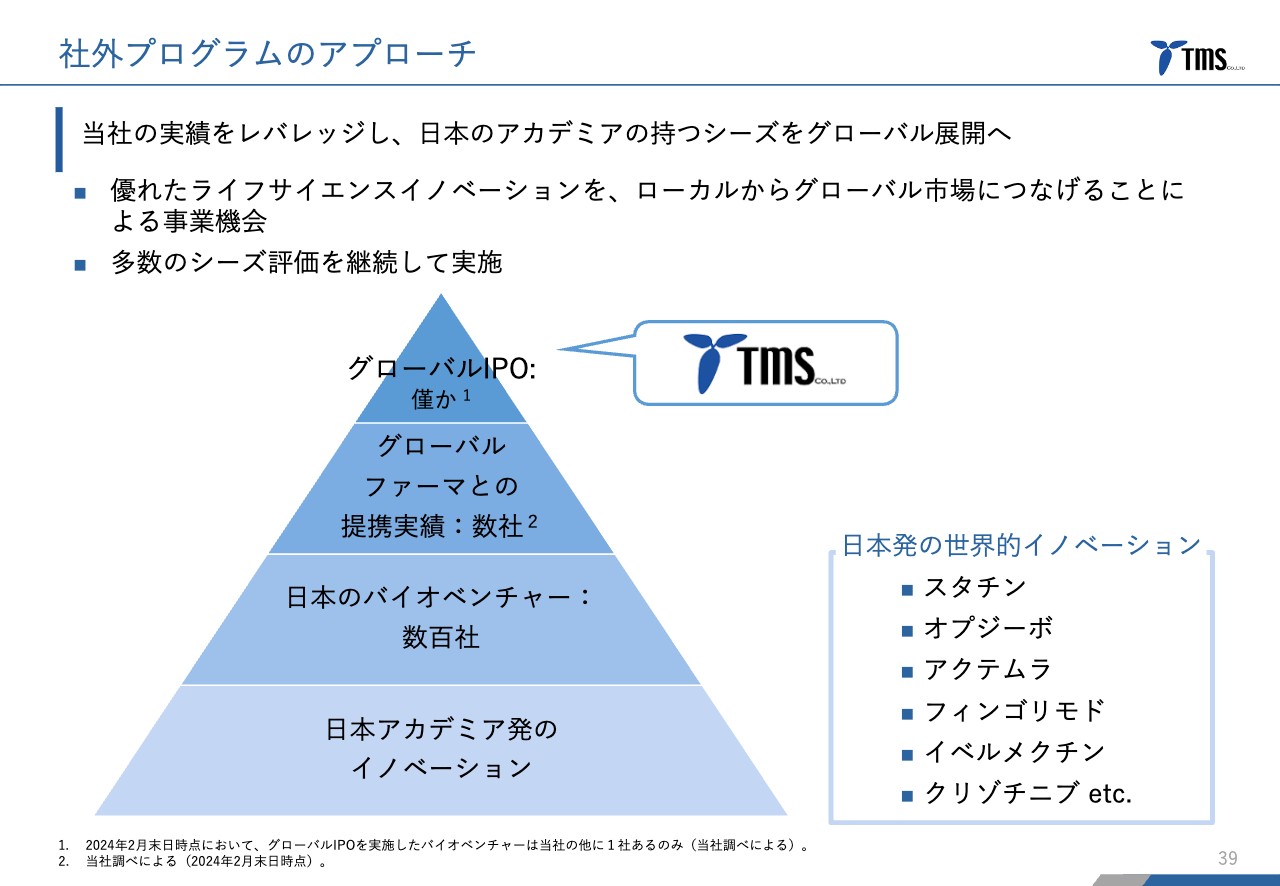
社外プログラムのアプローチです。先ほどお伝えしたとおり、グローバルの活動実績を持つ日本でも数少ない創薬型バイオベンチャーとして、グローバルの市場に向けて良い医薬品を出していきたいと考えています。
質疑応答:「TMS-007」の次の治験開始について
司会者:「『TMS-007』の次の治験開始は2024年中でしょうか?」というご質問です。
若林:「TMS-007」における次の治験の開始時期に関しては、現時点では2024年中であるかどうかも含めて回答しかねます。ただし、現時点ではJIXING社と当社で非常に緊密に連絡を取り合いながら次の治験の計画を進めており、着実に準備が進んでいます。
質疑応答:JIXING社のオプション契約の変更に基づくアップフロントについて

司会者:「JIXING社の株式取得におけるオプション契約の変更に基づくアップフロントについて教えてください」というご質問です。
若林:アップフロント相当として、まずJIXING社の株式500万ドル相当を無償取得しました。少し種類は異なりますが、「TMS-007」と「JX09」の日本における開発販売権を無償取得したことも、アップフロントとして含まれていると考えています。
質疑応答:「TMS-007」の治験がピポタル試験とならない可能性について
司会者:「『TMS-007』について、次の試験がピボタル試験にならず、次の試験ともう1つの試験を行わないと申請ができなくなる可能性はありますか?」というご質問です。
若林:非常に難しいご質問だと考えています。FDAの場合は、第Ⅲ相臨床試験を2つ要求することも数多くあります。
当社としては、まず今計画中の試験がピボタル試験になるかどうかを含めた部分が未確定です。次の試験がピボタル試験になったり、ピボタル相当の部分を含んだりする可能性はありますが、その場合にさらに第Ⅲ相臨床試験が必要になるかどうかは、さまざまな要因が考えられます。
究極的には次の試験の結果、有効性・安全性がどの程度優れているかにかかってくるだろうと考えています。
質疑応答:脳出血に関する特許の出願人について
司会者:「4月2日付で掲載された脳出血に関する特許の特許査定について、出願人がBiogen社となっていますが、JIXING社に譲渡されたものではないのでしょうか。特許は今もBiogen社が保有しているのでしょうか?」というご質問です。
若林:脳出血に関わる特許は、当社からBiogen社に譲渡されて、現時点ではBiogen社からJIXING社に譲渡済みです。一部のデータベースではまだBiogen社が名義人となっていますが、名義書換がまだ終了していないだけで、所有権はJIXING社に移転しています。
なお、この特許の内容はすでに論文等で発表されています。マウスを使った実験において、「TMS-007」が脳出血を引き起こさないだけではなく、脳出血を積極的に抑える可能性もあるという結果が出ており、当社としても重要な特許であると考えています。
質疑応答:JIXING社への譲渡に同意する決め手について

司会者:「貴社がJIXING社への譲渡に同意する決め手となった要因は何でしょうか?」というご質問です。
若林:JIXING社を譲渡先としたことは、当社ではなくBiogen社が選択したことです。オプション契約に関する条件変更の交渉等がさまざまある中で、当社は条件変更に関して拒否できる立場にはありましたので、消極的には同意しています。
ただし、JIXING社を譲渡先としたことについてマイナスと捉えているわけではありません。いろいろな契約交渉を通して、JIXING社やJIXING社を設立した投資会社であるRTW社のいろいろな方と話していく中で、構想力も実行力も非常に優れていると考えています。とてもよい相手先をBiogen社に見つけていただけて、非常に喜ばしいと思っています。
質疑応答:「JX09」の競合品との比較における優位性について

司会者:「『JX09』は、競合品との比較においてどのような優位性があるのでしょうか?」というご質問です。
若林:アルドステロン合成阻害剤に関しては、現在、アストラゼネカ社とミネラリス セラピューティクス社が第Ⅲ相臨床試験を進めているところです。同じ作用機序のもので臨床試験に入っているため、主要な競合としてはこの2つが考えられます。
「JX09」の優位性は、先ほどお伝えしたとおり、「CYP11B2」に対する選択的阻害性を持っており、類似構造をもつ「CYP11B1」を(「CYP11B2」の1/300程度しか)抑えないところが非常に優れていることだと考えています。先に進んでいるものがありますが、ベスト・イン・クラスを目指せる可能性があるのではないかと考えています。
若林氏からのご挨拶
若林:本日は大変ご多用の中、当社の2024年2月期決算説明会にご参加いただき、ありがとうございました。昨年度は提携先がBiogen社からJIXING社に変わるという非常に大きな変化がありました。
「TMS-007」の開発が再スタートしたため、これから開発をさらに加速していき、他のパイプラインも充実させていきながら企業価値を高める努力を引き続き行っていきたいと考えていますので、どうぞよろしくお願いします。ご清聴ありがとうございました。
新着ログ
「医薬品」のログ





