参天製薬、2Qのコア営業利益は前年比0.2%増で着地 医療用眼科薬は国内シェア50%を達成
基本理念とWORLD VISION

谷内樹生氏:みなさま、本日はご参加ありがとうございます。また、いつも弊社に対するご理解とご支援を賜り、誠にありがとうございます。まず2ページ目ですが、基本理念とWORLD VISIONを記載しています。「天機に参与する」を基本理念として掲げ、そして「Happiness with Vision」をWORLD VISIONとして据え置き、眼を通じて人々の健康と幸せを実現し、社会に貢献していくことを胸に、日々取り組んでいます。
2020年度上期ハイライト

3ページ目は2020年度上半期のハイライトです。今年2020年度は中期経営計画「MTP2020」の最終年、また「Vision 2020」の締めくくりでもあります。重要な年の上半期を、大変力強いオーガニックの成長と、また2030年に向けた取り組みについて充実した内容で締めくくることができたことを、大変喜ばしく思っています。
まず、中計に関しては、財務数値は前年並みを維持しながら増収増益基調を保つことができました。この全世界的なCOVID-19に伴うさまざまな困難、あるいは市場に対する大きな影響を乗り越えながら、着実に成長できたことを大変嬉しく思っています。
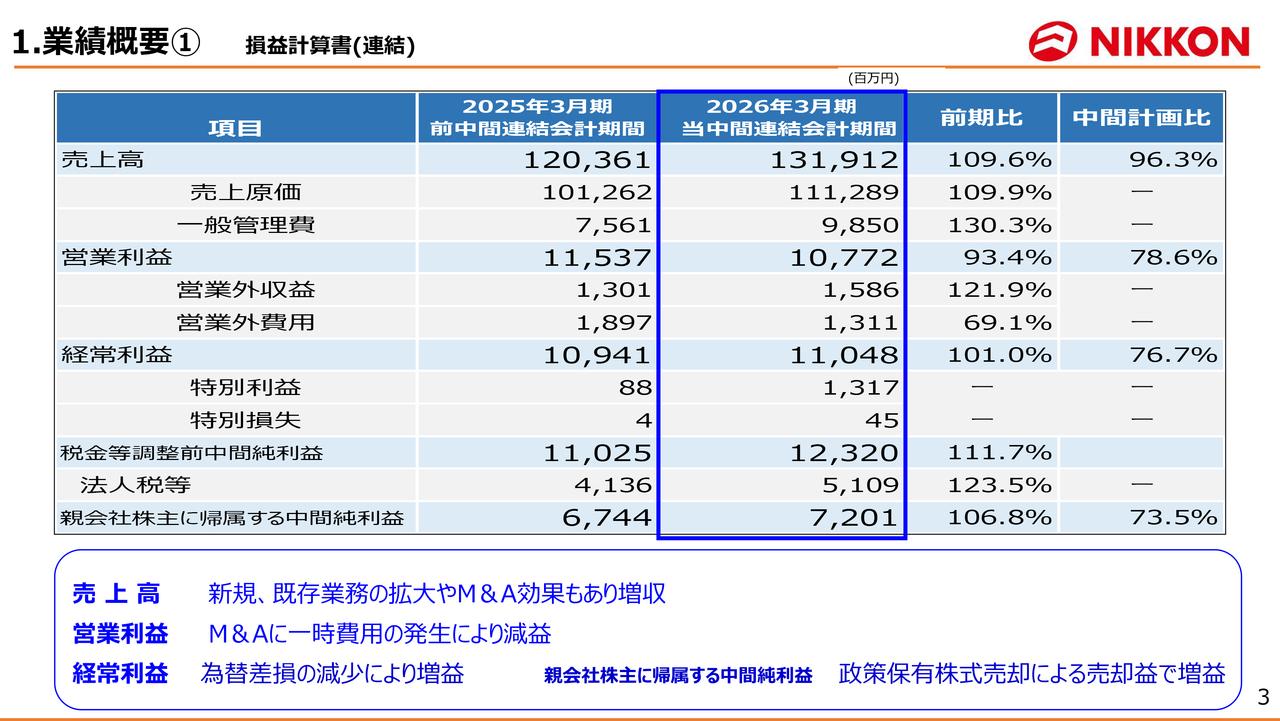
国内医療用眼科薬 市場概況(2019年10月-2020年9月累計)
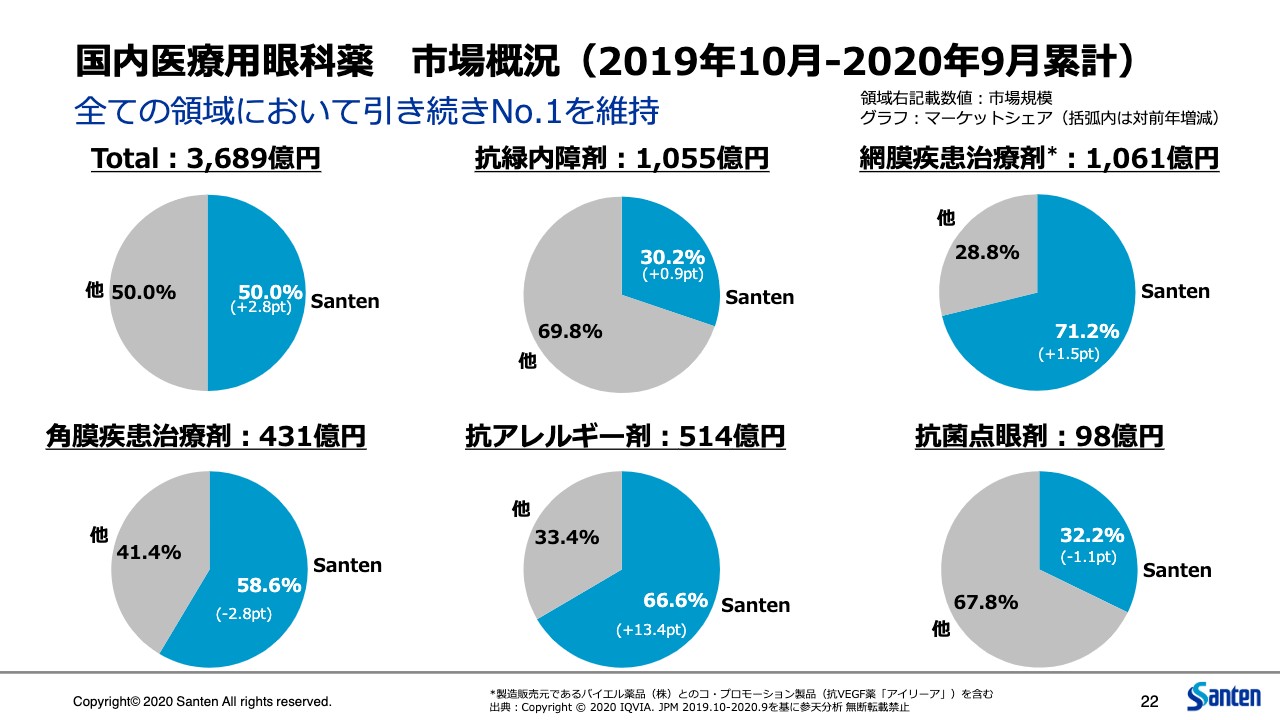
22ページに示すとおり、日本においてはシェア50パーセントという大台に到達することができました。これは参天の130年の歴史の中で初めてだと思います。もちろん市場に対するマイナスの影響はある中で、このようにシェアを伸ばしたというところは、大変力強い、強い事業がより強くなったということだと思っています。
また、グローバル展開という意味でも、Eyevanceの買収を行い、長年の挑戦であるアメリカへの参入に一定のめどが立ったという状況です。
「Santen2030」に向けた成長への布石ということについては、「Vision2020」に掲げた「Ophthalmology」「Wellness」「Inclusion」の3つの取り組みをそれぞれ進めています。jCyteとの提携、Osmoticaとの提携、Orbis Internationalとの提携、それから「ヒアレインS」の発売、ROCK阻害剤の導入、Eyevanceの買収、このような取り組みに加えて、ブラインドフットボール関連の取り組み等も着実に行っています。
本日は、この中で「ヒアレインS」、ROCK阻害剤、Eyevance、それから市場に変化があった中国事業についてお話ししたいと考えています。
①スイッチOTC「ヒアレインS」発売

4ページ目は、日本で発売を開始したスイッチOTC「ヒアレインS」についてです。この「ヒアレインS」は参天で初のスイッチOTC製品となりますので、非常に重要な意味合いを持っていると考えています。日本では医療用医薬品、いわゆるRxの事業とOTCの事業の2つを展開しており、どちらも大変力強いプレゼンス、高いシェアを確立しています。
この「ヒアレインS」が、両事業の強みを併せた初めての製品ということになります。「ヒアレイン」は、20年以上にわたりドライアイ治療の代表薬として日本やアジアの国々で使用されてきた製品です。「ヒアレイン」が築いてきた医療上の治験やブランドイメージをしっかりと継承して、この「ヒアレインS」として直接患者さまや生活者の方々にOTC販路通じてをお届けできるということは、治療の選択肢が増えるという意味で大変良いことだと思っています。
特にCOVID-19によりセルフメディケーションがあらためて着目されている中で、この新しい選択肢を日本で提供できることが大変喜ばしいと思っており、みなさまのクオリティ・オブ・ライフの向上につながればと思っています。
私どもとしても、医療用部門とOCT部門が力を合わせ、医療用事業を持つ参天にしかできないような情報の質と量の展開をしていくことを考えています。そのような会社としての意気込みも込め、石原さとみさまにアンバサダーに就任していただきました。
今後、情報発信もしっかりと行い、また製品の価値の最大化も図っていきたいと考えています。これは長期ビジョンの「Wellness」に関連する取り組みだとご理解いただければと思います。
②日本・アジア地域を対象にROCK阻害剤を導入 中長期的に緑内障におけるプレゼンスの維持向上へ
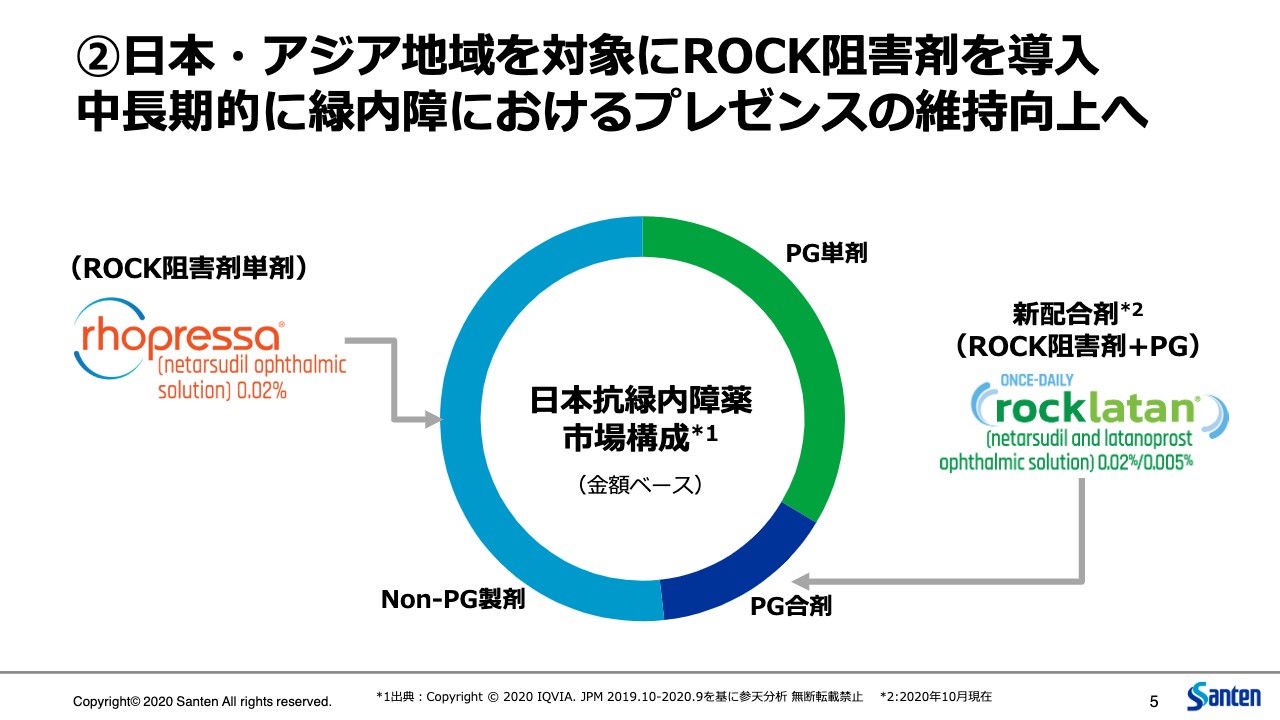
次に2つ目のROCK阻害剤の導入に関してご説明します。次期長期ビジョンにおいても、この既存事業、医療用眼科薬事業の継続的、持続的な成長は大変重要なテーマです。今回、それに向けた大事な一手であるROCK阻害剤の導入ができたことを大変嬉しく思います。
緑内障というのは、参天にとって大変大きな事業の柱です。日本においても、アジア、欧州においても、緑内障は大変大きな割合を占めています。ご存知のとおり、緑内障治療においては、患者の病態や生活状況に合わせて複数種類の薬剤をうまく使い分けながら眼圧をコントロールしていくことが大変重要です。そこに今回、この単剤の「Rhopressa」、それからラタノプロストとの配合剤「Rocklatan」の2つを導入することができました。
②今回のROCK阻害剤導入により 緑内障ポートフォリオのさらなる充実を図る
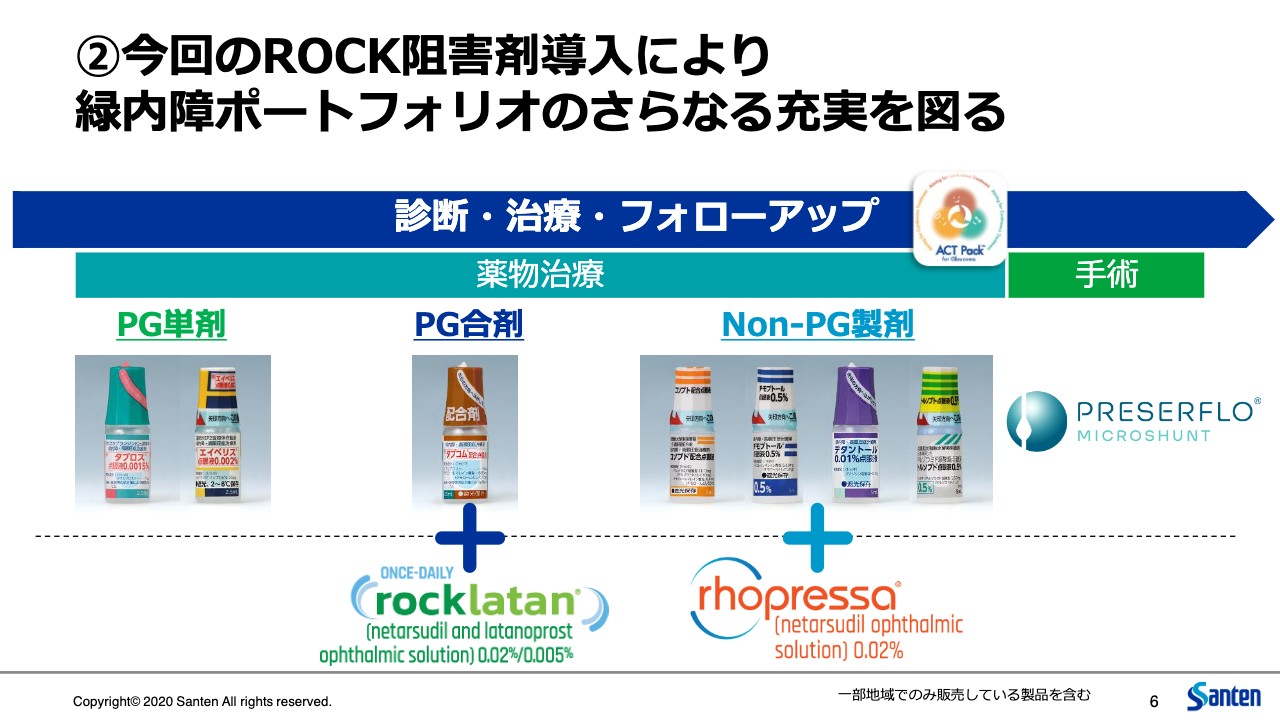
6ページ目です。参天の既存ポートフォリオ、「タプロス」にはじまり「エイベリス」等ありますが、こちらにこの「Rocklatan」と「Rhopressa」が加わることになります。これにより、プロスタグランジン単剤、プロスタグランジンの配合剤、あるいはそれらと組み合わせて使われる非プロスタグランジン系の薬剤の製品群が、それぞれ充実することになりました。
また手術用デバイスである「PRESERFLO MicroShunt」もあります。このような幅広いポートフォリオを持ち合わせることを強みに、より多くの患者のニーズに応えたいと考えています。
③Eyevance社買収により米国本格参入
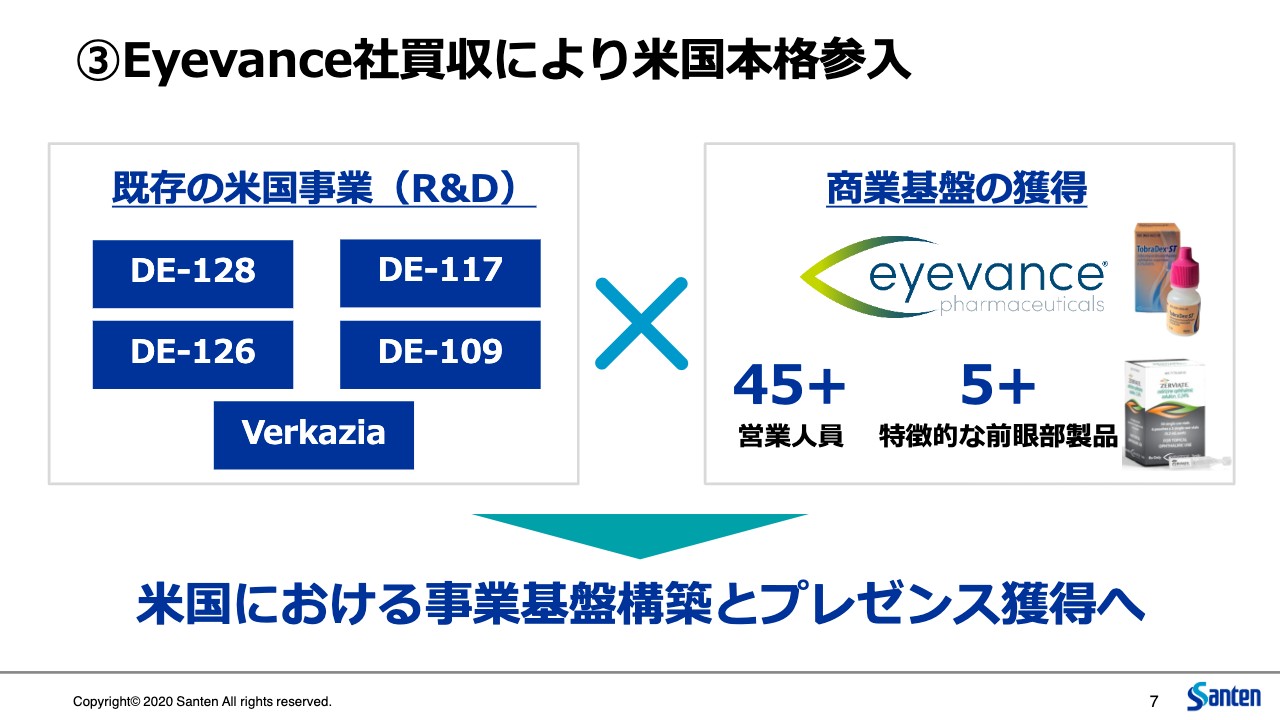
3つ目に、Eyevanceの買収についてご説明します。このEyevanceという会社は、アメリカの主に眼科専業メーカーで働いてきたメンバーが中心となって生まれた会社です。したがって、会社自体の歴史はまだまだ若いのですが、アメリカの眼科事業の経験が豊かなスペシャリスト集団が、すでにアメリカ市場で広く使われている製品を持って事業を行っていることになりますので、立ち上げ以降、順調に成長しています。
一方、私ども参天は、これまではアメリカで商業基盤を持ち合わせておらず、このような複数のパイプラインを持っている状況ということで、われわれに足りないのは、アメリカでの事業の経験や、この非常に広いマーケットをカバーする販路というものでした。
したがって、この買収は大変補完的なものです。私どもが一から基盤を立ち上げていくのに伴うリスクや費用、時間を極力省略したかたちでアメリカ市場への参入を完了させることができたということ、また、今後のパイプラインを商業化していくにあたってのプラットフォームを獲得することができたということになります。
また、これは「Vision 2020」で掲げた「グローバルカンパニーになる」ということについても、最後の大きなピースであったアメリカという市場に参入するという意味で、大きな意味合いがあります。アメリカで獲得した基盤に、われわれがもともと持ち合わせている日本、アジア、欧州における基盤も組み合わせながら、グローバル化の推進、そしてグローバルでの成長を引き続き志向していきたいと考えています。
④中国事業の持続的な成長:市場カバレッジ拡大
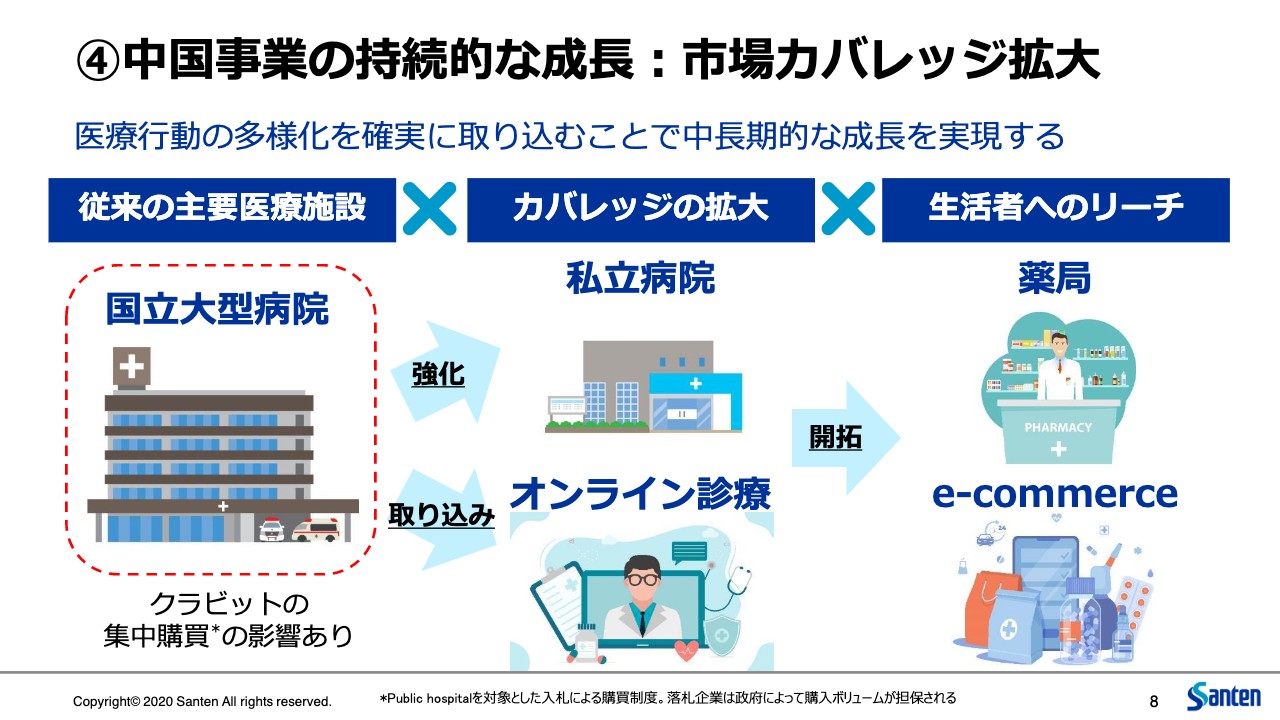
次に4つ目ですが、中国事業について少しお話しします。すでに当局からアナウンスされたとおり、中国政府が国立大型病院で進めている集中購買の対象品に、クラビットの主成分であるレボフロキサシン点眼薬が登録されることが発表されました。
これにより入札が行われた結果、最終的には非常に価格の安い国産品のレボフロキサシンが落札したということになり、この制度の運用上、参天のクラビットはこのような販路では今後購入されなくなるということで、短期的に大きな影響が出ることになります。
影響範囲については、クラビットは大変大きな数量を占める製品ですので、供給がどこまでできるのかなどのいろいろな不確定要素があり、実際にどの程度業績に影響を与えるのかは精査中です。
一方で、中国市場における医療行動の多様化に着目して、すでにさまざまな手を打っています。もともと中国市場は、この国立大型病院の一極集中というかたちであったわけですが、特にこのCOVID-19が広がって以降、市場の多様化、患者の行動の多様化が大きく進んでいると認識しています。
いわゆる3級病院と言われている大病院から、2級病院、1級病院という中小規模の病院へのシフト、私立病院や眼科のクリニックへの患者の移動と分散ということが、顕著に起きています。また、オンライン診療やオンライン薬局という違うチャネルが生まれるということも起きて、大きく変化している状況です。
したがって、当然この国立大型病院でのマイナスの影響というものはありますが、この市場の多様化をむしろ機会として、残りの販路でしっかりと私どもの製品が使われるように、普及促進活動、販売活動を行っています。
④中国事業の持続的な成長:緑内障市場の事例
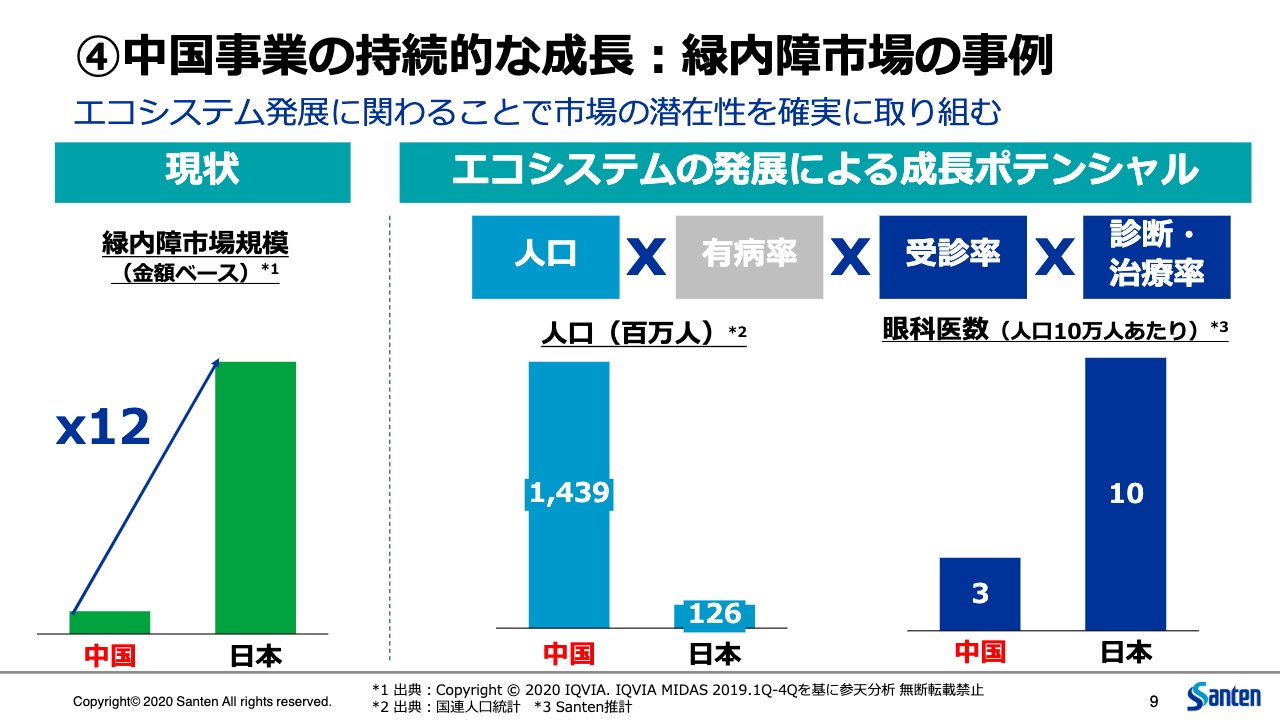
私どもは中国市場について、短期的に影響があるとは言え、中長期的な成長のポテンシャルを非常に評価しています。こちらは緑内障市場を例に取ったものですが、中国の緑内障市場は日本の12分の1しかないという規模です。一方で、中国の人口は日本の約12倍ですので、単純に言うと、人口あたり144分の1しか市場規模がないということになります。
どうしてそのようなことが起こるのかと言うと、これは緑内障の患者がいないわけではなく、ひとえに市場が顕在化していないということです。例えば、眼科医の数は人口あたりで言うと日本の3割しかいませんし、緑内障という高い専門性を必要とする疾患を治療できる専門医となるとさらに限られます。緑内障という疾患の認知度や早期診断、早期治療に関するアクセスの問題もあります。このような課題があるがために、現状の市場は氷山の一角であると考えています。
これは緑内障の例ですが、それ以外の疾患も含め、まだまだ今の市場規模は全体的に言うとまだ一部でしかなく、今後もっともっと大きな市場が顕在化してくると思っています。この高い潜在性をしっかりと認識して、ソーシャルイノベーターとしてさまざまな社会課題を解決するために取り組んでおり、今後さらに力を入れて取り組みたいと考えています。
眼科学会や政府、NGOとの取り組み等を今後も推進することで、よりこの眼科の治療環境がさらに充実し、より多くの患者さまが治療にアクセスができるような状況を実現していきたいと考えています。このような短期的な影響はありつつも、中長期的にはぶれずに市場の成長を追求していきたいと考えています。私からの説明は以上となります。ありがとうございました。
2020年度第2四半期業績
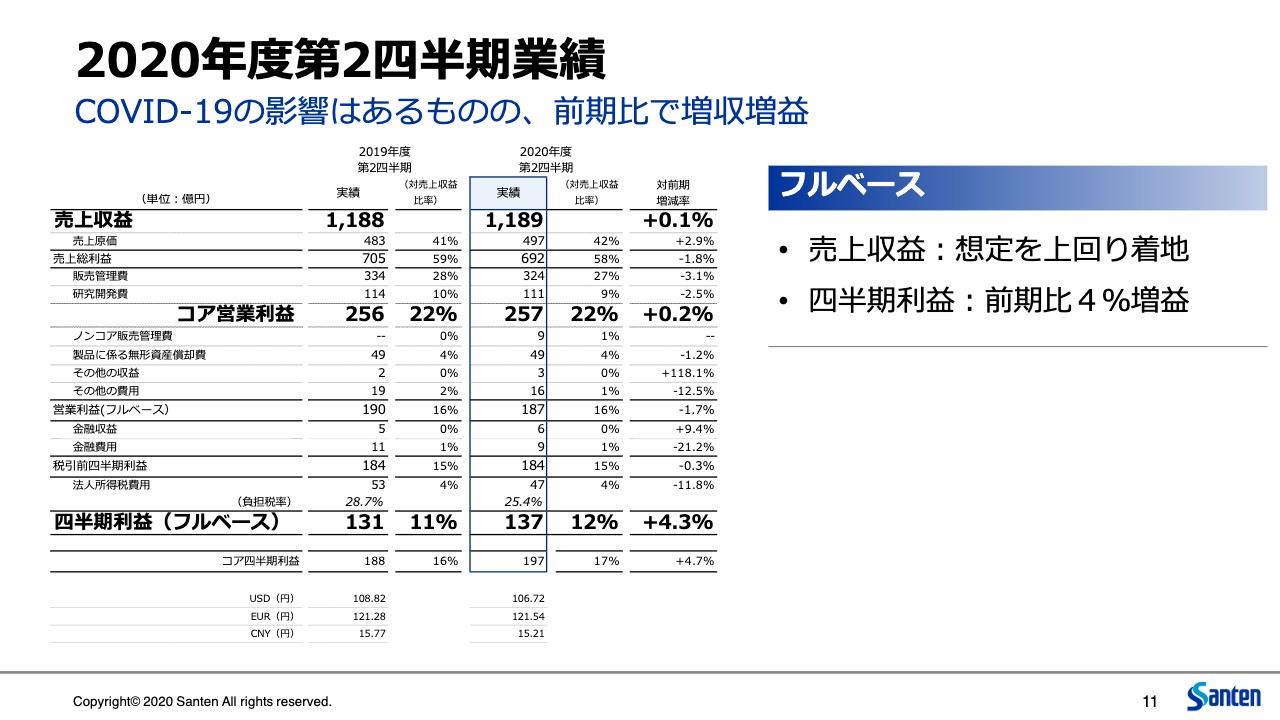
越路和朗氏:では、2020年度第2四半期の業績です。COVID-19の影響はありましたが、前期比で増収増益です。損益計算書の一番右側の列に記載のとおり、売上がプラス0.1パーセント、コア営業利益がプラス0.2パーセント、その他収益・費用、金融収益・費用はほぼ前年と同じような水準で、税金は前年よりも若干減少しましたので、四半期利益ベースでは前年比でプラス4.3パーセントという着地になりました。
2020年度第2四半期 売上収益(前年同期比)
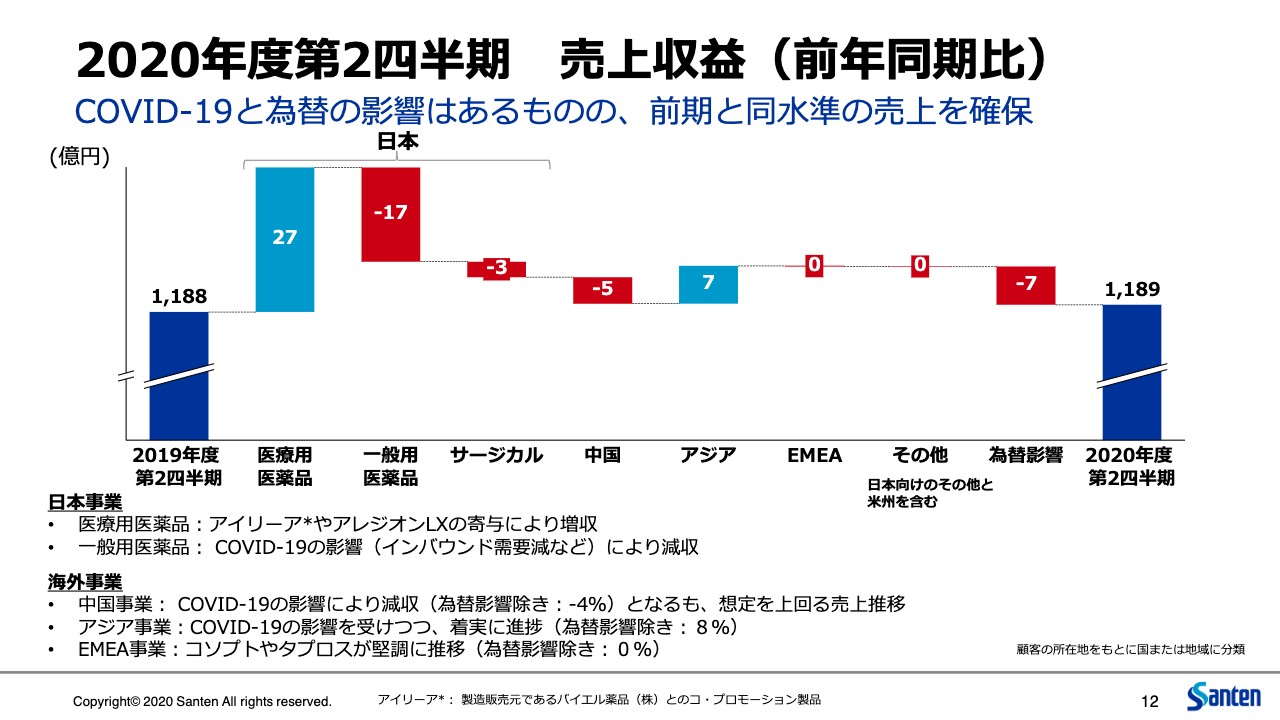
こちらは売上について、前年1,188億円からの推移を記載しています。おのおののポイントはスライド一番下に記載のとおりです。
2020年度通期業績予想:5月8日開示から変更なし
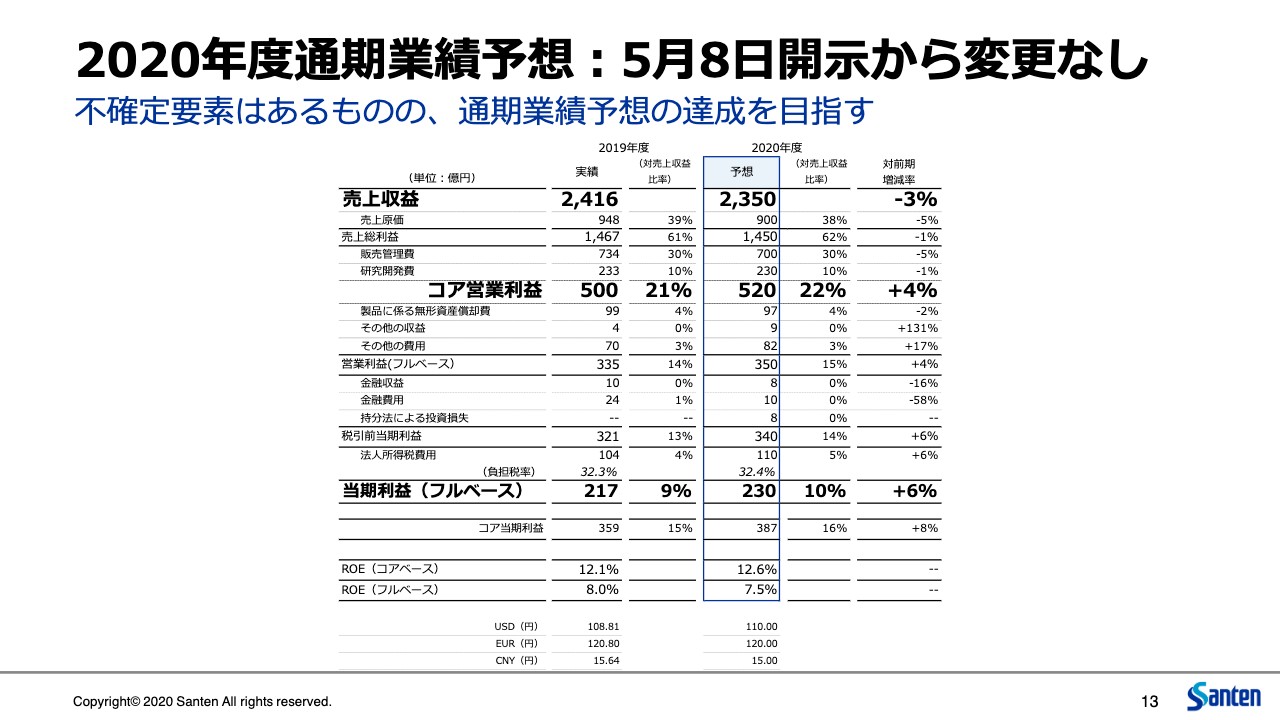
今年度の通期での業績予想ですが、5月8日の開示からの変更は今のところ考えていません。不確定要素はありますが、上期第2四半期の状況を踏まえると予定どおりの進捗と考えており、当初の業績予想どおりとしています。
配当
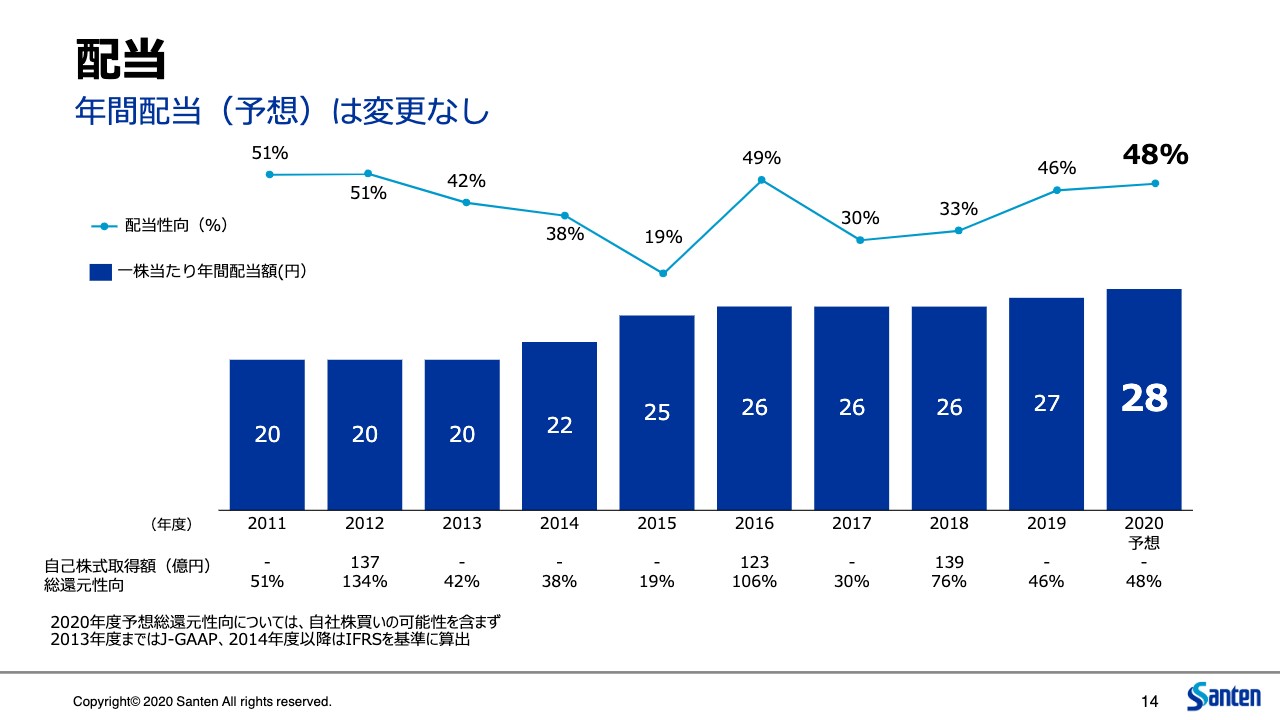
株主還元、配当ですが、こちらも収益の状況が当初の想定どおりの展開ということで、利益還元についても同様のスタンスとしています。以上、説明申し上げました。
DE-127: APPLE study/P2 (NCT03329638)
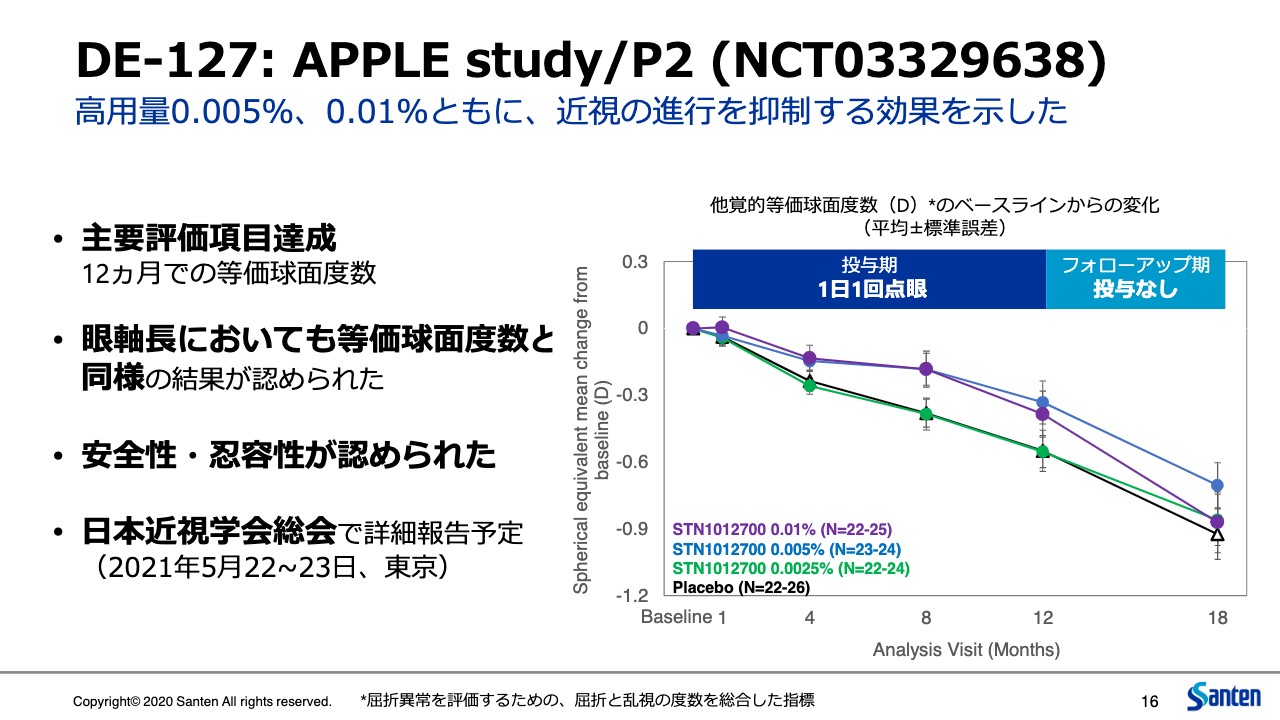
森島健司氏:製品開発本部から説明させていただきます。まず、今回、アジアで実施した「DE-127」のP2試験のAPPLE studyの結果について簡単にご報告します。これは5月に日本の近視学会で発表予定ですが、若干時間もあるということで、今回公表することにしました。
小児の近視患者に0.005パーセント、0.01パーセント、1日1回点眼することで、主要評価項目である他覚的な等価球面度数、屈折度数の変化が、投与12ヵ月目においてプラセボに比べ統計的に有意に抑えられることを確認しました。
副次項目である眼軸長の変化についても、この等価球面度数と同じような傾向を示しています。用量依存的に効果が認められたことは、これまでLAMP studyの海外で実施された近視の試験と一致しています。また、安全性、忍容性についても、重篤な現象を確認していません。
本試験については、先ほどお伝えしたように、2021年5月に東京で開催される日本近視学会の総会で報告する予定です。また後ほどご説明しますが、現在この「DE-127」については、日本でP2/3試験を実施しています。患者の組み入れがまさに完了したところです。
研究開発の現状①

進捗のあったものを中心にご紹介します。「DE-117」については、米国での申請準備を順調に進めています。アジア各国での申請も進めており、韓国に続きタイ、台湾での承認を得ています。韓国では今年度中の上市を予定しています。
「DE-128」については、ピボタル試験の2年間のデータについても入手できており、すでに開示している1年間のデータと同じ傾向を確認しています。来年3月の米国緑内障学会で詳細データを発表したいと考えています。また、承認を目指してFDAとのコミュニケーションを進めているところです。
この「DE-128」については10月にカナダで申請しました。現在、当局からの受領の連絡を待っている状況です。日本、中国での開発も計画しており、臨床試験の詳細が決まりましたら、こちらのリストに掲載する予定です。
研究開発の現状②

「DE-127」については、先ほどお話ししたように日本でP2/3を実施しており、予定どおり患者の組み入れが完了したところです。また、このリストには掲載していませんが、欧州、アジア、カナダなどで販売している、希少疾患の春季カタル治療薬の「Verkazia」についても、米国で承認の申請をして受理されたところです。
jCyteから導入した細胞治療や、Osmoticaから導入した眼瞼下垂薬についても、現在、各地域で必要な承認要件などを確認しており、こちらも臨床試験計画の詳細が決まりましたら、このリストで開示したいと思っています。
11月にオンラインで開催されます米国の眼科学会でも「DE-117」や「DE-128」の発表を予定しています。発表後にはみなさまにもアブストラクトをお知らせする予定です。以上となります。ご報告申し上げました。
新着ログ
「医薬品」のログ