3DM、上期製品売上は対前年14%増 米国癒着防止剤は来期の売上貢献を目指す
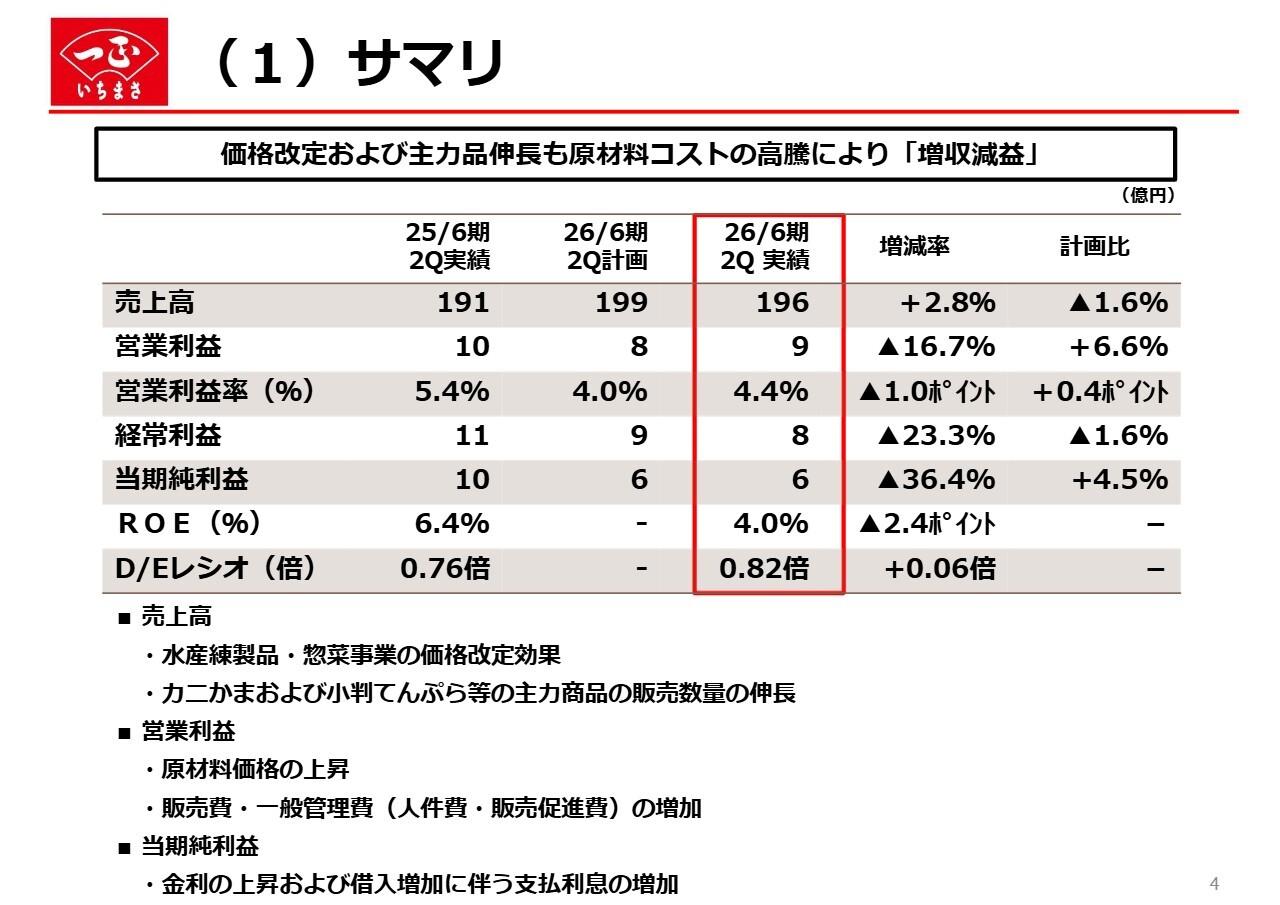
損益計算書の概要
岡田淳氏:スリー・ディー・マトリックス代表取締役社長、岡田でございます。本日は、12月のお忙しい中にも関わらずご足労いただきまして、誠にありがとうございます。私からは、簡単にではありますが、今期の上半期の業績につきましてご説明を申し上げます。よろしくお願いいたします。
今日ですが、3つお話しいたします。1つは数字です。業績の内容がどうだったのかという内容と、それから開示されたものも含めて、上半期でどのようなイベントがあったのかをもう一度おさらいさせていただくとともに、ちょっと補足させていただく。それから最後に、開発パイプライン。今動いているものと動いていないものがありますが、まとめてアップデートさせていただきたいと思っています。
まず損益計算書ですが、左側が今期、右側が前期でございまして、半期ごとに比較をしています。売上は14パーセント増となりました。これは、内訳を見るとポジティブなニュースも入っていますので、この後説明申し上げます。
コストは2億5,000万円ほど増えています。これは主に研究開発費でありまして、日本で今推進中の治験費用がかかっているところでございます。
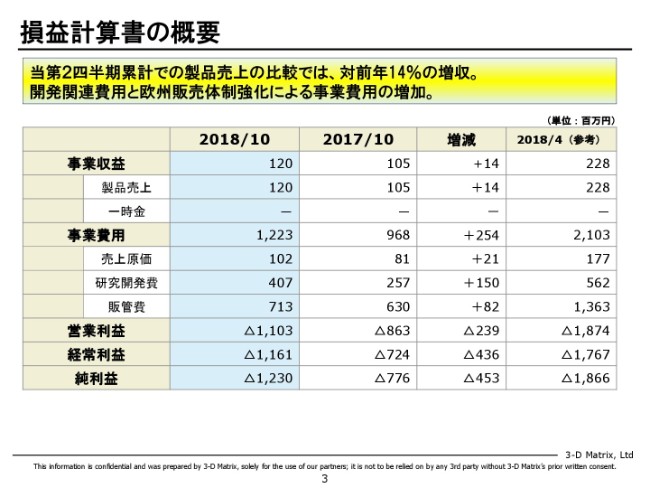
貸借対照表の概要
貸借対照表ですが、(2018年)7月から開始した新株予約権によるファイナンスです。SMBC日興証券さんに引き受けていただいてやっていますが、12月の時点で、当初予定のものは4万個、400万株分終了しています。これに伴いまして、17億円を調達済みでございます。
ここの数字は10月末のものでございますので、10月末時点で現金(及び預金が)13億円になっていますが、12月末時点でもうちょっと増えているということでございます。
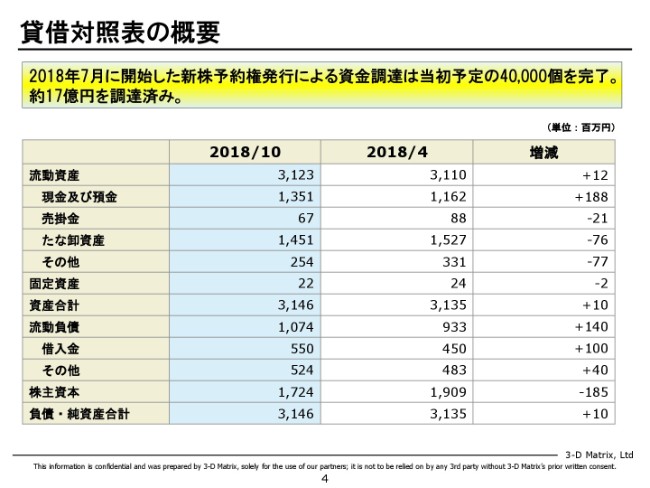
製品売上:前年同期比
売上の中身について、ちょっと補足の説明をさせていただきます。
これは、地域ごとに売上を比較しています。青いバーが前期の上半期、赤いバーが今期の上半期となっていまして、ヨーロッパ、アジア(を示しています)。アジアはオーストラリアです。そしてその他となっています。ヨーロッパは前期比で32パーセント増になりました。
それに対して、アジアは前期と比べてほぼ横ばいなのですが、これはちょっと事情があります。注(※)にも書かせていただいているのですが、オーストラリアで現地で代理店をやっていただいているゲティンゲグループさんが10月に……つい2ヶ月前ですが、中国の企業に(バイオサージェリー)部門を部門ごと渡してしまうという発表をなされました。
それに先立って、ゲティンゲグループさんは、うちの製品も含めた全部の製品について、在庫をどんどん圧縮して新たな仕入れをどんどん送らせて、キャッシュを貯めるという戦略に走られました。なので、ここ半年分ぐらいは残念ながら、ゲティンゲグループさんからのオーダーが遅れに遅れて、それで弊社の売上としては伸びていない。ただ、末端の売上では非常に順調にいっていますので、それはまた別途説明いたします。
まずヨーロッパなのですが、全体で32パーセントの伸びに留まっているのですが、実は内訳を見ると成功事例が出てきていまして、やっと伸びてきたかという手応えを感じ始めているところです。
製品売上:欧州における代理店成功事例
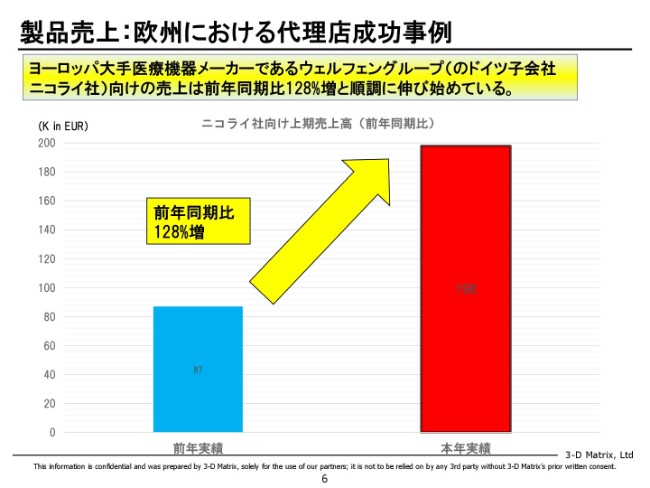
これはドイツの事例です。
ヨーロッパで一番重要なマーケットなのですが、ドイツのマーケットはヨーロッパの大手医療機器会社のウェルフェングループさんに手がけていただいて売っています。前期の上半期と比べて130パーセントぐらい伸びているということで、やっと我々が満足できるぐらいの伸びが出てきたということで、期待をしています。
私は何回もここで言い訳させていただいているのですが、ヨーロッパは、ドクターに製品の評価をしていただいて、「いいね」と言っていただいてから、実際に病院に買っていただくまでがものすごく長いんです。
我々がターゲットにしている病院は、すべて国立の大学病院です。そのようなところが新しい製品を1つ追加で購買リストに入れること自体が、ものすごく手続きに時間がかかっています。それに半年とか、下手したら1年とかかかってしまっているのですが。そのようなところを1回通り越えて、「壁を乗り越えると、こうなる」というのを、やっと実感できるところまできた。
これがドイツでできましたので、この同じような動きが主要各国でも起こってくると、我々の売上はグッと伸びていくという手応えを、今感じています。
製品売上:オーストラリアのEnd-User Sales
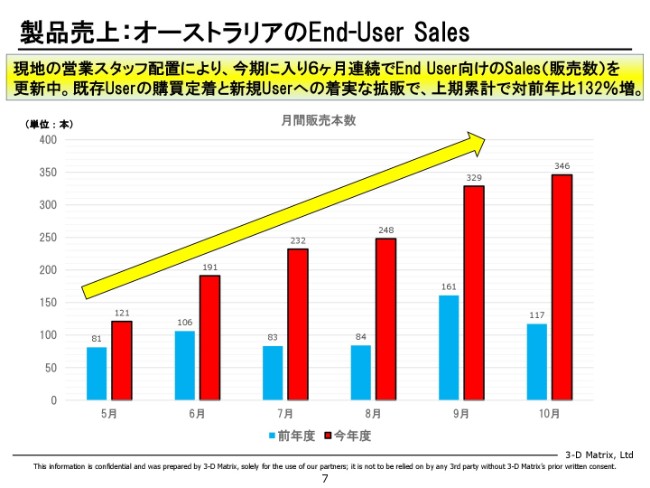
次は、先ほど申し上げましたオーストラリアです。
これは我々(単独)の売上ではなくて、我々の代理店さんから先に病院に……末端にどれだけ売ったかという数字を、ここに出しています。月ごとに出していまして、青いバーが去年、赤いバーが今年です。これを見ていただくと、明らかに去年はあまり伸びていないのですが、今年は非常に美しいカーブを描いていまして、毎月売上を更新していっている状況です。
11月もさらに伸びました。数字で言うと400本ぐらい売ったのでさらに伸びたのですが、毎年連続で伸びていまして、全体として132パーセントです。ここも、もう2倍以上伸びている。なので、オーストラリア・ドイツは非常に、実は末端ではうまくいっているというところです。
「なぜこうなったか?」ということなのですが、実は、去年からゲティンゲさんの動きがちょっとおかしかったので、我々としても販売力強化のために現地に1人採用して、フルタイムの営業スタッフを置いたんです。置いた途端に、この伸びになったんです。非常に即効性があって、労力をかけると売上に返ってくるということが非常に顕著に、しかもクイックに出てきたので、これも心強い成功例だと思っています。
それで、ゲティンゲさんはそのように部門を売却されたのですが、我々としてもちょっと前から動きがおかしかったので、実は手を打っていました。今期に入ってから、ロジスティクスも……ゲティンゲさんがあまりにも在庫を減らし始めたので危ないと思って、我々自身でロジスティクスも、実は裏で準備していました。今後は代理店契約を解消して、直販に切り替えようかなと思っています。
営業員を1人雇っただけでこれですから、これを2人、3人と増やしていけば……4人ぐらいいれば、オーストラリア全体をなんとかぎりぎりカバーできるので、そこぐらいまで増やして、逆に直販によってこのカーブをさらにずっと伸ばしていきたいと考えています。
以上、主に売上面ですが、業績の説明をさせていただきました。
英国における大規模臨床研究

続きまして、ハイライトです。発表されたものもありますが、今期になにがあったのかを、改めてざっとご説明申し上げます。
まず1つ目に、ヨーロッパでのセールスマーケティング活動内容の1つのご報告ですが、英国において大規模な臨床研究を企画しています。これは、携わっている先生方に「POPS」(Prospective Observational PuraStat Study)と呼んでいただいているスタディです。「PuraStat」のオブザベーション・スタディをやります。
このプロジェクトの目的は、UKのトップの先生方・病院に入っていただき、かつUKの政府の補助金も得て、それでデータを取ります。これにより「PuraStat」を、英国において……これは内視鏡の分野ですが、内視鏡の分野のスタンダードにしてしまおうというプロジェクトです。
さらに付加的な目的としては、これは我々が病院に物をタダであげるスタディではなくて、政府の予算をもらって製品を買っていただくプロジェクトですので、参加していただいている病院に製品を買っていただく。そうすると、今までは買うまでにものすごく時間がかかっていたものが、このスタディに参加した瞬間に製品が買えるようになります。そのため、主要な病院さんでこのスタディが始まった瞬間に、もう製品を買えるお客さんに変わってもらうことも目的にしています。
ポーツマス病院のバンダリ先生に主任研究員をやっていただいています。今参加を表明しているのは30病院ぐらいあったのですが、まず20病院から始めさせていただいて、200症例をターゲットとしてやっています。
政府の倫理委員会があるのですが、これも夏に通りまして、(2018年)11月に最初のリクルートメント……患者の組み入れが開始しました。引き続いて、毎月4病院か5病院ぐらいのペースで患者組み入れを開始していただいて、今期中には20病院のすべてで組み入れが開始をし、かつ「PuraStat」を買っていただいている状況を作るという目標で進んでいきます。
国際学会における発表事例:UEGW2018 Clinical Session
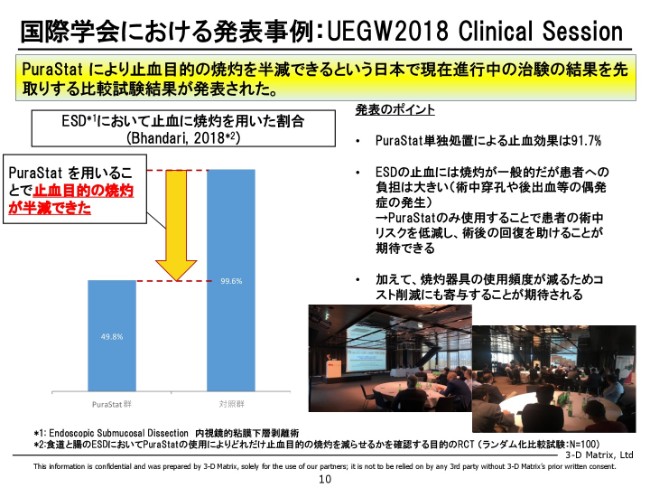
次は、またヨーロッパのセールスマーケティング関係の話ですが、学会で1つおもしろいものが発表されましたので、ご紹介させていただきます。
学会は「UEGW」という、世界の2大内視鏡学会の1つなのですが、そこにおける発表です。発表者は、ポーツマス(病院)のバンダリ先生。このスタディは、かなり厳密なスタディをやっていただいていまして、注(※2)にも書いていますが、ランダム化の比較試験です。
症例数は少なめで、50例・50例。「PuraStat」群が50例、対照例が50例、合計100例のスタディです。ランダムに患者さんを振り分けて、「『PuraStat』を使う群と使わない群で、どう違うんですか」というのを統計的に出していただくというスタディを、先生にやっていただいています。
その結果をグラフにしていますが、「PuraStat」を使った群においては、使わなかった群に対して、焼灼によって止血する率が半分になりました、ということを示しています。さらに、ここにも書きましたが、「PuraStat」を使った場合の止血率は9割を超えています。なので、「PuraStat」を使えばだいたい……若干止まらないものはあったが、ほぼ9割がた血が止まっている。
これは何を意味しているかというと、ESD(内視鏡的粘膜下層剥離術)・EMR(内視鏡的粘膜切除術)もそうですが、止血材が使えない内視鏡の領域ですから、今の基本的な止血方法は焼灼です。組織を焼いて(血を)止めることをしているのですが、焼灼すると傷を増やすことになるので、やはり患者さんの負担が大きい。あと、やはりジュージュー焼いていく中で、組織の穴を開けてしまうですとか、そのような臨床上のリスクもある。
なので、「できるだけ焼灼しないほうがいいよね」というのは、多くの内視鏡医が賛同するところなのですが、今のところ代替手段がないのでできません。それを、「PuraStat」を使用することによって、半分に減らすことができました。さらに、焼灼もタダじゃありませんから、ディスポーザブルを使わないといけないので、そのぶんのコストも浮きますという話をバンダリ先生にしていただいています。
これは(申し上げたいことが)2つあって、1つは(右下の)写真は、我々がやったランチョンセミナーで、先生に発表していただいている内容です。これは実は、我々がやったランチョンセミナーだけじゃなくて、この学会の本会場でも学会主催のプレゼンテーションとしてやられています。
その中で今年のキースピーチの1つに選ばれているので、学会としても「この結果はおもしろい、意義がある」と判断いただいているということが、1つ。会社がお金を出して、無理やり発表してもらっただけではないということです。
それからもう1つは、この試験は、まさに我々が今、日本で厚労省の承認を取るためにやっている臨床試験と同じ試験なんです。我々はこれを示したいから、日本で試験をやっているのですが。その結果が、1施設で100例という数字ではありますが、ここで先取りしてもう統計的有意を示されているのは、非常に心強い結果であると言えるかなと思います。
後出血予防材:承認取得

次のトピックに移りますが、新しい商品が1つ出ています。
こちらはヨーロッパの内視鏡領域ですが、予防です。内視鏡手術の後の出血を予防する用途で、やっと承認が取れました。かなり長く待たされまして、ジリジリしていたのですが、やっと(2018年)12月に承認が降り、「予防」という名目でこの止血材を使っていただけるようになりました。
それから、先に触れたプレゼンテーションでもこの予防の点は示されてコメントされていまして、50例・50例という数字が少なかったので統計的に有意とは言えなかったのですが、発表者のコメントによると、「『PuraStat』を塗布している部分からの後出血は、1例も確認されなかった」と言っていました。「もっと数を増やして、統計的に有意のデータを取っていくべきだ」と締めくくられていました。
後出血予防材:EU市場規模
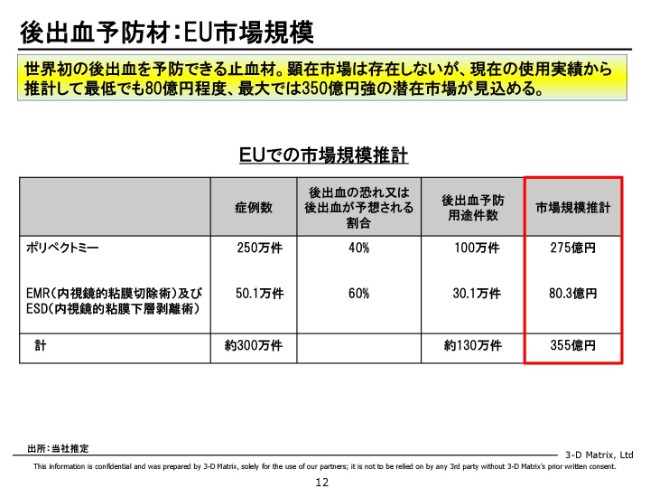
このインパクトですが、我々としては、予防によって我々にとっての内視鏡の市場が大きく広がる可能性を秘めていると思っています。
我々が狙っている部分に対して予防が適用された場合に、最低でも80億円ぐらいの潜在市場が生まれてくるんじゃないかと考えています。
これは潜在市場ですので、今あるものを置き換えていくよりは、もちろん時間がかかるのですが、他に競合がいない市場でもありますし、我々としてはできるだけ早くこの市場を作って、この80億円を刈り取っていきたいと思っています。
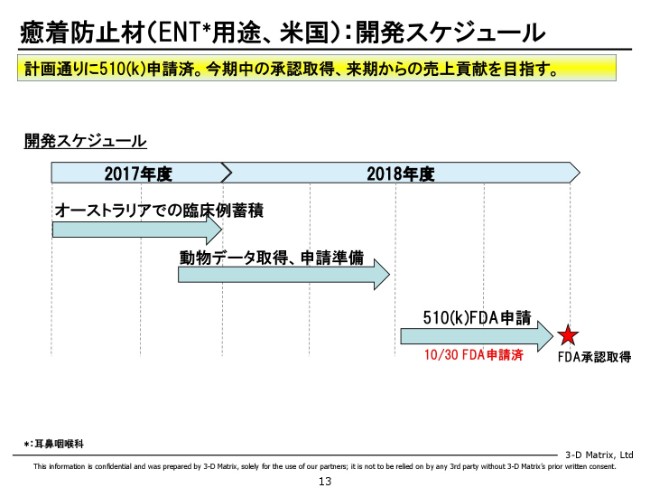
癒着防止材(ENT用途、米国):開発スケジュール
次のプロジェクトに移ります。癒着防止材です。
これはアメリカで開発している癒着防止材なのですが、「鼻の手術に対して、癒着を大幅に減らします」という製品でございます。こちらは予定どおり、ちょうど(2018年)10月末ですので、上期の終わりにFDAに申請を終了いたしました。
これは、幸いなことに「510(k)」というカテゴリーで申請できています。FDAは90日で審査するルールになっていますので、我々としては半年間、今期中になんとか承認ができることを目指して、ベストの努力をしていきたいと思っています。
癒着防止材(ENT用途、米国):市場規模
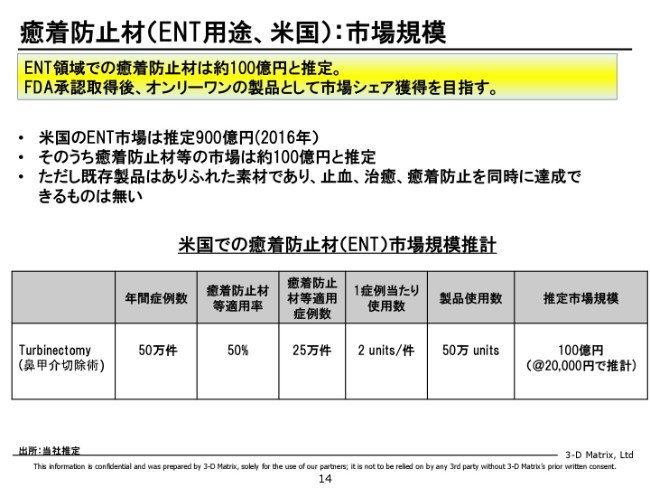
鼻の癒着の市場は、実はもうすでにアメリカにありまして、我々の推計だとだいたい100億円ぐらいあるんじゃないかと思っています。
ただ、既存製品は止血ができて、治癒もよくて、かつ癒着もできるという総合力がないんです。「癒着だけは妨げるかもしれないが、血を止められない」とか、いい製品がないので。そこに、オンリーワンのポジショニングとしてこの製品をぶつけていって、この100億円をどんどんスイッチさせていきたいと思っています。
癒着防止材市場
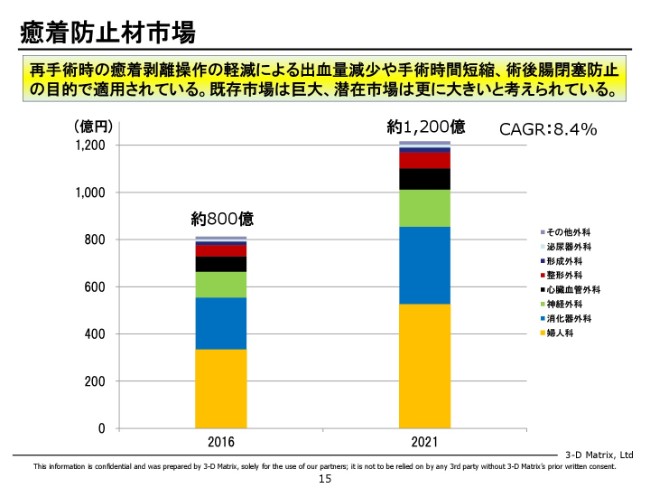
参考になりますが、まず鼻の癒着を始めようと思っています。
「癒着」という意味では、市場はすごく大きくて、潜在的には1,000億円を超える市場があると言われています。今ここに投入されている既存製品は1材か2材ぐらいしかありませんので、うちの技術で差別化する余地は十分あるので、鼻でうまくいった後、この中から我々がバリューを大きく出せるところを選んで、次々と攻めていきたいと思っています。
最先端がん治療に対する革新的薬剤の開発

次はまったく違う領域でして、ドラッグ・デリバリーです。しかも、がんをターゲットとしたドラッグ・デリバリーです。
これは、先日岡山大学さんと一緒に記者会見をさせていただいた案件でもあるのですが、「BNCT」と言われている療法に対して、我々のペプチド技術を供与しています。BNCTというのは、ホウ素を使って中性子を使う中性子捕捉療法なのですが、次世代のがん治療として政府も後押ししている治療法の1つです。
いろいろなメリットがあって、将来的には中性子によるがん治療が広がっていくだろうと考えられているのですが、1つ問題があります。がん細胞のみに集中的に届く、このホウ素を届けないと中性子を当てても意味がないのですが、このホウ素をうまくデリバリーできないという問題点がずっとありまして、それを我々のペプチド技術で改善したいということでございます。
がん治療(BNCT)の革新的ホウ素薬剤
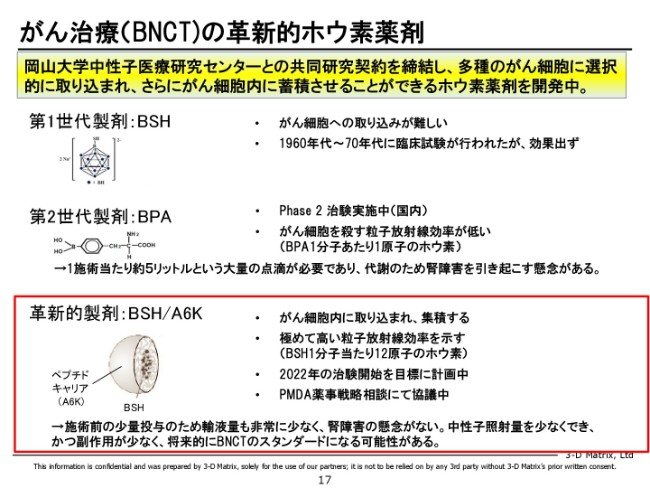
この技術は昔から注目されていまして、第1世代・第2世代はかなり実用に近いところまでいっていまして、第2世代は今フェーズ2で治験実施中です。
これは、国内のベンチャーさんと大手企業さんと、あと国の支援を受けて臨床試験をやられています。これが進んでいくと、この療法も広がってくるかなと思うのですが、我々はその次の世代のものになり得るんじゃないかという開発を、岡山大学さんと共同でやらせていただいています。
まず、投与量をすごく少なくできる。だから、輸液量が少なくて腎障害のリスクが低いということと、あとがん細胞にピンポイントに入るので、中性子の照射量を少なくできて副作用が少ない。なので、今の第2世代に比べて効率が格段に上がるのではないかと期待されていまして、我々としては早期に臨床研究にもっていきたいと思っています。
ハイライトだけ、駆け足で説明させていただきました。引き続いて、「では、開発パイプラインの全体はどうなっているのか?」ということを、最後のまとめとしてご説明させていただきます。
当社が開発する3つの領域
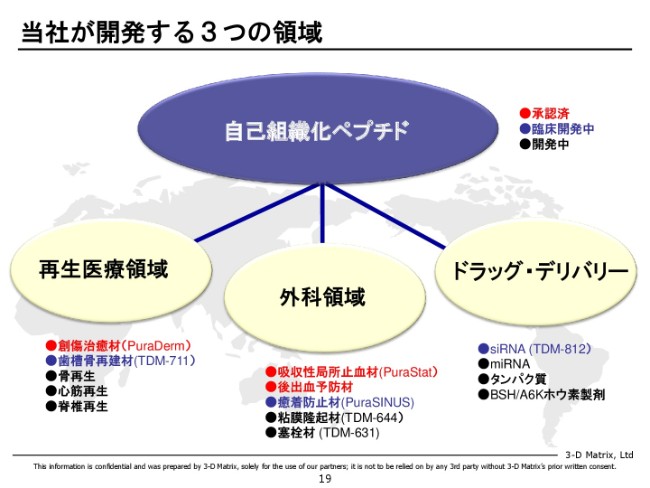
我々の「自己組織化ペプチド」は、生分解性が高くて安全性も高く、体のいろいろなところに使えるペプチドということで、いろんなアプリケーションを探索していますが、中期的にはこの3つ(再生医療領域、外科領域、ドラッグ・デリバリー)に絞っています。
主要パイプラインの開発状況(2018年12月現在)①
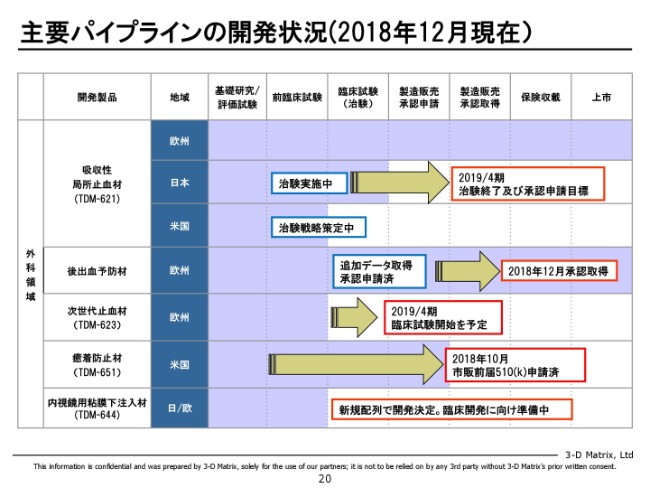
外科の領域ではもう止血材が承認されており、日本では今治験中。予防という意味では、ヨーロッパでちょうど適応拡大ができました。癒着防止材は、先ほど申し上げましたとおり、今申請中でございます。
主要パイプラインの開発状況(2018年12月現在)②
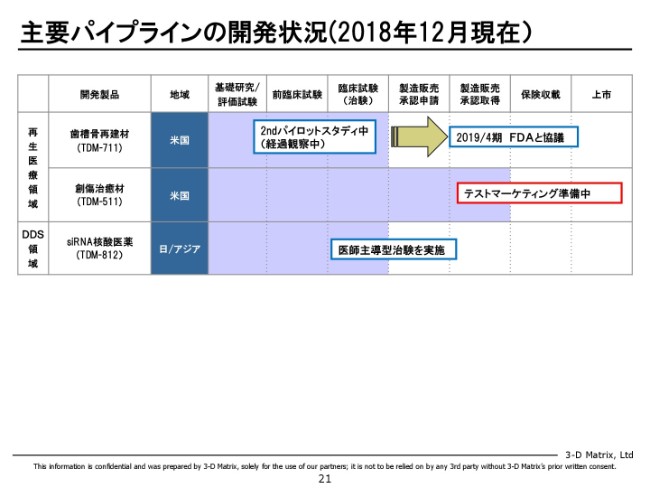
あと再生医療領域では、創傷治癒の用途ではもうすでにアメリカで承認が取れています。それから骨の再建材として、今治験が進行中でございます。
あと、ドラッグ・デリバリーの分野では、siRNAで乳がんを治そうというプロジェクトが臨床研究に入っています。その他にもメニューが控えていまして、miRNAで中皮腫を治療するですとか、先ほど(ご説明した)ホウ素をデリバリーして中性子でがんを殺すとか、そのようなプロジェクトが引き続いてあるという状況でございます。
止血材(TDM-621)日本の進捗

お手元のプリントにまとめて書いていますが、個別にコメントをしていきたいと思います。
まず、日本の治験です。内視鏡の治験は1年以上前に最初の1例が組み入れられて、その後非常に慎重に進めてきたのですが、今期に入って徐々にスピードアップしてきています。今のスピードアップされてきた状況から考えて、我々としての今のターゲットは、この春に試験の組み入れを終わること。今期中に試験を完了させるのが、今の目標でございます。
それと並行し、内視鏡の分野での治験の組み入れが進んでいますので、次の分野での治験の開始を見据えて、PMDAとの対面助言の打ち合わせを実施予定でございます。内視鏡の進捗がもうかなり進みましたので、そろそろ次のメニューにも取りかかろうと動き始めようとしているところでございまして、まずは心臓血管外科で進めていきたいと思っています。
心臓血管外科は、日本ではフィブリン糊がどんどん使いにくくなっています。うちのような安全性の高い止血材のニーズは、とくにヨーロッパなんかと比べてはるかに強いものもありますから、心臓血管外科がまず最初のターゲットかなと、今のところは考えています。
すべては、我々として勝てるプロトコルを当局とすり合わせができるかというところにかかっていますので、心臓血管外科だけではなく他のメニューも併せて考えながら、次はどこで承認が取りやすいのかを見極めていきたいと思っています。
内視鏡用粘膜下注入材(TDM-644)

続きまして、外科領域で、日本で次にやるメニューですが、粘膜下注入材です。前は「粘膜隆起材」と呼んでいましたが、正式には粘膜下注入材というカテゴリに入るということで、名称を変えさせていただきました。
こちらはもともと止血材と同じ配列で治験に入ったのですが、明確な競合優位性を示すことができなそうだということがわかりまして、「一時治験を中断して、もっといいペプチド配列を使おう」ということでやっていました。
(2018年)10月にペプチド配列を決定しまして、いくつか候補はあったのですが、いろんな比較試験をしてその1個に絞り込みまして、「この1個でやろう」と10月に決めました。それを、さっそく11月からPMDAと協議を開始して、この薬材で治験を開始することに向けて動き始めました。並行して、安全性試験もやっています。
消化器内視鏡領域での製品ラインナップ
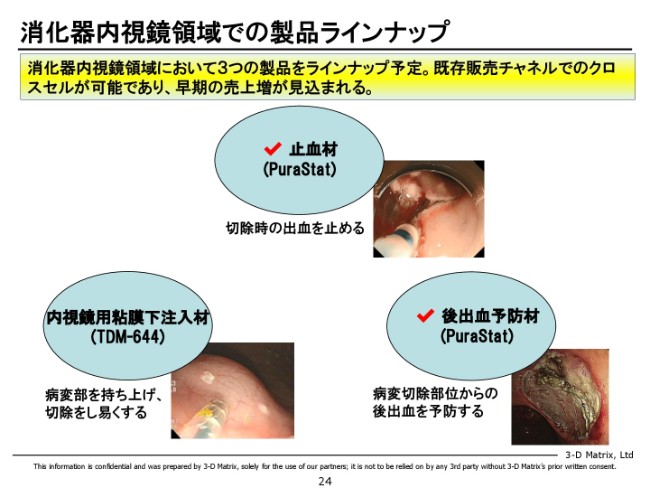
今まで申し上げたことをまとめると、とくに内視鏡領域においては、メニューとして3つが揃って、かなりいいコンビネーションになるんじゃないかと我々は思っています。
粘膜下注入材ができれば、手術がしやすくなり、切除がしやすくなる。切除して血が出たら、「PuraStat」で止めればいい。止めた後でもまだ後出血が心配であれば、また「PuraStat」を塗って予防していただければいい。
ということで、このような素材が内視鏡の分野で広がってくると、とくにまだ手技のレベルがあまり高くない……例えばヨーロッパですとか北米みたいなところに広がっていくと、このようなものをレバレッジして、内視鏡の症例数・治療そのものが広がっていくんじゃないか。そのような意味で、医療に貢献できるんじゃないかと思っています。
次世代止血材(TDM-623)
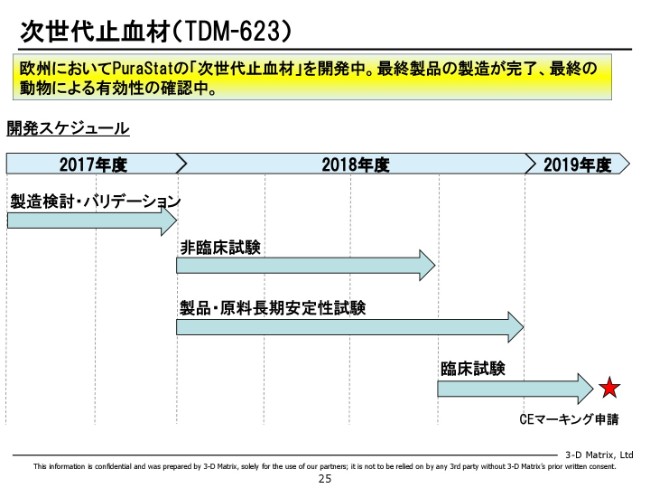
引き続きまして、外科領域の次世代止血材です。こちらは、ヨーロッパで開発をしています。
こちらは、開発戦略に関して考えているところがあります。すでに「PuraStat」という製品が市場にあります。この製品は、先ほど示したとおりデータがどんどん蓄積されてきて、知名度もどんどん上がってきています。なので、もしこの新しい止血材を次に出すんだったら、今の「PuraStat」と被らない領域でありたいと思っています。
そこの最大の今のターゲットが、中枢神経分野です。これは脳と脊椎なのですが、できればここの分野で使いたい。今「PuraStat」はそこへ適応がないので、新しい分野で適応を取りたいと思っています。
ただ、中枢神経分野は心臓外科と同じぐらい大きなマーケットで、非常に魅力的なマーケットであるのですが、我々として臨床の経験がほとんどありませんので、今は動物実験をかなりしっかりやっています。
動物での有効性を確認して、その上で臨床試験に入りたいと思っているのですが、残念ながら動物実験が若干ずれ込んでいます。もともと上半期ぐらいで動物実験を含めた非臨床試験を終わろうと思っていたのですが、ちょっとずれ込んでいまして、それに伴って臨床試験の開始もちょっと遅らせている状況です。
ヨーロッパでは動物実験も簡単ではなく、大きな国立の大学で動物実験をやる場合には倫理委員会を通さないといけません。動物の命であっても倫理的に許されるのかを厳密に審査されるところですので、今はオランダの大きな大学さんとやらせていただいているのですが、倫理委員会を通すだけで半年ぐらいかかってしまうという事情がございます。
創傷治癒材(TDM-511)
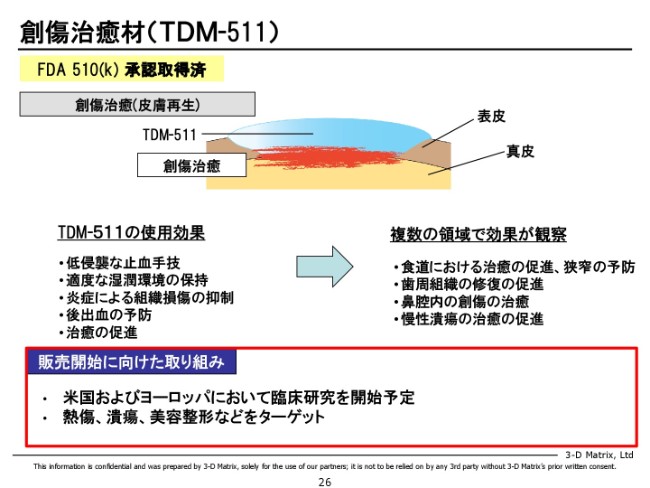
次です。これはもうすでに承認が取れている案件なので、「パイプライン」と言うには進んでいってしまっているのですが。
2年前に承認が取れていますが、熱傷・潰瘍・美容という、難易度が高いところにぶつかっていこうとしています。そのためには、ある程度臨床データがないとステルスマーケティングができませんので、今は最初の臨床データを取るべく、とくに美容分野でアメリカのトップドクターと連携をして、臨床研究を立ち上げようとしています。
今はそれに向けて、「PuraDerm」と呼んでいる製品を製造すべく、日本の提携先さんと製造準備を急いでいる状況でございます。今期中にはアメリカに製品を届けて、まずトップドクターに使っていただいて、本当に創傷治癒効果があるのかどうかという最初のオピニオンをいただきたいと考えています。
歯槽骨再建材(TDM-711)
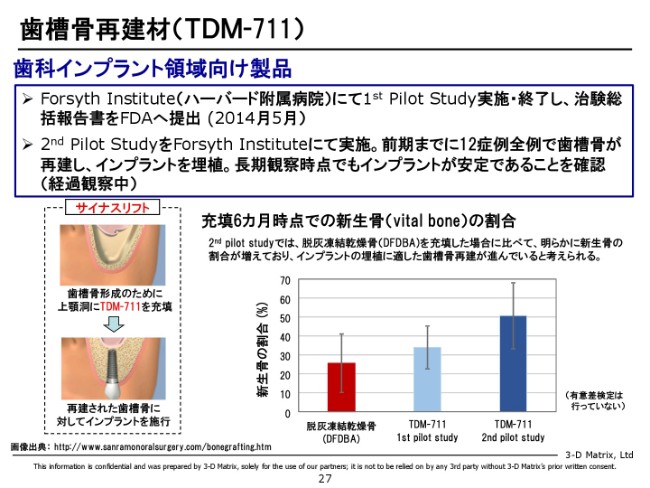
あとは、再生分野でもう1つ。骨の再生ですが、これは引き続き治験が継続中でございます。ハーバード大学の附属病院でやっていますが、2nd Pilot Studyまで移行しています。
骨は非常によくできているのですが、まだ経過観察中で観察待ちということでございまして、経過観察が終わり次第、FDAと次のステップについて協議をするという状況でございます。
siRNA核酸医薬(TDM-812)

siRNAのデリバリーです。
中皮腫を対象とした新規マイクロRNA核酸医薬

そのあとが、マイクロRNAのデリバリーです。スライドを入れさせていただいていますが、こちらは鋭意継続中ではございますが、ここで発表するトピックはありませんので、とくにアップデートはございません。
以上、パイプラインの概要を説明させていただきました。
2018年度下期の見通し

それで、下期に向けてなのですが、どのようなことが見込まれるかを最後のページに簡単に記載させていただいています。このような分野に我々は注力して、ここで計画される結果を出すべく、ベストを尽くしていくというところでございます。
まずヨーロッパですが、後出血予防(材)の適応が取れましたので、ここでプロモーションを開始していきます。今の潜在的な市場として大きいものがありますので、これをできるだけ早くカルティベートするように動き始めます。それから、提携面でも協議は進んでいまして、なんらかのかたちのパートナーシップを早い段階で結びたいということで、協議を進めています。
それから米国は、先ほど申し上げました鼻の癒着防止材の承認が今期中に得られるように、最善の努力をいたします。それから、創傷治癒材。これは承認が取れていますから、今期中に使っていただけるように、急いで製造するということになります。
日本はどちらも開発ですが、まず止血材の治験組入れを、今期中になんとしても完了させたい。それから、次のパイプラインです。(内視鏡用粘膜下注入材の)治験計画届を、上の治験終了とほぼ同時ぐらいのタイミングで出して、すぐ次に移りたいと思っています。
先ほど申し上げましたが、オーストラリアはゲティンゲグループが部門を売却しましたので、これを機に直販体制にしていきます。ちょっと人件費が増えますが、投資をして……先ほどお示ししたようなペースで売上が伸びていくと、すぐペイしますから。直販体制にして、まずENTの市場で十分な利益を確保したい。
さらに、代理店さんがなかなかやってくださらなかった内視鏡の分野にも、積極的に売っていきたいと思っています。内視鏡はヨーロッパで成功している領域ですから、ヨーロッパの成功事例をオーストラリアに早くもっていきたい。
鼻の領域はオーストラリアで成功しているので、これはアメリカにもっていきたいですし、ヨーロッパにもっていきたい。そのような成功事例をグローバルにいったりきたりさせながら、売上を作っていきたいと思っています。
あと、その他の地域では、カナダで承認がもうすぐ降りますので、これが今期中にくるんじゃないかと見込まれています。
以上、駆け足になりましたが、私からの説明はここで終わらせていただきます。ご清聴どうもありがとうございました。
新着ログ
「精密機器」のログ