リボミック、第2相臨床試験の結果良好 早期の収益化と第3相臨床試験の実施を目指す
本日の内容

中村義一氏:みなさま、こんにちは。リボミック社長の中村義一です。2026年3月期第2四半期決算説明にご参加いただき、誠にありがとうございます。本日のご説明は従来とは多少異なり、顕著な進捗が見られたプログラムにフォーカスしてお話しします。
スライドは本日のアジェンダです。まず、当社が進めている軟骨無形成症に関する第2相臨床試験について、目標を達成することができたことに重点を置きたいと思います。
トップラインデータを10月初めに発表しましたが、すぐに株価に反映されることはなく、即座に評価にはつながらないという少し意外な展開となりました。当社のご説明が十分でなかった点や、誤解を招いた可能性があると考えています。本日の説明会では、その点を十分にご説明したいと考えています。
アプタマー(Aptamer)とは?

まず、アプタマーについてです。こちらはいつも使用しているスライドで、アプタマーは非常にカラフルな模型で表されています。アプタマーは、阻害対象となるタンパクに密着し、そのタンパクの働きを止めることで治療効果を発揮するものです。抗体と比較してさまざまな特徴や優位性を備えています。
当社の重点領域

当社が重点を置いているのは、このアプタマーという新しい核酸医薬を用いて、これまでにない薬を開発することです。その1つが希少疾患向けの薬で、軟骨無形成症(ACH)という疾患に対する新薬の開発です。
次に、目に関する分野で、特に網膜疾患に対する薬の開発です。網膜や眼球は小さな組織であり閉鎖系器官であるため、加える薬の量を少なく抑えることが可能です。さらに、薬が体内に漏れ出さないという安全性も持っています。
これらのアンメットメディカルニーズが存在する病気に対し新薬を開発するという基本的な方針で進めています。
主要なパイプライン
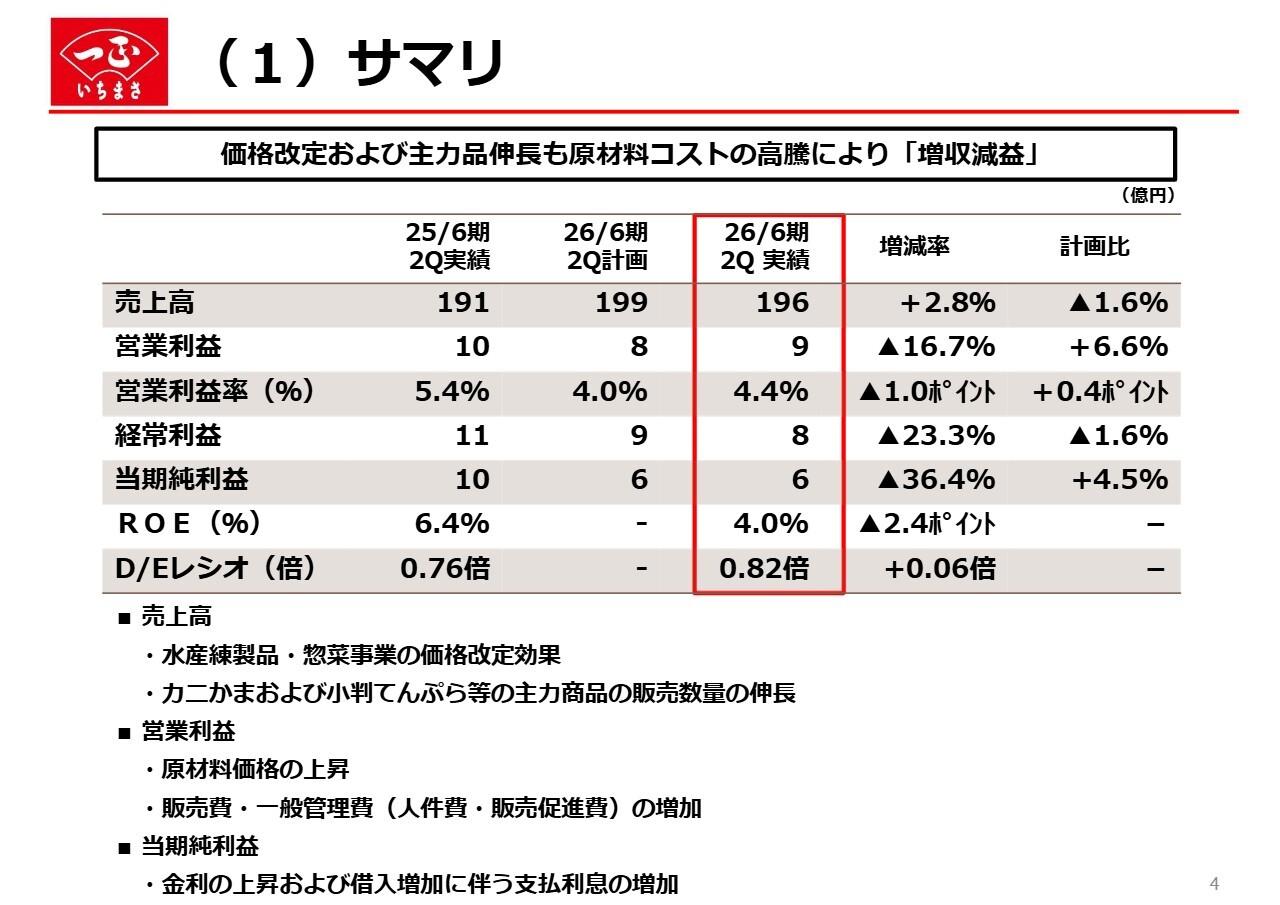
スライドは主要なパイプライン一覧です。これまでに示しているものに加え、3つ目のパイプラインとして糖尿病黄斑浮腫(DME)という新しい疾患が追加されています。
これらは現在、臨床試験が進行中、もしくは今後進行する予定のパイプラインです。滲出型加齢黄斑変性(wet AMD)およびACHについては、すでにProof of Concept(PoC)を取得しています。DMEについては本日、多少詳しくご説明します。
軟骨無形成症(ACH, Achondroplasia)
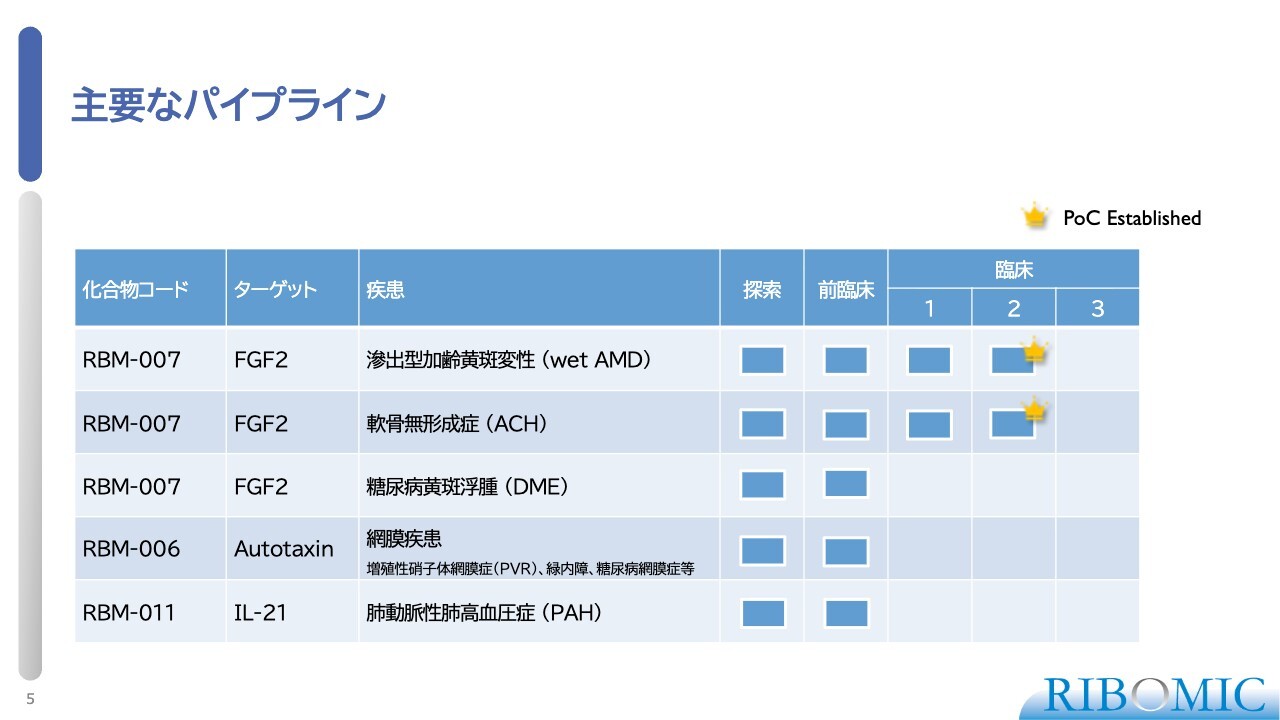
まず、軟骨無形成症についてです。トップラインデータが評価につながらなかったのは、我々のご説明が不十分だったことが一因だと思います。ただし、第2相臨床試験の目標を達成することができたという事実があります。
この病気は軟骨無形成症(ACH, Achondroplasia)と呼ばれます。この病気では、腕や足の大腿骨などの長管骨が発育不全を起こし、骨が十分に伸びません。その結果、軟骨無形成症の患者さまは、大人になっても男性は身長130センチメートル、女性は124センチメートル程度で成長が止まってしまうという希少疾患です。
この病気の原因は、FGF(線維芽細胞増殖因子)に対する4種類のレセプターのうち、3番目のレセプターであるFGFR3に起因します。FGFR3に起きた変異により、FGFR3を介したシグナルが細胞内に入ることで、骨の発育を阻害するブレーキの役割を果たします。そのブレーキ機能が過度に強いことが、この病気の発症原因であるとされています。
FGFR3変異による身長の変化
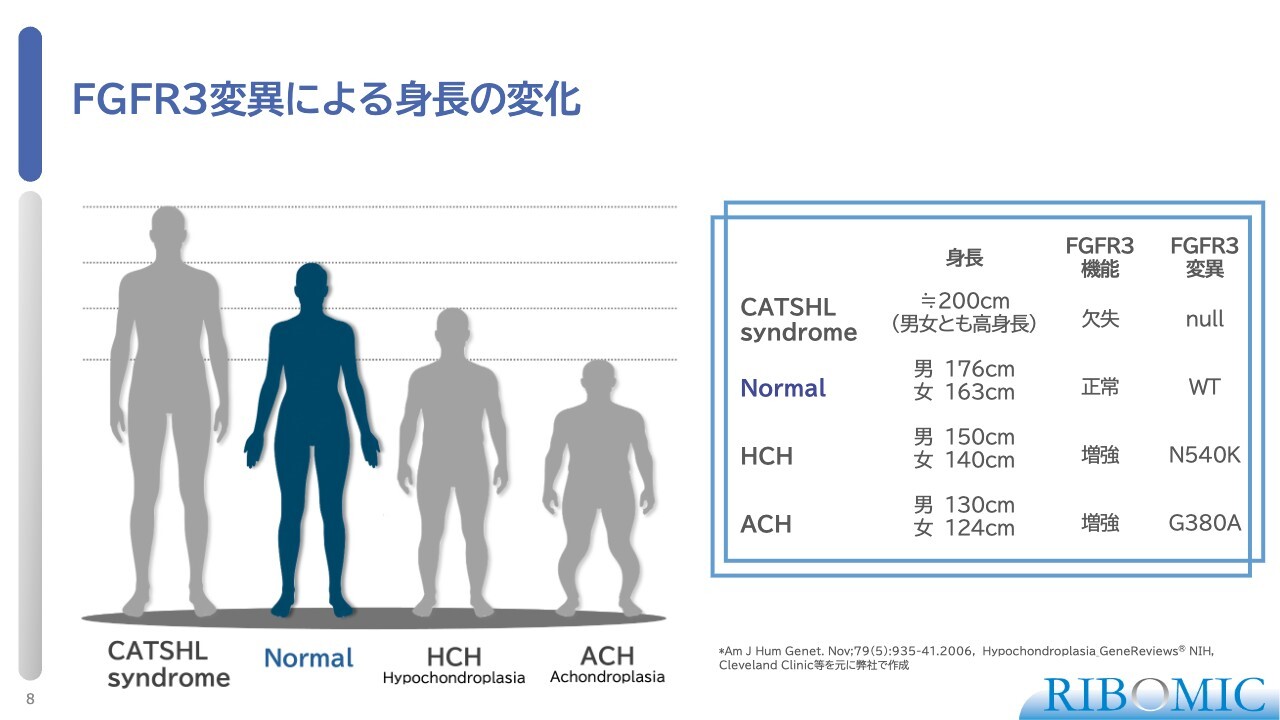
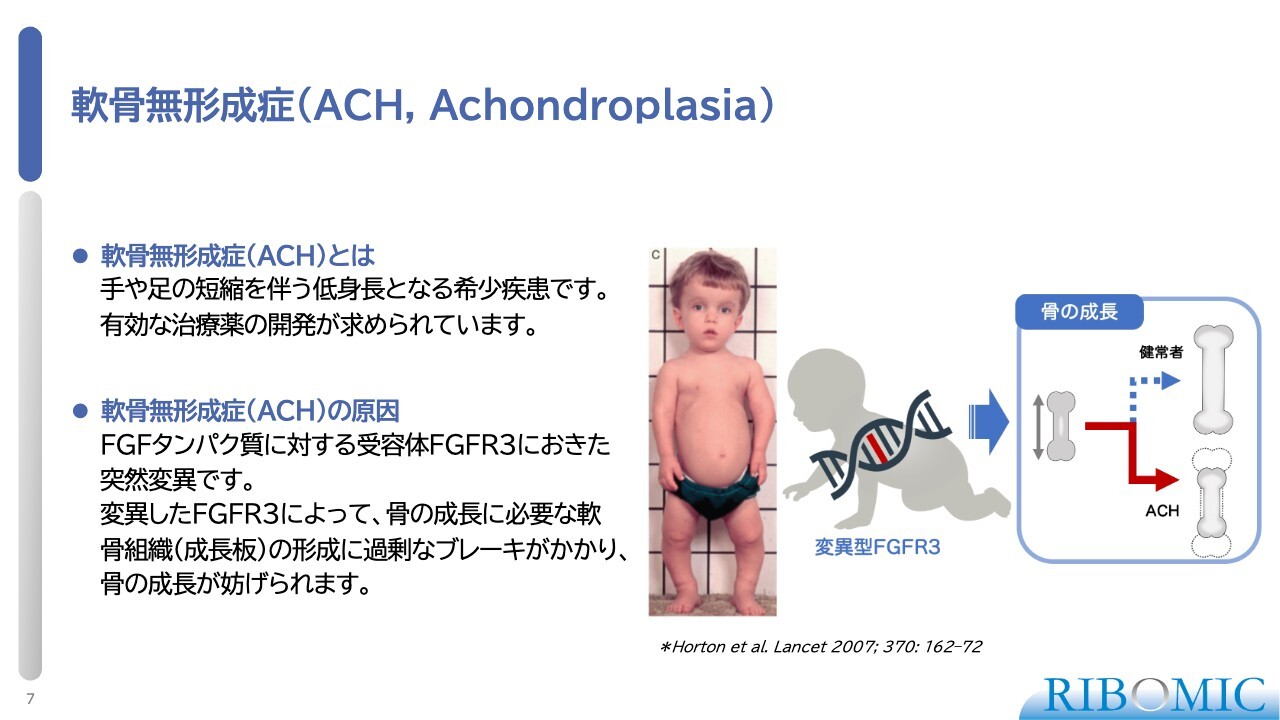
FGFR3の変異によって、さまざまな病気の形態が存在します。スライド図の一番右がACHで、これはトランスメンブレンという受容体の特異的な位置で起きたアミノ酸変異によるものです。この病気では、身長が130センチメートルや124センチメートルになるという特徴があります。
その隣にあるのが軟骨低形成症(HCH)です。これは突然変異が受容体の内側で発生し、このような表現型を引き起こします。スライド図で黒く塗られている部分は成人で、図の一番左がFGFR3の機能が完全に失われた場合に発症する巨人症です。
ACH治療薬の作用機序
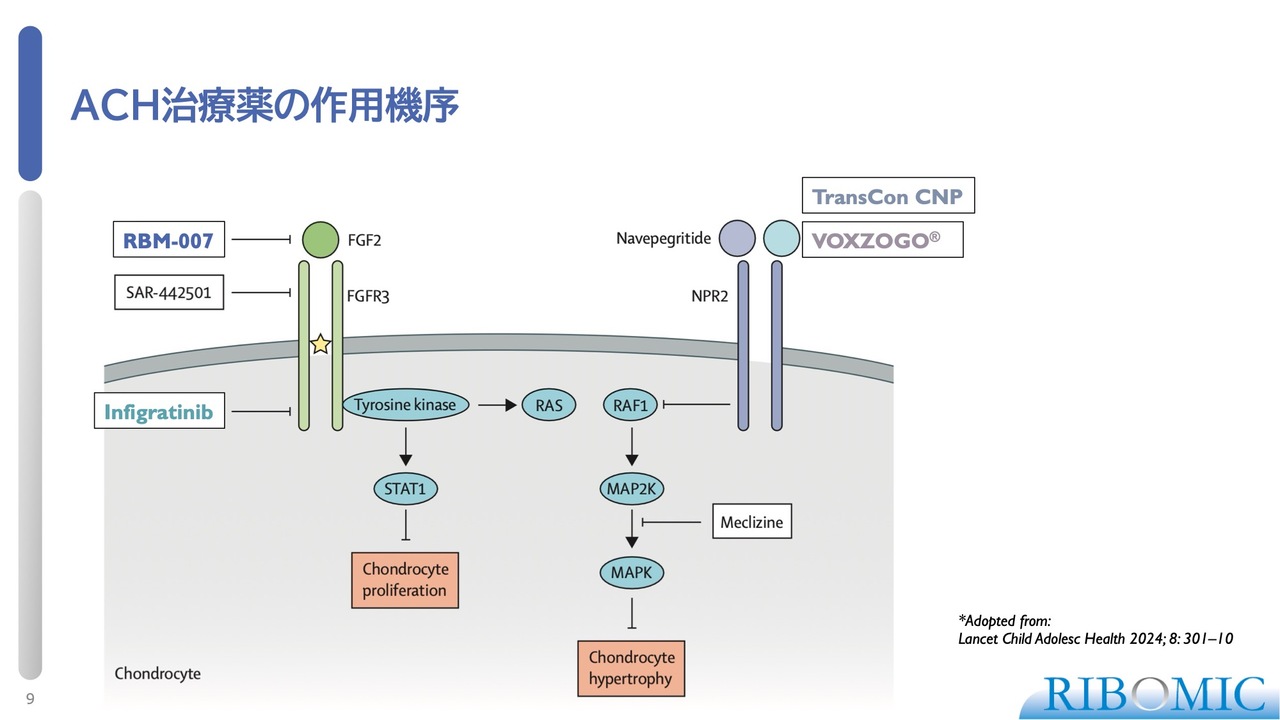
この変異は受容体に存在します。具体的には、受容体そのもののブリッジ部分や、その内側のレセプターでチロシンキナーゼと呼ばれる活性部位に変異が生じます。
いずれにしても、ACHに関しては、FGF2から送られるシグナルが細胞内に伝達され、Chondrocyteの増殖に関わるシグナルにつながっていきます。この過程が過剰に活性化すると、阻害が起こるという流れです。
また、もう1つ「VOXZOGO」という薬があります。これは別の経路でChondrocyteの機能に影響を与えるシグナルを阻害することで、病気の治療に寄与することがわかっています。このように作用点を極めながら、新しい薬の開発が進められています。
その1つが「RBM-007」で、もう1つが受容体の内側を抑える「Infigratinib」という薬です。また、「VOXZOGO」や「TransCon CNP」は、CNPという小さなペプチドに対する薬です。
他社開発品との比較
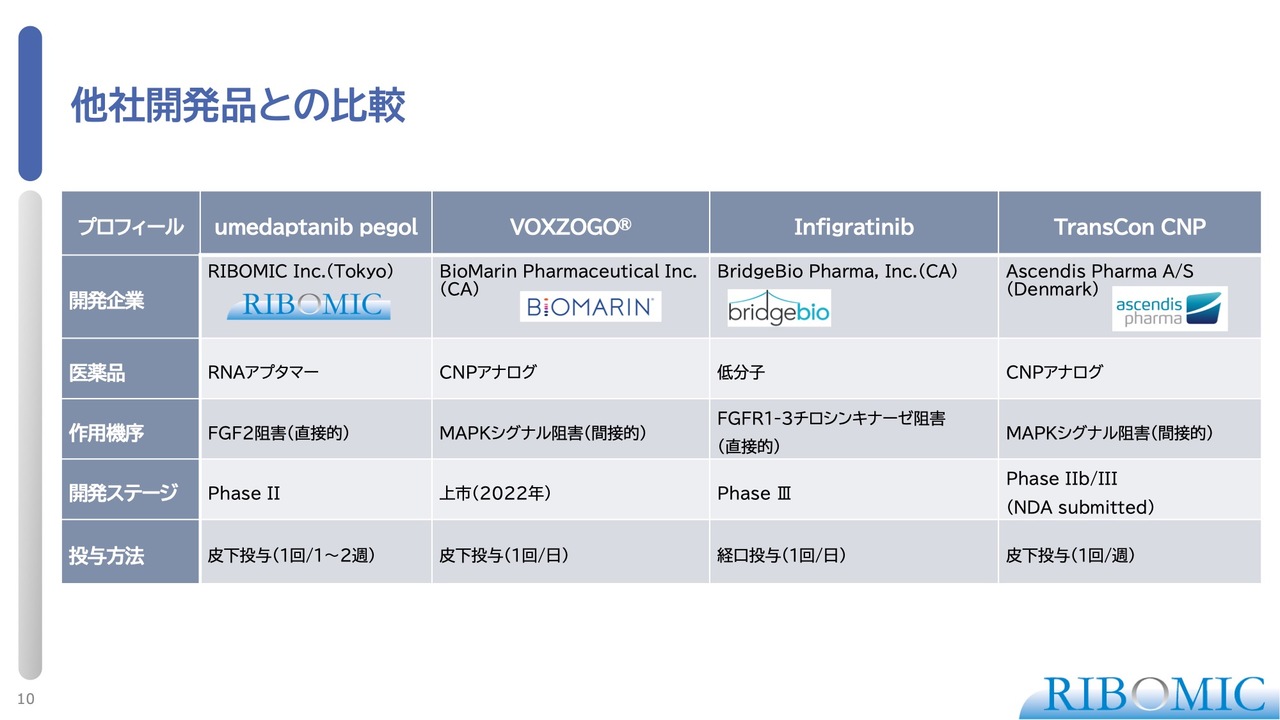
現在、合計4社が競合しながら新薬の開発を行っている状況です。当社の薬は「RBM-007」で、一般名称および化学名称として「umedaptanib pegol」という名前を付けています。この薬はRNAアプタマーで、FGF2を阻害する作用があります。投与方法は、皮下投与で1週間から2週間に1回です。
一方で、BioMarin Pharmaceuticalが開発した「VOXZOGO」という薬は2022年に上市され、使用されています。この薬はCNPアナログで、我々の薬とは作用点が異なり、毎日皮下投与が必要です。
「infigratinib」はFGFR3の機能を抑制する薬です。経口投与で毎日1回の服用が必要で、現在、第3相臨床試験(フェーズ3)が進行中です。
また、「TransCon CNP」という薬については、CNPという非常に不安定な物質を安定化させたもので、現在フェーズ3まで進んでいます。こちらは皮下注射で1週間に1回の投与となります。
このような薬が現在しのぎを削って開発されている状況です。
RBM-007(umedaptanib pegol):抗FGF2 アプタマー
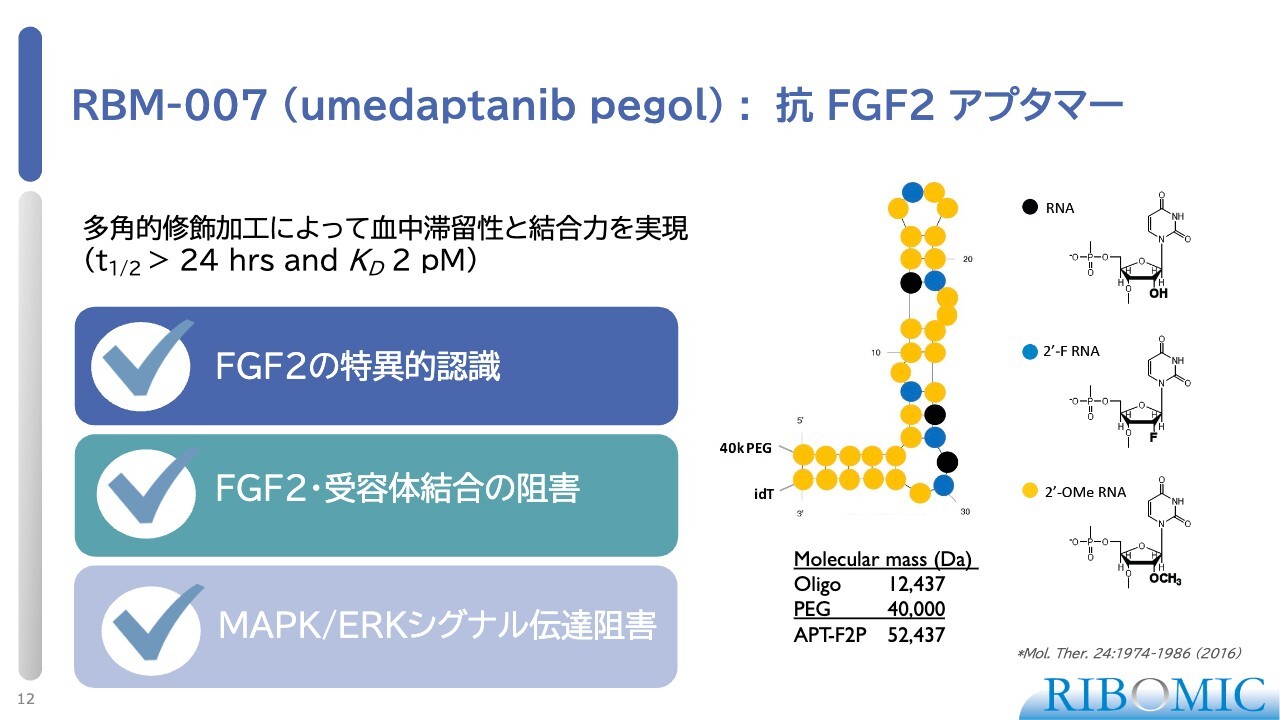
我々の「RBM-007」の第2相臨床試験の内容について詳しくお話しします。この薬剤「RBM-007」は、FGF2に対するアプタマーで、RNAを基本にした構造です。RNAは塩基のため不安定で、さまざまな修飾加工によって安定化させています。
血中の半減期は24時間以上とされていますが、実際にはおよそ46時間です。また、FGF2に対する結合性は非常に高く、通常の抗体よりも約1,000倍優れています。解離定数は2ピコモルで、この数値により結合性の高さが明らかです。
これまでに多くの実験を行った結果、FGF2に対する特異性や、FGF2とレセプターへの結合阻害プロファイル、さらにシグナル伝達の遮断といった点でデータが揃いました。そのため、次の試験段階に進めている状況です。
RBM-007投与によるACHモデルマウスの骨伸長の回復
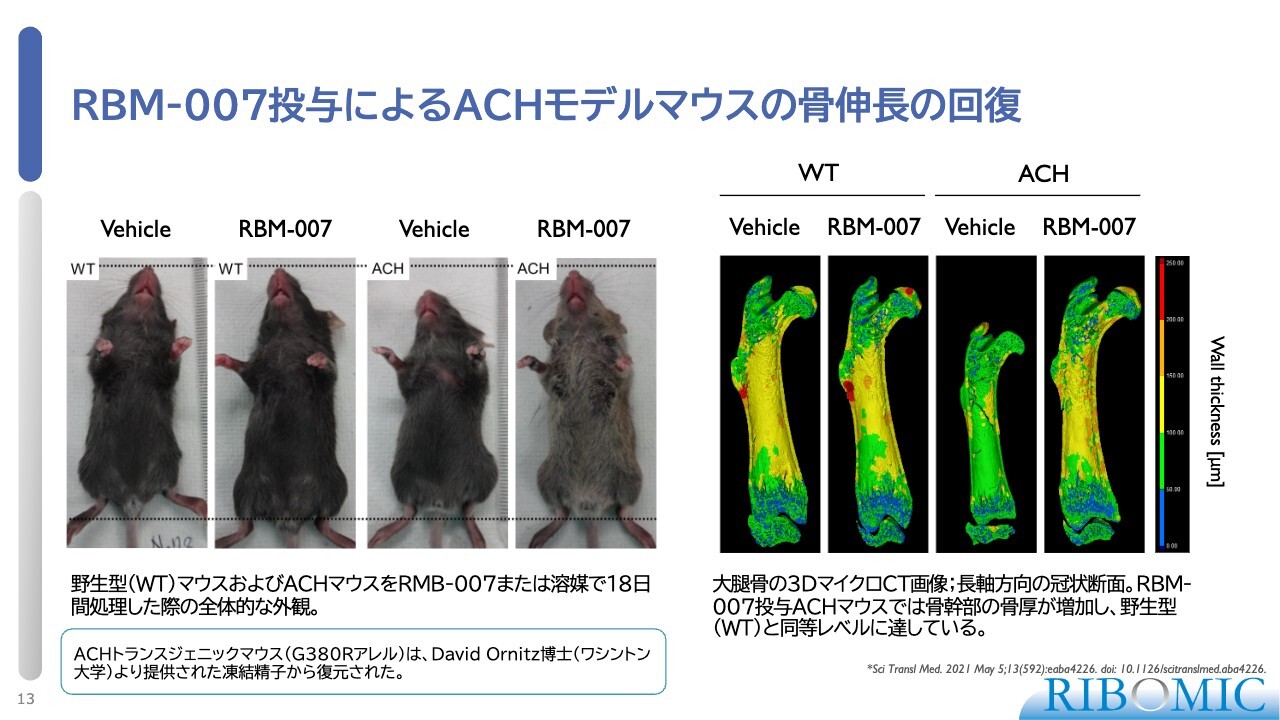
その一例として、スライドはACHの病態モデルであるマウスの実験結果です。このマウスには人間のACHの変異を移植しており、背丈が非常に小さくなっています。このマウスに我々の薬剤を毎日腹腔投与し、18日間飼育した結果、背丈および大腿骨が正常に戻ることが確認されました。
これによって臨床試験に進むためのさまざまな基盤が整い、現在、臨床試験に入っている状況です。
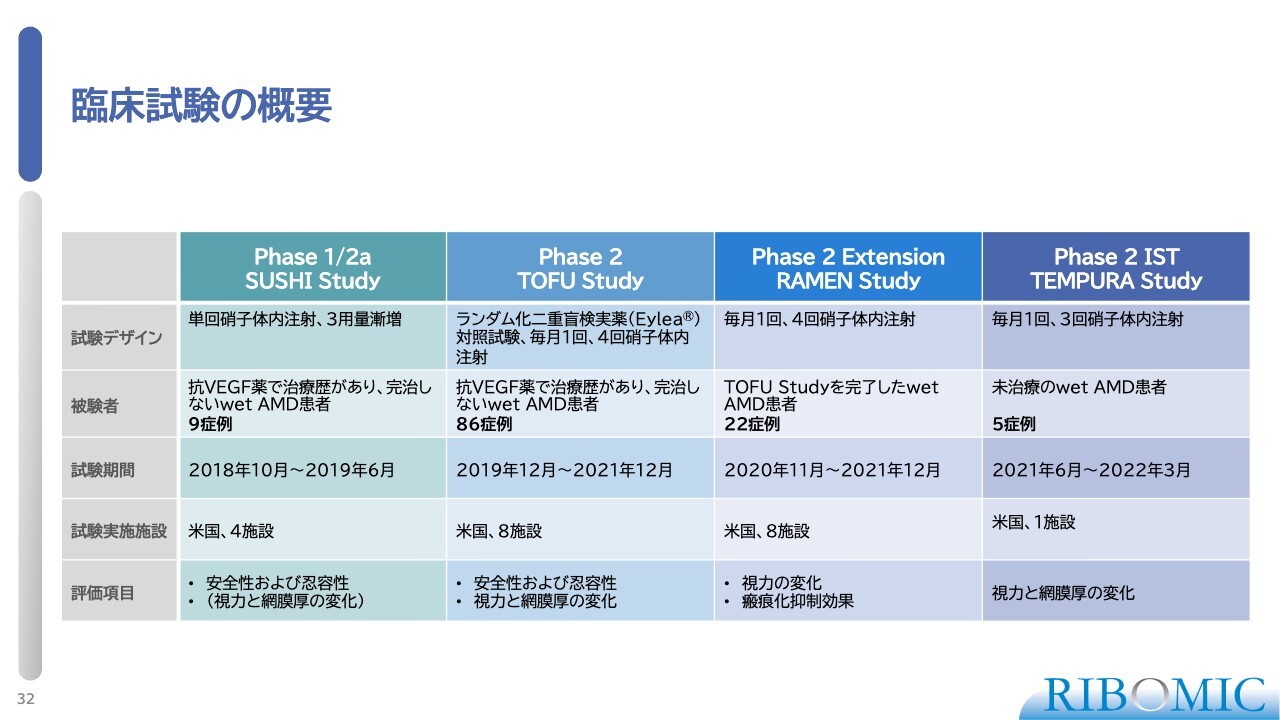
臨床試験の概要
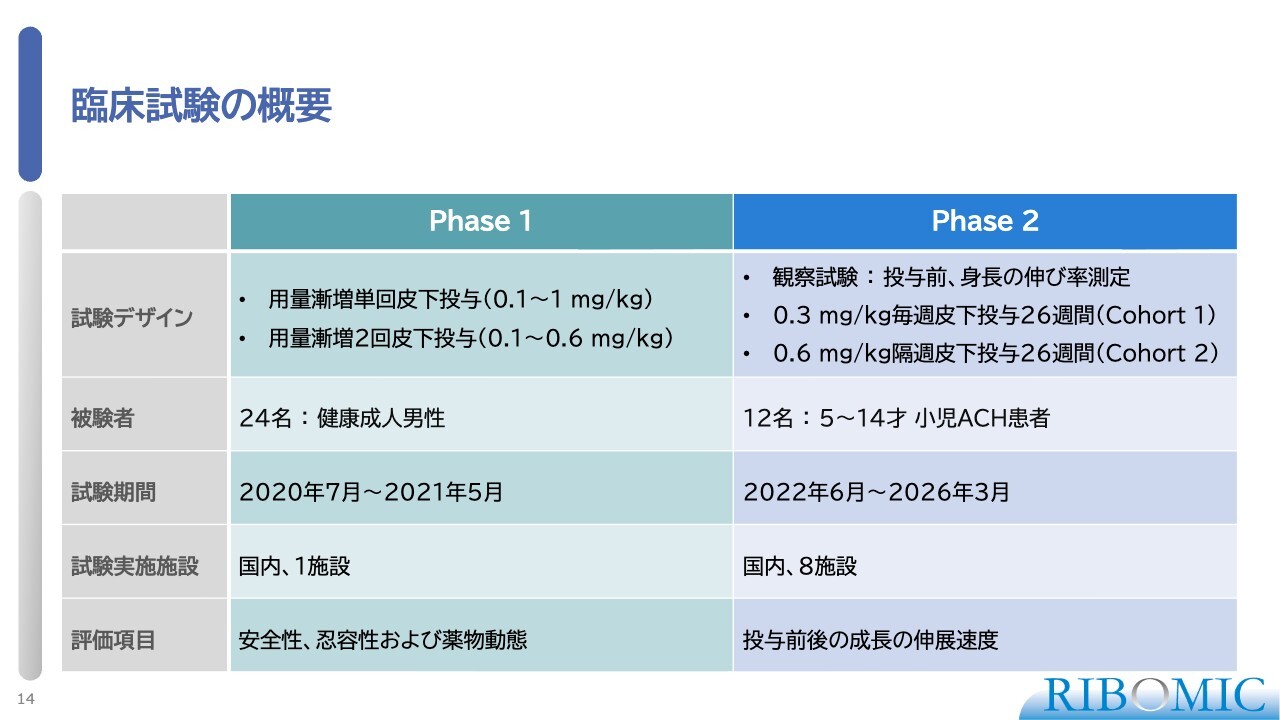
スライドに臨床試験の概要が示されています。第1相臨床試験(フェーズ1)では安全性、忍容性、薬物動態を明らかにします。また、第2相臨床試験(フェーズ2)は実際に薬が効くかどうかを試験するものです。
Phase 1 試験の単回投与PK(薬物動態)プロファイル
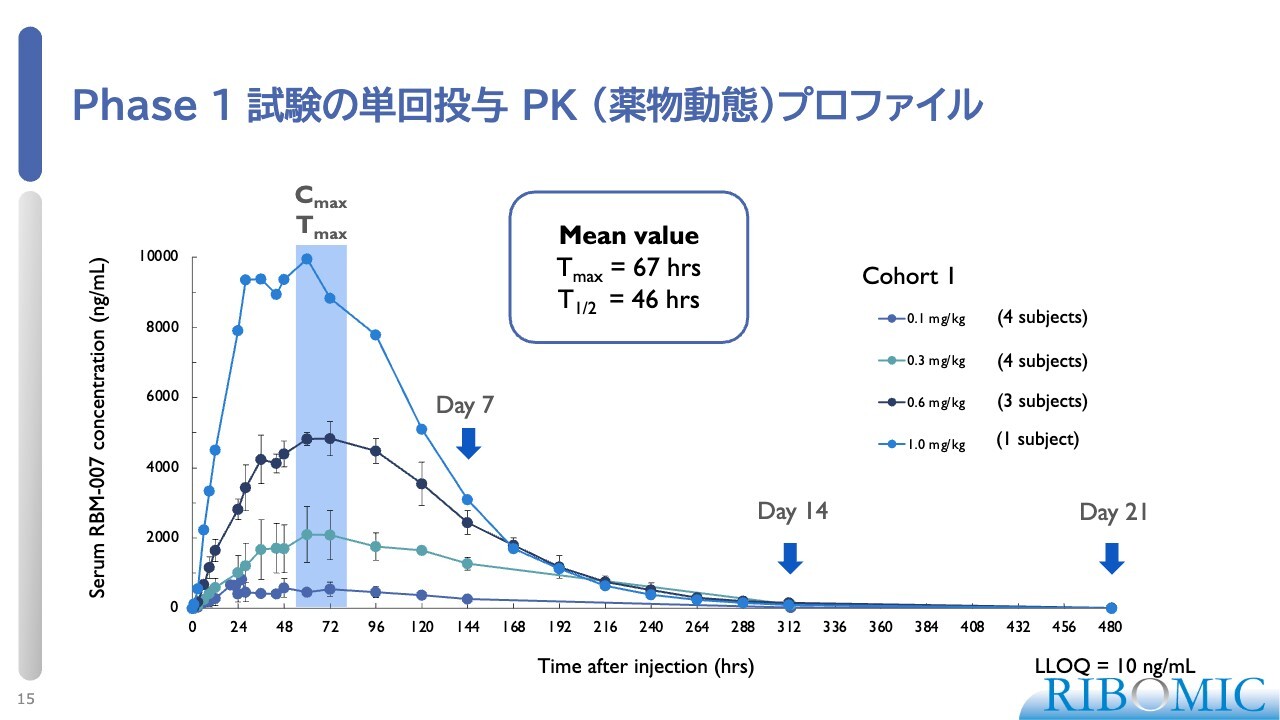
スライドにフェーズ1における薬物動態のプロファイルを示しています。薬物の濃度に応じて、きれいにプロファイリングが起きることが確認されました。
特徴としては、半減期(T1/2)が46時間と非常に長い点が挙げられます。また、血中濃度が最高になるまで(Tmax)に67時間かかります。このような基本的なデータが揃った上で、フェーズ2に進みました。
Phase 2 臨床試験デザイン
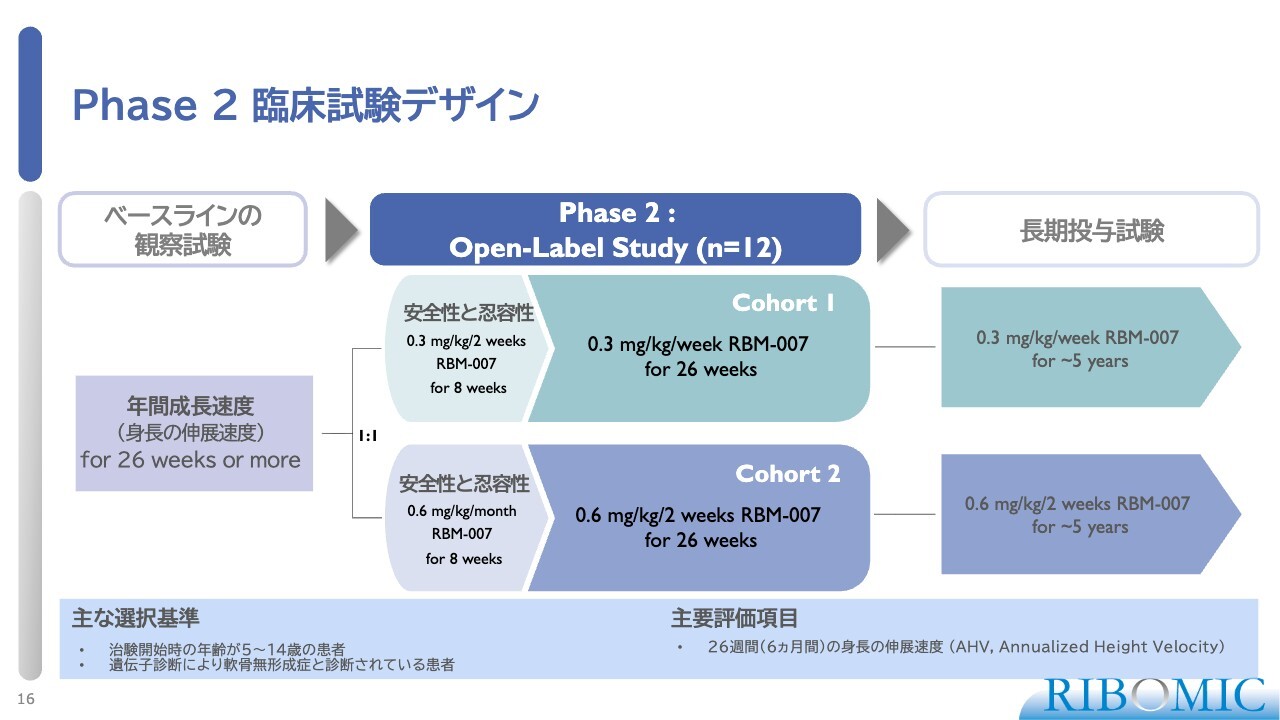
フェーズ2では、5歳から14歳のACH患者12名のお子さまに参加いただき、最初の半年間、個人の身長の伸びるスピードを観察しました。この観察試験の後、患者を6名ずつの2群に分け、安全性と忍容性を事前に確認した上で本試験を実施しました。
0.3ミリグラムを毎週皮下投与するコホート1と、0.6ミリグラムを2週間に1回の間隔で皮下投与するコホート2の2つの群で試験を行いました。その結果、半年後に身長がどれだけ伸びたかを評価する試験です。
我々の結果がすんなり受け入れられなかった理由として、コホート1とコホート2は薬物の増量依存性を見る試験ではないかと多くの方が考えた点が挙げられます。しかし、実際にはそうではありません。
コホート1とコホート2では、投与する薬物量は総量として同じです。試験の違いは、投与を1回で行い2週間間隔を空けるか、1週間ごとに2回に分けて投与するかという条件にあります。
Phase 2 臨床試験デザインと目的
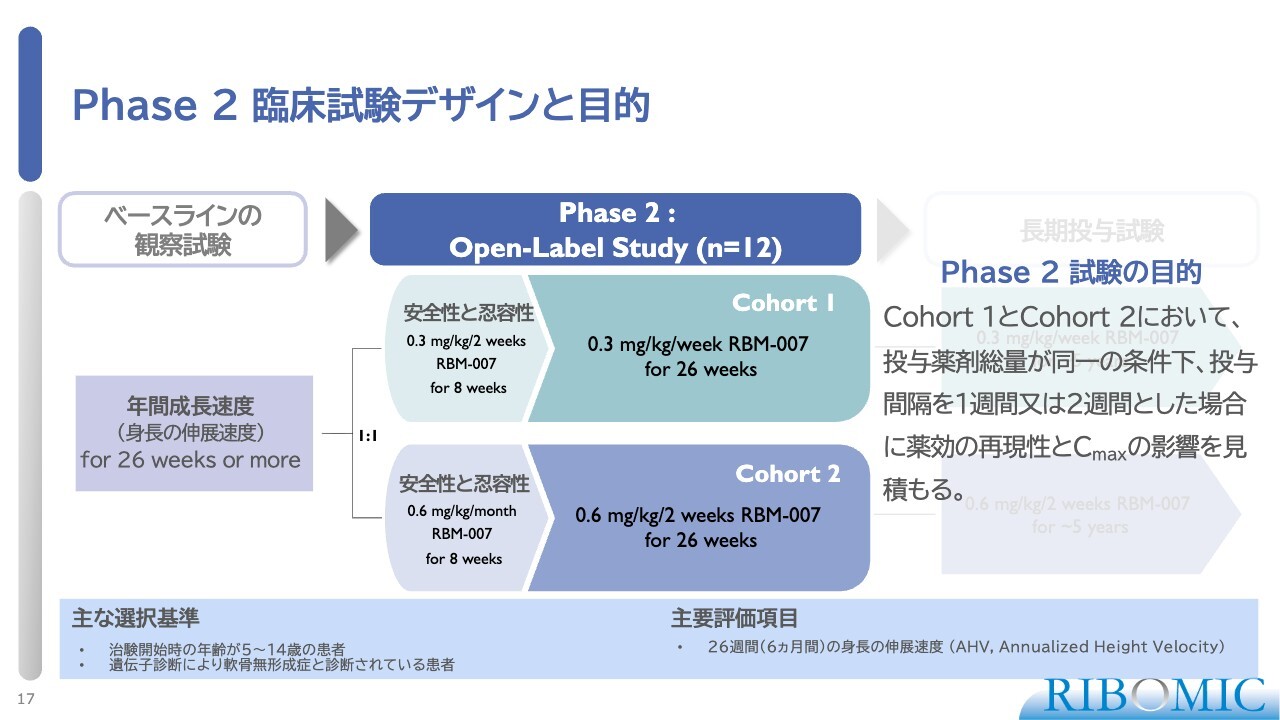
試験の目的は増量依存性を調べることではなく、薬物量を増やすことで投与間隔を1週間から2週間にできるかどうかを確認するものでした。これを専門用語でデュアビリティといい、薬物の再現性を確認すると同時に、投与間隔を伸ばせるかどうかを試験することが目的だったのです。
特にこだわった点は、この病気を持つお子さまが非常に小さな幼児であるという点です。現在、「VOXZOGO」というバイオマリン社が開発した薬は、毎日皮下投与が必要となっています。これが患者ご本人やご家族にとって非常に大きな負担となっているため、投与間隔を少しでも延ばせるかどうかを第一義的に、優先して試験を実施しました。
Phase 2 臨床試験の進捗
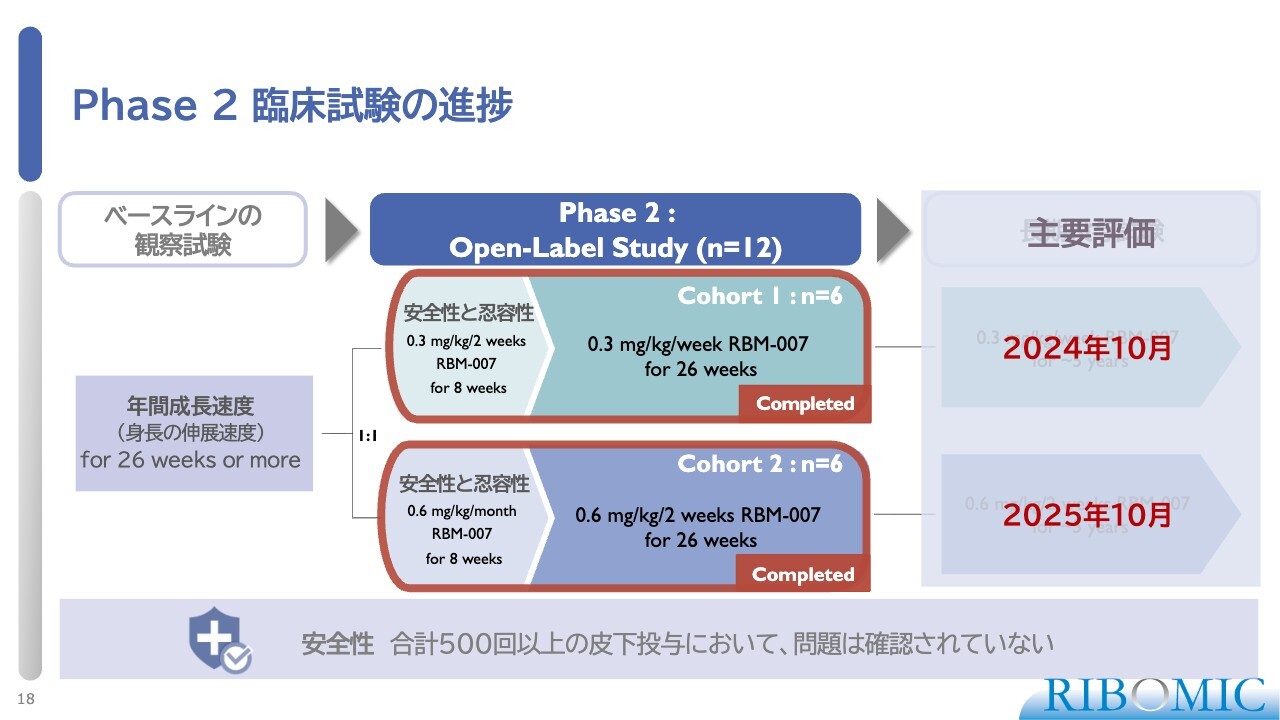
2つの試験はいずれも最近完了し、その結果が明らかになりました。さらに重要な点として、これまでに500回以上の皮下投与を行ってきましたが、副作用はまったく確認されておらず、非常に安全な薬であることが判明しています。
治験参加者のベースライン時の特徴
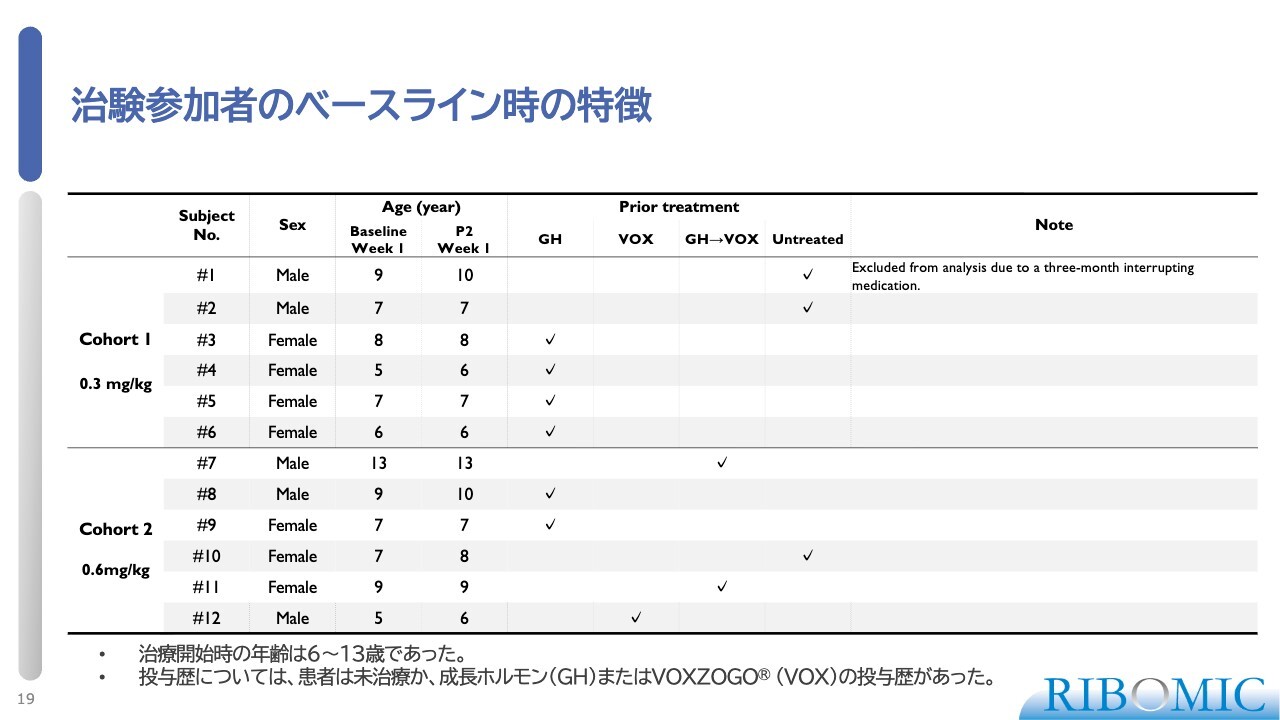
試験に参加した当初の12名の患者さまのうち、1名が離脱しましたが、その方々のおおよそのプロファイルをスライドに示しています。
非常に重要なこととして、「VOXZOGO」を使用していた、または成長ホルモン(GH)から「VOXZOGO」へ移行した3名の患者さまが、その治療から離れ、私たちのプログラムに移行してきました。これは、「VOXZOGO」の効果が十分ではなかったと判断し、我々のプログラムを選択したことを意味します。
Phase 2 Cohort 1 Cohort 2 の結果とVOXZOGOとの比較
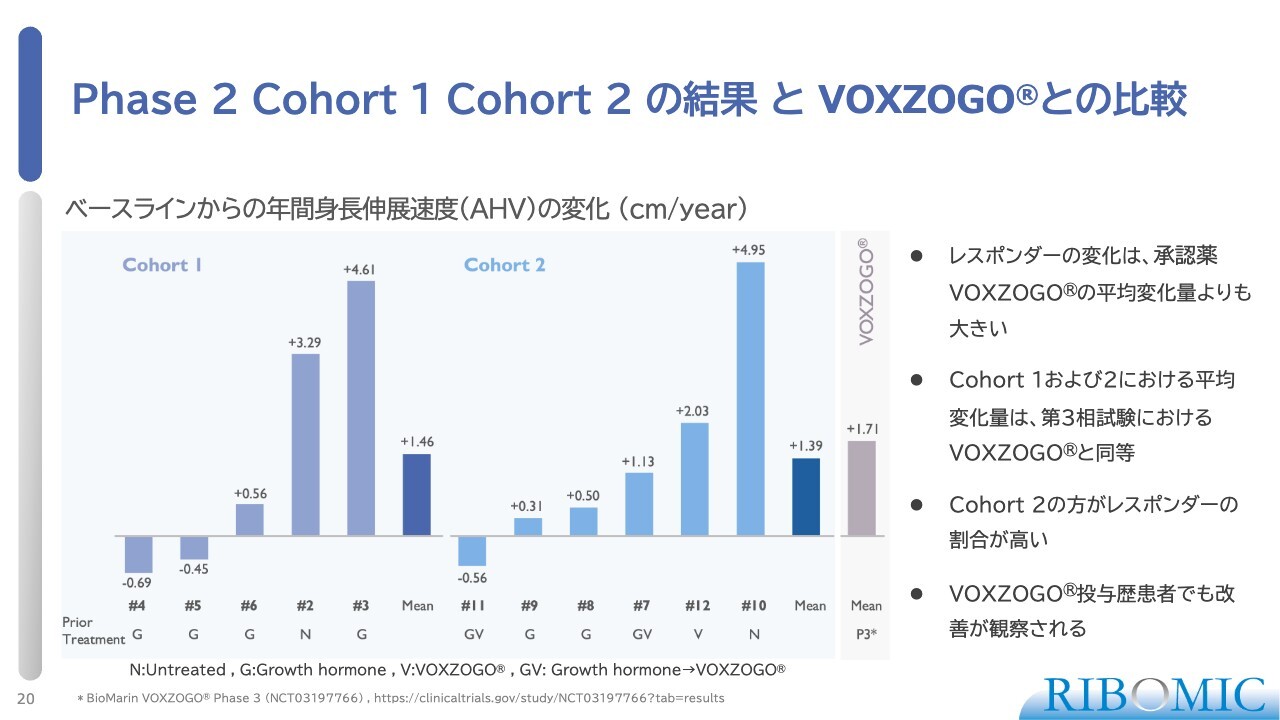
その結果がこちらのスライドです。コホート1を見ると、5名のうちNo.2とNo.3の2名が非常に身長の伸びが良い結果を示しています。「VOXZOGO」の平均がプラス1.7センチメートルであるのに対し、はるかに良い身長の伸び率を示しており、平均でプラス1.46センチメートルとなっています。
コホート2でもやはり、2名が非常に高い伸び率を示し、効果が顕著に現れています。コホート2のほうが反応性が良いこともわかりました。こちらの伸びの平均は1.39センチメートルです。
この試験の結果で、いくつかの重要なことが明らかになりました。1つ目は、反応があった患者の変化量が、承認薬である「VOXZOGO」の平均変化量を上回ったことです。2つ目は、コホート1およびコホート2の変化量の平均値が、フェーズ3の「VOXZOGO」とそれほど差がないことです。
さらに、コホート2のほうがレスポンダー(反応する患者)の割合が高いことがわかりました。これは、1回で高用量を投与するため、初期濃度が高くなることが影響していると考えられます。最後に重要な点として、「VOXZOGO」の投与歴があり、あまり効果が見られなかった患者が今回の試験に参加し、良好な効果が得られたというデータが得られました。
この結果は、特にこの病気の子どもたちにとって良いニュースであると考えています。
Umedaptanib Pegolの長期投与試験における持続的有効性
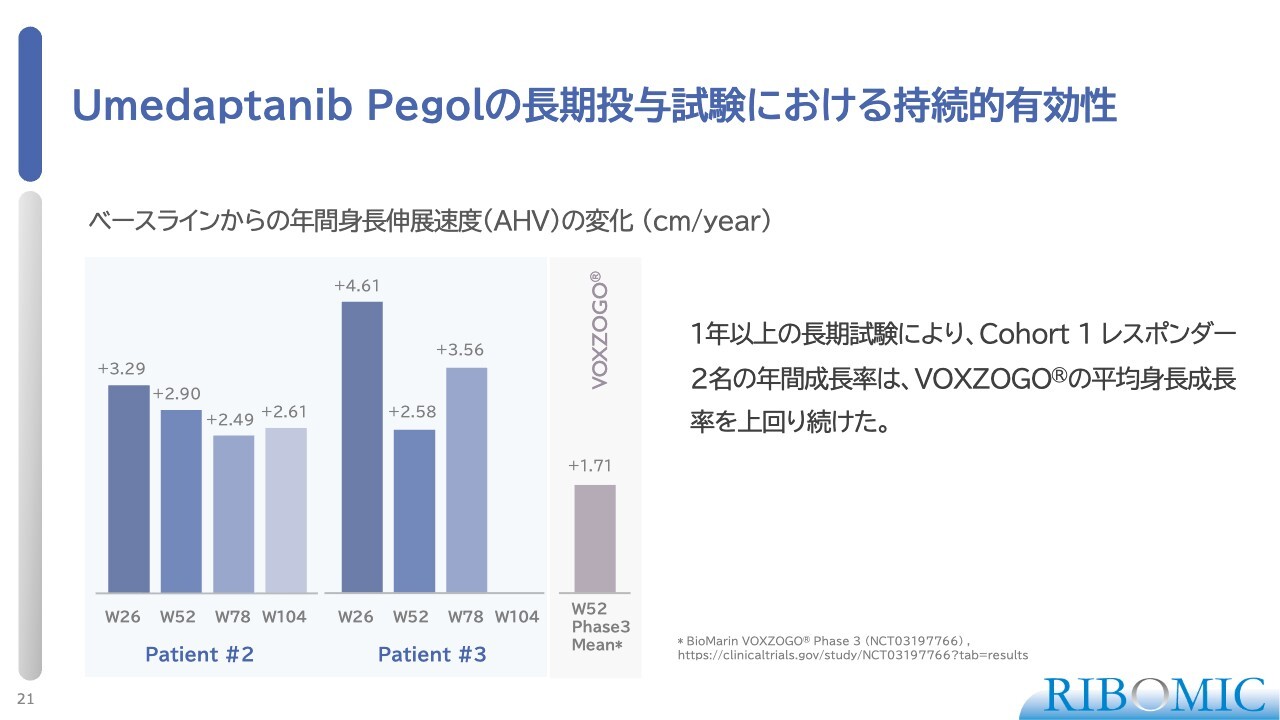
コホート1で特に反応が見られた2名のお子さまについて、その後の経緯を追いながら、引き続き同じ条件で薬の投与を行ってきました。うち1名は投与開始からちょうど2年が経過しており、もう1名は1年半が経過しています。
いずれの場合も高い身長の伸び率を維持しており、これは当社の薬が継続的に効果を発揮していることを示しています。このペースが続けば、年間約3センチメートルの身長増加が期待でき、年齢を考えると7年間で合計約20センチメートルの伸びが見込まれます。
したがって、男子の場合、通常130センチメートルで成長が止まるケースでも、150センチメートルまで伸びる可能性があります。これにより、一般的な人と同等の身長になり、生活の質の向上が期待できます。
Phase 2 試験の PK シミュレーション
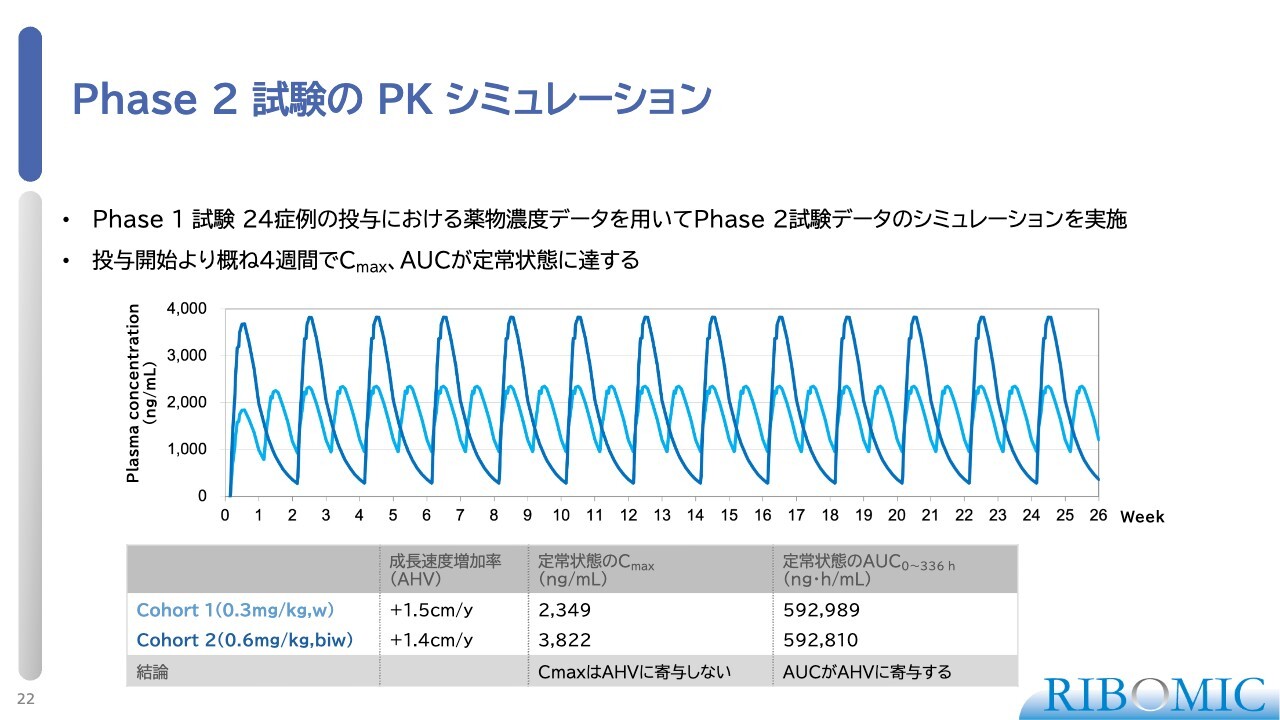
コホート1、コホート2の試験をPKシミュレーションで整理したのがスライドの図です。フェーズ1で薬物動態プロファイルが取得されているため、それに基づいています。
薄いライトブルーの線がコホート1で、0.3ミリグラムを毎週注射する方法です。一方、濃いブルーの線がコホート2で、0.6ミリグラムを2週間間隔で注射する方法です。血中での薬物濃度はスライド図のように変化していきます。
結果的に、両群ともに伸び率は1.4センチメートルまたは1.5センチメートルと同じであることが確認されました。つまり、投与した薬物の総量が一定であれば、伸び率は変わらないことがわかります。
コホート2の場合、最高血中濃度(Cmax)が一時的に高くなるものの、その後減衰していくため、Cmaxが伸び率に大きな影響を与えていないことがこのデータからわかります。
他社開発品との比較
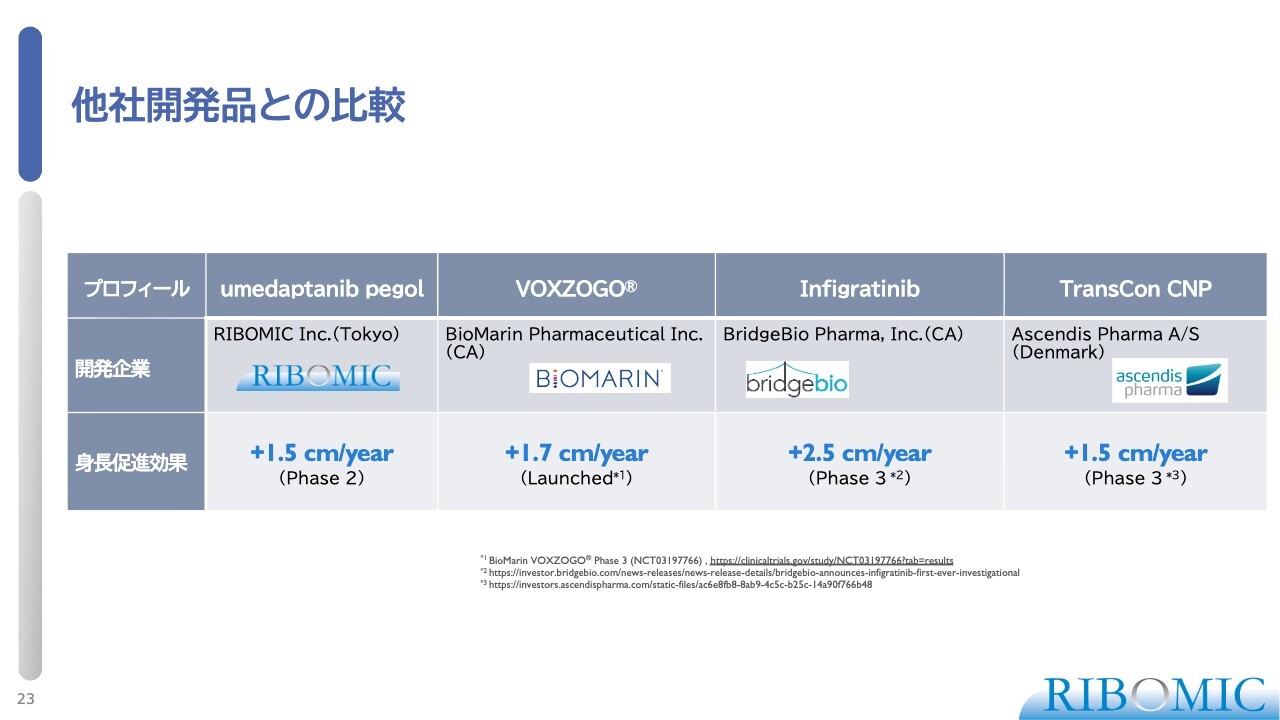
当社の薬はコホート1、コホート2で1年あたりプラス1.5センチメートルという伸び率です。また「VOXZOGO」は、現在市場で使用されており、プラス1.7センチメートルの効果を示しています。第3相臨床試験中の「Infigratinib」がもっとも有効で、プラス2.5センチメートル、「TransCon CNP」はプラス1.5センチメートルです。
現在、フェーズ2が完了し、非常に多くの国内外の製薬企業が当社のプログラムに対して関心を寄せており、秘密保持契約のもとで提携協議を継続しています。当社の薬はすでに「VOXZOGO」と同程度の薬効が確認されています。さらに、毎日皮下投与が必要な「VOXZOGO」と比較して、週1回の皮下注射で済むため、患者さまに対する利便性が非常に高く評価されています。
最後に「Infigratinib」との比較において、その伸び率プラス2.5センチメートルを上回る効果を示せるかどうかが各社にとっての指標とされ、それをクリアすれば問題なく導入するという意思表示がされています。これからが真剣勝負になると考えています。
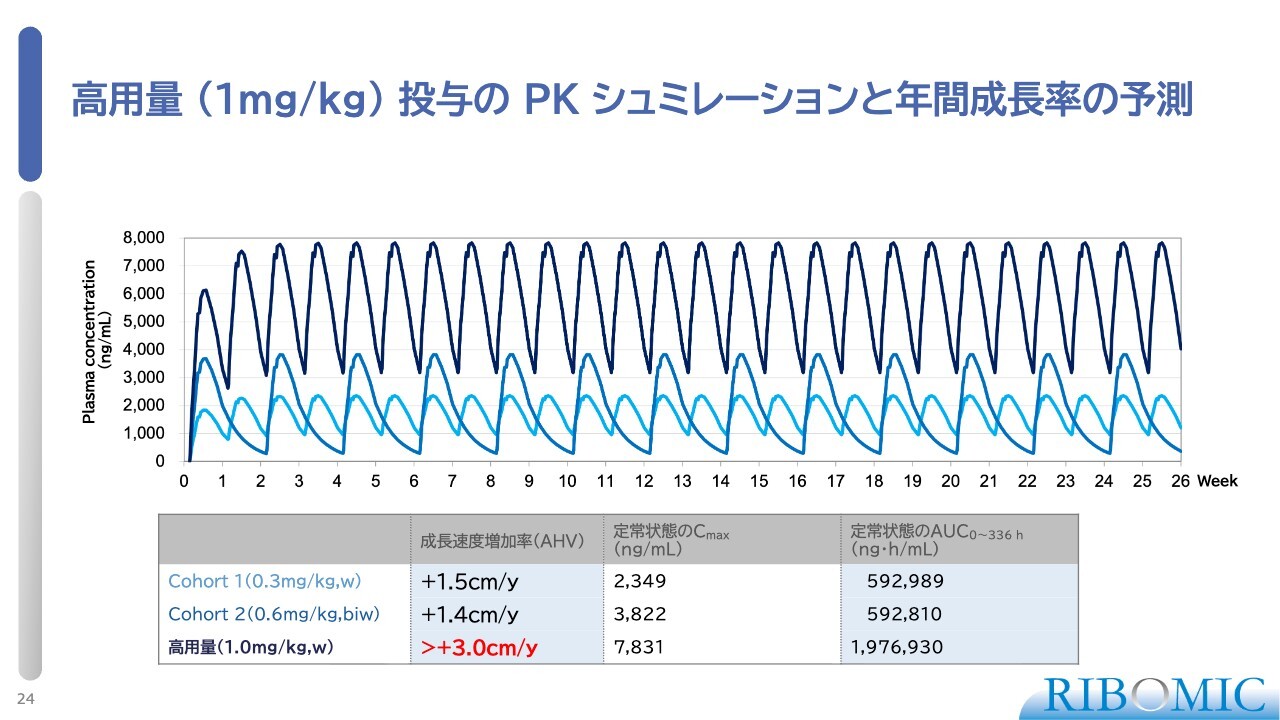
高用量(1mg/kg)投与のPKシミュレーションと年間成長率の予測
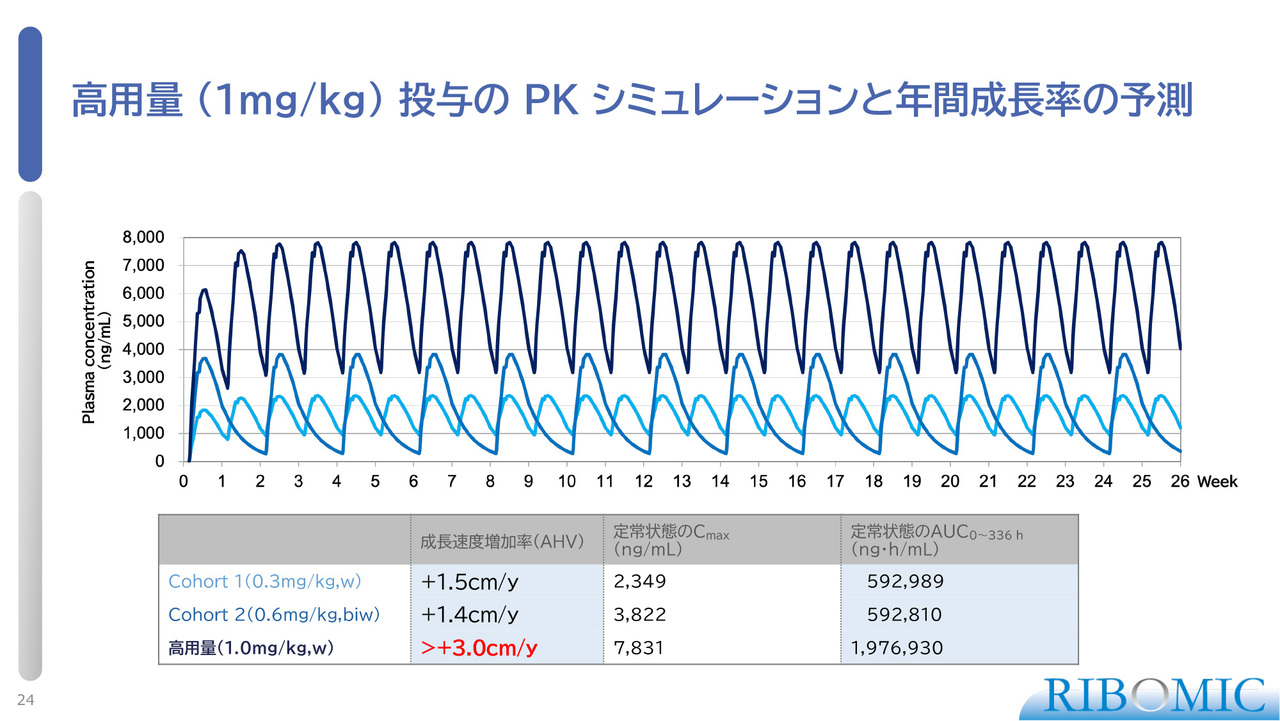
我々は次の試験として、承認を得るための第3相臨床試験をしたいと思っています。その試験においては、どの程度の濃度の薬を投与できるかが重要なポイントとなります。
スライドのグラフに紺色で表示した線は、体重1キログラムあたり1ミリグラムの濃度で、1週間に1回の投与を行った場合のシミュレーションです。この条件では、これまでの試験に比べて投与総量が3.3倍となります。その結果として、年間でプラス4センチメートル、控えめに見積もってもプラス3センチメートル程度の効果が見込めると考えています。
また、投与量については現在、規制当局と真摯に協議を進めており、決定は2026年3月頃を予定しています。現在のところ、提案が否定される兆候は見られません。
今後の方針
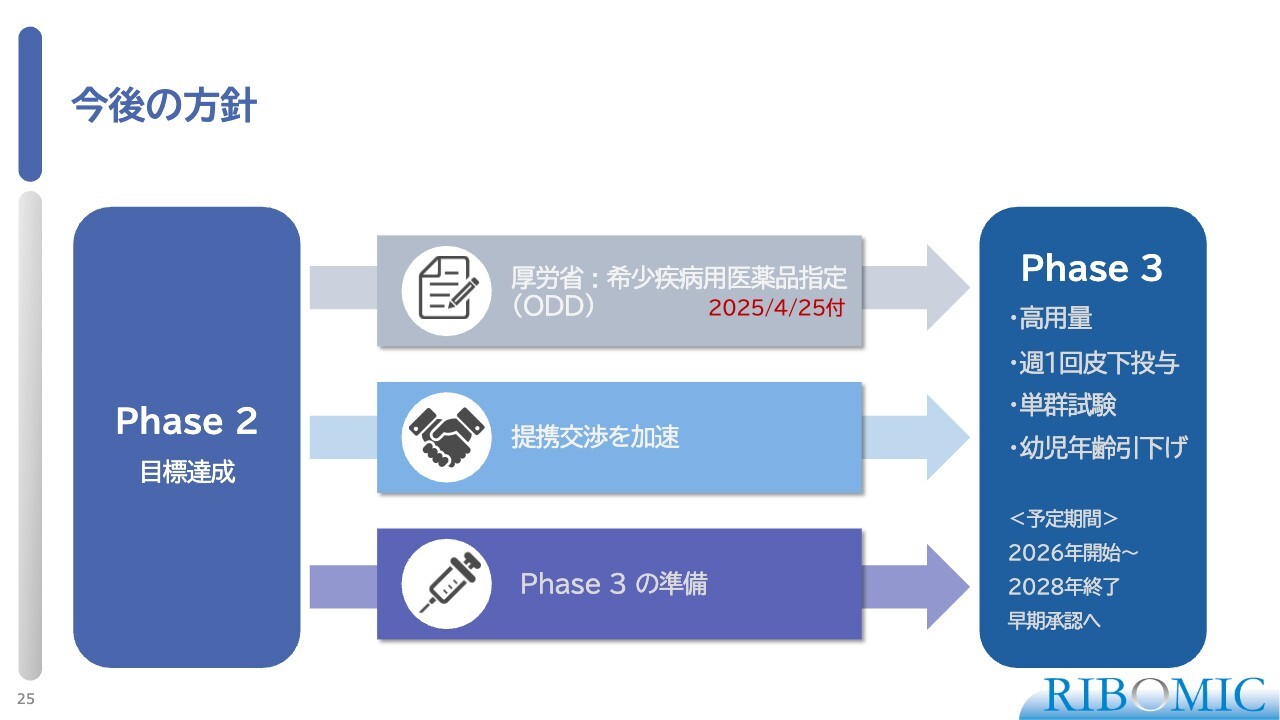
今後の方針についてです。このプログラムはフェーズ2を目標達成の上で完了し、厚生労働省から希少疾患疾病医薬品指定(ODD)を受けています。そのため、今後の審査過程において、さまざまな優遇措置が期待されます。現在は提携交渉を進めながら、フェーズ3の準備を進めています。
フェーズ3では、高用量の投与を予定していますが、用量設定は最終的に規制当局の承認で決定します。投与方法は週1回の皮下投与とし、偽薬や比較薬を用いない単群試験を想定しています。また、現在は5歳からとしている参加年齢を2歳まで引き下げ、より多くの患者さまが当初から参加できるようにする方針です。
予定どおりに進めば、2026年度に試験を開始し、2028年度には終了する予定です。その後、ODDの条件を満たし、早期承認を目指していきます。
このシミュレーション結果から、本薬は競合薬よりも効果的であると確信しました。実際のフェーズ3でその効果を検証したいと考えています。また、本薬は効果だけでなく、投与間隔を2週間に延ばすことが可能であり、患者さまにとって大きなメリットとなります。
この強みを活かして提携交渉を進め、フェーズ3の途中段階においても製薬企業との提携を実現し、試験終了を待たずにオプション契約などによる収益化を図りたいと考えています。
我々がフェーズ3を単独で始めると、収益化までに2年から3年を要すると考えて落胆される株主さまもいるかもしれません。しかし、本プログラムの途中で収益化を目指していますので、ご理解いただければと思います。

ちなみに「Infigratinib」は、米国のブリッジバイオ・ファーマから協和キリンが日本限定の権利を導入した際に、150億円のアップフロントが支払われました。「TransCon CNP」は、デンマークのアセンディス・ファーマから帝人が導入し、100億円のアップフロントが支払われています。
したがって、当社のプログラムも同等の収益が見込めると考えています。ぜひご期待ください。
拡大する網膜疾患の市場
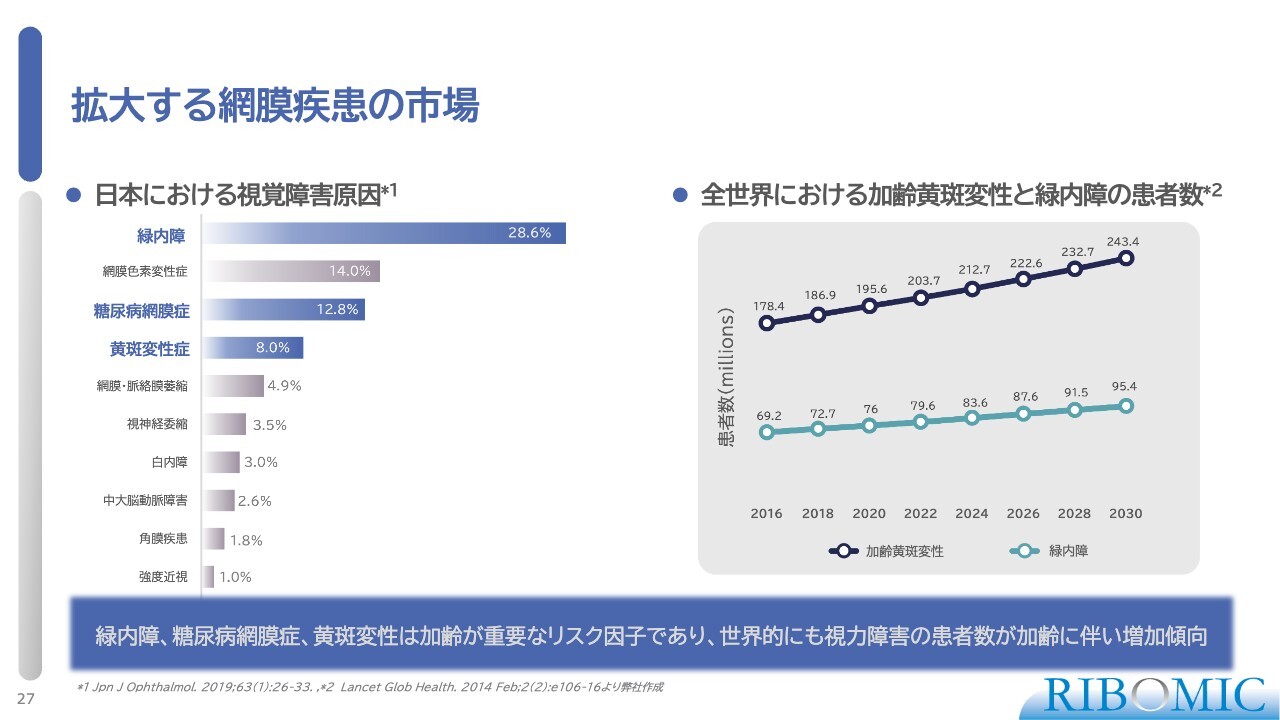
眼科事業についてです。日本の眼科領域では、特に緑内障が多く、続いて糖尿病網膜症や黄斑変性症が多く見られます。これらはいずれも加齢とともに患者数が増加するため、新しく非常に効果の高い薬の開発が求められています。
RBMアプタマーの網膜疾患への適応
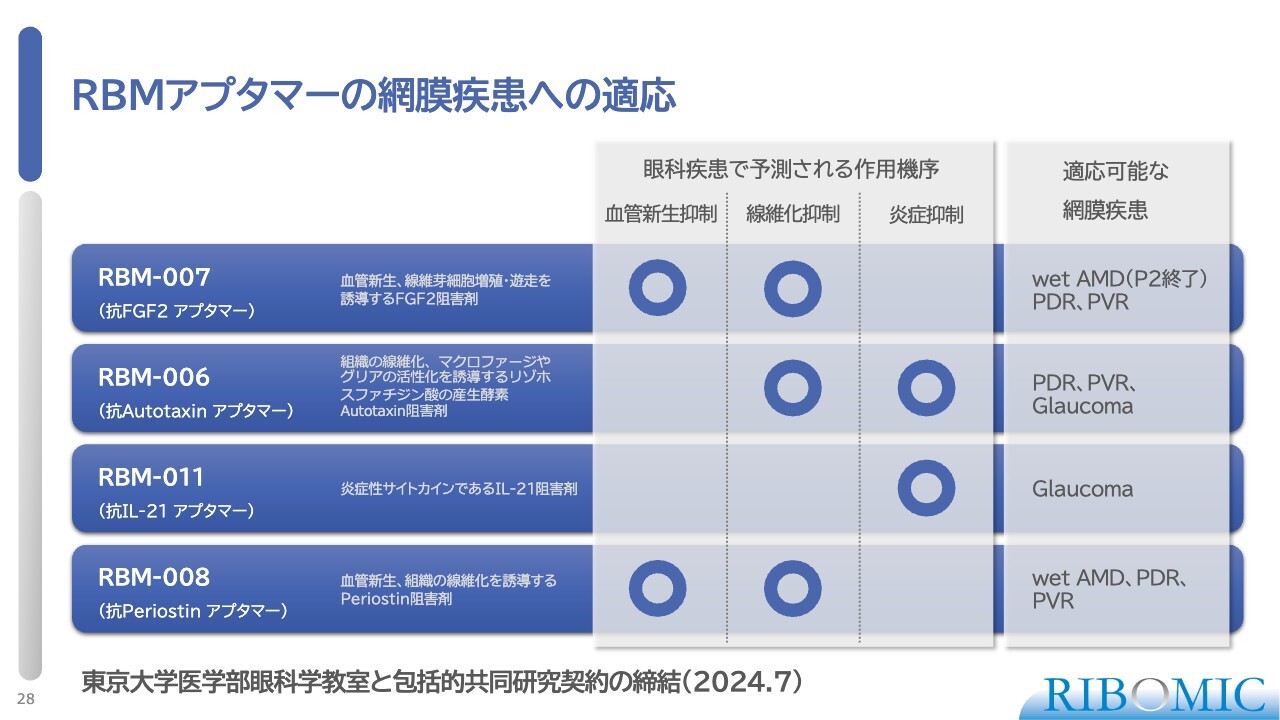
当社が保有する複数のパイプラインは、これら網膜疾患に対して非常に高い治療効果を上げる可能性があるとお伝えしています。その確認のため、2年前から東京大学医学部眼科学教室と包括的提携のもとで共同研究を進めてきました。すでに複数のポジティブなデータが確認できており、来年の決算説明の際には前向きなご報告ができると考えています。
滲出型加齢黄斑変性(wet AMD)
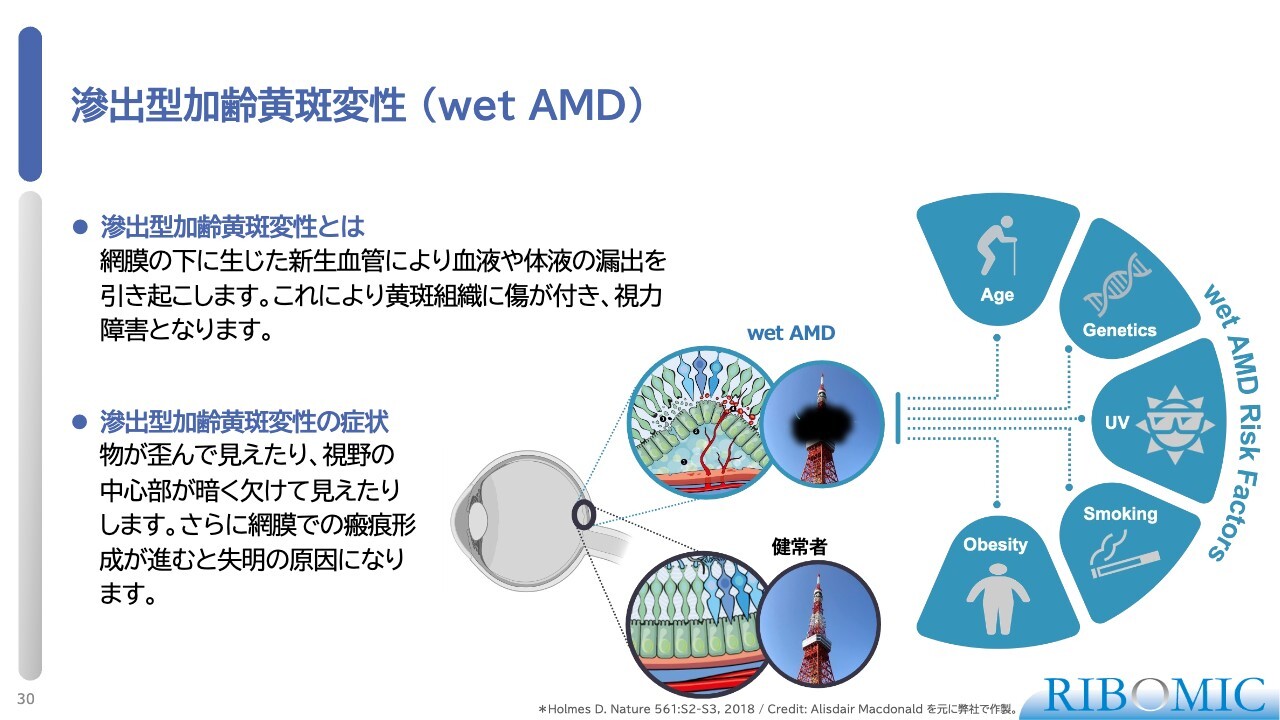
その中でも、「RBM-007」によるwet AMDに対する臨床PoCでは、大きな成果を得られました。wet AMDとは、網膜の最下層で血管新生が起こり、血液などが網膜の底にたまることで、受容体の構造を破壊し、失明につながる疾患です。
標準治療(抗VEGF薬)のUnmet Need

現在、血管新生を抑制するVEGF阻害剤「Eylea」や「Lucentis」が広く使用されており、世界では1兆5,000億円規模の市場を形成しています。しかし、「Eylea」や「Lucentis」では、網膜の奥で生じる線維化を完全に抑制できないという問題があります。
生体は傷がつくとかさぶたができるのと同様に、網膜の底でも同じ現象が起こり、線維化が進行して瘢痕が形成されます。その線維化を阻害できない点が致命的な欠陥となっているのです。
臨床試験の概要
我々の「RBM-007」は、線維化を抑制する可能性があることが、これまでの研究や臨床試験で明らかになってきています。今回、その詳細については省略します。
RBM-007 の臨床 POC(Proof of Concept)確立
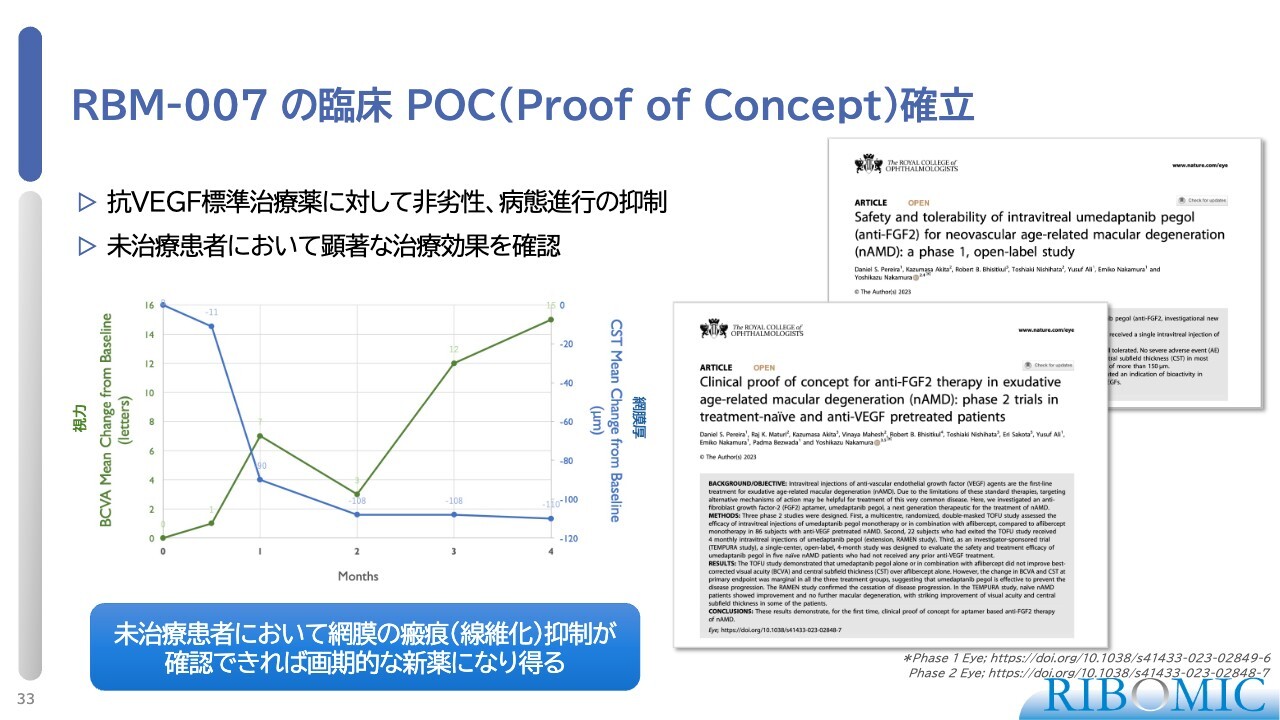
臨床試験の概要は2報の論文で報告しており、「RBM-007」はVEGF標準治療薬に対して効果が非劣性で、病態の進行を抑制すること、さらに未治療の患者さまにおいては顕著な治療効果が得られることが示されています。
スライドのグラフの緑色の線は視力を示しており、月1回の硝子体注射により視力の回復が見られ、読める文字数が増加しています。青色の線は網膜の底部の腫れを示していて、顕著な改善が示されています。
本試験は医師主導治験で、5名の患者さまが参加され、そのうち4名には瘢痕形成が認められないという、VEGFとは異なるデータが得られました。この結果を踏まえ、「RBM-007」のプログラムを進めていきたいと考えています。そのために、開発面および資金面でのパートナーが必要です。
今後の計画:提携実現と承認申請のための臨床試験の実施
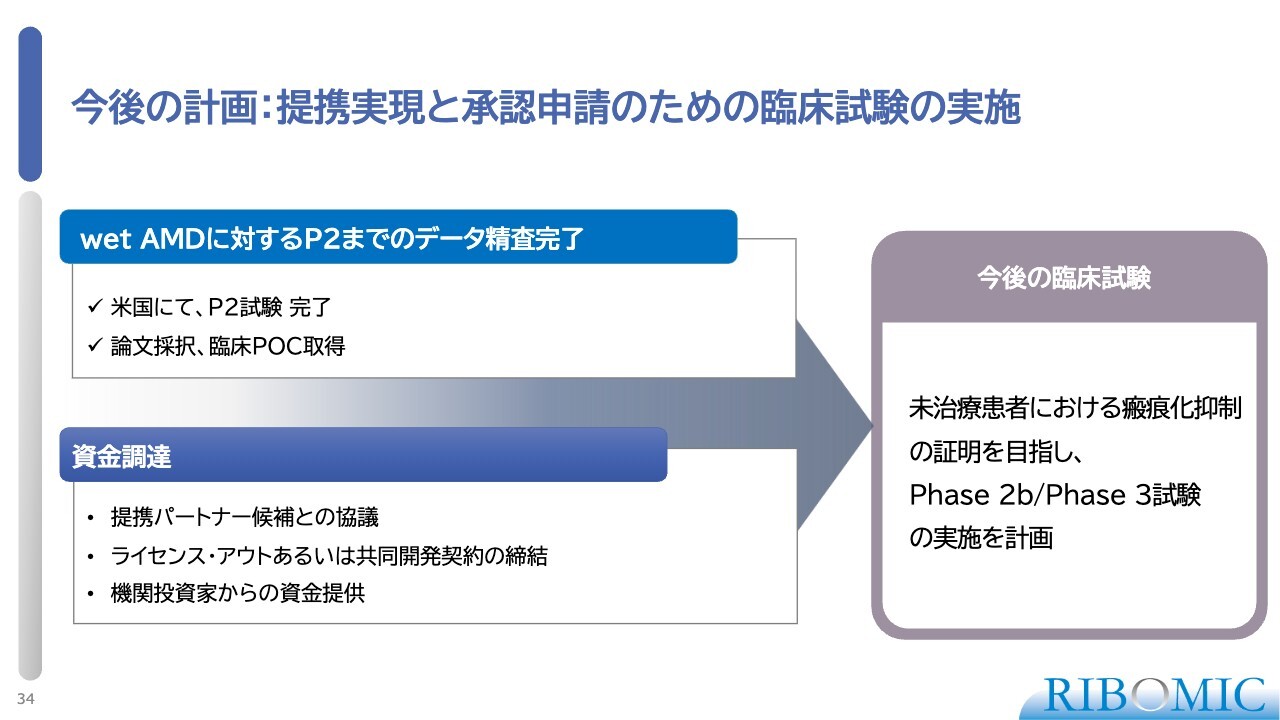
また、「RBM-007」の硝子体注射による効果が確認されたことから、本薬剤の適応拡大と応用を進める戦略も、今後の方針として検討しています。
糖尿病黄斑浮腫(DME, Diabetic Macular Edema)
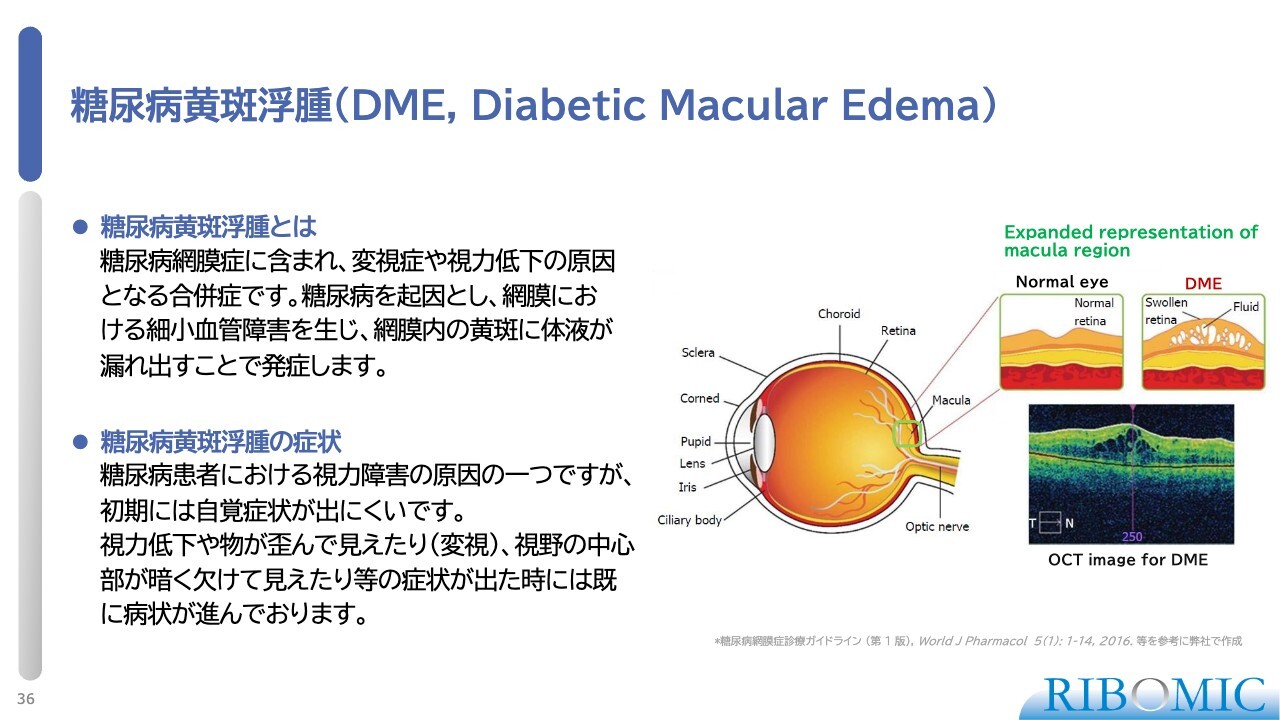
「RBM-007」のDMEへの応用について、当社ではこれまで動物実験を行い、非常に良好な成績を得ました。
スライドの写真にも示されているように、DMEは浮腫、つまり腫れが生じる疾患です。先ほどのwet AMDは網膜の最下層部で腫れが発生し、血液などが溜まる病気ですが、DMEは糖尿病患者由来の疾患で、網膜のもっとも表層部分に浮腫が生じます。そのため、発症のメカニズムが多少異なります。
DMEは患者数が非常に多く、まだ有効な治療薬が存在しません。現在はVEGF阻害剤が使用されていますが、効果があるのは患者さまの約半数という状況です。そのため、当社は「RBM-007」をwet AMDではなくDMEへ展開することも検討しています。
糖尿病網膜症モデルマウスにおける薬理試験
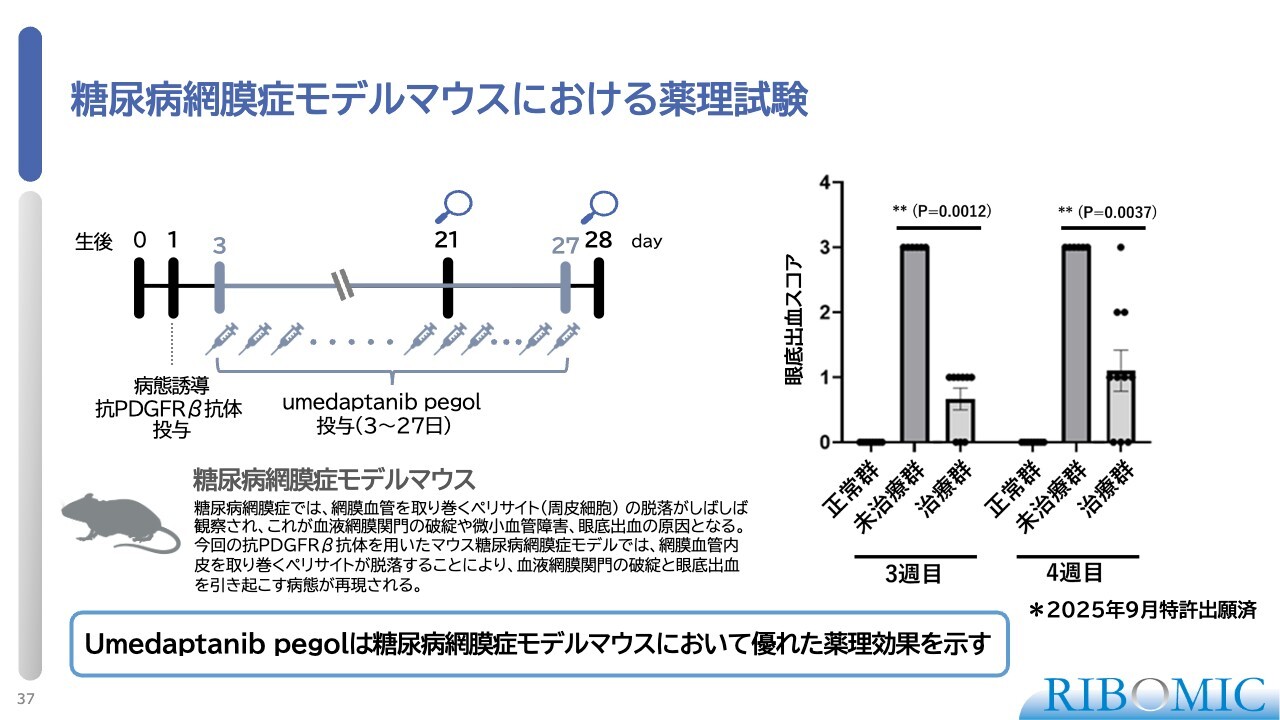
マウスを使った糖尿病網膜症の病態モデルにおける薬理試験です。糖尿病になると、本来網膜の血管を覆って保護しているペリサイトという細胞が剥がれ、血管が表出してさまざまな異常が起こることが知られています。
生後間もないマウスに対して、ペリサイトに作用するPDGFRβ抗体を注射し、病態を誘導して人為的にペリサイトを剥がした状態を作りました。その後、「RBM-007」を継続的に投与し、最終的に発生する眼底出血の頻度を測定することで薬効を調べました。結果として、「RBM-007」によって眼底出血スコアが著しく抑制されることが確認されました。
このモデルは非常にシビアな病態条件を再現しており、ここまでの効果が得られたことは非常に良好で貴重な結果といえます。この成果をもって、当社は「RBM-007」を網膜疾患としてwet AMDおよびDMEに適用できる可能性を得たと考えています。
新規DDSアプタマー技術開発の進捗
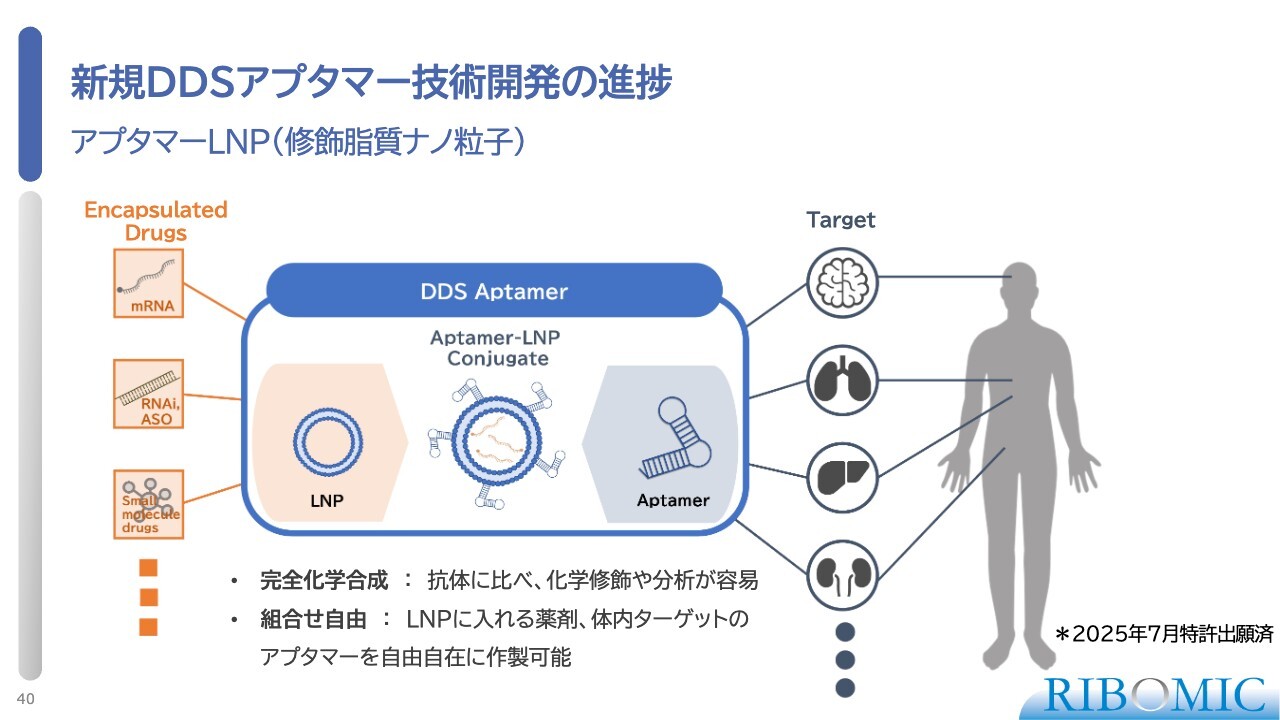
次世代アプタマーについてお話しします。当社が現在注力しているのは、DDS(薬物送達システム)の開発です。この技術は、脂質ナノ粒子(LNP)を器として、その表面に目的の臓器の受容体(レセプター)を標的とするアプタマーを結合させることで、さまざまな臓器に薬剤を届ける技術です。
抗トランスフェリン受容体1(TfR1)アプタマー修飾 LNP in vivo 試験
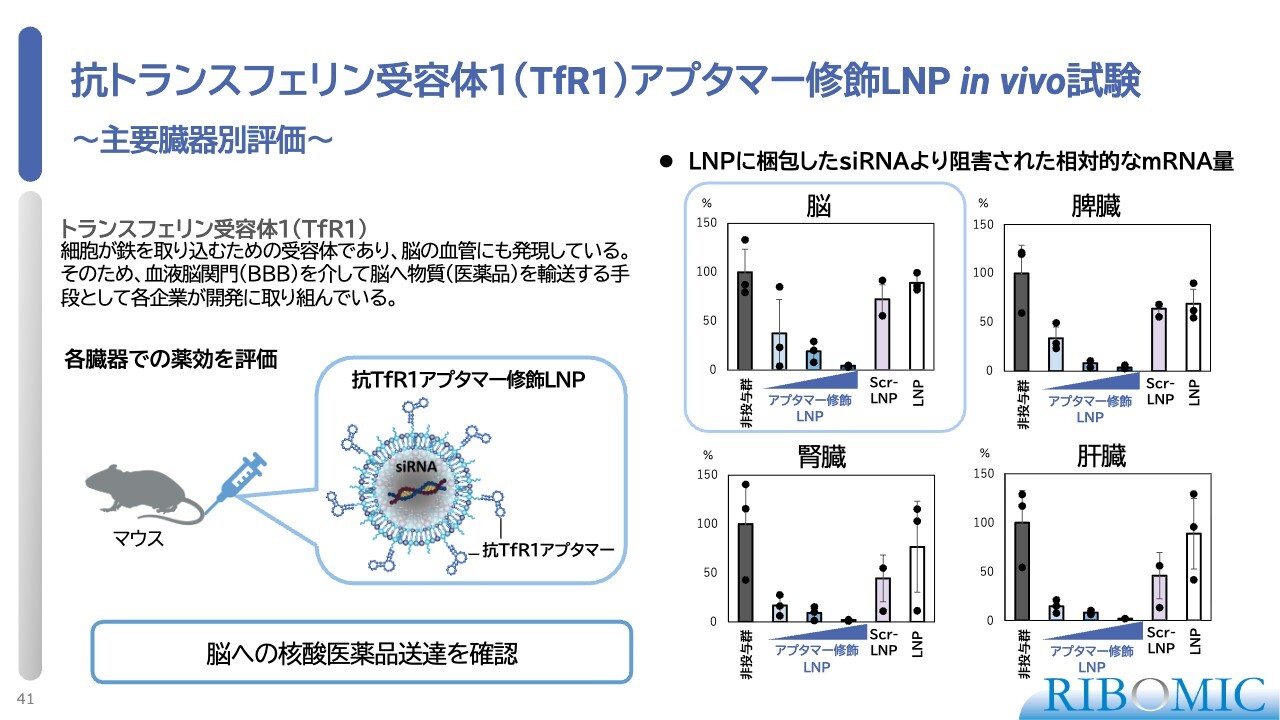
脳に薬剤を運ぶために、トランスフェリンレセプターを標的とするアプタマーをLNP表面に装着し、マウスの尾静脈に注射する動物実験を実施しました。その結果、各臓器に到達したLNP内のsiRNAが機能し、mRNA量が濃度依存的に低下することが確認されました。また、脾臓や腎臓などでも、期待通り機能していることが明らかとなりました。
抗トランスフェリン受容体1(TfR1)アプタマー修飾 LNP in vivo 試験
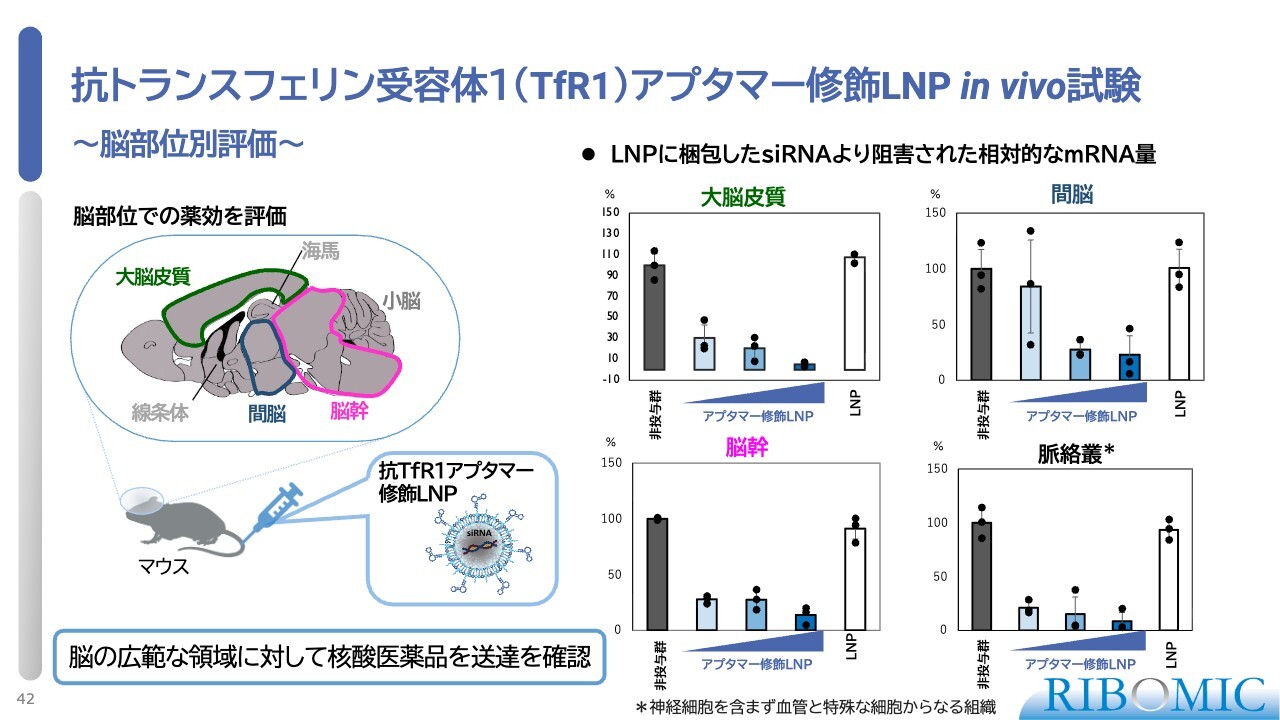
現在、注目を集めている脳における効果についてです。脳のマイクロ切片を用いて各所での抑制効果を確認した結果、アプタマー修飾LNPの濃度に依存して効果が減少し、封入されたsiRNAが確実に機能していることが明らかになりました。
この画期的なデータを日本核酸医薬学会で発表して以来、多くの企業から引き合いがあり、現在複数の企業と提携に向けた協議を進めています。
既存の脳への送達技術として、JCRファーマの「JCR-Brain Cargo」が世界中で広く使われ始めています。しかし、この最大の課題は核酸を的確に送達できない点です。一方、当社のシステムは核酸を適材適所に送達できる点が大きな強みで、この点に多数の企業が注目しています。
現在の交渉状況を踏まえると、間もなく提携について公表できる可能性が高いと期待しています。
当社主要パイプラインの進捗と市場規模
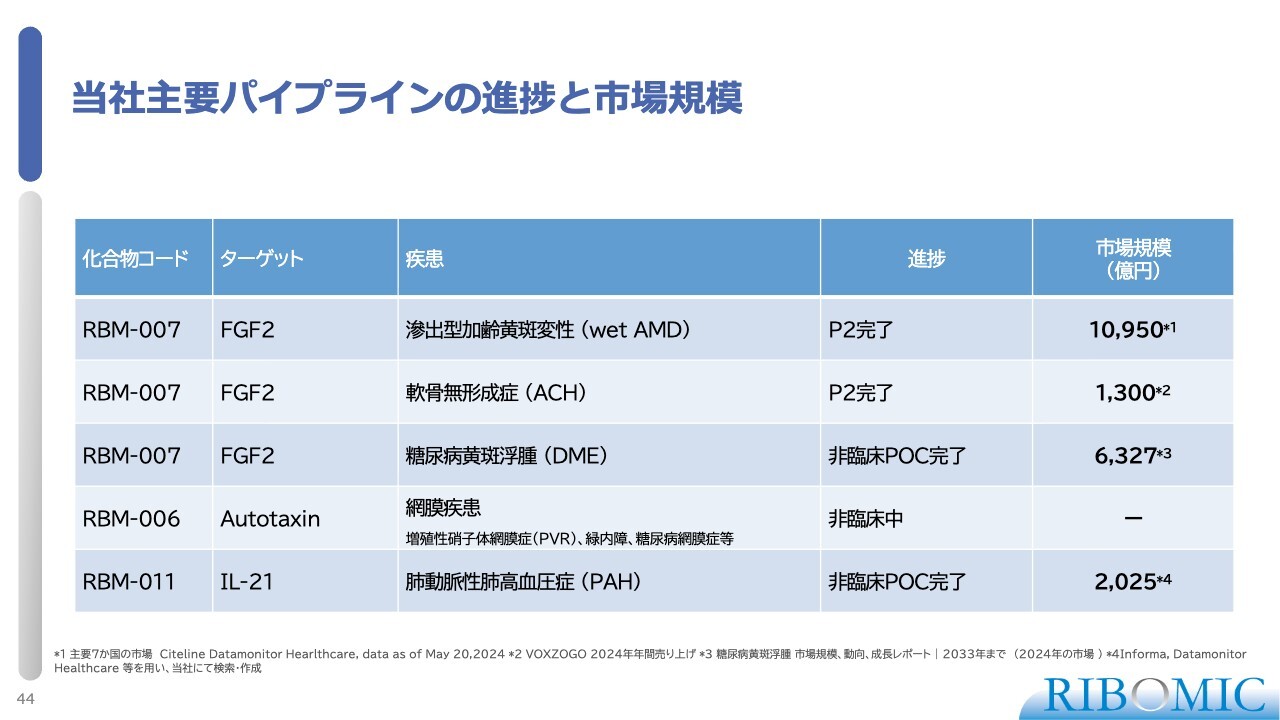
市場性においては、DMEが新たに適応として加わることで、マーケットが大きく拡大しています。
世界におけるACH治療薬の市場
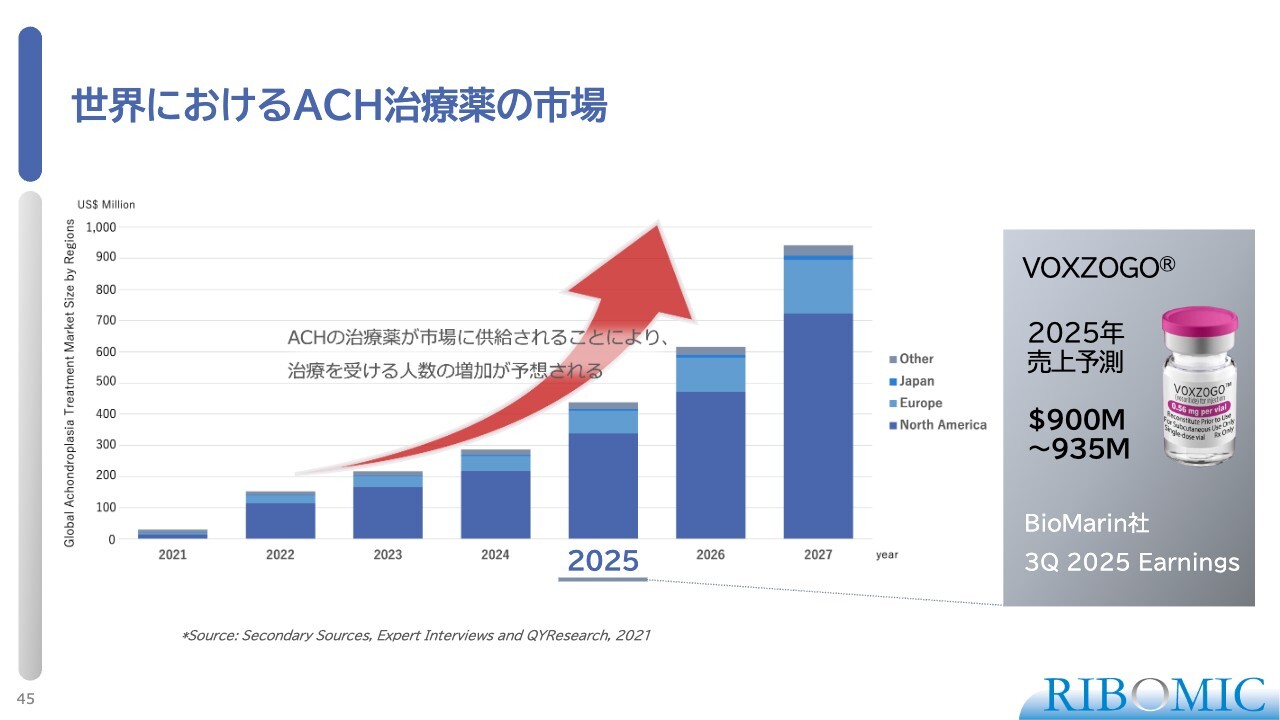
特にACHの市場では、2022年に「VOXZOGO」が上市されて以降、販売量が急増しています。今年は約1,400億円、日本市場では約100億円の売上が見込まれます。当社の薬剤は、この市場において「VOXZOGO」と競合または共存できるという特徴があり、大きな発展性があると考えています。
ACH治療薬の適応拡大と市場規模拡大
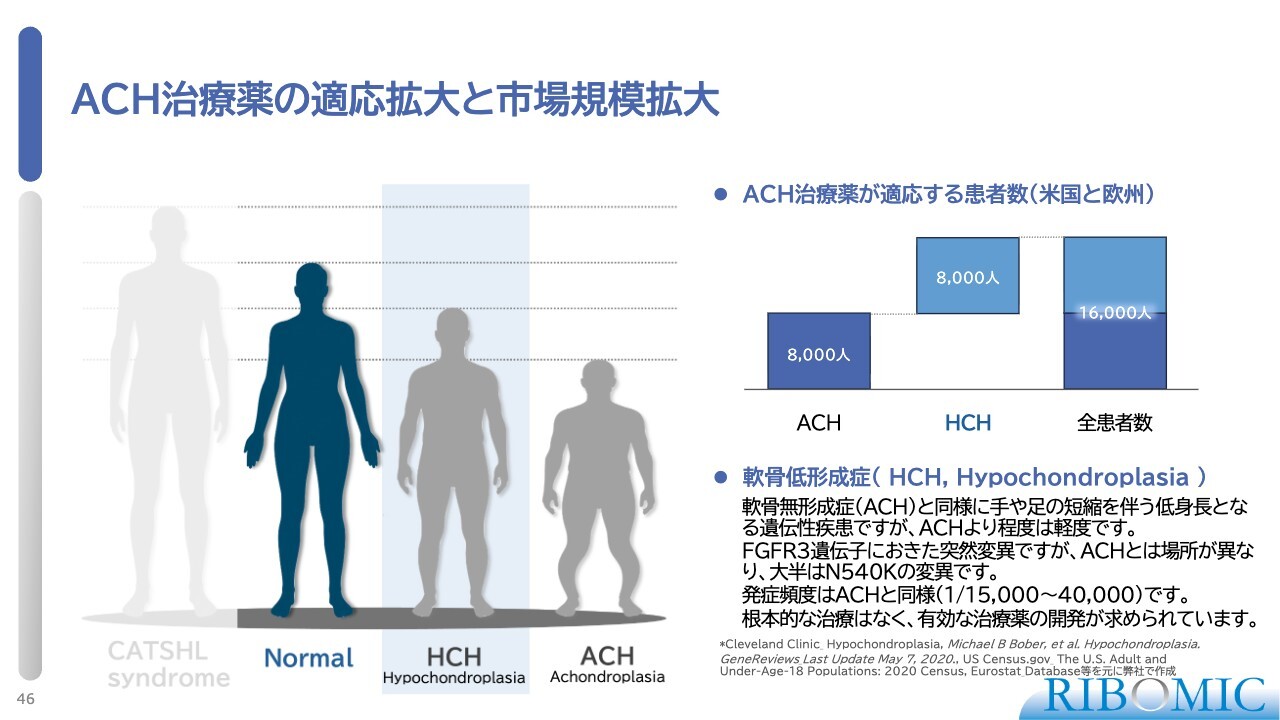
さらに、ACH治療薬は、軟骨無形成症だけでなく低身長となる軟骨低形成症にも適応が拡大できるため、市場のさらなる拡大が期待されます。
世界におけるwet AMDの市場
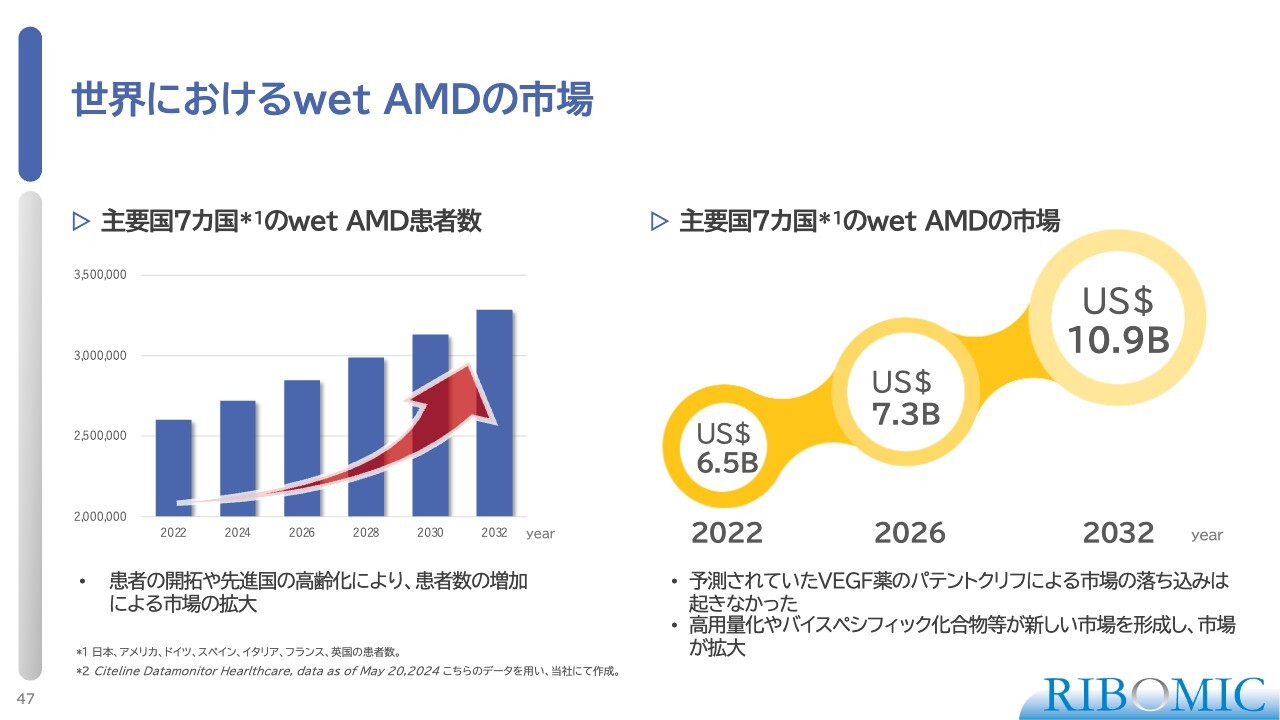
wet AMDについては、高齢化の進行に伴い市場規模が拡大してきています。
世界におけるDMEの市場
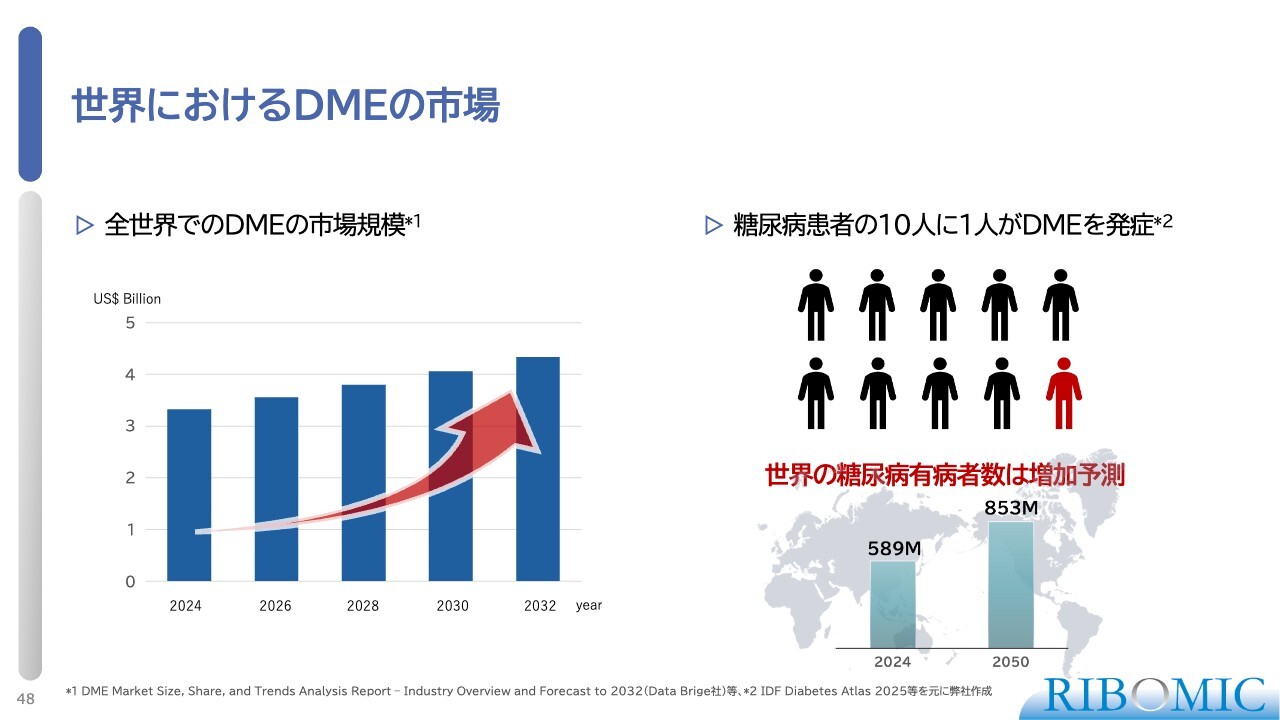
糖尿病患者数は世界的に増加傾向にあり、その中で1割から2割の患者がDMEを発症するとされています。このため、DMEはすでに5,000億円規模の世界市場となっています。
今後さらなる増加が予測される中で、現在も糖尿病網膜症やDMEには有効な薬剤がない状況です。そのため、当社は本開発を推進していきたいと考えています。
公的研究助成金

決算についてご説明します。2025年は4,500万円程度の公的研究助成金を受けています。
損益計算書の概要
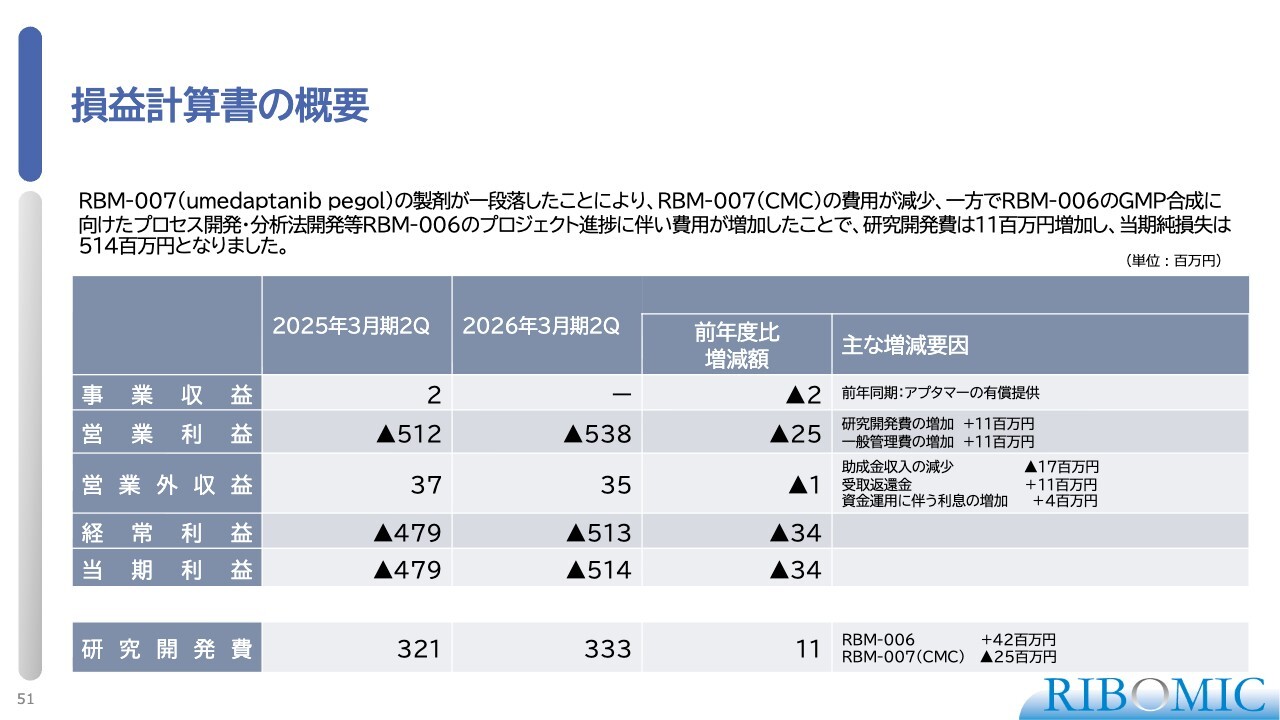
損益計算書の概要です。「RBM-007」の製剤が一段落し、同プロジェクトの費用が減少しています。一方で、「RBM-006」のAutotaxinに対するアプタマーのGMP合成および製剤化に資金を投入しています。
現状を踏まえると、2026年の最初の決算期には「RBM-006」についてより詳しい内容をお話しできると考えています。現在は、次のステップに向けた準備を整えている段階です。
貸借対照表の概要
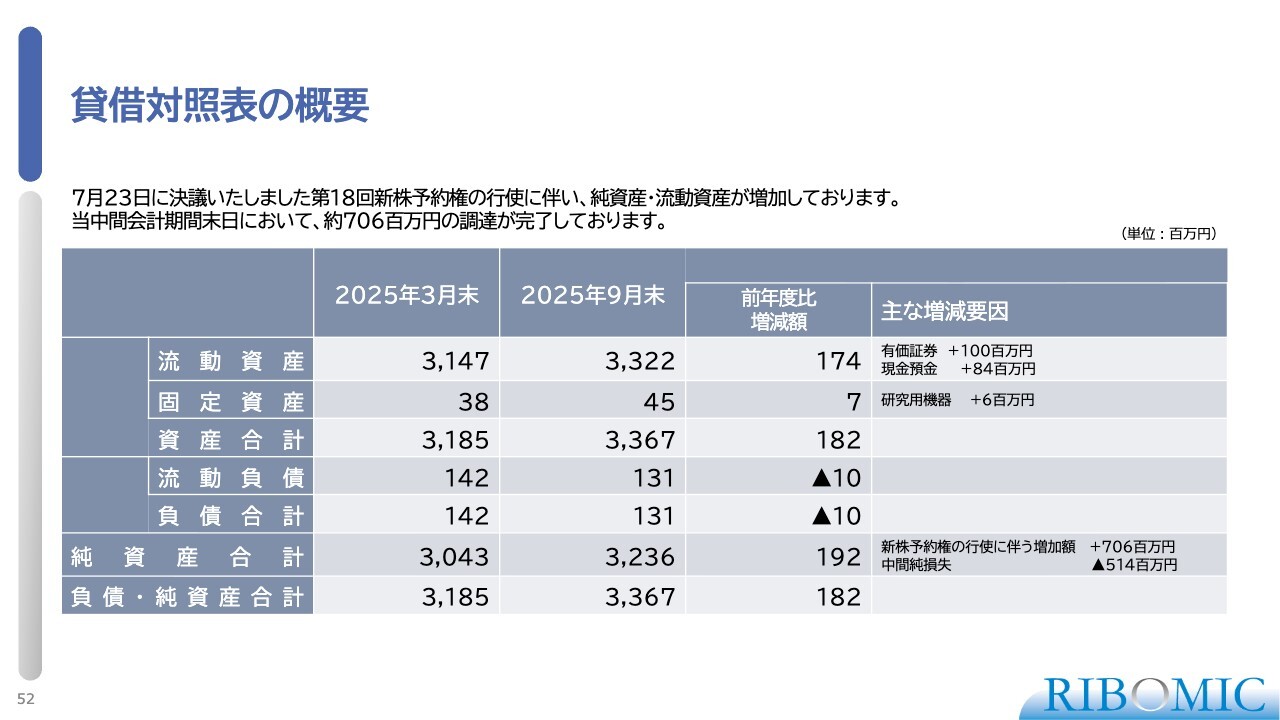
貸借対照表です。現在、33億円強の現金を手元に保有しています。
資金調達

資金調達については、第三者割当による第18回新株予約権の72パーセントから73パーセントが権利行使済みで、700万株を発行し約7億円を調達しています。残りについても近いうちに完了する見通しで、調達資金はすべてACHの第3相臨床試験費用に充当する予定です。
新着ログ
「医薬品」のログ