【QAあり】Chordia Therapeutics、研究開発へ先行投資で現預金減少 rogocekibは希少疾病用医薬品指定
当社は武田薬品工業からスピンアウトした低分子抗がん薬創薬企業

三宅洋氏(以下、三宅):Chordia Therapeutics代表取締役三宅洋と申します。本日はお忙しい中、ご視聴いただき誠にありがとうございます。
さっそくですが、2025年8月期中間決算のご説明を開始します。
まず、会社概況をご紹介します。私たちChordia Therapeuticsは、武田薬品工業株式会社からスピンアウトし、2017年10月に創業しました。
現時点での従業員数は21名で、その半分ほどが博士号の学位を有している専門性の高い少数精鋭のグループです。
昨年6月には、東京証券取引所グロース市場に上場しました。証券コードは190Aです。
現在の筆頭株主は、私たちの出身母体である武田薬品工業株式会社で、約15パーセントのシェアです。
臨床POCを確立したパイプラインをもとに高利益なビジネスを目指す
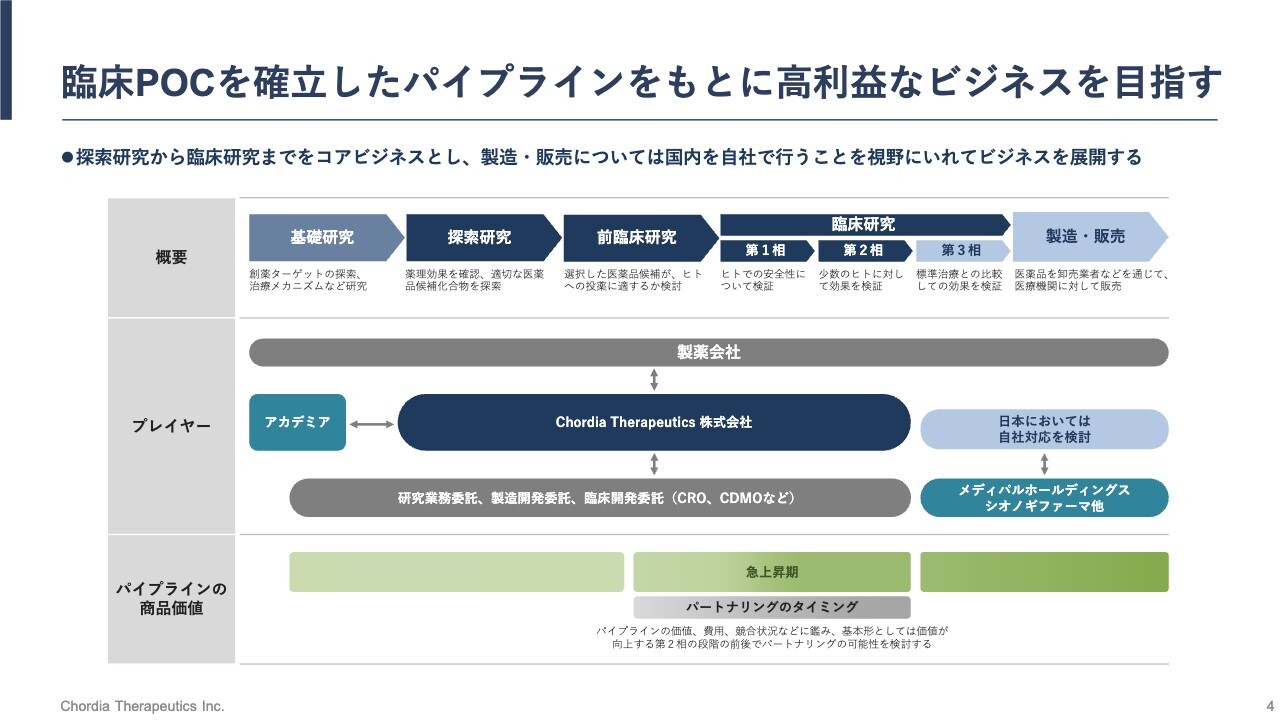
私たちは低分子の新しい抗がん薬の創出にチャレンジしている会社です。新しい薬の開発には、非常に長い年月と多額の先行投資が必要です。
スライドには、新薬を生み出す過程をまとめました。基礎研究、つまり主に大学で行われる科学研究から始まり、探索研究、前臨床研究と続きますが、ここまでが研究室での研究となります。いわゆる試験管での研究や動物での研究です。その後、実際に患者さまに治験薬を投与する臨床試験が始まります。
第1相、第2相、第3相と段階を踏み、より多くの患者さまに治験薬を飲んでいただき、安全性と有効性を検討します。その後、規制当局からの承認を経て、ようやく市場で販売することができます。そのため、新しい薬を作るには、10年から20年ほどの期間がかかると言われています。
私たちChordia Therapeuticsは、この長い新薬の研究開発の過程において、だいたい中流の過程を自社で行うことを想定しており、探索研究から第2相臨床試験程度まで自社で行うつもりです。
私たちが注力している開発は、がんの中でも患者さまの数が相対的に少ない希少がんです。希少がんの新薬を開発する場合、第2相臨床試験の成績をもって規制当局から条件付きの迅速承認が出されることが多いため、希少がんに対しては第2相臨床試験まで自社で手がけることを前提としています。
このように開発するパイプラインの価値を最大化し、会社を成長させたいと考えています。
また、販売ステージに入る際には、我々は少なくとも国内において、自社で製造と販売をリードする計画があります。それにより、研究・開発から製造・販売まで自社で手がける製薬会社に成長させることが当社のビジョンです。
製造・販売については、すべてを自社のリソースで行うわけではなく、戦略的な事業提携先であるメディパルホールディングスやシオノギファーマの力を借りながら、自社でリードしていくことが前提となっています。
海外での販売権に関しては、海外メーカーに導出することが前提です。
投資家株主が社外取締役に就任

昨年11月に、当社は上場後初めての株主総会を開催しました。その株主総会において、投資家株主である中村学氏の社外取締役就任が承認されています。新生キャピタルパートナーズを率いる中村氏は、上場前、上場時にも出資していただいたクロスオーバー投資家です。
このような投資家が我々の経営陣、取締役会に参加することにより、従前以上に株主さまの利益に配慮した経営を進めていきたいと考えています。
2025年8月期 第2四半期(中間期)の財政状態(貸借対照表)
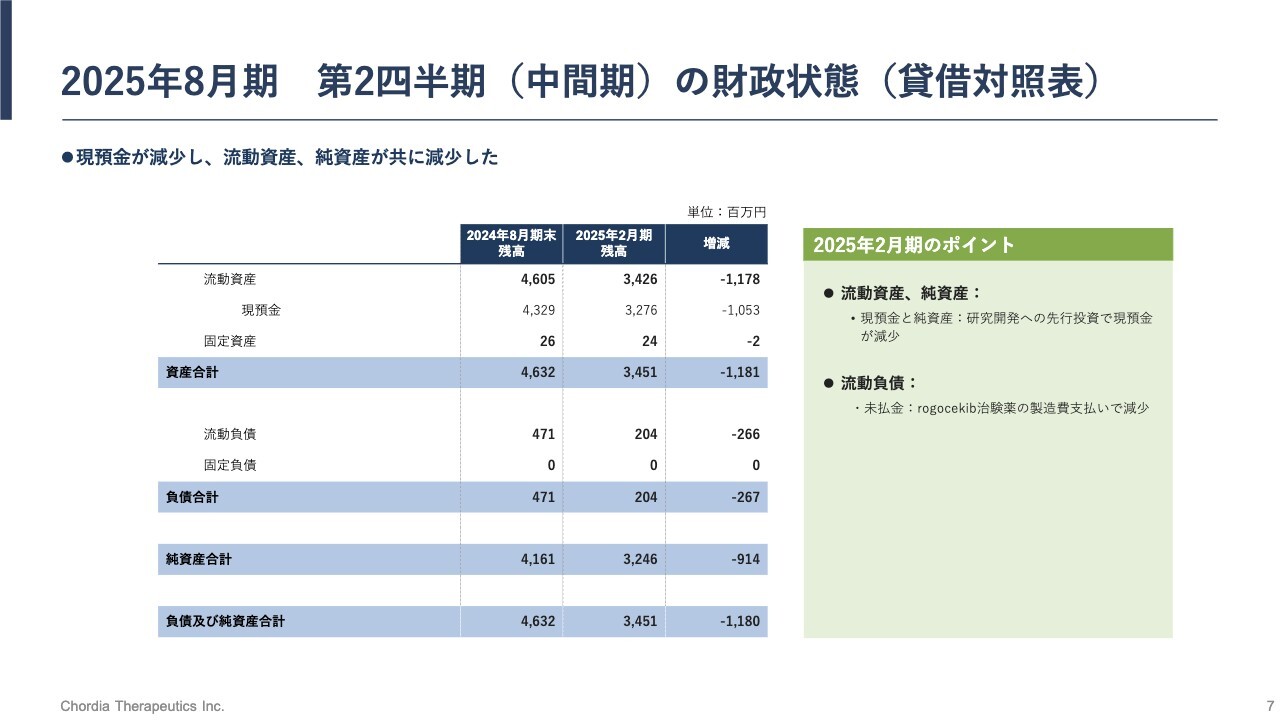
2025年8月期第2四半期の業績です。まず、バランスシートです。
資産合計は2月末において34億5,100万円でした。こちらは前期期末の資産合計である46億3,200万円と比較して、11億8,100万円の減少となっています。これは現預金の減少が主な理由です。
当期中間期末の現預金は32億7,600万円です。こちらは期末の43億2,900万円と比較して、10億5,300万円の減少となっています。
これについては研究開発費に使ったことが背景にあります。また、この現預金は、この先1年半程度の研究開発の源となります。
負債については流動負債が減少し、当中間期末で2億400万円です。前期末と比較すると2億6,700万円減少していますが、こちらは未払金の減少が理由です。
当社のリードパイプライン「rogocekib」の治験薬を製造するための費用はこちらで払っており、流動負債の減少となっています。
純資産合計は、当中間期末で32億4,600万円です。前期末の41億6,100万円と比較すると、9億1,400万円減少しています。
2025年8月期 第2四半期(中間期)の業績(損益計算書)
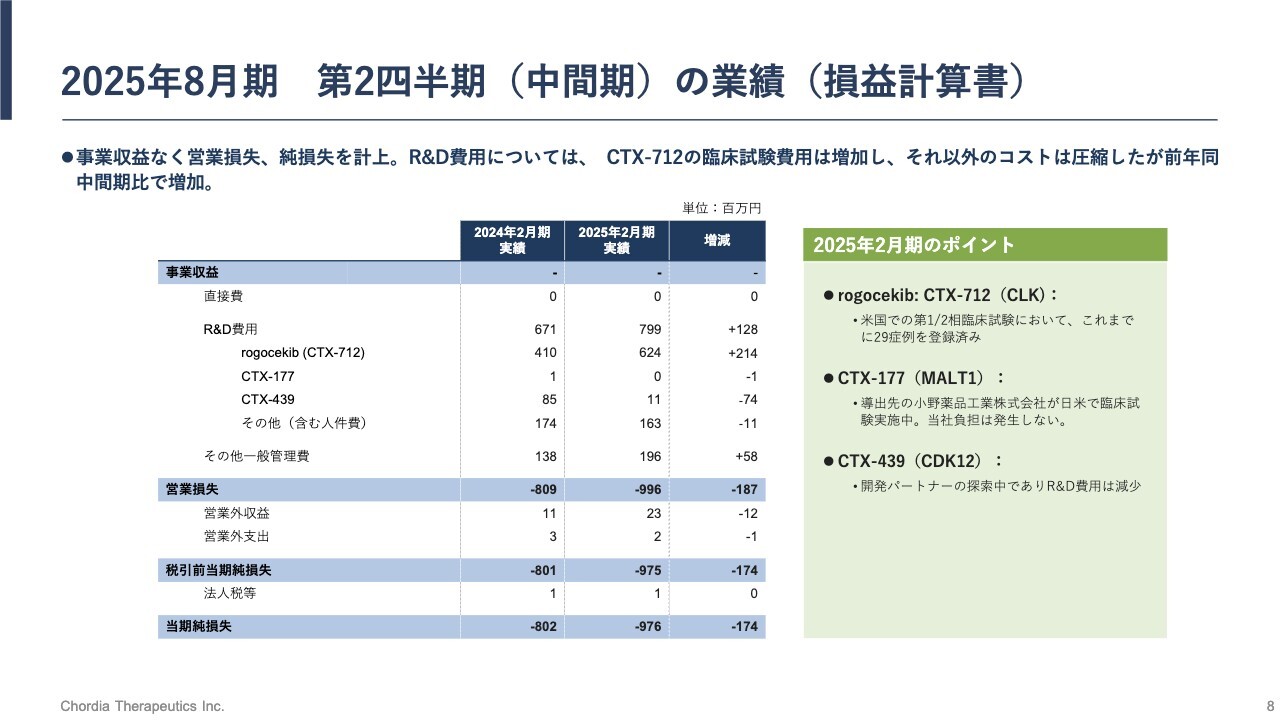
損益計算書についてです。事業収益はありません。研究開発費用は、当中間期末で7億9,900万円を計上しており、前年同中間期と比較すると1億2,800万円の増加です。
内訳としては、リードパイプライン「rogocekib」の研究開発費に現在集中しています。その他のパイプラインの研究開発費が減少していますが、トータルで研究開発費は増加しています。
「rogocekib」の研究開発費については、当中間期末で6億2,400万円を使い、当期の損失は9億7,600万円となっています。
5つのパイプラインのうち、2つは臨床ステージ

パイプラインの進捗状況についてです。当社は、5つの低分子化合物のパイプラインを有しています。そのうち2つが臨床試験ステージで、いわゆる臨床ステージのバイオテックカンパニーです。
リードパイプライン「rogocekib」は、国際一般名称を使っていますが、この名前はWHOから使用を許可されています。後ほど名前の由来についてもご紹介したいと考えています。
「rogocekib」は、戦略的に全世界での全権利を自社に留保して、当社が臨床試験を実施しています。
日本での第1相臨床試験を終え、現在は米国において、再発難治となった急性骨髄性白血病の患者さまに第1/2相臨床試験を実施しているところです。
一方で、2号パイプラインは、前臨床ステージにおいて、小野薬品工業株式会社に全世界での全権利を2020年12月に導出しています。現在、小野薬品工業において、米国で再発難治となったリンパ腫を対象とした第1相臨床試験が進行中です。
3号、4号、5号パイプラインは、すべて前臨床ステージにあるパイプラインです。戦略的に現在の社内リソースを1号パイプライン「rogocekib」に集中させている状況です。
ただし、3号と4号パイプラインは、前臨床ステージではありますが、社外のパートナーの力を借りて研究と開発を進めていくことを前提にしており、現在、積極的に事業開発活動を行っています。
3号と4号パイプラインの内容については、今までご紹介する機会があまりなかったのですが、この説明会の最後にご紹介したいと思います。
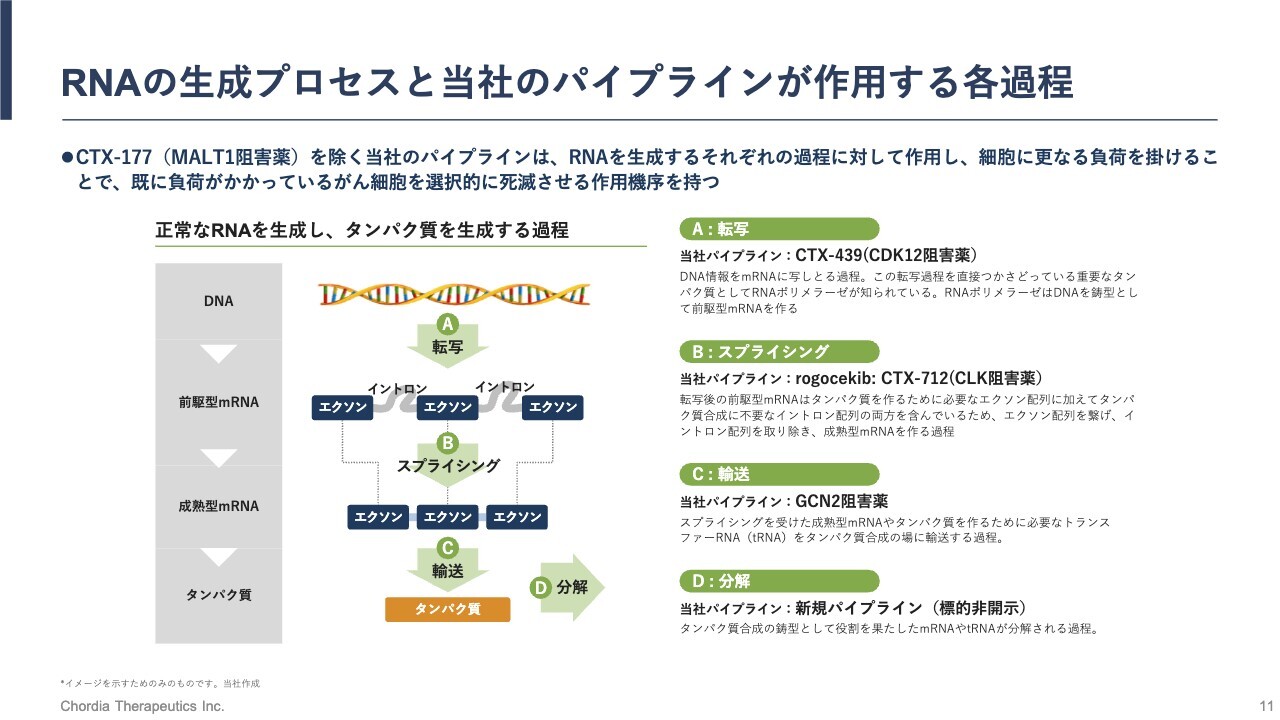
RNAの生成プロセスと当社のパイプラインが作用する各過程
1号パイプラインの作用機作と、3号と4号パイプラインについても簡単に説明したいと思います。
スライドの図は、当社が注力しているRNAが生成する過程を示しています。このRNAを生成する過程の一部が、がん細胞においては乱れており、それが原因でストレスがかかっています。
我々はよく、RNA制御ストレスを大きくすることで、がん細胞を死滅に追い込むという説明をしているのですが、そのRNA制御ストレスは、ここに示すRNAを生成する過程の異常により生じるとご理解ください。
RNAの生成過程は、大きく分けられると考えています。最初の過程が転写、続いてスプライシング、そして輸送、分解と続きます。遺伝情報はDNAという物質に記録されていますが、その情報をもとに、最終的にはタンパク質が作られます。そのタンパク質が働くことにより、人間のほとんどすべての生命現象が担われているため、非常に大切な過程です。
そのDNA上にある遺伝情報は、タンパク質になる前に一度、RNAに写し取られますが、RNAの中でもメッセンジャーRNAと呼ばれる物質に写し取られます。その反応が転写と呼ばれる反応です。
転写で遺伝情報が写し取られたメッセンジャーRNAは、成熟過程を経る必要があります。DNAから遺伝情報を写し取ったメッセンジャーRNAは、初期的には前駆体メッセンジャーRNAと呼ばれますが、タンパク質になる部分とならない部分が含まれています。
そのタンパク質にならない部分を選択的に認識し、切り出す反応がスプライシング反応というものです。
当社のリードパイプラインは、このスプライシング反応を変化させることで、RNA制御ストレスを大きくさせ、がん細胞を死滅させる働きをします。
スプライシング反応を経て成熟したメッセンジャーRNAは、タンパク質翻訳の場に輸送されてタンパク質が生み出されます。
また、役割を終えたメッセンジャーRNAは分解され、新たなRNA分子に再利用されます。これでRNAのライフサイクルが閉じるとご理解ください。
私たちの3号パイプライン、CDK12阻害薬「CTX-439」ですが、このRNAを生成する過程の最初に、転写反応を変化させることで、RNA制御ストレスを大きくします。
また、4号パイプライン、GCN2阻害薬は輸送過程に働くと位置付けています。具体的な働き方については、後ほどまた詳細にご説明します。
当社が手掛ける抗がん薬のコンセプト
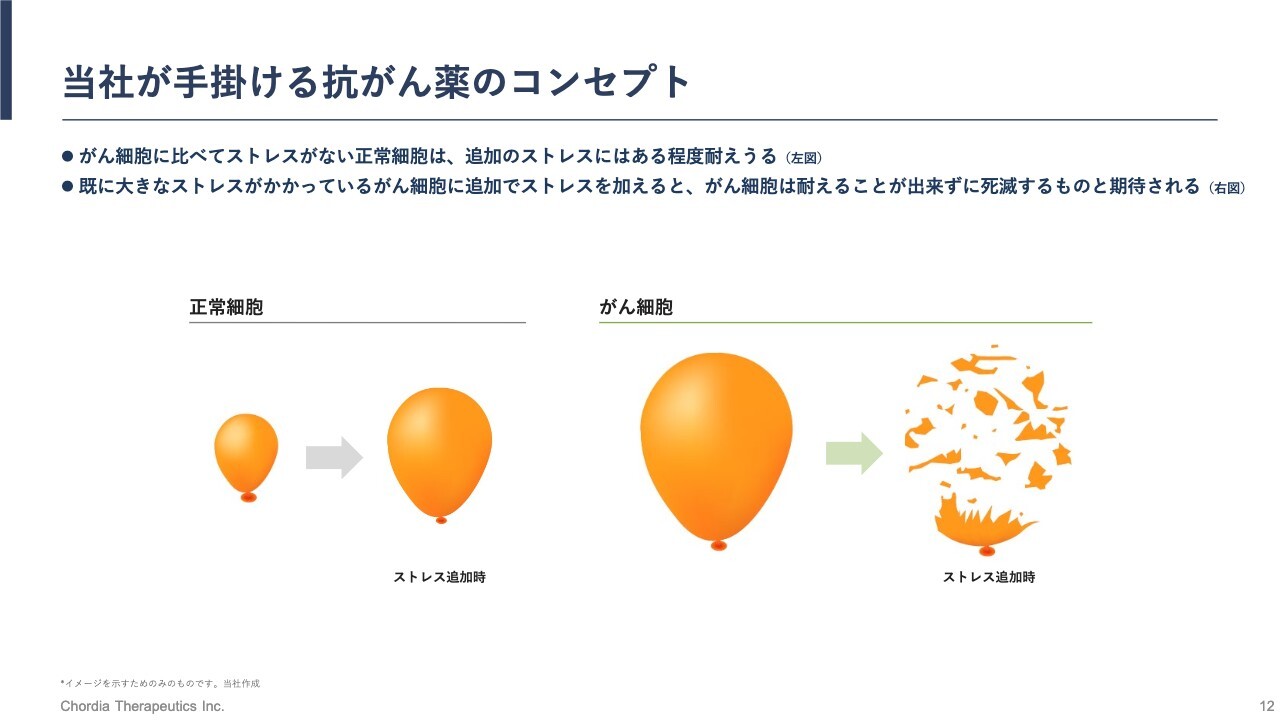
このRNA制御ストレスを大きくすることで、がん細胞を死滅に追い込みます。これについては何度か説明していますが、あらためてお話しします。
細胞はストレスを抱えていますが、特にがん細胞は大きなストレスを抱えています。どこに起因するかと言いますと、がん細胞は複数の遺伝子の変化を有しており、その変化によって、正常細胞より早く、無制限に増殖することができます。
進化論的には、がん細胞が正常細胞より優れているというのはここに起因し、そのせいで我々の体に害をなし、重篤な病気であるがんを引き起こすのです。
ただし、がん細胞はそのような複数の遺伝子の変化を有しているため、無理して生きており、大きなストレスがかかっています。そこに我々のパイプラインが追加のストレスをかけることで、それに耐えきれなくなったがん細胞が死滅していくというわけです。
イラストの風船の大きさは、細胞にかかっているストレスの大きさを示しています。がん細胞は大きな風船で、追加のストレスに耐えきれなくなり、風船が破裂するように死滅します。
一方で、正常細胞にも我々のパイプラインは作用しますが、正常細胞は通常状態でほとんどストレスはかかっていません。また、ストレス対処能力を持っており、追加のストレスがかかった場合もすぐに元の大きさに戻っていくため、がん細胞を選択的に死滅させることになります。
直近でのFDAにて承認・承認申請を行っている治療薬との比較
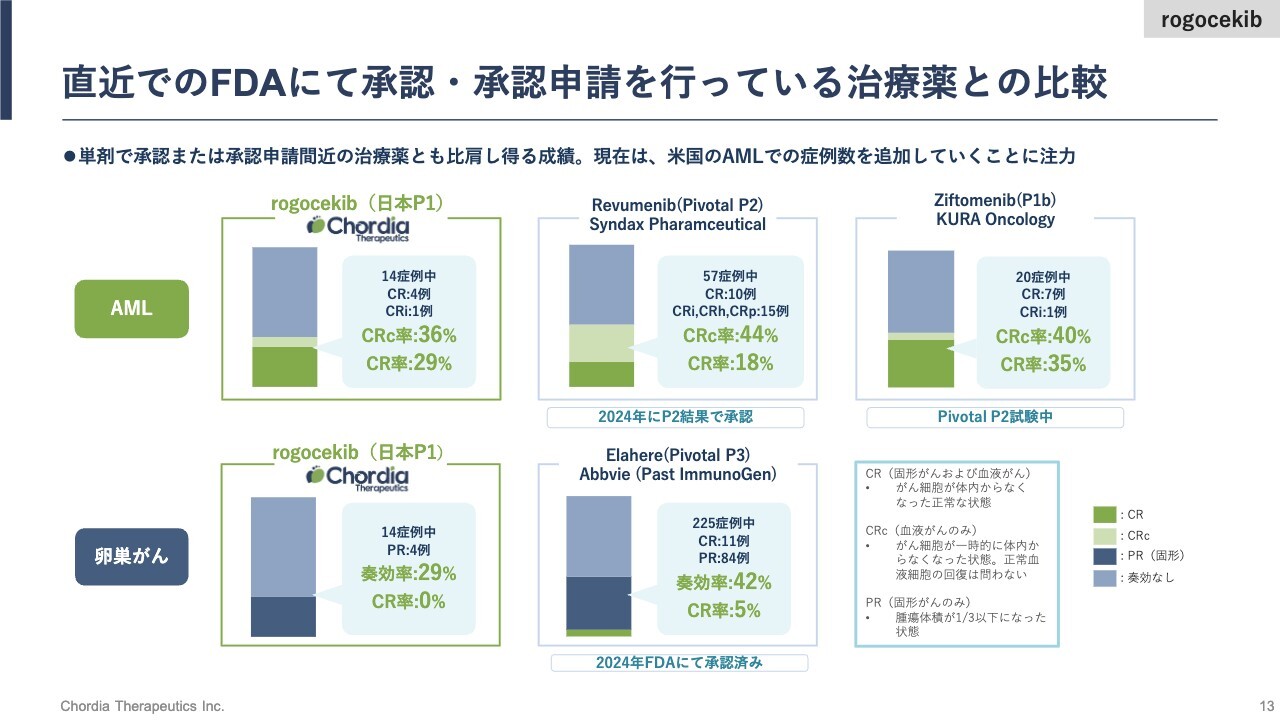
日本で実施した第1相臨床試験の成績もすでに発表済みですが、もう一度ここでご説明します。
日本で、60名の標準治療が効かなくなったがんの患者さまに「rogocekib」を飲んでいただきました。60名のうちの14名がAMLと呼ばれる血液がんです。AMLは急性骨髄性白血病の略ですが、14名が白血病の患者さま、他の14名が卵巣がんの患者さまです。
この14名の患者さまに対して「rogocekib」が有効性を示した患者さまは、白血病では5例、卵巣がんでは4例です。奏効率は、白血病は36パーセント、卵巣がんは29パーセントです。特に白血病の奏効率については、いくつかの基準がありますが、どこで切るかというところで奏効率は変わってきます。
我々が40何パーセントと言っていたのは、もう1つ異なる奏効を示した患者さまを加えた数で、ここは、直近で米国の規制当局であるFDAから承認を受けたお薬の臨床試験の成績と横並びに比較するため、奏功率のスレッシュホールドを今までの発表と変えて、ご説明しています。
例えばスライド上段の真ん中をご覧ください。Syndax社というナスダックに上場している米国のバイオテックカンパニーが、AML治療薬として昨年末にFDAから第2相臨床試験の成績を持って承認を得ています。その時の成績です。
奏功率44パーセントという数字は、我々の「rogocekib」が日本の第1相臨床試験で示した成績とだいたい同レベルだと理解しています。
KURA Oncology社もAMLを対象に、第2相臨床試験を実施しているところです。現在、協和キリン株式会社が全世界での権利を獲得していますが、契約一時金が日本円で約500億円という大きな契約です。
KURA Oncology社は我々より1年から2年先を進んでいる会社ですが、第2相臨床試験の成績が良ければ、これくらいの価値がついてくるという良い例です。
ちなみにSyndax社、KURA社はメニン阻害薬を開発しており、我々の「rogocekib」はCLKというタンパク質の機能を阻害するCLK阻害薬のため、直接の競合にはならないと考えています。しかし、AMLの治療薬で承認を取った会社、また大きなディールをした会社があるということだけご報告します。
卵巣がんについても、直近では1兆円を超えるバリューでAbbvie社に買収された米国のImmunoGen社が、2024年にFDAから第3相試験の成績を持って完全承認を獲得しています。
その完全承認の前は、第2相臨床試験の成績で迅速承認を獲得していますが、こちらも奏効率42パーセントで、「rogocekib」が日本の試験で示した奏効率29パーセントと比べるとトントンの成績だと評価しています。
日本において実施した第1相臨床試験において、なかなか期待のできる奏功率が得られたと考えています。
特に急性骨髄性白血病での奏功率が高いと分析しており、現在は米国において第1/2相臨床試験を、主に再発難治となった急性骨髄性白血病の患者さまを対象に実施しているところです。
その進捗状況については、短信および半期報告書で紹介していますが、この3ヶ月で4例の追加症例登録があり、合計でこれまでに29症例の患者さまに対して投薬を行いました。
CTX-712の国際一般名称はrogocekibに決定

リードパイプライン「rogocekib」の国際一般名称の由来についてご紹介します。医薬品国際一般名称は、英語でINN(International Nonproprietary Name)と訳されます。医薬品国際一般名称をつけるにはWHOに使用許可を得る必要があります。この手続きはあまり知られていないかもしれませんが、2年程度の長い期間を要することとなります。
そのため、当社は日本での第1相臨床試験の成績がまずまずであることが見えてきたタイミングで、いち早く手続きを開始し、ようやく昨年年末に医薬品国際一般名称がつきました。
「rogocekib」の冒頭のRはRNAです。当社が注力しているRNA制御ストレスのRを取っています。そして「cekib」のCはCLKです。今後、CLK阻害薬、低分子のCLKのキナーゼ阻害薬には、この「cekib」が語尾として使われることになると理解しています。
また、「rogo」という単語は、RとGをOで挟んでおり、スプライシングのタンパク質になる部分とならない部分が交互に現れてくるところをイメージしています。このようにして、「rogocekib」という名前をつけました。
当初予定通りに米国での希少疾病用医薬品指定を受領

続いて、今年の年初に米国の規制当局であるFDAから、希少疾病用医薬品の指定、Orphan Drug Designationを受けたことについてご報告します。
希少疾病用医薬品指定を受けるメリットとしては、スライドにまとめたとおりです。承認申請時の手数料の免除や、承認後最長7年間のデータ保護があります。これにより、独占的な販売を行うことができます。
また、使用した開発費に対する税制優遇もあります。「rogocekib」の権利は海外メーカーへ導出することを前提としており、今後米国企業等に導出した場合、希少疾病用医薬品指定を受けていることが評価されると考えています。この希少疾病用医薬品への指定は、「rogocekib」の価値の最大化に大きく貢献すると期待しています。
参考)FDA Guidance Project Optimusの概要

現在、当社が米国で実施している第1/2相臨床試験はプロトコル改訂を行っています。そのため、開発のタイムラインが若干遅れていると前年期末の決算説明会でご説明しました。
「FDAのProject Optimusというガイダンスに沿ってのプロトコル改訂」とご説明していましたが、そもそも、Project Optimusが何かということを今までお伝えしたことがなかったため、この場で簡単にご説明します。
Project Optimusは「用法用量の設定について、第1相臨床試験で、より幅広く検討してください」というFDAの考えを示したものです。
背景には、これまで抗がん薬の領域において分子標的薬というものが複数承認されていますが、承認後、実臨床の現場で使われる際に、承認された用法や用量では使い切れないケースが多々見受けられたということがあります。
したがって、承認された薬の用法や用量が十分に検討された上で最適とされたのか、少し疑問視される状況があったようです。それを踏まえて、FDAから「臨床試験の早期からもう少し幅広く用法と用量を検討しなさい」という考えが示されたわけです。
ただし、Project Optimusはガイダンスであり、ガイドラインではありません。ガイドラインですと「何をどうしなさい」ときっちり定められるのですが、ガイダンスというのは「幅広く検討しなさい」と考えが示されるだけです。
そのため、Project Optimusのガイダンスが発行されたのはもう数年前になりますが、米国や世界中の抗がん薬を開発する企業がこのガイダンスを実際の臨床試験にどう入れ込むか、あまり明らかになっておらず、最近ようやく実例が出てきているという状況です。
当社としては、米国のコンサルタントを採用し、彼が集めてきた情報やアドバイスをきっちりと踏まえながら、Project Optimusに対応するかたちでプロトコル改訂を行っています。
Project Optimusの主たる内容としては、スライド左側にありますように、科学的で統合的な用法用量の設定の重要性が謳われています。臨床試験で幅広い用法用量の検討を行うとともに、PK(薬物動態)、PD(薬力学的反応)、用量反応曲線の解析を活用するよう書かれています。
また、臨床試験の成績のみならず、非臨床試験データの活用もしながら、統合的に用法用量を検討してくださいという考えが示されています。そのために開発早期からFDAとのコミュニケーションをとることが推奨されています。
当社の対応としては、まずプロトコルを改訂し、週1回に加え、週2回の投与スケジュールも現在検討しています。用量についても、複数用量を検討しており、複数の用法用量の安全性と有効性を十分に比較した上で、第2相臨床試験に移る計画です。
このような当社のアクションについては、先ほど申し上げたとおり、米国のコンサルタントを活用し、社内で方針を決定しています。
また、この第1相臨床試験の成績をもってFDAとしっかりとコミュニケーションを取り、FDAに同意を取った上で、第2相臨床試験を進めていく計画です。
Rogocekibの開発マイルストン

「rogocekib」の今後予定している開発マイルストンです。まずは、米国で進行中の第1/2相臨床試験の第1相パートの中間成績の報告を、今年年末のアメリカ血液学会で行うことを目標に進めているところですが、Project Optimus対応で、プロトコルを改訂している関係で、現在症例の組み入れが若干遅れています。
そのため、2025年12月の発表については、現時点でややリスクが懸念される状況になってきています。2025年12月の学会発表を行うためには、2025年8月上旬にアブストラクト、発表概要を学会に投稿し、審査を受けた上で許可が下りれば、発表できるという流れになります。
2025年8月の要旨提出に向け、ギリギリではありますが、今、全社一丸となって進めているところです。
また、第1相臨床試験終了後に第2相臨床試験を開始し、2026年年末から2028年にかけて、日本において販売の承認申請を行うことが、当社の大きな計画になります。
ただし、Project Optimusへの対応を踏まえると、2026年年末の承認申請はかなり難しい状況となっており、2027年から2028年にかけて承認申請を行うことが、現実的なタイムラインだと考えています。
ここまでが、当社のリードパイプラインである「rogocekib」のご説明でした。
CDK12阻害薬 CTX-439
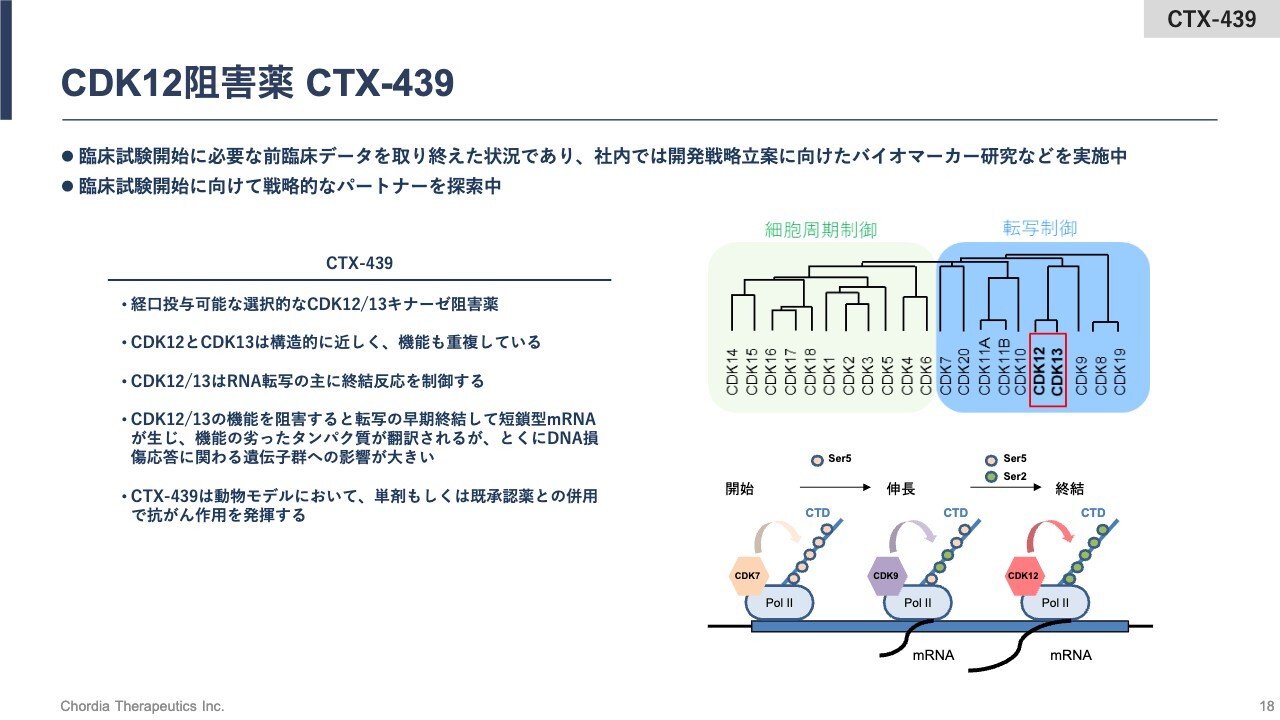
続いて、3号パイプライン、4号パイプラインの内容についてご紹介します。3号パイプラインは、CDK12阻害薬「CTX-439」です。すでに臨床試験を開始するために必要な前臨床の研究はすべて終えています。
治験薬についても原薬の製造は終えており、製剤を検討するのみとなっていますが、現在当社は「rogocekib」の研究開発に注力していることもあり、臨床試験を開始するために社外のパートナーを探している状況です。
CDK12阻害薬「CTX-439」は、経口投与可能な低分子のキナーゼ阻害薬です。CDK12阻害薬と表現していますが、実際にはCDK12、CDK13といった2つのタンパク質の機能を阻害します。
CDKというタンパク質はたくさんありますが、その中でもCDK12、CDK13は構造的にも機能的にも極めて近しいものと考えられています。この2つのキナーゼを阻害するものになります。
CDK12、CDK13のキナーゼ活性を阻害すると何が起きるかについてご説明します。先ほど、DNAにある遺伝子情報がRNAに転写されるとお話ししました。この転写反応は、さらに、転写の開始反応、伸長反応、終結反応にわけることができます。
CDK12、CDK13キナーゼは、主にRNA転写反応の終結反応に関係しているキナーゼです。そのため、これらのキナーゼの活性を「CTX-439」が阻害すると、早期終結して短鎖型RNAを生み出します。
短鎖型RNAは正常細胞にはあまり存在しないため、RNA制御ストレスになり、がん細胞の死滅につながる働きをすることになります。「CTX-439」は、前臨床の動物の薬効モデルにおいて、幅広いがん種に対する抗がん作用を示しています。
単剤、もしくはすでに承認されている抗がん薬との併用によって、抗がん作用を発揮することが確認されています。臨床試験においても同様に、単剤もしくは併用試験によって、患者さまに抗がん作用を届けられると期待しています。
GCN2阻害薬 CRD-099
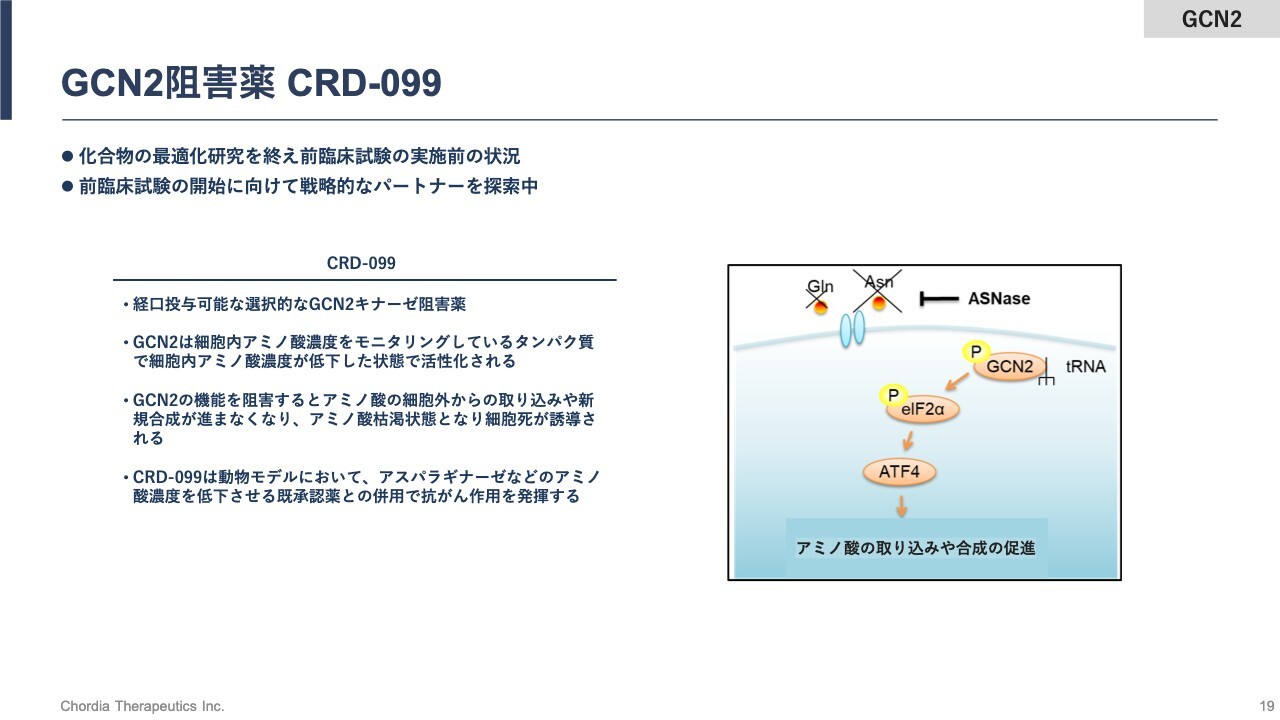
続いて、4号パイプラインGCN2阻害薬「CRD-099」をご紹介します。現在、探索研究がちょうど終わり、前臨床試験を開始する前の段階です。いわゆる化合物の最適化研究を終え、「CRD-099」で前臨床試験を行うことが合理的だろうと社内で考えているところです。
こちらも、現在当社が「rogocekib」の開発に注力していることを鑑み、このタイミングで前臨床試験を一緒に実施してくれる社外のパートナーを探している状況です。
「CRD-099」も、経口投与可能な低分子のGCN2キナーゼ阻害薬です。GCN2キナーゼは、細胞の中のアミノ酸の濃度をモニターしているタンパク質です。
がん細胞はいろいろな理由で細胞内のアミノ酸の濃度が低下することがあります。GCN2キナーゼは、その状態を感知して、アミノ酸濃度を上げるために、細胞外からアミノ酸を取り込んだり、新規のアミノ酸の合成を促したりするタンパク質です。
GCN2キナーゼの機能を阻害することによって、アミノ酸が低下している状態を維持し、最終的にはがん細胞を死滅に追い込むという働きをします。
「CRD-099」は、動物の薬効試験において、アスパラギナーゼなど細胞の中のアミノ酸濃度を低下させる、すでに承認されている薬と併用することによって、抗がん作用を示すことが確認できています。
今後動物モデルにおいて、さらなる薬効と安全性の確認を行い、臨床試験に進むことができる化合物であると考えています。
4件の物質特許とそれを支える複数の用途特許・製法特許

当社の第1号、第2号、第3号、第4号のパイプラインを支える知財の状況を示しています。主に物質特許を出願しており、世界中の国で登録が進んでいます。
「rogocekib」の物質特許は、すでに全世界51ヶ国で登録されています。2号パイプラインについても、小野薬品工業株式会社に導出した物質特許が全世界15ヶ国で登録されています。
本日ご説明した3号パイプライン「CTX-439」、4号パイプラインGCN2阻害薬の物質特許についても、それぞれ49ヶ国、25ヶ国で登録されています。特許についてはきっちり押さえているとご認識ください。
当社の経営理念と2030年ビジョン

最後になりますが、当社のビジョンをあらためてご紹介します。当社は日本に拠点を持つバイオテックとして、既存薬とは異なる新しい働き方をする新薬を世界中に届けたいと考えています。
そうすることによって、今日効く抗がん薬がなくなってしまった患者さまが、明日新しい抗がん薬を使えるような、明日に希望を持てるような社会を作りたいと思い、がんばっています。
また、2030年までには、当社リードパイプラインである「rogocekib」の販売承認を獲得し、研究開発から製造販売まで手がける製薬会社へと成長していくことが、当社のビジョンです。
そのようなステージにたどり着くまでにはまだ少し時間が必要ですが、投資家のみなさまには温かい応援のほど、どうぞよろしくお願いします。これで当社の2025年8月期中間決算のご説明とします。
質疑応答:Project Optimusへの対応状況およびFDA人員削減による影響について
質問者:「rogocekib」「CTX-712」についてです。Project Optimus対応は終了しているという認識でよろしいでしょうか? また、FDAの人員削減などの影響について教えてください。今年の後半に予定されているエンド
新着ログ
「医薬品」のログ