【QAあり】Chordia Therapeutics、臨床POCを確立し高利益なビジネスを目指す 研究開発は順調に進行
目次

三宅洋氏(以下、三宅):みなさま、こんにちは。Chordia Therapeutics代表取締役CEOの三宅洋でございます。本日も大変お忙しいところご視聴いただき、心より感謝を申し上げます。それでは、当社の2024年8月期の決算についてご説明します。
本日のアジェンダは、スライドのとおりです。
会社概要および沿革

会社概要および沿革です。当社は2017年10月に創業しました。今年の6月14日には、東京証券取引所グロース市場に上場しています。
経営陣とコーポレートガバナンス

経営陣とコーポレートガバナンスです。取締役会は5名の取締役で構成されています。業務執行を行う取締役は私1人で、残りの4名は社外取締役です。経営、会計、研究開発、法律など、それぞれ異なる専門性を持った社外取締役が、当社の取締役会をモニタリングしています。
女性取締役は2名で、多様性にも配慮した取締役会の構成となっています。
当社の特徴
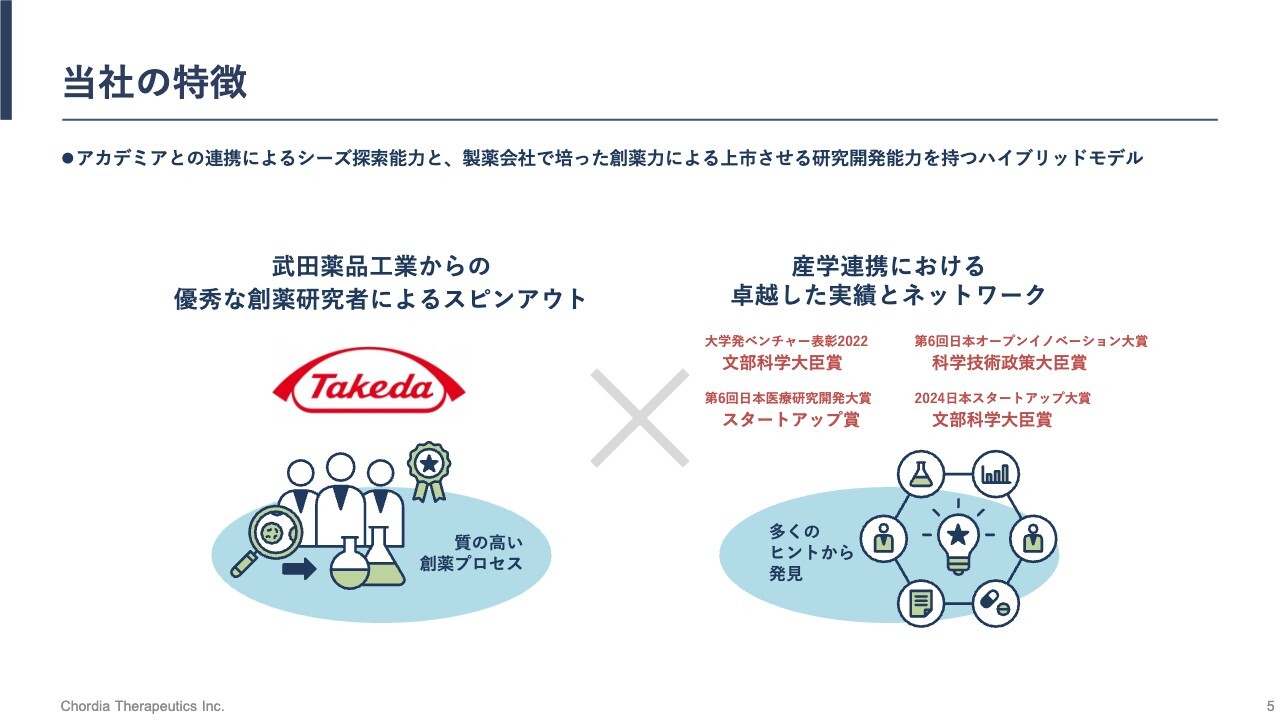
当社の特徴です。当社は、武田薬品工業株式会社からスピンアウトした設立経緯を持っています。武田薬品工業時代に身につけた創薬のノウハウを活かし、研究と開発を続けています。
また、当社は日本国内のいくつかの大学と共同研究を行っています。産学連携を活用して最先端の科学に触れながら、新しい抗がん薬の研究と開発にチャレンジしているところです。
臨床POCを確立したパイプラインをもとに高利益なビジネスを目指す
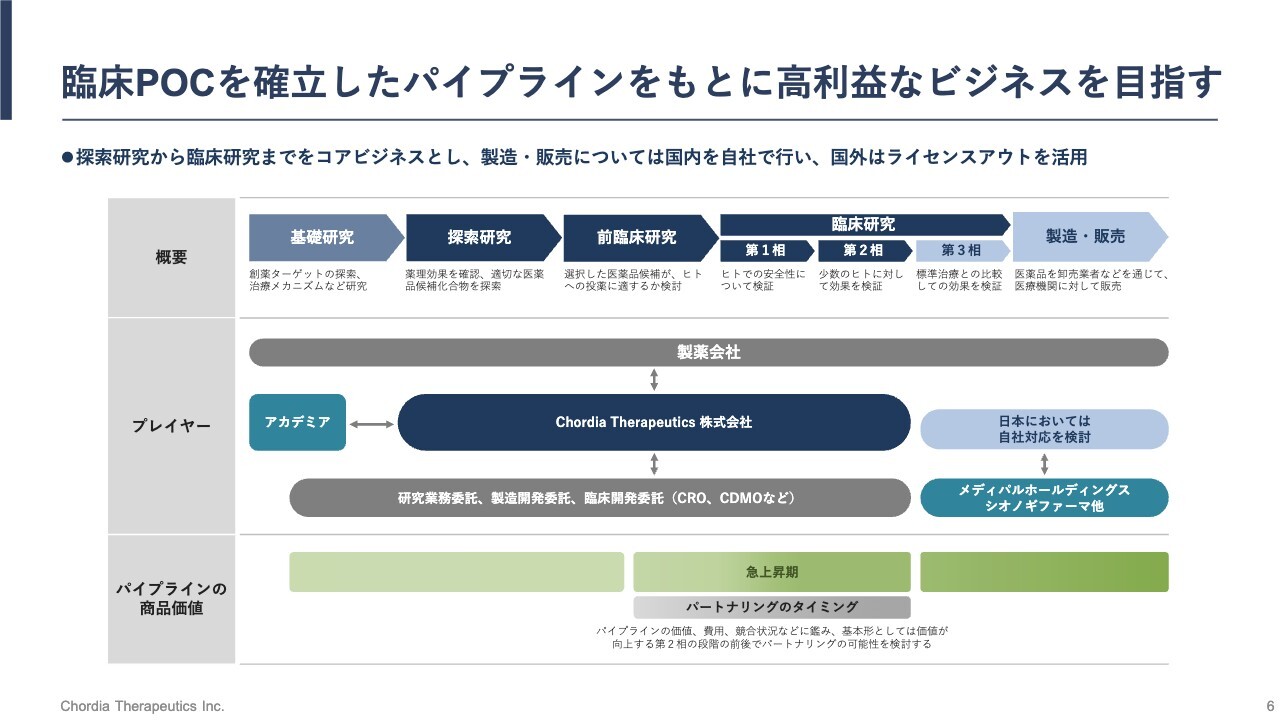
当社のビジネスモデルです。みなさまもご存じのとおり、新しい薬を作るには多額の先行投資と長い期間が必要です。基礎研究から始まり、探索研究、前臨床研究、そして患者さまを対象とした臨床研究と続けていき、最終的には規制当局に承認をいただいて、新薬の製造と販売を行うといったプロセスになります。
この一連の流れのうち、当社は真ん中あたりの工程を自社で担当する想定です。具体的には、探索研究から臨床研究の第2相程度までを自社で手がけていきます。それより前のステージでは大学との共同研究を行い、製造・販売ステージにおいては、当社の戦略的な事業提携先の力を借りながら進めていく前提です。
日本発の製薬会社になることを視野にいれた国内プレイヤーとの提携
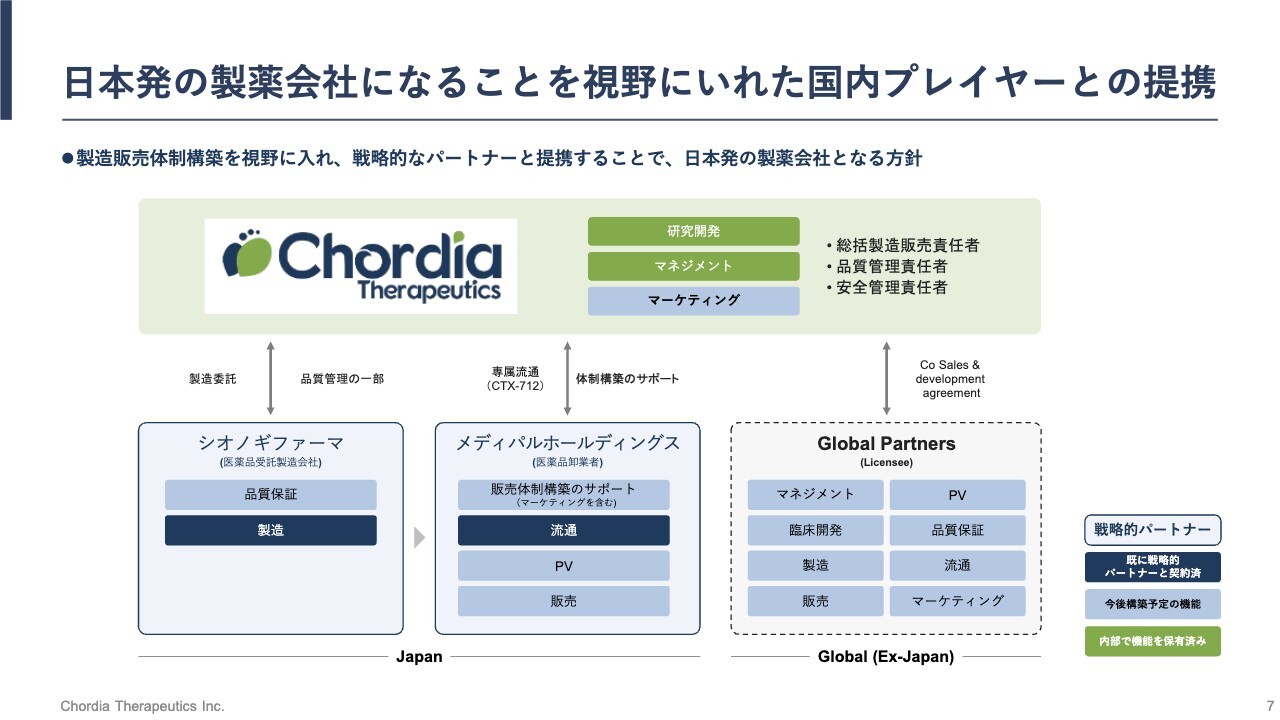
私たちは、日本においては可能な限り自社で製造販売まで行うことを前提としていますが、海外においては海外の製薬メーカーへの導出を前提としています。また、日本においてもすべてを自社で賄うのではなく、戦略的な事業提携先の力を借りながら進めていく前提です。
当社はすでに、CDMO(医薬品開発製造受託機関)のシオノギファーマや日本の医薬品流通卸の最大手であるメディパルホールディングスと、戦略的な事業提携を結んでいます。主に日本国内での将来的な製造と販売に向けて準備を進めているところです。
グローバルスタンダードである当社のポジショニング
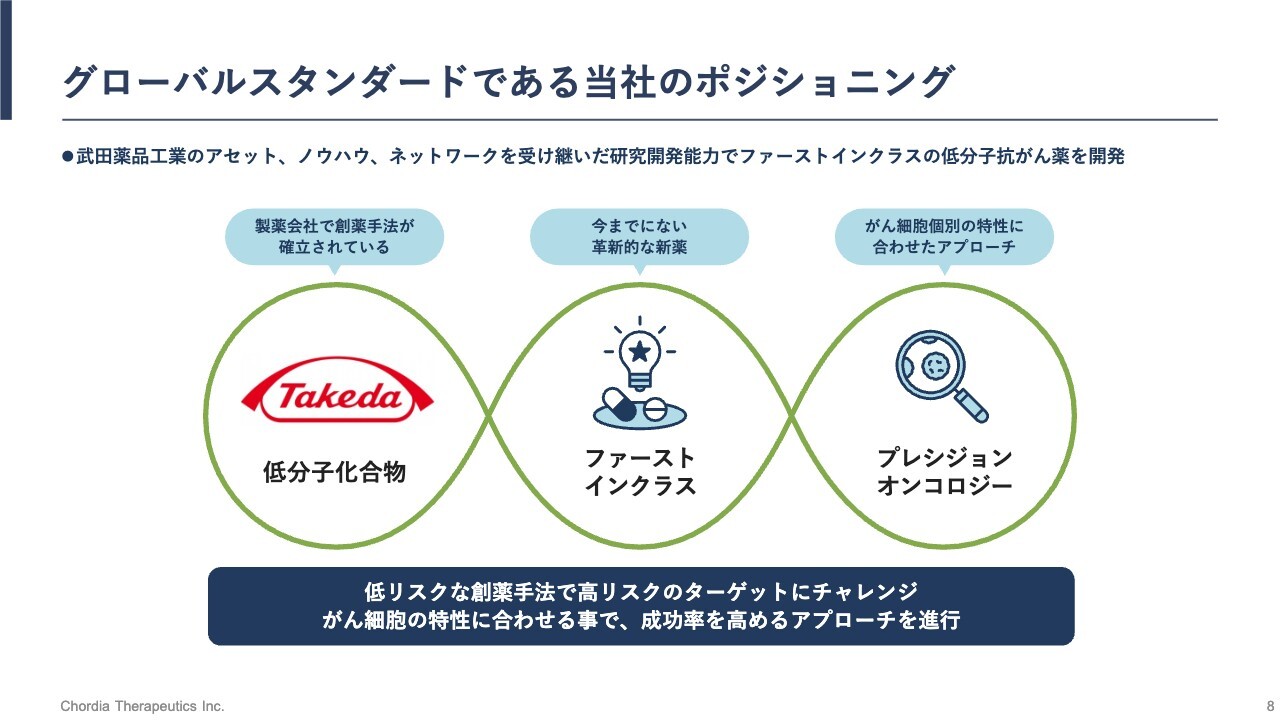
当社のポジショニングについてです。当社が手掛ける創薬モダリティは低分子化合物で、狙う抗がん薬の標的タンパク質は、既存の抗がん薬とはまったく異なる新しいタンパク質です。いわゆるファーストインクラスの可能性を持ったパイプラインを手掛けています。
また、当社のサイエンスはプレシジョンオンコロジーに基づいています。こちらはがんの弱点や特徴を理解した上で、抗がん薬の標的となるようなタンパク質を見出すアプローチです。
次のスライドから、低分子化合物、ファーストインクラス、プレシジョンオンコロジーについてさらに詳しくご説明します。
当社のポジショニング~低分子化合物創薬
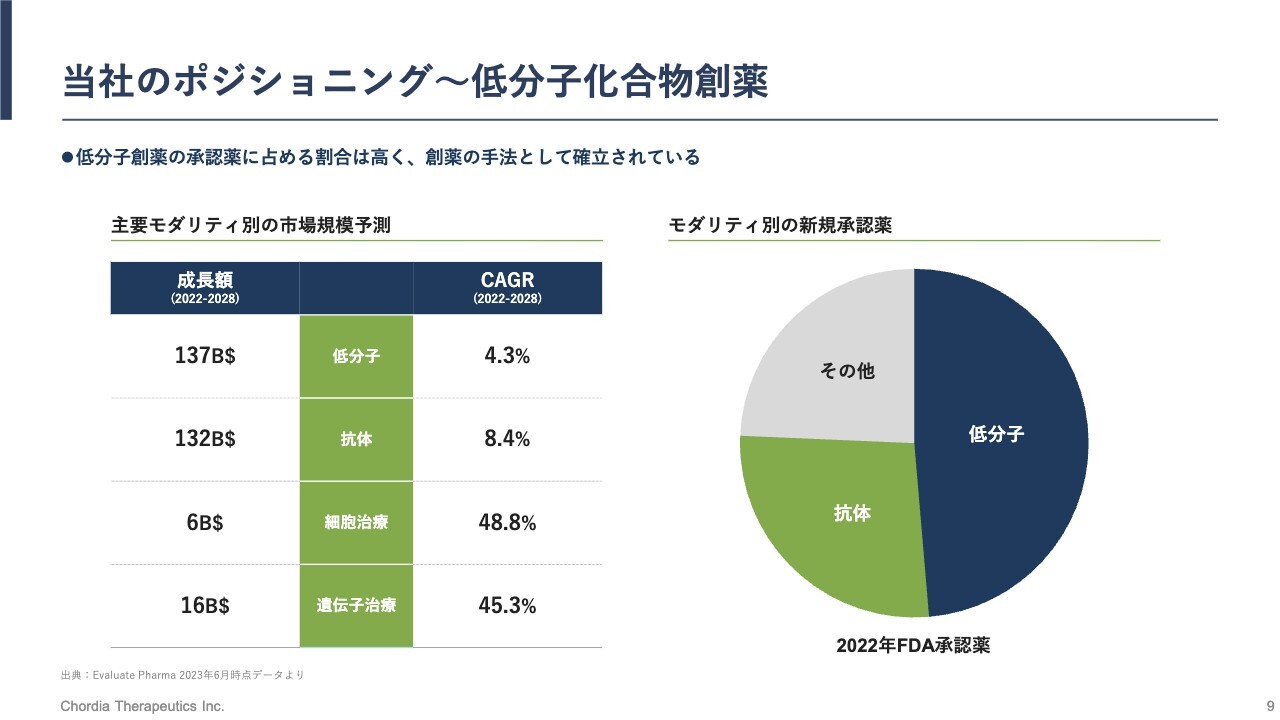
当社が手掛けている創薬モダリティである、低分子化合物の状況です。最近は、抗体医薬品、細胞治療、遺伝子治療などの新しい創薬モダリティが注目を集めていますが、現在も新規に承認される医薬品の半分程度が低分子モダリティです。
スライド右側の円グラフのとおり、2022年に米国FDAから承認された新薬のおよそ半分が低分子です。またその成長性も、ニューモダリティと比べるとやや落ちるものの、引き続き高い成長性を示しています。
当社のポジショニング~ファーストインクラス創薬
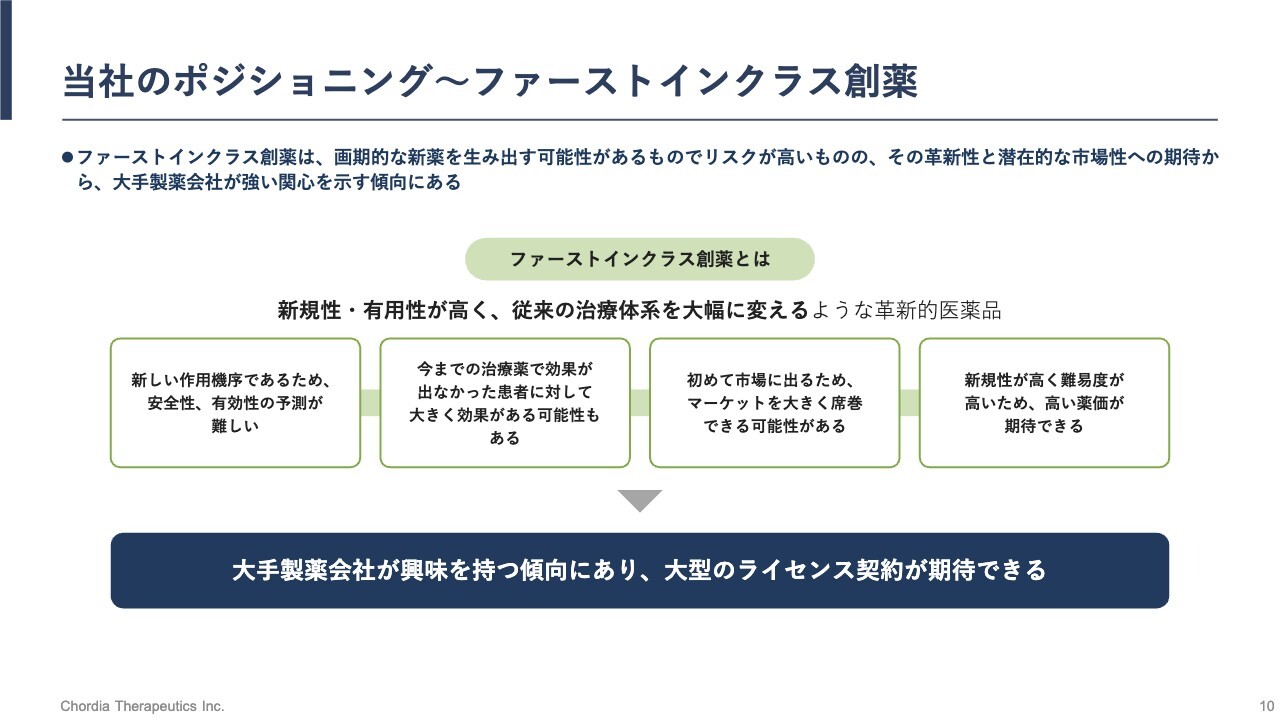
ファーストインクラスについてご説明します。ファーストインクラスは、既存の抗がん薬とは異なる標的を狙っています。したがって、既存の抗がん薬とは異なる新しい働き方をする医薬品が生まれることになります。
これは、がん治療にとって非常に重要なことです。なぜならば、既存の治療法に失敗したがんの患者さまは、既存の治療法とは異なる働き方をする新しい薬が必要だからです。
がんは非常にずる賢く、ある治療に対してすぐに抵抗性を獲得します。ですので、既存治療法に対して抵抗性を示す、もしくは再発・難治となるような患者さまに対しては、新しい働き方をする抗がん薬でないと治療が継続できないことになります。
私たちはそのような新しい働き方をする抗がん薬の創出にチャレンジしている会社です。ファーストインクラスの抗がん薬は、その新規性ゆえに、世界中の製薬メーカーから高く評価されることが多いと当社は認識しています。
当社が着目するがんの特性であるRNA制御ストレス
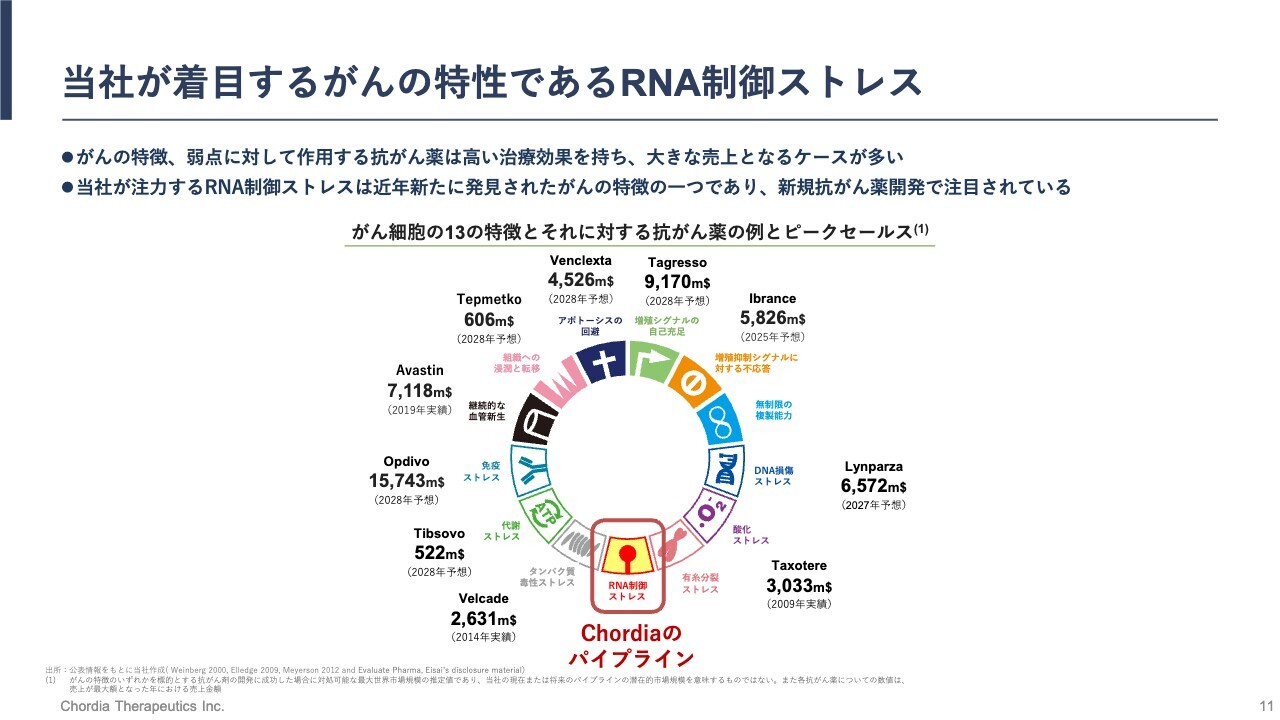
「プレシジョンオンコロジーは、がんの特徴や弱点を理解した上で、新しい抗がん薬の標的を見出すサイエンスだ」とお伝えしましたが、すでに世界中のがんの研究者によって、10を超すがんの弱点・特徴が見出されています。スライドに、それらの特徴・弱点をまとめて示しています。
このようながんの特徴・弱点に対応した抗がん薬は、すでに世界中の製薬メーカーやバイオテックによって複数生み出されていますが、その多くが商業的に大きな成功を収めています。がんの特徴や弱点は、がん種に横断的にある程度の共通性を示すため、適用拡大ができる医薬品が多いからです。
私たちはこのようながんの特徴・弱点の中でも、比較的最近に見出されたがんの弱点である「RNA制御ストレス」の研究に集中しているところです。
RNA制御ストレスは、RNAを生成する過程の異常によって生み出されます。遺伝情報はDNAに載っていますが、それがmRNAに写し取られ複数の過程を経て成熟し、最終的にはタンパク質に翻訳されます。
遺伝情報が載っているDNAや私たちの生命活動のほとんどすべてを担うタンパク質は、研究がかなり先行していましたが、その間をつなぎ、情報を伝達する役割を担うRNAの研究は相対的に遅れていました。mRNAは、日本語では「伝達RNA」と翻訳します。
しかし、最近はRNAの研究が進んできており、がんにおけるRNA制御ストレスが2011年に同定されました。また、mRNAとは異なりますが、今年はマイクロRNAの研究がノーベル賞を受賞しています。
そのようなかたちで今、RNAを取り囲む研究が非常に飛躍的に発展しています。私たちはその中で、RNA制御ストレスに特化した研究と開発を行っているところです。
ストレスを標的としたがん治療薬の状況
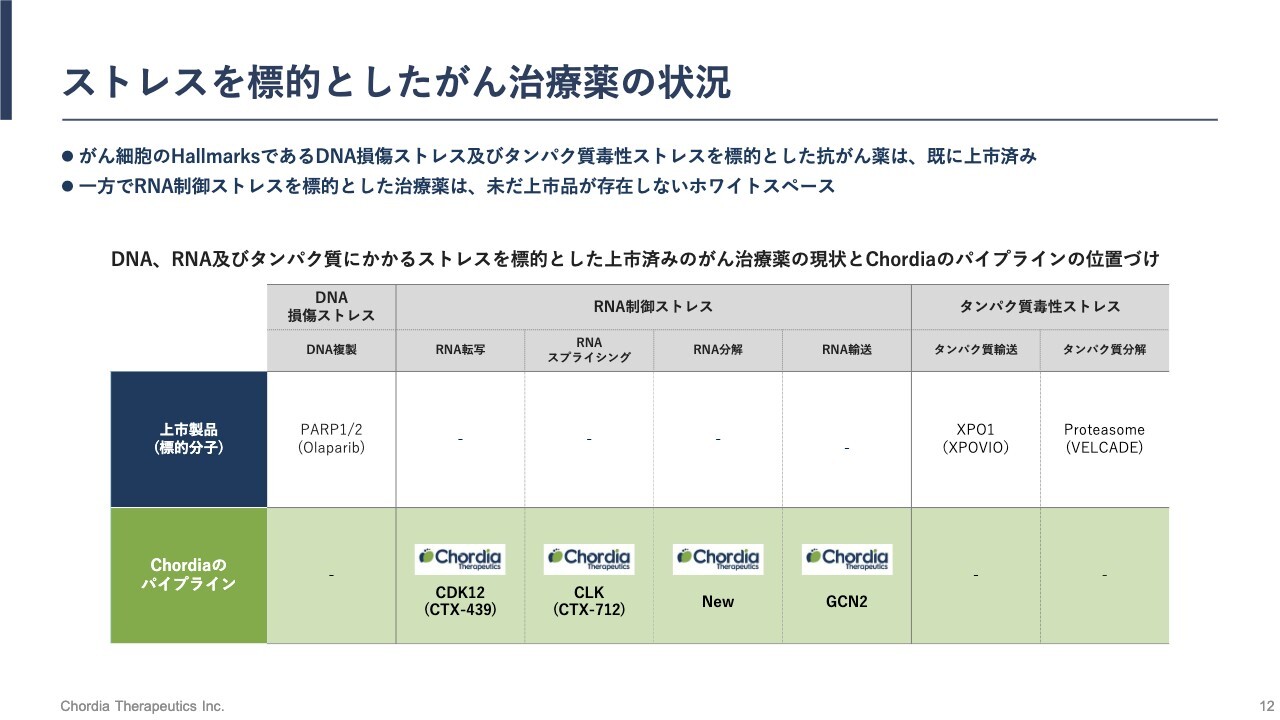
RNAを生成する過程は、スライドに示すとおり、転写、スプライシング、分解、輸送といった複数の過程に分かれます。がん細胞は、それぞれの過程に異常を生じており、RNA制御ストレスを受けています。
私たちは武田薬品工業時代にいち早くこの領域の可能性の高さに気がつき、研究を開始しました。その成果のすべてをChordia Therapeuticsが引き継ぎ、研究開発を続けているため、私たちはRNAが生成する過程のそれぞれに対応したパイプラインを揃えることができています。
その中でも、当社のリードパイプライン「CTX-712」は、RNAスプライシングを変化させることによりRNA制御ストレスを増大させるという働きを持っています。
当社が手掛ける抗がん薬のコンセプト
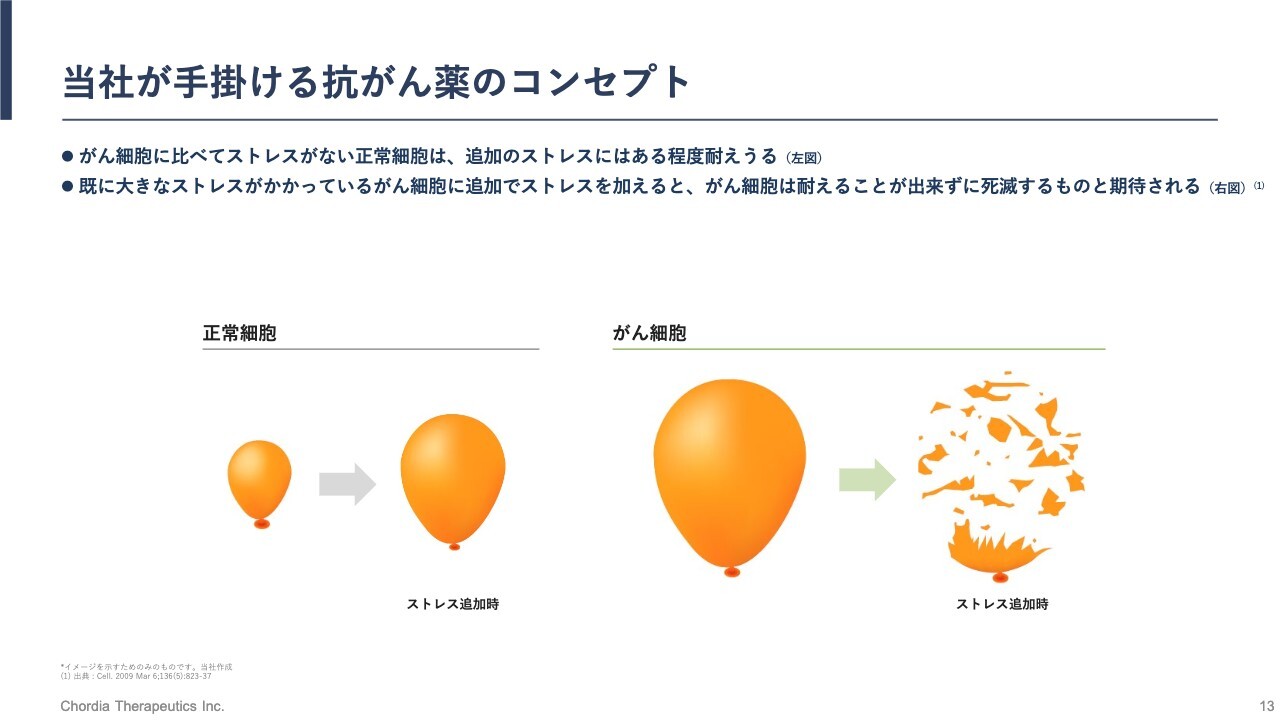
こちらのスライドでは、ストレスを大きくすることにより、がん細胞が選択的に死滅するイメージをみなさまに持っていただくために、風船の画像を使ってご説明しています。風船の大きさは、細胞が抱えるストレスの大きさを示しています。
正常細胞は通常ストレスフリーの状態ですので、小さな風船です。一方、がん細胞は複数の遺伝子変化を抱えて無理して生きています。正常細胞よりも早く無制限に増殖することができますが、無理しているためストレスがかかっており、風船が大きい状態です。
ここに対して、私たちのパイプラインはRNA制御ストレスをさらに大きくする働きかけを行います。そうすると、正常細胞は風船が一過的に大きくなりますが、ストレス対応能力があるためすぐに元の大きさに戻ります。
一方、がん細胞はたくさんのストレスを抱えていますので、追加のストレスに耐え切ることができません。これにより、風船が破裂するように死滅していくことになります。
ESG経営に対する当社の取り組み

ESG経営についてご説明します。私たちは新しい抗がん薬を生み出すことにチャレンジしている会社ですので、非常に大きな社会インパクトを届けられる事業を行っていると理解しています。
また、取締役の構成のところでもお伝えしましたが、ダイバーシティ&インクルージョンにも配慮した取り組みを行っています。
5つのパイプラインのうち、2つは臨床ステージ
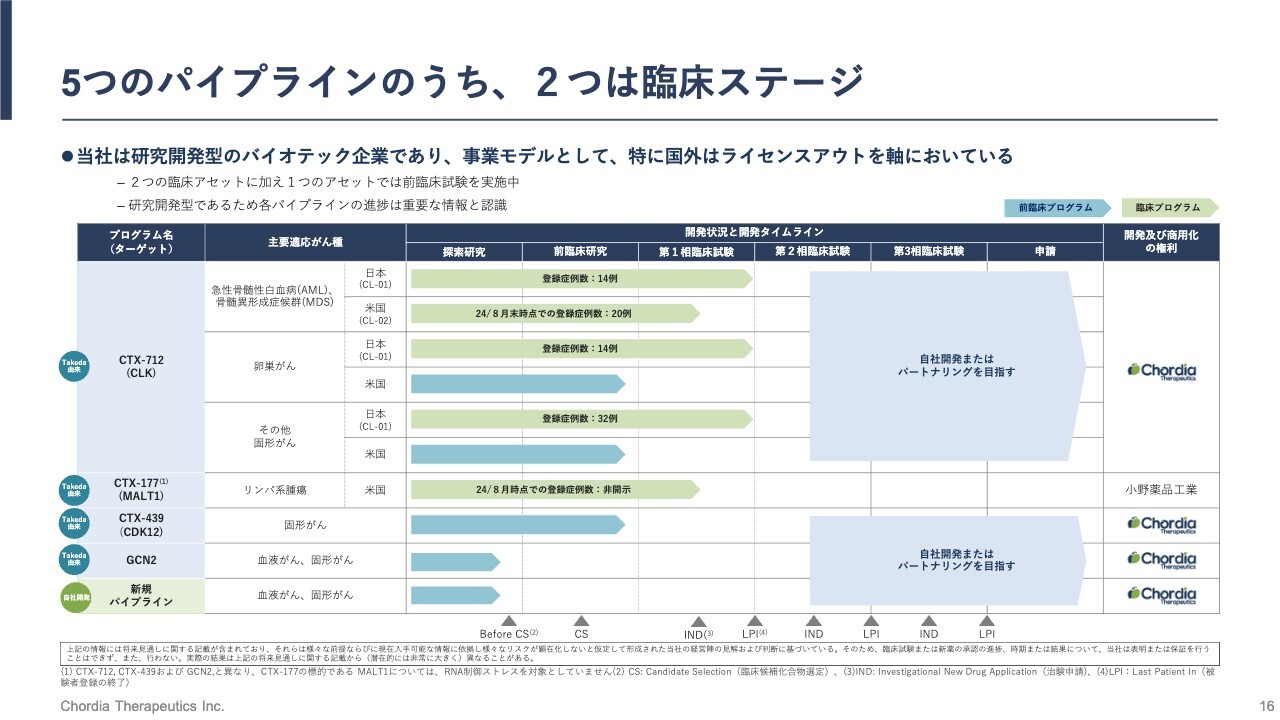
パイプラインの概況をご説明します。当社は5つの低分子化合物のパイプラインを有しています。そのうち4つは、武田薬品工業から全世界での権利を導入したパイプラインです。最後の5番目は、当社が創業後に京都大学との共同研究を通じて立ち上げた新規パイプラインです。
この5つのパイプラインのうち、当社が「2号パイプライン」と呼んでいる「CTX-177」は、すでに全世界での権利を小野薬品工業株式会社に導出しています。残り4つのパイプラインの権利は、当社が実際に留保している状況です。
当社のリードパイプライン「CTX-712」は、すでに臨床試験を開始している、いわゆる臨床パイプラインとなります。
RNAの生成プロセスと当社のパイプラインが作用する各過程
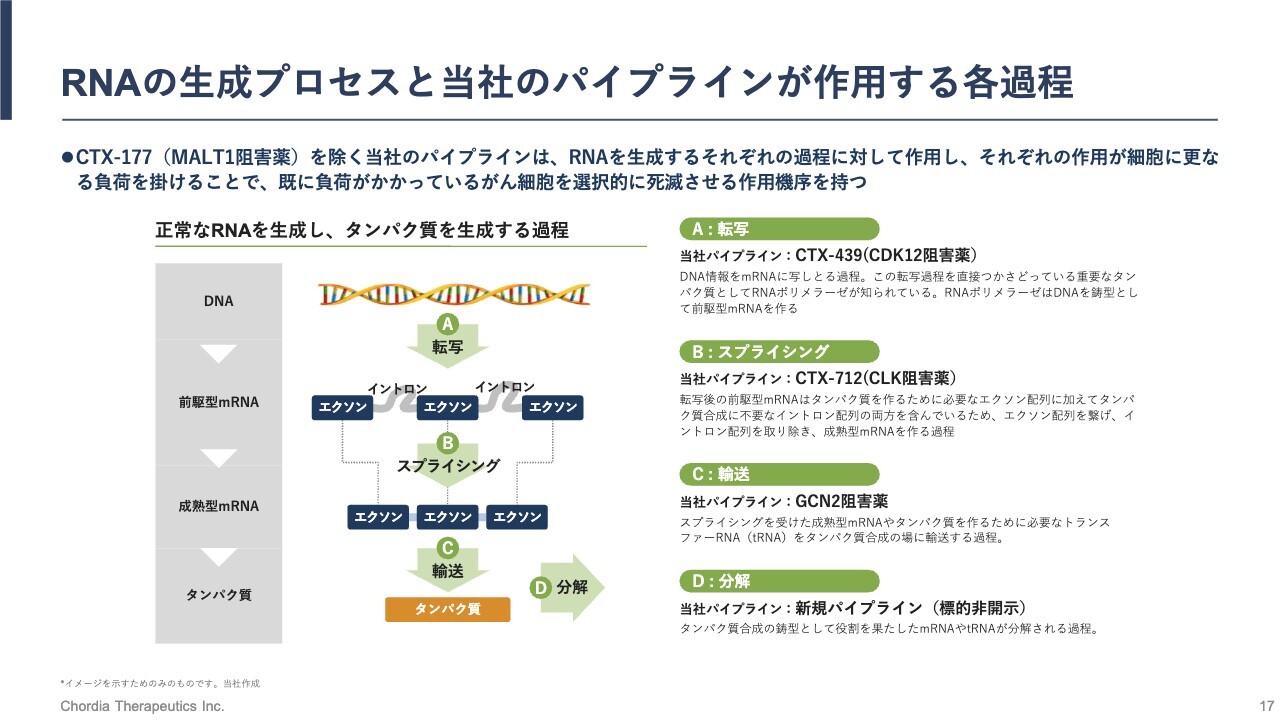
リードパイプライン「CTX-712」の作用機序についてご説明します。先ほど「RNA制御ストレスは、RNAを生成する過程の異常によって生じる」とお伝えしましたが、「CTX-712」は、スプライシング反応を変化させる働きを持っています。
DNAから遺伝情報が写し取られた前駆型mRNAは、タンパク質に翻訳される部分と翻訳されない部分を有しているRNA分子です。その中でタンパク質に翻訳されるエクソン配列だけを残し、不必要なイントロン配列を取り除く反応がスプライシング反応です。
このスプライシング反応を制御しているタンパク質に、CLKタンパク質があります。「CTX-712」は、このCLKタンパク質の機能を阻害することでスプライシング反応を変化させ、異常なスプライシング産物を細胞に生じさせます。
その異常なスプライシング産物がRNA制御ストレスとなって、最終的にはがん細胞が死滅するという流れです。
RNA制御ストレスを増大させてがん細胞を死滅させる
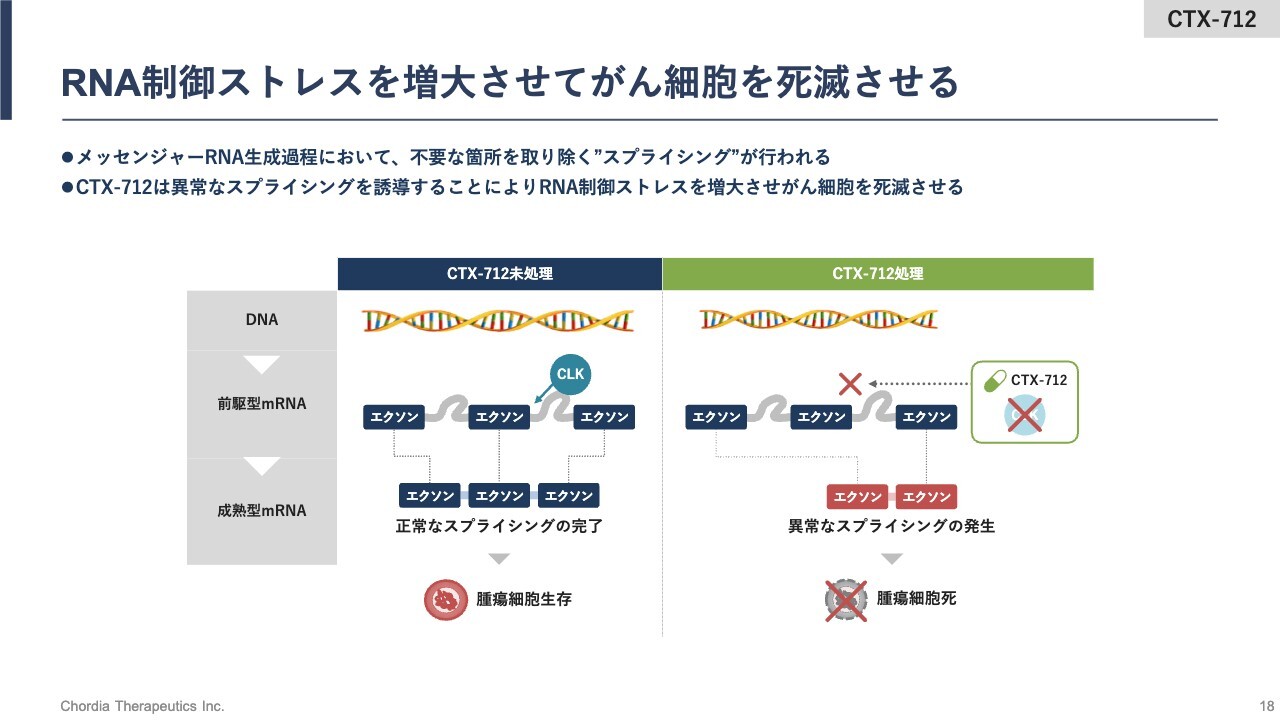
こちらのスライドでは、今ご説明した流れをイラストで示しています。
日本での第1相臨床試験においてAMLと卵巣がんで有効性を確認
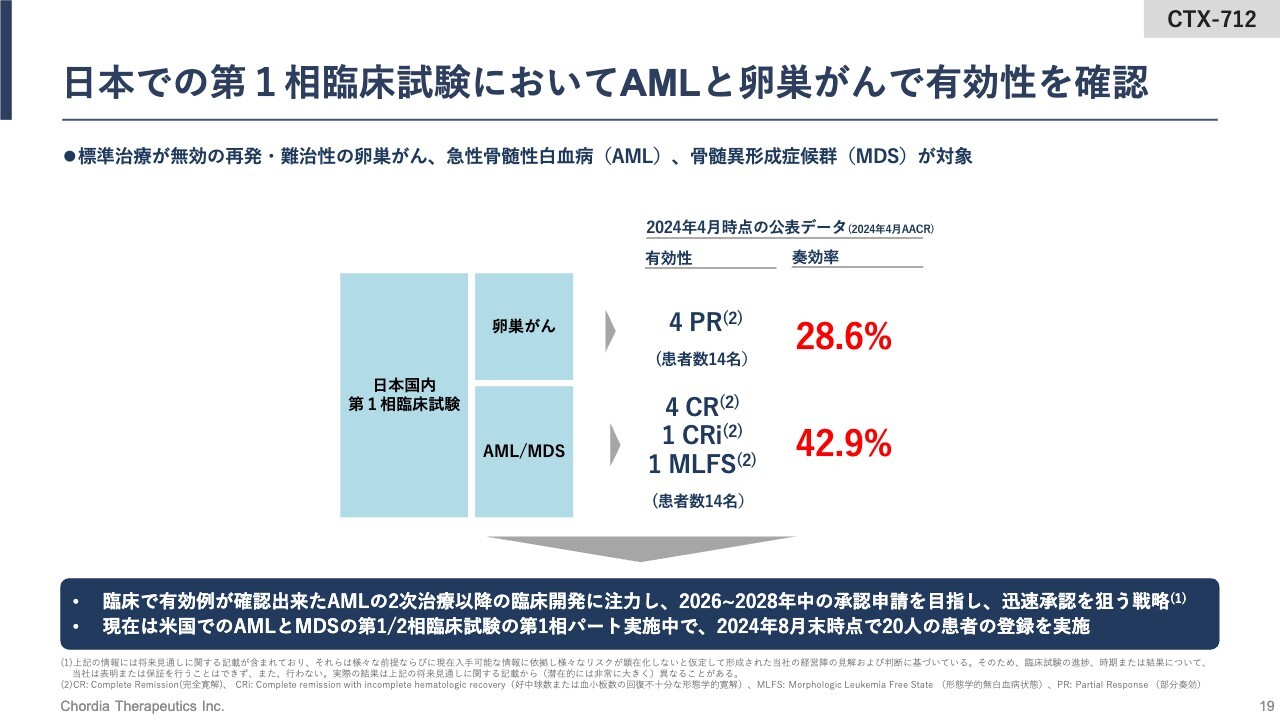
「CTX-712」は、すでに人での臨床試験を行っています。臨床試験での成績をご説明します。
日本において、既存の治療法がなくなった再発・難治のがんの患者さま、具体的には固形がんの患者さまと血液がんの患者さまを合わせて60名に投薬を実施しています。その中で、卵巣がんの患者さま14名のうち、4名が部分奏効となりました。部分奏効とは、「CTX-712」の治療によって、がんの大きさが半分以下まで小さくなっている奏効です。
また、急性骨髄性白血病(AML)や骨髄異形成症候群(MDS)の患者さま14名のうちの6名で奏効が確認できています。中でも、4名の患者さまにおいては、一過的にはなりますが、がん細胞が患者さまの体の中から消える状態である完全寛解を達成できています。
卵巣がん、白血病での奏効率は、それぞれ28.6パーセント、42.9パーセントとなっています。
日本の試験の成績を受け、現在は米国において、白血病の患者さまに対する第1/2相臨床試験を行っています。2024年8月末時点で20名の患者さまに投薬を実施し、計画どおりに進んでいるところです。
CTX-712は第1相臨床試験で高い奏効率を示した
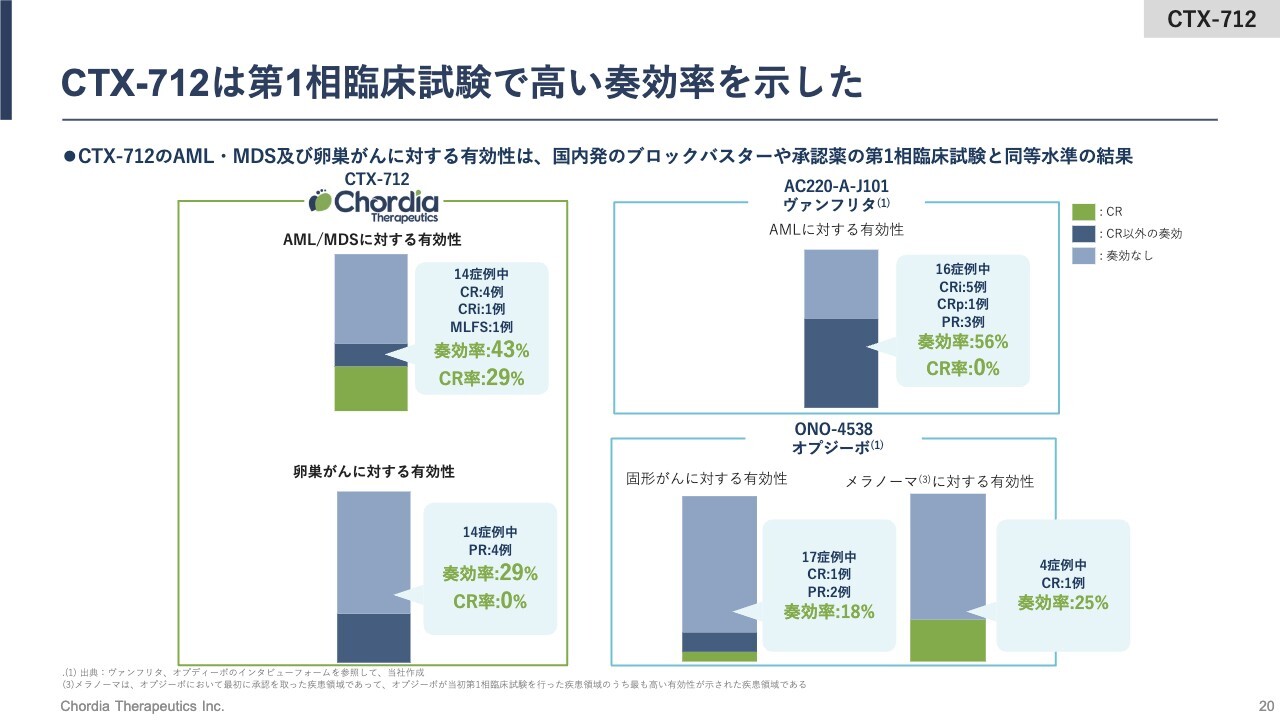
こちらのスライドでは、「CTX-712」の卵巣がんと白血病それぞれの奏効率を、すでに日本の規制当局が承認し市販されている薬の第1相臨床試験の成績と比較しています。
スライド左上が「CTX-712」の白血病に対する成績、スライド右上がFLT3遺伝子に変異を持つ患者さまに使える白血病薬「ヴァンフリタ」の成績を示しています。「ヴァンフリタ」の第1相臨床試験での奏効率は、56パーセントです。ただし、完全寛解率は0パーセントですので、「CTX-712」は「ヴァンフリタ」の成績と同等以上の成績を示していると当社は考えています。
固形がんに対する成績についてです。スライド左下に示すとおり、「CTX-712」における卵巣がんの奏効率は29パーセントとなっています。比較対象は、小野薬品工業株式会社のブロックバスター医薬品「オプジーボ」です。「オプジーボ」の第1相臨床試験では、「CTX-712」と同じく、オールカマーの再発・難治となった固形がんの患者さまで治験が実施されました。
その結果、最初に承認を取った皮膚がんであるメラノーマでの奏功率は、25パーセントとなっています。完全寛解が1例と非常にすばらしい成績なのですが、奏効率としては「CTX-712」と同等程度の奏効率を示していると当社は考えています。
直近でのFDAにて承認・承認申請を行っている治療薬との比較
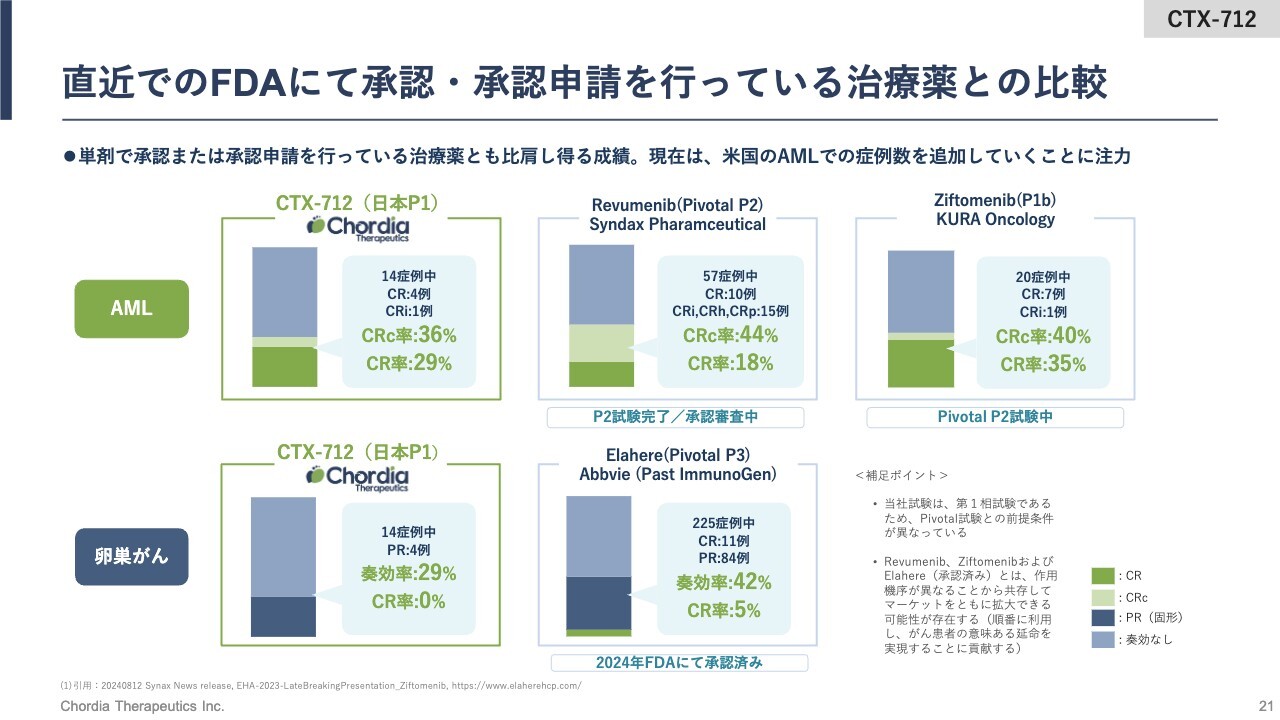
こちらのスライドでは、「CTX-712」の成績を、米国FDAから直近で承認を取っている薬、もしくは承認を取るために承認申請を行っている薬の成績と比較しています。
白血病においては、Syndax Pharmaceuticals社とKura Oncology社が、メニン阻害薬を開発しています。Syndax Pharmaceuticals社は、すでにFDAに迅速承認申請を行っていますが、その時のCRc率、つまりCRとCRiという奏効率を足し合わせた数値は44パーセント、CR率は18パーセントでした。
Kura Oncology社では、第2相試験の成績をもって迅速承認をかけるための第2相試験を実施中です。Phase1bの成績はCRc率が40パーセント、CR率が35パーセントでした。こちらは「CTX-712」のCRc率36パーセント、CR率29パーセントと比べてほぼ同等ではないかと考えています。
卵巣がんにおいては、AbbVie社に昨年買収されたImmunoGen社の葉酸受容体のADCが、第2相試験の結果をもって迅速承認を勝ち得ています。最終的には第3相試験の成績が発表されましたが、奏功率は42パーセント、CR率は5パーセントでした。
こうして見ると、「CTX-712」は葉酸受容体拮抗薬「Elahere」よりも成績は若干落ちるようではありますが、併用試験等を検討することによって、卵巣がんでの承認も十分狙えるような第1相臨床試験の成績だったと考えています。
アンメットニーズの高いAMLと卵巣がんを最初の対象として想定
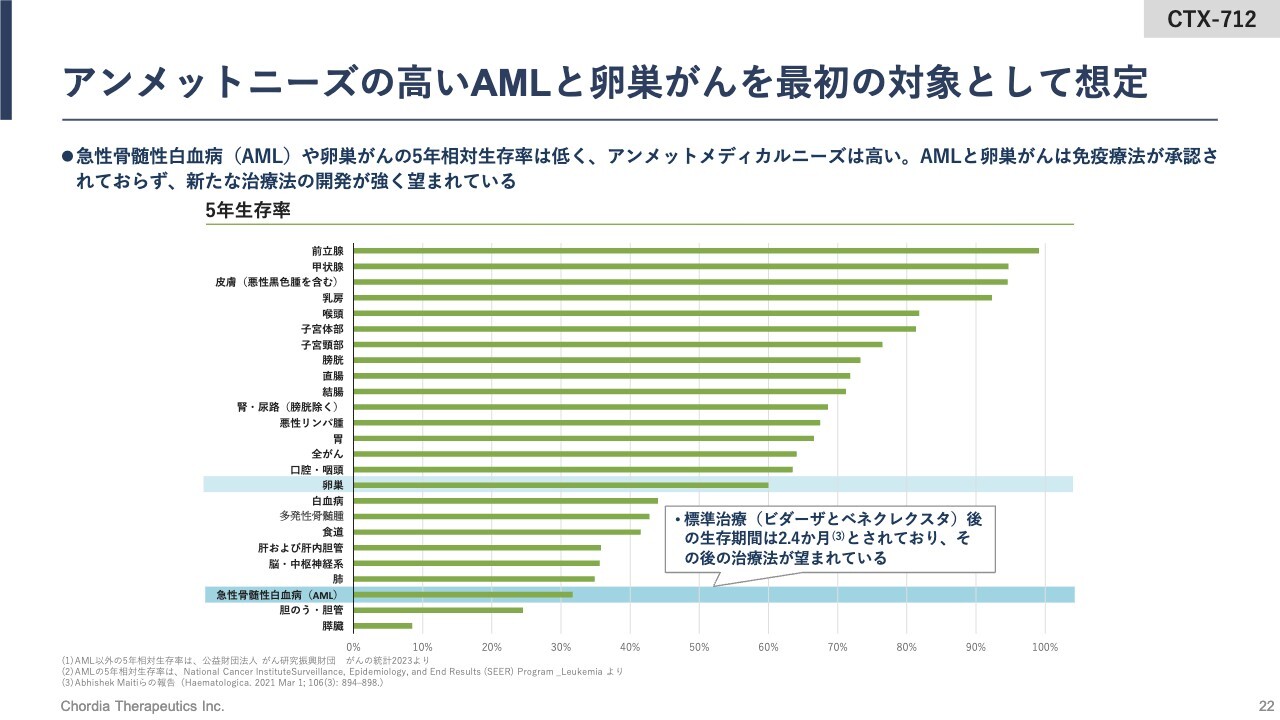
スライドには、当社が先行して開発を進めているAMLと卵巣がんの5年生存率を示しています。AMLの5年生存率は30パーセント程度しかなく、まだまだ新しい抗がん薬の誕生が望まれているがん種です。卵巣がんも、5年生存率は60パーセント程度となっています。
CTX-712は治療選択肢が限られるAMLの2次治療以降で開発中
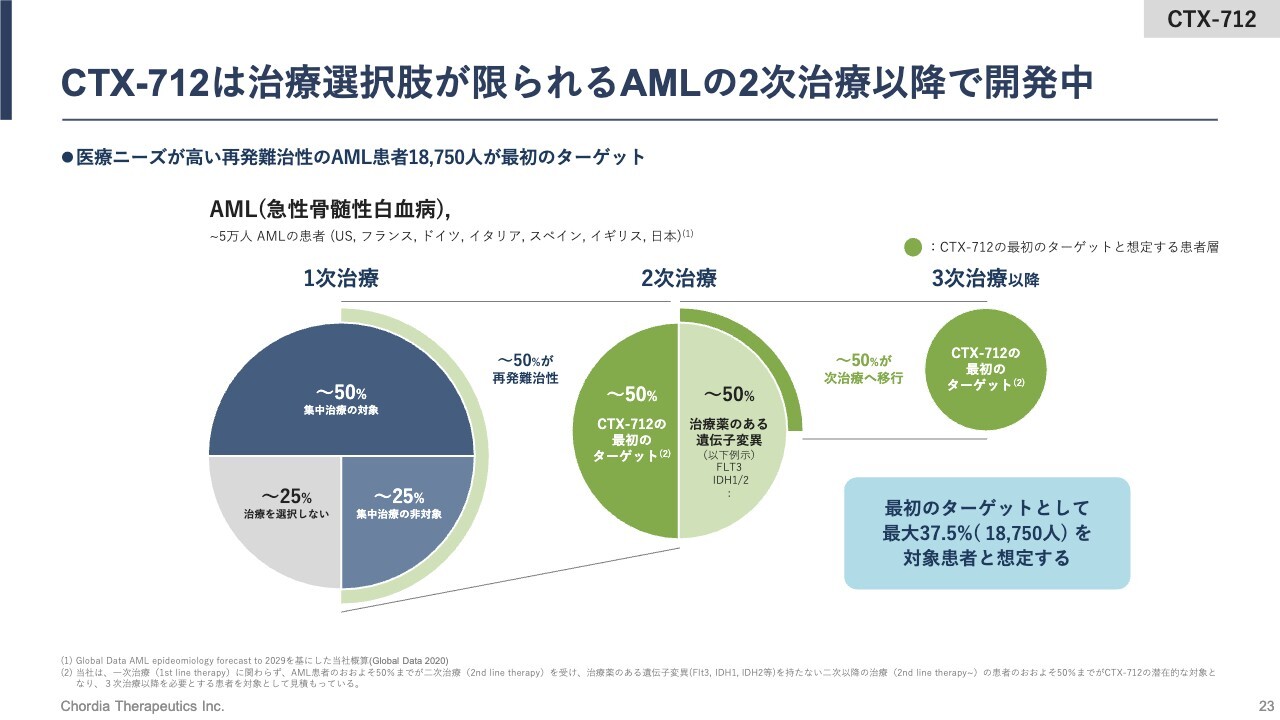
AMLの治療体系についてご説明します。全世界において、年間およそ5万人の患者さまが新たにAMLを発症します。そのほとんどすべての患者さまが1次治療を受けますが、残念ながら半分程度の患者さまは有効性不十分で、2次治療が必要となります。
この2次治療において、半分程度の患者さまが「CTX-712」の治療を受けるようになるだろうと想定しています。最大で1万8,750人程度が、年間で「CTX-712」の治療を受けうると算出しています。
AML 2次治療以降での市場規模は2,000億円以上
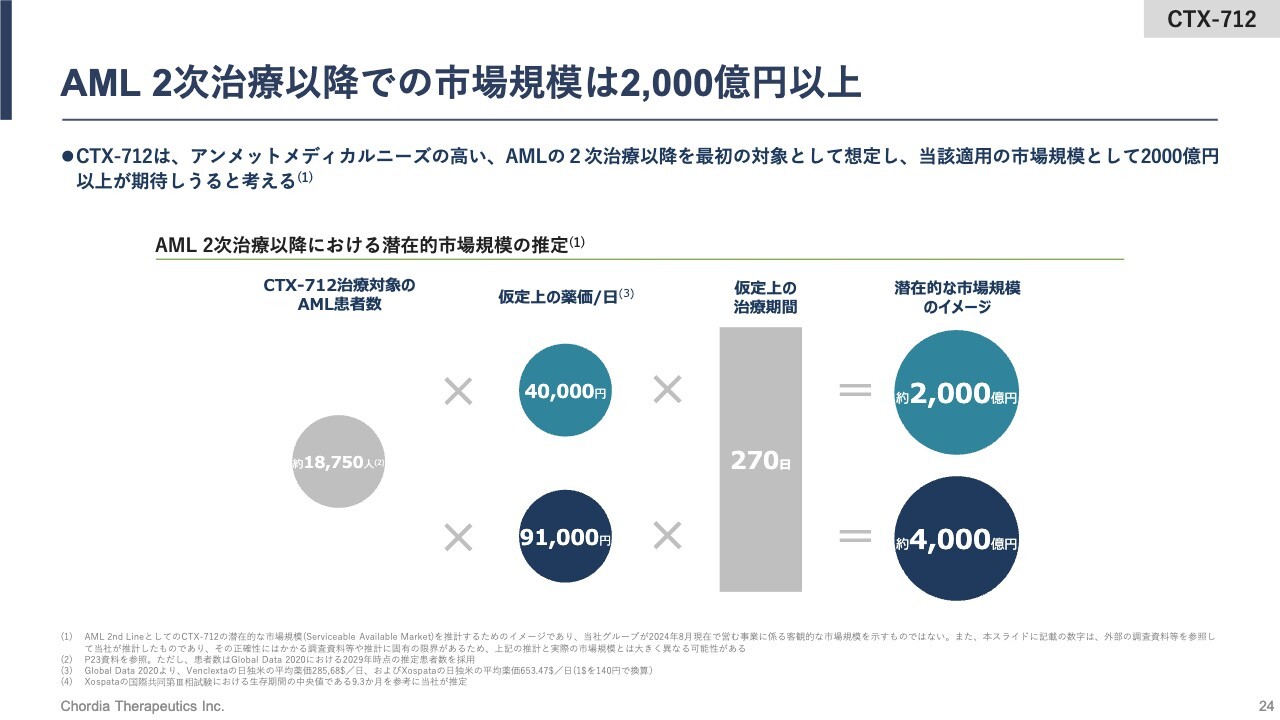
こちらのスライドでは、AMLの2次治療以降の市場規模を計算しています。当社は現時点で治療期間を9ヶ月程度と仮定しており、それを先ほどの1万8,750人に想定される薬価と掛け合わせると、市場規模は2,000億円から4,000億円程度になると算出しています。
例えば、この半分程度を「CTX-712」が取ることができれば、再発・難治の白血病治療だけで、年間のピークセールスは1,000億円から2,000億円に到達できるだろうと期待しているところです。
プラチナ製剤抵抗性の卵巣がんは治療選択肢が少ない疾患
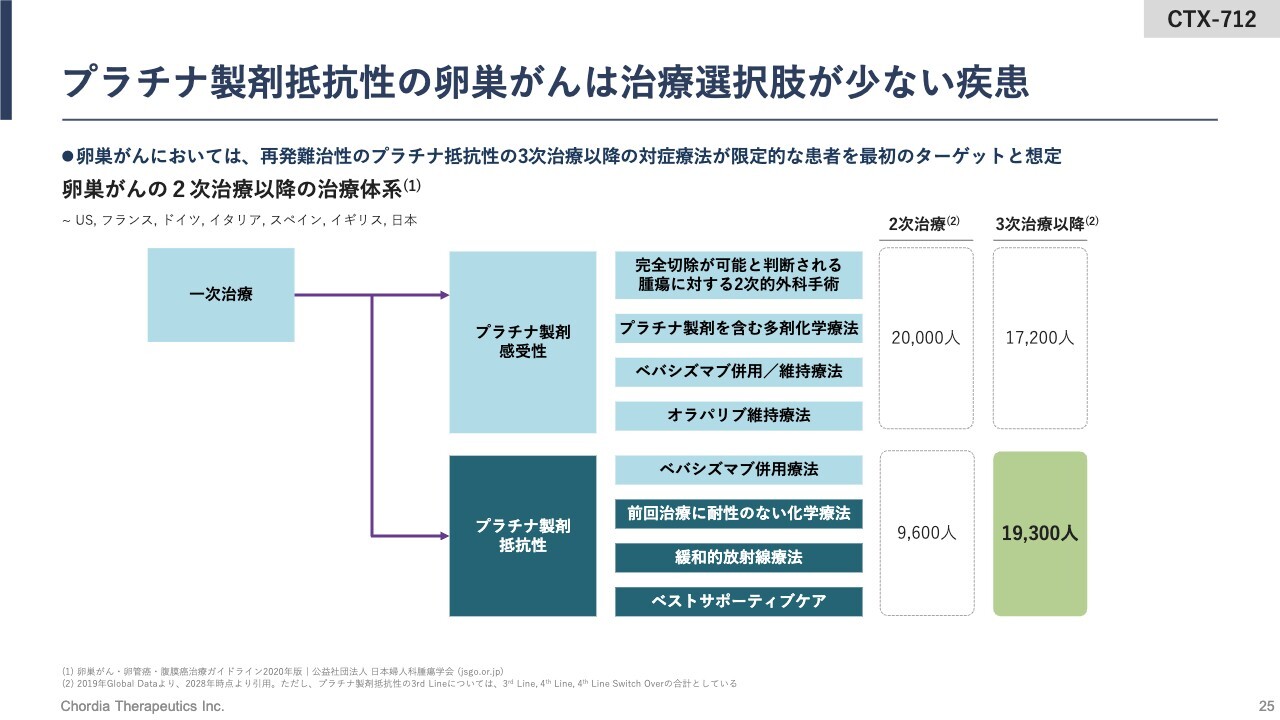
卵巣がんの治療体系についてご説明します。まずはプラチナ製剤に抵抗性のある患者さまに使われるようになると想定しています。したがって、全世界で年間1万9,300人程度が「CTX-712」の治療を受けるようになる可能性があると考えています。
プラチナ製剤抵抗性卵巣がん治療薬の潜在市場規模は1,000億円以上
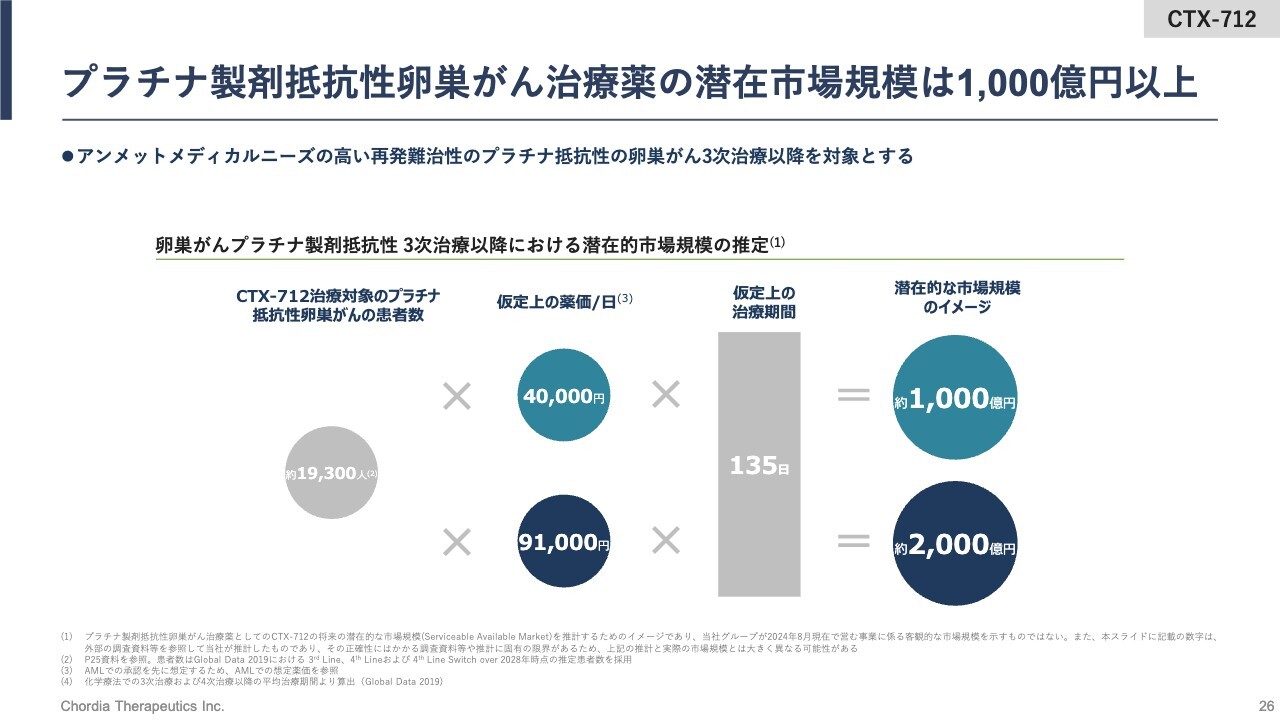
スライドは、プラチナ製剤抵抗性卵巣がん治療薬の潜在市場規模を計算したものです。1万9,300人に想定される薬価に仮定上の治療期間を掛け合わせると、年間で1,000億円から2,000億円の市場が、プラチナ製剤抵抗性の卵巣がん患者さまの治療薬に存在していると考えています。
当社がこの半分程度を「CTX-712」で取ることができれば、先ほどの再発・難治のAMLのピークセールスに500億円から1,000億円ほどを足すことができるだろうと考えています。
適応拡大で製品価値の最大化を中期的に目指す
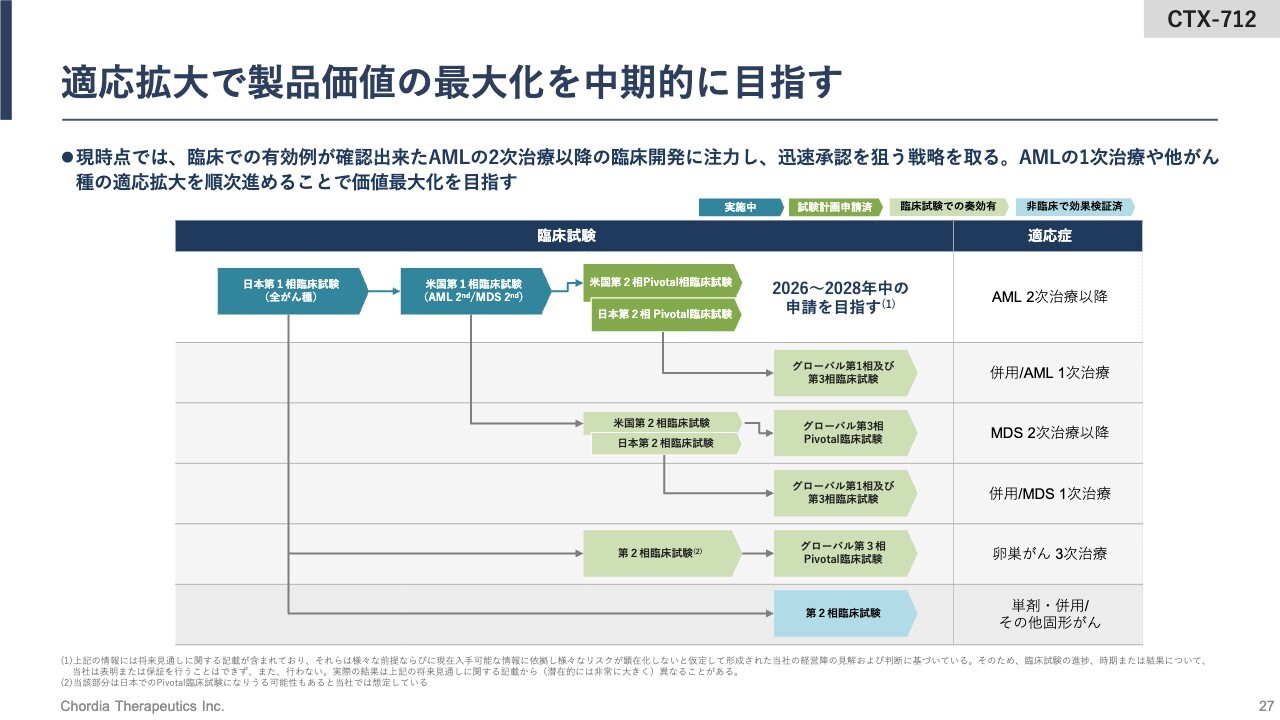
当社は、適応拡大によって「CTX-712」の価値最大化を図っていく想定です。まずは、再発・難治のAMLで承認を取りにいきたいと考えており、早ければ2026年から2028年に申請できると考えています。
それと並行もしくはその後に、AMLの1次治療やMDSの1次治療、2次治療、また卵巣がんの2次治療で適応を拡大していくことによって、「CTX-712」の製品価値の最大化を図っていきます。
最初に承認を目指すAMLでは複数の新薬が第2相で承認を受けている
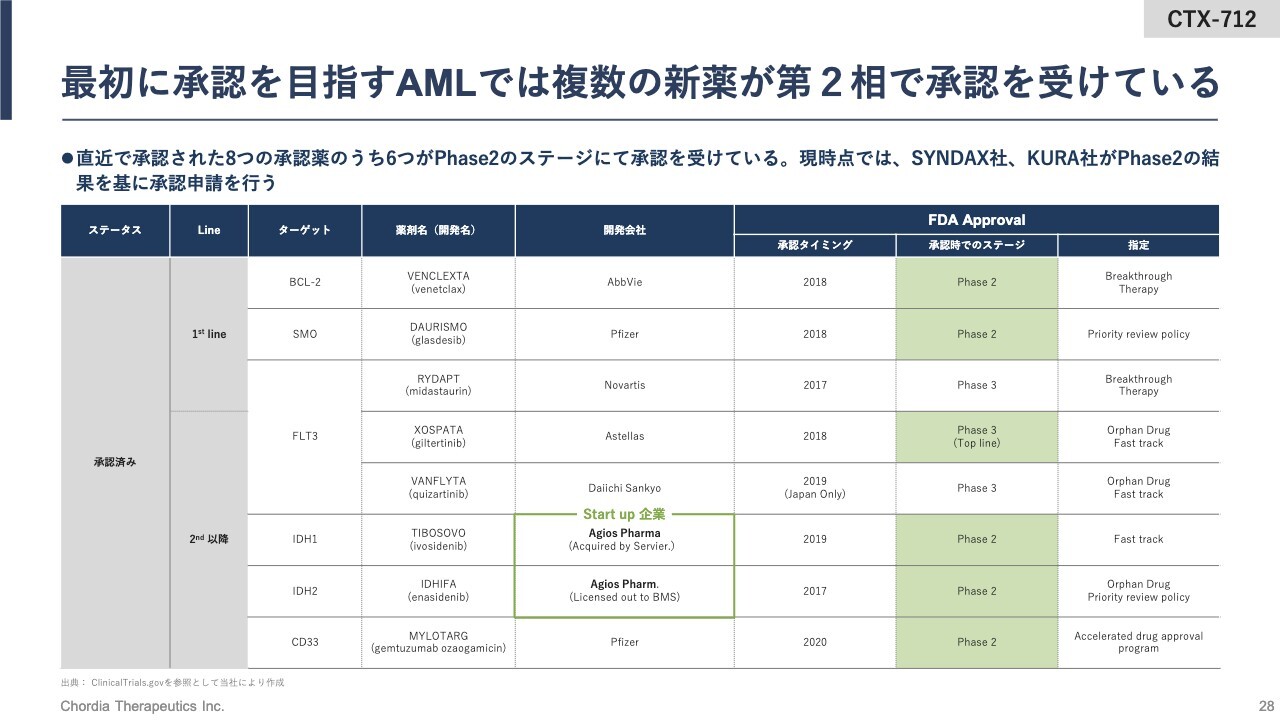
当社は、再発・難治のAMLの治療の承認を取るために、第2相臨床試験の成績を活用することを想定しています。
スライドには、直近10年ほどの間に米国FDAから承認を受けたAMLの治療薬を示しています。その多くが、第2相臨床試験の成績をもって条件付きの迅速承認を受けている状況です。当社もこの流れに沿い、第2相試験の成績をもって承認申請をかける前提で開発を続けています。
CTX-712のマイルストン達成状況と今後の想定マイルストン

「CTX-712」のマイルストン達成状況と、今後の想定マイルストンについてです。スライド右上に記載のとおり、まずは今年末までに「CTX-712」の希少疾病用医薬品の指定(Orphan drug designation)を、FDAに申請する準備を進めているところです。
また、来年末までには、米国臨床試験の第1相中間成績の公表を行いたいと考えています。すぐに第2相パートに移行した後、早ければ2026年に第2相データを取得し、2026年から2028年にかけて販売承認申請を行っていく想定です。
競争環境_CLK
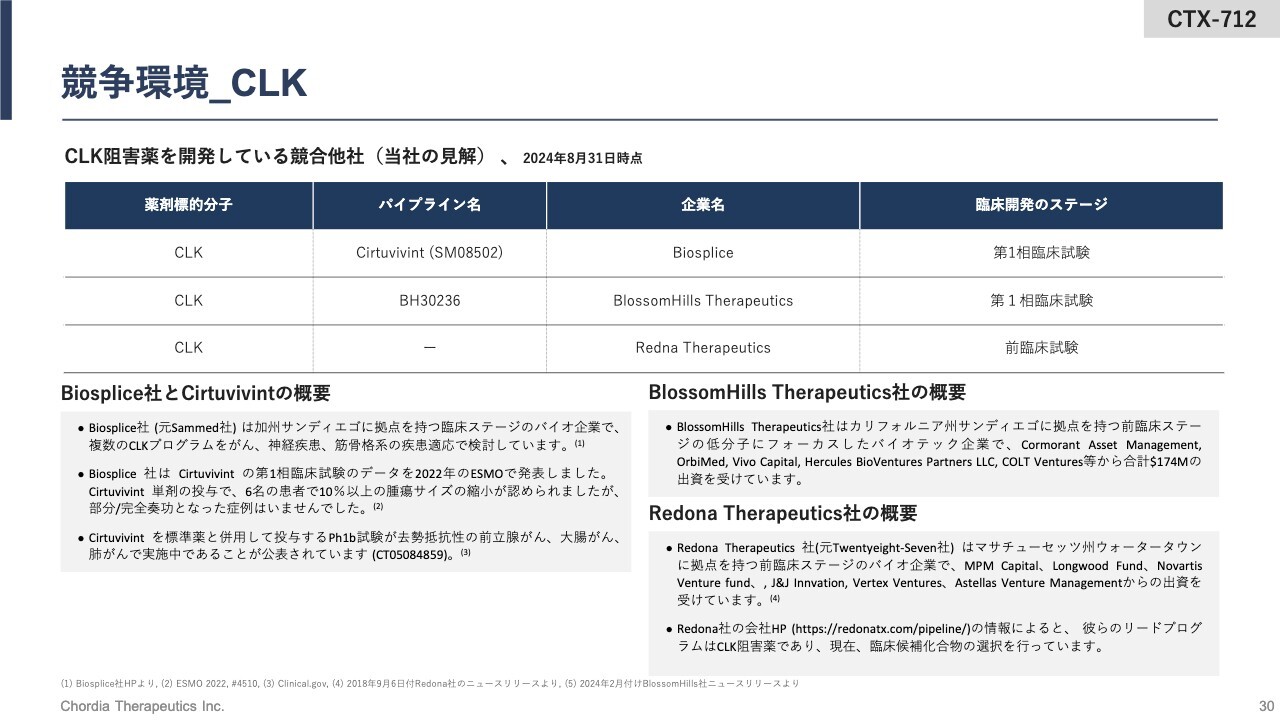
競争環境についてです。CLK阻害薬は現在、当社に加えて米国のバイオテック3社が臨床試験もしくは前臨床試験を行っている状況です。
Biosplice社とBlossomHill Therapeutics社はCLK阻害薬の第1相臨床試験を実施中もしくは準備中、Redona Therapeutics社は前臨床試験のCLK阻害薬を持っているとアナウンスしています。
競合会社が発表しているデータを見る限り、当社の「CTX-712」は、キナーゼの選択性において競合他社よりも優位性を持っていると考えています。
また、開発タイムライン上も、当社は競合他社より3年から5年先を走っていると考えています。しかしながら、米国の会社は多額の資金を調達して私たちを追いかけてきますので、このリードを保ったまま、1日でも早く「CTX-712」を上市し、世界中の患者さまに届けたいと考えています。
CTX-712の物質特許 すでに世界主要各国での登録を完了
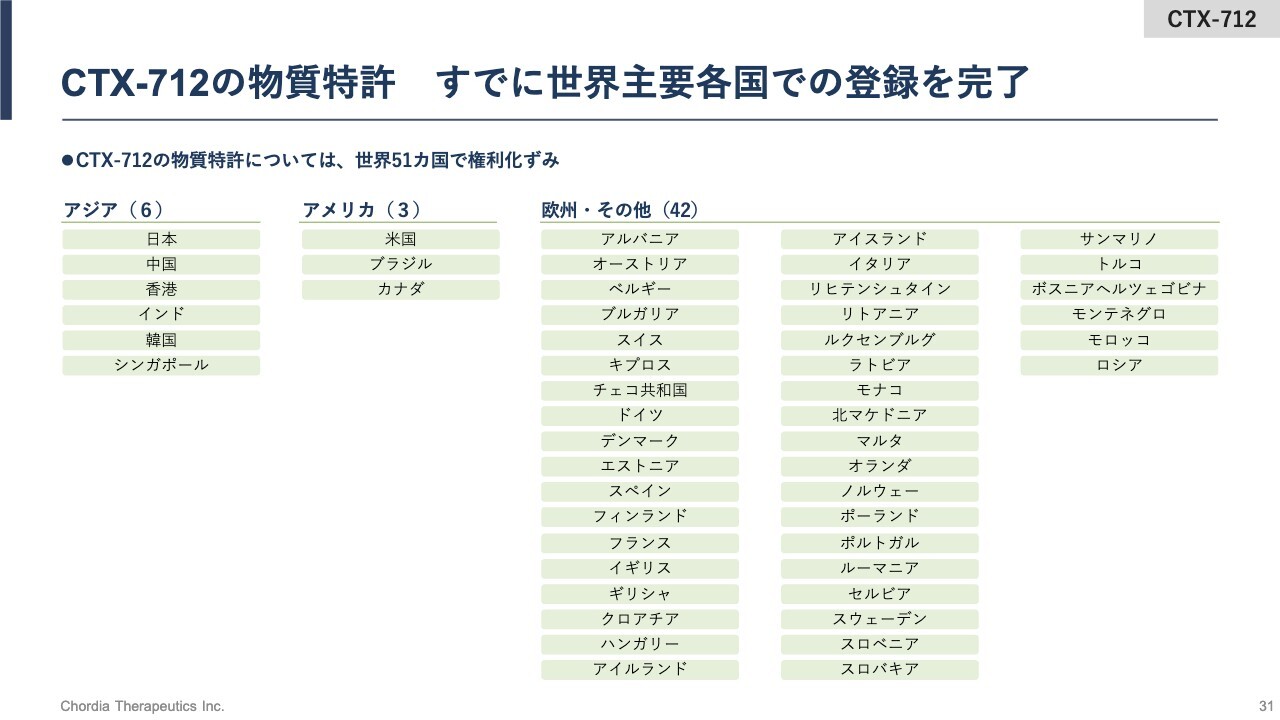
「CTX-712」を含むCLK阻害薬の物質特許の登録状況です。すでに世界51ヶ国で権利化済みです。
Mucosa Associated Lymphoid Tissue protein 1(MALT1)阻害薬
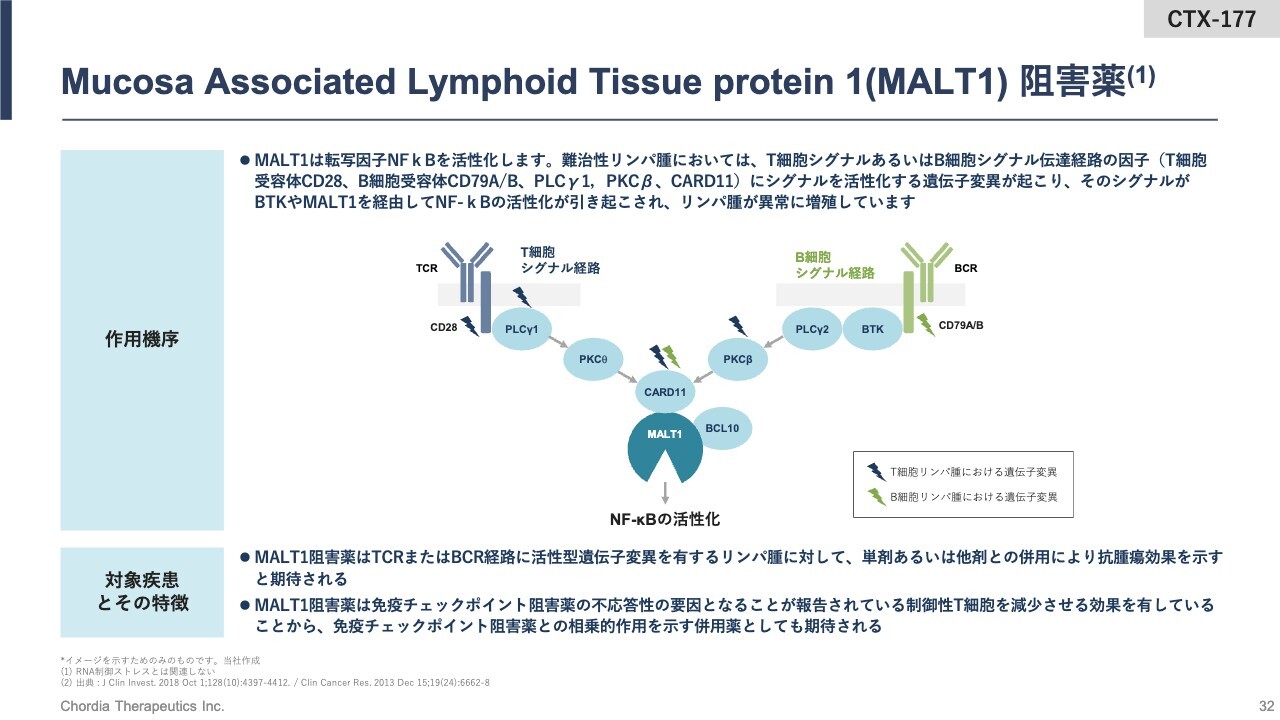
当社の2号パイプラインについて簡単にご説明します。2号パイプラインは全世界での権利を小野薬品工業株式会社に導出していますが、MALT1というタンパク質の機能を阻害することによって、リンパ腫の治療に使えるような開発品です。
オプジーボを開発した小野薬品に最大500億円超の条件で導出
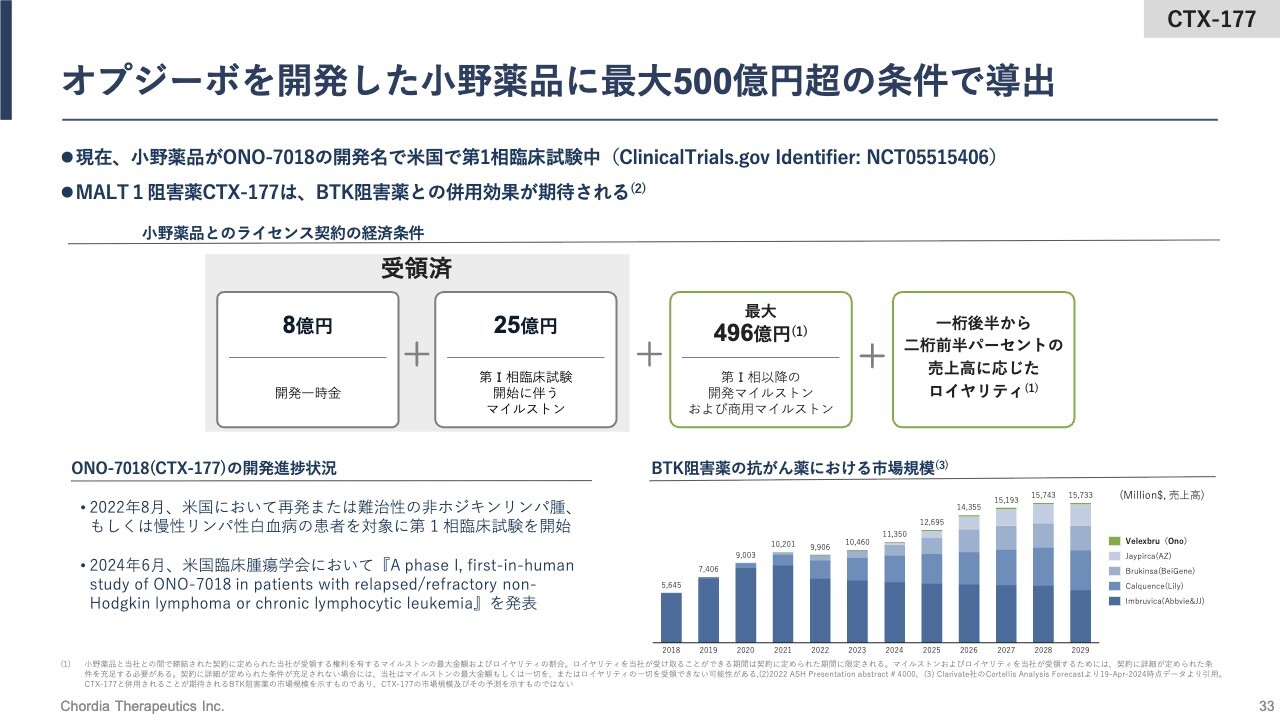
小野薬品工業に導出した際の経済条件です。当社は、開発一時金の8億円に加えて最初の開発マイルストンとして25億円、合計33億円をすでに受領しています。
今後は、開発が進むもしくは販売額が一定額を超えるにつれて、合計で最大496億円のマイルストンを受領する権利を有しています。さらに販売後は、全世界での売上高に対して1桁後半から2桁前半パーセントのロイヤリティを受領する権利を有しています。
小野薬品工業で精力的に開発を続けていただいており、2024年6月の米国臨床腫瘍学会においては、第1相臨床試験の概要が小野薬品工業によって発表されています。
競争環境
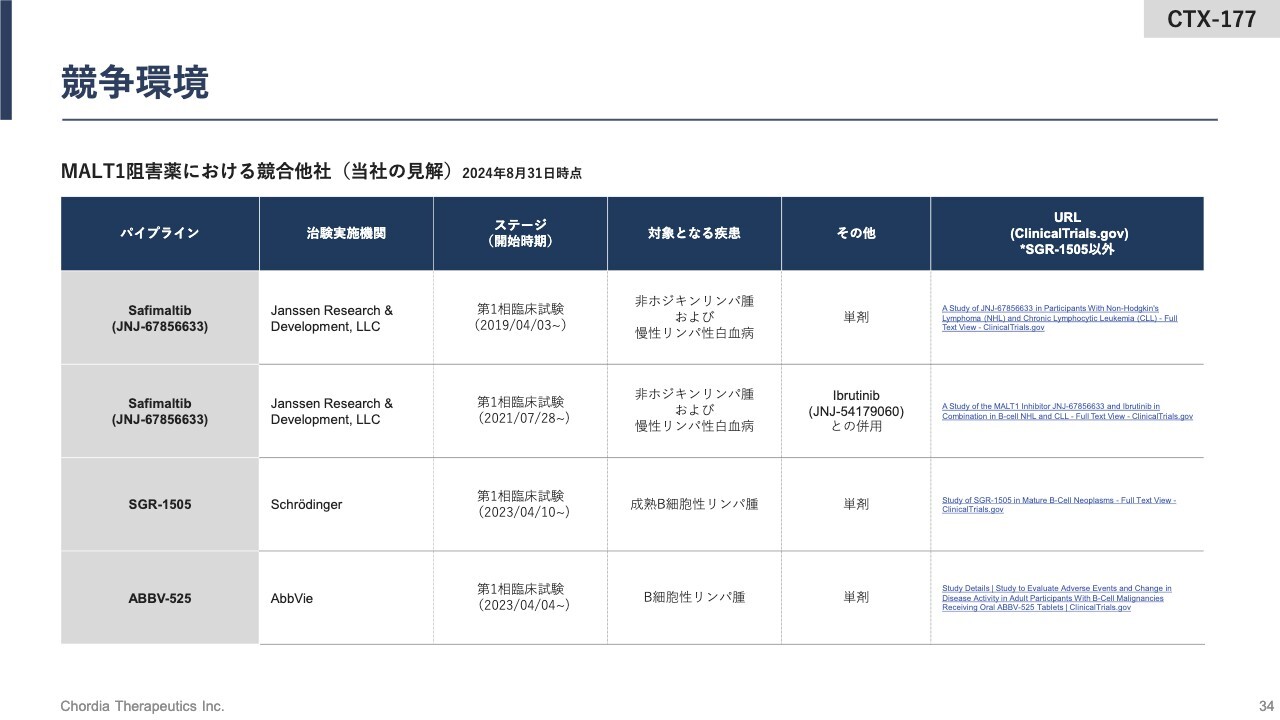
MALT1阻害薬の競合状況です。米国の製薬会社3社が第1相臨床試験を実施しており、当社としても非常に注目を浴びている領域だと認識しています。
アカデミアを中核として11件の共同研究を実施
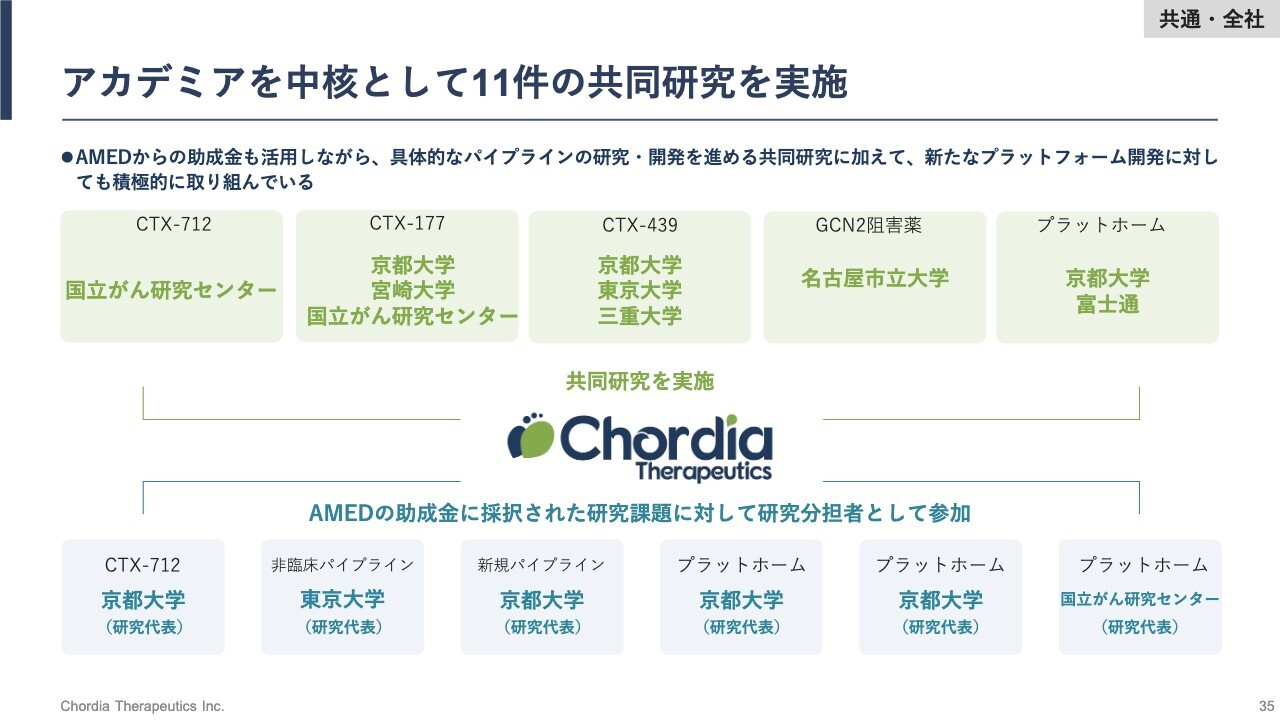
MALT1阻害薬が一番大きな成功例ですが、当社はアカデミアを中核として11件の共同研究を実施しています。
「CTX-712」「CTX-177」以外にも、「CTX-439」や「GCN2阻害薬」、プラットフォームの研究など、スライドに示した大学や企業と共同研究を実施しています。AMEDをはじめとした行政機関からも助成金の補助を受けながら、パイプラインの価値最大化に向けた共同研究を進めています。
4件の物質特許とそれを支える複数の用途特許・製法特許

先ほどは「CTX-712」の物質特許についてご説明しましたが、それ以外の特許状況もスライドにまとめています。
サマリー

2024年8月期の業績と2025年8月期の業績予想についてご説明します。
2024年8月期において事業収益はありませんでした。研究開発費は15億円で、最終損益は18億円の損失となりました。2025年8月期も同様に、研究開発への先行投資のため23億円程度の損失となる見込みです。
2024年8月期末の財政状態(貸借対照表)
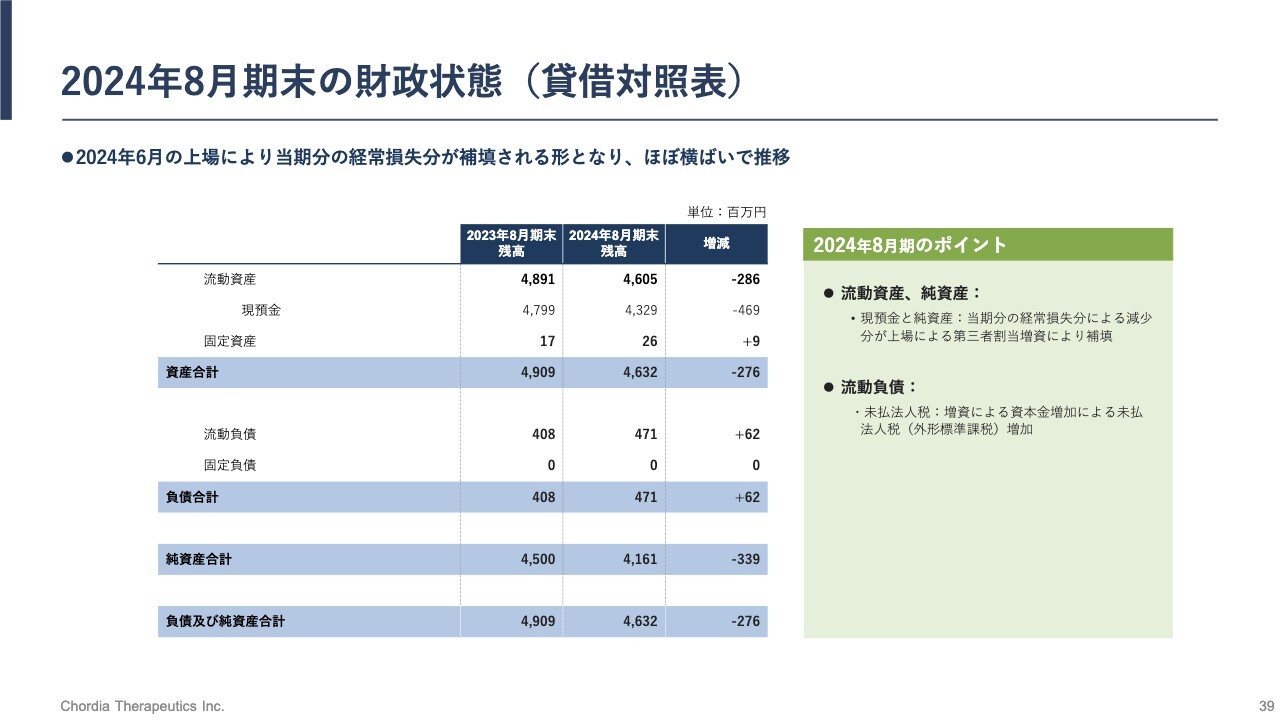
財政状態です。2024年8月期末時点で、現預金として43億円程度を有しています。
2024年8月期の業績(損益計算書)
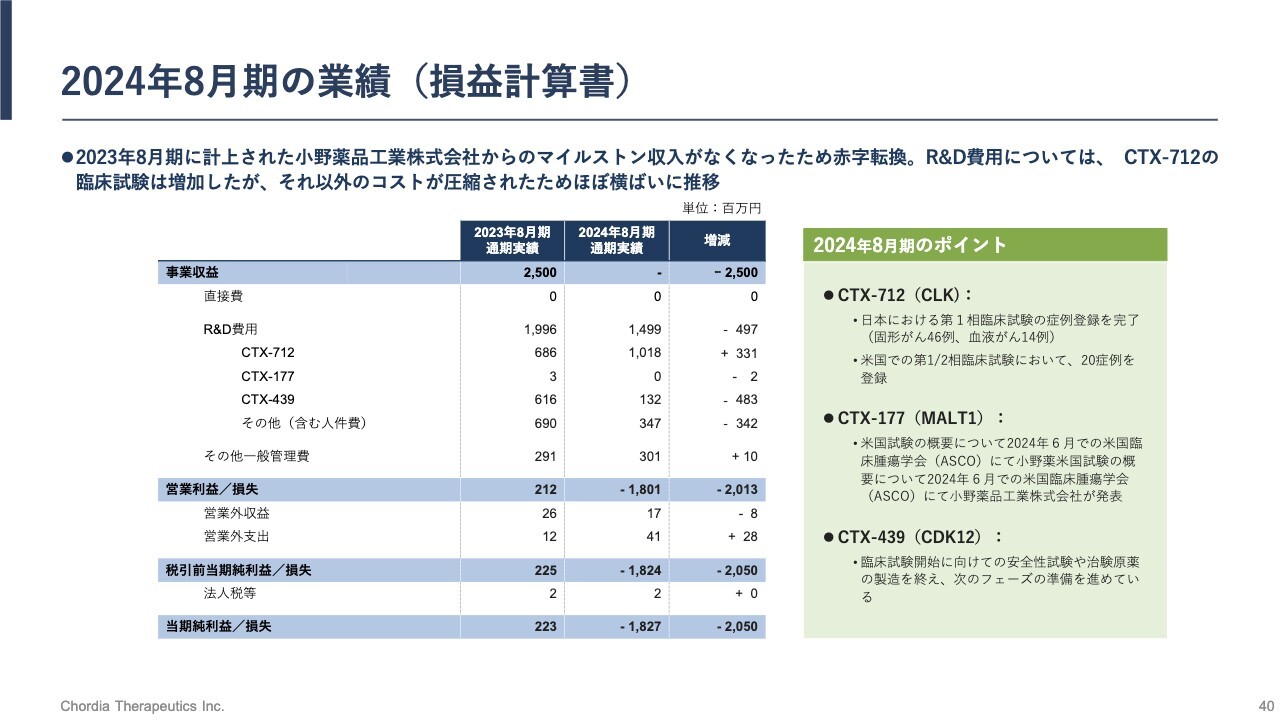
2024年8月期の業績です。研究開発費約15億円のうち、約10億円を「CTX-712」の開発に費やしています。
2025年8月期の業績見通し
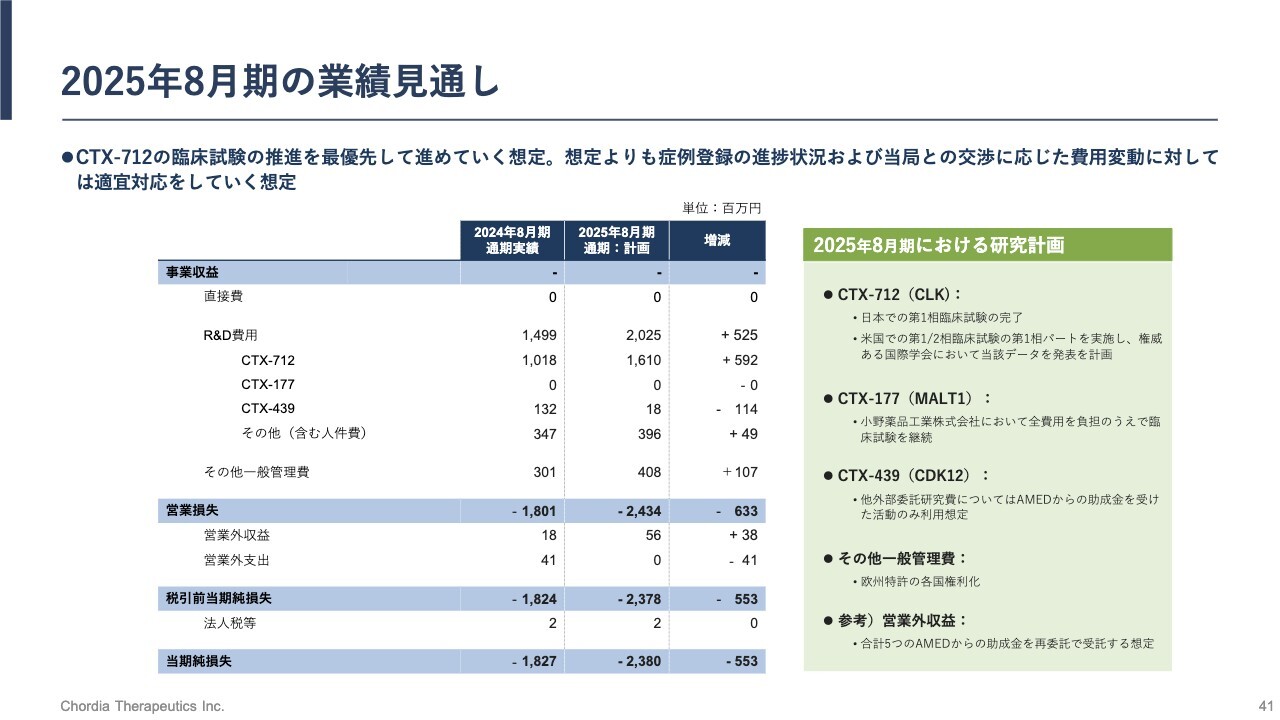
2025年8月期の業績見通しです。研究開発費約20億円のうち、約16億円を「CTX-712」の開発進捗に費やす計画です。その他一般管理費については、「CDK12」および「GCN2」における欧州各国での特許登録費用の増加を見込んでいます。
研究開発・コーポレート活動ともに順調に進行<2024年8月期>
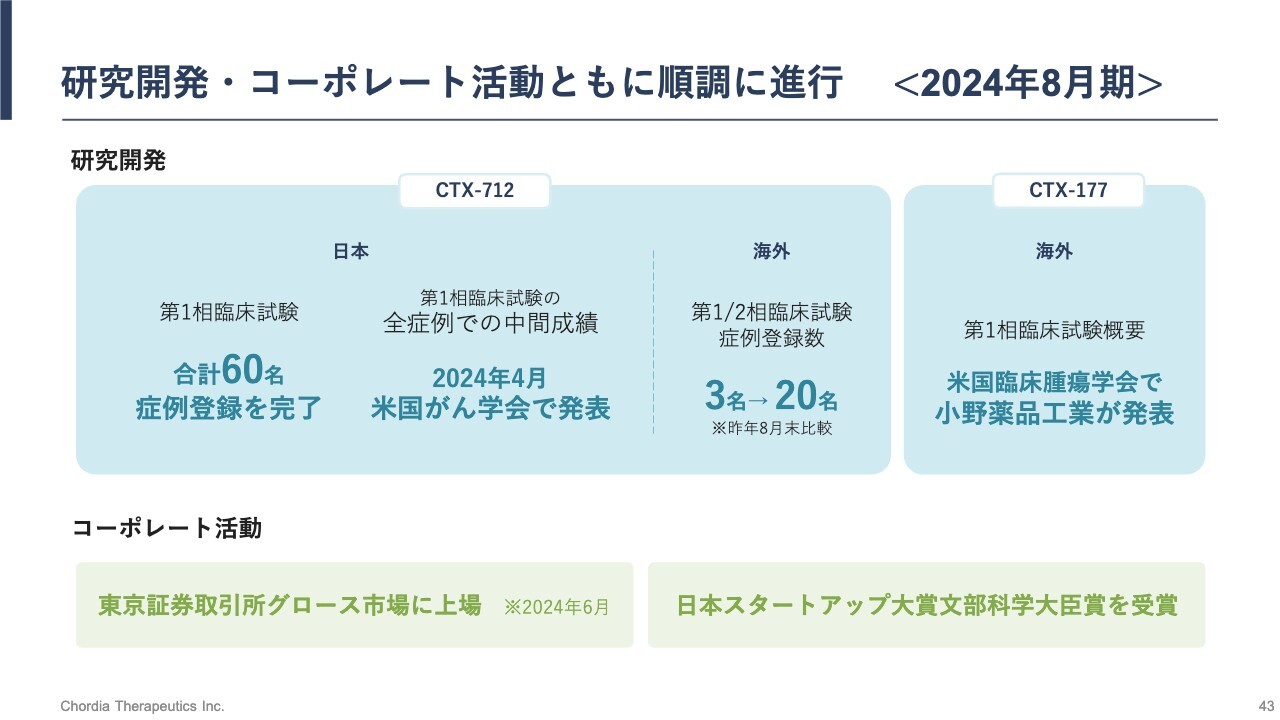
事業の振り返りです。「CTX-712」の研究開発は計画どおりに進んでいます。日本における第1相臨床試験は、すでに60名の症例登録を完了しました。米国で開始した第1/2相臨床試験は、本年8月末時点で20名の患者さまに投薬を行っているところです。
「CTX-177」は、小野薬品工業により米国で第1相臨床試験が順調に進行されています。また、2024年6月には東証グロース市場に上場することができ、「日本スタートアップ大賞2024」において文部科学大臣賞を受賞しました。
2025年8月期に向けての優先事業目標
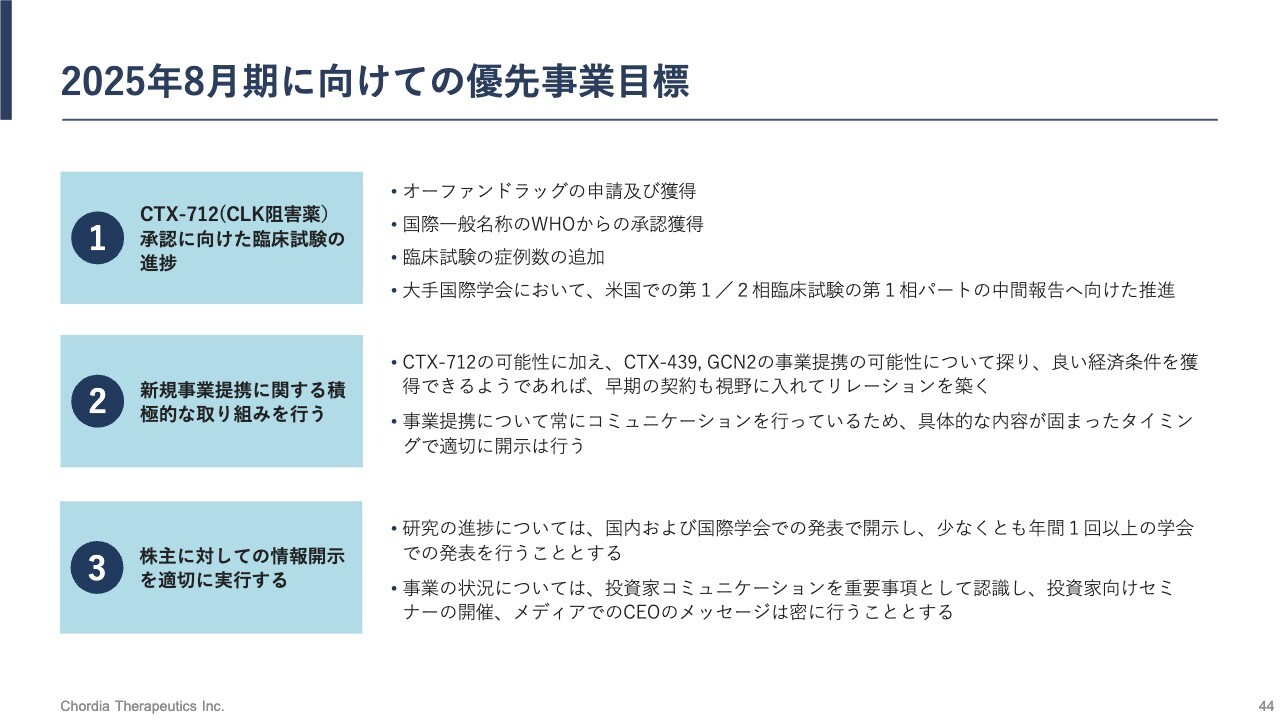
2025年8月期に向けた優先事業目標です。先ほど「CTX-712」の開発マイルストンでご説明したオーファンドラッグの指定に加え、国際一般名称(INN)のWHOからの承認を今年末までに獲得できる想定です。「CTX-712」に名前が付くことになります。
また、米国第1/2相臨床試験をしっかりと行い、中間報告を行うための準備も進めます。「CTX-712」の可能性に加え、前臨床パイプラインである「CTX-439」や「GCN2」の価値最大化も図っていきます。
加えて、事業提携の可能性を探り、良い経済条件を獲得できるようであれば早期契約も視野に入れて、製薬会社やバイオテック企業とリレーションを築いていきます。事業提携については常にコミュニケーションを行っているため、具体的な内容が固まったタイミングで適切に開示を行う想定です。
同様に、株主に対し適切に情報開示を行っていくことが大切だと当社は認識しています。
当社の経営理念と2030年ビジョン

当社の経営理念と2030年のビジョンです。日本から世界中のがん患者さまへ、これまでにない新しい抗がん薬を一日でも早く届けるために努力しています。2030年には、日本発の研究開発型の製薬会社となり、規制当局に承認された薬を持つ会社になりたいというビジョンを掲げています。
当社の情報開示の方針について

こちらのスライドには、当社の情報開示の方針を示しています。
免責事項

免責事項です。以上で、2024年8月期の決算説明を終わります。
質疑応答:「CTX-712」の開発スケジュールの遅れについて

質問者:「CTX-712」の米国における第1相中間成績の公表時期などが、前回の資料と比べて後ろ倒しになっているように見えます。開発スケジ
新着ログ
「医薬品」のログ