オンコリスバイオファーマ、新薬開発にも尽力 がん、感染症領域に対して「ウイルス創薬」により画期的な治療薬を
COVID-19による影響

浦田泰生氏(以下、浦田):みなさま、こんにちは。オンコリスバイオファーマの浦田でございます。新型コロナウイルスの感染拡大が続く中、またオリンピックの真っ最中ではございますが、お忙しい中ご参加いただきまして、どうもありがとうございます。それではさっそくですが、2021年12月期の中間決算説明会を開始させていただきたいと思います。
本日はまず業績発表を行い、その後に各パイプラインの進行状況についてお話ししたいと思います。最後に、今後のマイルストーン等についても、併せてご説明したいと思います。
まず、今世界中に広がっているCOVID-19による影響です。当社もご多分に漏れず、非常に大きな影響を受けているとお伝えしなければなりません。
1番目に挙げたのが、治験薬に対する製造(CMC)についてです。GMP製造に必要なさまざまな物資の不足が起こっています。同時に、製造会社(CDMO)がワクチン製造に追われており、当社が入り込むようなスロットが十分に用意されていないという状況にあります。
特にスライド最初の「①」ですが、ワクチンを作るためにいろいろな培地やカラムなどのようなものが、ある意味では買い占めをされている状況です。我々もできる限り早くこのような物資の調達を行っているわけですが、なかなか手に入りづらいという状況もあります。
特に我々のようなウイルスを作る会社は、みなさまもご存じのようにAstraZeneca社やJohnson&Johnson社がウイルスベクターを使ったワクチンの製造を大々的に行っているため、我々もその間を縫ってスロットを確保している状況です。
2番目に、我々が行っている国内外での臨床試験の遅延が、無視できない状況になってきています。医療機関においては、マスクやガーゼ、ガウンのようなものが、昨年は非常に手薄になっていました。今年はこのような物資に関してはかなり改善していると聞いているのですが、医療側が治験になかなか力を割けないということがあります。
もう1つは、今日の日経新聞の朝刊にもありましたが、コロナ禍に伴い、がん検診などの受診控えが起こっています。少なく見積もっても20パーセントくらいが受診を控えている状況で、なかなか治験の参加条件に合う患者さまが出てこない状況があるようです。
とは言え、臨床試験が止まっているわけではなく、動きがスローになっている状況です。残念ながら今、国内も海外も、特に日本は第5波の最中ですし、アメリカはいったんパンデミックが収まったように見えたのですが、またデルタ株によって新規感染者が増えているということで、大変危惧すべき状況ではないかと考えています。
2021年上半期 業績結果
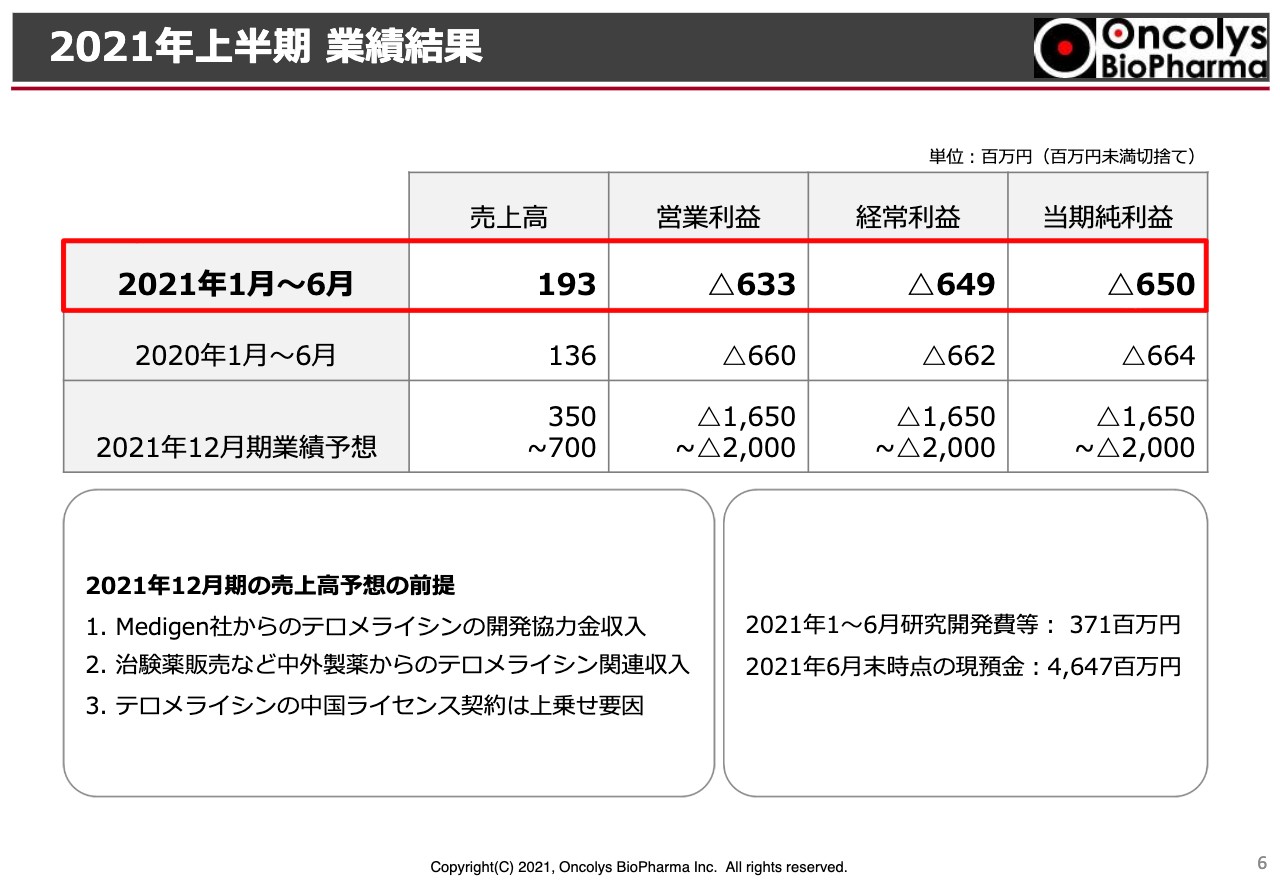
今年上半期の業績です。スライドに記載のように、売上高は1億9,300万円、営業利益は6億3,300万円の赤字です。経常利益、当期純利益ともに6億5,000万円程度の赤字でした。この数字は昨年、一昨年の上半期の数字と大きな差は出ていません。特に経費等に関しては同等の推移になっています。
今年の年度末までの業績予測ですが、スライドのテーブルに記載のように、3億5,000万円から7億円の売上高になると予測しています。営業利益、経常利益あるいは当期純利益についても、だいたい16億5,000万円から20億円の赤字を見込んでいます。
売上の内容は、これまでと大きく変わっていませんが、台湾のMedigen社からの「テロメライシン」の開発協力金の収入、中外製薬からの治験薬製造を行った分の販売をしており、これらの関連収入があります。
さらに、今年度に見込んでいる「テロメライシン」の中国圏のライセンスの契約が決まれば、もう少し大きな幅を持った収入になると予想しています。今年の上半期の研究開発費は約3億7,100万円です。今年の6月末時点での現預金は46億4,700万円となっています。
2021年上半期のトピックス①

今年上半期の当社のトピックスについてお話しします。まずコーポレート全体として、今年の1月から3月にかけて資金調達を行い、33億円程度の資金調達が完了しました。また3月の株主総会では、取締役の任期を1年に短縮しています。これにより取締役会を活性化させる狙いです。
「テロメライシン」については、7ページに記載のように6つのトピックスがあります。1つ目は中外製薬が行っている臨床試験、あるいは製造についてです。当社が主体になって行っていますが、いろいろな意味で遅れが生じてしまい、承認申請を2023年から2024年に延長しています。これは、2024年末ということではなく、現段階ではできる限り2024年の早い段階での承認申請を見込んでいます。
2つ目は肝細胞がんの臨床試験の投与を開始しました。3つ目は頭頸部がんの臨床試験の投与が始まりました。
4つ目は国立がん研究センター東病院で行っていたチェックポイント阻害剤のペムブロリズマブ併用の食道がんPhase1bの組入れが終わり、現在患者さまのフォローアップを行っている状況です。
5つ目は後ほど詳しくご説明しますが、Henogen社というベルギーの会社と将来の商用製造におけるセカンドサプライヤーとしての位置づけで契約ができました。
6つ目が、医薬品として商業化される前によくこのような名前を付けますが、国際一般名として「suratadenoturev」という名前に決定しました。
続きまして「OBP-702」についてお話しします。第2世代の「テロメライシン」ですが、こちらは前臨床試験とGMP製造について苦労しながらスタートしています。これにより治験申請を来年末までに行う予定でしたが、2023年に遅延しています。
その一番大きな原因はGMP製造です。後にお話ししますが「テロメライシン」とは若干異なることを考えなければならない状況で遅延しています。しかし、これは決定したわけではなく、できる限り来年中に治験届が出せるよう最大限努力したいと考えています。
2021年上半期のトピックス②

コロナ治療薬の開発状況についてお話しします。今年に入り、2番目の化合物「OBP-2011」を特定しています。昨年、お話ししていた「2001」と少し名前がややこしいですが、最初の化合物と基本骨格は同じで、より活性が強いものを特定しています。
この化合物については、スライド8ページに記載の、イギリス型(α)、南アフリカ型(β)、ブラジル型(γ)、インド型(δ)すべてに対して効果を示すことがすでに確認されています。さらに2000年に入り、パンデミックを起こしたSARS、MERSといったコロナウイルスに対しても、同等の効果があることを確認しています。
開発については、CROである新日本科学と包括的な契約を結んでおり、共同研究契約として前臨床試験を開始しています。また、製造についても非常に経験豊富なスペラネクサス、スペラファーマといった企業と契約を結んでいます。
「テロメスキャン」は、今年の6月に順天堂大学と共同研究講座を開設しています。将来、我々が商売する上でのプラットフォームを大学としっかり共同して作る計画として、話が進んでいます。
最後に「OBP-601(Censavudine)」ですが、アメリカのTransposon社とすでにライセンス契約を行っています。Transposon社がアメリカ合衆国のFDAに、治験届である「IND申請」を行い、すでに治験実施のゴーサインをいただいています。これにより、年内には神経変性疾患を対象にした治験薬の投与が行われる予定です。
以上が2021年上半期のトピックスになります。これらを含めて、パイプラインのそれぞれの状況についてご説明したいと思います。
承認申請時期の遅延

「テロメライシン」についてです。これは先ほどお伝えしたとおりですが、承認申請時期が年度として1年遅れることが中外製薬から発表されています。それ以外の状況については、先ほどお話ししたとおりです。
商用製造セカンドサプライヤーの決定/GMP製造

商用製造セカンドサプライヤーをHenogenという会社に決定しました。Lonzaという会社および当社が作ってきたわけですが、だんだんとLonza社も手狭になってきている状況です。
Lonza社は、特にワクチン製造において相当なエネルギーをかけている状況です。やはり中外製薬としても商用化する上で、1ヶ所ではなにかあった時に困るという意向があり、世界中で会社を探したわけです。
そこで、Thermo Fisherグループの子会社であるHenogen社を特定しました。経験も大変豊富な上に、商用化ウイルスをGMP製造で作っていく実力が十分にあると判断してこの会社と提携し、現在GMP製造において製法を変えています。
これまではバッグで製造してきたのですが、これからはタンクの製造に切り替えていきます。また、新たにマスターセルバンクを再製造し、各工程のプロセスバリデーションを詳細に実施しています。2023年末までに商用生産のGMP製造を成功させる目的で進んでいます。
局所がん免疫微小環境の変化

臨床試験の状況です。現在の組入れはまだ11例です。昨年末に中間解析を行った結果、1例は長期に生存されていると報告を受けています。
「ペムブロリズマブ」単独では局所の胃がんにほとんど効かないわけですが、「テロメライシン」を注射することで比較的きれいに腫瘍が消えたという症例が認められています。今後は18例まで投与を行う予定です。これで中間評価を行い、今後はどうするかについて決定していきたいと考えています。
また、投与前は、がん細胞を殺すような免疫細胞があまり血液中に見られなかったのですが、「テロメライシン」を投与し、その後の血液を調べると、T細胞あるいはB細胞のクラスターがたくさん出てきます。もちろん「ペムブロリズマブ」の効果もあるのかもわかりませんが、「テロメライシン」の効果としては予想どおりの結果が得られています。
WHOによる国際一般名称の決定

あまり聞き慣れないと思いますが、国際一般名称は「suratadenoturev」に決まりました。スライド下部の表のとおり、「ヘルペスウイルス」「アデノウイルス」などの開発が進んでいる会社では、このような一般名がどんどん決まっています。第一三共と東京大学医科学研究所が開発し、先日許可されたヘルペスウイルスの一般名も「teserpaturev」となっており、これが世界に通じる名前になります。
我々はこれまで通称で「テロメライシン」と呼んできましたが、世界的にこれからは「suratadenoturev」という名前になります。名称として「adeno」「turev」は決まっており、後は頭にどのようなものを乗せるかで、かなりたくさんの候補を挙げました。最終的に、WHOから「これは使えるのでは」と言われたのが「surat」です。
今後の開発見通し
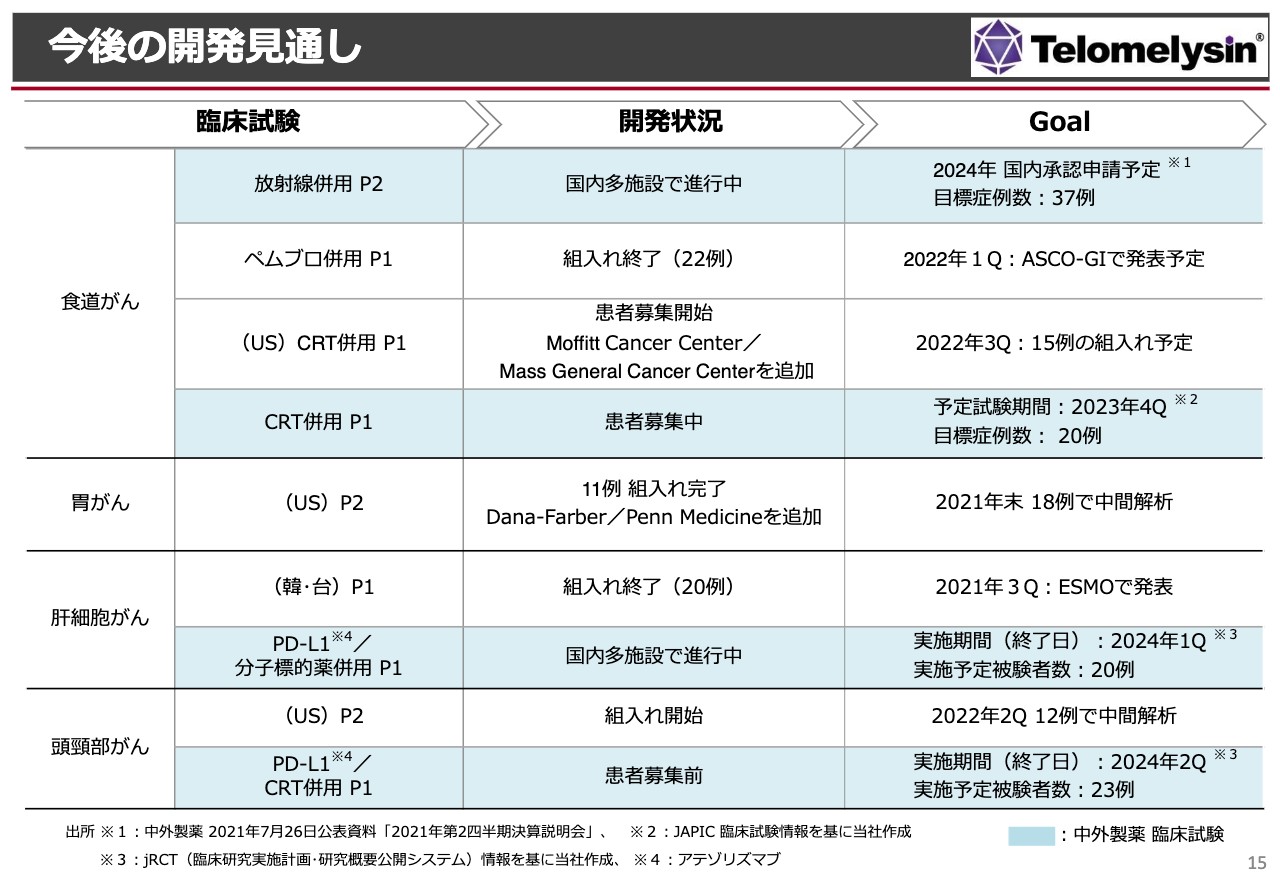
今後の開発見通しですが、表のとおり、食道がんに関しては4つあります。一番重要なのは「放射線併用 Phase2」です。これは中外製薬(表の青色部分)ですが、目標症例数は37例であるため、2024年はできる限り早い段階でしっかりと承認申請できるように進めていきます。
「国内のペムブロ併用 Phase1」の国立がん研究センター東病院では、組入れが22例となりすでに終わっているため、来年、ASCO-GIという学会で発表する予定です。また、アメリカでの「CRT(化学放射線)併用 Phase1」は、まだ1例も進んでいませんが、組入れを開始できる状況になっています。モフィットがんセンターやマサチューセッツ総合病院 でも臨床試験が開始される予定になっています。国内の「CRT(化学放射線)併用 Phase1」も、現在患者さまの募集は開始されているものの、中外製薬としてはまだ1例も進んでいない状況です。
胃がんについては、先ほどお伝えしたとおりです。これまではコーネル大学のみでしたが、ダナ・ファーバーがん研究所、ペンシルベニア大学を追加しています。
肝細胞がんについては、当社のPhase1はすでに終わり、今年の秋頃、11月に欧州臨床腫瘍学会(ESMO)で発表する段取りができています。中外製薬でも免疫チェックポイント阻害剤と分子標的阻害剤を併用した肝臓がんのPhase1がスタートしています。これは投与が開始されたということです。
頭頸部がんに関しては、アメリカでのPhase2を当社が行っています。国内でも中外製薬が行っており、組入れが始まったのは当社のアメリカの臨床試験です。中間成績で1年目の結果が出ましたが、注射した腫瘍が完全に消えたという結果が認められており、スタートとしては非常によい状況だと考えています。
腫瘍溶解ウイルスの開発状況
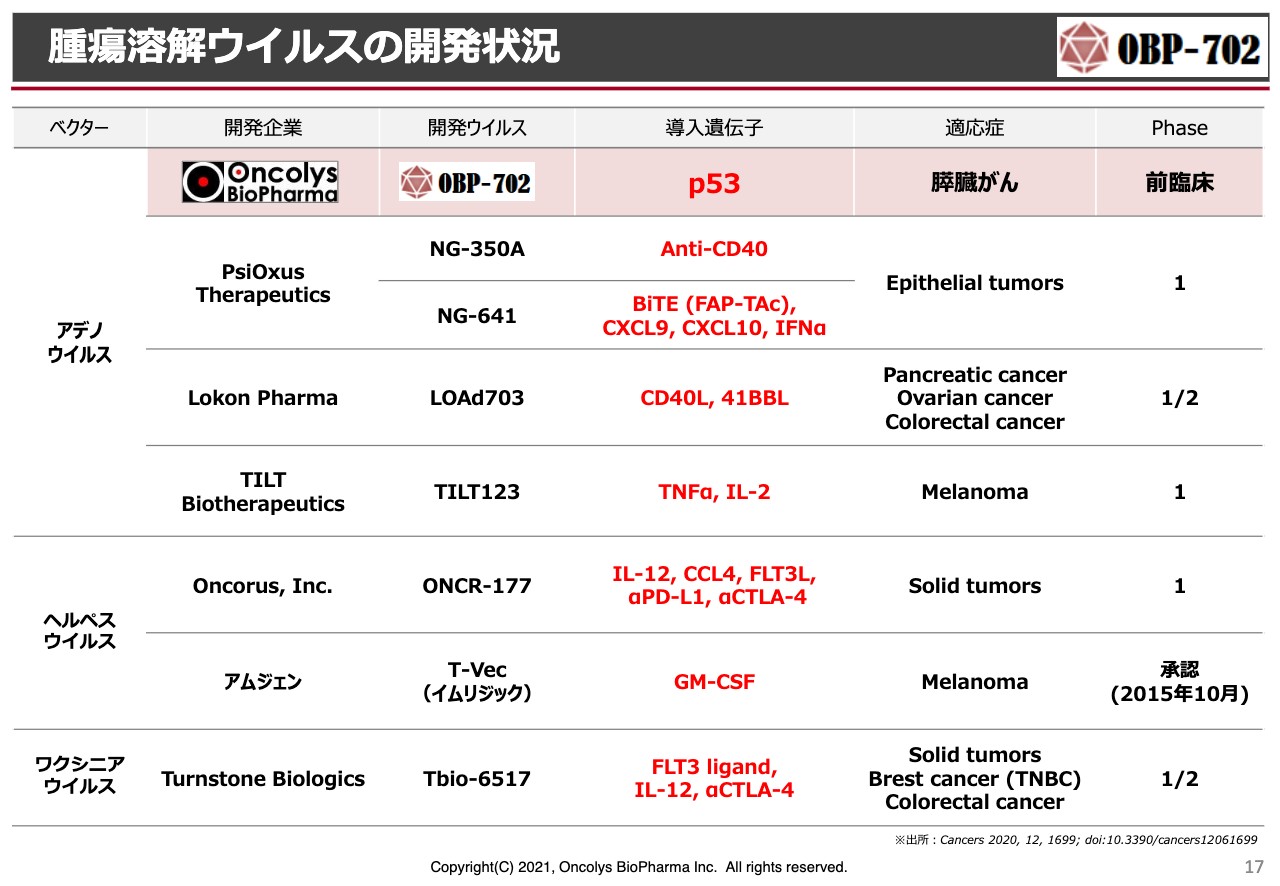
次世代テロメライシン「OBP-702」についてです。世界においてオンコリティックウイルス(腫瘍溶解ウイルス)の競争が非常に激しくなってきています。スライドでは赤文字で示しましたが、アデノウイルスにもいろいろな分子を搭載することでより強力に、あるいは免疫チェックポイント阻害薬との併用効果をより強力なものにしようと、いろいろな試みが行われています。当社は「p53」という、がん細胞に対して非常に強力にアポトーシスさせる分子を入れ、チャレンジしていきたいと考えています。
OBP-702の特長
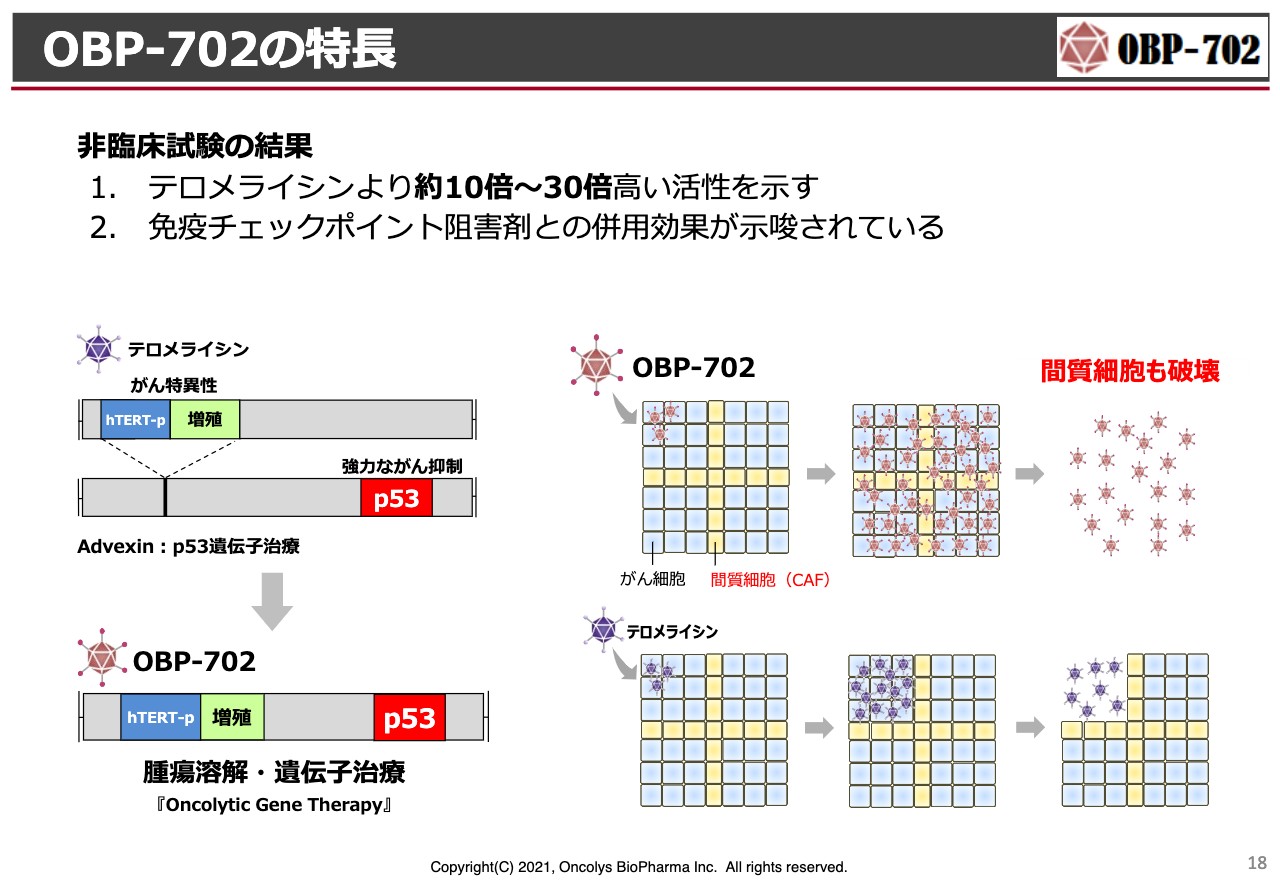
何度もお伝えしましたが、「OBP-702」は「テロメライシン」の遺伝子配列の中に、非常に強力な「p53」というがん抑制遺伝子を入れているものです。
開発に対する専門医の見解

すでにいろいろな臨床医からの話をアメリカなどで聞いています。どのような対象で行うのがよいかについて、まず国内では、岡山大学で膵臓がんでの臨床試験の準備が始まっています。
ご存知のように、膵臓がんは非常に予後が悪いがんです。見つかった段階で、ステージ3、またはステージ4と診断される可能性が高い、非常に難治性のがんです。
特に膵臓がんは、繊維芽細胞(fibroblast)が非常にたくさんがん組織にあるため、抗がん剤が効きにくいです。「OBP-702」は、このような繊維芽細胞にも効果を示すことがわかっていますので、膵臓がんにあえてチャレンジしてはどうかと考えています。
それ以外の疾患に対してアメリカの先生にうかがったところ、全身性の筋肉のがんである骨肉腫(サルコーマ)に対して、非常に投与しやすく、また、腫瘍崩壊が起こることで、全身性の免疫誘導が十分に期待できるのではないかと考えます。
また、オーファン分野になりますが、メラノーマの中でも眼性黒色腫というがんがあります。これは目の中にできる皮膚がんですが、全身に転移しやすいがんです。
メラノーマに対する治験薬は、ウイルスで言いますと、例えばアメリカの「T-VEC(タリモジーン)」があります。国内では、タカラバイオがメラノーマで一定の成績を示した報告があります。
ただ、これまで許可されたアメリカの黒色腫に対する薬は、眼性黒色腫にはほとんど効かないことがあり、もし「OBP-702」がこのようなものに効くことがわかると、オーファン指定を受け、少数例で許可を取れる可能性はあるといった意見が出ています。
それ以外にも、特に肛門近くにできる直腸がんは非常に予後が悪いため、これも局所治療の必要性が非常に強調されています。今後の臨床試験は、このようながんで行っていく予定です。
前臨床試験

現在、前臨床試験では、スライドの赤色で示したところはすでに着手しています。残りは毒性試験などがあり、このためのGLP製造をしっかり行っていきたいと思っています。
「OBP-702」のウイルス製造は、製造用に準備したがん細胞にウイルスを加えることにより、がん細胞の中でウイルスがどんどん増え、がん細胞を殺していきます。
「テロメライシン」と同じ方法で製造を行うと、「OBP-702」は「テロメライシン」よりも30倍ほど活性が強いため、早くがん細胞を殺してしまいます。そのため、製造においても、なかなかたくさん取れず、この部分の改善を今検討しています。
またスライドの右側は、最近、岡山大学から出た結果です。日本で「ゲムシタビン」という膵臓がんの治療薬が出ているのですが、この治療薬に対する耐性株を使って行った実験です。
免疫チェックポイント阻害剤と「OBP-702」を併用し、非常に顕著ながん細胞の増殖の抑制が行われる結果が出てきました。
開発計画
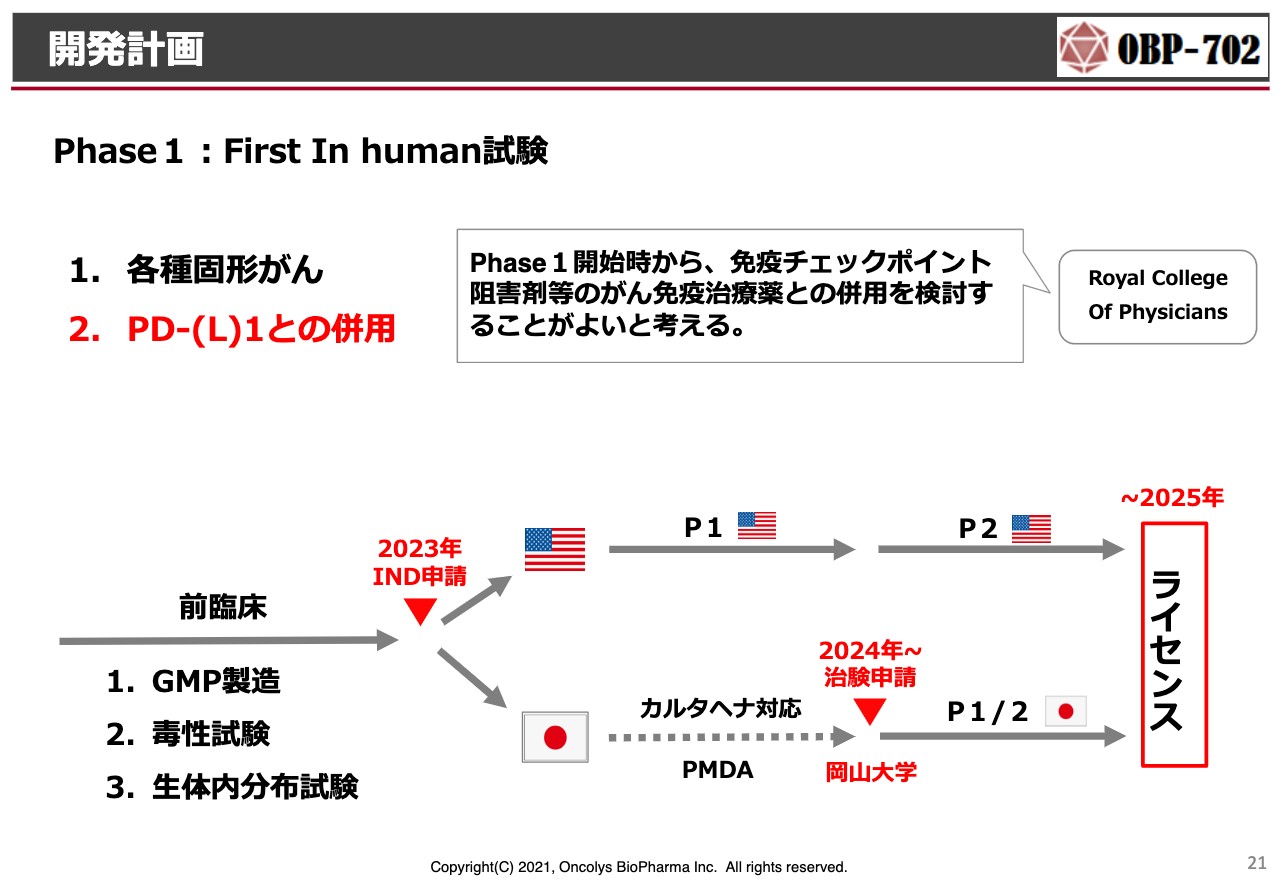
この結果から考えた上で、直近で行う治験計画です。まず「Phase1:First In human試験」を行わなければいけません。
これまでどおり、各種固形がんを対象にする治験の方法は仕方がないのですが、単独投与がこれまでの1つの流れではありました。がんの治療・治験に関する専門家の意見をうかがうと「最初からチェックポイント阻害剤との併用を行ったPhase1を行ったらどうか」と言われています。
当社も、当然その考え方に乗りたいと思っています。今後、どのような先生と、どのようながん種を対象にしてPhase1を行っていくかに関しては、これから検討会などを開いて決定していきたいと思っています。
スライドの下に記載のように、アメリカでPhase1を行って、安全であるという結果をもとに、例えば、岡山大学で医師主導の臨床試験を行い、POC(プルーフ・オブ・コンセプト)をとっていこうと考えています。
当然、将来ライセンスをしたいと思っており、本当はもっと早い時期を設定したいのですが、2025年くらいまでには、しっかりしたPOCを取った上でライセンスにつなげていきたいと考えています。
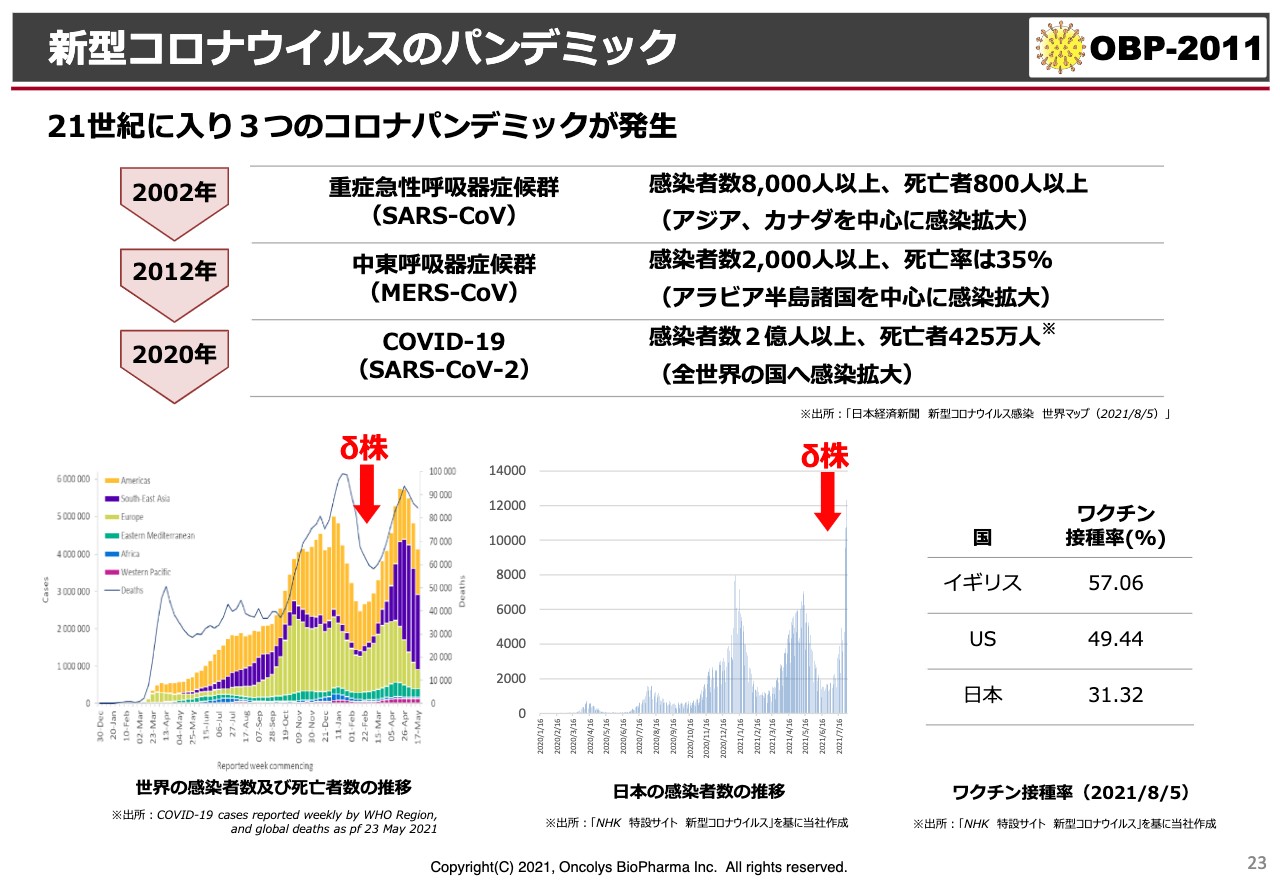
新型コロナウイルスのパンデミック
次に、新型コロナ治療薬「OBP-2011」のお話です。当社は今、経口投与によるコロナ治療薬の開発を試みています。最初のうちは日本国内でも、このパンデミックに対して「ワクチン、ワクチン」でした。ただ、最近になってようやく重症化を抑制するために、まずは中等症にしないことが非常に重要だということがわかってきました。
経口投与を行って、軽症の方から身体のウイルスをなくしていくという戦略が必要であるということが、いろいろな専門家から言われるようになりました。
新型コロナウイルスのパンデミックは、スライドに示したように、2000年に入ってからもうすでに3回起こっています。おそらく、今後10年間の間にも、また新たなパンデミックが起こるだろうと言われています。
それどころか今、日本国内は第5波に見舞われており、まったく性質の違うコロナウイルスがどんどん広がっている状況です。可能な限り早いうちに、我々もこの薬を臨床現場に持っていきたいと考えています。
パンデミックに対する医学専門家の見解

専門家のご意見は今お話ししたとおりで、やはり飲み薬が必要だと考えられています。軽症者に薬を投与して中等症を防ぐことが非常に重要で、医療崩壊を防ぐための第一の手になるべきだと考えられています。
治療薬開発に向けた共同開発体制
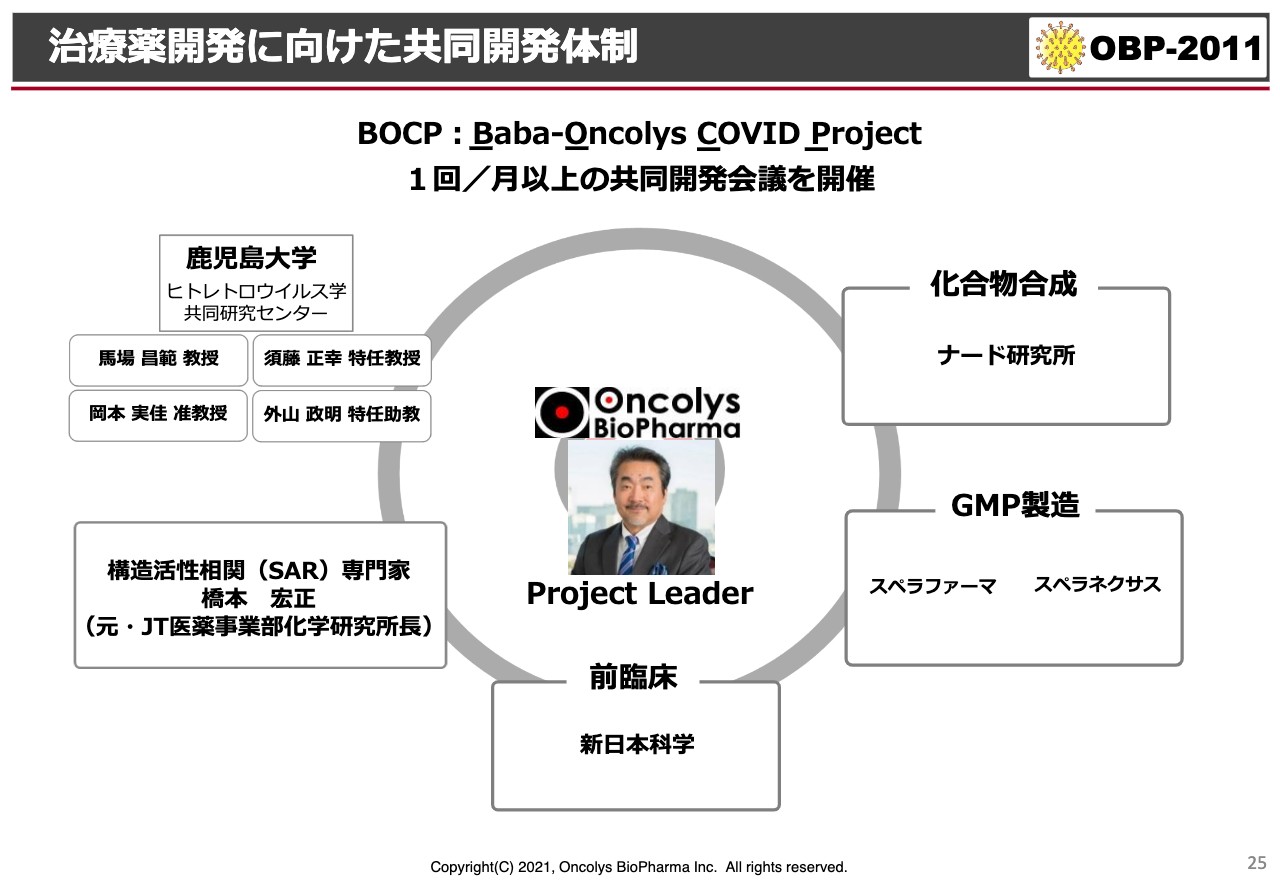
スライドに記載のように、私が自らプロジェクトリーダーになっていますが、BOCPというグループは、鹿児島大学のウイルス学の大家である馬場先生とオンコリスによるCOVIDのチームです。
鹿児島大学だけではなく、ナード研究所という構造活性相関を見て、化合物を作っていただけるような神戸の会社や、スペラファーマ、スペラネクサス、あるいは新日本科学の研究者の方々にも一緒にミーティングに参加いただき、どうすれば早く臨床に出せるかということを、日々ディスカッションしています。
OBP-2011の特長
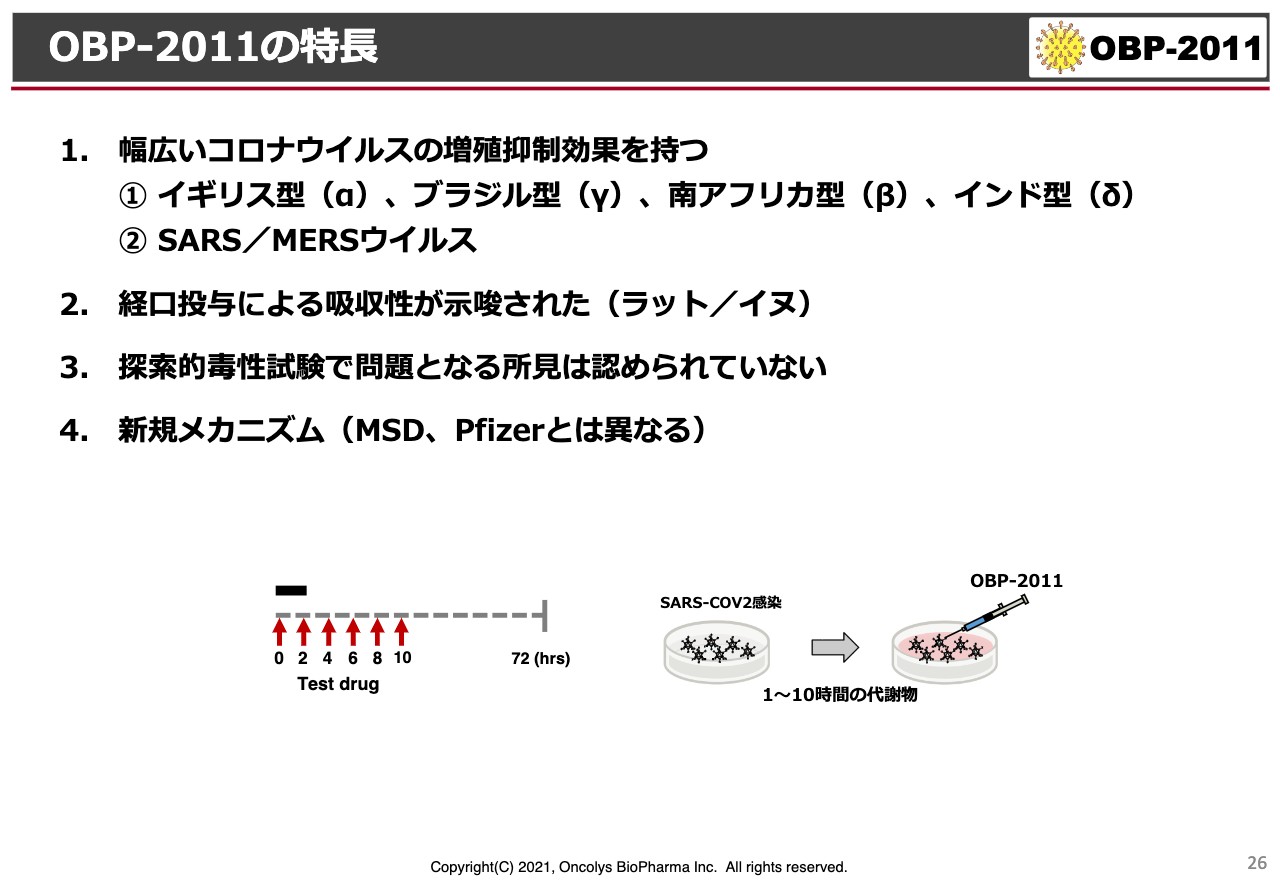
「OBP-2011」の特長です。まだ特許などに関わる内容もあり、なかなかデータをお示しすることはできないのですが、現在わかっているα・β・γ・δの変異型ウイルスに対して効くこと、SARS・MERSに効くことは、お話ししたとおりです。それ以外にも、経口投与できちんと効果が出る可能性がある化合物だということです。
また、これまでの探索的な毒性試験では、問題となるような所見は認められていません。メカニズムについても、ここには記載していないのですが、ほぼ特定できており、ウイルスの最終形成を阻害することがわかってきています。
“飲み薬”として開発
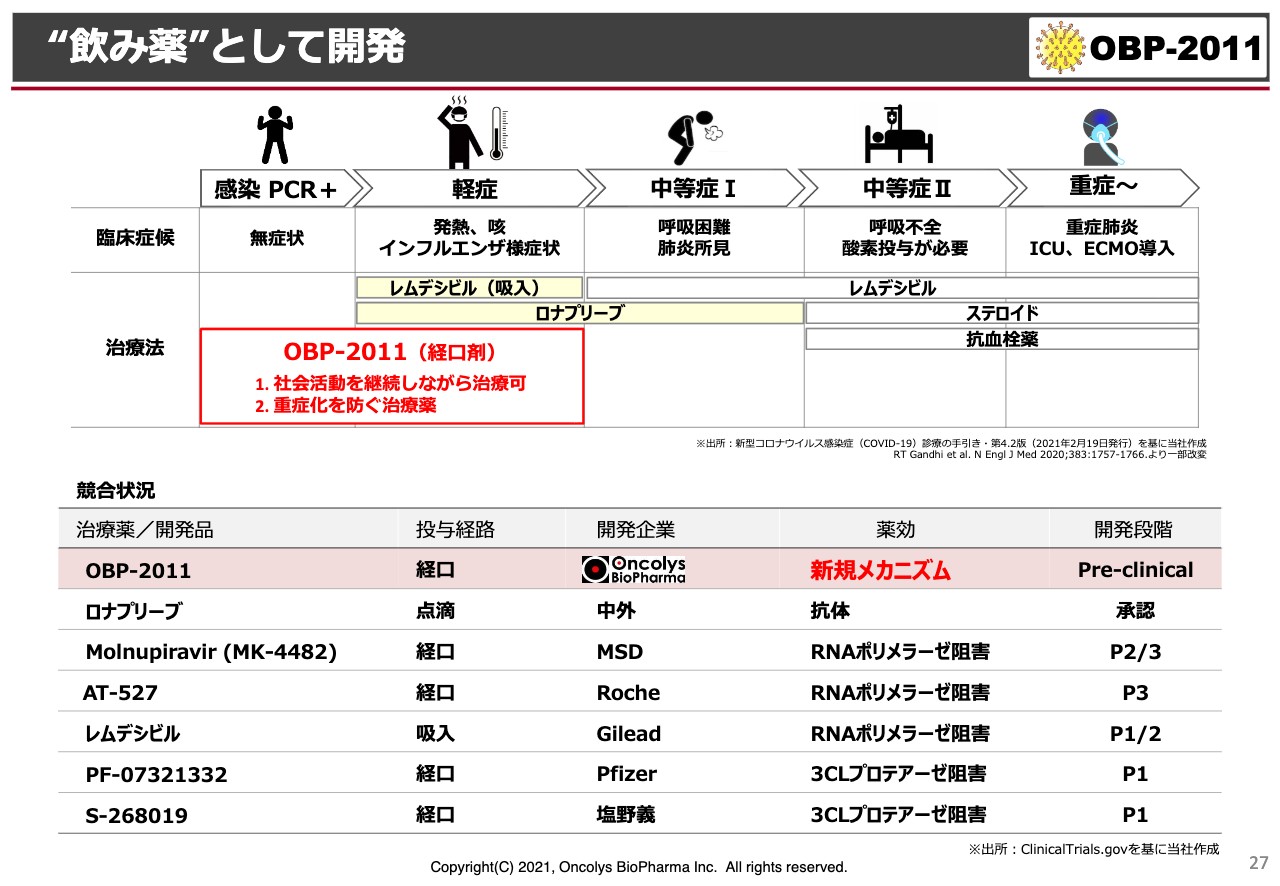
試験管の中の結果ですが、新型コロナウイルスを添加してから、4時間、6時間、8時間後に「レムデシビル」を投与しても、やはり、細胞はどんどん死んでしまいます。
ところが、当社の「OBP-2011」は、新型コロナウイルスを感染させた細胞をそのままにしておき、4時間、6時間、8時間、10時間後に添加しても、人間の細胞はずっと生きています。
このようなことから、「レムデシビル」とはまったく違った作用を示す化合物であるとわかっていきました。これは、当社にとっては非常に大きなメリットで、当然、将来は「レムデシビル」などと併用することが考えられます。
当社は今、臨床試験で軽症者、特に症状の有無にかかわらず、PCR検査で陽性と診断された方のウイルスまで、3日ないし5日間の経口投与でウイルスをなくそうと考えています。
最近、許可された「ロナプリーブ」は、中外製薬から出された抗体医薬(抗体のミクスチャー)で、軽症者にも投与できるということですが、入院加療が必要な方に点滴を行うことになっているようです。
また、「レムデシビル」も現在は点滴投与のため、軽症者に使えると言っても、やはり入院しないと連日投与できない状況です。
それ以外にも、27ページの下の表に記載しているように、MSD、Roche、Pfizer、塩野義製薬もポリメラーゼ阻害剤、あるいはプロテアーゼ阻害剤を発表していますが、当社の「OBP-2011」はまったく違うメカニズムで、来年早々には臨床に入りたいと考えています。
開発計画
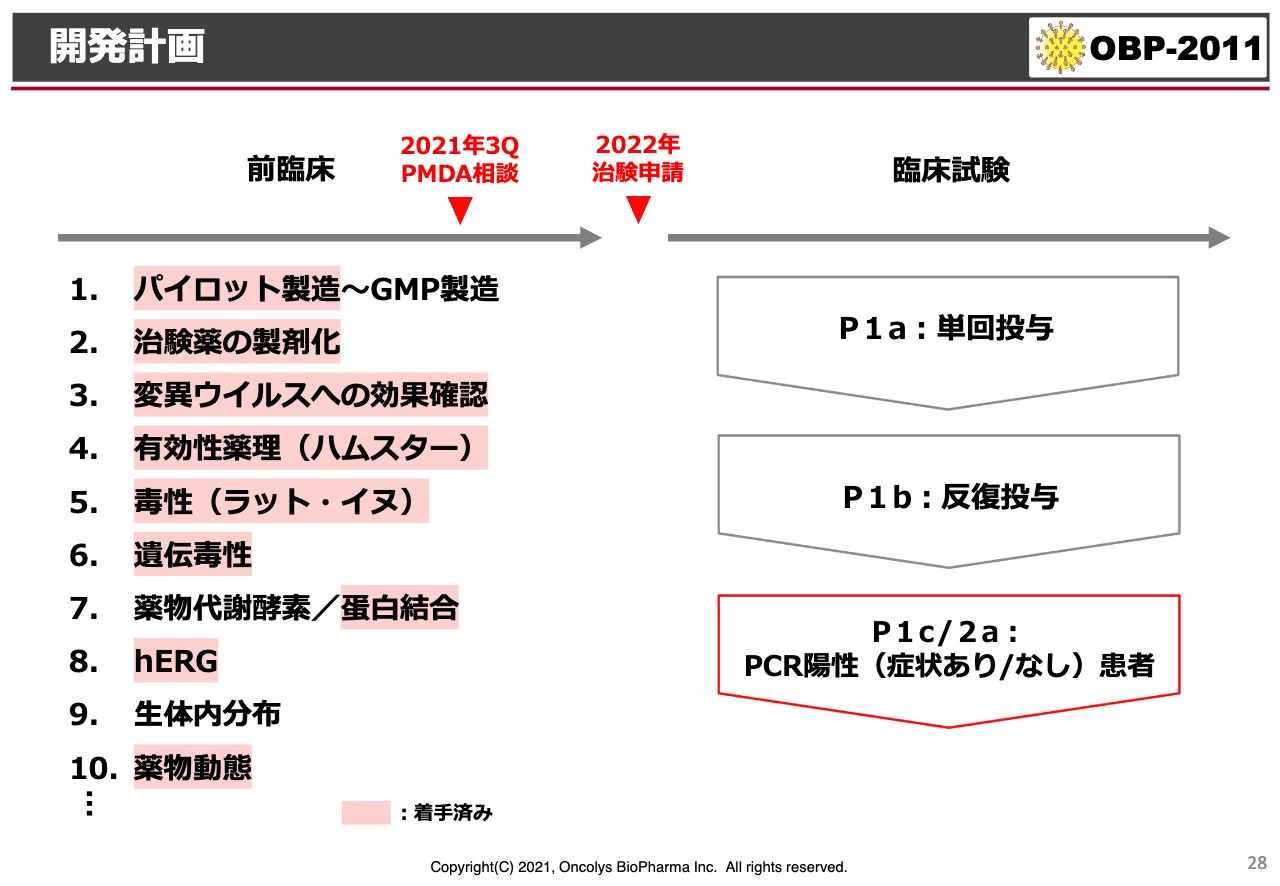
現在、パイロット製造を行っており、有効性薬理は今後さらに詳細に見ていく予定です。初期の毒性試験も終わりましたが、GMP製造が終わった後に、本格的なGLPの毒性試験を行う準備ができています。
それ以外にも、遺伝毒性、蛋白結合、心臓の伝導系に対する影響や薬物動態がすでに着手されており、来年の第1四半期には試験届を出すことで開発を進めています。
臨床試験について、最初は健常成人男性を対象にすると思います。Phase1cというPhase1の最終段階では、症状の有無にかかわらず、PCR陽性患者を対象に安全性および初期の有効性を確認する試験を行いたいと思っています。来年中には、患者に対する効果が明らかになるような臨床試験にしていきたいです。
順天堂大学と共同研究講座を開設
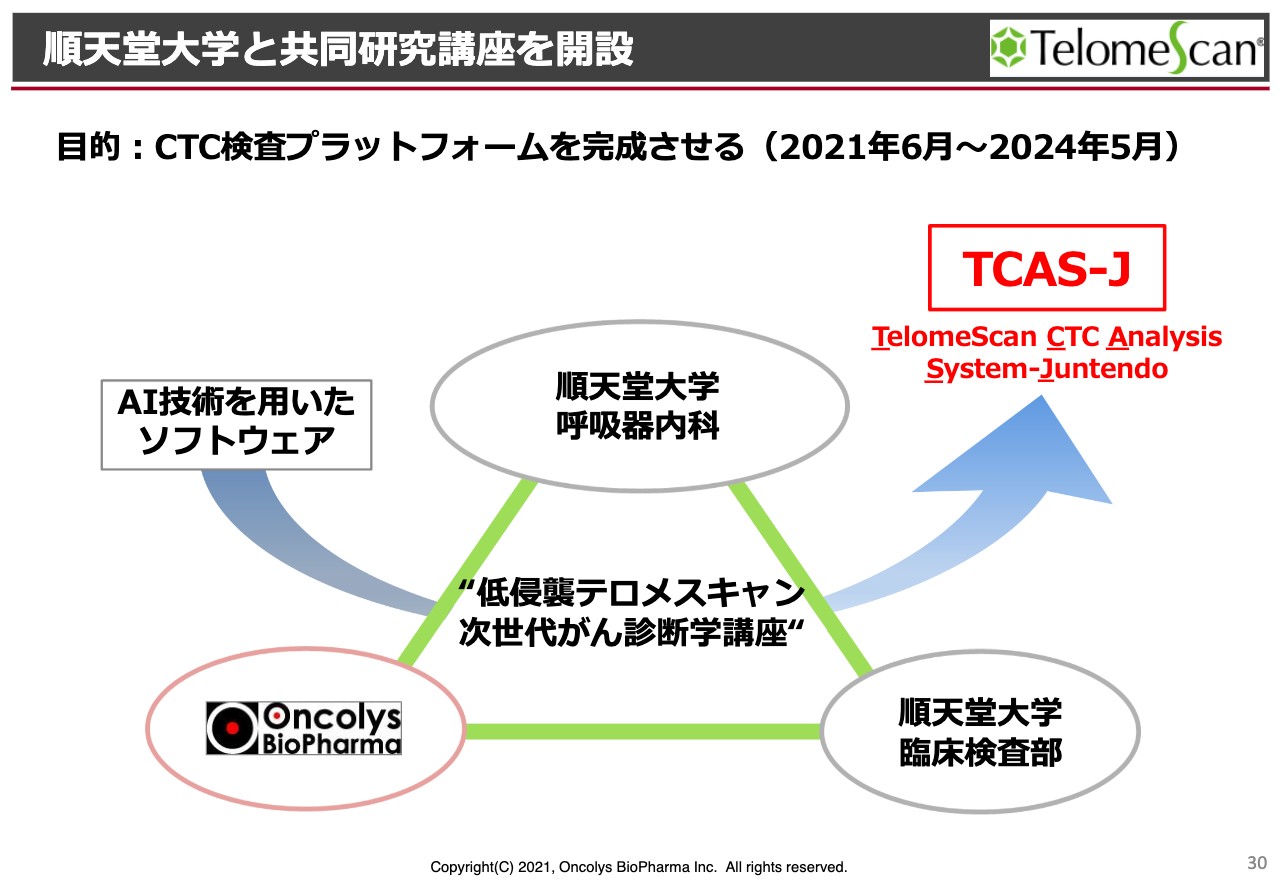
次に、「テロメスキャン」についてお話しします。こちらも非常に長く、いろいろと行っていますが、ようやく順天堂大学と共同研究講座を開設できるようになりました。
それにより、「TCAS(TelomeScan CTC Analysis System)」の順天堂大学バージョンを作り、これを最終的に当社のプラットフォームにしていきたいと考えています。
特に、AI技術を使ったソフトウェアを完成させることで、いろいろなことが可能になります。例えばさまざまな研究室、あるいは検査センターの顕微鏡にソフトウェアをインストールすれば、がん細胞の検出ができるようになるということです。
開発のゴール
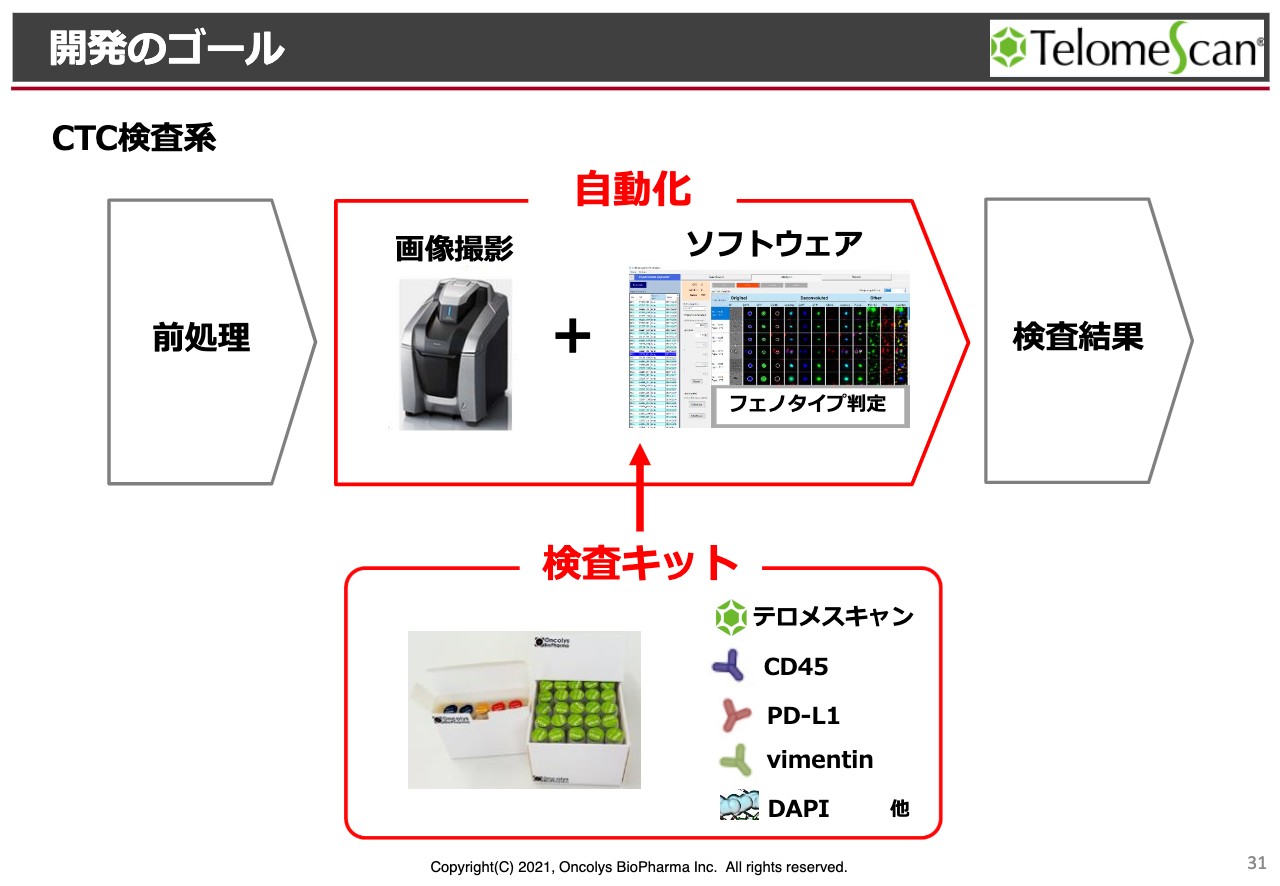
検査キットの中には「テロメスキャン」が入っており、プラスしていろいろな抗体を入れることにより、自動化を達成していきたいと考えています。
検査キットの拡販を目指す
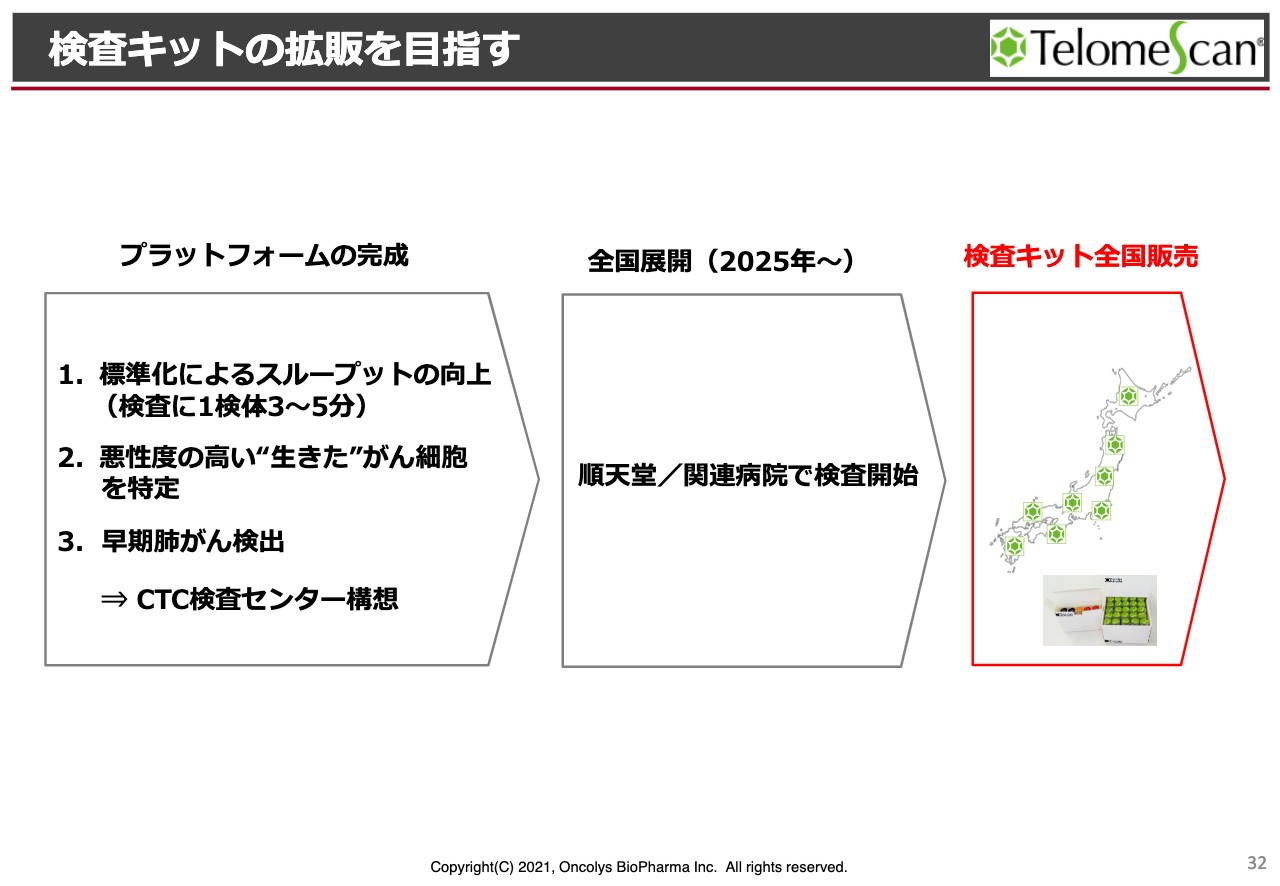
例えば、これまで3時間から4時間かかっていた顕微鏡の検査が、1検体あたり数分でできてしまうということです。また、さまざまな色で染めることで、悪性度の高い生きたがん細胞だけを特定することが可能になります。
特に、早期の肺がん検出を我々の最初のターゲットにしたいと考えており、順天堂大学の、特に健康診断センターのようなところで、ルーティンで使えるようにしていきたいと考えています。
ルーティンで検査ができるようになった場合には、国内とは言わず海外でも、非常に簡便な、がんの第一次スクリーニングとして検査ができるよう開発していきたいと考えています。
OBP-601の開発進捗
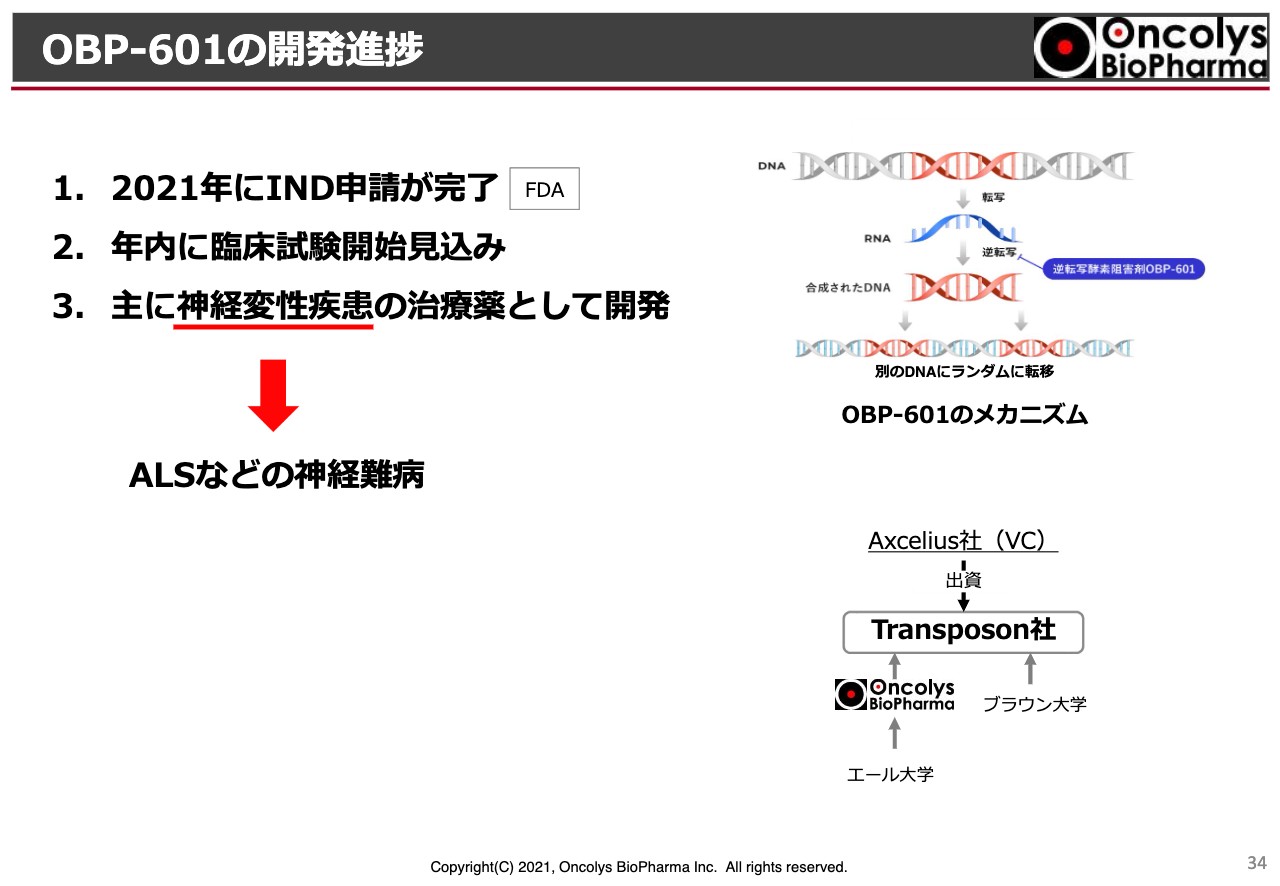
「OBP-601」の一般名は「Censavudine」です。こちらは、先ほどお話ししたとおり、アメリカのTransposonという会社にすでにライセンスしており、Transposon社が今年にIND申請、すなわち治験申請を完了しています。
対象疾患については、公表できるようになりましたら、みなさまにお伝えしますが、ALSや特にいわゆる認知症も含めた神経難病に適用を拡大していく予定と聞いています。
ただし、この臨床試験が始まると、Phase2ということで当面は二重盲検試験を行うため、中間的な報告はなかなかできなくなることが少し心苦しい点です。
2021~2022年の主なマイルストーン

今年から来年にかけての主なマイルストーンです。「テロメライシン(OBP-301)」において、中国圏のライセンスが現在若干遅れています。
話はどんどん進んでいる一方で、最後の契約につながるところまではなかなか至っていない状況ですが、決して消極的ではなく、よりよいライセンス契約にするために時間をかけています。
GMP製造のプロセスバリデーションは、2022年中に完了予定です。特に、中外製薬が行っている国内放射線併用のPhase2は、当社もできる限り協力して、予定どおりの組入れを完了したいと考えています。
「OBP-702」は当然、できる限り早めのINDを行うために、来年にはPre-IND Meetingを行いたいと考えています。
新型コロナウイルスの治療薬「OBP-2011」ですが、シリアンハムスターなどの動物での効果を示した上で、治験届を遅くとも来年の上半期には提出し、臨床試験をすぐに開始できるようにしていきたいと考えています。来年中には結果をみなさまにお知らせできるようにしたいと考えています。
「OBP-601(Censavudine)」については、先ほどお話ししたとおり、治験は進んでいくと思うのですが、中間解析がなかなかできない状況で、2023年ないしは2024年の報告になると考えています。
オンコリスの目指す姿
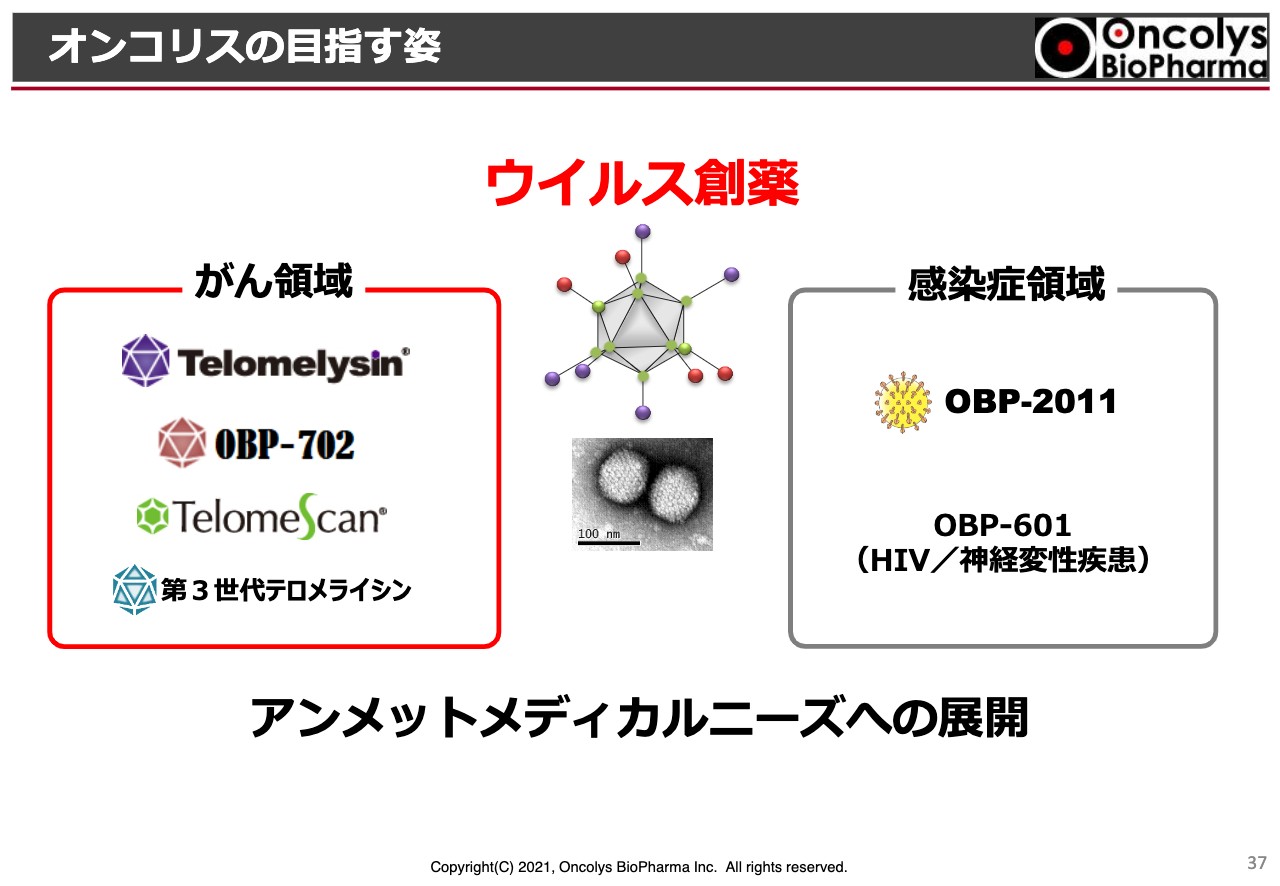
今後も、オンコリスは「ウイルス創薬」を続けていきます。「ウイルス創薬」は当社が作った言葉ですが、「がん領域ではウイルスでがんを殺す」「感染症領域ではウイルスそのものを殺していく」、このような対象に絞って開発していきたいと考えています。 以上でございます。ご清聴ありがとうございました。
質疑応答:「テロメライシン」「ペムブロリズマブ」併用の医師主導治験について
質問1:「テロメライシン」と「ペムブロリズマブ」併用の医師主導治験についてお尋ねします。この試験は中外製薬との契約締結以前から日本とアメリカで行っていますが、中外製薬と提携している現在の状況において、引き続きこの試験を積極的に進める狙いについて教えてください。
浦田:これまで「ペムブロリズマブ」で進めてきて、途中で「アテゾリズマブ」に変えるのは、なかなかやりづらいことですし、行うとしたら別治験ということになってしまうため、現段階の治験は続けていきます。
ただし、もう抗PD-1抗体と抗PD-L1抗体の質的な有効性の違いがないだろうという考えがあります。そのため、現段階では「ペムブロリズマブ」の試験をこのまま続けていき、その結果を中外製薬に積極的に公開していきたいと考えています。
質疑応答:「OBP-2011」の進捗状況について
質問2:コロナウイルス治療薬の「OBP-2011」について、2022年の上半期中に前臨床試験と治験薬のGMP製造を完了する予定ですが、足元の進捗状況について教えてください。
浦田:先ほどお話ししましたとおり、現時点ではGMP製造までは進んでいませんが、パイロットのキログラム製造についてはほぼ完了しています。製剤化についても、現在検討が行われており、今年の年末にかけて原薬のGMP製造を終えたいと思っています。
その後、Phase1に使用する治験薬の製剤を作って、治験届を提出する流れになっています。よほど大きなネガティブ情報がなければ、2022年上半期に治験届を提出する予定です。さらにPhase1の施設選定の準備をしっかり行っておけば、すぐに治験が始められるのではないかと考えています。
質疑応答:新型コロナウイルスの治験スケジュールへの影響について
質問3:直近で新型コロナウイルスの再拡大が継続していますが、特にテロメライシンと放射線併用のPhase2の開発スケジュールへの影響はどの程度あるのでしょうか?
浦田:オリンピック終了後、患者数は4,000人から5,000人あるいはもっと増える可能性があり、COVID-19対策分科会尾身会長も「だいたい1万人までいくのではないか」と言われています。今後、医療現場にどのような影響を及ぼすかということは我々もわかりませんが、臨床試験が進むよう中外製薬も大変努力しておられます。
質疑応答:「テロメライシン」の中国圏のライセンスアウトについて
質問4:「テロメライシン」の中国圏のライセンスアウトの見込み時期について教えてください。
浦田:どの会社と交渉を行っているというのは私もなかなか話しづらいところですが、国内外の大手製薬企業を含む複数社と話を進めています。当社が考えている規模のライセンスになるかどうかが、大きなクライテリアになると思います。なんとか年内に決着させ、ご報告できるような状態にしていきたいと考えています。
質疑応答:「テロメライシン」の製造について
質問5:「テロメライシン」の製造に関してバリデーションの進捗状況、CMCについて教えてください。
浦田:これまでLonza社でいろいろなバリデーションを行ってきました。そして、Henogen社はこれから開始します。特に当社はこれまでの経験からウイルス製造における十分な情報・ノウハウを蓄積しています。
Henogen社でのバリデーションはこれからですが、バリデーションのプロトコルや方法はほぼ決定しているため、おそらく大きな問題は発生せずに、予定どおりに進んでいくと考えています。
一方、タンクで製造するため、当社が使っているヒーラ細胞(浮遊細胞)が、タンクにどう早く馴染むかが一番大きな課題になると思います。これについても年内にはタンクのバリデーションの進捗によって、大まかな方向性が見えてくると考えています。
質疑応答:「テロメライシン」の治験遅延の原因について
質問6:新型コロナウイルスの影響で「テロメライシン」などの臨床試験が遅延していますが、原因について詳しく教えてください。AstraZeneca社などがウイルスベクターを買い占めているのでしょうか? またこの状況はいつ頃まで続くのでしょうか? 製造のところで、ベストシナリオやワーストシナリオなどがあれば教えてください。
浦田:誰が何をどう買い占めているのかは当社には正直わかりませんが、Henogen社やLonza社に製造依頼時期を伝えると「培地が十分に手に入らない」といった返答を常に受けています。このような状況もあって開始時期をどうしても遅らせざるを得なかったのが現状です。
しかし、これ以上遅らせないために、早めにいろいろな資材の手配を行うようにしており、次いつ始まるかわからないという状況は今のところありません。
Henogen社も契約の前から対応していただいており、資材がないから製造ができない、ということをできる限り少なくしてほしい、できればなくしたいという旨を強くお願いしています。Henogen社と協力し、今後、これ以上の遅れが発生しないように両社で努力していく考えです。
質疑応答:「OBP-601」プロジェクトの現状と臨床入りのタイミングについて
質問7:「OBP-601」に関するご質問です。プロジェクトの現状と臨床入りのタイミングについて、可能な範囲でご説明をお願いします。
浦田:先ほどお伝えしたように、Transposon社は非常によいスタッフを集めており、潤沢に資金を調達できている状況です。臨床試験の規模は初期のPhase2の予定と聞いていますが、神経疾患は難病のため、フォローアップが1年くらい必要と予想しています。
そうなると、少なくとも臨床試験開始後、2年間は二重盲検試験のまま、患者さまの組入れが行われ、その後にキーオープンが行われることを考えると、結果がわかるのは2023年頃になるのではないかと現段階で予想しています。私がお伝えできるのはこのようなところです。
特に、この「OBP-601(Censavudine)」は、2010年にライセンスしたBristol-Myers Squibb Co.社がPhase2bまで完了させており、ヒトに対する長期投与のデータも得られています。
また、ネズミに丸1年間で大量の薬を投与し毒性を見るようながん原性試験も全て終えているため、Transposon社が行う臨床試験の結果が出ると、比較的早く米国で承認されるのではないかと考えています。
質疑応答:「OBP-702」の前臨床の進展状況について
質問8:「次世代テロメライシンOBP-702」の前臨床の進展状況、現在の状況について教えてください。
浦田:「OBP-702」については、先ほどお話ししたとおり、動物実験レベルではありますが、チェックポイント阻害剤との併用において明らかな効果が認められてきています。また、製造においては、「OBP-702」の活性が非常に強いため、十分な回収量が得られないというデメリットもあります。
十分に得られないというのは、「テロメライシン」と同様の方法で製造を行っても、「OBP-702」の活性が強すぎて、もともとの細胞が死んでしまい、「テロメライシン」と比較して、ウイルス回収量が若干低くなるということです。回収量をもう少し上げるために細胞数を増やす、培養液の条件を変えるなど、今苦労しているのですが、なんとか少しずつ先が見えてきた状況です。
これが片づき、今年中にGMP製造、来年にGLPの毒性試験を行えば、治験届(IND申請)ができると見込んでいます。とにかく製造がなんとかうまくできれば、来年中のINDも不可能ではないと考えています。
また、岡山大学で有効性薬理試験などの前臨床試験が進められており、現段階では毒性試験などでも特に大きな問題は出ていません。
質疑応答:「OBP-2011」の開発計画について
質問9:COVID-19治療薬「OBP-2011」の、今後の開発計画について教えてください。
浦田:年内にGMP製造を完了させる予定です。また、前臨床試験を完了させるスロットについても、新日本科学に確保いただいています。
そのため、大きな問題がなければ2022年上半期に治験届を提出し、受理されれば健常人対象のPhase1を実施する予定です。Phase1を最短で完了させれば、2022年中に新型コロナウイルス感染者(PCR陽性:症状あり/なし)を対象にしたPhase2ができるのではないかと考えています。
浦田氏よりご挨拶
現在、新型コロナウイルスのパンデミックが拡大している中で、「テロメライシン」の試験もなかなか思うようにいかないという、非常に忸怩たる思いでいるわけですが、中外製薬と協力して、臨床試験の遅れをなんとか取り戻していきたいと考えています。
当然、新型コロナ治療薬「OBP-2011」についても、患者さま対象の臨床試験で効果を早く確認し、できれば今のパンデミック中に緊急収載まで持っていき、第5波の後の第6波が来るかはわかりませんが、早く臨床現場で使えるようなものにしていきたいと思います。我々だけではできないため、大手製薬企業と契約をした上で、治療に臨んでいきたいと考えています。
今後とも、注目していただきたいと思います。よろしくお願いいたします。本日はありがとうございました。
新着ログ
「医薬品」のログ