ソレイジア・ファーマ、上期営業損益は10億円の赤字 新製品販売開始で販売費・一般管理費が増加
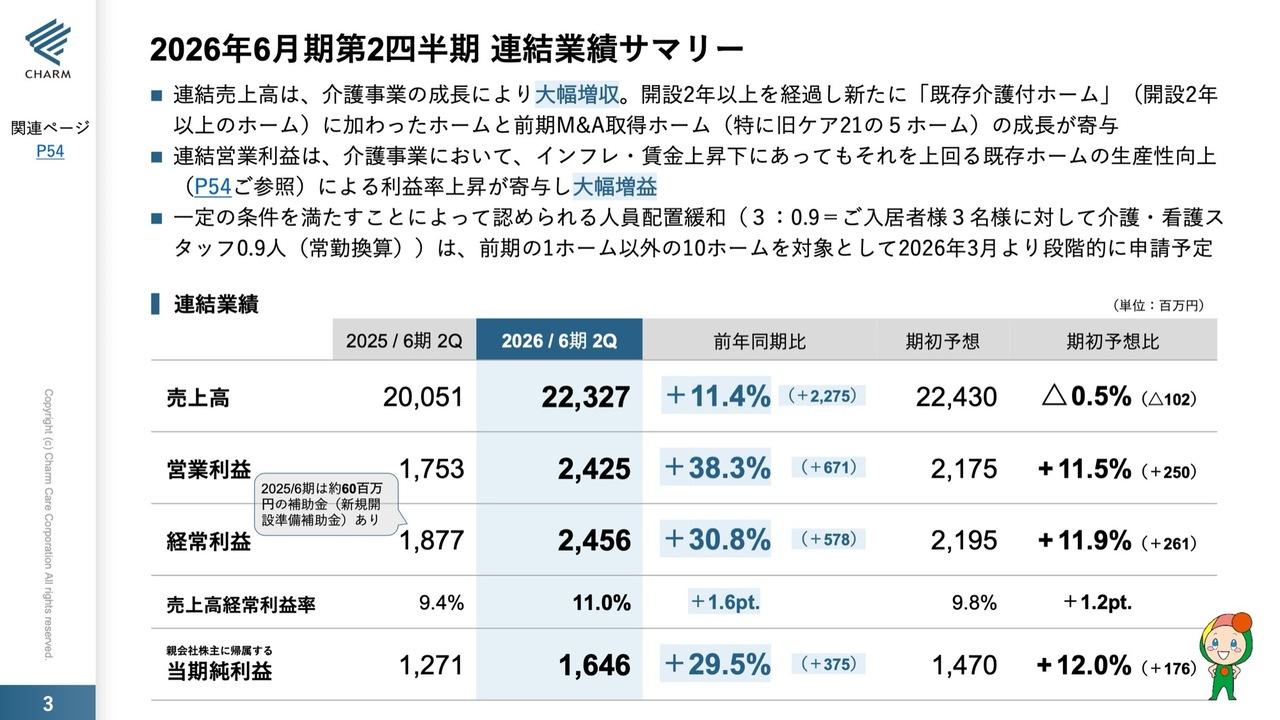
2019年12月期第2四半期 連結業績(国際会計基準IFRS)
荒井好裕氏:本日はお忙しいところお集まりいただきまして、ありがとうございます。それでは、2019年12月期第2四半期の決算説明会を開催させていただきます。よろしくお願いいたします。
最初に、2019年12月期第2四半期の国際会計基準IFRSに基づく連結業績です。売上収益は、この第2四半期では1億3,000万円で着地いたしました。売上総利益は1億1,100万円です。一方、研究開発費は4億5,500万円、販売費及び一般管理費は6億6,600万円で着地いたしました。
最終的な営業損益は10億1,000万円の赤字、そして四半期損益は10億9,300万円の赤字という状況です。
売上収益1億3,000万円のおおまかな内訳としては、当社の第1号製品「Sancuso®」および第3号製品「エピシル®」の販売によるものです。先般、「エピシル®」は中国で承認を取得しましたが、これに伴うマイルストンとロイヤリティなどで構成されています。
研究開発費は、現在も検討が実施されている第2号製品SP-02及びSP-04の2つの最終臨床試験の費用としての計上です。
販売費及び一般管理費の内容は、いま申し上げたように、「Sancuso®」と「エピシル®」の両製品が中国で販売開始されたということで、これに伴う自社でのセールス、あるいはマーケティングの費用、そしてMRの採用を含めた体制の運営費です。また、この6億6,600万円の中には、無形資産等償却費として1億9,900万円を計上しております。これらを全部合わせると、営業損益は10億1,000万円の赤字となります。
また、(スライドの)一番下の従業員数(の増加)は、中国で第1号製品「Sancuso®」と第3号製品「エピシル®」を販売開始したことに伴い、現地でのMRの採用を行ったことによります。昨年のちょうど同じ時期の人数は22名でしたが、今年(2019年)6月末では53名で、この増加のほとんどは中国の営業部員の採用によるものとご理解いただければと思います。
2019年12月期第2四半期 連結財政状態(国際会計基準IFRS)
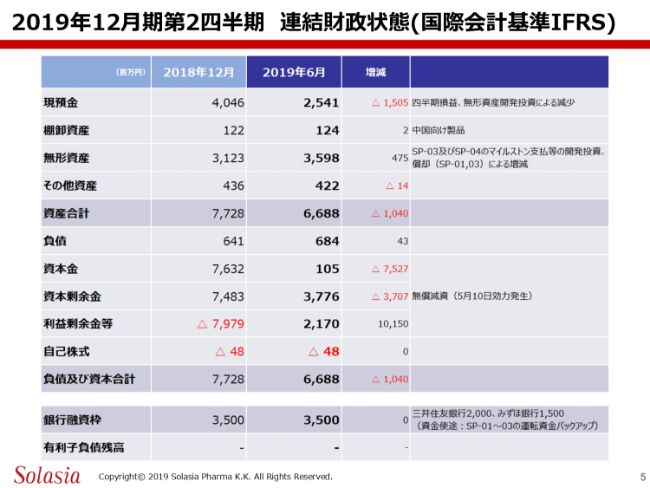
次に、連結財政状態についてご報告申し上げます。(2019年)6月末の現預金は25億4,100万円です。また、棚卸資産は1億2,400万円となっております。無形資産は35億9,800万円、その他資産は4億2,200万円で、資産合計は66億8,800万円で着地しております。
また、負債は6億8,400万円、資本金は1億500万円、そして資本剰余金は37億7,600万円、利益剰余金等は21億7,000万円です。資本金・資本剰余金・利益剰余金につきましては、今年3月の株主総会で決議し、5月10日に効力が発生した無償減資による結果です。
自己株式は変わらず4,800万円のマイナスで、負債及び資本合計は66億8,800万円です。
これらの財政状況のほかに、当社では銀行融資枠として昨年と同じ35億円の銀行融資枠を三井住友銀行、そしてみずほ銀行両行から頂戴しています。また、現時点においては、有利子負債はございません。以上がこの第2四半期の連結財政状態です。
世界の医薬品市場規模の推移
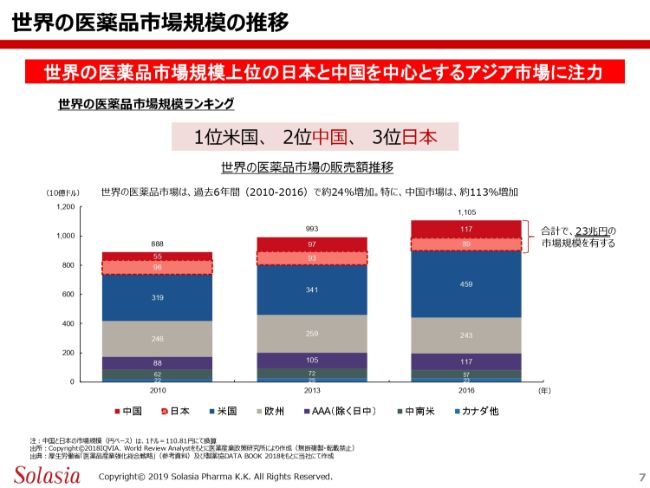
次に、中国の医薬品市場、そして当社製品の中国の商流について、改めてご紹介いたします。こちらのスライドは、これまでもみなさまにご紹介したと思いますが、世界の医療用医薬品の市場規模の流れを年度で追ったものです。
(スライドのグラフの)一番左が2010年、真ん中が2013年、一番右が2016年の数字です。(グラフの)一番上の赤色の部分が中国、その下の薄い赤色の部分が日本です。2016年の数字をご覧いただくと、この両国を合わせておよそ23兆円の市場規模になります。最新のデータでは、この比率はもう少し高くなっていると思います。
全体のトレンドとして、やはり一番伸びているのはアメリカです。そして中国が伸びていき、いずれアメリカを追い越すだろうという分析もあります。日本については、だいたい横並びというかたちではありますが、金額的には若干下がっているものの、売上のボリュームは伸びていると理解しております。
我々のターゲットの市場である中国と日本を合わせると23兆円(の市場規模)ということで、我々としてはかなり大きな市場をターゲットとして狙っていこうと考えているところです。
中国抗がん剤市場の現状
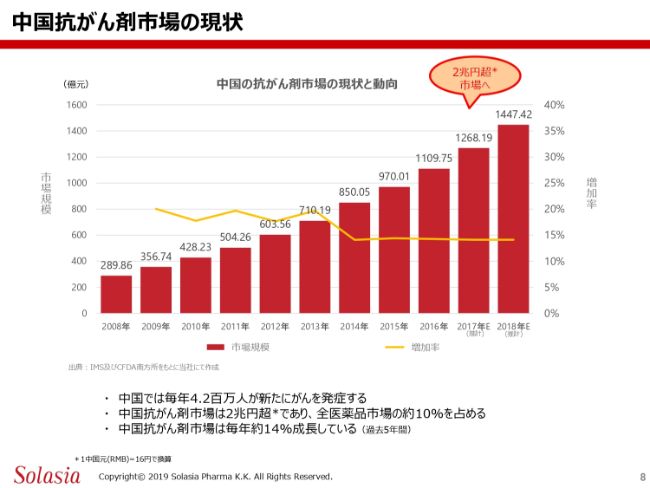
こちらの(スライドの)グラフは、中国における抗がん剤市場の伸びを示しています。棒グラフが市場規模、折れ線グラフはその増加率を示しています。
一番右側は、この資料をつくった時はまだエスティメート(推計)でしたので、「E」という文字が書いてありますが……この棒グラフの数値は億元単位ですので、2017年は約1268億元、昨年(2018年)は約1447億元となります。スライドにもあるように、日本円に換算すると2兆円を超える抗がん剤の市場になっているといえるかと思います。
増加率は若干下がっているように見えますが、これも極めて不確定で、15パーセントほどの増加率になるといわれています。
中国では毎年約400万人が新患として、新たにがんになられるということです。日本では、おそらく今年の数字が100万人を少し超えたぐらいではないかと思いますので、やはり中国はかなり大きな市場になります。
(中国と日本の)人口は10倍ほど違いますので、ここが4倍というのはなんとなく合わないような気はするんですけれども……中国の場合は、まだ都市部と農村部で医療環境がかなり違いますので、いわゆる都市部は日本と同じような医療環境でがんと診断されていても、農村部ではしっかりと診断されていないといったこともあります。このようなことも加味して、現時点においては約4倍の新患数といえるのだろうと思います。
農村部でも都市部と同じような診断ができるような医療環境が中国に整えば、残念ながらこの数はもっと上がってくるのではないかと想定できます。
中国子会社 組織
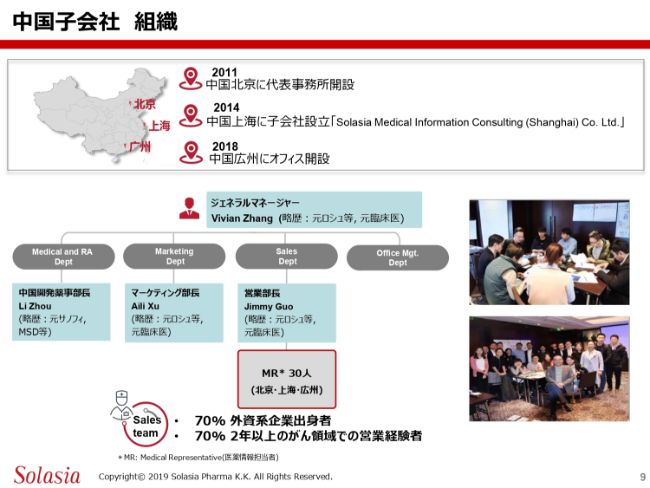
こちらのスライドは、当社の中国子会社の組織についてまとめたものです。2011年に、中国の北京に代表事務所を開設しております。その後、上海には2014年に子会社を設立しております。そして2018年には、3つ目のオフィスとして、広州にオフィスを開設しておりまして、現時点では北京・上海・広州の3都市において、当社のオフィスを構えているという状況です。
(スライドの)真ん中に当社の組織図を簡単にまとめてあります。ジェネラルマネージャー、いわゆる支社長はVivian Zhangという女性です。彼女は元臨床医で、以前はロシュ社の中国支社でがん領域事業部長を責任を持って努めていたという経験を持つ方です。がん市場に関する知見・経験と、有名なお医者さま方のグループに対してのコネクションは、非常に強いものを持っています。
また、ジェネラルマネージャーの下に4つの大きなデパートメントがあります。Medical and RAはいわゆる開発薬事を担う部署で、北京にあります。そのほかに、マーケティングを担う部署、セールスを担う部署、そしてオフィスマネジメントということで、アドミニストレーションを担う部署がありますが、この3つは上海にあります。
また、北京・上海・広州3つの都市に、MRがそれぞれ約10名ずつ配置されているといった状況であります。これまでに採用したMRが約30名いるのですが、彼らの約70パーセントは過去に外資系企業の中国支社に勤めた経験がある者で、また、同じく約70パーセントはがん領域において2年以上の販売経験がある者です。
当社製品の中国商流
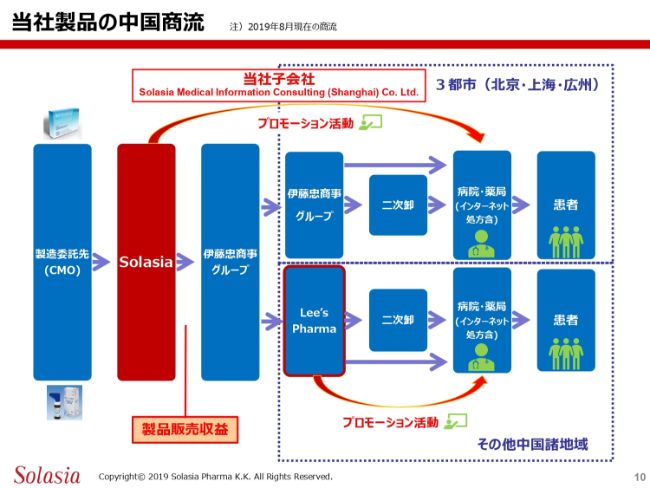
当社製品の中国商流です。これもこれまでみなさま方にはいろいろなかたちでご説明・ご紹介していますが、改めてご紹介したいと思います。
当社の場合、自前の工場は持っていませんので、製造委託先、いわゆるCMO(Contract Manufacturing Organization)に対して製造を委託するところから、製造物の供給が始まります。
ここで製造されたものをソレイジアに持ってきて、これを伊藤忠商事グループに販売します。この段階で、当社としての製品販売の収益が計上されます。
その後の動きについては、伊藤忠商事グループに販売した製品は2つに分かれます。1つは、先ほどご紹介した北京・上海・広州の3都市です。この3都市では、伊藤忠商事グループからまた別の伊藤忠商事グループに輸入され、この3都市の中の二次卸さんに伝わり、この二次卸さんから病院・薬局に伝わっていきます。そして最終的には、処方に基づいて患者さんの手元に届くというのが、第1の商流です。
この3都市以外については、伊藤忠商事グループから我々のパートナーであるLee’s Pharmaに商品が移行して、Lee’s Pharmaの二次卸を通じて3都市以外の病院・薬局に商品が流れていき、医者の処方に基づいて患者さんにお届けされます。
こういった2つの商流に基づいて商品が動き、最終的に病院、そして患者さんのお手元に届くようになっています。
製品/開発パイプライン (2019年8月14日現在)
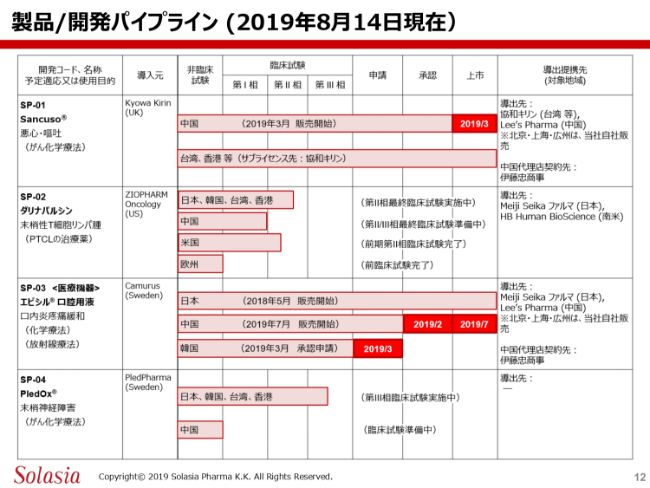
さて、ここからは製品の現状についてご紹介したいと思います。こちらのスライドは、2019年8月14日現在のパイプラインの状況です。みなさんご存知のように、このガントチャートは、どのくらい開発が進んでいるかを、横の長さでビジュアルで見ていただくことを目的としてつくられた図です。
第1号製品「Sancuso®」は、中国で2019年3月から発売開始したということで、このチャート的には「上市」に位置付けられています。中国以外の台湾、あるいは香港については、すでにサブライセンスを受けた協和キリンさんが販売されていましたが、こちらはもともと上市まで至っておりました。(スライドのチャートの)「上市」で赤抜きになっているところが、今回の新しい事業結果となります。
SP-02の「ダリナパルシン」については、日本・韓国・台湾・香港の4ヶ国において、最終の臨床試験を現在も実施中です。この臨床試験が終了して、想定していたような結果がきちんと出れば、それをまとめてPMDAに承認申請を行っていくことになります。この状況については、現時点では変更ありません。
また、中国については、これから臨床開発試験の具体的なプランを立てて立てていくということになろうかと思います。
アメリカにおいては、当初我々がこの製品を導入した導入元であるザイオファーム社が第Ⅱ相臨床試験まで終了していて、我々はそこで導入したわけですが、実際には、アメリカ・ヨーロッパではいまのところその段階で開発を止めている状況です。
我々としては、まずアジアでこの薬を開発し、その後、時期を見計らってアメリカ、あるいはヨーロッパといったところで、パートナーさんを通じて開発を進めていきたいと考えています。従って、現時点ではとくに赤抜きしておくような達成は、ここにはありません。
SP-03の医療機器「エピシル®」については、日本では昨年(2018年)5月に販売が開始され、現在もMeiji Seikaファルマによって販売されています。
中国においては、2019年2月に承認を取り、7月に発売が開始されました。販売が開始されてちょうど1ヶ月ほどになります。この承認・販売開始の2つについて、今年の大きなアチーブメントとして、赤抜きにしております。
また今回、我々は韓国の権利を受け取って、すでに2019年3月に韓国の規制当局に承認申請を行いました。現在、韓国の規制当局がレビューしているところです。「エピシル®」の製造場所はスウェーデンにありますので、おそらく一度そこへ行くことになると思いますが、そこで内容を確認した上で、現在行っているレビューの結果もあわせて、承認を得ることができるといったスケジュールになろうかと思います。
最後に、SP-04です。我々は、日本・中国、あるいはここ(スライド)にあるように韓国・台湾・香港といったアジアのテリトリーが我々の権利範囲ですが、この中の日本・韓国・台湾・香港の4ヶ国で、実施中の第Ⅲ相臨床試験があります。
中国については、おそらく今年から来年にかけて、臨床開発の具体的なプランを実行開始するというステージに移っていくことになろうと思います。この第Ⅲ相試験は、我々と導入元であるPledPharma社が共同して進めており、アジアはソレイジア・ファーマ、そして欧米に関してはPledPharma社が進めています。両社で協力しながら、なるべく早くこの試験を進めるために日夜努力しています。
【製品】 SP-01:経皮吸収型制吐剤「Sancuso®」①
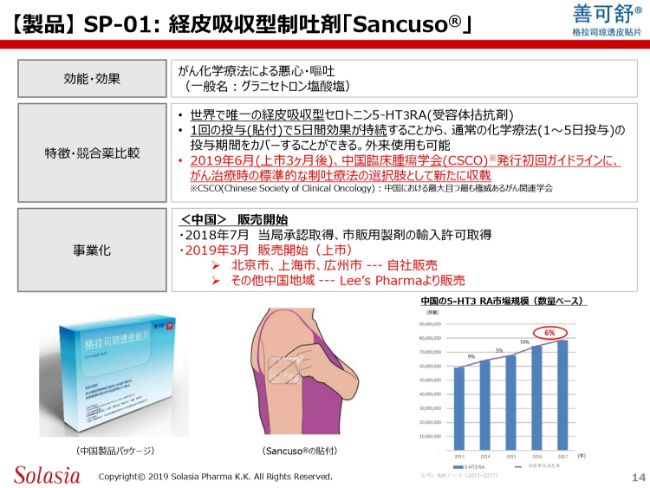
それぞれの製品について、少し詳しくご紹介したいと思います。「Sancuso®」は、世界で唯一の経皮吸収型の制吐剤で、グラニセトロンという薬効成分を含んだパッチ製剤です。1枚貼ることによって、5日間効果が持続するということが臨床試験でも確認されています。
今年(2019年)6月、ちょうど上市してから3ヶ月後になるのですが、中国の臨床腫瘍学会(CSCO)があります。これは、おそらく中国で一番大きながん関係の学会で、約3万人のお医者さまが集まります。
この学会が、今回初めてガイドラインを設定しました。どのような制吐剤が標準的に使われるのかという、制吐剤の標準治療に関するガイドラインなのですが、「Sancuso®」も標準治療の1つとしてそこにすでに記載されています。
事業化については、すでに今年3月から販売を開始しています。先ほど商流でもご紹介しましたが、北京・上海・広州は我々ソレイジア・ファーマ自らが販売し、中国のその他地域についてはLee’s Pharmaによって販売されています。
(スライドの)下段の左にある写真が外箱で、中央がその貼り方です。上腕後部等に1枚貼るというかたちです。
実際にこの市場がどうなっているのかといいますと、グラニセトロンは薬効成分の分類でセロトニンの5-HT3 RAというカテゴリーに入りますが、こちらの市場が数量ベースで(前年比で)6パーセントほど伸びているということで、まだまだかなり高い伸びを示しています。約800億円の市場ということになります。
【製品】 SP-01:経皮吸収型制吐剤「Sancuso®」②

こちらも同じく「Sancuso®」についてのご紹介のスライドです。今年(2019年)3月16日に、上海で上市セミナーというものを開催しました。私もここに参加して、写真に載っていますけれども……この中には、先ほどご説明したCSCOの理事長、そして副理事長もいらっしゃいます。こういった先生方にご協力いただいて、上海で「Sancuso®」の上市セミナーを実施しました。
ここでは、これまでの開発の経緯、実際に中国で行われた臨床試験の結果、現時点での中国における制吐剤の使用状況、そして今後の標準治療はどうあるべきかといったことについて、専門の先生方から紹介されたました。
また、先ほど少しご紹介したように、CSCOとして初となるガイドラインが今年6月に制定されたわけですが、ここに「Sancuso®」が収載されています。(スライドの)右下に中国語で(ガイドラインの一部抜粋が)書かれています。小さな文字で日本語も書いていますが、赤枠で囲んだ部分が「Sancuso®」に関する記載であります。
ここには、「しっかりと7日間使えますよ」ということや、「7日間終わったら、またもう1回使えますよ」「次のサイクルでも使えますよ」ということなどが書かれています。
最後の行は、中国で使われている経口剤「グラニセトロン」と「Sancuso®」の比較について書かれています。「グラニセトロン」を1日1回、2ミリグラム投与した場合と、今回の「Sancuso®」を比較したときの非劣性がきちんと確認されています。このガイドラインには、そういった科学的なデータの根拠も記載されています。
【製品】 SP-01:経皮吸収型制吐剤「Sancuso®」③
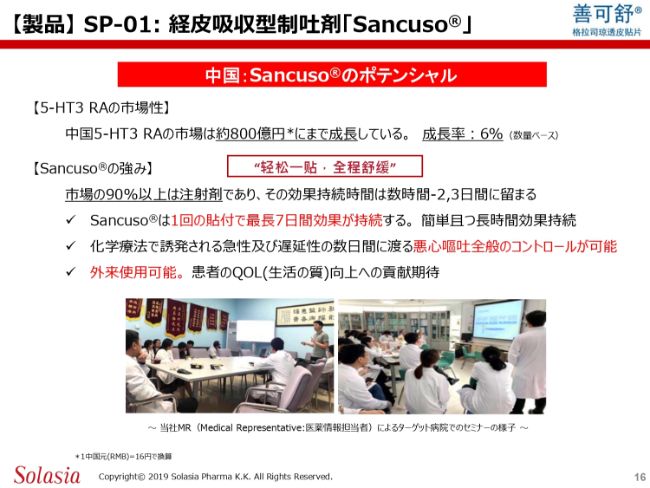
そして、「Sancuso®」のポテンシャルはどうなのかということです。先ほど申し上げたとおり、(5-HT3 RAの)市場的には800億円くらいまで成長しています。数量ベースでも6パーセントの成長率で、ずっと伸びてきています。
先ほど、「抗がん剤市場はかなり大きくなって、2兆円を超えている」とご紹介しました。あれは実際には抗がん剤の市場であって、いわゆる治療剤の市場ですが、そこが伸びているということは、それに伴って副作用が出る方も増えていくと想定できますので、そういうことも含めて、5-HT3 RAの市場が伸びています。
(スライドの)下段には「Sancuso®」の強みが書いてあります。繰り返しになりますが、中国では注射剤が9割以上使われており、注射剤の効果持続時間は数時間から2、3日間程度に留まります。
ただ、抗がん剤の治療方法はいろいろなレジュメがあるわけで、例えば、1日だけの抗がん剤の治療もありますし、3日間使う場合もあれば5日間使う場合もあります。これはがん腫、あるいは薬剤によって異なってくるのですが、例えば5日間、あるいは3日から5日間にわたって抗がん剤を投与する場合、注射剤は毎日打つか、5日間の間に2、3回病院に来て打たなければなりません。
「Sancuso®」の場合は、臨床試験において、1回の貼付で5日間きちんと効果があることが確認されていますし、中国の先生方は「血中濃度の下がり具合からすれば、おそらく7日間くらいまでは効果が持続するだろう」とおっしゃっています。従って、1枚貼付すれば5日間の抗がん剤治療をカバーできるというのが、「Sancuso®」の強みになります。
抗がん剤を投与して24時間以内に出てくるのが急性の嘔吐で、24時間から後に出て来るのが遅延性の嘔吐というカテゴリーになっていますが、急性・遅延性の両方を合わせた、抗がん剤治療で出てくる嘔吐の全行程を1枚でコントロールできることが、大きな強みです。病院に来る必要がありませんから、外来での治療も可能ということになります。
日本もそうですが、現在、中国では入院から外来へと比重が移っており、今後もその傾向は続いていくと思います。そういった中で、外来で使えるというのは、極めて大きなアドバンテージになると思います。
(スライドの)下部に2枚の写真がありますが、これは当社のMRが、病院のお医者さま方に対して「Sancuso®」の紹介をしているところです。日本でいうところの医局説明会的なものですが、このように「Sancuso®」のデータや特徴をきちんとお医者さんに説明して、理解していただいた上で、これを使っていただく選択肢をご提供しています。
こういったやり方は、日本ではきちんと行われていますが、我々としては中国でも、きちんととデータを元に、しっかりとお医者さんにそれを伝えていくことを、すでに開始しています。
【製品】 SP-03:医療機器 「エピシル® 口腔用液」①
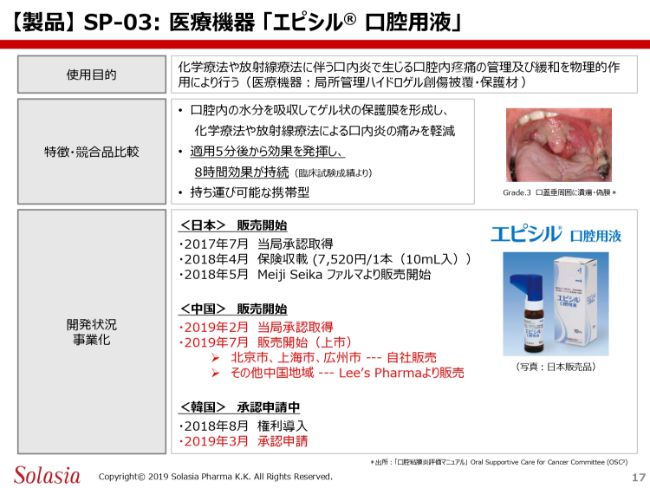
次に、SP-03の「エピシル® 口腔用液」です。「エピシル® 口腔用液」の使用目的は、ここ(スライド)にあるように、化学療法や放射線療法に伴う口内炎で生じる口腔内の痛みを管理・緩和することです。
「エピシル® 口腔用液」は、薬効成分を含まない医療機器に分類されます。物理的な被膜で口内炎の周りを覆い、刺激による痛みからカバーすることが、この製品の大きな特徴です。口腔内の水分を吸収して、すぐにゲル状になるということで、最初はオイル成分のようなものですが、唾液と混ざると瞬時にゲル、膜ができて、口内炎の表面を覆うことができるという特徴があります。
およそ5分で完全に膜になります。1回の使用は2~3滴で、だいたい約8時間効果が持続するということになります。ポケットサイズのもので、スライドにも「持ち運び可能」ありますが、外来で家に持って帰ることもできますし、いろいろな場所に置いておくこともできます。例えば、外出時にも持っていくことができます。また、うがいして出さなければならないようなものではないので、非常に簡単に使うことが可能になります。
日本では、2017年7月に承認を取得した後、昨年(2018年)5月にMeiji Seikaファルマ株式会社から販売が開始されています。
中国においては、(2019年)2月に承認を取得し、7月から販売を開始して、ちょうど1ヶ月ぐらい経ったところです。北京・上海・広州では我々が発売し、その他の中国地域では「Sancuso®」と同じように、Lee’s Pharmaより販売されています。韓国では、すでに今年3月に承認申請しており、年内の承認を目指しているところです。
【製品】 SP-03:医療機器 「エピシル® 口腔用液」②

「エピシル® 口腔用液」について、もう少し詳しくご説明します。今年(2019年)7月19日に、「Sancuso®」と同じように、「episil® 中国上市セミナー」を中国の成都で開催しました。
成都では、ちょうどこの時期にCRPCというリハビリテーション等のサポーティブケア専門の学会が行われていて、だいたい3,000人から4,000人の先生が集まります。その中の学会の1つのセッションで、「エピシル® 口腔用液」が紹介されました。
400名以上の先生方に集まっていただいて、「エピシル® 口腔用液」に関して、中国での臨床試験のデータ、海外での使用経験、そして高名な先生からの「今後、どうやってこれを使っていこうか」というコメントなどが、「episil® 中国上市セミナー」の中で発表されました。
こちらも(スライドに)写真が載っていますが、一番背の高い先生が、CSCOの副理事を務めるQin Shukui教授です。「Sancuso®」「エピシル® 口腔用液」ともに、この先生が中心となって、我々をサポートしていただいています。
【製品】 SP-03:医療機器 「エピシル® 口腔用液」③

「エピシル® 口腔用液」のポテンシャルについてです。実は、中国で実際に販売されているお薬・医療機器の中には、「エピシル® 口腔用液」のような使用方法のものがほとんどありません。
従って、いまの市場がどのくらいかというデータはないというのが正直なところですが……実際に抗がん剤を使っていて、口内炎が発症している患者さんを推定すると、80万人くらいいらっしゃるだろうとされています。日本では20万人前後といわれていますので、およそ4~5倍の患者さんがいるということです。
現在、競合品と呼ばれるものはほとんどないので、最大ではこの80万人全員にお使いいただくことも可能だと思います。これから我々がきちんと市場をつくっていけば、市場はどんどん大きくなっていくという製品だとお考えください。
「エピシル® 口腔用液」の強みですが、まず現時点で(化学療法または放射線療法に伴う口内炎に対する)標準療法というものは確立されていません。これは日本も同様です。口内炎をどのように扱っていくのかということに関しては、ワールドワイドの中でもいろいろな意見があります。
やはり、すごくひどいものですので、何とかしなければいけないということは、日本、欧米、そして中国の先生方、あるいは規制当局でも、だいぶ考えを進めているところです。
そういう意味では、今後、もしかしたら標準療法ができてくるかもしれませんが、その中に「エピシル® 口腔用液」が入る可能性はもちろんあると思いますし、現在、標準療法がない中で、しっかりとしたエビデンスをもって先生方にきちんと説明できるものであるということが、一番大きなポイントになるのではないかと思います。
スライドに「マウスウォッシュ等の既存品」とありますが、日本もそうですが、例えば、各病院で、院内処方等によって鎮痛剤を砕いて粉にして、水に溶いて、うがいして出すといったこと、あるいは氷を口に含む等、いろいろなことを行っています。これは標準療法ではなくて、各病院あるいは各先生方が、過去の経験に基づいてお使いになっているものです。既存品には、使いやすいものはほとんどないということになります。
こういうことからすると、当然ながらアンメット・メディカル・ニーズがありますし、今後、ソレイジア・ファーマ自身で、あるいはLee’s Pharmaと一緒に、この市場を開拓していくことができると考えられます。
(「エピシル® 口腔用液」は)適用5分からすぐ効果が現れて、8時間効果が持続するということもありますし、いま申し上げたように、我々は臨床試験をしっかり行っており、そのエビデンスを元に承認申請をして、中国の規制当局から承認をいただいています。こういった臨床試験があるものは他にありませんので、こういったことを、医局説明会等で先生方にしっかりとお伝えしていき、理解をしていただいた上で使っていただく……こういったスキームが可能な唯一の製品です。
QOLの向上は非常に大事で、「話す・飲む・食べる」ができなければなりません。(「エピシル® 口腔用液」は)QOLの向上に役立つだろうと考えています。
【開発パイプライン】 SP-02:新規化学療法剤「ダリナパルシン」

続いて、開発品についてご紹介します。現在、SP-02は再発・難治性の末梢性T細胞リンパ腫を予定適応症として臨床試験が進められています。
先ほどご紹介したように、日本・韓国・台湾・香港の4ヶ国で、最終の臨床試験である第Ⅱ相試験を実施中です。これは、いわゆるピボタル試験ですので、この試験が終わって、我々の期待した結果が出れば、それをまとめて承認申請に進めることができます。こちらの試験が実施中で、今年中の終了を予定しています。
アメリカでは、ライセンス元であるザイオファーム社が前期第Ⅱ相臨床試験まで実施した後に我々が導入していますので、いまはアジアに注力しています。今後、アジアの試験結果、あるいは情勢も踏まえて、パートナーへの導出がメインになると思いますが、そういうところも含めて欧米の開発を進めていくことになると思います。
また、適応の拡大についてですが、末梢性T細胞リンパ腫は(患者数が)日本でおよそ3,000~4,000人という、いわゆるオーファン(希少疾病)ですから、あまり大きな市場にはならないと思います。
ただ、やはり抗がん剤の「ダリナパルシン」の特徴は、分子標的に分類されるものではないですし、免疫チェックポイントインヒビターといったものでもないだろうと、いまのところはいわれています。
作用機序がまだ100パーセント明らかになっていませんが、分類としては一応抗がん剤ですので、いろいろな癌に効く可能性があります。そういった中で、現在、他のリンパ腫や白血病、固形がん等、どういった適応症に拡大できるのか、非臨床試験が実施されています。
事業化については、日本はMeiji Seikaファルマ株式会社さんに導出していますし、南米ではHB Human BioScience社にすでに導出が終わっています。アメリカ・ヨーロッパ・中国に関しては、現在パートナーさんを探しているところです。問い合わせも来ていますので、日々新しい情報の交換をしながら、可能性を探っています。
【開発パイプライン】 SP-04:細胞内スーパーオキシド除去剤「PledOx®」

SP-04は、がん化学療法に伴う末梢神経障害を予定適応症として、現在、第Ⅲ相試験を実施中です。(スライドに)赤字で書かれているように、現時点で、がん化学療法に伴う末梢神経障害といった効能・効果を持つ薬は、日本だけではなく世界でも、まだ発売されていないと思います。いくつか開発が進められているものもありますが、おそらく「PledOx®」が一番先頭を走っている開発品であろうと認識しています。
現在、我々のテリトリーである日本・韓国・台湾・香港の4ヶ国で、2つの第Ⅲ相試験(を実施しています)。導入元のPledPharma社と一緒に行っている国際共同試験で、「POLAR-M試験」「POLAR-A試験」という2つの臨床試験です。
事業化については、日本を含めた我々のテリトリーについては、現在パートナーさんを探しているところです。こちらも複数の会社から問い合わせがあり、現在、そういった会社さんとのいろいろな質問・回答やディスカッションを進めている状況にあります。
事業目標
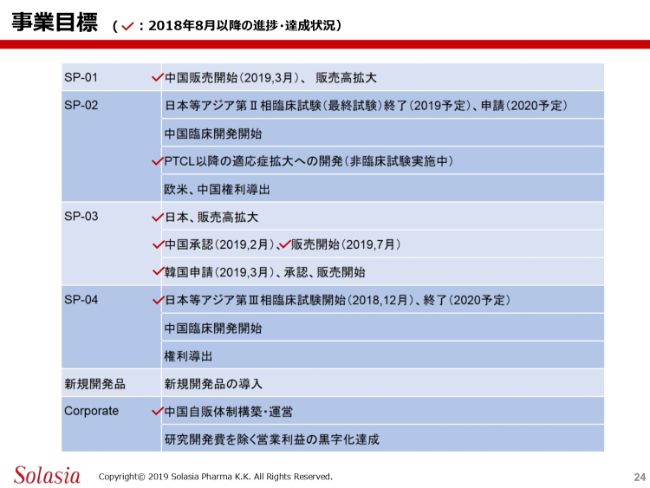
こちらの表では、こういった状況下で、今後の事業目標、あるいはこれまでの事業目標をどのように達成したのかを示しています。2018年8月以降の進捗です。
SP-01の「Sancuso®」については、中国での販売が開始されています。我々は3都市、Lee’s Pharmaさんは残りの都市で、いま販売をどんどん伸ばしているところですので、こちらは一応達成できたということになります。
SP-02に関しては、現在、臨床試験を実施中ですので、これはオンゴーイングということになります。中国での臨床開発の開始は、日本等アジア試験の進捗や、規制当局あるいはお医者さんとの話を踏まえて、今後、具体化することになると思います。
PTCL以降の(適応症)拡大については、先ほどご紹介したように、試験管の試験あるいは動物試験、in vitroとin vivoの試験を現在実施しているところですので、達成ということになります。
欧米・中国への権利導出については、いろいろ問い合わせは来ているものの、まだ確定はしていませんので、引き続き行っていくことになります。
SP-03は、日本では承認を取って、販売が少しずつ伸びてきています。中国も、今年(2019年)7月から販売を開始することができました。韓国の申請もできていて、今年年内に承認が取れるのではないかと考えています。承認が取れれば、すぐに販売開始することになります。
SP-04は、我々は日本をはじめとした4ヶ国で臨床試験を実施しています。そして、PledPharma社では欧米で試験を実施し、こちらも進んでいるという状況です。我々のテリトリーである中国に関しては、今後、規制当局も含めて具体化させていくことになります。
権利導出については、こちらもすでに複数の会社からいろいろと問い合わせをいただいています。そういう中で、我々と同じような考えで進められるところがあれば、一緒に取り組んでいくということも含めて、今後のパートナリングを進めていきたい(と考えています)。
(新規開発品については)我々はバイオベンチャーということで、企業価値を上げていくことが非常に大事だと考えています。私からも常々、みなさまにそういうお話しをさせていただいていますが、常に新しい開発品の導入を考えていく必要があります。
ただ、我々の戦略に合ったものであったり、もちろん経済条件などもいろいろとありますので、しっかりと吟味した上でいいものを入れていくことは、常々考えていかなければならないと思っています。従って、日々、こういうこと(新規開発品の導入)に取り組んでいくということになります。
会社全体としては、中国の自販においては北京・上海・広州それぞれに約10名ずつ、トータルで30名のMRの採用がすでに終わっています。こういう方が自分の担当病院に行って、すでに販売を開始しているということで、体制はほぼでき上がったと思います。
直近の目標の1つとしては、研究開発費を除いた営業利益の黒字化達成です。これを達成した上で最終的な黒字になると思いますので、まずはこれを目指していきますが、もう少し時間がかかるだろうと思います。
ソレイジアの成長戦略
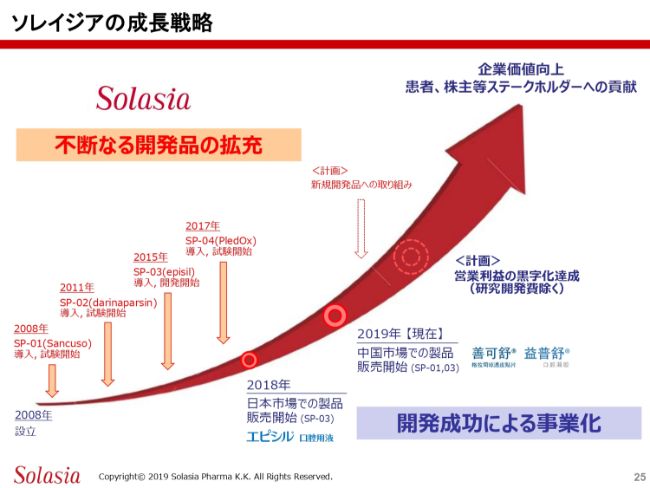
最後のスライドは、成長戦略についてです。いま申し上げたとおり、我々としては、新規開発品を導入して、しっかりと開発を進めていく。そして、どんどんアチーブメントを出していくことで、企業価値を上げていく。これが、ソレイジアの成長戦略のコアだという確信を持っています。
そうなると、やはり開発費を拡充する必要があります。我々が2008年に設立した後、第1号から第4号までの4つの製品を導入してきました。いくつか試験が終了しましたし、いい結果も得られています。第2号製品、第4号製品は現在試験中ということで、これらの結果もいずれ得られてくるだろうということになります。
これはこれで、いま存在している製品ですから、これが承認されて、販売されていけば、当然、販売による利益・収益が上がっていきます。これは大きな収益の1つで、我々の企業価値を上げる大きなコアの1つです。しかしながら、これだけではなくて、やはり5番目、6番目、7番目の製品を導入して、しっかりとそれを開発していくことが必要になります。
我々は2018年から2019年にかけて、すでに販売開始に至っています。2008年に設立していますから、ちょうど10年かかって開発し、導入して、やっとここまで来たという感じです。製品の販売が開始になったということですから、ステージとしては、これまでとは少し違うステージになってくると思います。(すでに販売を開始しているのは)2つの製品ですが、これらをしっかりと日本・中国で販売して、販売による収益を上げていく必要があります。
もう1つは、将来のために新しい製品を入れて、しっかりと開発していくことが必要だと思います。私もいつもお話ししていますが、基本的には開発するために導入が必要になります。我々は研究所を持たないので導入になるのですが、たくさん導入して、成功しなければだめなんです。やはり導入して、なんらかのかたちで成功に向けていくのが大事です。
成功して初めて発売に至って、販売収益が上がり、患者さんのためにもなります。ですから、しっかりとしたものを導入して、しっかりと開発して、なるべく成功確率を上げる。これが、最終的な企業価値を上げていく1つの大きな要素だと思います。
我々としては、日々いいものをきちんと評価して入れていって、しっかりとした開発プランの下に、我々のテリトリーの中で開発をして、成功確率を上げて、製品を作って世に出す。こういったことをしっかりと行いながら、パイプラインを拡充して、企業価値を上げたいと考えています。
これがきちんと行えれば、この(スライドの図の)矢印のように、最初は小さかったものがぐっと大きくなっていくだろうと想定されますし、私も含めて社員一同、常にこれを目標に取り組んでいます。
ご清聴、ありがとうございました。
新着ログ
「医薬品」のログ