第一三共、1Q売上収益は前年比134億円減 「キザルチニブ」はグローバルで承認申請予定
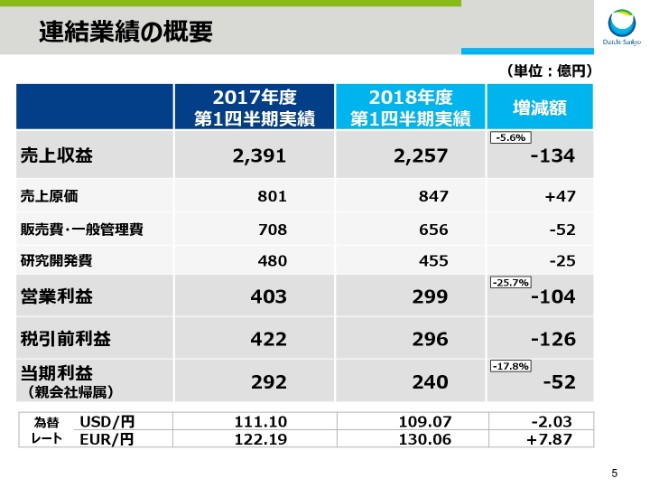
連結業績の概要
齋寿明氏:2018年度第1四半期の決算内容について、ご説明いたします。
スライド5をご覧ください。2018年度第1四半期決算の概要でございます。
連結売上収益は2,257億円。前年同期比134億円、5.6パーセントの減収となりました。売上原価は、前年同期比47億円増。販売費・一般管理費は52億円減、研究開発費は25億円減となっており、この結果、営業利益は299億円。前年同期比104億円、25.7パーセントの減益。
税引前利益は、前年同期比126億円減益の296億円。そして、親会社帰属の当期利益は240億円。前年同期比52億円、17.8パーセントの減益となりました。
為替レートの実績でございます。1ドルは109円7銭となり、前期よりも2円3銭の円高。1ユーロは130円6銭となり、前期よりも7円87銭の円安となりました。
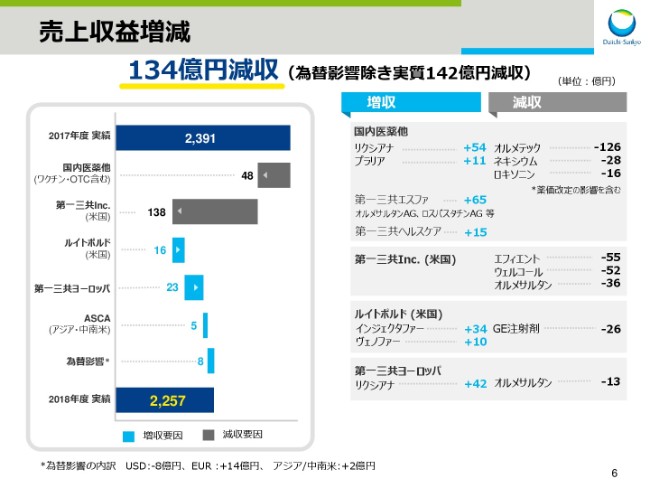
売上収益増減
スライド6をご覧ください。ここからは、3枚のスライドを使いまして、前年同期比での増減要因について説明いたします。
売上収益は、前年同期比134億円の減収となりましたが、その内訳を主要事業ユニット別にご説明いたします。
まず、国内医薬。ワクチン・OTCを含む日本事業では、直接経口抗凝固剤「リクシアナ」、骨粗鬆症治療剤「プラリア」に加え、「オルメサルタン」「ロスバスタチン」のAGを含めた第一三共エスファ品、第一三共ヘルスケアなどを中心に、売上を拡大しました。
一方、ジェネリック薬品の拡大の影響を受け、高血圧症治療剤「オルメテック」は大きく減収となり、薬価性の改革にともなう薬価引き下げの影響も重なり、日本事業全体では48億円の増収となりました。
次に、海外事業について説明いたします。ここでは、為替変動の影響を除外したかたちで記載しています。
米国の第一三共Inc.は、抗血小板治療剤「エフィエント」、(2018年)5月にジェネリックが参入してきた高コレステロール血症治療剤・2型糖尿病治療剤「ウェルコール」、高血圧症治療剤「オルメサルタン」の減収等により、138億円の減収となりました。
一方、米国ルイトポルドは、鉄欠乏性貧血治療剤「インジェクタファー」および「ヴェノファー」の伸長により、16億円の増収。
第一三共ヨーロッパは、「リクシアナ」の売上拡大により、23億円の増収となっております。
また、アジア中南米地域を担当するASCA事業では、5億円の増収でした。
なお、円安による増収は、全体で8億円でありました。
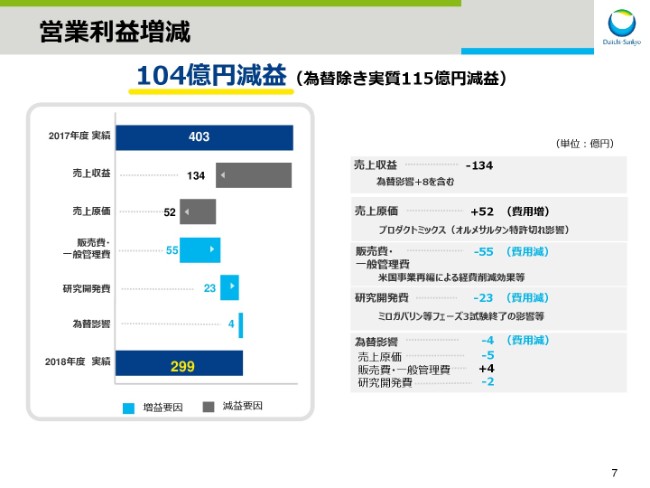
営業利益増減
次に、スライド7をご覧ください。営業利益の増減要因をお示ししています。
先ほどの説明のとおり、売上収益は為替影響による増収8億円を含めて、134億円の減収となっています。
次に、経費関連を為替影響を除いて説明しますと、売上原価は「オルメサルタン」の特許切れによりプロダクトミックスが変わった影響で、52億円増。
販売費・一般管理費は、米国事業再編による経費削減効果等により、55億円の減。
研究開発費は、「ミロガバリン」等のフェーズ3試験完了等の影響等により、23億円減となりました。
為替影響による費用減は、合計で4億円。
この結果、営業利益は、前期比約100億円減の299億円となりました。なお、売上収益での為替影響を含めると、実質では115億円の減益だったことになります。
当期利益(親会社帰属)増減
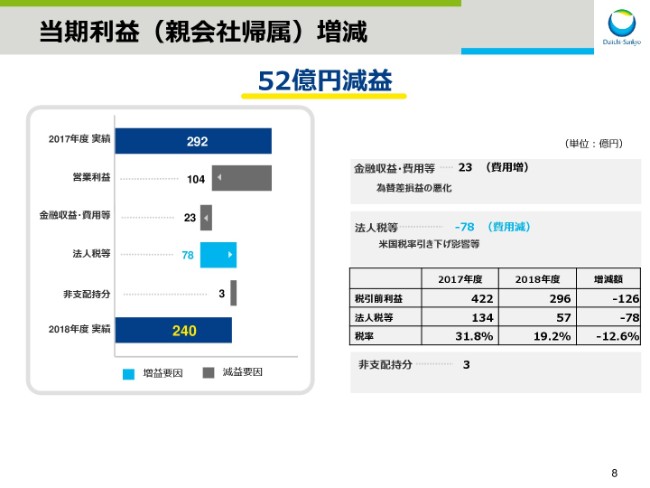
次にスライド8で、当期利益に関してご説明いたします。
営業利益が104億円の減益となりましたが、米国税率の引き下げ影響等により、法人税等が78億円減少した結果、親会社帰属の当期利益は240億円、対前年52億円の減益となっています。
リクシアナ:日本における成長
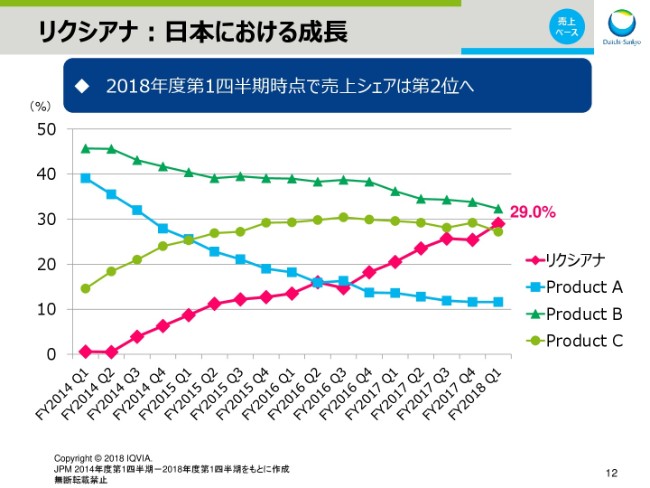
次に、第1四半期の主要なアップデートについてお話しします。
スライド12をご覧ください。まず、直接経口抗凝固剤「リクシアナ」についてお話しします。
日本市場において、2017年度は順調に成長し、シェアを大きく伸ばしました。2018年度もその勢いは継続しており、第1四半期時点でシェア第2位となっております。
日本事業:がん疼痛への取り組み
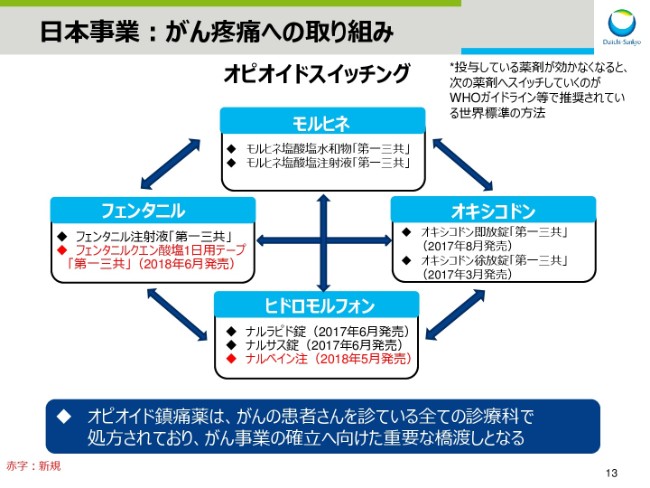
次に、スライド13では、日本におけるがん疼痛への取り組みについてご紹介します。
がん疼痛のコントロールでは、投与中の薬剤が効かなくなると、次の薬剤へスイッチしていく。いわゆるオピオイドスイッチングが、世界標準としてWHOガイドライン等に推奨されております。
「ナルベイン注」を(2018年)5月に、フェンタニルクエン酸塩1日用テープ「第一三共」を6月に新発売するなど、製品ラインナップを充実させており、がん疼痛に苦しむ患者さんに多様な治療の選択肢を提供できるようになりました。
また、オピオイド鎮痛薬は、がん患者さんを診ているすべての診療科で処方されており、日本におけるがん事業の確立に向けた、重要な橋渡しとなると考えております。
長期収載品の一部譲渡

スライド14ページでは、本日(2018年7月31日)リリースでご案内しました、長期収載品の一部譲渡についてでございます。
第一三共および第一三共エスファが製造販売を行う長期収載品41製品について、2019年3月より、アルフレッサファーマ株式会社へ譲渡することを決定しました。これにより、事業の選択と集中を図り、がん領域への優先的資源投入を進めてまいります。
ルイトポルド事業:鉄注射剤フランチャイズの成長
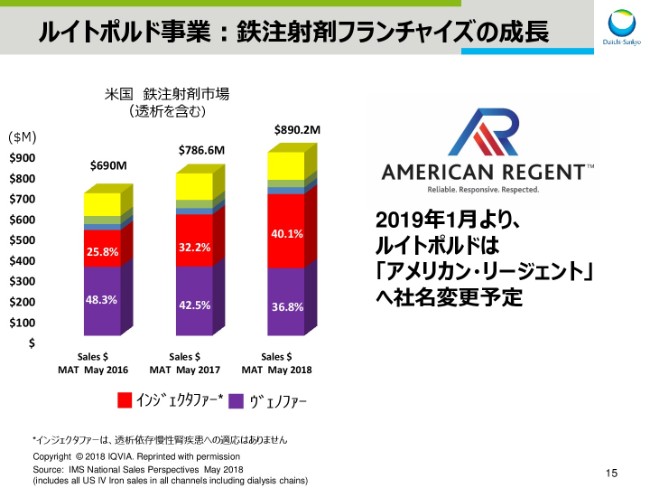
スライド15では、米国のルイトポルド事業の状況をお話しします。
スライドの左に示しておりますのは、米国における鉄注射剤市場の状況です。
赤いバーの「インジェクタファー」は、引き続き拡大しております。紫のバーの「ヴェノファー」と赤いバーの「インジェクタファー」の2製品で、市場の75パーセント以上のシェアを確保しております。
(2018年)5月にリリースでご案内しましたが、ルイトポルドは2019年1月より、すでに米国市場で広く普及している「アメリカン・リージェント」という製品ブランドを会社名といたします。
Cancer Enterprise 主要なパイプライン
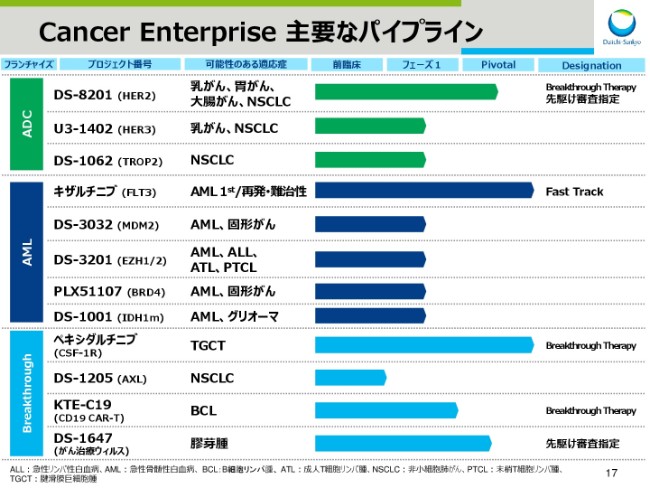
ここからは、研究開発の進捗についてです。
スライド17は、オンコロジー領域の主要なパイプラインです。
HER2に関する用語

続いて、スライド18をご覧ください。HER2に関する用語が、今後多用されますので、ここで一度整理をさせていただいております。
こちらの表では、一般的に使われているHER2の分類と、当社の「DS-8201」(HER2に対する抗体薬物複合体)が今後試験を実施する、HER2低発現が加わったときの分類の相関関係を示しています。
これまで「HER2陽性」と「HER2陰性」と分類されていたうち、「IHC 2+/ISH -」「IHC 1+」の2つについて、「HER2低発現」と分類することとしました。
DS-8201:試験計画
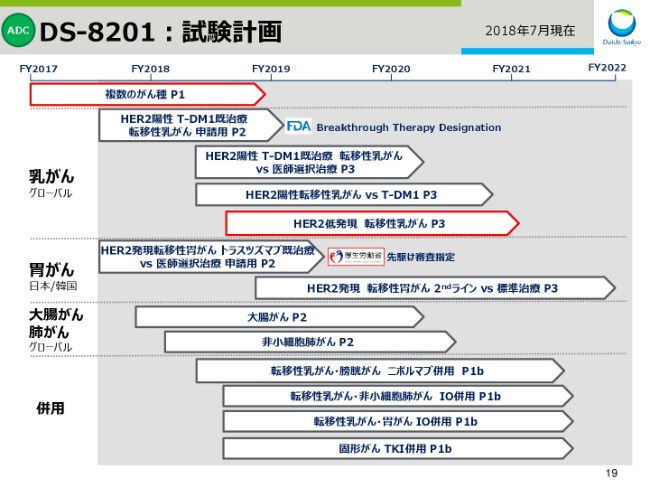
スライド19をご覧ください。こちらは、「DS-8201」の現在の開発計画です。
本日は、このうち赤枠でお示ししている現在進行中のフェーズ1試験と、今年度下期から開始予定のHER2低発現のフェーズ3試験の概要について、お話しさせていただきます。
DS-8201:P1試験 試験デザイン
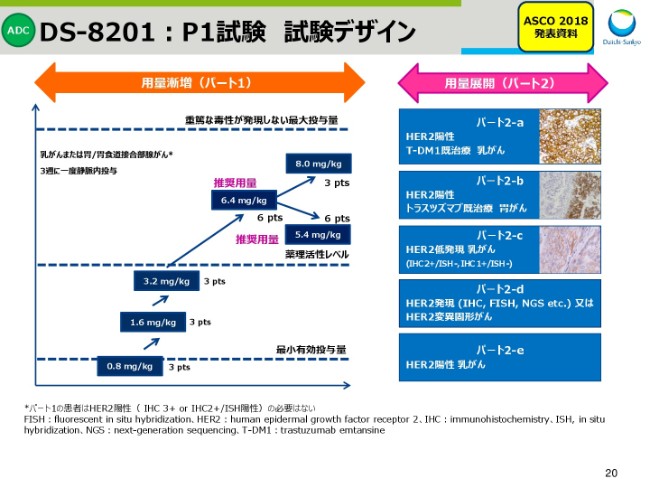
スライド20は、フェーズ1試験の試験デザインです。
(2018年)6月に米国シカゴで開催されたASCOでは、パート1(用量漸増)・パート2(用量展開)のうち、5.4または6.4ミリグラムパーキログラムを投与された症例について、発表いたしました。
DS-8201:P1試験 患者背景(5.4、6.4mg/kg)
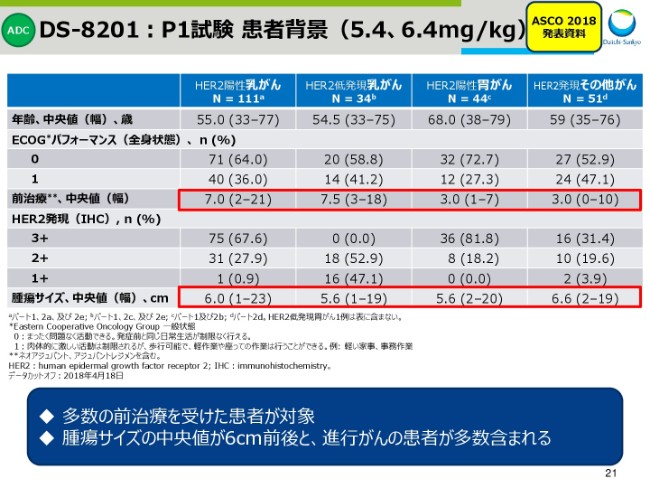
スライド21は、患者背景でございます。
どのがん種においても、多数の前治療を受けた患者さんがエントリーされております。また、腫瘍サイズの中央値が6センチメートル前後であり、がんが進行した患者さんがエントリーされております。
DS-8201:P1試験 有効性①
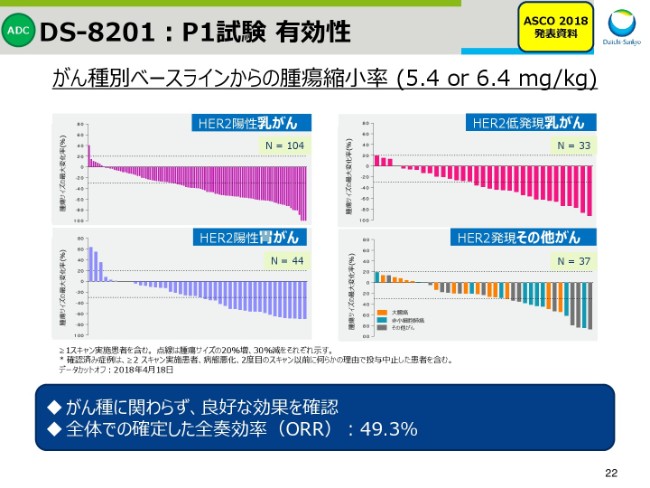
スライド22は、有効性を示すウォーターフォールグラフです。
それぞれのバーが、患者さん一人ひとりの結果を表しており、がんの縮小率が高い患者さんから、右から左へ順番に並んでおります。
どのがん種におきましても、良好な効果が得られていることから、グラフより見て取れるかと思います。なお、すべてのがん種での全体の奏功率は、49.3パーセントでございました。
DS-8201:P1試験 有効性②
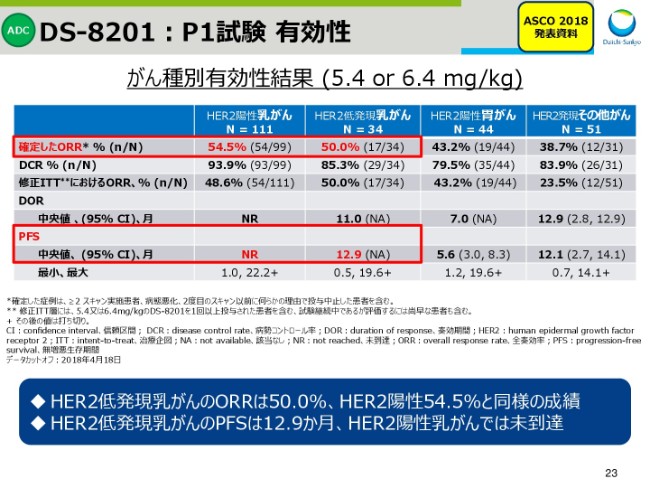
スライド23は、副次評価項目を含む有効性のデータです。
HER2陽性乳がんの奏効率は、以前より高い値を示していましたが、今回HER2低発現乳がんで50パーセントと、HER2陽性乳がんの54.5パーセントと同様の奏効率が得られました。
また、HER2低発現乳がんの無増悪生存期間(PFS)の中央値は12.9ヶ月と、1年を超えました。HER2陽性乳がんでは、進行数の増加と治療継続例の増加のため、患者さんの半数以上が進行せず安定した状態であることから、このPFSはまだ、未到達ということになります。
DS-8201:P1試験 安全性①
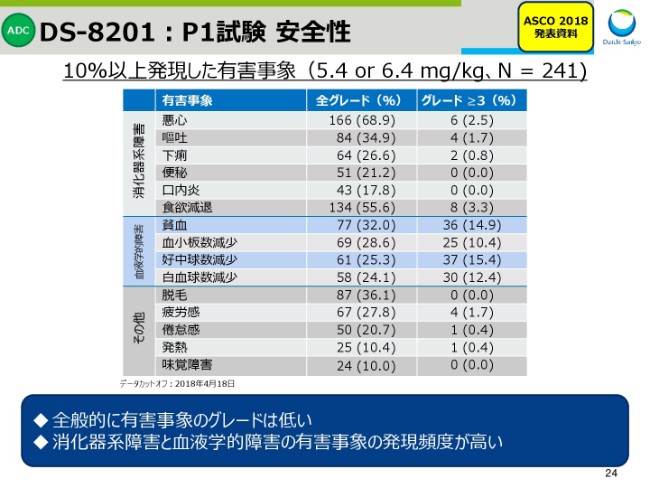
スライド24は、10パーセント以上発現した有害事象の一覧でございます。全般的に有害事象のグレードは低く、発現頻度の高い有害事象は、消化器系と血液系のものでありました。
DS-8201:P1試験 安全性②
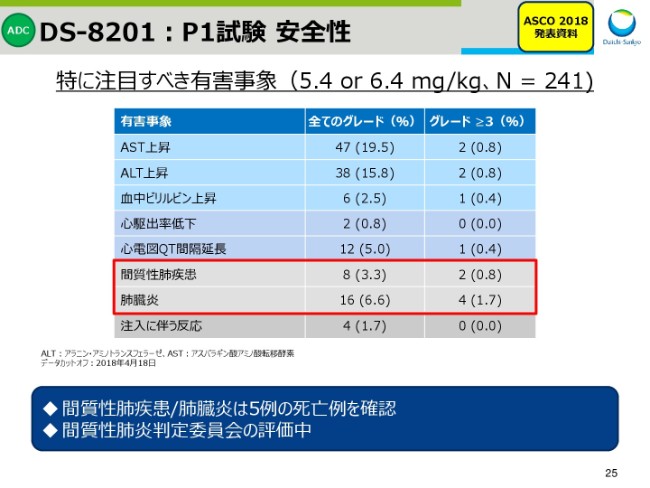
とくに注目すべき有害事象について、スライド25にまとめております。
間質性肺疾患と肺臓炎を合わせまして、これまで24例の報告がありました。このうち、5例は死亡例です。現在、間質性肺炎判定委員会におきまして、すべての間質性肺疾患と肺臓炎の症例について、評価中でございます。
DS-8201:HER2低発現乳がん
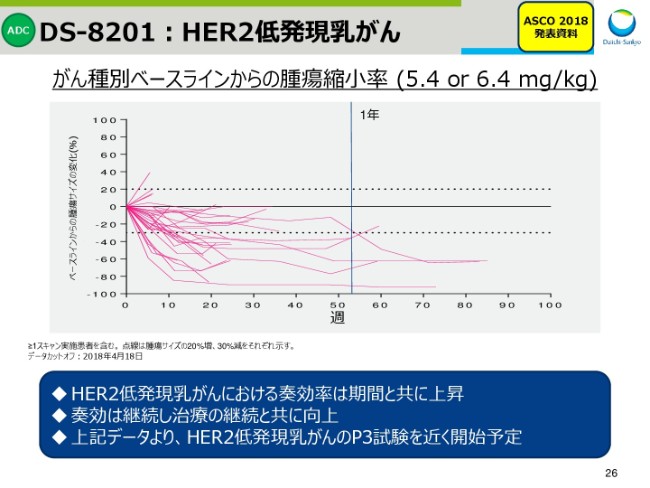
スライド26からは、「DS-8201」のHER2低発現乳がんについてであります。
こちらのグラフは、ASCOで発表したHER2低発現乳がんの、スパイダーチャートと呼ばれる有効性のグラフです。縦軸は腫瘍サイズの変化、横軸は治療期間を表しています。
それぞれの線が、患者さん一人ひとりの結果を表しておりまして、治療期間が長くなるほど奏効することが見て取れるかと思います。この結果を受けて、HER2低発現の乳がんを対象としたP3試験を、近く開始予定です。
HER2サブタイプを再定義
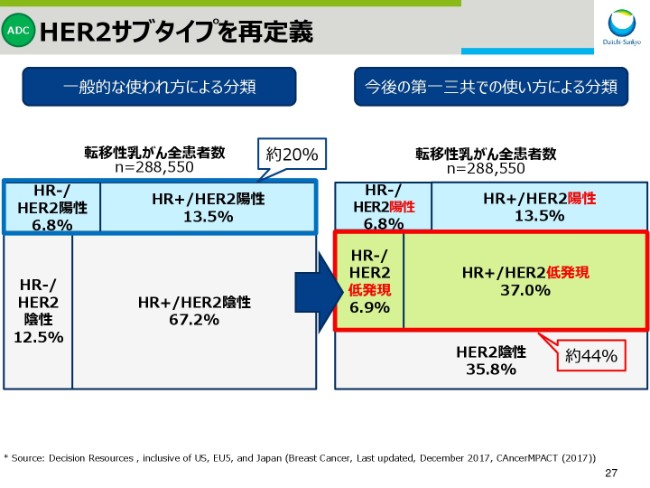
スライド27をご覧ください。先ほどご説明した、これまでの一般的な分類と、当社が今後使用する予定のHER2陽性・低発現・陰性と分類した際の患者割合を示しております。
HER2陽性は、転移性乳がんの約20パーセントを占めています。HER2低発現の転移性乳がんは約44パーセントとなり、HER2陽性と合わせますと、全体で64パーセントになります。
DS-8201:HER2低発現 乳がんP3試験の対象
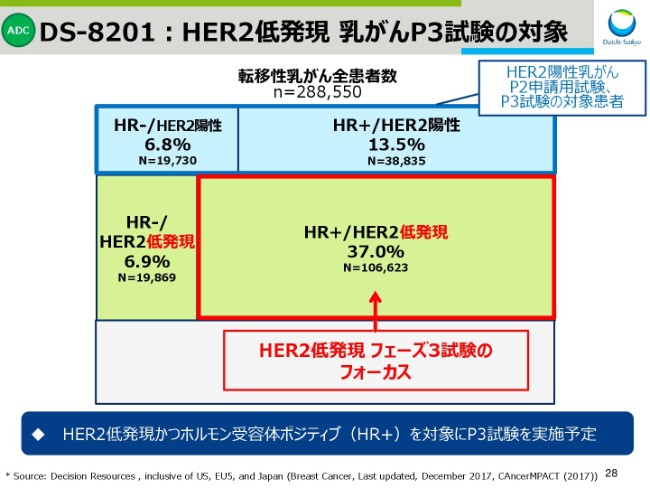
スライド28をご覧ください。HER2低発現のうち、ホルモン受容体がポジティブな患者さんの割合は37パーセントで、ここに分類される患者さんを対象に、今年度下期からフェーズ3試験を実施する予定であります。
U3-1402:乳がんP1/2試験 概要
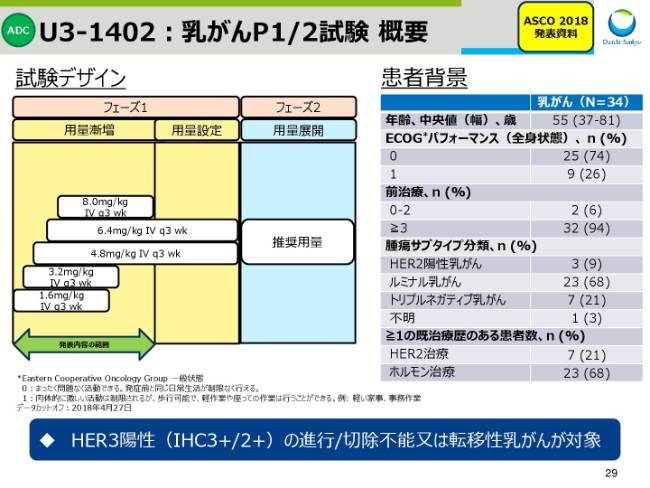
続きまして、スライド29からは、ASCOで発表しました当社の第2のADCである「U3-1402」について、お話しします。
このスライドは、現在進行中のフェーズ1・フェーズ2試験の試験デザインと、患者背景です。本試験は、HER3陽性の進行・切除不能または転移性の乳がんを対象としています。
U3-1402:乳がんP1/2試験 有効性
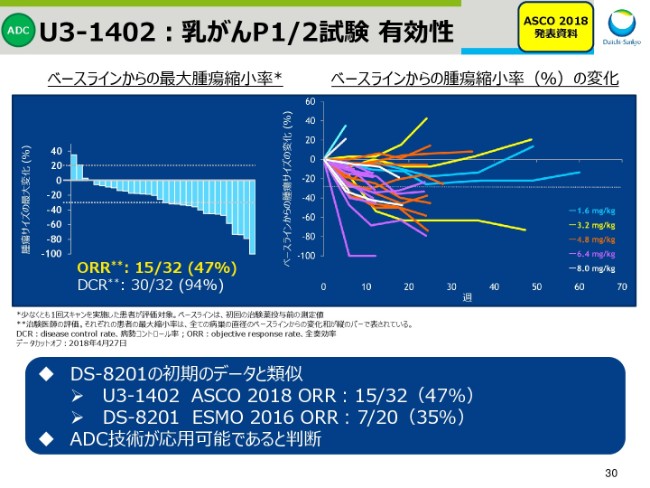
スライド30は、有効性をウォーターフォールとスパイダーチャートを使ってお示ししています。「U3-1402」の奏効率は47パーセントであり、「DS-8201」が2年前のESMOで初めて発表したデータと類似しております。
U3-1402:乳がんP1/2試験 安全性
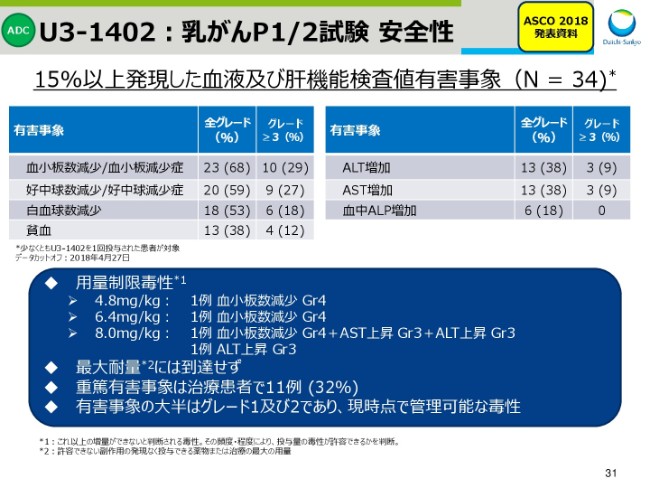
スライド31では、15パーセント以上発現した有害事象のうち、血液及び肝機能検査値関連の有害事象を示しております。用量制限毒性が4.8mg/kg、6.4mg/kg、8.0mg/kgで発現しましたが、最大耐量には到達しておりません。用量制限毒性の詳細は、スライドをご確認ください。
また、重篤有害事象は11例で見られたものの、有害事象の大半はグレード1・グレード2であり、現時点では管理可能な毒性であると考えております。
ADCフランチャイズ:次のデータポイント

「DS-8201」と「U3-1402」の今後のデータポイントについて、スライド32にお示ししておりますので、ご確認をお願いいたします。
7つ目のADCプロジェクト(Glycotope社との提携)
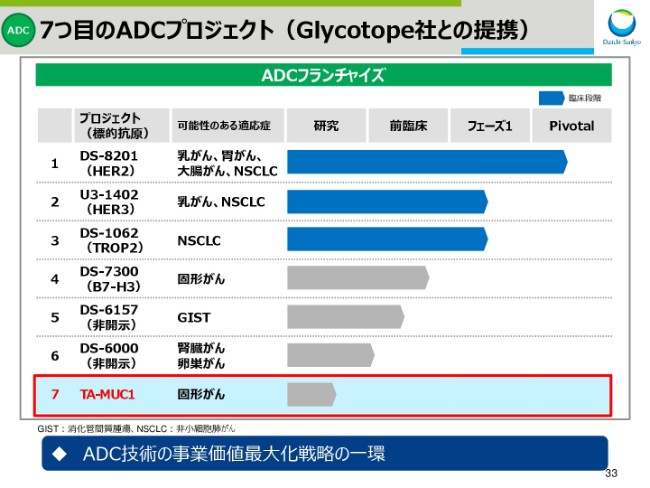
スライド33は、ADCフランチャイズの一覧表です。
Glycotope社とは昨年(2017年)オプション契約を締結し、抗TA-MUC1抗体に対し、当社のADC技術の可能性について、予備的検討を行ってまいりました。昨日(2018年7月30日)発表いたしましたが、このほど本剤を全世界において、独占的に開発および商品化するオプション権を行使いたしました。今回の契約により、当社ADCフランチャイズは合計で7品目となりました。今後も、ADC技術の事業価値最大化に向けて、さまざまな手を打っていく所存です。
ADC フランチャイズのサマリー

スライド34は、本日説明した、ADCフランチャイズのまとめです。
「DS-8201」のHER2陽性乳がんに対しては、2020年度承認申請がベストケースではありますが、2019年度中の申請を目指してまいります。HER2低発現乳がんに対しては、HER2陽性と同様の効果があったことから、近くフェーズ3試験を開始予定です。
「U3-1402」の乳がんを対象とした試験に関して、ASCOで初めてデータを発表をしましたが、その結果は「DS-8201」の初期の結果と類似しています。このことから、繰り返しになりますが、我々のADC技術が抗体を変えても応用可能であるということが確認できたと考えております。
また、Glycotope社とのライセンス契約により、当社のADCフランチャイズは、合わせて7プロジェクトということになりました。
キザルチニブ:AMLの治療の流れとQuANTUM試験
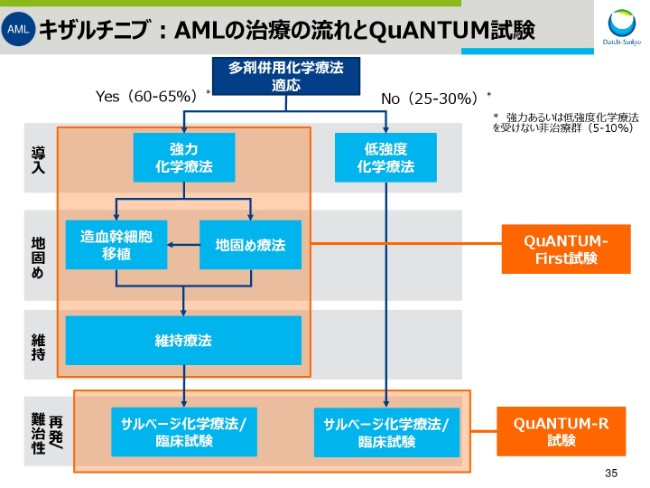
スライド35からは、「キザルチニブ」に関してです。
こちらには、AMLの治療の流れ……Patient Journeyと、「キザルチニブ」の2つのフェーズ3試験で狙っている治療ラインを表しております。今回は、再発性/難治性AMLを対象とした、QuANTUM-R試験のアップデートであります。
キザルチニブ:QuANTUM-R試験デザイン
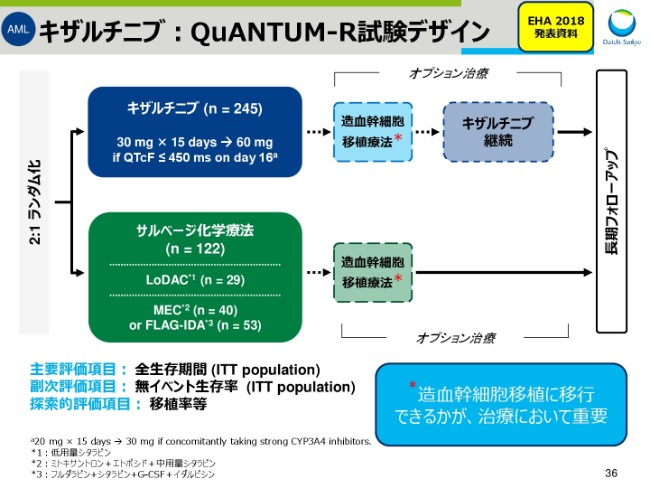
スライド36は、(2018年)6月のEHA(ヨーロッパ血液腫瘍学会)で結果を発表した、QuANTUM-Rの試験デザインであります。再発性/難治性AML患者においては、造血幹細胞移植に移行できるかが、大変重要な治療ポイントとなります。
キザルチニブ:QuANTUM-R試験 有効性結果
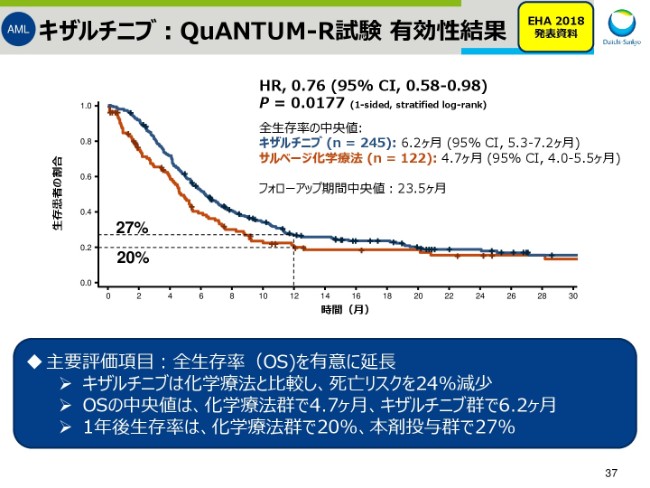
スライド37は、(QuANTUM-R試験の)有効性のデータを示しています。
「キザルチニブ」は化学療法と比較して、死亡リスクを24パーセント減少させ、主要評価項目である全生存率(Overall Survival)の中央値は、化学療法群で4.7ヶ月、「キザルチニブ」群で6.2ヶ月でありました。
また、1年後生存率は、化学療法群で20パーセント、「キザルチニブ」群で27パーセントでした。
キザルチニブ:QuANTUM-R試験 有効性
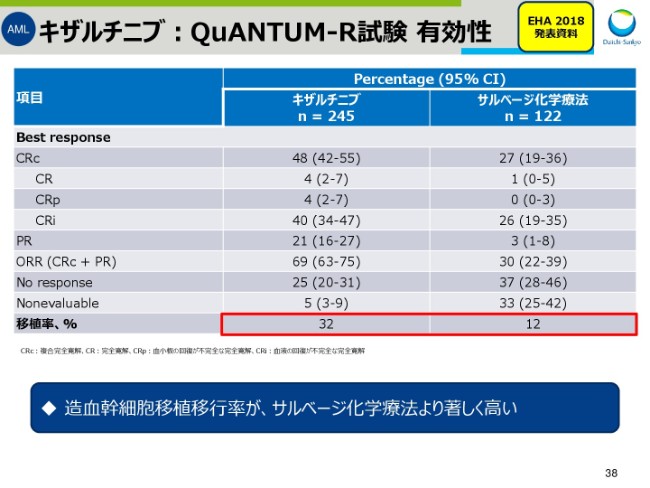
スライド38は、有効性の探索的評価項目の結果一覧です。
再発性/難治性のAML患者において重要な造血幹細胞移行率について、「キザルチニブ」において、サルベージ化学療法より著しく高い結果が得られました。
キザルチニブ:QuANTUM-R試験 安全性QT延長
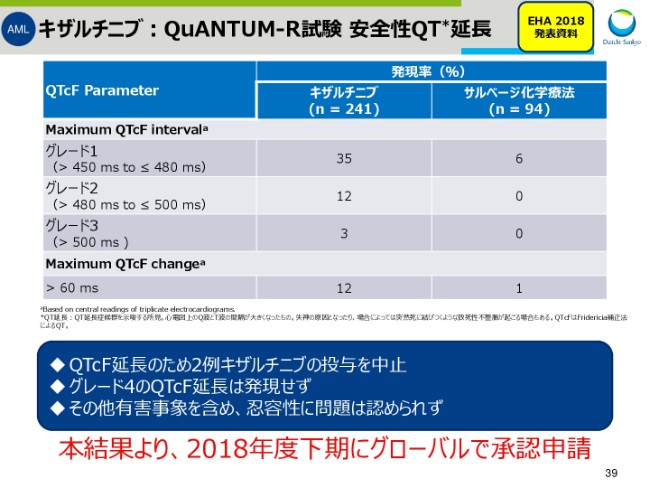
スライド39は、安全性でとくに注目していた、QT延長のデータです。
QT延長のため、2例の「キザルチニブ」の投与を中止いたしましたが、グレード4のQT延長は発現しませんでした。また、その他有害事象を含めて忍容性に問題は認められず、以上の結果をもちまして、2018年度下半期にグローバルで承認申請を行う予定であります。
ペキシダルチニブ:TGCT概要
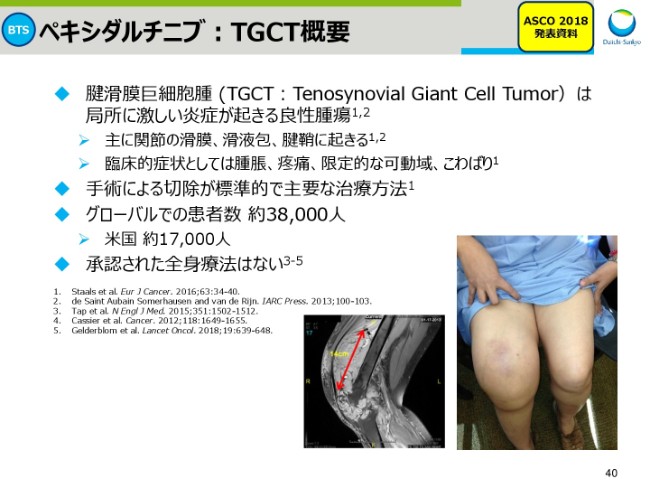
スライド40からは、「ペキシダルチニブ」です。
こちらにありますとおり、腱滑膜巨細胞腫(TGCT)に苦しむ患者さんは、グローバルで3万8,000人ほどいると言われており、良性腫瘍ではありますが承認された薬剤はなく、手術による切除が標準療法となっております。
ペキシダルチニブ:ENLIVEN試験 有効性結果
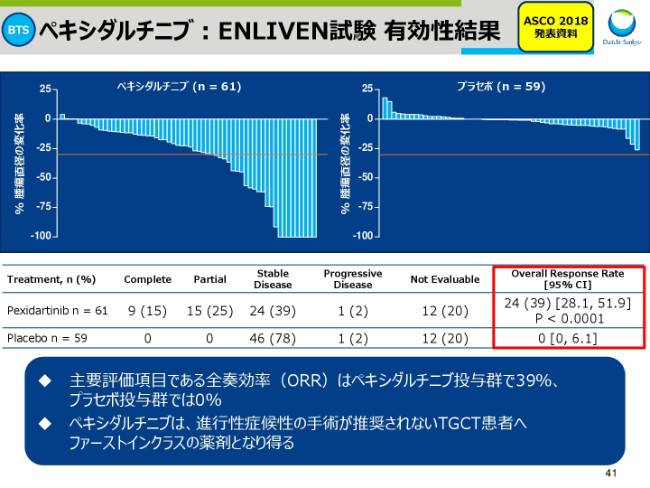
スライド41は、(2018年)6月のASCOで発表したフェーズ3試験、ENLIVEN試験の有効性データです。ほとんどの患者さんで腫瘍が縮小しており、また、腫瘍が30パーセント以上縮小した全奏効率(ORR)は39パーセントでした。
このことから「ペキシダルチニブ」は、手術が推奨されない患者さんへ、ファーストインクラスとなり得る薬剤と考えております。
ペキシダルチニブ: ENLIVEN試験 著効例
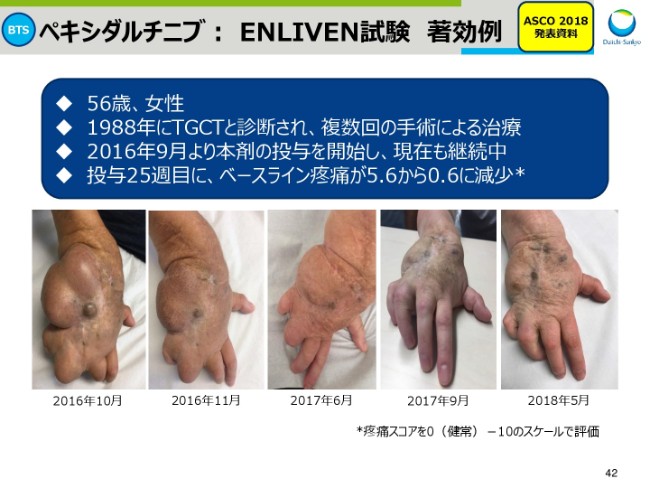
スライド42は、「ペキシダルチニブ」の著効例の写真です。こちらの例では、見た目も大きく変化しておりますが、伴う痛みのレベルも大きく改善しております。
ペキシダルチニブ:ENLIVEN試験 安全性
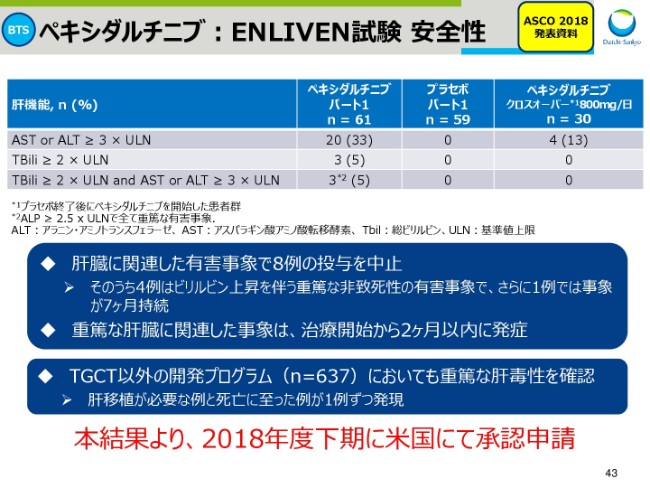
スライド43が、(ENLIVEN試験の)安全性のデータです。
ENLIVEN試験では、肝臓に関連した有害事象で8例の投与を中止しておりますが、「ペキシダルチニブ」のほかの適用を狙っていた臨床試験でも、重篤な肝毒性を確認しており、2018年度下半期の米国での承認申請に向け、規制当局と連携を密にしてまいります。
キザルチニブ、ペキシダルチニブのサマリー
スライド44が、「キザルチニブ」と「ペキシダルチニブ」のまとめです。
「キザルチニブ」は、再発性/難治性のFLT3-ITD変異のあるAMLにおいて、サルベージ化学療法と比較して全生存率を改善し、本データをもって、2018年度下半期にグローバルで承認申請していきます。また、本日は詳しく紹介しておりませんが、ファーストラインの試験が順調に進捗しております。
「ペキシダルチニブ」は、手術が推奨されないTGCT患者さんへ、ファーストインクラスの薬剤として、2018年度の下半期に米国で承認申請していきます。
DS R&D Day 2018のご案内

スライド45は、今年度のR&D Dayのご案内です。2018年12月12日の15時00分から17時00分で、開催を予定しております。ご参加につき、ご検討いただけましたら幸いでございます。
以降はAppendixを記載しておりますので、後ほどご確認をお願いします。
私からの発表は以上です。
新着ログ
「医薬品」のログ