JCRファーマ、通期の営業利益は前期比154.9%増 今期は「イズカーゴ」の販売開始等が寄与する見込み
2021年3月期決算説明会
芦田信氏:JCRファーマ株式会社の芦田信でございます。本日は2021年3月期決算説明会の動画をご覧いただき誠にありがとうございます。みなさまにおかれましては、平素より当社の格別のご理解とご支援を賜り、誠にありがとうございます。
本日の決算説明会は、2021年3月期の決算概要と研究開発状況について、後ほど各担当者からご説明いたします。
はじめに、2021年3月期の決算は売上高、各利益ともに期首の予想を大きく上回る結果となり、過去最高となりました。「JR-141」に関しましては、日本において3月に「イズカーゴ」として製造販売承認を取得し、5月19日に薬価基準に収載され、販売を開始する予定です。こちらは当社にとって大変重要なマイルストーンとなります。
「JR-141」は、我々の独自技術である「J-Brain Cargo」を適用した初めての医薬品です。日本で実施したフェーズ1/2試験で、4週間から始まり、今日まで100週以上の長期投与結果により安全性に問題ないことが確認できました。
これらの臨床試験の結果から「J-Brain Cargo」は、現在開発中のライソゾーム病の約16疾患についてもよい結果が出ることを確信できました。また臨床結果から、患者さまにとっても、患者さまの家族にとっても大変よい結果が得られました。
次に「JR-141」に関するライセンス契約についてお話しいたします。我々が開発している「JR-141」をはじめとする「J-Brain Cargo」を適用したライソゾーム治療薬は、グローバルでも販売することができる企業でないとならないと考え、契約締結に向けた交渉を継続して行っています。
交渉先とは、「JR-141」だけではなく、「J-Brain Cargo」技術を利用した他のライソゾーム病の医薬品開発に関しても、同時に交渉を行っています。また、世界でも患者数の少ないスライ症候群やサンフィリッポ症候群のような疾患については、我々がグローバル販売を行うことも検討しています。
次に、アストラゼネカ社のワクチン原液製造に関する件をお話しします。ワクチン原液製造については相当な人員を投入して今年の初めから製造を行い、3月に無事に出荷いたしました。このワクチン原液は世界の10ヶ国以上の企業にライセンスされており、我々が製造した原液の品質について高い評価をいただいております。
いまだ新型コロナウイルス感染拡大の収束が見えない中、1日も早く日本国内の安定供給に貢献できるよう製造現場を中心に鋭意取り組んでまいります。昨年5月に公表しました3ヶ年中期計画の「変革」については、売上高や営業利益は予想を大きく上回ることになりますが、重要経営課題については引き続き取り組んでまいります。
最後に、来月開催予定の株主総会の取締役新体制および組織変更についてお話しいたします。昨年に新たに就任しました取締役を含め、若い取締役が会社に新たな成長をもたらしていることを実感しています。昨年に引き続き、会社の組織として株主総会後に組織変更を実施いたします。
当社は「J-Brain Cargo」の次の基盤技術開発についても取り組んでおり、これはより長期的に成長するために必須であると考えております。今、JCRは第2の創業を開始したと思っています。
若い経営層や社員が中心となって会社を牽引し、チームJCR一丸で挑戦し続けてまいります。今後ともみなさまのご理解とご支援を賜りたく、よろしくお願い申し上げます。
2021年3月期 決算ハイライト

太田義博氏:管理本部経理部の太田と申します。2021年3月期実績ならびに2022年3月期予想につきましてご説明させていただきますので、よろしくお願い申し上げます。まず、2021年3月期の概要についてご説明します。売上高、営業利益、経常利益、当期純利益はいずれも過去最高を達成しております。
連結決算概要

売上高につきましては300億8,500万円を計上しており、前期比で21.4パーセントの増加となっております。詳細につきましては後ほどご説明させていただきます。一方、販売管理費合計につきましては前期比で2.7パーセントの増加となりました。
販売・一般管理費につきましては、コロナ禍をきっかけとした業務効率の見直しがあった一方で、事業拡大期における人件費の増加などにより、前期比で13.1パーセント増の86億4,300万円となりました。
研究開発費につきましては、スケジュールは順調に進捗しておりますが、効率的な研究開発を行った結果、前期比で10.6パーセント減の53億6,000万円にとどまりました。なお、研究開発費の対売上高は17.8パーセントとなっております。
これらの結果、営業利益は前期比で154.9パーセント増の82億6,900万円、経常利益は前期比で157.7パーセント増の84億8,800万円、当期純利益は前期比で157.4パーセント増の68億9,200万円となりました。
なお対売上高の売上原価率は26.0パーセントと前期比で5.9ポイント改善し、対売上高の営業利益率は27.5パーセントと前期比で14.4ポイント改善しております。
売上高内訳(連結)
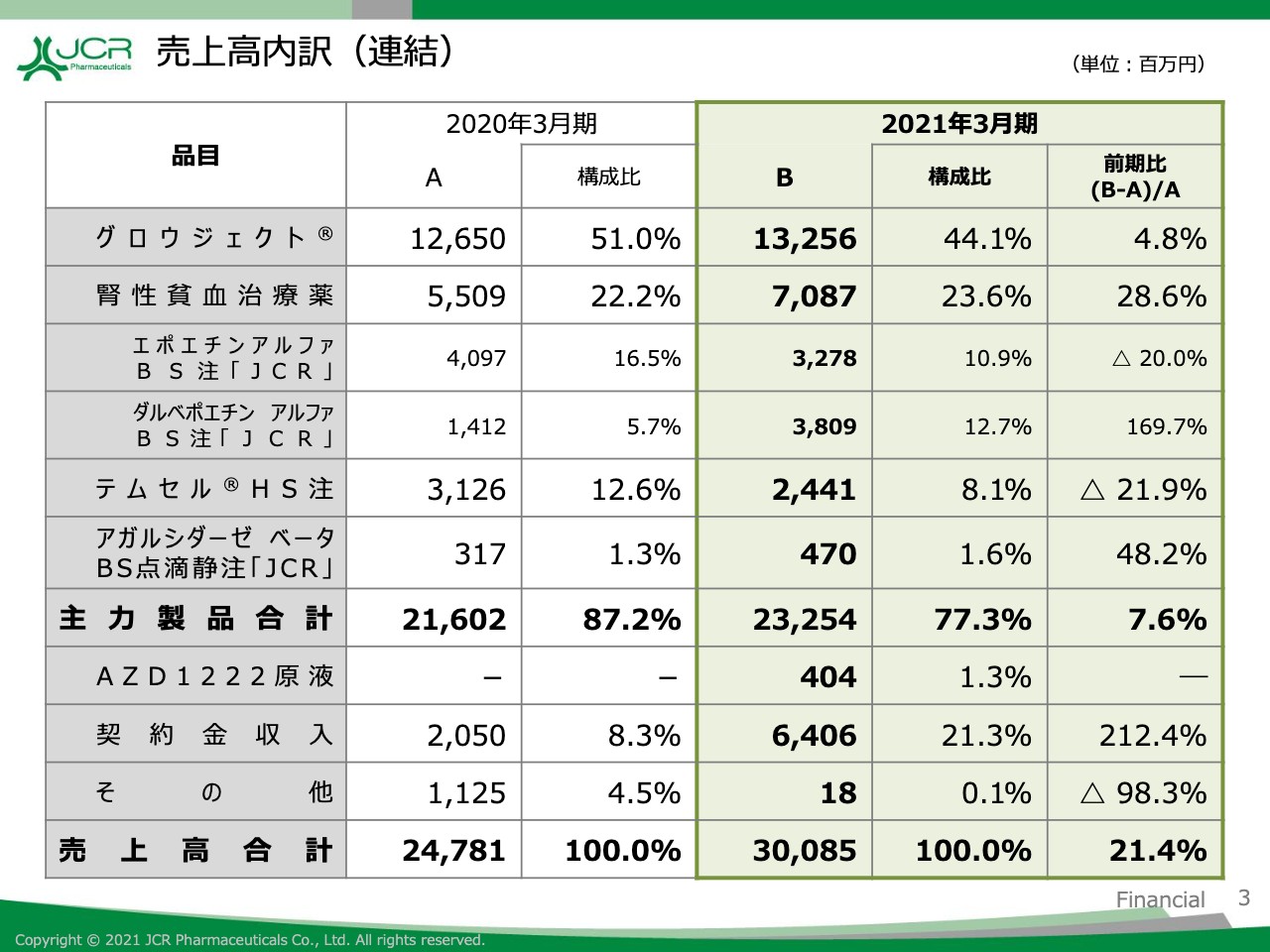
売上高の内訳についてご説明します。主力製品である遺伝子組換え天然型ヒト成長ホルモン製剤「グロウジェクト」につきましては、前期比で4.8パーセント増の132億5,600万円となりました。数量ベースでは9.8パーセントの増となり、着実に増加しております。
もう1つの主力製品である腎性貧血治療薬につきましても、前期比で28.6パーセント増の70億8,700万円となりました。
再生医療等製品「テムセル」につきましては、2020年4月から在庫積み増しのため一部出荷制限を実施しましたので、前期比で21.9パーセント減となりました。しかし、ファブリー病治療薬「アガルシダーゼ ベータ」につきましては前期比で48.2パーセントの増となりました。
アストラゼネカ社より受託しております新型コロナウイルスに対するワクチンの原液「AZD1222」原液につきましては、4億400万円の売上となりました。契約金収入は64億600万円と、前期比で43億5,600万円増加しております。以上により、売上高合計は前期比で21.4パーセント増の300億8,500万円と、過去最高を達成いたしました。
財務状態
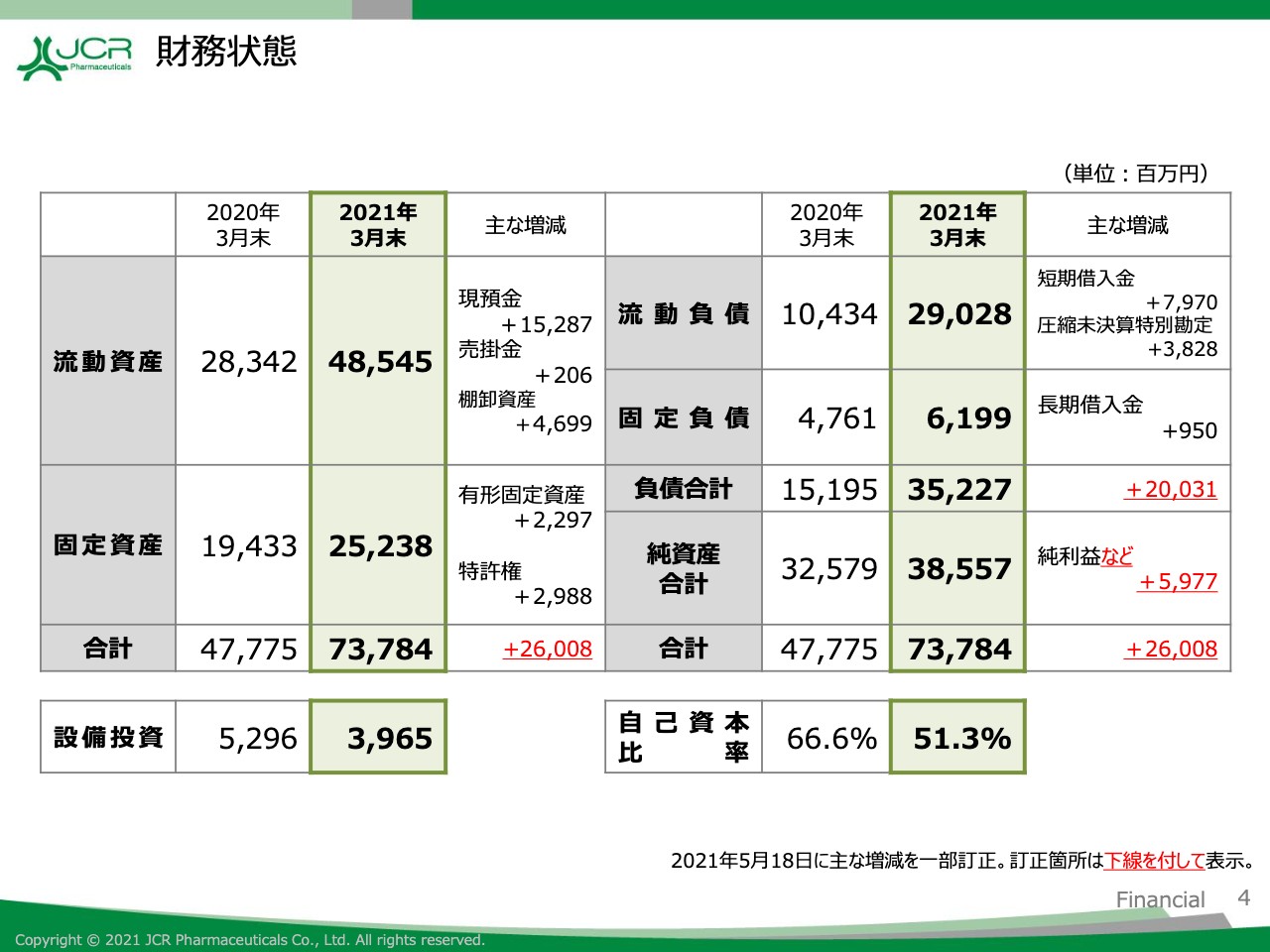
2021年度末の財務状態についてご説明します。資産合計は737億8,400万円と、前期比で260億800万円の増加となりました。流動資産につきましては、現預金ならびに棚卸資産の増加などにより、前期比で202億300万円増加しております。
棚卸資産の主な増加要因としましては、コロナ禍において世界的に材料調達が困難な状況になりつつあることを踏まえ、早めの材料調達を行っていることが挙げられます。
固定資産につきましては、前期比で58億500万円の増加となりました。こちらは新型コロナウイルスワクチン原液の新工場建設用の土地取得、ならびに米国ArmaGen社の買収などによるものです。
負債合計につきましては、新型コロナウイルス感染症が蔓延する状況を鑑みて、現金同等物残高を厚くすることを目的に借入金を増加させたことを主な要因として、前期比で200億3,100万円増の352億2,700万円となりました。
純資産につきましては当期純利益の計上などにより、前期比で59億7,700万円増の385億5,700万円となっております。
キャッシュフロー(連結)
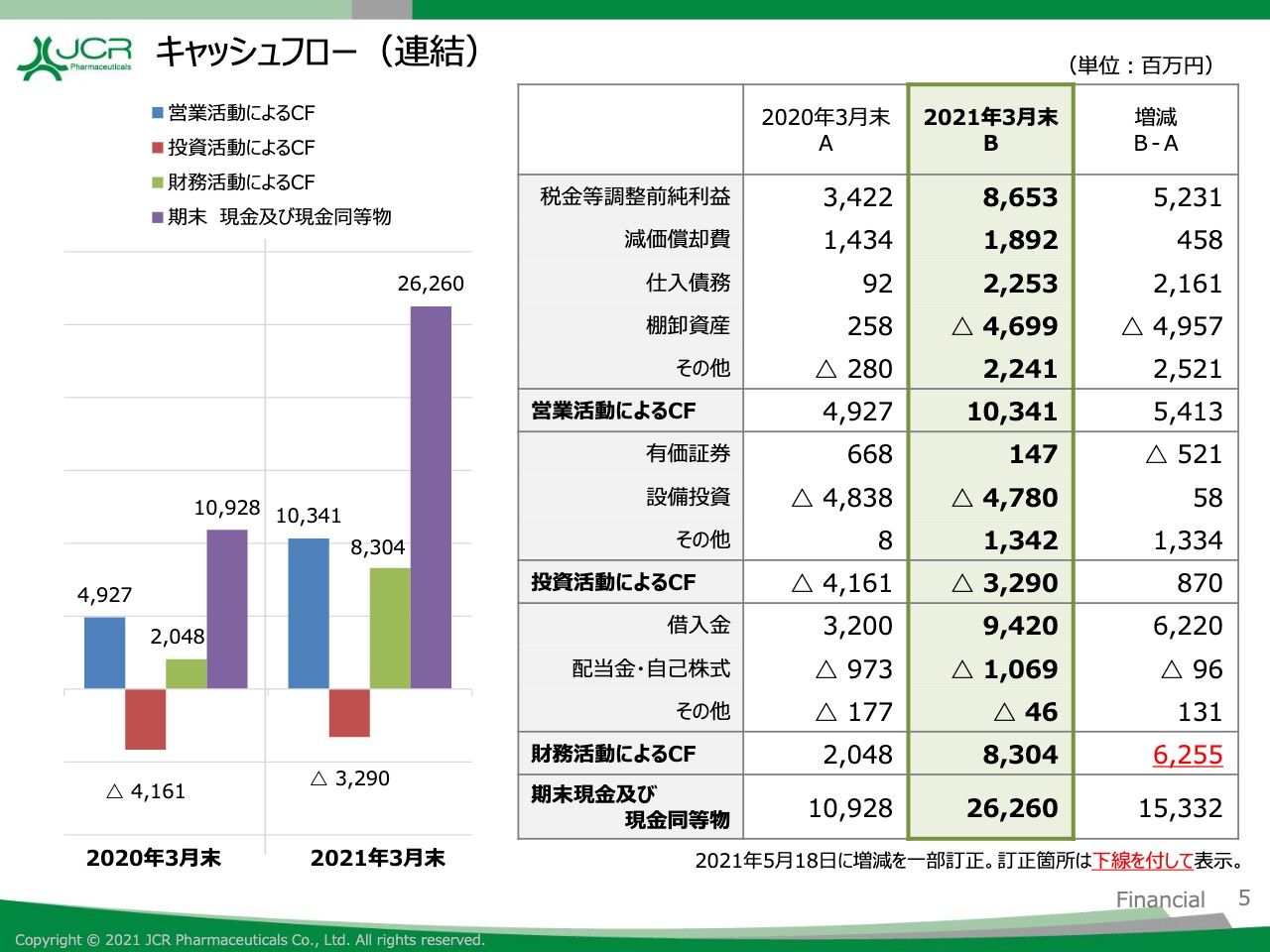
キャッシュフロー計算書の状況についてご説明します。営業活動により得られたキャッシュフローは前期比で54億1,300万円増の103億4,100万円、投資活動により使用したキャッシュフローは前期比で8億7,000万円減の32億9,000万円、財務活動により得られたキャッシュフローは前期比で62億5,500万円増の83億400万円となりました。
これらにより、期末現金同等物の残高は前期比で153億3,200万円増の262億6,000万円となりました。以上が2021年3月期の業績についてのご説明となります。
2022年3月期 予想ハイライト

2022年3月期の業績予想についてご説明します。当期のトピックスとしましては、ハンター症候群治療薬「イズカーゴ」の販売を開始するほか、ライセンス事業への積極的な取り組み、および「AZD1222」原液製造が業績に大きく寄与することが見込まれます。
一方で、主にライソゾーム病治療薬関連の研究開発の進捗によりまして、研究開発費は前期比で92.2パーセント増の103億円と、大きく増加することを見込んでおります。販売費・一般管理費につきましても事業拡大の中で増加が見込まれ、前期比で35.4パーセント増の117億円を計画しております。
2022年3月期 予想
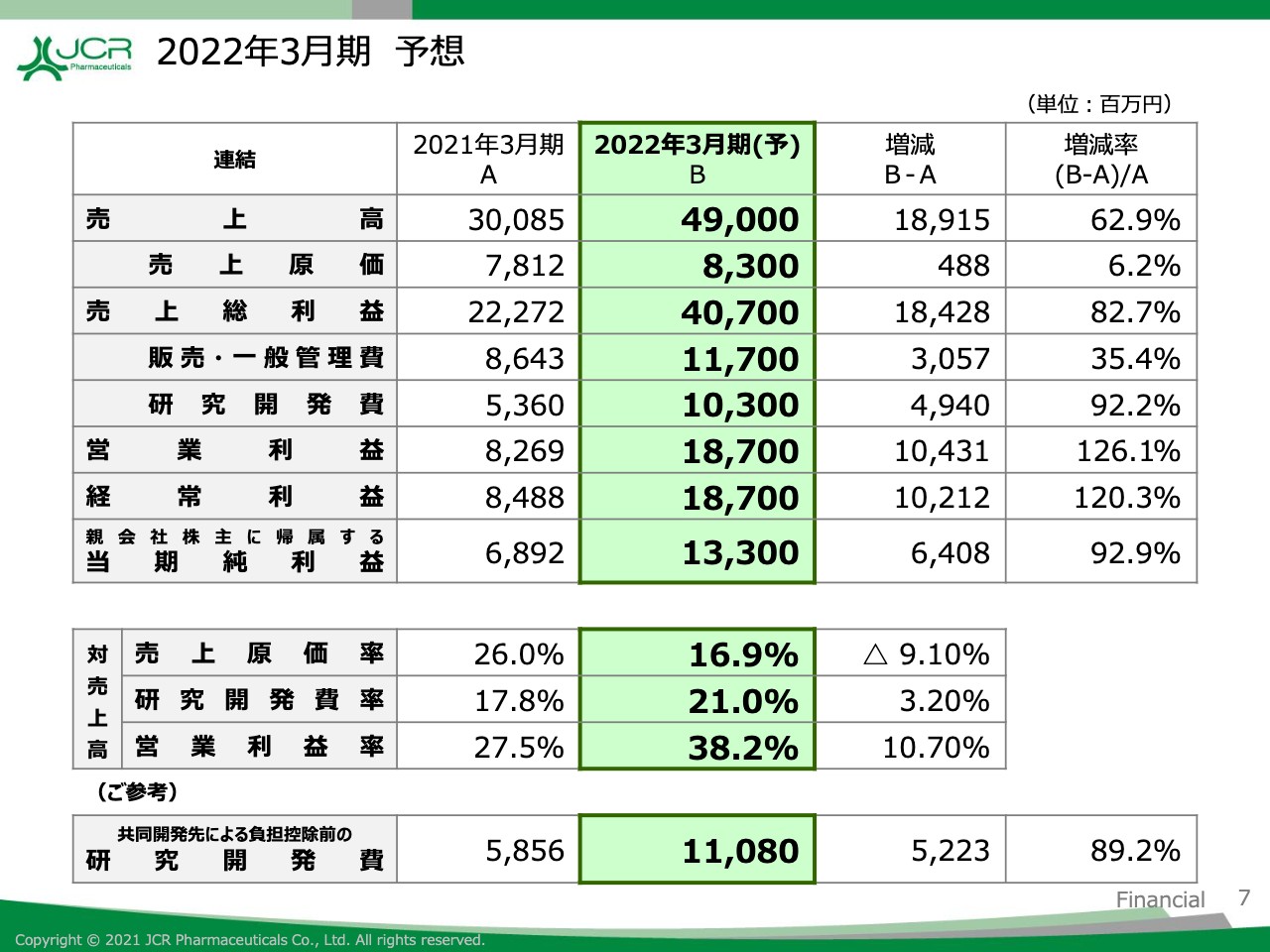
これらの結果、売上高は前期比で62.9パーセント増の490億円、営業利益は前期比で126.1パーセント増の187億円、経常利益は前期比で120.3パーセント増の187億円、当期純利益は前期比で92.9パーセント増の133億円と大幅な増収増益を計画しております。
2022年3月期 予想(内訳)
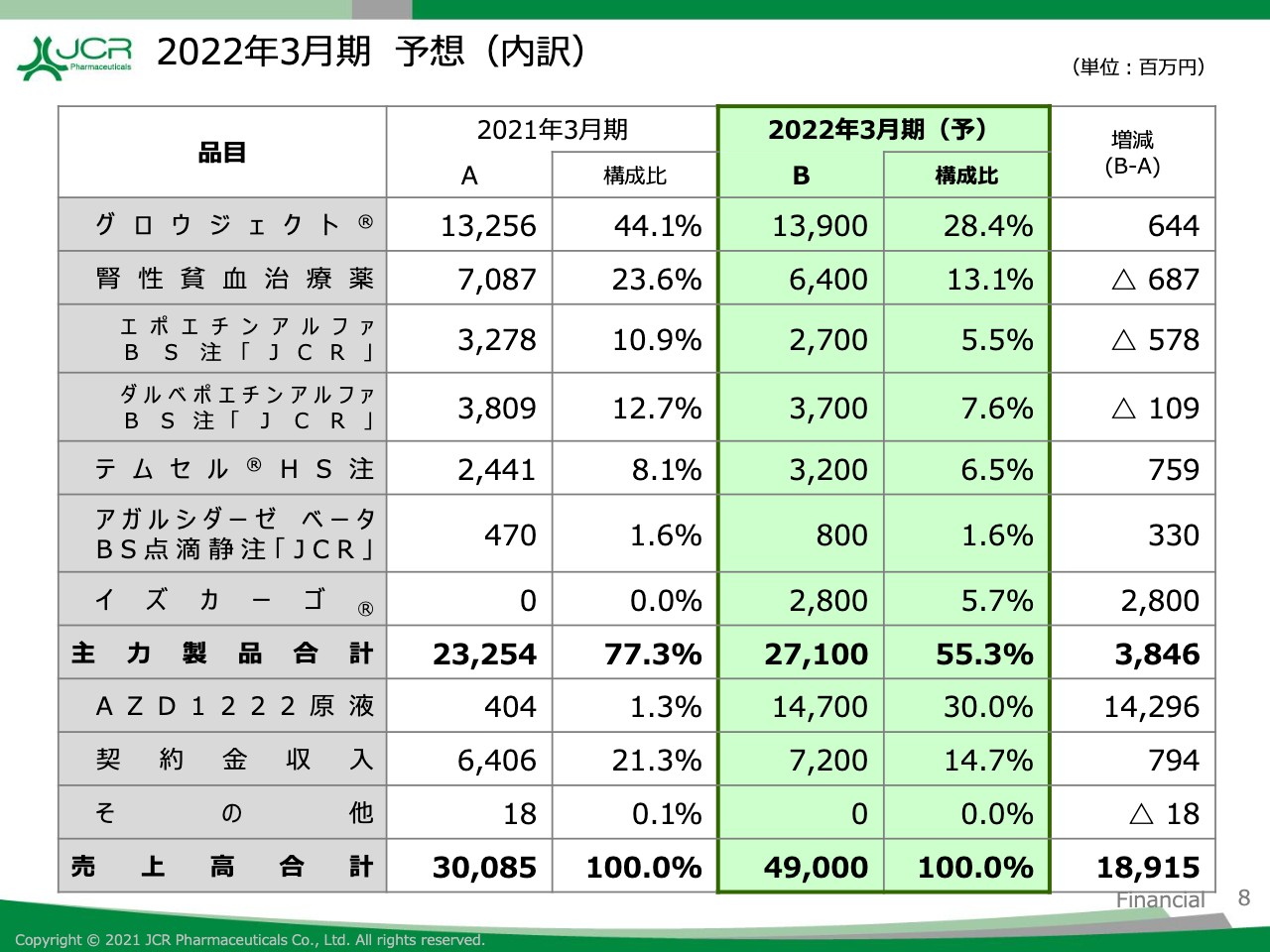
2022年3月期の品目別売上高の予想についてご説明します。主力製品である「グロウジェクト」につきましては営業体制の変更により、各製品においてより効率的、効果的な情報提供活動を展開していきます。
また、電動式デバイスという特性を活かした治療満足度の向上により差別化を図ることで、販売数量の伸長を図ります。その結果、当期比で6億4,400万円増の139億円を計画しております。
一方、腎性貧血治療薬につきましては、前期比で6億8,700万円減の64億円を計画しています。「テムセル」は前期比で7億5,900万円増の32億円を、「アガルシターゼ ベータ」は前期比で3億3,000万円増の8億円を計画しています。
「イズカーゴ」につきましては、2021年5月に薬価基準収載を見込んでおり、売上高28億円を計画しています。「AZD1222」原液につきましては、売上高147億円を計画中です。
契約金収入につきましても、当期比で7億9,400万円増の72億円と増収を計画しております。以上、2021年3月期実績ならびに2022年3月期予想につきましてご説明させていただきました。ありがとうございました。
研究開発ニュースリリースハイライト(期間:2020年11月-2021年3月)
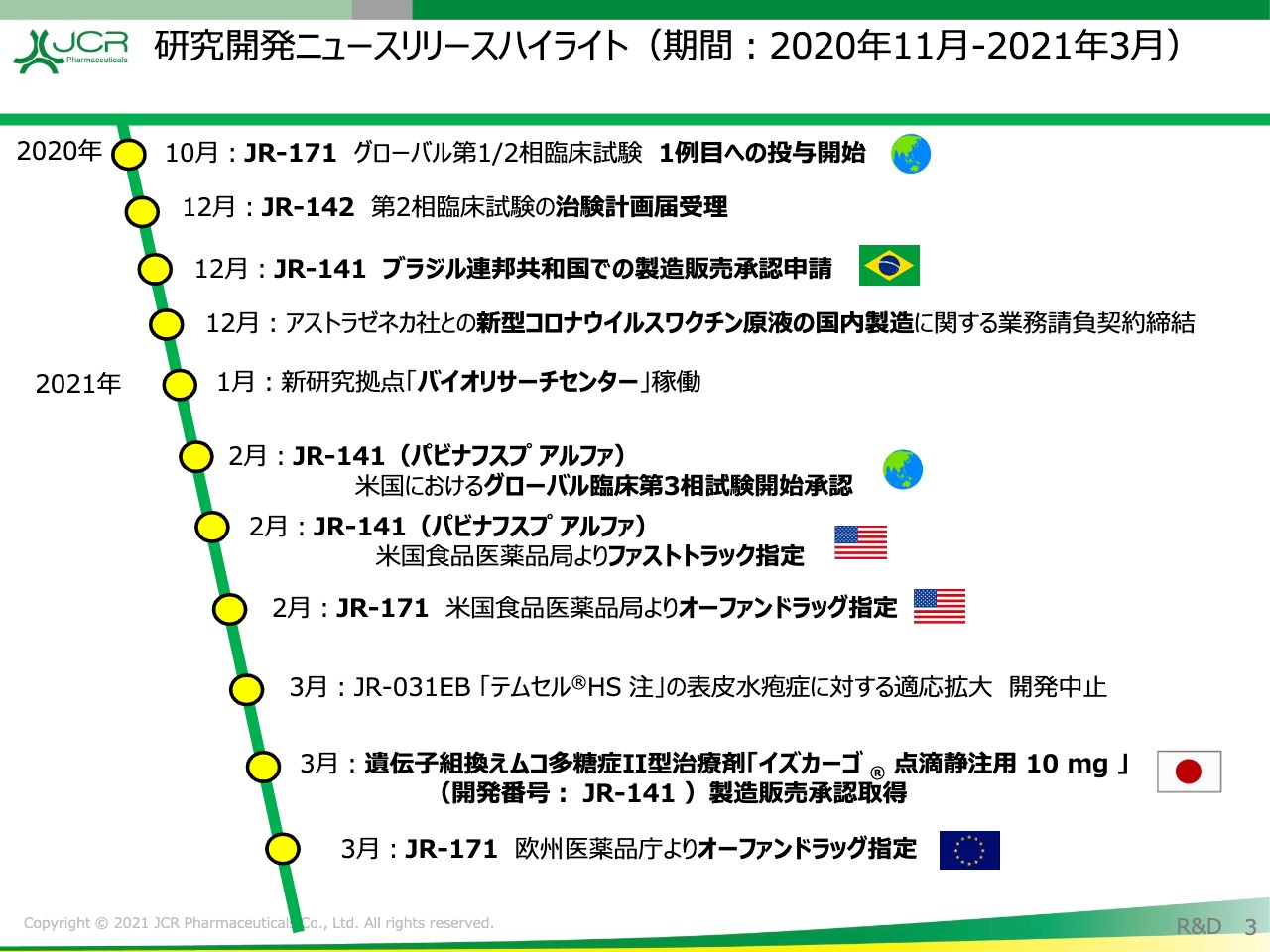
谷澤和紀氏:開発本部の谷澤でございます。私から研究開発の進捗についてご説明を申し上げます。最初に、ニュースリリースのハイライトをお示ししております。大きな点としましては、「イズカーゴ」が3月に製造販売承認を取得いたしました。
また、ハーラー症候群の治療酵素「JR-171」に関しましても、第1相試験の進捗が順調に進んでおります。
ライソゾーム病とは
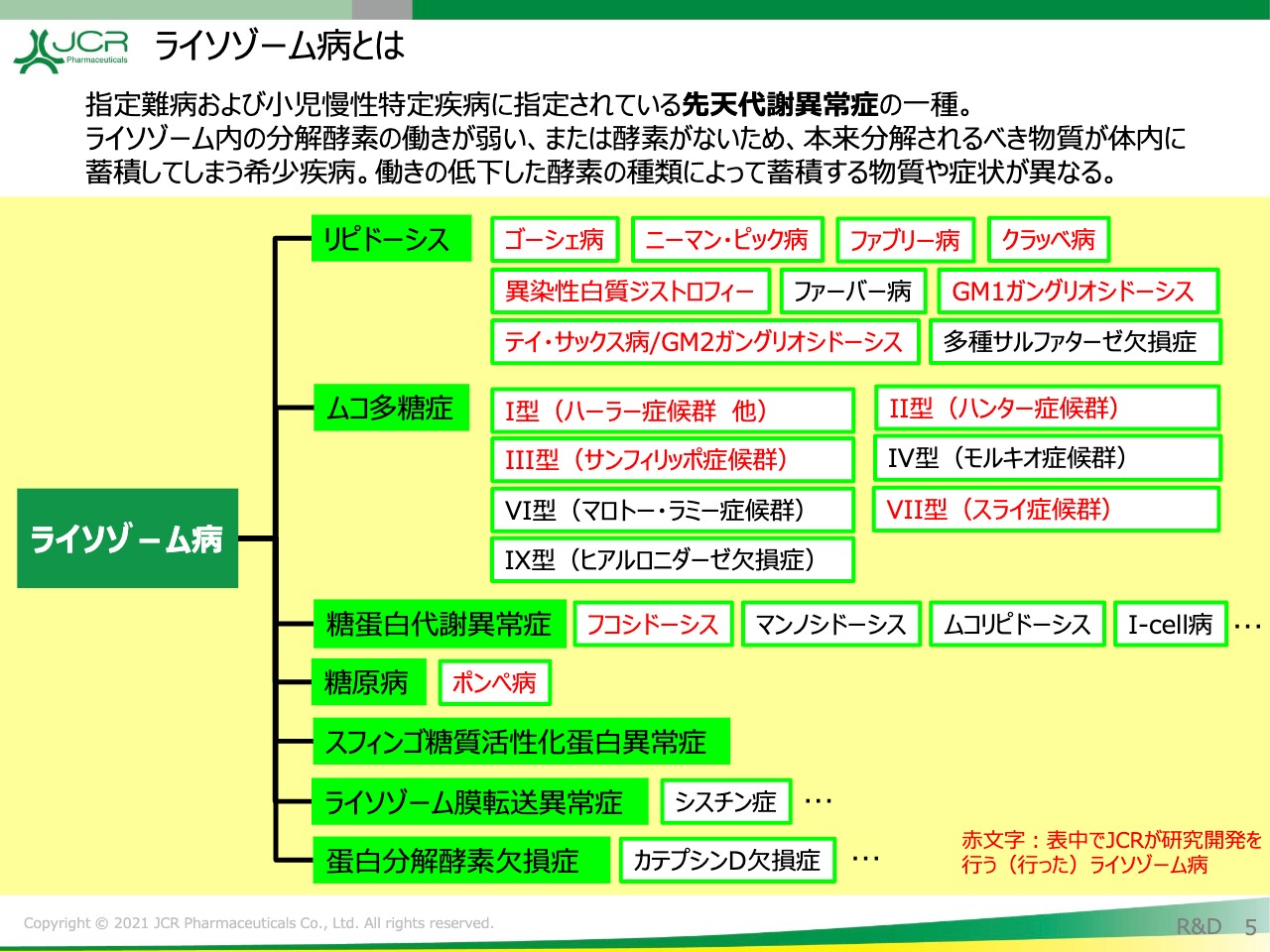
「JR-141」の開発状況についてご説明します。ライソゾーム病とは先天代謝異常症の一種で、蓄積する基質によってリピドーシスやムコ多糖症、糖原病といった分類がされております。
「JR-141」の対象となっているのがムコ多糖症Ⅱ型のハンター症候群で、「JR-171」に関しましてはⅠ型のハーラー症候群を対象としております。
JR-141 開発状況①
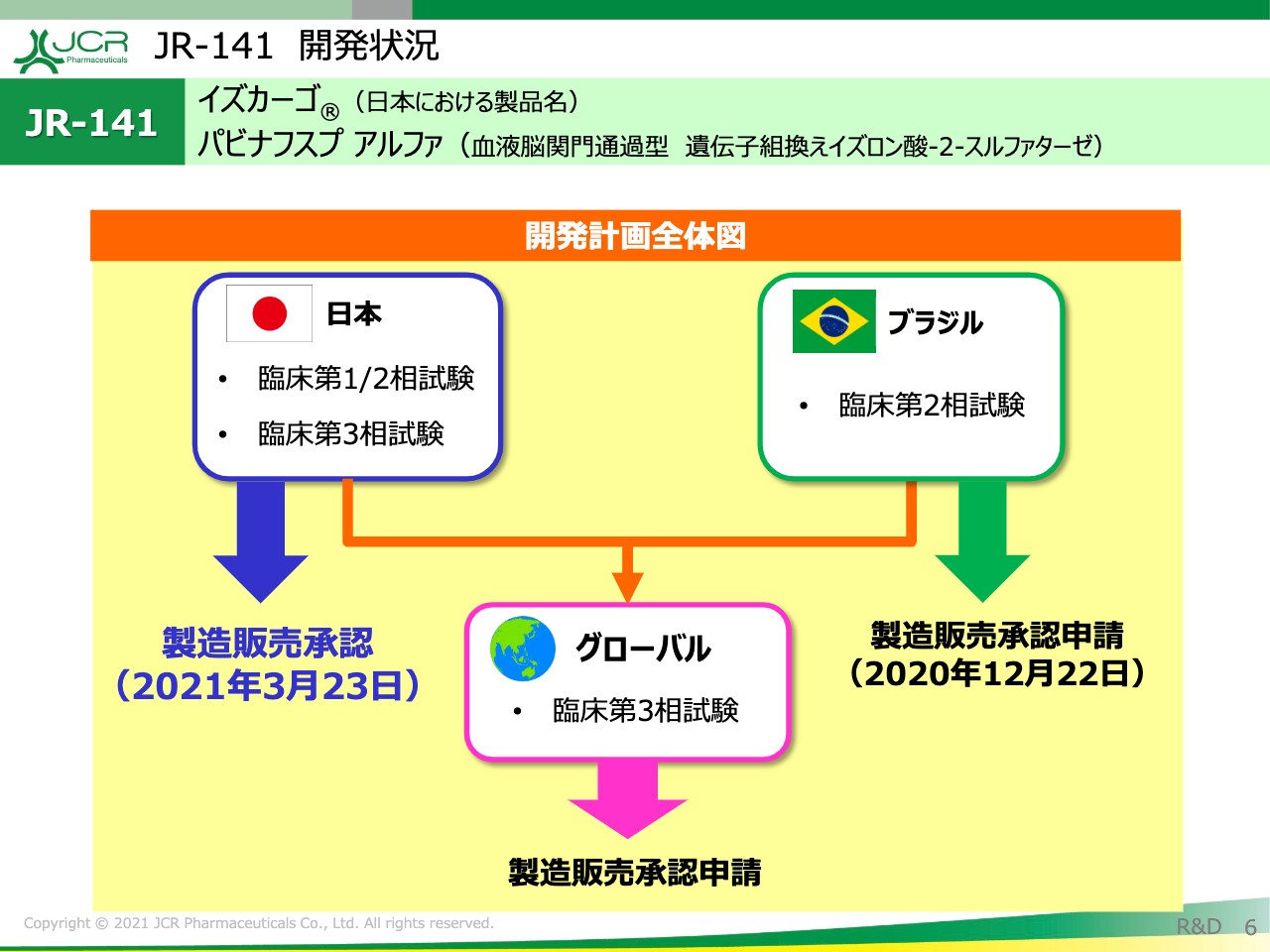
「JR-141」の開発全体像をお示ししております。日本に関しましては、臨床第1/2相試験と国内の第3相試験を実施しまして、先日承認取得となりました。ブラジルに関しましては第2相試験を実施して、現在製造販売承認申請を行っているところです。
今後、グローバルの第3相試験を実施していくのですが、今年の2月にINDの受理ということでFDAからすでにレターを受領しておりますので、現在は開始に向けて準備を進めているところです。
JR-141 臨床試験
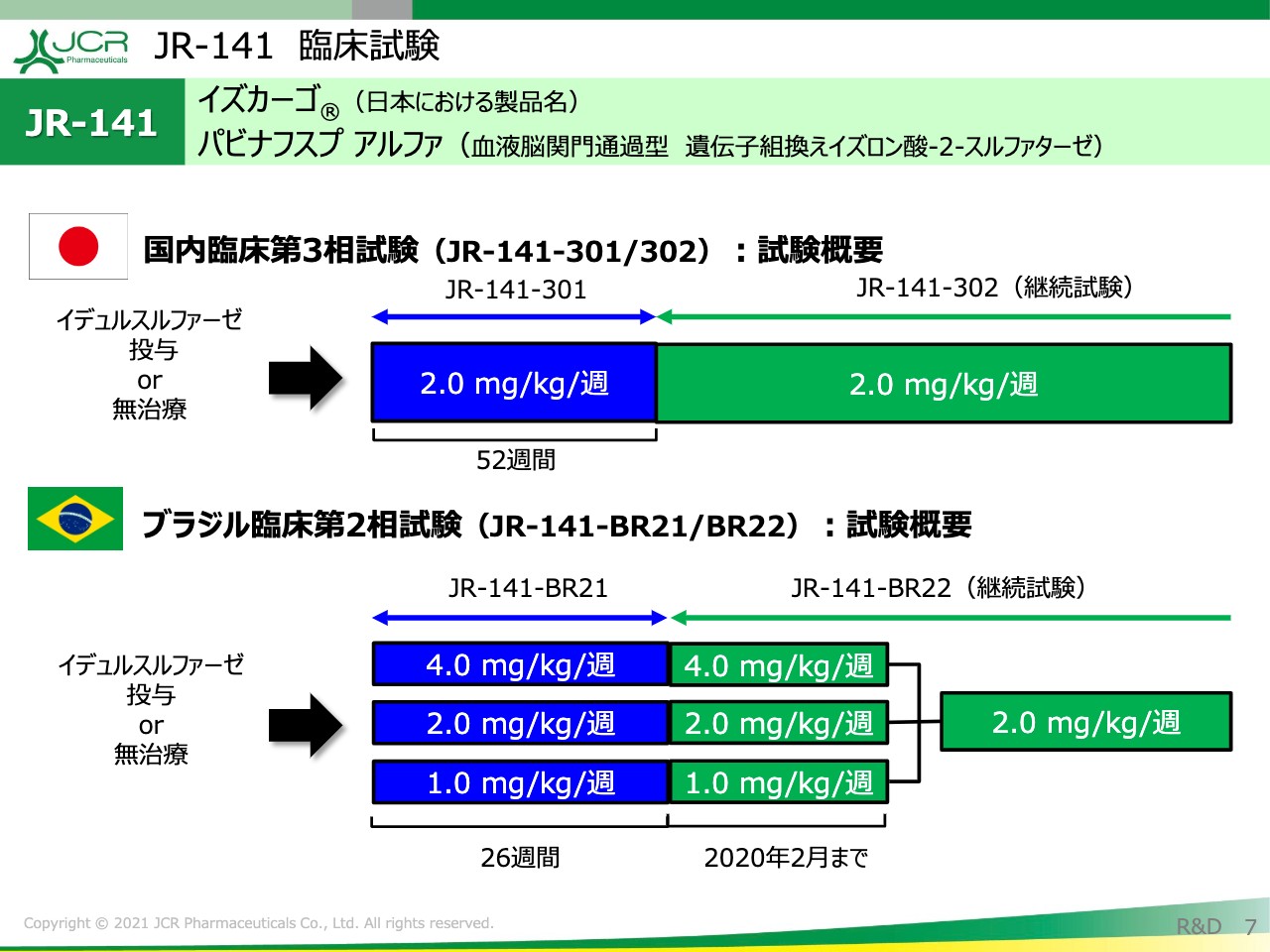
臨床試験の全体像をお示ししております。国内の第3相試験は非常にシンプルなかたちになっており、承認用量である「2ミリグラム/キログラム/週」を用いて、現在も投与が継続されております。
ブラジルに関しましては、1ミリグラム、2ミリグラム、4ミリグラムの3用量の検討を行い、最終的に有効性、安全性の観点から2ミリグラムを選択し、投与が継続されているところでございます。
JR-141 臨床試験(日本)①
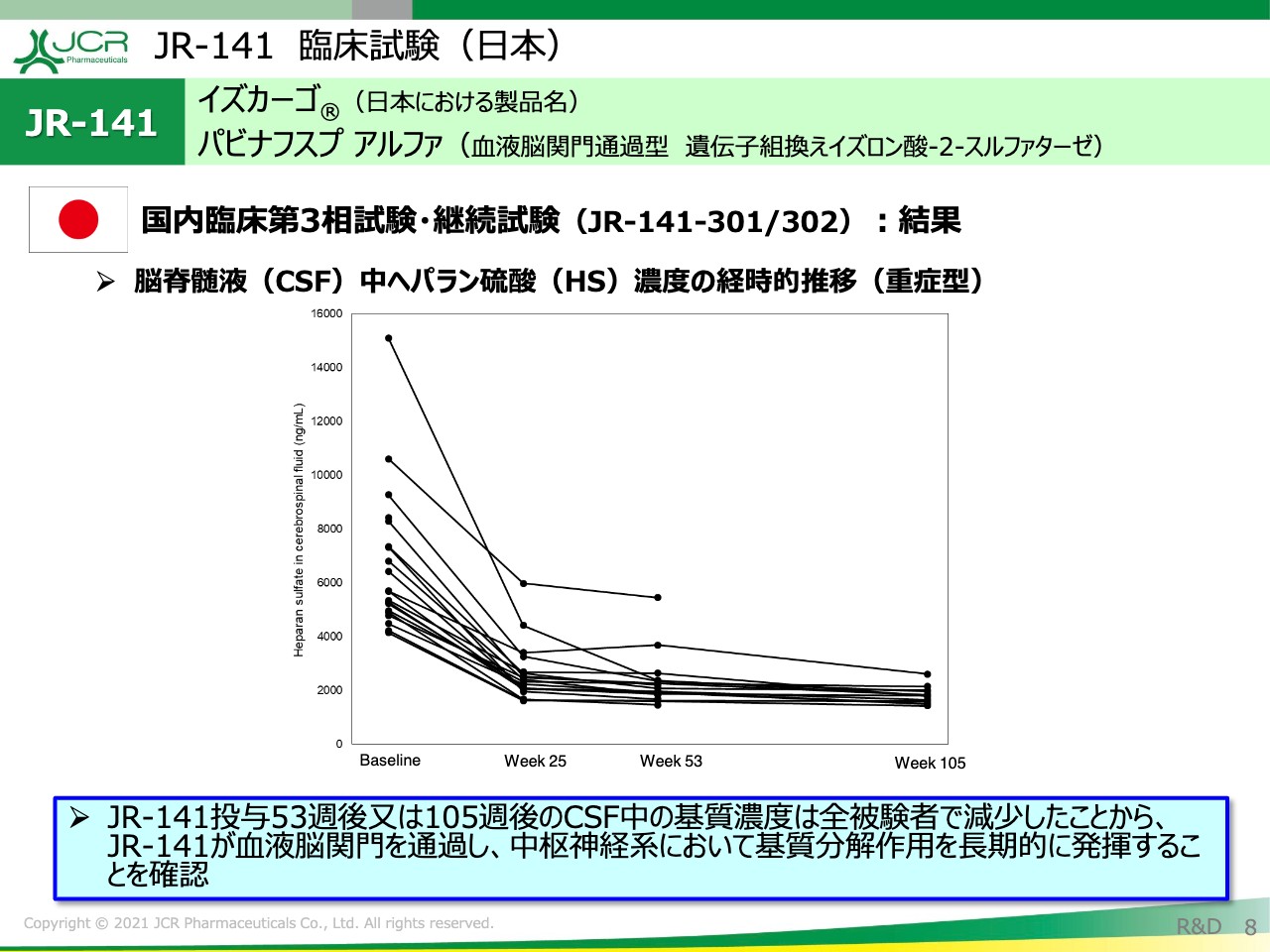
8ページからデータについてお示ししております。8ページは、脳脊髄液中のヘパラン硫酸の濃度の経時的推移です。こちらのデータは重症型に限っております。ご覧のとおり、52週間(1年間)かけて、全例でヘパラン硫酸の減少が認められました。
2年間の投与を終了しているデータもあり、そちらを見ると52週からさらに減少している例も認められます。52週の段階で十分に下がっている被験者に関しましては、そのまま2年後も推移していることがおわかりいただけるかと思います。
我々が考えているのは、このヘパラン硫酸の濃度を軽症型のレベルまで維持することが非常に重要だということです。このデータをご覧いただくとおわかりのとおり、「JR-141」は長期的にヘパラン硫酸を抑えていくことができると言えます。
JR-141 臨床試験(日本)②
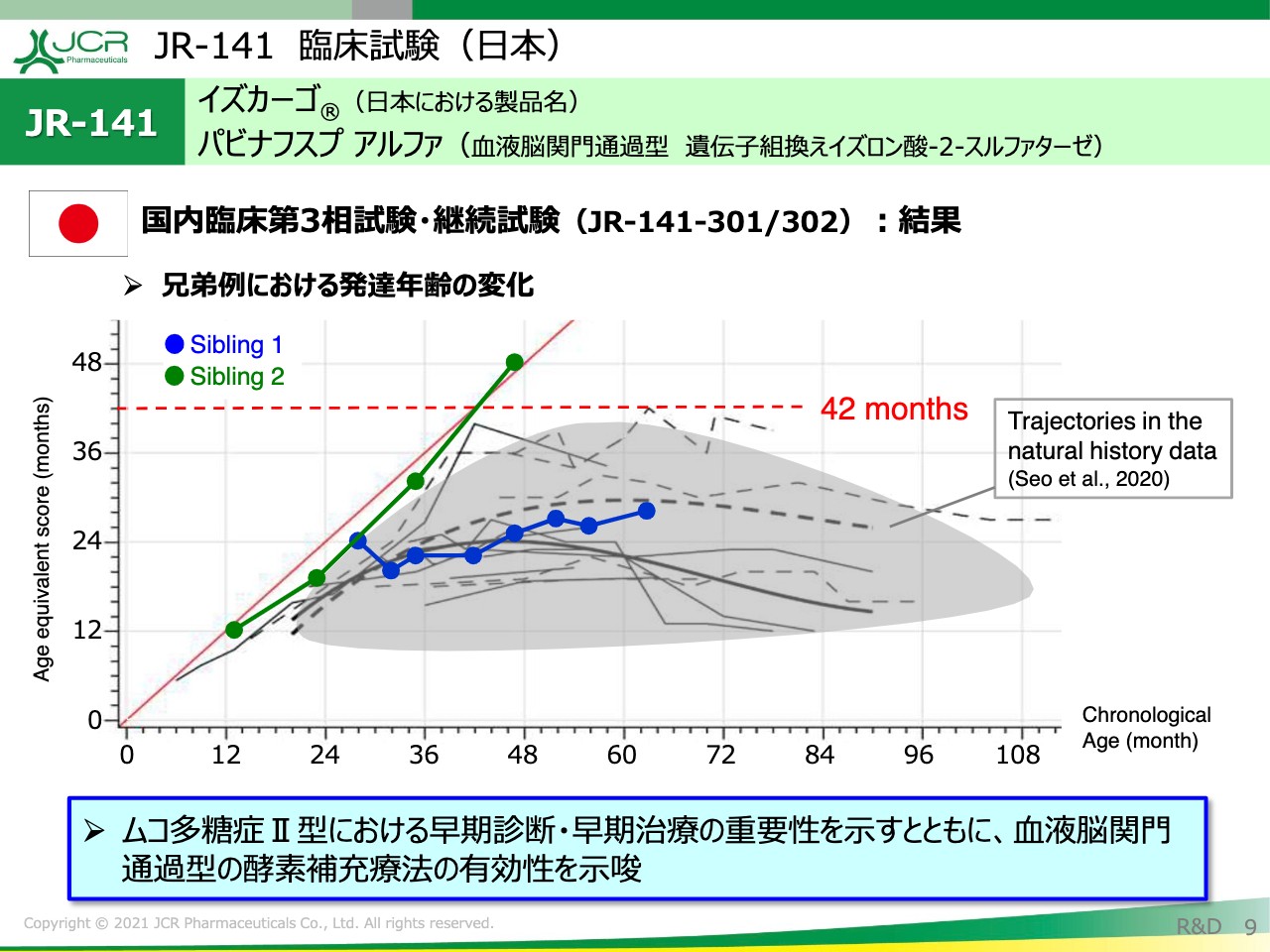
ヘパラン硫酸を低値に抑えていくことの重要性についてです。折れ線グラフの緑色のラインが、だいたい1歳11ヶ月くらいで「JR-141」の治療を始めた患者さまの発達の推移です。
現在、患者さまは48ヶ月で4歳になっていますが、ご覧のとおり発達年齢も48ヶ月ということですので、正常な発達を継続されています。
患者さまのヘパラン硫酸のレベルは2,000未満となっておりますので、やはりヘパラン硫酸のレベルを非常に低い値で維持していくことが治療上で重要なポイントだと言えます。
青色の折れ線グラフは、患者さまのお兄さまのデータですが、この方に関しては既存の酵素治療を受けられていた患者さまです。グラフのグレーで示している部分は、重症患者さまのナチュラルヒストリー(自然歴)ということになります。
やはり2歳くらいから発達の鈍化が見られて、「JR-141」の治療を受けた弟さまとは違った発達の推移を示しています。この点から、治療は早期診断・早期治療が非常に重要なポイントであることをお伝えしたいと思います。
JR-141 臨床試験(ブラジル)
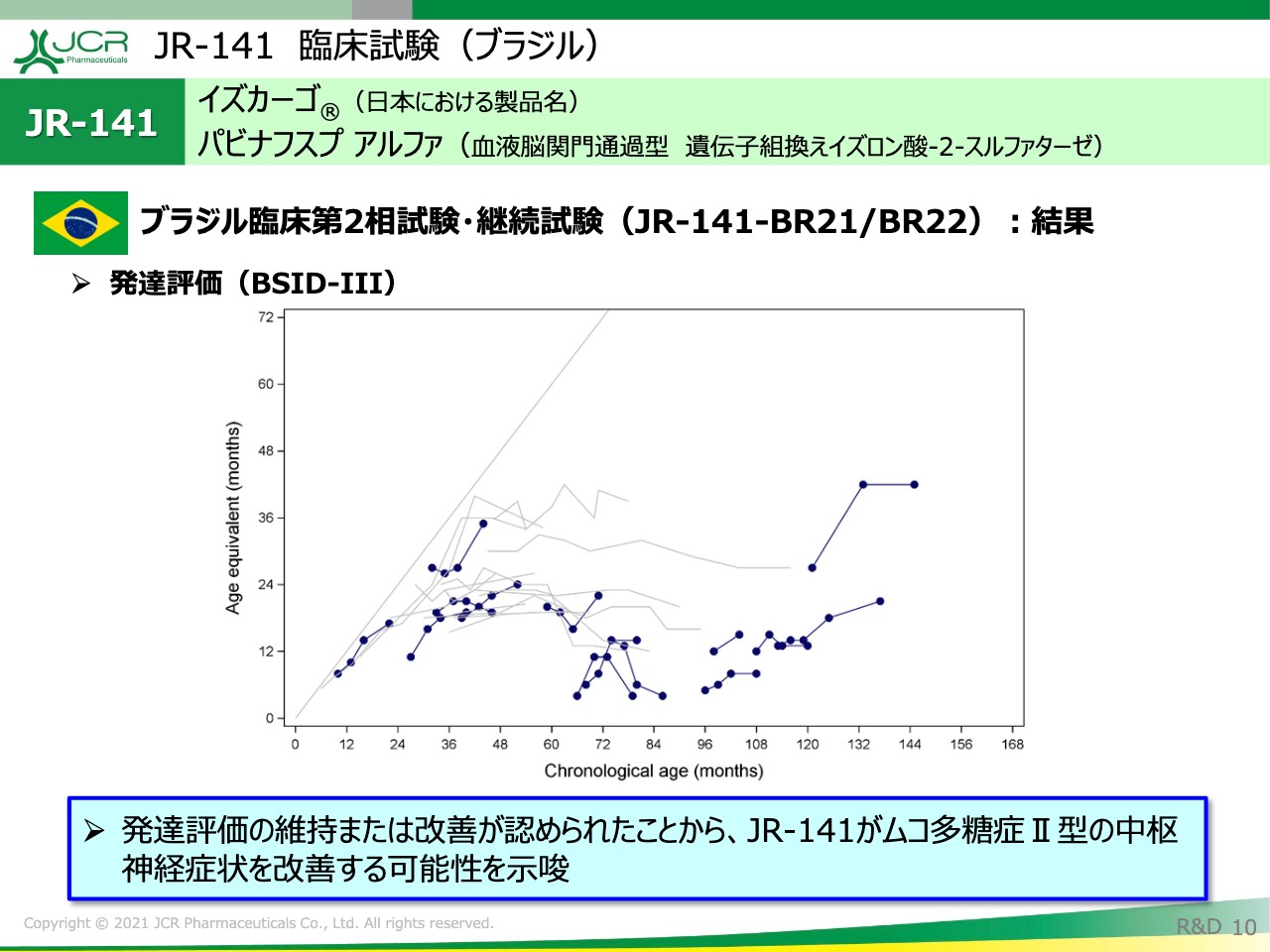
10ページは、ブラジルの試験における長期的な発達の推移をお示ししております。こちらの試験では、「Bayley-Ⅲ」という発達の質問票を用いて発達年齢の評価を行いました。
「Bayley-Ⅲ」は、ムコ多糖症あるいはライソゾーム病の中で発達を評価する上でのスタンダードな質問票となっています。ご覧のとおり、5歳未満、あるいは5歳以上、10歳以上のいずれの年齢群におきましても、発達年齢の改善または維持が明確に認められていることが読み取れるかと思います。
また、強調したい点としまして、次に実施するグローバル第3相試験は、72ヶ月未満の患者さまのリクルートを考えております。用いる質問票は「Bayley-Ⅲ」で、こちらも主要評価項目の中に組み込んでおります。
ですので、この結果が将来の第3相試験の結果の1つの予想になる点でも重要だということを強調してお伝えしたいと思います。
JR-141 臨床試験(グローバル)①

ここからは、グローバル第3相試験の試験概要についてご説明します。実施予定国は米国、ブラジル、欧州(ドイツ、フランス、イギリス)となっております。
大きな特徴としましては、この試験は2つのコホートがあります。1つはNeuronopathic patientsを対象とした「CohortA」、もう1つはAttenuated patientsを対象とした「Cohort B」です。
トータルで50名の患者さまのリクルートを考えており、対象群も設定します。重要な点としては主要評価項目ですが、こちらは単一の主要評価項目を設定しておりません。脳脊髄液中ヘパラン硫酸の濃度と中枢神経症状の評価、また全身症状の評価といった複数の項目を評価していく予定です。
JR-141 臨床試験(グローバル)②
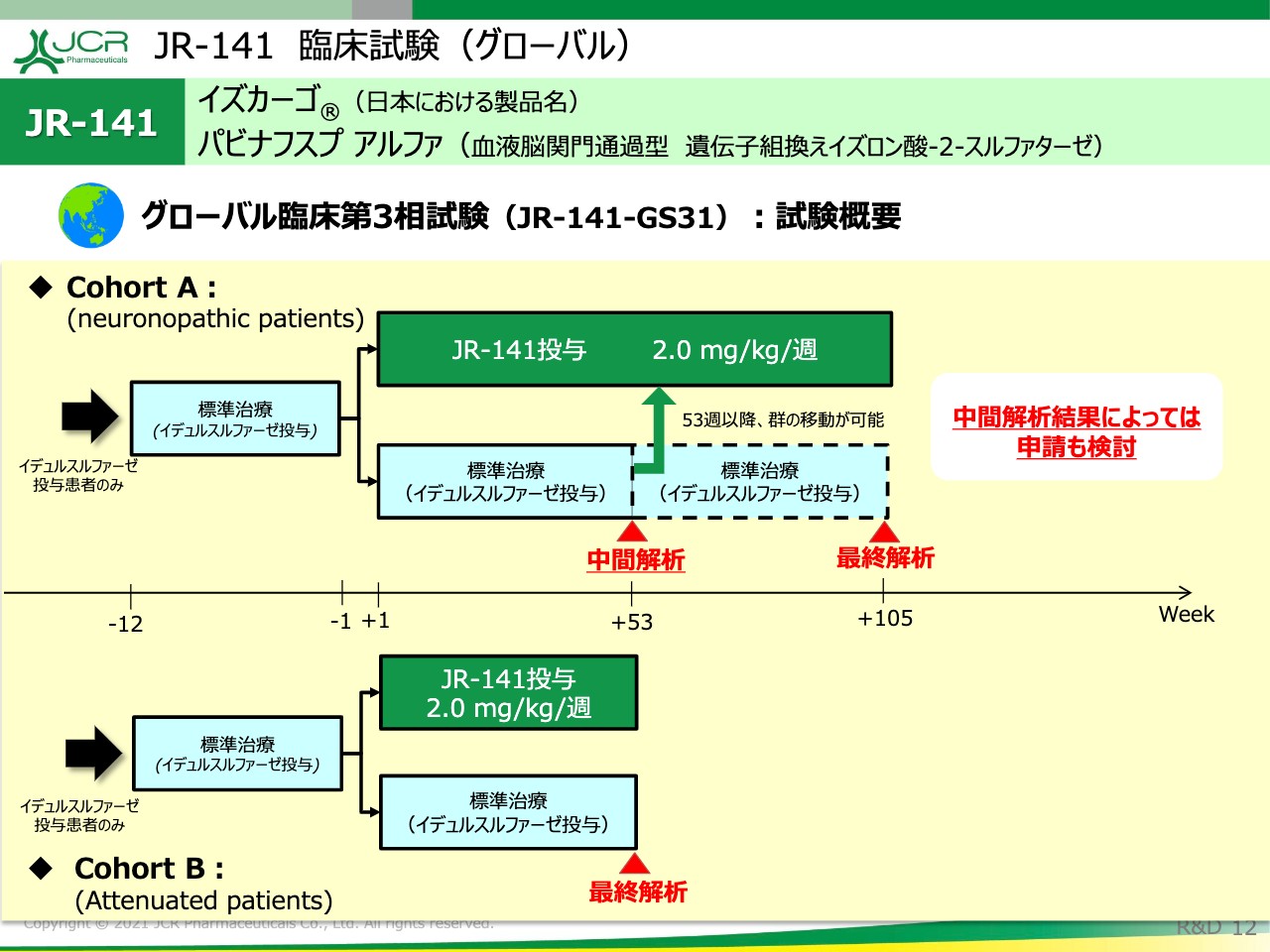
試験デザインをお示ししております。先ほどご説明したとおり、Cohort AはNeuronopathic patientsを対象として2年間の試験を予定しています。Cohort Bは軽症型の患者さまで、1年間の試験です。
いずれも中間解析を1年間のところで置いておりますので、先ほどご説明した主要評価項目を対象群と比較して検討することを、この中間解析の段階で実施します。その結果によっては申請も考えたいと思います。
JR-141 開発状況②

世界的な開発状況をお示ししております。先ほどお伝えしたとおり、日本は3月に製造販売承認を取得いたしました。また、5月には薬価収載を予定しております。
ブラジルに関しましては昨年12月に申請を行い、現在もANVISAとディスカッションを行っているところでございます。予定どおりに進めば、グローバル第3相試験はもうすぐ開始できると思います。
JR-171 開発状況①

「JR-171」の開発状況についてご説明します。「JR-171」はムコ多糖症Ⅰ型(ハーラー症候群)を対象とした治療薬でございます。今期にオーファンドラッグの指定も受けており、臨床第1/2相試験が順調に推移しておりますので、その内容についてご説明します。
JR-171 開発状況②
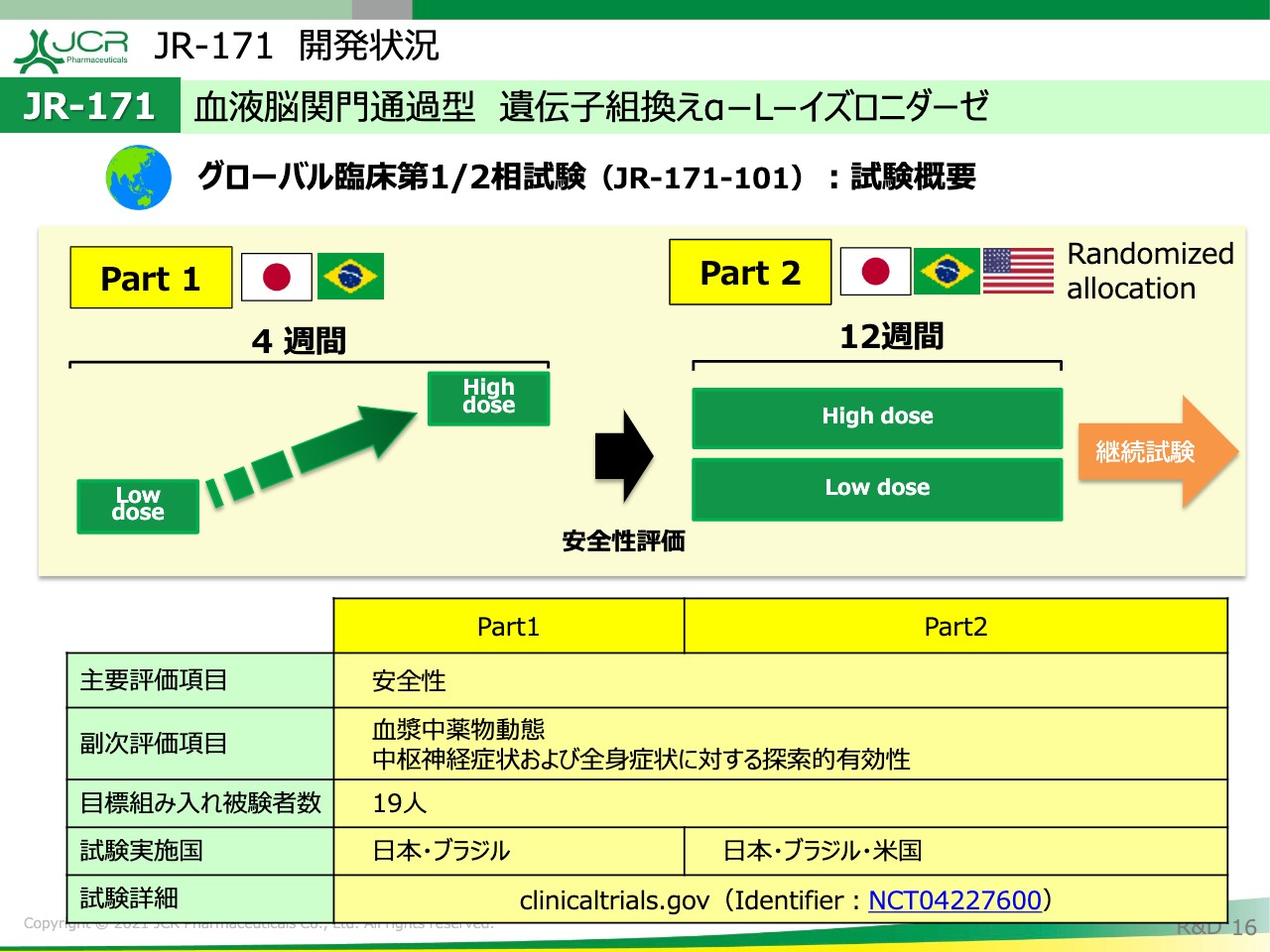
グローバル第1/2相試験の試験概要になります。Part1とPart2の2つに分かれており、Part1では用法用量の安全性の検討を行いまして、Part2でLow dose、High doseのより長期的な検討を行います。
PK/PDプロファイルなどをこの試験で確認してきました。すでにPart1が終わってヘパラン硫酸のデータが得られておりますので、次のスライドでご説明したいと思います。
JR-171 開発状況③
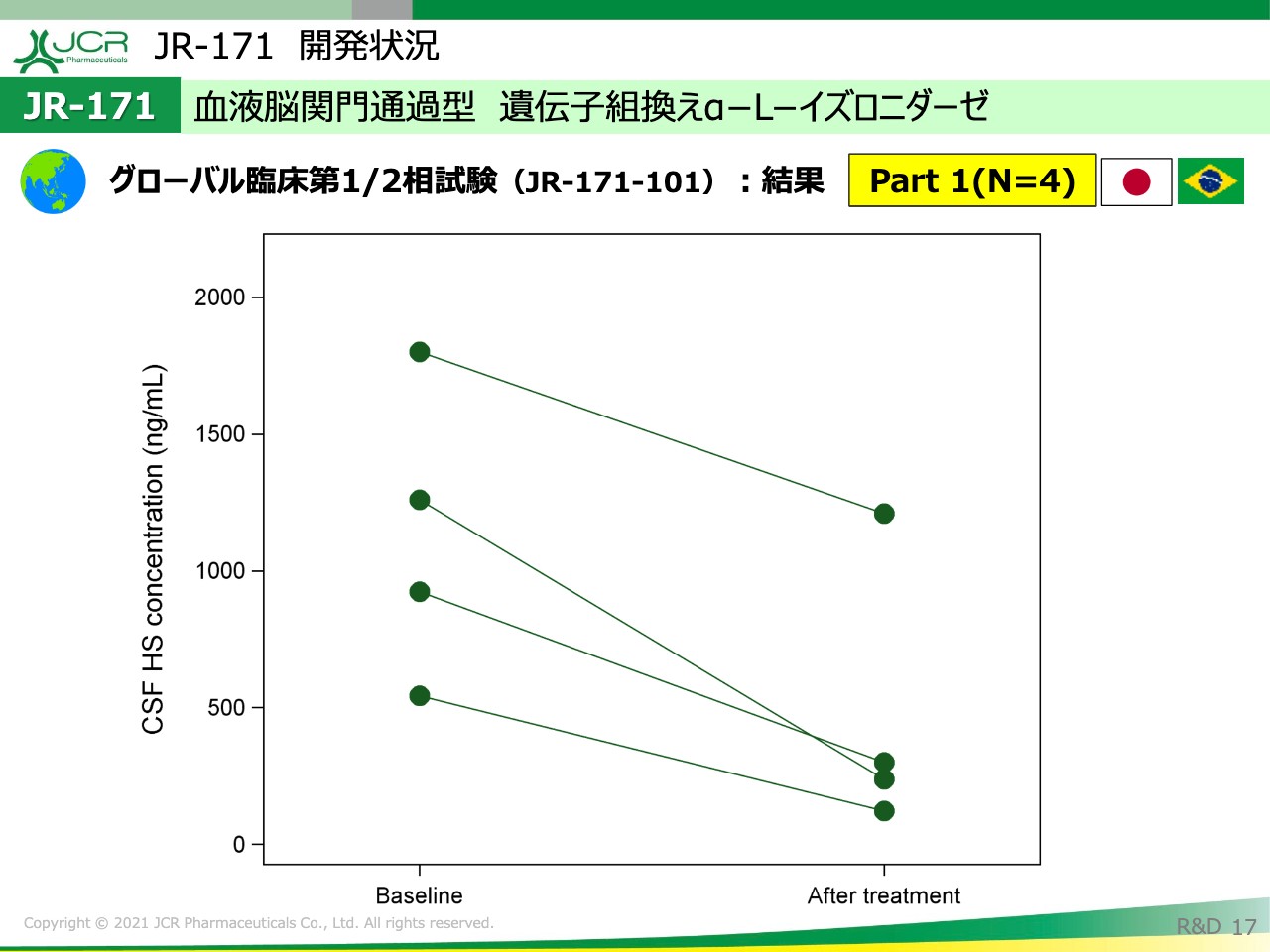
ご覧いただくとおわかりのとおり、4週間の検討の下で、ヘパラン硫酸の減少が全例で確認されました。平均で60パーセント以上の減少が確認されておりますので、我々が当初期待していた結果がこの試験で得られたと思います。
ですので、Part2ではより長期的なヘパラン硫酸の変化を見ていくなど、臨床的な有効性を検討することが必要になっていくと思います。
JR-142 臨床試験①

「JR-142」です。持続型の成長ホルモンの開発進捗についてご説明します。適応症は小児成長ホルモン分泌不全性低身長症ということで開発を進めております。技術は独自の改変型アルブミンを用いたものになりまして、こちらはJCR研究所で開発した技術となります。
すでに健康成人を対象とした第1相試験が終わっておりますので、その結果についてお話しします。第1相試験は安全性とPK/PDのプロファイルを見る試験になっておりますので、doseを上げていくフェーズと、4週間継続的に投与するフェーズに分かれております。
JR-142 臨床試験②
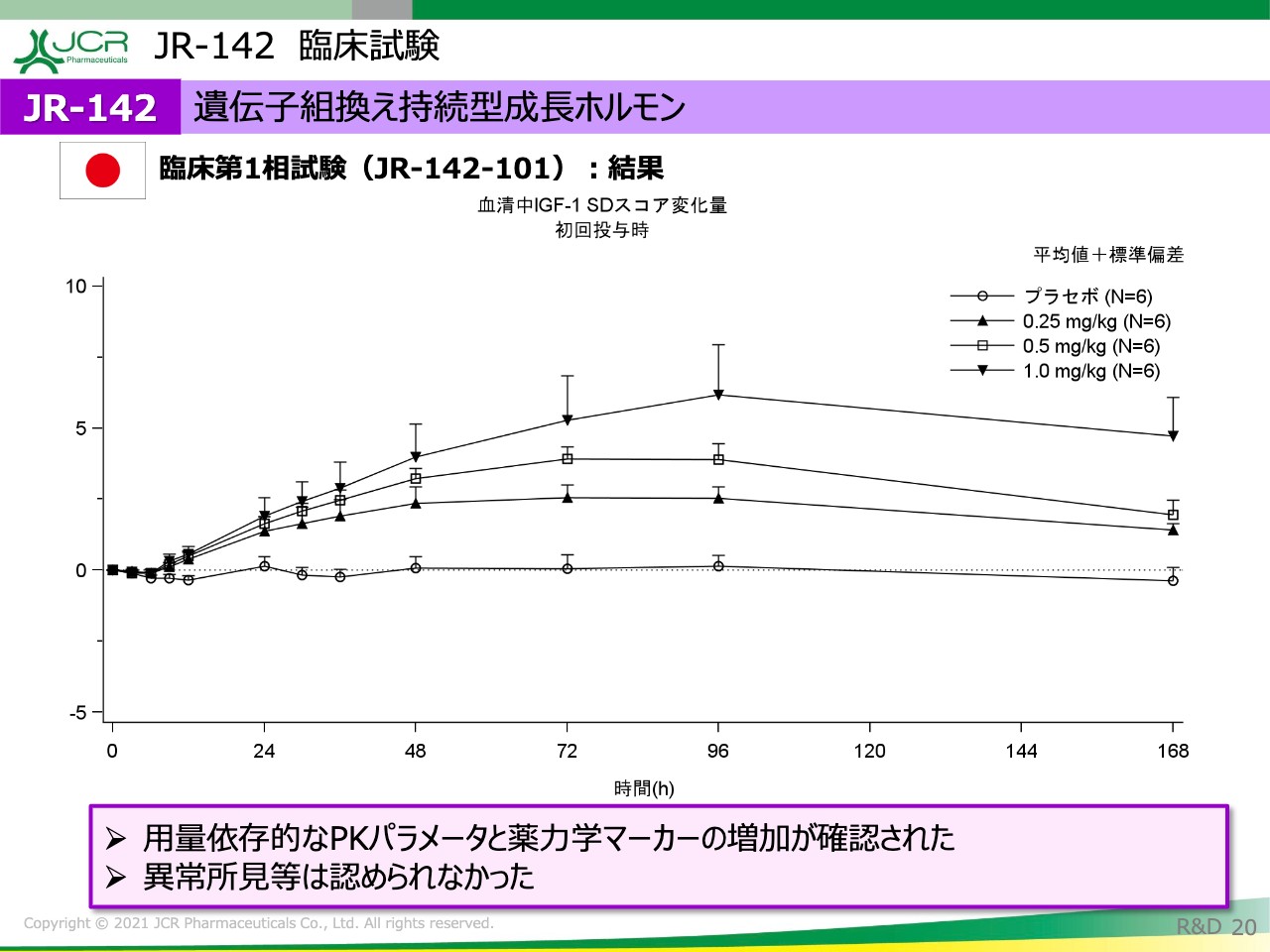
成長ホルモンの治療で非常に重要なポイントは、バイオマーカーである「IGF-1」の上昇です。「IGF-1」が上昇することによって、成長に対して寄与することがわかっております。ただ、「IGF-1」を上げていくことが一番重要ということではなくて、上がり過ぎることも少し気をつける必要があります。
治療方針としては、上がり過ぎず、下がり過ぎず、よいところでキープしていくことが非常に重要ですが、スライドのグラフをご覧いただくとおわかりのとおり、非常にきれいで用量依存的な「IGF-1」の増加が認められております。
1週間の結果を見ているのですが、次の試験で用法用量を検討するのに非常に十分なデータが得られたと考えています。この結果をもちまして、現在は患者さまを対象とした第2相試験の準備を進めているところです。
JR-142 臨床試験③

現在準備を進めております第2相試験の試験概要です。対象群として連日投与の「グロウジェクト」を設定し、長期作用型の治療には低用量と高用量の2群設定をしています。
5月に第1症例目の投与を予定しており、評価項目は身長ということになります。この剤に関しましては、非常に多くの先生方から期待されていますので、その契約の下で24名のリクルートを予定しております。
その他の開発パイプライン(ライソゾーム病)①
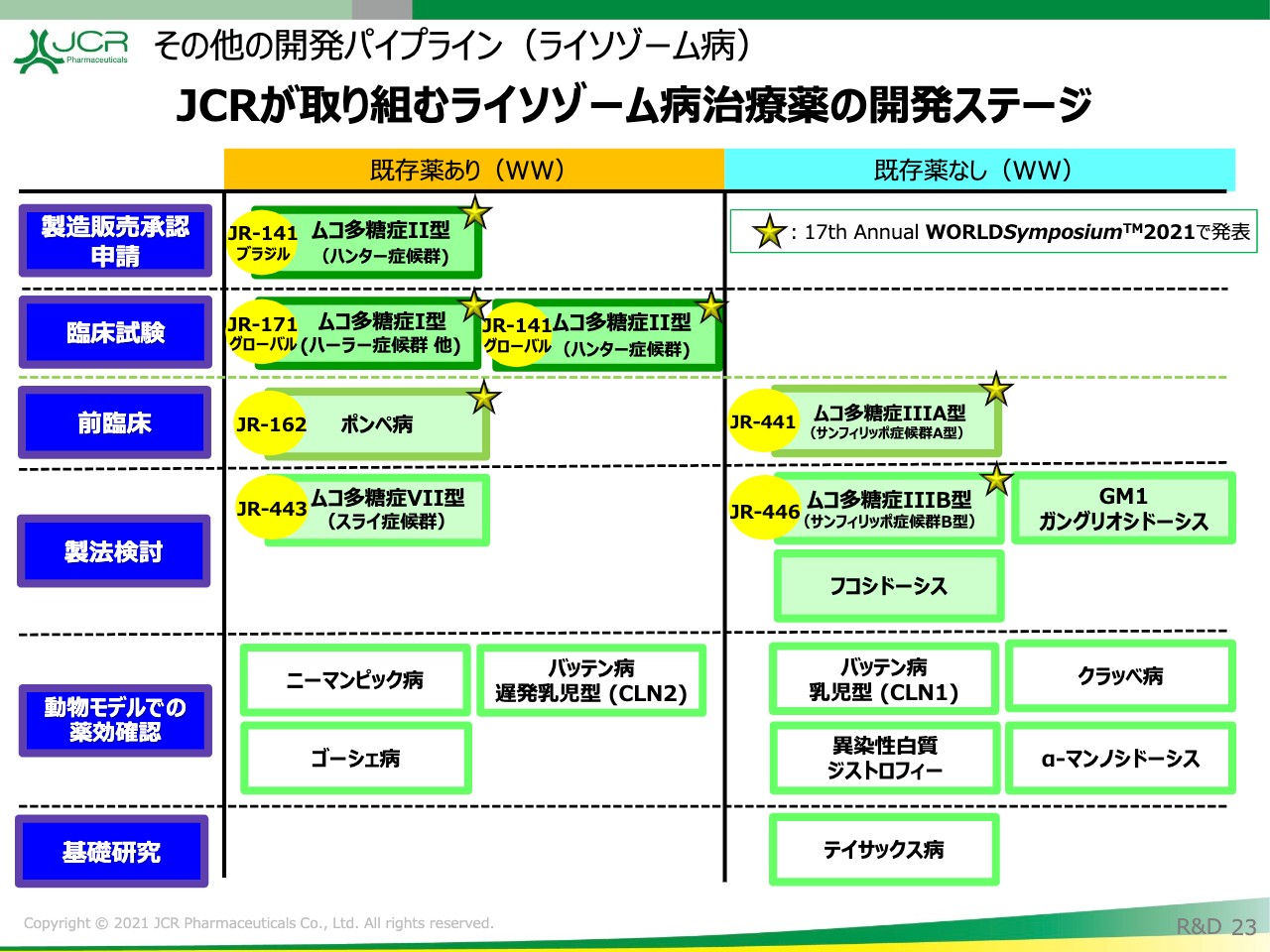
その他のライソゾーム病治療薬の開発についてお話しします。「JR-141」「JR-171」は順調に臨床のステージに進んでおります。次の品目としましては「JR-162」「JR-441」のⅢ型の治療薬ということになります。
ムコ多糖症Ⅶ型、Ⅲ型等、他の品目も控えておりますので、「JR-141」によって「J-Brain Cargo」の技術が確立されたという背景を踏まえ、開発を1日でも早く進めていきたいと考えております。
その他の開発パイプライン(ライソゾーム病)②

想定タイムラインを記載しておりますが、変更はございません。「JR-441」に関しましては、来年に臨床第1/2相試験の開始を目指しております。また「JR-162」「JR-443」「JR-446」に関しましても、2023年には臨床に入っていきたいと考えております。
その他の開発パイプライン(成長ホルモン領域、細胞治療・再生医療等製品)
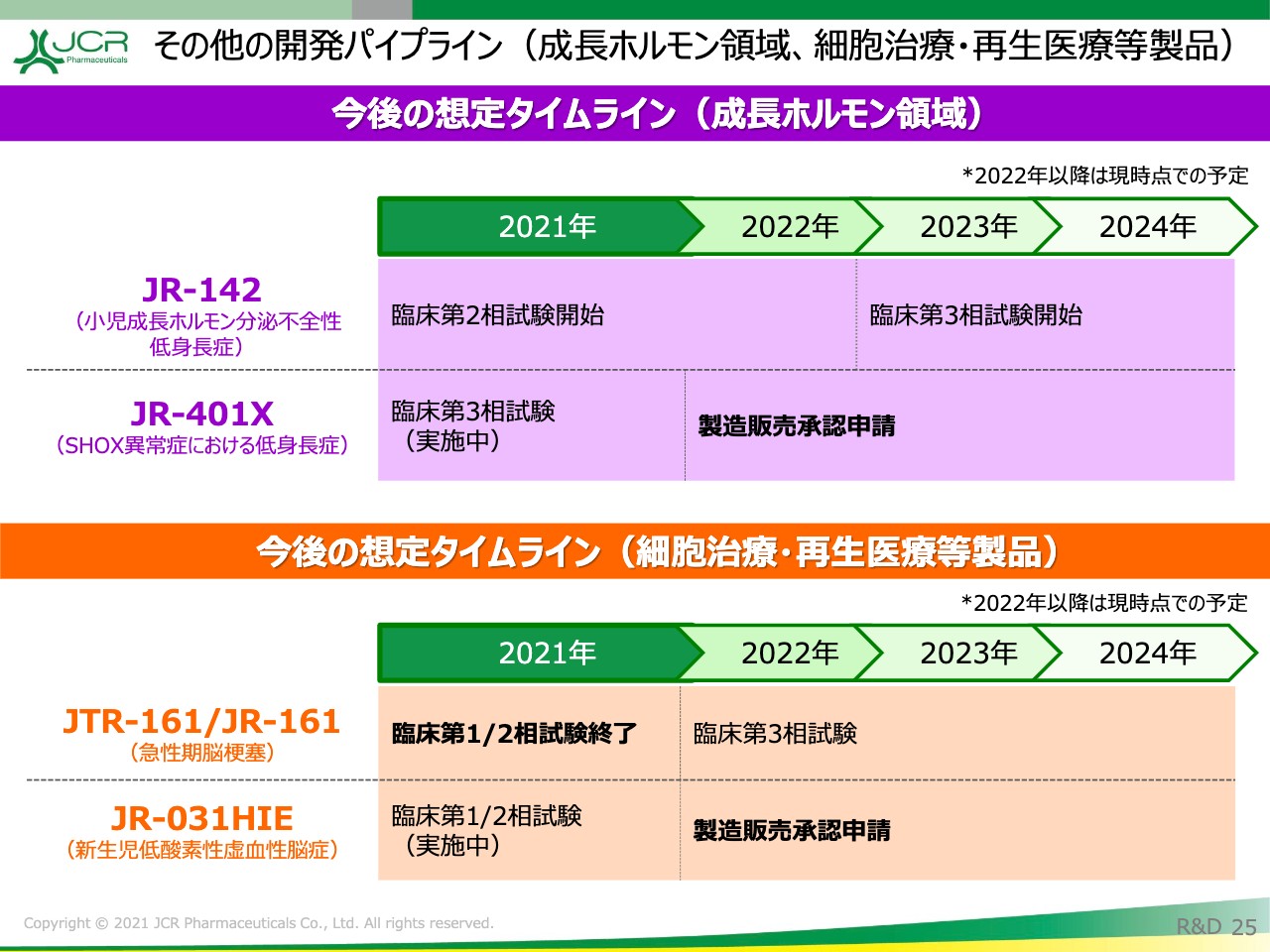
先ほどお伝えしたとおり、成長ホルモン関連につきましては「JR-142」が第2相試験に進捗しております。また、「グロウジェクト」の適用拡大のプロジェクトであるSHOX異常症を対象とした「JR-401X」に関しましては、すでに第3相試験のリクルートが終わり経過を観察しているところですので、試験が終了次第、製造販売承認申請を行う予定としております。
その他再生医療等製品につきましては、「JTR-161」が臨床第1/2相試験を本年に終了いたします。「JR-031HIE」につきましては、臨床第1/2相試験の終了とともに当局への申請の相談を進めていく予定としております。私からの説明は以上となります。ありがとうございました。
新着ログ
「医薬品」のログ





