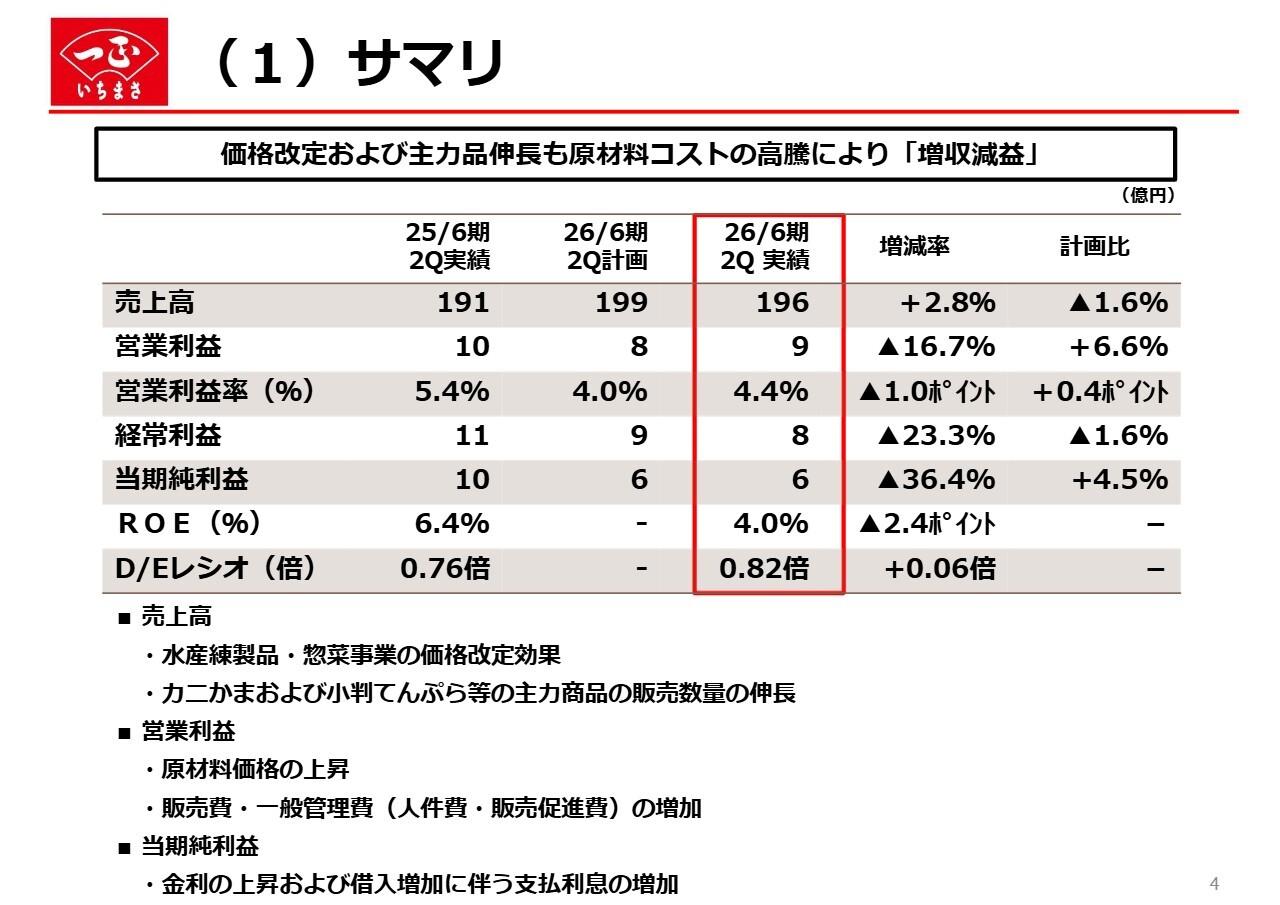
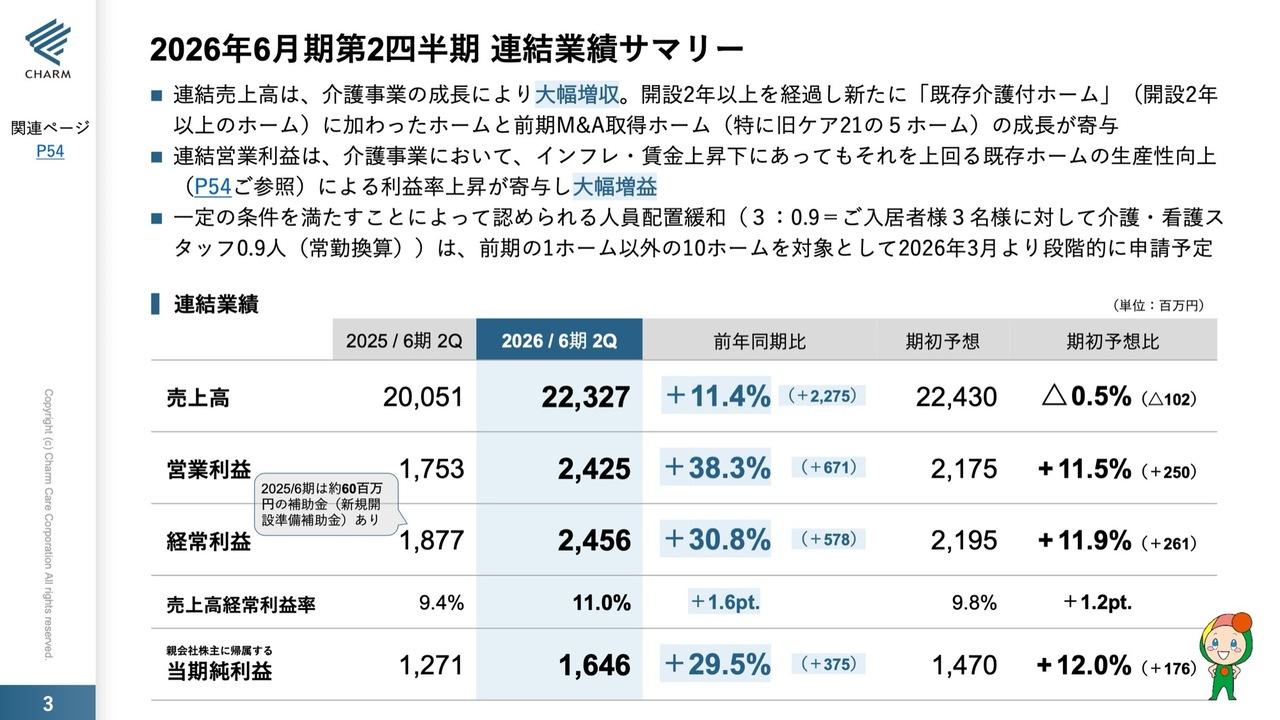
ヘリオス、通期は赤字拡大 「MultiStem®」の独占的ライセンス権拡大による追加コスト等が要因
ミッション/ビジョン/バリュー

鍵本忠尚氏:それではさっそくですが、2018年12月期決算説明を始めます。上場から約3年を経て、当社の社員も130名体制になり、組織のミッション、ガバナンス、そして戦略を新たにし、会社としても心新たに出発しようということで、ここ(スライド)にあらためてミッション、ビジョン、バリューを記載しています。
組織として非常に充実してきたという手応えがございまして、社員のモチベーション、またそれぞれの持ち場のガバナンスなど、いいかたちになってきたと考えています。
governance
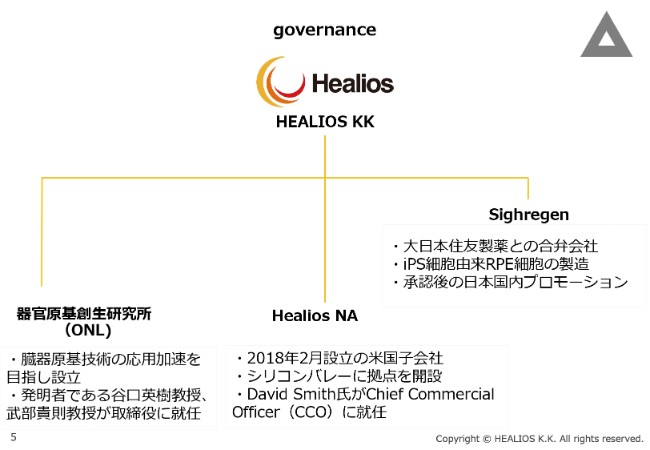
ガバナンスとしては、現在、関係会社が3つございます。株式会社サイレジェンは、大日本住友製薬さまとの合弁会社であり、iPS細胞由来RPE細胞の製造、および承認後の国内プロモーションを行う会社です。
また、(2018年2月に)北米にHealios NA, Inc.を設立いたしました。シリコンバレーに拠点を構え、David Smith氏がChief Commercial Officer(CCO)に就任し、北米での情報収集ならびにアライアンスを担当しています。
そして、当社がグローバルに独占的権利を持つ臓器原基技術の応用加速を目指し、(2018年6月に)器官原基創生研究所(ONL)を設立いたしました。発明者である谷口(英樹)教授、武部(貴則)教授が取締役に就任し、イノベーションを加速する体制を作ってまいりました。
事業戦略①
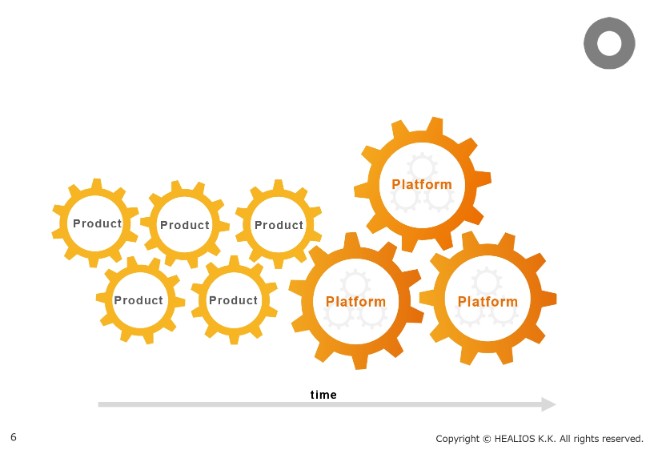
当社の事業戦略ですが、従来から、まずProduct(製品)を開発しながら、Platformに移行することを謳っています。その中で、具体的にどのようなProductを選び、どのようなPlatformを得ていくのかが重要です。
事業戦略②
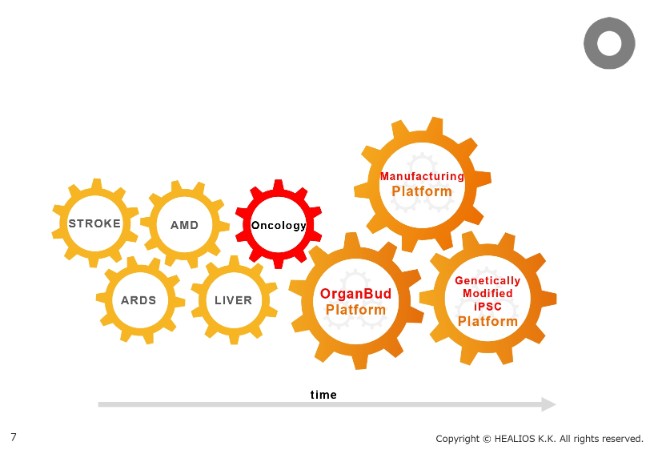
そこに関しては、従来、STROKE、AMD、ARDS、そして臓器原基を用いた肝臓(LIVER)がございましたが、そこにOncologyの領域を加えようと考えています。まだ具体的なパイプラインの発表はしていませんが、Oncology領域でのさまざまな研究活動が、とくに神戸の研究所で進んでいます。
Platformとしましては、何よりも製造(Manufacturing)です。細胞の領域は、製造ができないことにはものになりません。その製造のPlatformは、着実に準備が進んでいます。また、臓器原基(OrganBud)のPlatformとしての研究開発も、進んでいるところです。
最後に、おそらく最も重要なのが、遺伝学的に改変されたiPS細胞(Genetically Modified iPSC)です。現在、このPlatformが作られてきています。iPS細胞自身、さまざまな臨床へ進んでいますが、先進の研究は、iPS細胞の遺伝子をどのように改変して、さらに治療に好ましい性質を持ったiPS細胞に変えていくかということにすでにシフトしてきています。
当社が従来からアライアンスを通じて進めてきた、改変された免疫システムに見つからない細胞や、求められる機能を高めた細胞が、準備されているところです。
アサシス社の創製した幹細胞製品 MultiStem®

それでは、各論に入っていきたいと思います。上場後に当社がアサシス社から導入した「MultiStem®」は、骨髄由来の幹細胞で、特許取得済みです。
免疫抑制剤が不要、凍結保存が可能、一貫した安全性……すでに200名以上に投与されています。また、複数の薬理作用により細胞修復と治癒を促進、投与した細胞は体内から安全に消失。これらの特徴があります。
アサシス社との提携関係の深化

アサシス社との歴史を振り返りますと、まず2016年1月に、日本国内における脳梗塞急性期に対する治療法の開発・販売ライセンスを取得し、この分野への取り組みを開始しました。
2018年3月には、アサシス社への戦略的投資・提携強化の合意に至り、約21億円を投資し、同社の発行済株式数の8.7パーセントを取得し、単独では最大の筆頭株主となりました。
2018年6月に「MultiStem®」に関する複数の独占的ライセンスを取得し、同時に私がアサシス社の取締役に就任いたしました。そろそろ1年になりますが、アサシス社のボードの状況も、会社の状況も、よく勉強ができたと思っています。
昨年末(2018年末)には「MultiStem®」システムを用いた中国でのオプション権の交渉期間を延長しています。
MultiStemに関するライセンス保有状況
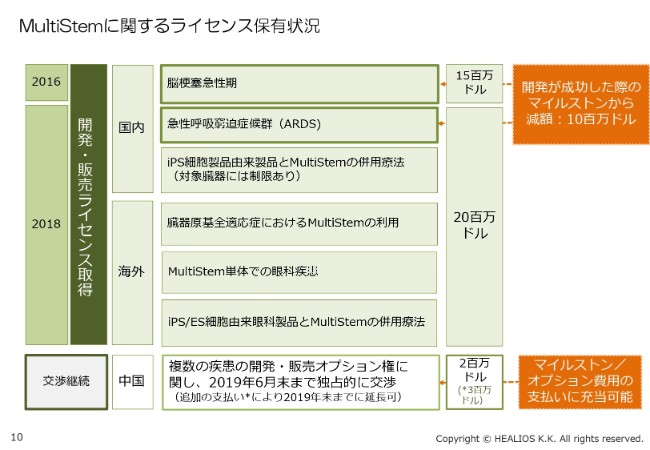
(「MultiStem®」に関するライセンス保有状況について)詳細をご説明します。(スライドの)一番上の「脳梗塞急性期」が最初のライセンスで、現在、国内での臨床治験が着々と進んでいます。
そして昨年、オプション権を行使したのがARDS(急性呼吸窮迫症候群)です。後ほどご紹介しますが、大変すばらしい臨床データが出てまいりました。また、iPS細胞と「MultiStem®」の併用療法。さらにグローバルで、臓器原基全適応症に「MultiStem®」を使えるという権利や、「MultiStem®」単体での眼科応用、iPS/ES細胞由来眼科製品と「MultiStem®」の併用療法……これらに約20億円を投資し、権利を拡大いたしました。
中国については、複数の疾患の開発・販売オプション権に関して、現在、交渉権を独占的に持っていますが、交渉権をまず(2019年)6月末まで伸ばし、さらに今年(2019年)の年末まで延長できるようにしています。いずれの支払いも、(スライドの)右側に書いてありますとおり、当社が開発に成功した際のマイルストン/オプション費用の支払いに充当できることになっています。
当社としては、脳梗塞とARDSの2製品を開発していますので、いずれにせよ払わなければならない現金であるので、先に支払いをして権利範囲を拡大するというように、戦略的に取り組んでいるところです。
アサシス社による二重盲検試験結果 <脳梗塞急性期>
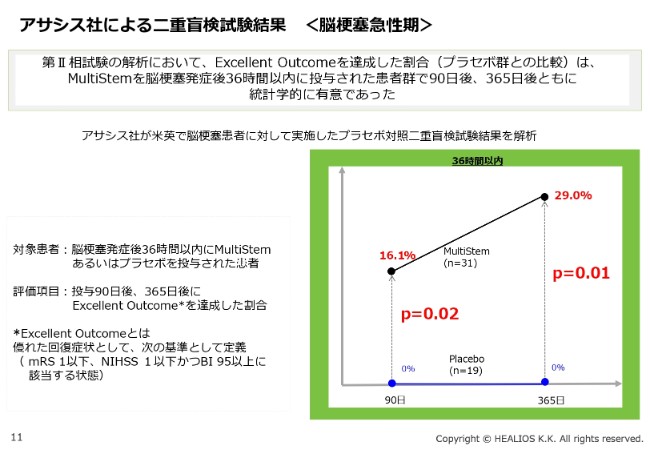
(スライドのグラフは)過去に米国でなされた脳梗塞患者に対する二重盲検試験、第Ⅱ層試験の結果です。こちらは、Excellent Outcomeを達成した割合で解析した結果ですが、非常に強い有意性がみられる結果となっています。
「90日」のところでは「P=0.02」ですが、1年(「365日」)のところでは「P=0.01」となります。昨今、いろいろな治験が行われていますが、脳梗塞の場合はどうしても、二重盲検試験をしないとわかりません。プラセボの方が反応するといったこともあります。医薬品開発の基本ですが、二重盲検試験の結果が一番信頼できます。
二次解析の結果で、非常にきれいな傾向が出ていますので、基本的にこのプロトコルに従い、現在、日本でも治験を進めているところです。従来から申し上げているとおり、約2年の治験ですので、来年(2020年)の頭に治験が終了する予定で、現在、順調に進んでいるところです。
アサシス社による二重盲検試験結果 <ARDS>

今回、我々が一番大きなニュースと考えてるのが、アサシス社が(米欧で)行った、ARDSに対する二重盲検試験の結果です。後ほどご説明しますが、当社のARDSの試験はオープン試験で、かつ、肺炎に起因するARDSの患者さんに限定しています。これは有効性を示しやすい(試験方法です)。
我々としましては、「3年で3本の承認を取る」という戦略の中、(日本国内では)固い治験をデザインし、着実に行っていきますが、正直に申しまして、米国では思った以上によい結果が得られました。
繰り返しになりますが、重要なのは二重盲検試験です。現在、第Ⅰ相試験、第Ⅱa相試験を行っていますが、第Ⅱa相が二重盲検試験にあたります。こちらは、患者さんは何を投与されたかわかりません。10名がプラセボ群、20名が薬(「MultiStem®」)を投与されたという試験でした。
ARDSという病気は非常に厳しい病気です。通常は、だいたい50パーセントから60パーセントの方が亡くなります。ひょっとすると、身近な方が肺炎で亡くなられたことがあるかもしれませんが、そういった方の中には、ARDSがかなり含まれています。原因はいろいろありますが、最期は肺炎で亡くなるという病気です。
こちらの試験の結果を申し上げますと、プラセボ群、要は薬を投与されない群では、40パーセントの方が亡くなりました。一方、「MultiStem®」の投与群では、25パーセントの方のみが亡くなったということで、死亡率が低くなっています。また、重症例で見ますと、プラセボに比べて半分ほどまで死亡率が下がるという傾向がみられました。
また、日本での治験のエンドポイントに設定していますが、「(投与後28日間のうち)人工呼吸器を使用しなかった日数」、要は「いかに早く人工呼吸器を外せたか」です。こちらは日数が長い方がよいのですが、プラセボ群では9.2日であったのに対して、(「MultiStem®」の投与群は)12.9日ということで、よい傾向がみられます。
そして、「(投与後28日間のうち)ICUにいる必要がなかった日数」、要は、「どれくらい早く(ICUを)出られたか」ということですが、こちらを見ますと、「MultiStem®」の投与群で改善がみられました。当社としては、この結果をベースに(日本での)臨床試験を行い、着実に承認まで持っていきたいと考えています。
パイプライン
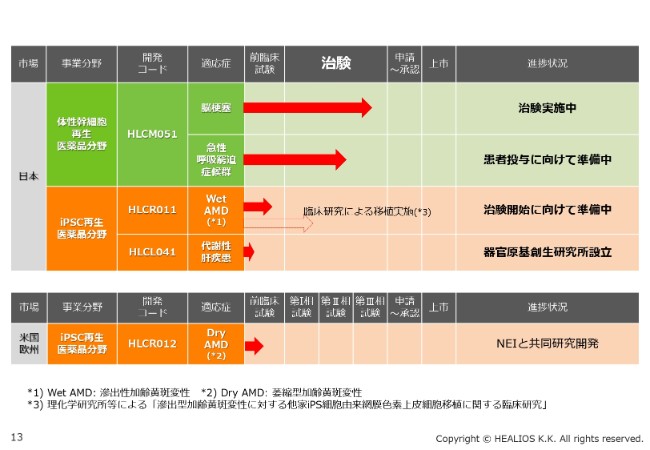
パイプラインの全容は、ここ(スライド)に書いてあるとおりです。脳梗塞では、淡々とエンロールメント、組入れが進んでいます。ARDSは、今回、非常によいデータが出ました。オープン試験での患者さんへの投与が、そろそろ始まると考えています。
創業のコアであるiPS領域では、WetタイプAMDに対する治験の準備も進んでいます。代謝性肝疾患も、臨床研究に向けて、現在は前臨床試験を行っているところです。
HLCM051 現状の日本の脳梗塞急性期治療について
それでは、少し具体的なところを、簡単にご説明いたします。まず、脳梗塞とManufacturing Platformです。
そもそも論ではありますが、我々が間葉系幹細胞の世界に進出した理由の1つに「iPS細胞の領域をやるにしても、細胞の大量培養技術がいる。それを学ぶためには、先んじて進んでいる、間葉系幹細胞の大量培養技術を学ぶべきであろう」という考えがありました。
実際、このHLCM051も、細胞を大量に投与します。そのような中で、二次元培養にしても、三次元培養にしても、細胞を大量に培養する、非常に高度な技術を学んでいるところです。
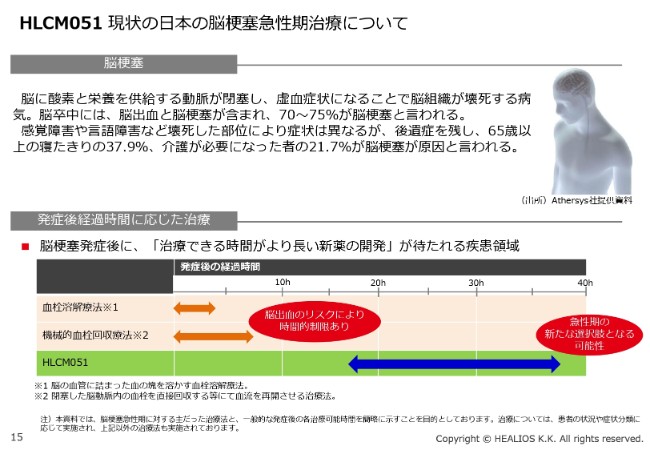
現在の治療法は、t-PA(血栓溶解療法)や機械的血栓回収療法などがありますが、いずれも(発症後の経過時間が)4.5時間あるいは8.5時間(以内)の治療法です。現在、当社が開発しているものは、(発症後の経過時間が)約18時間から36時間の間に点滴で静注するという、これまでにない治療法を提供できます。
HLCM051 脳梗塞の年間発症患者数
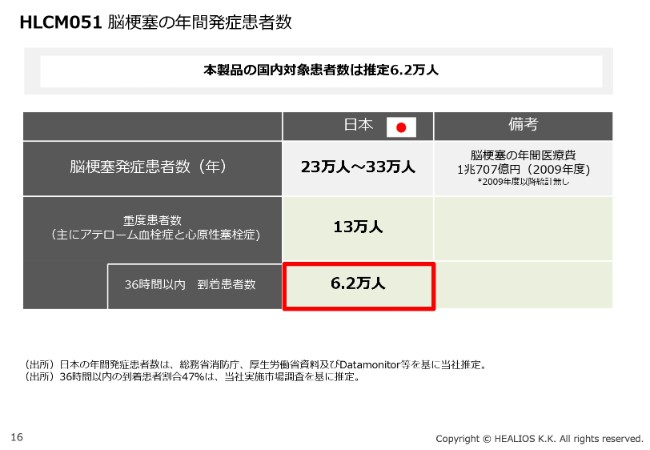
(本製品の国内)対象患者さんは、36時間以内に到着する方、かつ我々が治験を実施している(重症)患者さんに限定した場合でも、年間6万2,000人いらっしゃいます。非常に大きなボリュームがあると考えています。
HLCM051 想定メカニズム
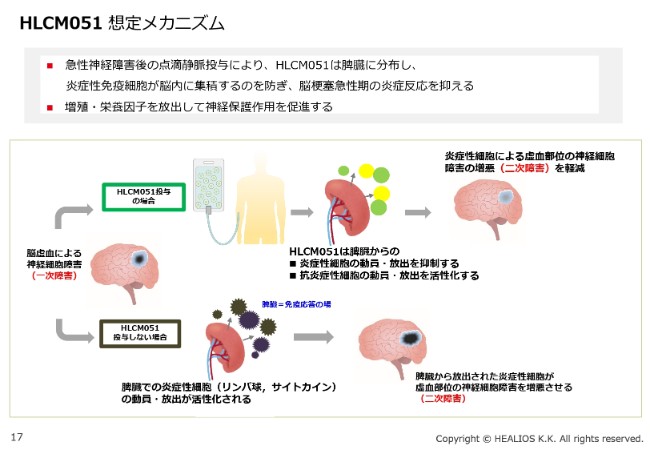
薬理の想定メカニズムですが、必ずしも脳にいって治すということではなく、免疫のモジュレーションです。一次災害と二次災害という言葉があるように、脳梗塞のそもそもの一次障害は、血流が途絶えることで起こります。ただ、一次障害は思ったほど大きくないことが多いです。
問題は、血流が途絶えて細胞が死ぬと、その死んだ細胞がサイトカインを出して、身体全体から免疫細胞を呼んできます。すると、本来はダメージを受けないで済む、サイトカインで汚染された周りの細胞が攻撃されて、さらに災害が広がります。これを二次障害といいます。この二次障害が大きくなることによって、実際の臨床的なダメージが広がっていきます。
「MultiStem®」の投与によって、細胞は脾臓に集積します。少し細かい話になりますが、動物モデルなどで見ますと、脳梗塞になった豚の脾臓は、量・重さが非常に減ります。それは、(脾臓の)中の免疫細胞がぐっと絞り出されて、脳にいってしまうからです。
これに対し、「MultiStem®」を投与することによって、脾臓の大きさが変わらないということがわかっています。同じようなメカニズムで、臨床的な効果が得られると考えています。
臨床的効果に関しては、米国の第Ⅱ層試験で明確な傾向がみられていますが、日本において、同じ結果が得られるかどうか……プロトコルを多少変えているところもあり、現在、そこを試しています。
HLCM051 治験概況
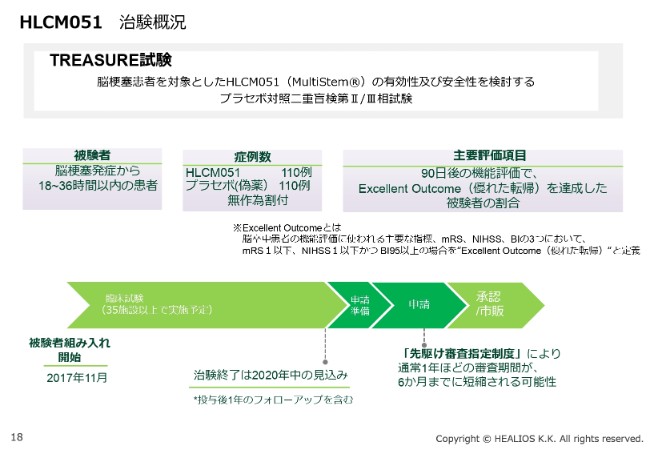
現在の治験ですが、先ほどお示しした(脳梗塞発症後の経過時間が)18~36時間(以内の患者)に対して、二重盲検試験を行っています。(HLCM051投与)110名対(プラセボ投与)110名です。
110名対110名と、比較的大きな試験にしていることには、理由があります。医薬品のように、有意性がしっかりとつくような試験をやるべきであると(考えているからです)。
数字を増やすことによりサブセットの解析も可能になりますし、どの患者さんが反応しているかが、よりわかりやすくなります。統計学的有意性が出しやすく、かつサブセット解析がしやすいということで、治験の規模を大きくしました。
主要評価項目は、90日後の機能評価で、Excellent Outcomeをエンドポイントにしています。こちらは「先駆け審査指定」をいただきましたので、通常は申請から1年かかる承認が、約6ヶ月まで短くなることがメリットです。スケジュールは従来どおりです。
HLCM051 製造体制
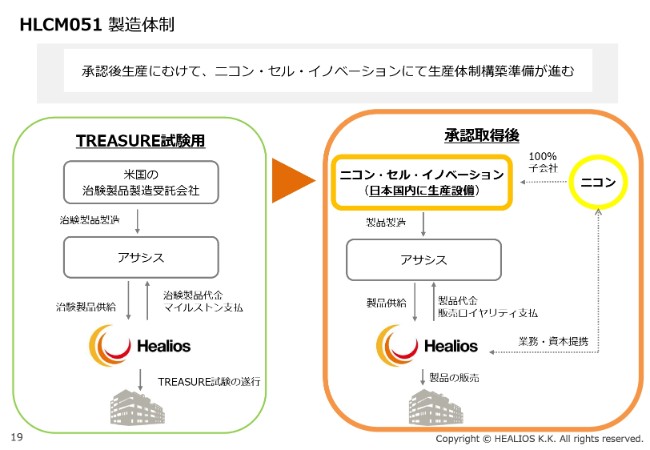
製造体制です。いまの治験薬は、アサシス社が米国のCMOに委託したものを、当社が使っているところですが、承認後はニコンさまの100パーセント子会社であるニコン・セル・イノベーションさまにて国内製造をする予定で、技術移転などを進めています。
救急に使うものであること、かなりの量の細胞がいること、そして生き死にに関わる病気であることなどを考えますと、国内にバリューチェーンを築くことが重要であると思い、このような体制をとっています。
HLCM051 ARDS 治験デザイン

次に、ARDSです。先ほど、米国で非常によい結果が出たという話をさせていただきました。そこで説明させていただいたとおり、日本では非常に固い治験のデザインをしています。
固い治験のデザインとは、なるべく患者さんが反応し、わかりやすい明確な結果が出ることを目的にしています。また、この病気の特性上、二重盲検試験にできない理由がいくつかあり、結果としてオープン試験になりました。非盲検で、標準治療との対照となります。
(被験者は)肺炎を原因疾患とするARDSの患者さんです。患者さんは30名で、(「MultiStem®」)投与群が20名、標準治療が10名というサイズになります。治験の実施期間は約2年間を想定しています。
そして、ここが重要ですが、エンドポイントは「投与後28日のうち人工呼吸器を装着しなかった日数」です。死亡率でなく、「人工呼吸器をどれくらい付けていたか」「どれくらい早く抜けたか」をエンドポイントにしますので、比較的結果がはっきり出やすいデザインになっているのではないかと思います。早ければ、2019年上半期より、患者投与が開始される見込みです。
HLCM051 ARDS 年間発症数
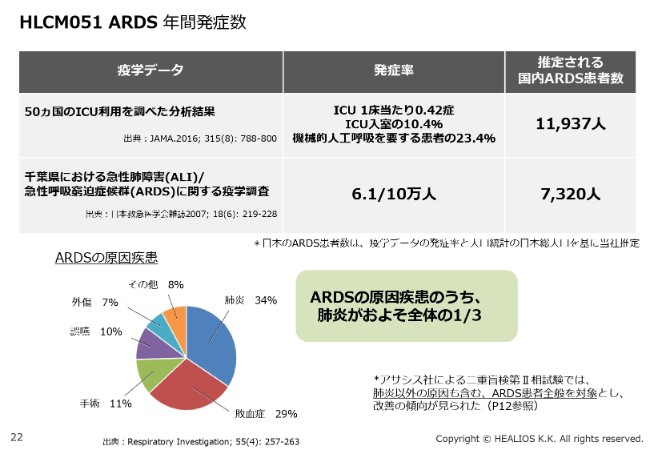
(ARDSの)患者さんの数ですが、いろいろな統計がございます。DPC上の数字は、ここ(スライド)の「疫学データ」にあるとおり、ざっくりいって、年間1万人程度というイメージです。
今回、治験をしている対象は、ARDSのうち肺炎を起因とするものですので、全体の約3分の1です。ここで、強調させていただきたいことが1点ございます。アサシス社で出た二重盲検試験の結果は、肺炎以外の患者さんも含む、(ARDS)全体の患者さんです。
二重盲検試験で改善の傾向がみられましたので、最終的な適応は肺炎に限られないのかなとも思います。ただ、ここは今回のデザイン上、承認後かもしれませんが、適応拡大が必要になるところかと考えています。
HLCM051 ARDS 急性呼吸窮迫症候群(ARDS)とは

ARDSは、いろいろな原因で起こる病気です。先ほど、脳梗塞の説明でサイトカインという言葉を使わせていただきましたが、(ARDSも)同じように、重症肺炎や敗血症、または大量に輸血をした際、あるいは骨折や外傷など、いろいろなことでサイトカインが出たときに、最後は肺に溜まります。
HLCM051 ARDS 治療法の想定メカニズム
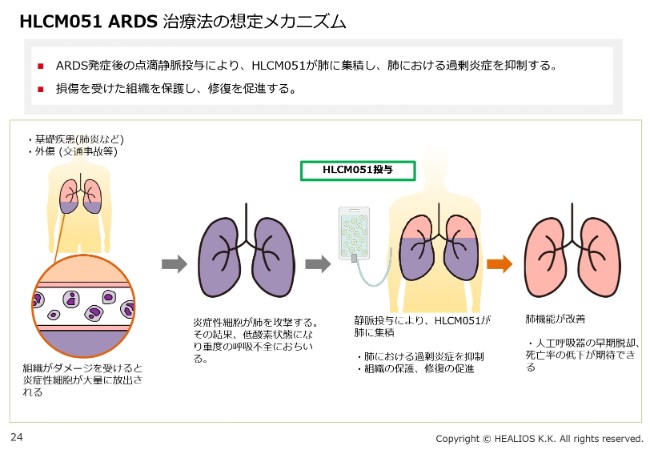
なぜ肺かといいますと、肺は、コーヒーフィルターのようにろ過をする、非常に細かい毛細血管がある組織です。また、ボリュームも大きいので、体のどこかでサイトカインができると、肺に引っかかります。その結果、肺にサイトカインが増え、体の免疫細胞が、肺にばい菌が入ってきたと勘違いして、肺を攻撃し始めます。これがARDSのもともとの原因です。
脳梗塞の二次障害を抑えるのと同じ理由で、「MultiStem®」を投与することによって、この勘違いで起きている現象を抑えます。これにより、ARDSの臨床症状がよくなると考えています。これがメカニズムです。
HLCR011 AMD 病態説明
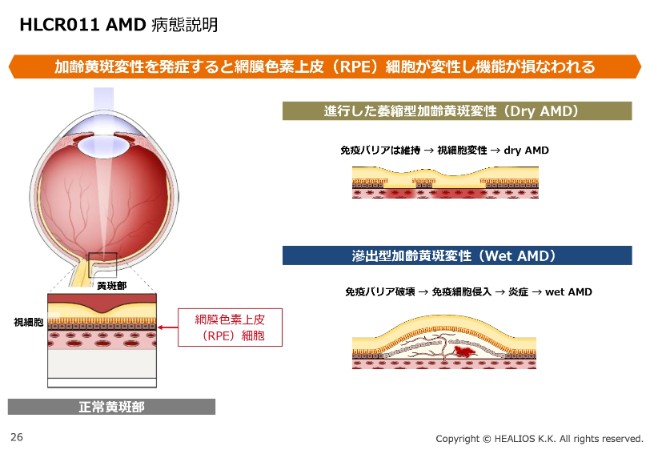
続きまして、AMDです。こちらも創業からのパイプラインです。病気の説明は割愛させていただきますが、みなさま、臨床試験開始をいまかいまかと待ち望まれているのではないかと思います。
HLCR011 AMD WetAMDに対する現在の治療法の課題
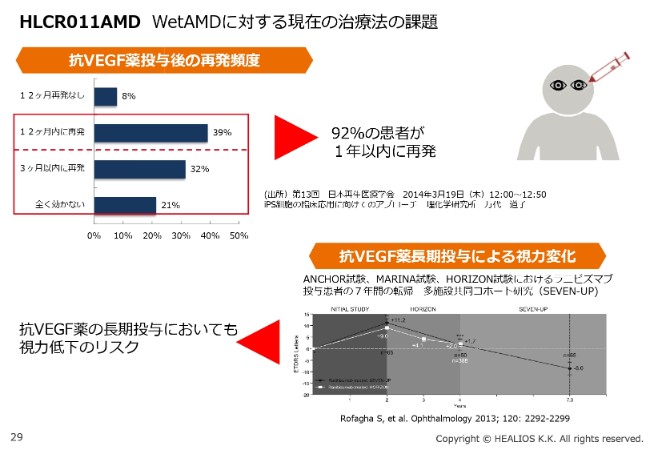
抗VEGF薬は、頻回投与が必要です。このため、有効性としては、投与回数をなるべく減らせるところにあると考えています。
HLCR011 AMD iPS細胞由来RPE細胞製品投与による視力推移のイメージ
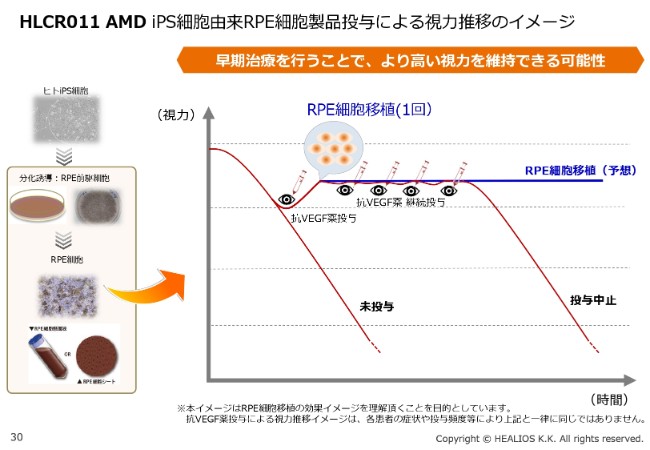
過去の患者さんのデータでも、公表ベースでこの4~5年近く、追加投与が必要でなかったということもいわれています。
こちらに関しては、現在、合弁会社である株式会社サイレジェンで、治験に向けた製造、およびその後の商用の製造を行っており、治験開始に向けた準備を淡々と進めているところです。
HLCL041 LIVER OrganBud Platform①
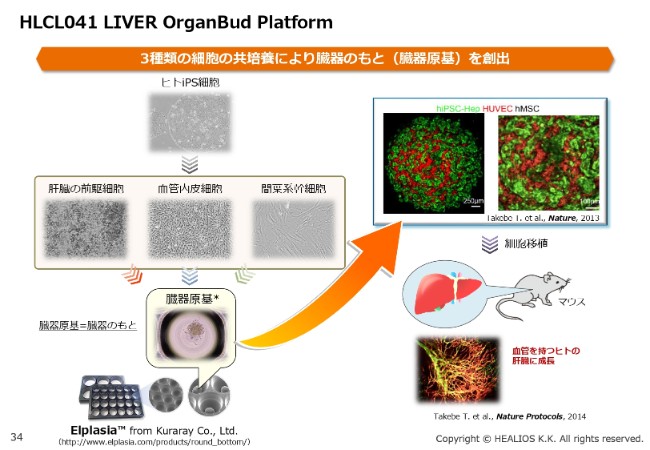
続きまして、肝臓に説明を移したいと思います。LIVER OrganBudは、さまざまな臓器の種となるものを作ることができます。
先ほどご説明した「MultiStem®」ですが、このOrganBudに関しては、あらゆる適応に使える権利を確保いたしました。(スライドの写真の)一番右側の間葉系幹細胞は、すでにGMPレベルで確保が終わりました。
また、肝臓の前駆細胞・血管内皮細胞に関しては、準備を進めているところです。こちらもある一定の段階で、臨床戦略を明確にお示しできればと思っています。
HLCL041 LIVER OrganBud Platform 肝不全モデルマウスにおける生存率
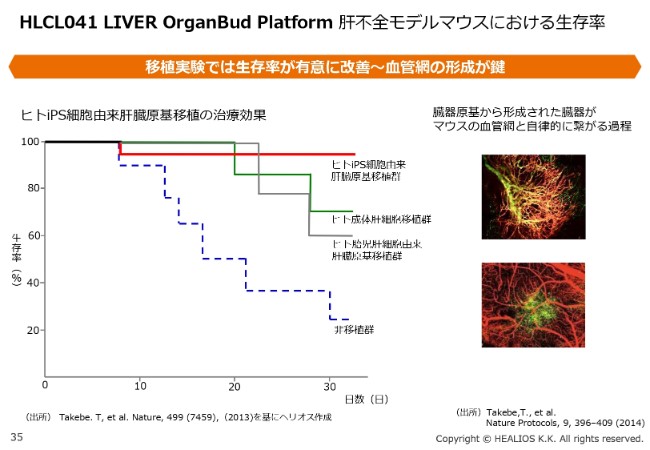
OrganBudの投与では、血管網がしっかり再生されて臓器ができます。これにより、他の単一種の細胞投与と比べ、はるかに長い間生着し、機能が保たれるという特徴があります。
HLCL041 LIVER OrganBud Platform 肝臓移植の代替治療の可能性
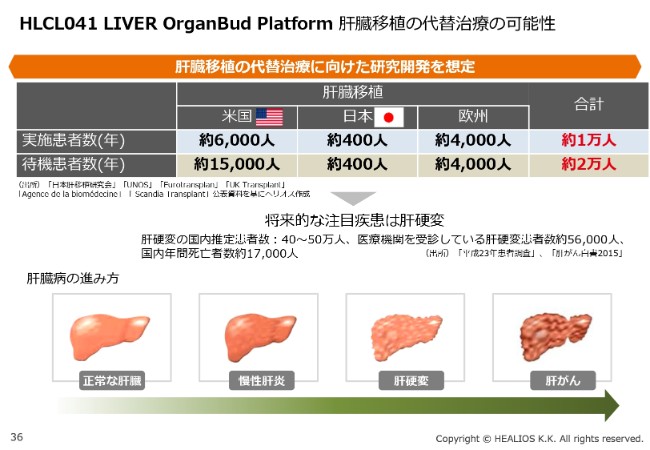
対象疾患としては、肝移植を待っている患者さんや、肝硬変に代表される代謝性異常疾患を対象に考えています。
HLCL041 LIVER OrganBud Platform②
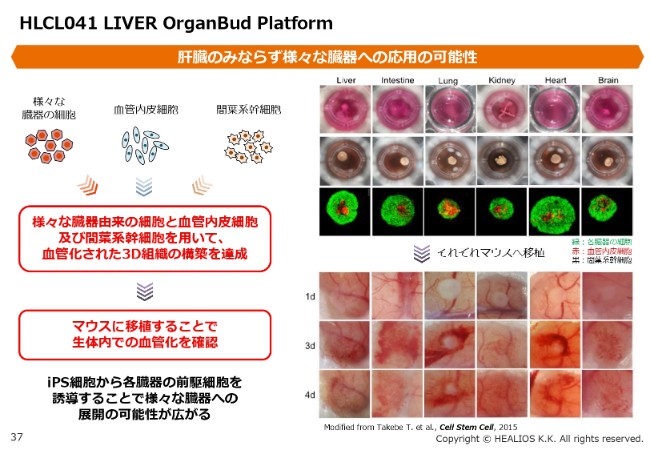
(2018年6月に)子会社として器官原基創生研究所(ONL)を設立しまして、谷口(英樹)教授、武部(貴則)教授が取締役に入られています。その新しい体制の中で、グローバルに見て、「どの疾患を、どのように進めるのがいいのか」あるいは「どのようなパートナーと進めるのがいいのか」など、戦略を再度練り直しているところです。近い時期に、新たな戦略やグローバルの開発方針をご紹介できればと考えています。
プラットフォーム技術としては、非常におもしろい技術でして……ここ(スライド)に書いてあるとおりですが、肝臓・腸・肺・腎臓・心臓・脳といった組織を臓器として作り、そして血管網を作ることができるという、非常にユニークな技術です。
損益計算書の概要
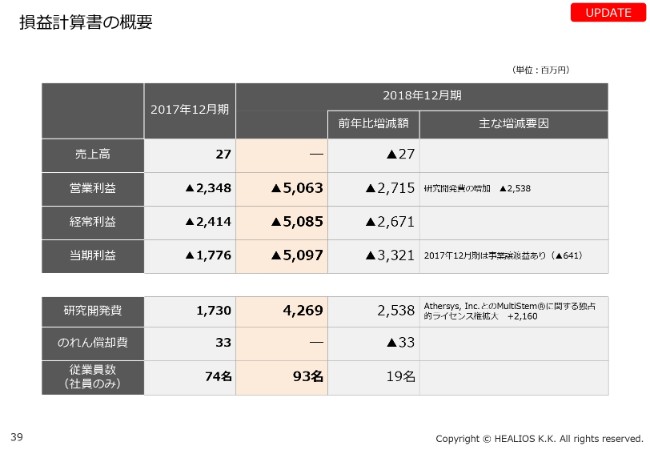
続きまして、決算概況に入りたいと思います。今期は、約50億円の赤字となっています。内訳としては、アサシス社への「MultiStem®」の(独占的)ライセンス権拡大により追加コストが発生しています。
貸借対照表の概要
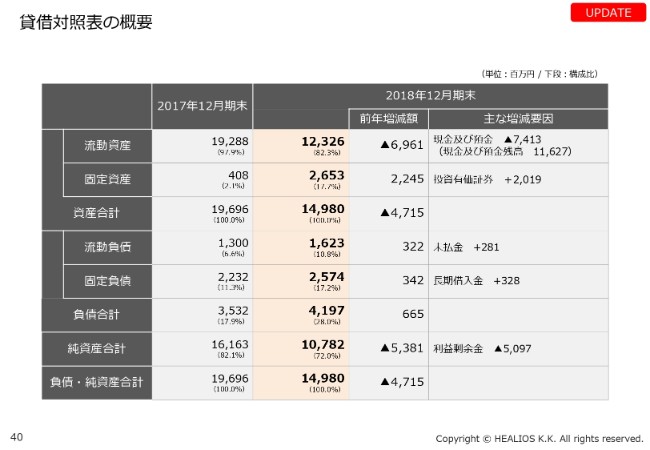
アサシス社へのライセンス権の拡大やオプション権の行使に加え、(投資)有価証券で、アサシス社の株式を8.7パーセント取得するために、約20億円使われています。この分は、固定資産に入っています。
現在、流動資産としては、ここ(スライド)に書いてあるとおり、足元の現預金はしっかりとありますので、治験の完了に向けて、事業を確実に進めていきたいと考えています。以上、ざっくりですが、当社の事業を説明させていただきました。
創業からずっと見ますと、みなさまのご支援のおかげもありまして、上場後、「3年(以内に)3本(の承認をとる)」というパイプラインも充実し、とくにARDSに関しては、直近で非常によい二重盲検試験の結果が出てきました。この治療法も含めて、なんとか3年で3本の製品を出し、1日も早く製薬企業としての体制に移行するということを、引き続き実行していきたいと考えています。
以上でございます。ご清聴、ありがとうございました。
新着ログ
「医薬品」のログ