株式会社メディネット 2018年9月期決算説明会
メディネット、通期は減収減益 再生医療等製品のパイプライン拡充・早期収益化を図る
2018年9⽉期 トピックス①

鈴木邦彦氏(以下、鈴木):決算説明会を始めたいと思います。みなさま、本日はお忙しいところどうもありがとうございます。それではさっそく、私から2018年9月期のトピックスについて、まずはご報告したいと思います。
まず、第1四半期でございます。一番のトピックスと申しますと、昨年(2017年)の11月22日、アメリカのヒストジェニックス社と自己培養軟骨「NeoCart®」のライセンス契約を締結いたしまして、日本での臨床開発・製品化を目指すということで、会社の方針を明確にさせていただきました。
2018年9⽉期 トピックス②

それから、第2四半期でございます。
第2四半期におきましては、(2018年)3月22日でございますけれども、こちらは今度は第2の製品化の取り組みでございます。独立行政法人国立病院機構と成人T細胞白血病……九州や西日本で比較的多い病気と聞いておりますけれども、こちらを対象にした樹状細胞ワクチンの再生医療等製品としての製造販売承認(取得)を目指すための、共同開発契約を締結しました。
先ほどのヒストジェニックスの「NeoCart®」、それからこちらの国立病院機構とのこの2つの中身の詳細については、後ほど研究開発本部長の池田から、詳しくまたご説明させていただきたいと思っております。
2018年9⽉期 トピックス③

それから、第3四半期でございます。
こちらのトピックスとしましては、すでにみなさまもご承知のとおり、私どもは市場環境等によって、売上等でなかなか厳しい環境が続いておりました。そこで、そのままただただ座してというわけにもまいりません。ということで、(2018年)4月27日に「ACCEPT2021」という名前の構造改革を決定しまして、それに着手いたしました。
これについては、また後ほど追加でご説明申し上げたいと思うのですけれども、そういった環境に合わせて、新たな我々の体質を筋肉体質に変えていくということ。それから、新しい需要環境に合わせた構造改革に取り組みをしております。
2018年9⽉期 トピックス④

それから、第4四半期でございます。
こちらは、(2018年)9月に2つほどご報告しました。1つは、ヒストジェニックス社が米国での第Ⅲ相臨床試験のトップラインデータを発表し、さらにそれに関してその後のFDAとの協議を開始しているということです。この2つについても、また後ほど池田から話があると思います。
以上私から、まずは2018年9月期のいくつかのトピックスで、みなさまにご報告したい点をご説明申し上げました。
それでは続きまして、2018年9月期の通期業績と2019年9月期の通期業績予想について、経営管理部長の落合からご報告したいと思います。よろしくお願いします。
業績ハイライト
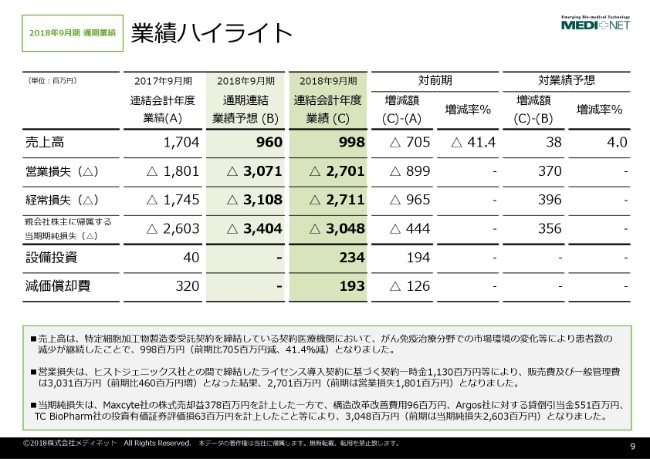
落合雅三氏:メディネット経営管理部の落合と申します。私から2018年9月期通期業績、それから2019年9月期通期業績予想についてご説明をさせていただきます。
2018年9月期の業績ハイライトでございますけれども、(C)という列をご覧いただければと思います。売上高は9億9,800万円、営業損失は27億100万円、経常損失は27億1,100万円、当期純損失は30億4,800万円という結果でございました。
前年度につきましては、2017年9月期の業績が(A)というところでございます。それから、(2018年)4月27日に開示をさせていただきました業績予想につきましては、(B)というところをご覧いただければと思います。
2018年9月期の売上高につきましては、私どもが主力にしております、がん免疫細胞治療の治療に用いる細胞の培養というものの、がん免疫細胞治療の市場環境が大きく変化して、患者数が大幅に減少したことを受けて、4割を超える売上の減少に繋がっております。
営業損失につきましては、売上高の減少に伴う利益の減少に加えて、ヒストジェニックス社に対するライセンス契約一時金で11億3,000万円を計上した結果、27億100万円の営業損失という結果でございます。
当期純損失につきましては、保有しておりましたアメリカMaxcyte社の株式を売却した一方で、構造改革の費用、それからArgos社に対する貸倒引当金、TC BioPharm社の投資有価証券評価損等を計上した結果、30億4,800万円の損失を計上しているという状況でございます。
対前年と比べますと非常に厳しい結果という一方で、業績予想と比べると、構造改革の成果等によりまして、営業損失が改善しているという部分がございます。
売上総利益、販売費及び⼀般管理費の内訳
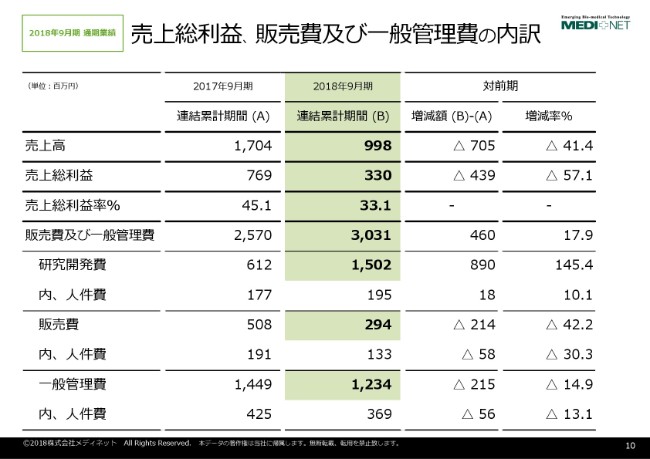
売上総利益、販売費及び一般管理費の内訳でございますけれども、売上総利益につきましては3億3,000万円を計上しております。こちらは、売上高の減少に伴う利益の減少に加えまして、一部取引先と一部の契約条件等を見直したことによりまして、売上総利益が減少しているという状況でございます。
販売費及び一般管理費につきましては、研究開発費・販売費・一般管理費をそれぞれお示ししておりますけれども、販売費と一般管理費につきましては、構造改革の進捗によりまして、削減及び効率化が図られている状況でございます。
研究開発費につきましては、先ほど申し上げましたヒストジェニックス社に対するライセンス契約一時金で11億3,000万円を含めて計上しておりますので、前年と比べて大幅な増加となっています。
細胞加⼯業の売上⾼・利益
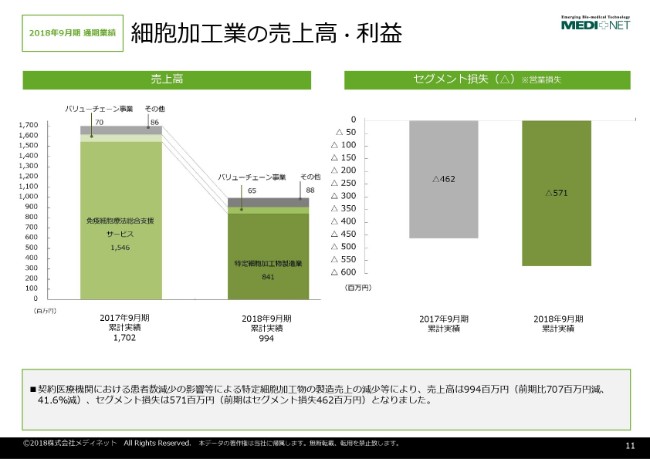
私どもは2つのセグメントで事業を開示させていただいておりますけれども、細胞加工業のセグメントについての売上高と利益のスライドでございます。
細胞加工業につきましては、先ほど申しました「がん免疫細胞治療に用いる治療用の細胞の培養」が、主な事業となっております。
従いまして、がん免疫細胞治療の市場環境の変化によりまして、患者さんが減少したことに伴って、こちらのセグメントに関しては売上も大幅に減少しているという状況でございます。
セグメント損失につきましては、売上の減少による利益の減少に加えまして、構造改革等によって一部経費の削減・効率化は図られておりますけれども、利益の減少に伴って損失が拡大しているという状況でございます。
細胞加⼯件数実績
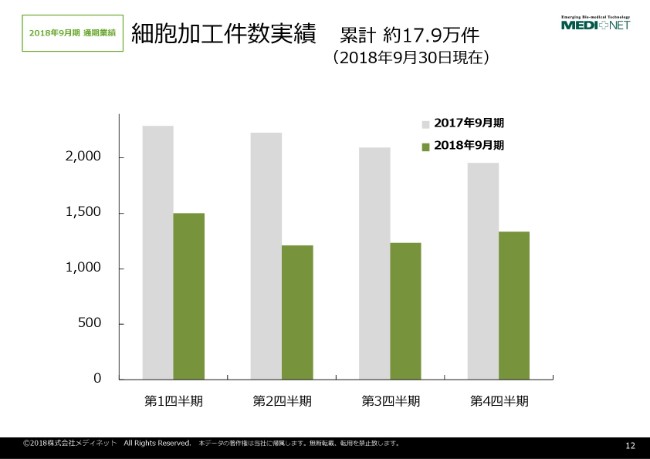
こちらは、私どもが1999年から2018年9月までに行ってまいりました、細胞加工の実績でございます。累計で17万9,000件の実績を有しております。
ただ、2017年9月期と2018年9月期の対比をしたものがこちらのグラフでございますけれども、ご覧のとおり、2017年を大きく下回る2018年9月期の結果ということでございます。しかしながら、第2四半期を底に、今徐々に回復傾向を見せているという状況にございます。
再⽣医療等製品事業の売上⾼・利益
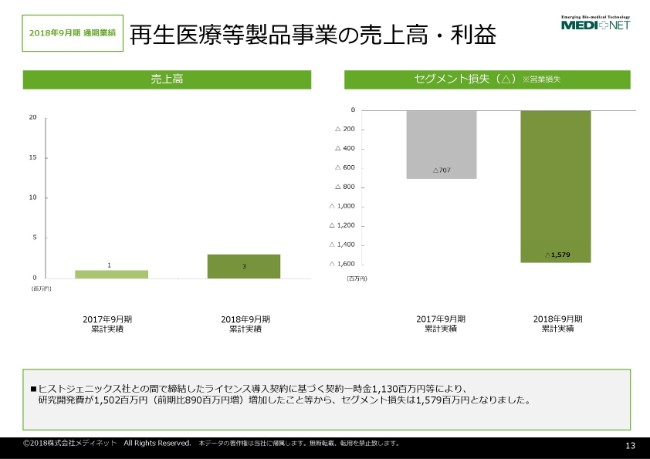
もう一方の開示セグメントが、再生医療等製品事業でございます。
こちらのセグメントにつきましては、再生医療等製品の上市をしていくということでございます。しかしながら現時点におきまして、当社で上市している再生医療等製品がございませんので、売上高はごくわずかに留まっているという状況でございます。
セグメント損失につきましては、先ほど来申し上げております、ヒストジェニックス社に対するライセンス一時金で11億3,000万円を計上した結果、15億7,900万円の損失を計上しているという状況でございます。
貸借対照表の概要
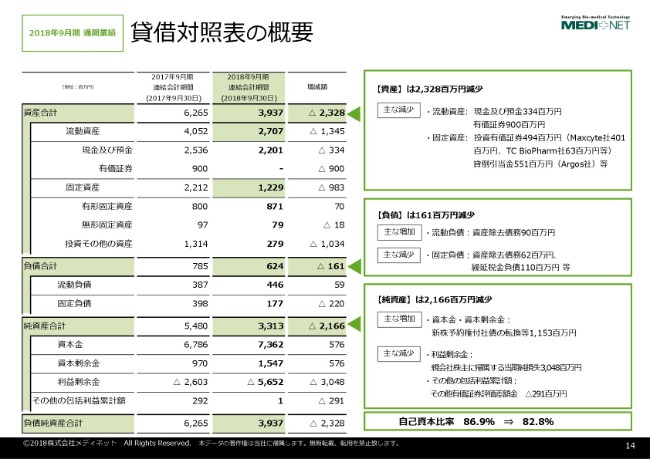
貸借対照表の概要でございますけれども、詳細につきましてはご覧のとおりでございます。
大まかに申し上げますと、資金調達をした結果、純資産が11億円強増加した一方で、当期純損失が30億4,800万円計上して、資産全体として23億円強の減少をしている状況でございます。
資⾦調達
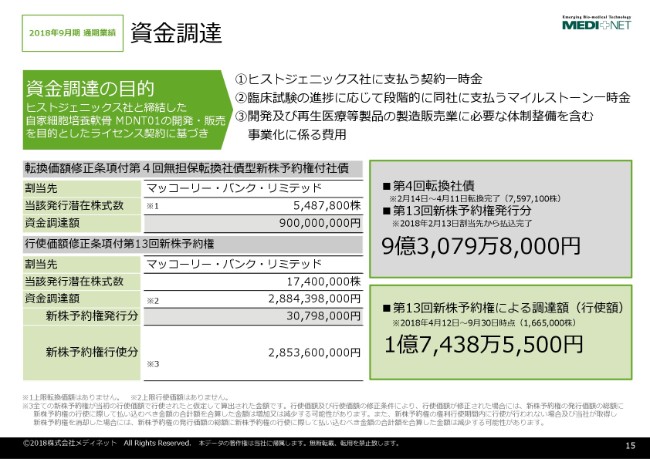
資金調達の状況でございますけれども、今年(2018年)の2月にマッコーリー・バンクを対象に、新株予約権付き社債および新株予約権の発行を行っております。2018年9月までに、11億円強の資金調達が完了しているという状況でございます。
資⾦調達における資⾦使途
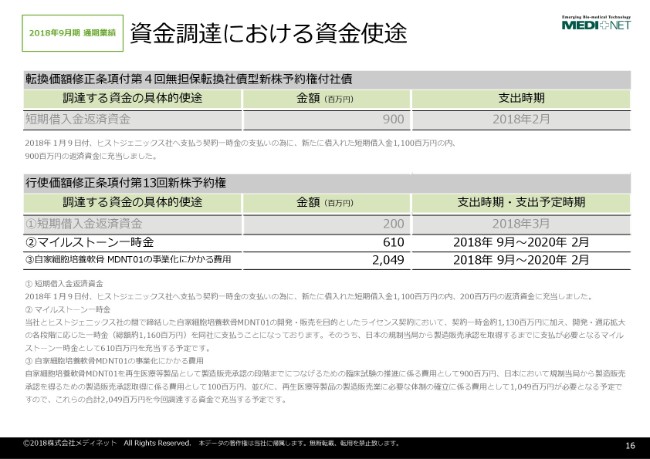
資金使途でございますけれども、こちらは自家細胞培養軟骨「MDNT01」という膝軟骨の再生医療等製品の事業化にかかる費用を目的としております。
構造改⾰(ACCEPT2021戦略)

それから、(2018年)4月27日に開示させていただきました構造改革「ACCEPT2021戦略」でございますけれども、スライドの右側が、この構造改革の大きな目標でございます。「細胞加工業のセグメントを2019年9月期に黒字化をしていく」。それから、「再生医療等製品を早期に収益化していく」ということでございます。
これまでに実施してまいった内容がスライドの左側の部分でございまして、希望退職(募集)の実施、それから拠点の統廃合を行ってまいりました。それから10月1日になりますけれども、子会社でありました株式会社医業経営研究所と株式会社メドセルをメディネットに吸収合併いたしまして、事業運営効率化を図っているところでございます。
2019年9⽉期 通期業績予想
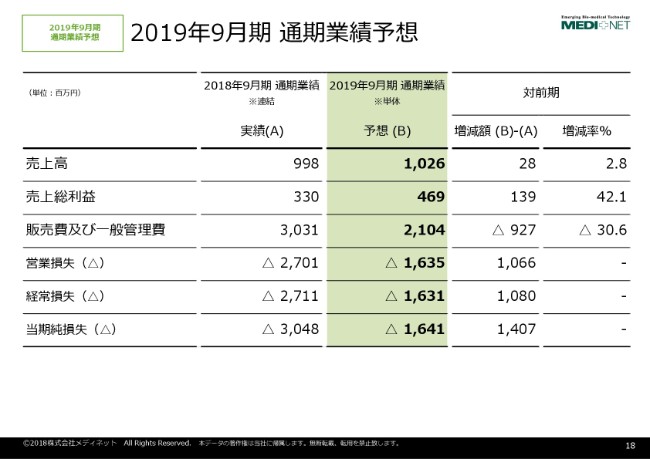
2019年9月期の通期業績予想でございますけれども、業績予想は(B)というところをご覧いただければと思います。
売上高につきましては10億2,600万円、営業損失は16億3,500万円、当期純損失は16億4,100万円という予想でございます。
売上総利益、販売費及び⼀般管理費の内訳
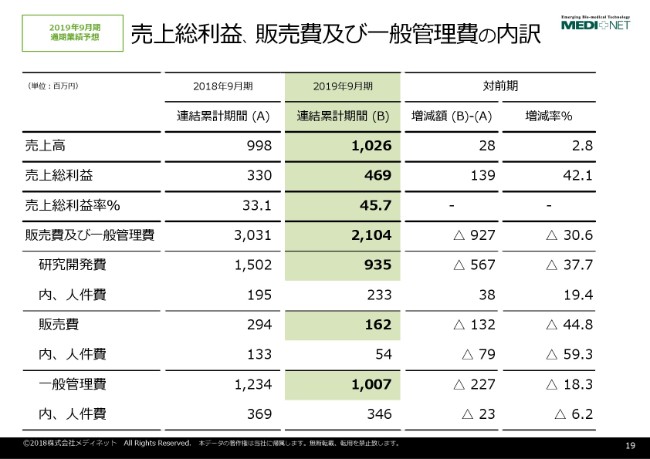
売上総利益、販売費及び一般管理費の内訳でございますけれども、売上総利益につきましては、構造改革の実行による売上原価の低減、それから取引先との一部の契約条件の見直し等によりまして、4億6,900万円という見込みでございます。
販売費及び一般管理費の内訳として、研究開発費・販売費・一般管理費をそれぞれお示ししておりますけれども、構造改革の実行によりまして、これらの経費が削減及び効率化が進み、実行されるという計画でございます。
研究開発費の人件費だけ増加しておりますけれども、これにつきましては今開発に着手している膝軟骨製品、それから「ATL-DC-101」という開発品目の進捗に伴いまして、これまで当社の中になかった治験申請専門の人材等の確保及び強化を見込んでおりまして、人件費が増加しているということでございます。
セグメント別通期業績予想(細胞加⼯業)
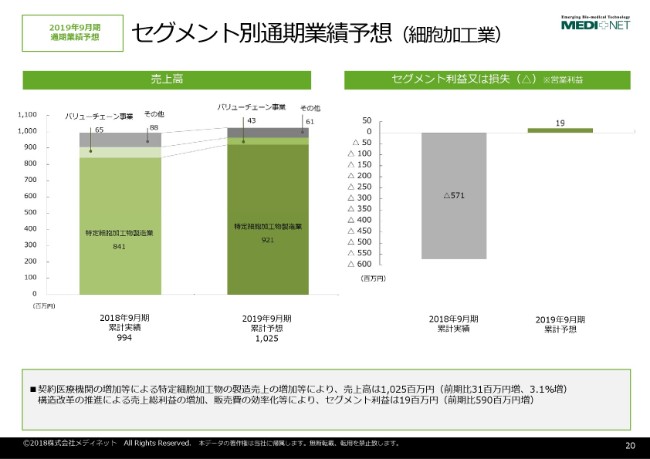
セグメント別の業績予想でございますけれども、先ほど申し上げました細胞加工業のセグメントでございます。
細胞加工業につきましては、がん免疫細胞治療に用いられる治療用の細胞の加工ということでございます。細胞加工業の売上高の予想は10億2,500万円ということで、免疫細胞治療の市場環境にまだまだ不透明な部分がございます。
前期並みということに加えまして、これまで当社には細胞の受託をせずに免疫細胞治療を実施している医療機関が当社に培養の委託を切り替えるという案件がいくつかございまして、その分の売上を上乗せしているという予測でございます。
一方でセグメント利益でございますけれども、構造改革のところでも申し上げましたけれども、細胞加工業につきましては、2019年9月期は黒字化を達成するという計画でございます。1,900万円のセグメント利益を見込んでいる状況でございます。
セグメント別通期業績予想(再⽣医療等製品事業)
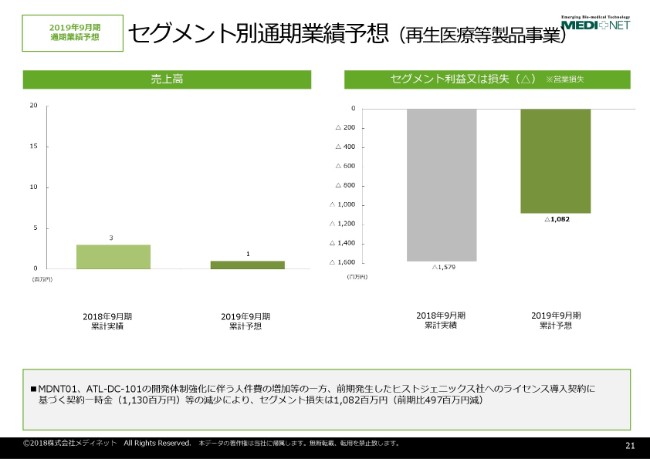
もう一方の再生医療等製品事業でございますけれども、こちらは2019年9月期におきましても再生医療等製品の上市予定がございませんので、売上高はわずかな数字ということでございます。
一方で、セグメント損失でございますけれども、自家細胞培養軟骨「MDNT01」、それから「ATL-DC-101」というものの開発が進む一方で、ヒストジェニックス社に2018年9月期に支払いました契約一時金がなくなる関係で、10億8,200万円の損失を予定しているという状況でございます。
私からの説明は、以上でございます。ありがとうございました。
研究・開発等の状況
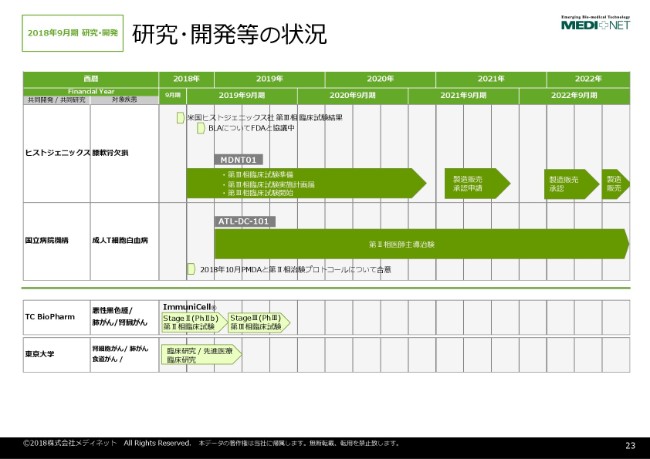
池田昇司氏:再生医療等製品事業部の池田と申します。私から、再生医療等製品の開発状況について説明させていただきます。
先ほどのトピックスのところで鈴木からありましたように、昨年(2017年)及び今年(2018年)の3月に「NeoCart®」及び「ATL-DC-101」の導入を決めまして、現在その治験に向けた準備を行っております。詳細については、また後ほど説明させていただきます。
その2製品のほかに、弊社のガンマデルタティー(γδT)を技術投資しておりますTC Bioでも、ガンマデルタティー細胞の治験を実施中でありまして、現在フェーズ1で安全性を確認したのち、3つの癌腫をその中からどれを選出して最終的な対象とするかというフェーズ2試験を実施しております。その結果、癌腫が決まれば、次にフェーズ3の検証試験に進むというように話を聞いております。
それ以外に、あと弊社が提供しておりました東大の寄付講座。そこにおいても、一応臨床研究並びに先進医療でいくつかのがんの免疫療法の検討をやっておりまして、それぞれの試験の患者登録はだいたい終了しております。今後はその結果を解析して、がん免疫療法についての可能性、再生医療等製品としての可能性を検討していく予定にしております。何かできましたら、また次回に報告させていただきたいと思います。
⾃家細胞培養軟⾻ MDNT01 開発⽅針
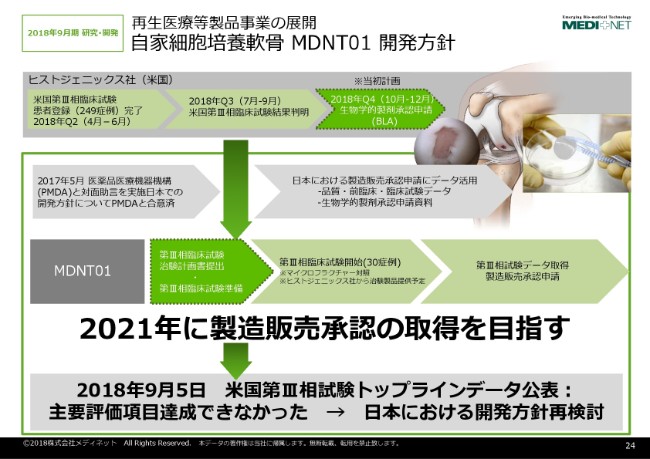
まず、「NeoCart®」についての説明でございます。
「NeoCart®」は、日本での開発治験で開発番号が「MDNT01」。これ自体は、現在ハーバード大学におられる水野秀一先生が開発されましたバイオ技術を使って製造する、膝軟骨のバイオ製品でございます。
⾃家細胞培養軟⾻ MDNT01 開発①

ここに示しましたように、米国においては、現在ヒストジェニックス社がこういうスケジュールで開発を進めております。日本での開発においても、昨年(2017年)ヒストジェニックス社がPMDA(医薬品医療機器機構)との対面助言を行いまして、日本での開発戦略について、一応合意を得た状況であります。
それ自体は、米国のフェーズ3の試験データを使えれば、日本で少数例の試験を実施して、米国のデータと日本のデータを一緒にして申請可能というように、PMDAとの協議の結果、そういう合意が得られております。
それで、我々もその合意に従いまして、昨年ライセンスインしたあと、昨年末から今年(2018年)にかけて治験の開始を……という準備をしていた段階で、我々としては治験をなるべく早く開始して、2021年に製造販売承認を目指すというふうに動いておりました。
ところが、先ほど鈴木からも一部述べましたように、今年の9月5日に米国の第Ⅲ相試験のトップラインデータが公表されました。その結果自体なのですけれども、残念なことに、主要評価項目の達成ができなかったということです。そういうことで、もともとアメリカの試験がうまくいって、それをもとに申請するというストラテジーを立てておりましたので、日本でもそのあたりでもう一度、再度開発方針を見直すという必要が出てきたと考えております。
⾃家細胞培養軟⾻ MDNT01 開発②
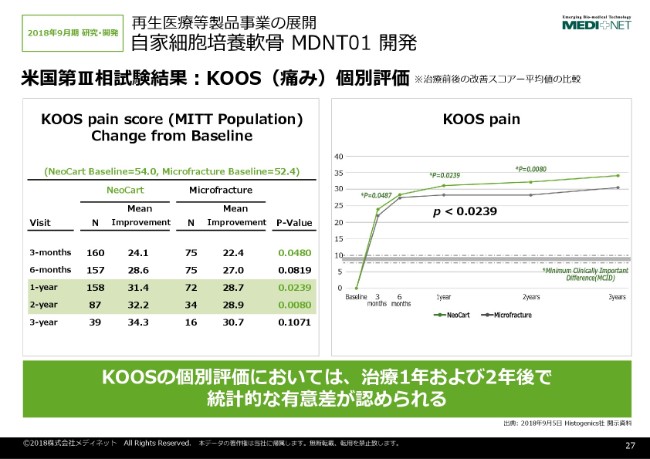
26ページを1枚飛ばして(27ページの)データ……フェーズ3の米国試験の結果の概要を説明させていただきます。
もともとアメリカの試験は、主要評価項目といたしまして、ここに書いてある奏効率。奏効率には、痛みのスコアと機能の改善(がございます)。それぞれのスコアが、「痛み」に関しては12ポイント改善、「機能」のIKDCスコアに関しては20ポイント改善。この両者を満たすものの割合を比較するという試験をやっております。
⾃家細胞培養軟⾻ MDNT01 開発③
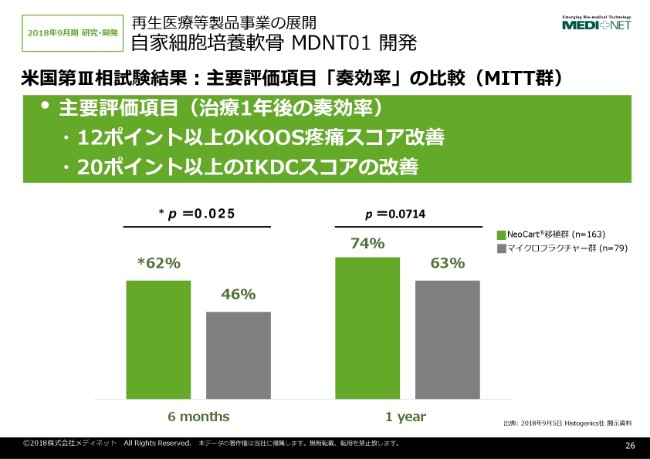
ここに示しましたように、1年後の奏効率の割合なんですけれども、「NeoCart®」は74パーセント、マイクロフラクチャーは63パーセントということです。ここに示したように、P値自体は、残念ながら統計的な有意差を示すことができませんでした。
しかしながら、こちら(左側)が治療から半年後のデータなのですけれども、「NeoCart®」自体が62パーセント、マイクロフラクチャー群が46パーセントということで、6ヶ月後は統計的有意差がついております。
「NeoCart®」自体が、もともと硝子軟骨というか、軟骨組織に近いものを移植するということで、効果発現が早いという特徴を表しているのではないかとも考えております。
こちらの膝軟骨製品の開発自体のいろんなガイドラインが出ておりまして、FDAの膝軟骨製品の開発におけるガイダンスというのが、2011年に公開されております。そのガイドラインでは、評価項目としては「痛みと機能を評価する」ということが一応求められております。
その評価に使うのが、「KOOS」という痛みに対する調査評価表。あともう1つやっております「IKDC(機能)」についての評価をすれば、一応そこで有効性が確認できたら申請可能というようなガイドラインになっております。そのガイダンス自体は、米国だけではなくて日本及びヨーロッパにおいても同じような傾向になっております。
ここでフェーズ3の結果なのですけれども、それぞれKOOS(痛み)の評価及びIKDC(機能)の評価がどうなっているかというのを、このスライドは示しております。2年目の評価自体は、まだ患者さんの最終評価が半分くらいしか終わっていないのですけれども、ここに示したように1年後及び2年後において、統計的に有意差がついておりまして、マイクロフラクチャーより効果が高いというデータが得られております。
⾃家細胞培養軟⾻ MDNT01 開発④
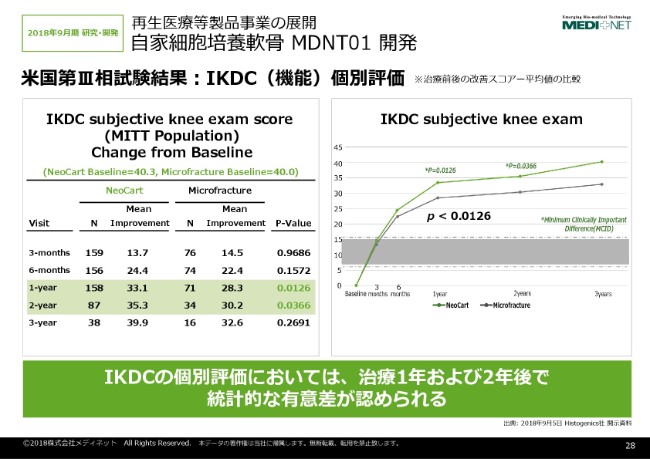
これが、IKDCの個別評価のデータでございます。これも同様に、1年後及び2年後において有効性というか、機能においてマイクロフラクチャーに対して有意差を示して勝っているというデータが得られております。

スライド25ページに戻っていただきたいと思います。
このような状況で、我々は米国第Ⅲ相試験において「NeoCart®」の有効性・安全性は確認できた。ヒストジェニックス社でもそう考えまして、このデータをもとに申請可能かどうかということを、FDAと今協議をしております。
(2018年)10月30日に1回目のミーティングをやりましたけれども、まだその段階では結果が出ておりませんので協議が続いております。たぶん予想では、12月中にはFDAが米国においてBLA(生物学的製剤承認申請書)を受け付けるかどうかというのがわかると(いうことです)。
こちらとしても、FDAが協議を受け付けてくれたということで、効果自体はある程度認識されていると思いますが、エンドポイントを達成できなかったことが、どう判断されるかという結果を待っている状況でございます。
従いまして、日本においても米国のFDAの結果を見ながら開発をどうするかということを現在検討しておりまして、KOOSおよびIKDCで有効性の証明をしております。そのあたりを含めて、日本での開発戦略・治験の試験デザインについて、PMDAと相談するような予定にしております。
成⼈T細胞⽩⾎病を対象 樹状細胞ワクチンの第Ⅱ相医師主導治験

29ページをお願いいたします。もう1つの成人T細胞白血病を対象とした、樹状細胞ワクチンであります「ATL-DC-101」でございます。これは前回も説明しましたように、九州がんセンターの末廣先生が中心になって研究を進められてきたもので、今年(2018年)の3月に国立病院機構と共同開発計画を結んでおります。
役割分担としては、国立病院機構が次の医師主導フェーズ2試験を実施いたしまして、その治験製品の製造自体はメディネットが担当します。その後、これまで実施されたフェーズ1・フェーズ2の医師主導試験の結果をもちまして、製造販売承認申請を弊社がやるというような枠組みでの共同開発契約でございます。
昨年(2017年)契約後、今国立病院機構ではフェーズ2のプロトコルについてPMDAと対面助言が行われ、一応だいたい大筋では合意しておりまして、プロトコルはだいたい準備ができてきたと(いうことです)。
あと残っておりますのが、前回のフェーズ1に関しましては、九州の先端医療イノベーションセンターで製造していた治験製品を弊社の品川CPFで製造することになっておりますので、今製造の移管を行っております。製造後、フェーズ1との治験製品との同等性が確認できた段階で、治験が開始できるものと思っております。これも、早く患者さんに製品を届けたいという思いで、国立病院機構の方々と一同で協力しあって、研究を進めているような状況でございます。
以上、再生医療等製品の開発状況について説明させていただきました。
ACCEPT2021戦略

鈴木:それでは、2019年9月期の経営ビジョンについてご説明申し上げます。
まず、先ほど少しご説明させていただいたところでございますけれども、「ACCEPT2021戦略」について、もう少し説明を加えたいと思います。
「『ACCEPT』……どういう名前の付け方なんだ?」というところでございますけれども。私どもの事業領域の自家細胞……「Autologous Cell」ということで、そこから「AC」と取りました。
それから、自家細胞で私どもは培養あるいは加工技術をずっと20年近く積み上げてきたわけでございまして、「Culture & Engineering」(のCとE)というところでございます。さらに、自社製品を主体とする事業構造に転換していくということで、「Product」……製品の「P」と「T」を使って、この「A」「C」「C」「E」「P」「T」で「ACCEPT」ということです。2021年に向かって事業領域を拡大し、再生医療等製品のパイプライン拡充、それから早期の収益化を目指していくということでございます。
それで、再生医療等製品については、先ほど池田からご説明申し上げましたとおり、「MDNT01」、それから「ATL-DC-101」ということで、こちらでぜひ製品化を早期に実現していきたいということです。
こういった「ACCEPT2021」に向かって構造改革も実施してきたということで、だいぶ筋肉体質になっており、落合から説明がありましたとおり、コスト構造はずいぶんスリム化したという状況であります。
次世代の医療を⽀える⾰新的な技術及びサービスを創造し、迅速かつ効率的に社会に提供し続ける
それで、今後でございます。
タイトルにありますとおり、「次世代の医療を支える革新的な技術及びサービスを創造し、迅速かつ効率的に社会に提供し続ける」ということが、私どもの会社のミッションでございます。それを考えるにあたって、少しおさらいということで、社会環境の変化あるいは革新的技術の進展というところで、ちょっと字が小さいのであれ(見えづらい)ですけれども、キーワードを少し並べてみました。
「健康長寿」「超高齢化」「少子高齢」「免疫老化」「未病対策」「免疫チェックポイント阻害剤」「ゲノム医療」「予防治療」。今後社会の構造が変わり、人口の構成が変わり、技術が進展していく過程で、今後の医療の在り方が変わっていくであろうと我々は認識しております。
その中で、私どもが今立っております、この矢印の一番下の「ACCEPT2021戦略」から始まって、今後売上を上げていく、あるいは収益化をしていくために、どんなことを考えているかを申し上げたいと思います。
まず、「ACCEPT2021」から。短期的に考えていかなければならない課題あるいは目標でございますけれども、「製造体質の強化」。すでに製造体質については、大井競馬場の前に新しい品川CPFという細胞加工施設を持っておりますけれども、さらにこれを強化していくということが1つでございます。
それに伴って、先ほど(申し上げたように)だいぶ市場環境が厳しくなった細胞加工業でございます。少し回復基調にありますけれども、さらにこれを回復させていくべく、免疫細胞のみならず、あるいは当社の技術のみならず、他の方々の技術あるいは他の細胞、こういうものに広げていくということ。それから、製品群に関しての、製品開発に伴う製造の受託にも取り組んでいくということでございます。
それから、自社製品の開発でございますけれども、再生医療等製品をできるだけ早く上市するということを目指していきます。さらには、今は2つのパイプラインでご説明申し上げましたけれども、今後さらにパイプラインを拡充しつつ、継続的な再生医療等製品を提供していくということで、取り組んでいきたいということでございます。
それで、今後どの方向に向かっていくかについては、当然社会情勢や技術の進展、同業他社動向、それから海外の動向。こういったものを判断していかなきゃならないとは思っております。
ここに4つほど書きましたけれども、「社会環境やニーズをとらえた事業領域拡大」ということで、具体的には「医療・ヘルスケア分野での新規事業への進展」。これは、「新規再生医療のシーズ」を見つけていく、「再生医療のグローバル展開」あるいは「新しい免疫細胞治療への展開」といったこと。こういったことに一つひとつ目を向けて、事業を拡大できるように今後努力していくということでございます。
それで、キーワードとして一言申し上げますと、私どもはこれから「再生医療のトータルソリューションプロバイダー」になるように、がんばっていきたいと思っております。

健康長寿社会において、我々には「イノベーティング・カンパニー」という言葉がありますけれども、常に革新を求めて成長していくことを目指していきたいと思っております。当社の経営ビジョンのご説明は、以上で終わりたいと思います。
決算説明も、これで終わらせていただきます。ありがとうございます。
新着ログ
「サービス業」のログ





