アンジェス、上期事業収益は前年比104.0% Vasomune社と共同開発契約を締結
最新のトピックス

山田英氏:おはようございます、山田でございます。どうぞよろしくお願いいたします。今から、決算の説明をさせていただきます。
まず、最新のトピックスというかたちで、まとめさせていただきます。
1つ目でございますが、HGF遺伝子治療薬。ご存じのように、重症虚血肢の適用でございますが、厚生労働省に対しまして、再生医療等製品の製造販売承認申請を、今年(2018年)の1月22日に行ってございます。一般論ではございますが、申請から承認まで1年程度と言われていることから、私どもといたしましては、2019年における承認を見込んでございます。
2つ目でございます。NF-κBデコイオリゴ。椎間板性腰痛症の適用でございます。これは、第Ⅰb相臨床試験を米国にて、今年の2月から実施してございます。
3つ目でございます。DNAワクチン。これは、高血圧の適用症でございます。現在、第Ⅰ/Ⅱ相臨床試験をオーストラリアにて実施中でございます。今年の4月から、実施してございます。
4つ目でございます。これは新しいものでございますが、Vasomune社との共同開発契約ということで、Tie2受容体アゴニストをメカニズムとするものでございます。急性呼吸不全の治療薬を共同開発しようということで、先日でございますが、7月に締結を実施いたしました。
2018年度第2四半期 連結業績ハイライト
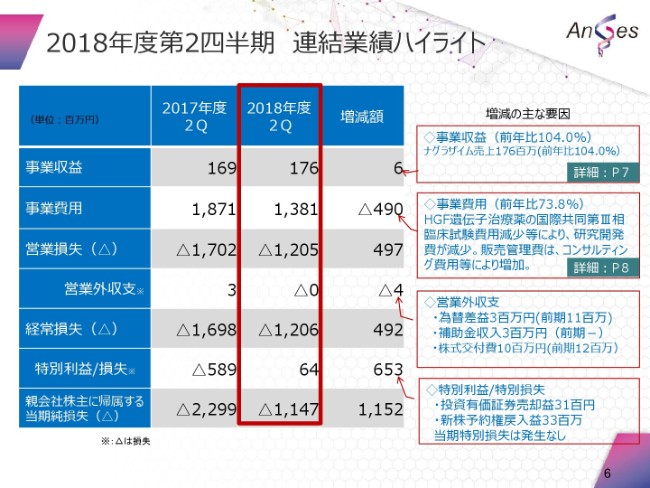
続きまして、(資料の)大きな2番目、決算の概要でございます。とくに、連結業績ハイライトという観点からまとめさせていただきました。
事業収益は、1億7,600万円。これは、(ムコ多糖症Ⅵ型治療薬の)「ナグラザイム®」の売上そのものでございます。
また、事業費用は13億8,100万円。これは、とくにHGF遺伝子治療薬の国際共同第Ⅲ相臨床試験の費用減少等によるものでございます。
営業損失でございますが、12億500万円。
経常損失でございますが、12億600万円。
それから、特別利益損失等々がございまして、当期純損失が11億4,700万円ということでございます。
事業収益の内容
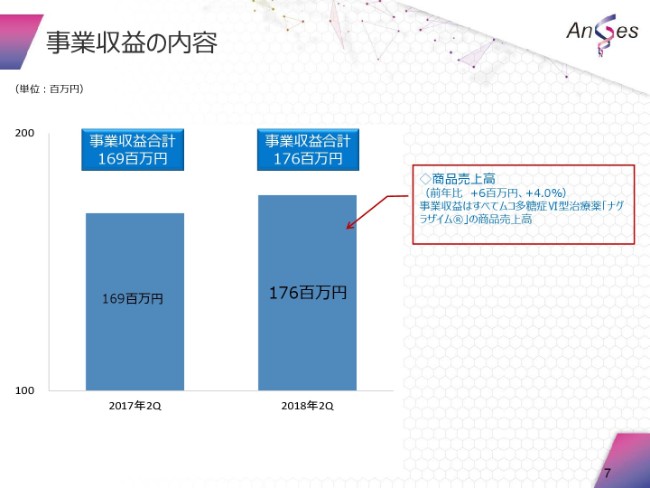
事業収益の内訳でございます。先ほど申し上げましたように、1億7,600万円。これは、「ナグラザイム®」の売上相当分でございます。
事業費用の内容
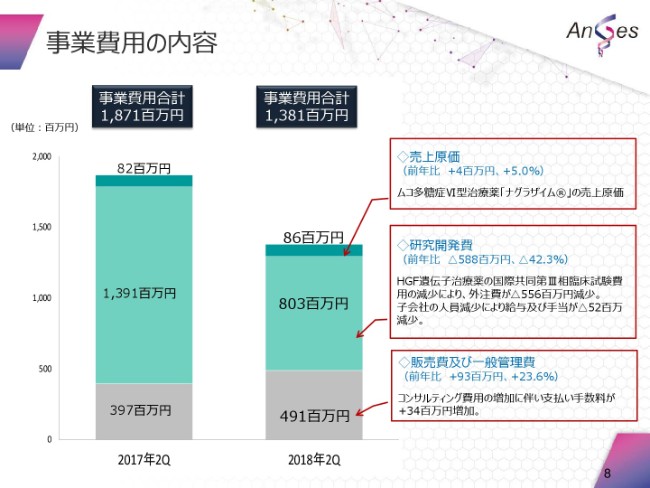
それから、事業費用の内容の内訳でございます。
まず、8,600万円でございますが、これは「ナグラザイム®」の売上原価でございます。研究開発費は、8億300万円でございます。その中身につきましては、先ほど申し上げたとおりでございます。
販管費及び一般管理費でございますが、4億9,100万円でございます。
連結貸借対照表 ハイライト
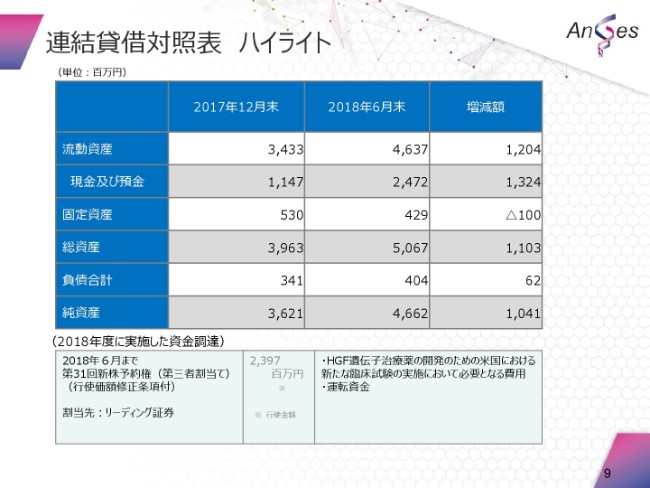
連結貸借対照表のハイライトというかたちで、まとめさせていただきました。
流動資産・現金及び預金・固定資産・総資産・負債合計・純資産は、この(スライドの)数字のとおりでございます。
とくに、2018年度に実施した資金調達でございますが、23億9,700万円でございます。使用使途につきましては、従前から申し上げているとおりでございますが、HGFの米国における開発に係る運転資金ということで、説明をしてございます。
2018年度通期業績見通し
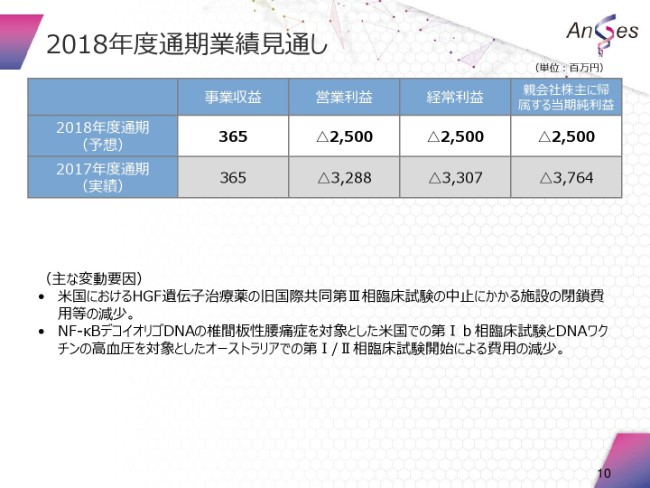
2018年度の通期業績見通しは、この年初に申し上げたとおりでございますが、事業収益が3億6,500万円。営業利益・経常利益・当期純利益ともに、25億円の赤字を予想してございます。
ここにも書いてございますが、主な変動要因でございます。米国におけるHGF遺伝子治療薬の旧国際共同第Ⅲ相臨床試験の中止にかかる、施設の閉鎖費用等の減少でございます。
2つ目は、NF-κBデコイオリゴDNAの椎間板性腰痛症を対象とした、米国での第Ⅰbに相当する相臨床試験。それから、DNAワクチン。これは、高血圧を対象としたものでございますが、オーストラリアで第Ⅰ/Ⅱ相臨床試験開始による費用の減少ということでございます。
臨床開発ステージにあるプロジェクトの状況
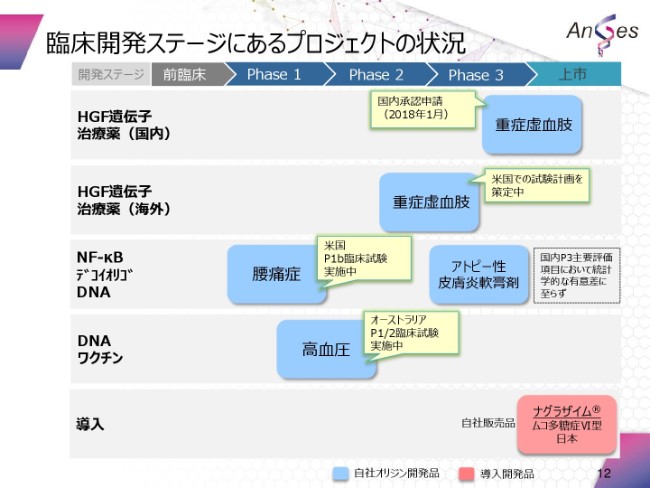
開発プロジェクトの進捗状況でございます。プロジェクトの状況を、一覧で1つの表にまとめたものでございます。
繰り返しになりますが、HGF遺伝子治療薬の国内につきましては、今年(2018年)の1月に申請をいたしました。海外につきましては、さらに米国での試験計画を策定中でございます。
NF-κBデコイオリゴDNAの腰痛症につきましては、先ほど申し上げたとおり、米国でPⅠb臨床試験を実施中でございます。
アトピーにつきましては、今のところ、動きはございません。
DNAワクチンにつきましては、高血圧の適用でございますが、オーストラリアでPⅠ/Ⅱの臨床試験を実施中でございます。
導入薬につきましては、「ナグラザイム」は、自社販売として継続してございます。
Vasomune社との共同開発契約について

Vasomune社との共同開発契約につきまして、簡単にまとめたものでございます。
Vasomune社が創製したTie2受容体アゴニスト化合物について、全世界を対象とした共同開発です。共同開発にかかる費用・将来の収益を、それぞれ折半するという趣旨でございます。
2つ目でございます。最初の適応疾患として、重症の呼吸不全である急性の呼吸窮迫症候群……ARDSと呼ばれているものでございますが、これを想定した、非臨床開発を実施しまして、2年後をめどに、臨床開発を開始する予定でございます。POCを獲得した段階で導出することを、現時点では想定してございます。
3つ目でございます。ARDSに対する根本的な治療薬はないというのが、現状でございまして、有効な治療薬の開発が望まれている……まさに、非常に高いアンメット・メディカル・ニーズの状況でございます。
有効なARDS治療薬が開発できた場合、潜在的な事業機会というものが25億ドル以上と算定してございます。将来は喘息など、他の疾患にも共同開発を広げる可能性がある。そういう展望を、持っているものでございます。
当社といたしましては、HGF遺伝子治療薬の開発を通じ、血管疾患に関する知見・ノウハウ・経験則を含めて蓄積してございますが、そういったバックグラウンドを背景に、今回の共同開発では、そうした当社の強みを活かせるんではないか。そういうふうに考えてございます。
今後の予定 (2018年)

今後の予定を、もう一度まとめてみました。
1つ目でございますが、HGF遺伝子治療薬。重症虚血肢、国内でございます。今年(2018年)の1月に申請をしたということでございますので、承認に向け、最善を尽くしてまいります。
2つ目でございます。米国につきましては、新しい試験の設計に向け、今まさに作業中でございます。
3つ目でございます。NF-κBデコイオリゴ。椎間板性の腰痛でございますが、米国にて相臨床試験を実施中ということでございます。
DNAワクチン。高血圧の適用症でございますが、オーストラリアにてPⅠ/Ⅱ相臨床試験を実施中でございます。
以上、簡単にまとめました。どうぞよろしくお願いいたします。
新着ログ
「医薬品」のログ





