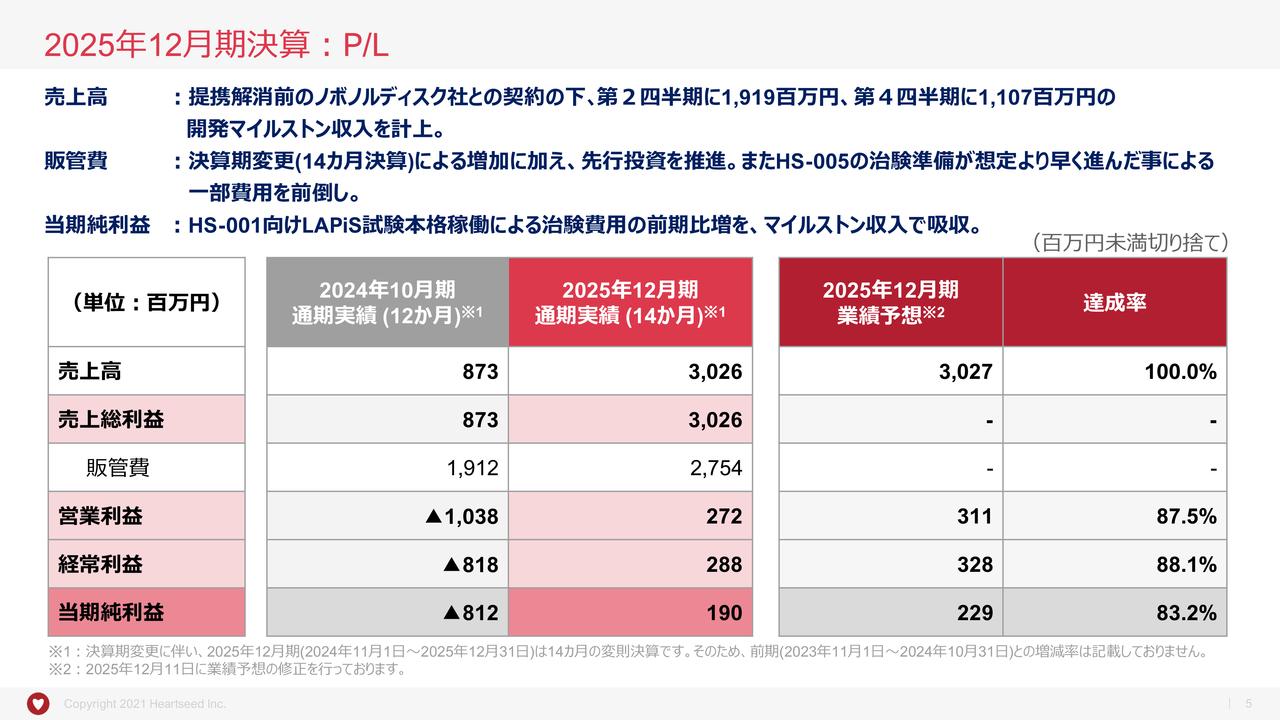
【QAあり】オンコリスバイオファーマ、テロメライシン年内承認申請に向けたデータ提出体制整う OBP-601はALSで有望な結果
目次 Agenda

浦田泰生氏(以下、浦田):代表取締役社長の浦田です。本日は大変お忙しい中、当社2024年度の中間決算説明会をご視聴いただき、誠にありがとうございます。
本日は、まず決算の状況をご説明した後に、事業進捗をご報告します。
財政状態の概況
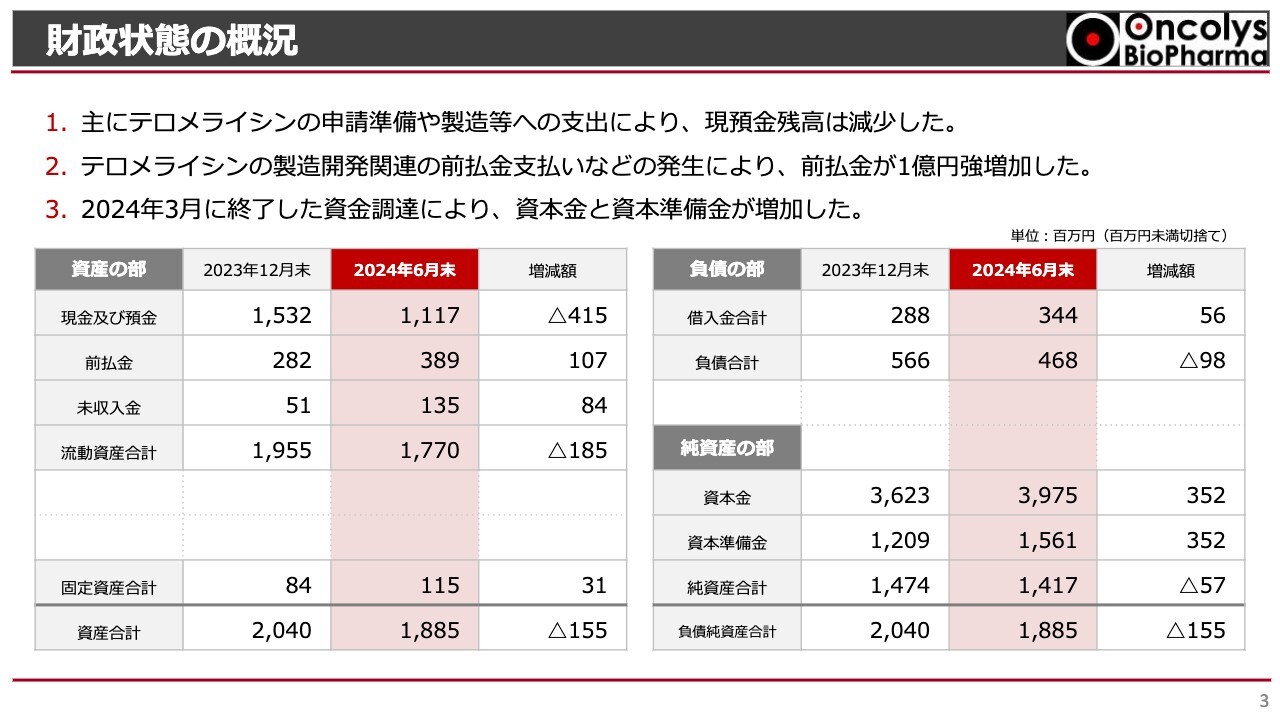
樫原康成氏:常務取締役の樫原です。財政状況の概況です。今年度上半期における現金および預金残高は11億1,700万円となり、これは昨年度末の15億3,200万円と比較して、4億1,500万円の減少となりました。現預金減少は、「テロメライシン」の申請準備、あるいは製造開発等への支出が主な原因です。
次に、今年度上半期における前払金は3億8,900万円となり、昨年度末の2億8,200万円と比較して、1億700万円の増加となりました。これは、ウイルス製造を委託しているヘノジェン社への前払金の増加が主な要因です。
今年度上半期における資本金および資本準備金は、それぞれ39億7,500万円、15億6,100万円となっています。昨年度末と比較して、それぞれ3億5,200万円の増加となりました。これらの増加は、昨年から今年3月末までに実施した資金調達によるものです。
経営成績の概況
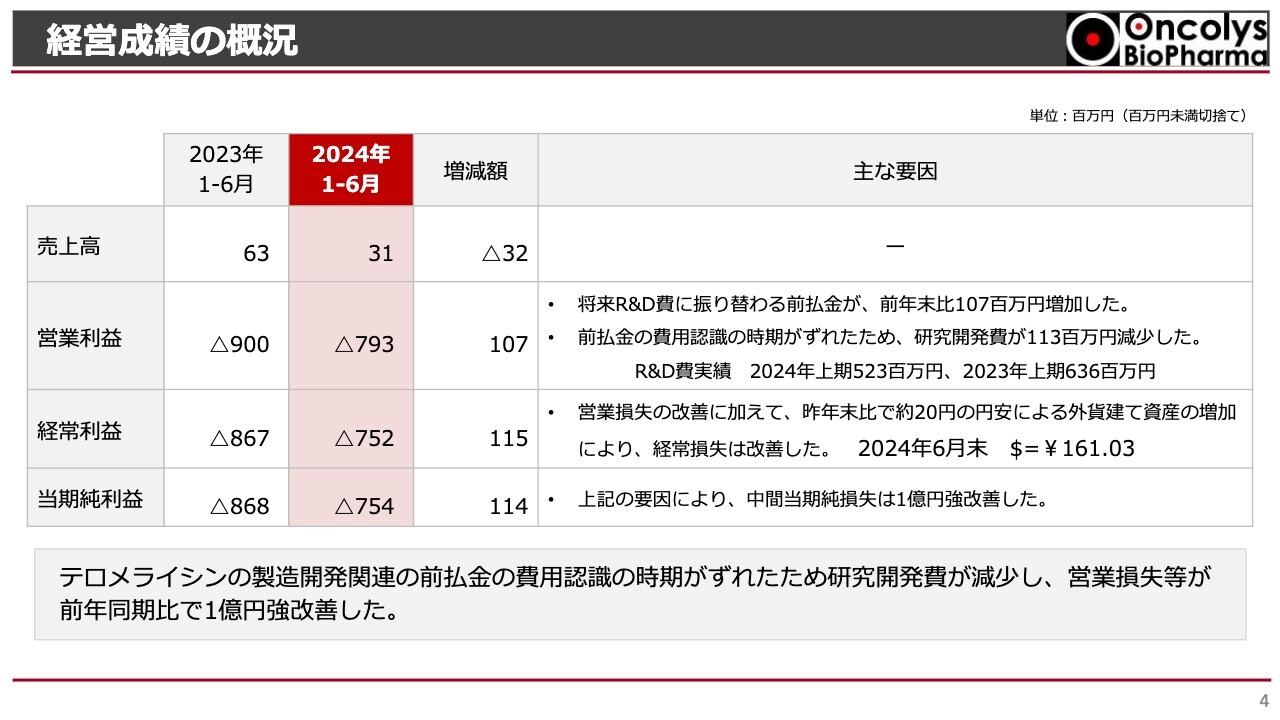
経営成績の概況です。今年度上半期における売上高は3,100万円で、昨年同期の6,300万円と比較して、3,200万円の減少となりました。
営業損失については、今年度上半期は7億9,300万円であり、昨年同期の9億円と比較して、1億700万円の縮小となりました。これは、ヘノジェン社への前払金が増加し、その費用認識のタイミングがずれたことによる、研究開発費の減少が主な要因です。
ただし、研究開発費は会計上、減少していますが、これは費用認識のタイミングによるものですので、実際の研究開発活動は引き続き積極的に行っています。
経常損失について、今年度上半期は7億5,200万円となりました。昨年同期の8億6,700万円と比較して、1億1,500万円の縮小となっています。これは、営業損失の縮小に加え、為替差益が影響した結果です。
これらの要因により、当期の中間期純損失は7億5,400万円となり、昨年同期比で1億1,400万円の縮小となりました。
キャッシュ・フローの概況
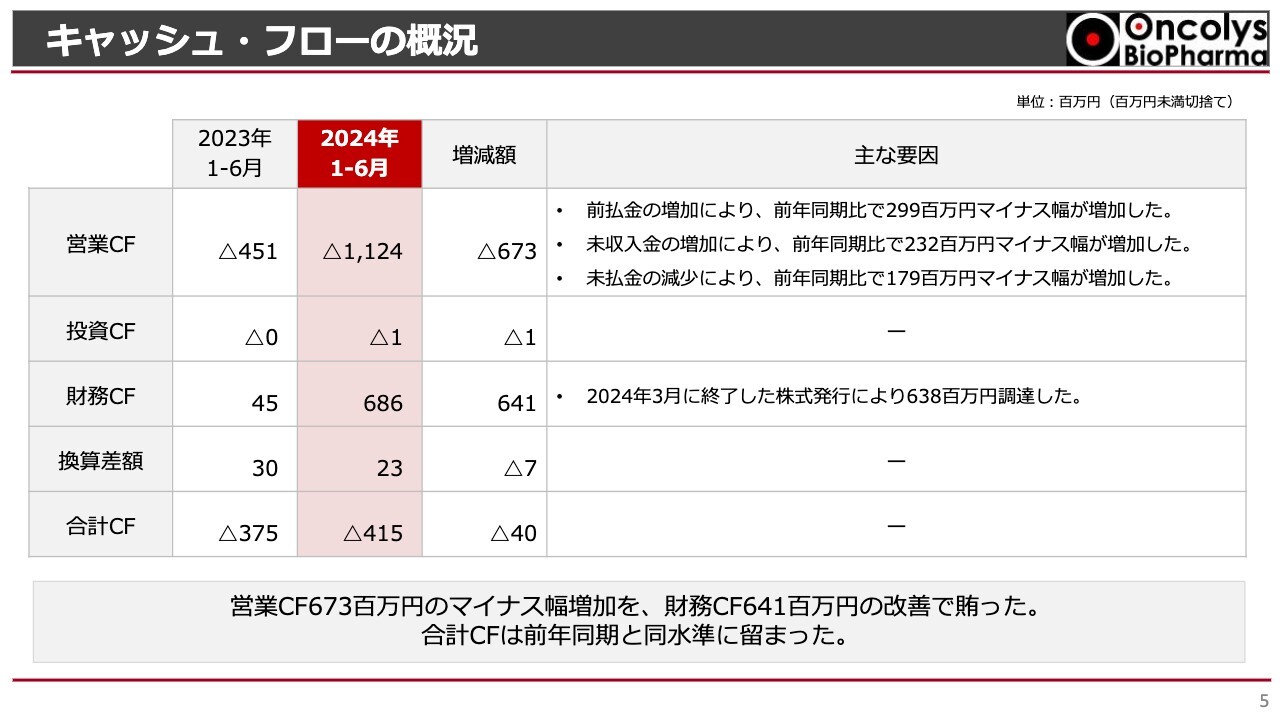
キャッシュ・フローの概況です。今年度上半期の営業キャッシュ・フローは11億2,400万円のマイナスで、昨年同期の4億5,100万円のマイナスと比較すると、6億7,300万円のマイナス幅の増加となりました。これは、前払金の増加、未収入金の増加、未払金の減少が原因です。
次に、財務キャッシュ・フローですが、新株発行による資金調達の結果、今年度は6億8,600万円となりました。
営業キャッシュ・フローのマイナスを財務キャッシュ・フローの改善で相殺したことにより、合計キャッシュ・フローは前年同期と同水準にとどまっています。
パイプライン一覧
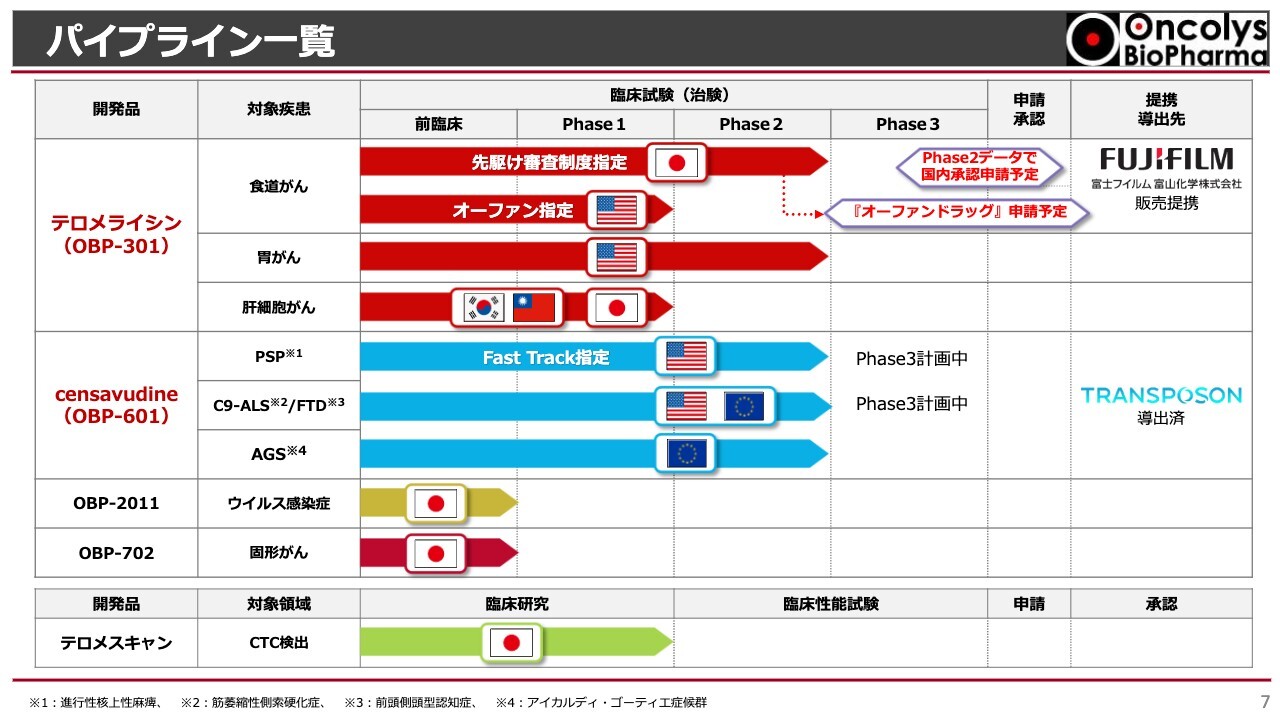
浦田:事業開発の状況をご報告します。今年の3月末の株主総会において、株主のみなさまに向けて「今年中に達成したい」とお話しした項目の進捗をお伝えしたいと思います。
スライドに当社のパイプラインをまとめています。赤い矢印は「テロメライシン」、ブルーの矢印は「OBP-601」で、もともと抗HIV薬として開発していたものを神経難病治療薬へとドラッグリポジショニングしています。
「テロメライシン」は、現段階では主に食道がんの臨床試験を日本・アメリカで行っています。胃がんについてもアメリカで医師主導治験が行われています。日本における食道がんはPhase2臨床試験を完了し、承認申請ができるかどうかというところに来ています。本日は、このテロメライシンとOBP-601の2つのパイプラインについてご報告します。
2024年にご期待頂きたい事項

今年の3月に株主総会で私がお話しした「2024年にご期待いただきたい事項」を、スライドに記載しています。
ピンク色に塗ってあるのが「テロメライシン」、ブルーのほうが「OBP-601」に関する項目です。
まず、「テロメライシン」は年内の承認申請に向けて、現在は臨床・非臨床、CMCなどのデータを集めて、PMDA(独立行政法人医薬品医療機器総合機構)と事前相談を行っています。これらが整えば、オーファン申請もできるところまで来ています。
2番目は、商用製造の1バッチをしっかりと進めるということです。
3番目は、社内での製造販売体制の構築です。
4番目は、「テロメライシン」販売後の、製造から販売までのサプライチェーンの始動です。
5番目は、アメリカでの胃がんの臨床試験を確実にスタートさせるとお話ししました。
続いて「OBP-601」です。6番目の項目は、PSP(進行性核上性麻痺)の臨床試験の48週、だいたい1年間のデータを、最終解析データとして開示するということです。
7番目は、2つの病気の中間解析データの開示をお約束しています。C-9 ALS(筋萎縮性側索硬化症)とは、全身の筋肉が衰え、最後は呼吸ができなくなってお亡くなりになる神経の難病です。FTD(前頭側頭型認知症)は、アルツハイマー病とは違った病態なのですが、皮質領域で認知機能の低下が起こる病気です。
これらの項目について、現段階の進捗状況をご説明します。なお、8番目に記載しているC-9 ALSを中心にした48週最終解析データの詳細は、後ほどお話しします。
①臨床データの総括 局所奏効率
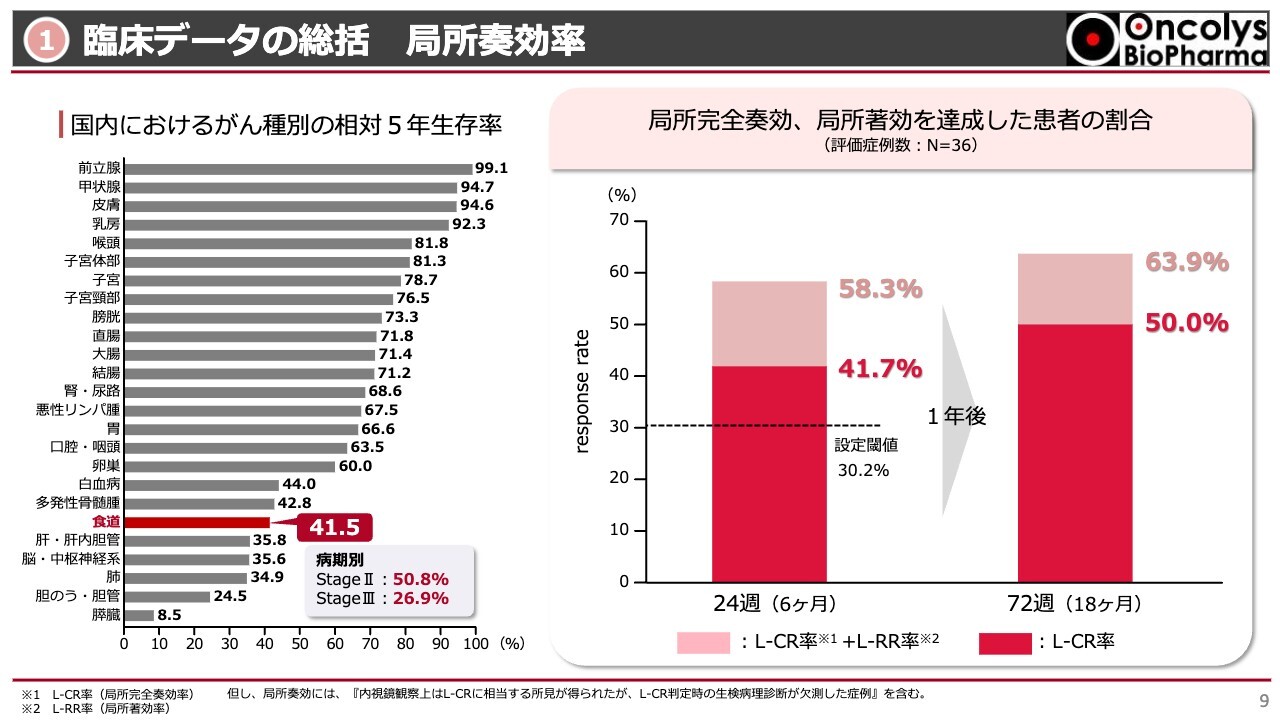
承認申請に向けて、一番重要なものの1つが臨床データです。我々は今、食道がんをターゲットにしていますが、食道がんは5年生存率が40パーセントくらいと、すべてのがん種の中で下から数えて何番目という病気です。どちらかと言うと重く、治療法があまり確立していません。
これに対して、右側の棒グラフでは、投与開始後6ヶ月から1年半の期間で局所奏功率がどのように変化したかを示しています。
まず6ヶ月目ですが、内視鏡の中央判定の結果、がんが完全に局所から消えた方は41.7パーセントでした。
また、治療を行いがんが治っていく過程における画像所見で、治療後の瘢痕が残っている症例も含めると、58パーセントの方が「テロメライシン」と放射線併用の治療に反応した結果になりました。我々が設定した、少なくとも30パーセント程度効けばよいというところから見ると、予想を上回る成績でした。
さらに24週目から1年が経つと、完全に局所でがんが消えている症例が50パーセントになっています。ちょうど半分の症例において、がんが完全に局所から消えました。さらに、治療後の痕跡である瘢痕は少し残ったが、がんはほぼないだろうという例を含めると、64パーセントくらいの方が今回の治療に奏功しました。
我々は局所治療によるがん縮小効果の表れる時期を半年と目論んでいたのですが、半年以降にも改善例が出てきたということは1つの良い発見でした。
①臨床データの総括 生存率
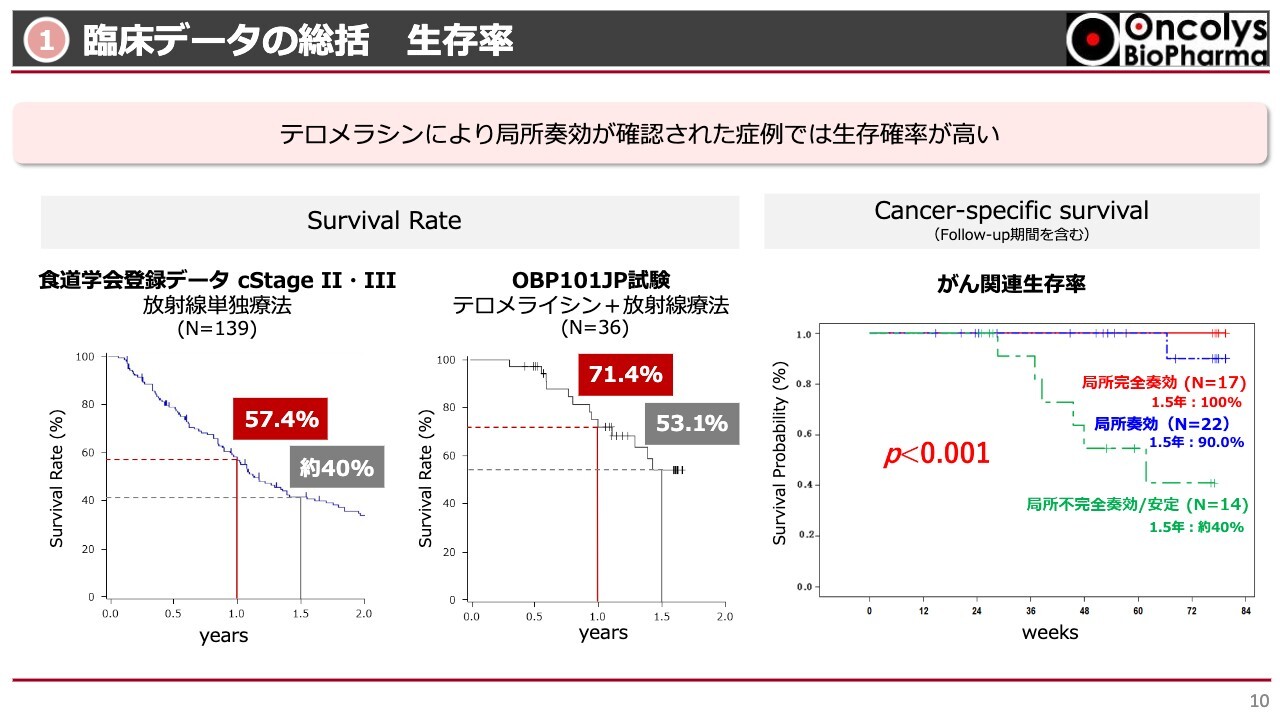
こちらのグラフは、「テロメライシン」が効いた方がどのくらい生存していたかを示しています。
一番左に、かつて食道学会に登録されていたデータがありますが、当社の臨床試験と同じようにステージⅡ・Ⅲというやや重い患者さまの結果です。1年の生存率が約57パーセント、1年半で約40パーセントという結果が出ています。
中央のグラフは今回の臨床試験の全症例をプロットしたものですが、1年の段階では約71パーセント、1年半でも約53パーセントと、学会の放射線単独療法のデータより生存率が優れていることが分かりました。
さらに、これを細かく検討したものが一番右のグラフです。今回は80歳以上の方が多く登録されていたため、こちらの生存率曲線には、がんの再発だけではなく合併症などでお亡くなりになった方も含まれています。
食道がんの再発でお亡くなりになった方のみをプロットした結果が、一番右のグラフです。緑色の点線は、残念ながら今回の臨床試験であまり奏功しなかった方を示しています。
この点線を見ていくと、だいたい食道学会のデータと同じくらいの、1年半で40パーセント程度の生存率を示しています。一方で、局所で効いた方だけをプロットしていくと、完全に治った方はほぼ100パーセント生存しており、少し瘢痕が残った方を含めても90パーセント以上の方が生存されていました。
これは非常に顕著な効果が得られたのではないかと考えています。多くの臨床医の先生方にもこのデータを見ていただき、大変すばらしい結果であると評価をいただいています。
①食道がん放射線Phase2試験の結論

この臨床試験は80歳以上の高齢の方がお集まりで、かつ、ステージⅡ・Ⅲとなかなか治療が難しい方ばかりでしたが、6ヶ月で約41パーセント、1年半で約50パーセントの方が、完全に局所からがんが消えたという結果が出ました。
生存率は90パーセントを超えたということで、局所で効けば、当然ながら「生存率にも大きく影響する」という結果が得られたわけです。
この結果をいろいろな文献と比較していますが、我々のように内視鏡だけでしっかり評価した論文は、これまで世界中で例がありませんでした。
転移したがんもすべて含めたがんの評価方法にはRECIST評価があり、CTなど、より簡便な方法で調べた論文はいくつかあったのですが、どの論文を見ても、完全に治ったという方はだいたい15パーセントから19パーセントでした。それに対して当社は41.7パーセントと、過去の論文よりも高い成績が得られていたことが明らかになっています。
主な副作用は風邪関連症状のような、投与した1日、2日くらいは少し熱が出る、あるいは一過性のリンパ球数の低下が認められたくらいで、肝臓、腎臓、心臓などの臓器の機能障害はほとんどありませんでした。
①承認申請に向けて

この非常に良好な結果を受けて、現在はPMDAと話し合いを進めています。過去に同じような内視鏡判定した論文がないため、いろいろな論文を寄せ集めて、過去の結果よりも明らかに良いことを示し、事前相談を進めています。
国立がんセンターをはじめとする今回の臨床試験の参加施設の先生のお考えも含めて、今回の結果は臨床的に非常に意味があるため、PMDAとの話し合いが終われば、次は先駆けの総合評価に移っていくと考えています。少なくとも有効性・安全性ともに大きな問題はないと、我々としては考えています。
臨床試験以外にも、非臨床試験、毒性試験、生体内分布試験、あるいは臨床で得られたウイルスがどのように体から排出されているかといった試験の資料もまとまりつつあり、できるだけ早くPMDAに申請できるよう準備を整えています。
一方で、CMCに関しては、製品をバイアルという小さな瓶に入れる最終製剤瓶詰めの段階でウイルス自体が凝集する現象が出てきており、これが本当にウイルスかどうかも含めて、なぜこのようなことが起こったか、原因究明をするよう宿題も出ています。
さまざまな方法を用いて、ウイルスが凝集体を作っていることをほぼ証明できました。この結果も近日中にPMDA等に提出する予定です。
凝集体ができないような新製剤の処方もすでに完成しており、「テロメライシン」を商用のバイアル製剤としてリリースできるように、今後もPMDAと相談を続けていく予定です。製造販売体制についても、社内でさまざまなSOPの構築を進めています。
オーファン申請については、すでに申請準備が整っているものの、先駆けの総合評価に移る頃に申請したいと考えており、もう少し時間がかかる予定です。
②原薬に関する商用製造の1バッチ完了に向けて
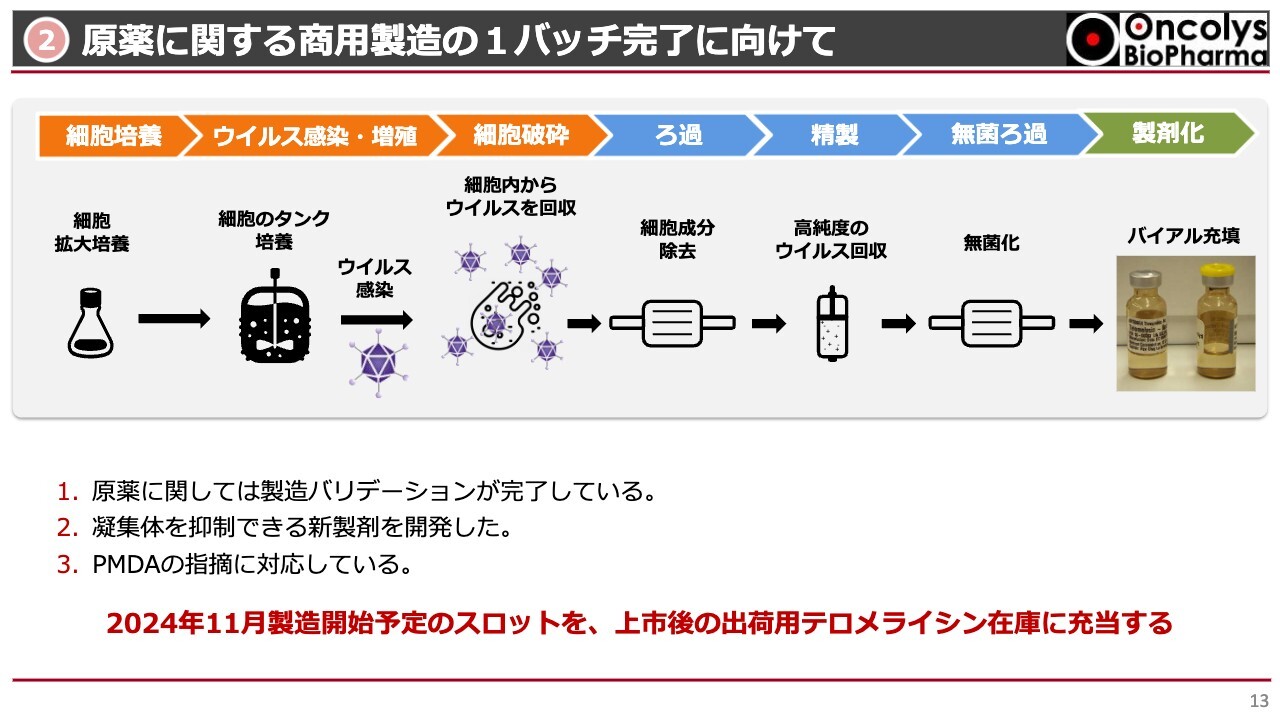
商用製造については、少なくとも1バッチを完了させるよう準備を進めています。最終製剤には凝集が起こるなどいろいろな問題が起こっていますが、原薬に関してはバリデーションも完了しています。そのバリデーションをより完璧にするために、8月に入ってもう1バッチ作っています。
これがうまくいけば、2024年11月頃には最終的にもう1バッチ作って、この製造方法の頑健性を強く打ち出したいと思います。この凝集体ができないような条件づけも完了させて、2024年内には商用製造に用いることができるように原薬製造を完了させたいと考えています。
現在はこのようなスケジュールで進んでいます。今後もPMDAとできる限り綿密な相談を行い、良い製剤、良い原薬にしていきたいと考えています。
③社内製造販売体制の構築
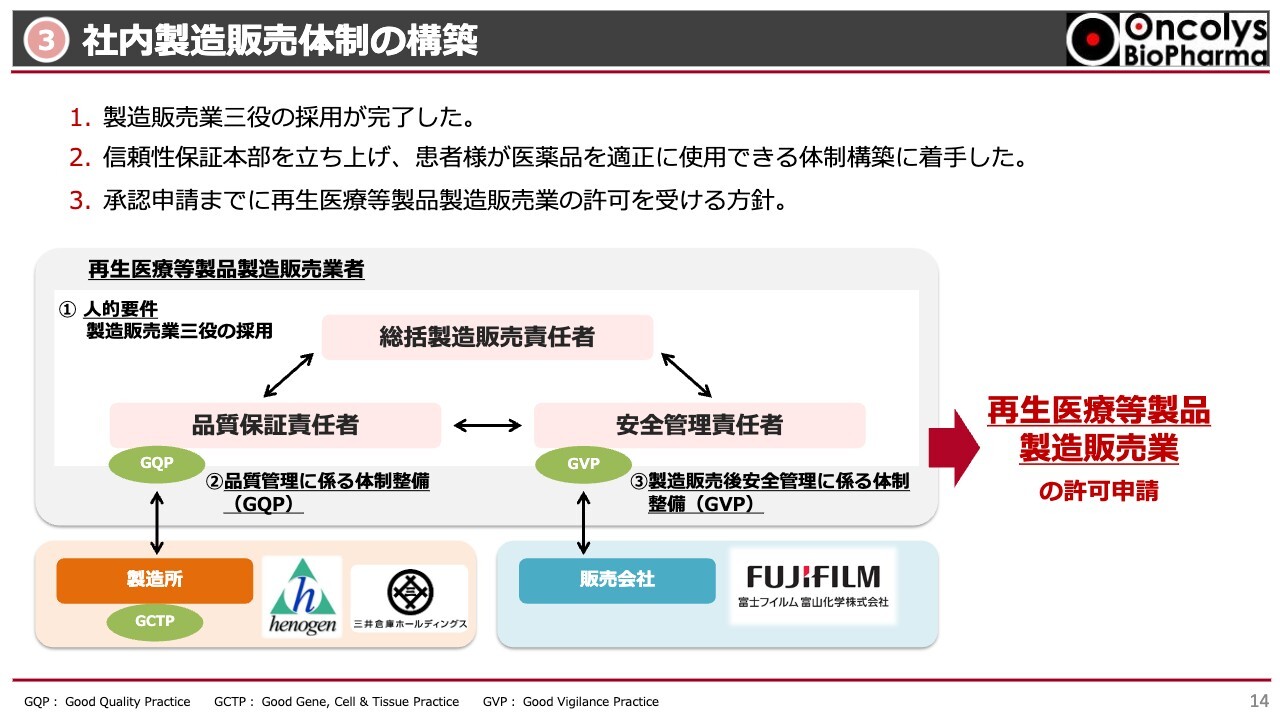
社内の製造販売体制についてご説明します。スライド中央の図をご覧ください。総括製造販売責任者、品質保証責任者、安全管理責任者の任命は終わり、すでにこの三者を中心としたGQP体制を構築しています。
GVP体制では、安全性情報管理の観点で、どのようにモニターできるかといった体制のSOPが徐々に完成してきています。
2024年内に再生医療等製品の製造販売業に関する許可申請ができる状況まで進めています。また、教育訓練が非常に重要な課題となっています。教育訓練を十分にできるSOPを最終的に完成させつつある状況です。
④サプライチェーンの始動
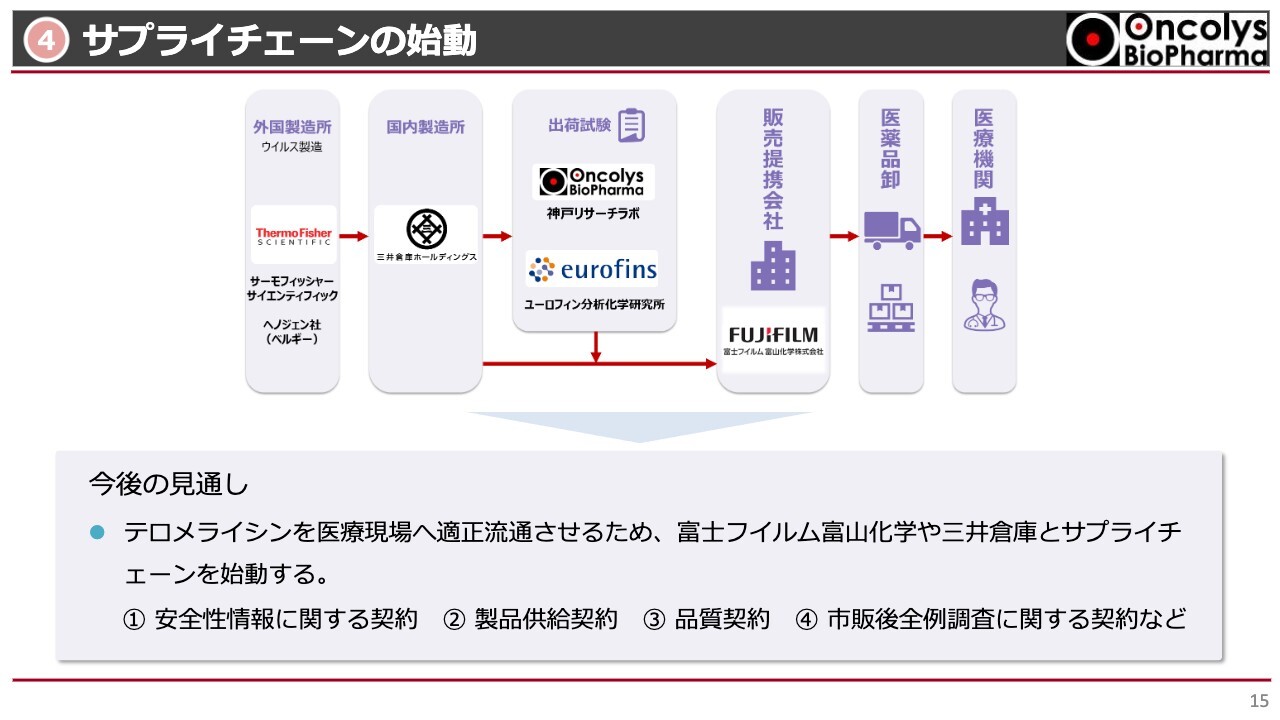
サプライチェーンの完成についてご説明します。ベルギーのヘノジェン社で原薬を作りバイアルに充填し、それが国内に送られて箱詰めされるのですが、箱詰めは三井倉庫ホールディングスの倉庫で行っています。
最終的に、包装された製剤がリリースできる品質を保っているかどうか、当社の神戸リサーチラボ、および京都にあるユーロフィン分析科学研究所で入念に検査を行います。その後に、販売提携会社の富士フイルム富山化学から、卸を通じて医療機関に送られる体制がほぼ完成しました。
ただし、医薬品卸会社については、富士フイルム富山化学が契約を完了していないため、現段階ではまだ公表できません。こちらは時間の問題で、ここが決定すればサプライチェーンは十分に動くと考えています。すでにヨーロッパから日本国内に送るテスト輸送が行われています。安全に、かつ安定して送れるような条件がほぼ完成された状況です。
⑤米国2nd Lineのペムブロリズマブ併用胃がんPhase2臨床試験の開始
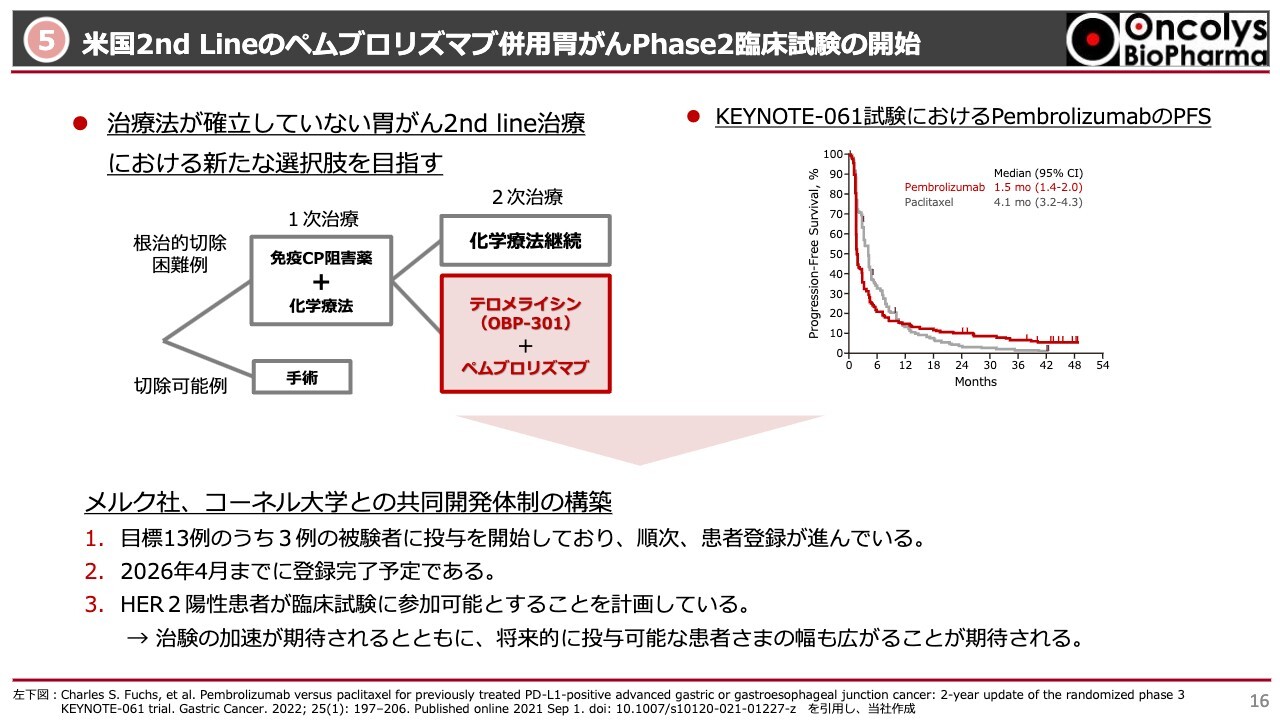
アメリカでの「ペムブロリズマブ」併用の胃がんの臨床試験についてです。「ペムブロリズマブ」というチェックポイント阻害剤は、メルク社から全部サンプルを出していただきます。当社は「テロメライシン」をコーネル大学に提供して、この臨床試験の費用をメルク社と折半して行います。
胃がんに対するペムブロリズマブを用いた臨床試験にKEYNOTE-061試験があり、PFS(無増悪生存期間)を確認しています。12ヶ月から4年で増悪しない症例は、スライドのグラフからわかるように15パーセントぐらいです。
逆を言うと、ステージ3、4がメインですが、85パーセントぐらいの方は「ペムブロリズマブ」による治療が効いていないと見ることもできます。効いていない患者さまに対して次に行えるのは、現時点では薬を変えた旧来型の化学療法ぐらいしかありません。
ここに2次治療として「テロメライシン」を入れることで、例えばフォローアップした結果、生存率がさらに伸びるかということをエンドポイントにした臨床試験を行っています。かなりマーケットは大きいところです。
こちらも2023年まで行っていたコーネル大学の別の医師主導治験で「テロメライシン」をペムブロリズマブに追加することにより、脳に転移した遠隔のがんも消失しました。このような症例報告により、今回この試験が企図されました。
今回の臨床試験では、目標ステージ1として13名、ステージ2を含めると27名の被験者登録を行っていき、ステージ1はすでに13名のうち3例の被験者に投与しています。13例の中で1例でもレスポンダーがあれば、ステージ2へ移行してこの試験を完了させる計画です。
試験が全部終わるのは2026年4月の予定ですが、目標の13名の中で多くのレスポンダーが出れば、メルク社と相談して、さらに本格的なPhase3に移行することも考えています。今後の試験に移行できればと思いますが、少なくとも今回臨床試験が開始されたことで、みなさまとのお約束が守れたと考えています。
化学放射線併用療法Phase1試験:患者登録完了

アメリカのNRGグループが、進行性食道がんや胃と食道の接合部がんを対象にした試験を進めてきました。
化学放射線療法に対して「テロメライシン」を上乗せするとどうなるかという試験を行い、Phase1として目標症例15例が登録完了したという報告がありました。
現段階では放射線化学療法と併用しても「テロメライシン」は安全にがんの局所に投与できるという結果が出ています。今後、NRGグループがさまざまな解析を行い、有効性まで出すということになっています。2025年1月から2月頃にアメリカで行われるASCO-GIという学会などで、何らかの報告が行われるのではないかと期待しています。
⑥PSP(進行性核上性麻痺) Phase2a 48週 最終解析データ開示

「OBP601」の結果についてです。もともと抗エイズ薬として開発していたものをアメリカのブラウン大学がいろいろな知見をもとにして検討した結果、「OBP601」は、抗エイズ薬でありながら脳内のレトロトランスポゾンという遺伝子を減らすことがわかりました。
これを臨床で確認するためにTransposon社という会社ができました。当社は2020年に Transposon社へライセンスして、同社はすでにOBP-601の臨床試験をかなり進めています。
タイトルにある進行性核上性麻痺は、脳の神経が炎症性の変化によって分断されることで、パーキンソン病のような症状が出たり、歩いていて突然倒れたり、だんだん認知機能が悪くなってきたりする難病のことです。日本には数千人しか患者さまがいません。
3月の株主総会でお話ししたように、「OBP601」はPSP患者さまの脳脊髄液中のNfLをしっかり上昇抑制しているという試験結果が出ました。炎症性変化のバイオマーカーのインターロイキン6も上昇を抑えていることがわかり、大変プロミシングな結果になりました。7月8日にはFDAと「End of Phase2 Meeting」を実施しています。
その結果、「FDAは非常に前向きにPhase3試験を推奨している」という情報が得られました。ただし、これまでの薬にない結果だったため、Transposon社は、Type Cミーティングを2024年内に開いて、ブレイクスルーセラピーに認定されるようにしたいと考えています。
⑥PSP Phase2a試験 NfLCSF 変化量(48w)
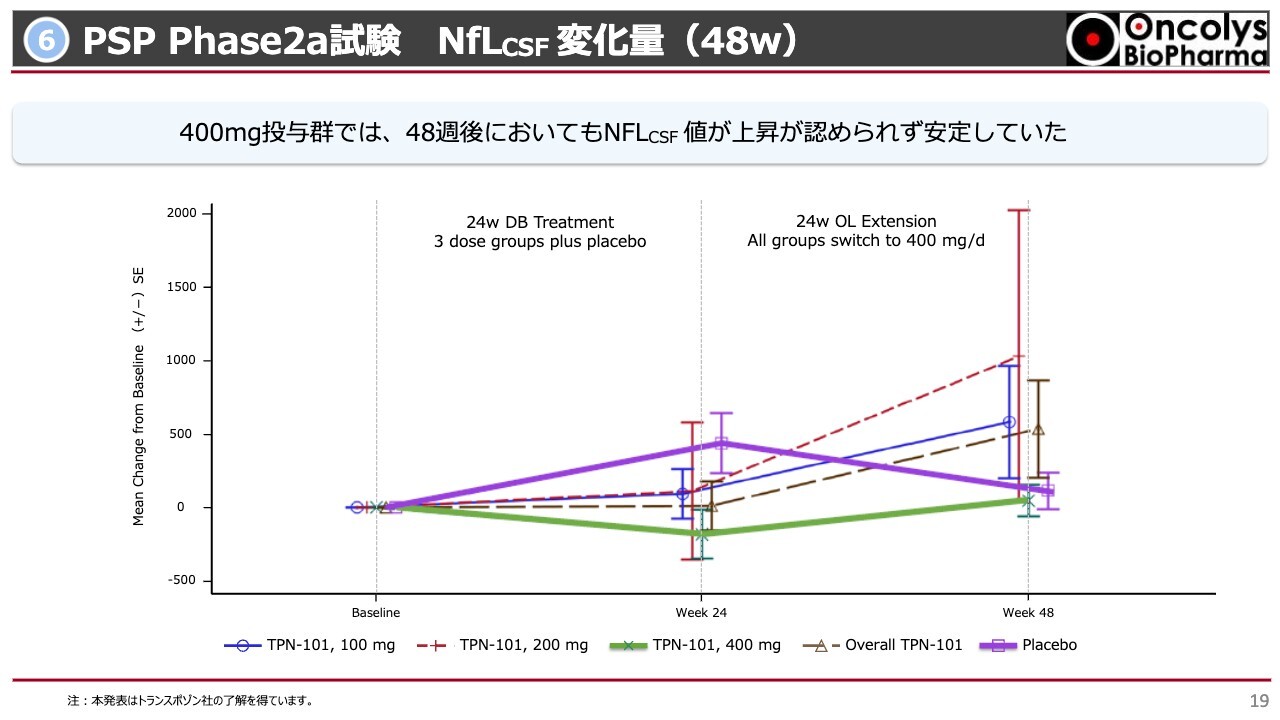
スライドは脳脊髄液中でのNfLの結果です。グラフを見るとまったく変化がないように見えるかもしれませんが、スケールによっては非常に大きな変化が出ています。緑色の線は、400ミリグラムの「OBP601」をずっと投与されたものです。投与前値よりも下がっているという結果が出ました。
紫色の線は、開始から24週の間プラセボ(偽薬)を投与された方です。まったく効き目のないものを投与された方ですが、24週後、全員に「OBP601」を飲ませる措置を行うと、ほとんどの方がきれいにNfLが下がってきました。こちらと同じような現象がNfLだけではなく、インターロイキン6や他のバイオマーカーでも認められました。
この結果に対してFDAが非常にプロミシングな結果だと認めている状況です。
⑦C9-ALS(筋萎縮性側索硬化症) / FTD(前頭側頭型認知症)

C9-ALS(筋萎縮性側索硬化症)とFTD(前頭側頭型の認知症)を対象にした臨床試験も行っています。今回は、C9-ALS、いわゆるALSの中でもC9ORF72という遺伝子変異が見られた方を対象にした群の最終解析が行われました。
結果はスライドに記載してあるとおりで、こちらもプロミシングな結果です。3番、4番にあるようにバイオマーカーは、これまでPSPの結果でも得られたインターロイキン6やNfLといったものがしっかりC9-ALSでも低下していました。
2番目にあるALSの機能スケールを用いた評価では、投与開始から30週間ほど経って進行抑制がクリアに見えてきました。
ALSという病気は、宇宙物理学者のホーキング博士が発症した病気です。あの方もだんだん手や筋肉が動かなくなり、最後は眼の動きでパソコン動かして通話を行っていましたが、その後に何が起こるかというと、呼吸ができなくなります。
今回の試験結果は肺活量を測っていますが、プラセボ(偽薬)を半年間投与した方と比べると、呼吸機能が悪くなる症状を50パーセント以上抑制したというクリアな結果が出ています。
これはかなりFDAにも訴求力のある結果ではないかと考えています。このような結果を受けて、2024年内にTransposon社はPSPと同様に、FDAと「End of Phase2 Meeting」として打ち合わせを行い、Phase3に行きたいという意思をFDAに表明することになっています。この48週の結果も2024年内のパーキンソン病やALSに関する学会で報告することになると思います。みなさまにさらなる詳細をご報告できると考えています。
オンコリスの未来像<テロメライシン>
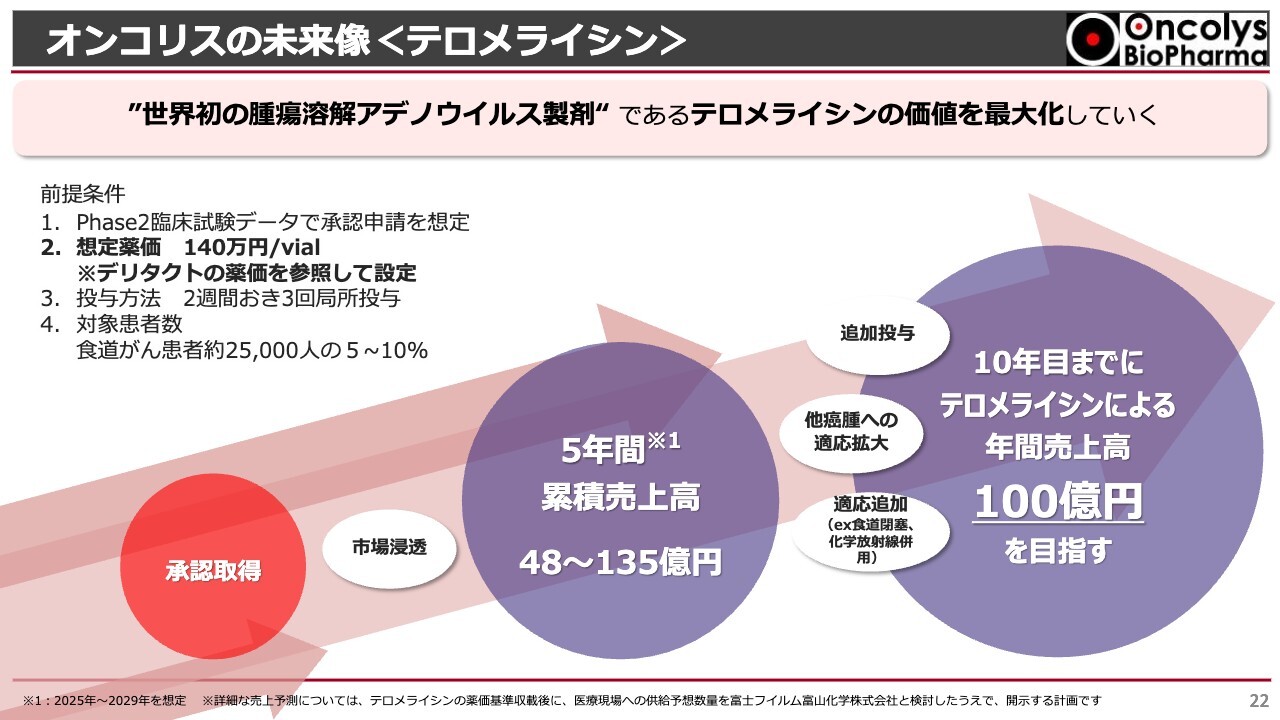
今後のオンコリスについてですが、まずは「テロメライシン」の価値を最大化していきたいと考えています。
我々としては、2024年内に承認申請に足るデータをすべて揃え、すぐに提出できる体制を作っていきます。このようなことを実現できる状況にきています。ただし、承認申請については、PMDAからの意思表示がなければ我々も行えないため、できる限りPMDAと密な話し合いを行い、年内に資料が出せるようにしていきたいと考えています。
「テロメライシン」の承認が取れれば、発売後5年間の累積売上は、非常にコンサバティブに見込んで、だいたい50億円弱です。効能追加や、食道がんを担当している先生方に対してのマーケットへの浸透がうまく進めば、135億円の累積売上が見込まれるのではないかと思います。発売10年目までには、年間売上100億円が安定して見込めるのではないかと考えています。
「テロメライシン」は3回投与ということで、今、1人の患者さまに2週間おきに3回投与というレジメンになっています。当然、この100億円の中には、これを4回、5回投与できるようにしたり、ケモラジ(化学放射線療法)や放射線単独療法を行ってもまだがんが残ってしまった患者さまにも使えるようにしたり、舌がんや歯肉がんといったものに対して効能追加を行えるようにしたりすれば、年間100億円の売上も夢ではないと考えています。
我々は「テロメライシン」の価値を最大化し、それによってオンコリスの価値も上げていきたいと考えています。
今後のシナリオ<OBP-601>

「OBP-601」が、Transposon社を通じてどれだけ価値の最大化を図れるかも大きいところです。
すでに当社は、Transposon社と総額3億ドル、今の為替でいくと450億円程度の条件でライセンス契約が成立しているため、うまくいけばこのようなライセンス料が入ります。あるいは、仮にTransposon社が、大手製薬会社などにこの「OBP-601」をサブライセンスしたり、あるいはM&Aをされたりした場合でも、我々はTransposon社からこの総額3億ドルのライセンス料を受け取ることができるよう、契約に落としこんでいます。
このように、今後Transposon社がどれだけ成長するかは、我々の成長にも大きく関わってきます。
神経難病領域におけるディールサイズ
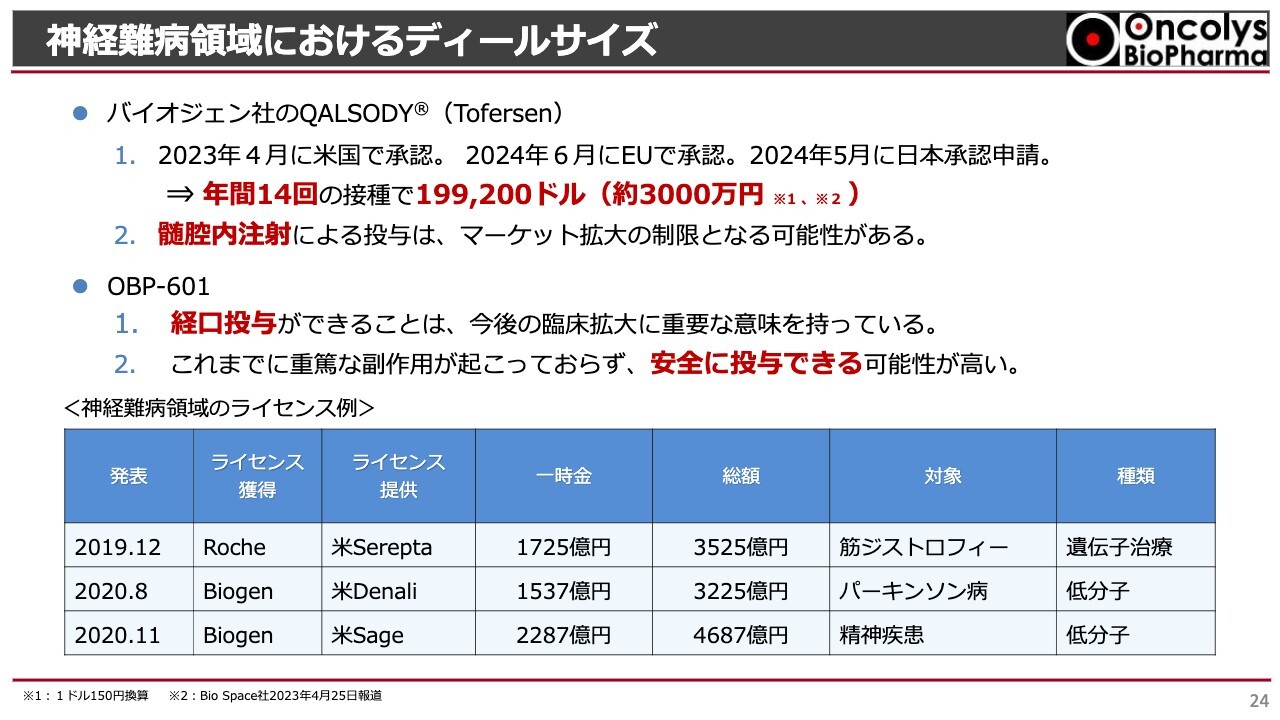
神経難病については、すでにバイオジェンという会社の「Tofersen」(トフェルセン)という薬がアメリカで承認されています。日本ではまだ承認されていませんが、ゆくゆくは承認されると思います。
「Tofersen」は、SOD(スーパーオキシドジスムターゼ)の活性を下げ、RNAを分解するような薬なのですが、1ヶ月に1回程度、注射剤で脊髄内に投与しなければならない薬です。
また、年間14回の接種で、アメリカでは年間3,000万円ぐらいの薬価になる非常に高い薬ですが、他に比較する薬がないため許可になっています。しかも、バイオジェン社はNfLを低下させる結果がメインで承認されています。
我々はすでにそれが実現できているため、これが国内でも承認されれば、経口投与ができるということで、マーケット拡大を非常に行いやすい薬になると期待しています。副作用も、重篤なものはほとんどありませんし、我々が良い結果を出せれば、非常に大きなマーケットを築くことができると思います。
スライドの下部に、近年行われた筋ジストロフィーやパーキンソン病などの神経疾患のライセンス額を載せています。だいたい、Roche社やBiogen社といった大きな会社にベンチャー企業がライセンスを提供していますが、総額3,000億円、あるいは4,000億円を超えるようなライセンス額になっています。我々も、このような大きなライセンス契約の締結をTransposon社に対して期待しています。
ビジョン
当社は研究開発を行い、ライセンスで収入を得るビジネスモデルを今後も維持していきますが、それと同時に、製薬会社としての製造販売体制をより確実に築くことによって、「テロメライシン」だけではなく、将来的には、海外から持ってくる薬、例えばアメリカでは使われていても日本ではまったく使われていないような薬も、販売できる会社になっていきたいと考えています。
今後も、どうかオンコリスバイオファーマに対するご支援、ご指導を賜りたく思います。本日はご清聴ありがとうございました。
質疑応答:「テロメライシン」承認申請のボトルネックについて
司会者:「『テロ
新着ログ
「医薬品」のログ