【QAあり】Delta-Fly Pharma、佳境を迎える臨床試験と新たなパイプラインの開始のため、研究開発費は前期比137%の15.3億円を計上
2024年3月期通期決算の概略
黒滝健一氏(以下、黒滝):Delta-Fly Pharma株式会社取締役管理部門担当の黒滝です。よろしくお願いします。
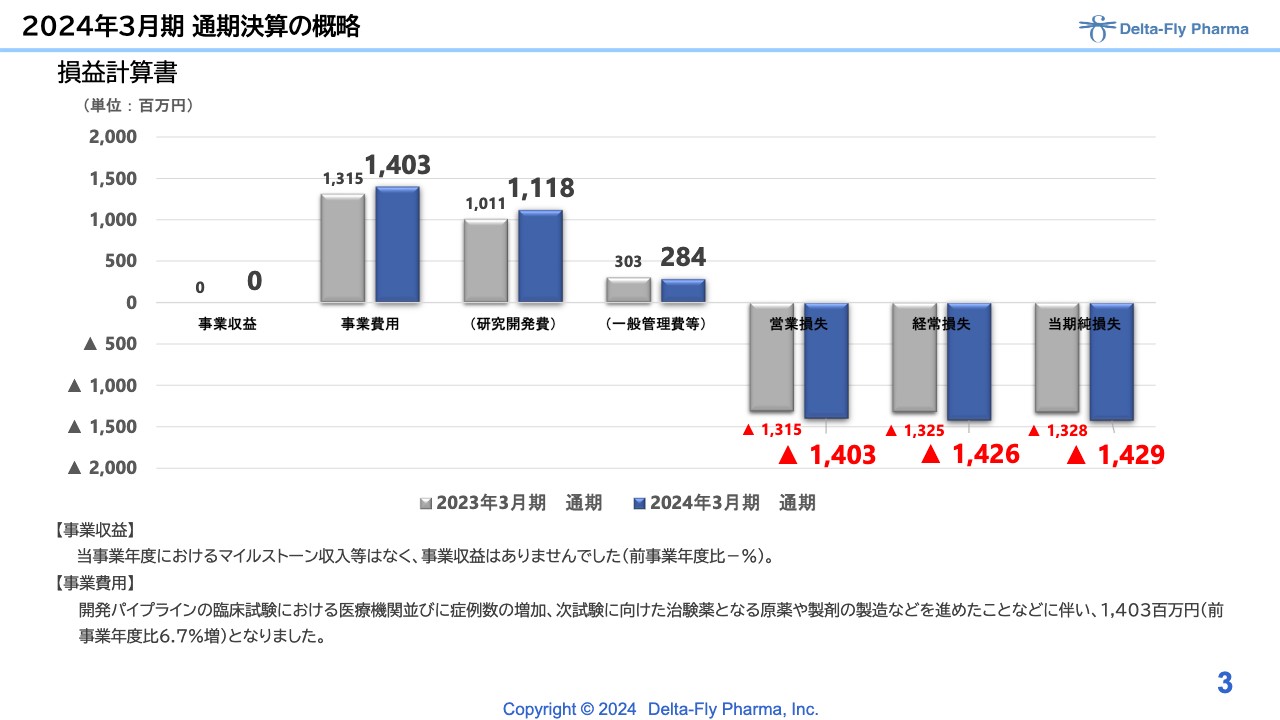
2024年3月期の通期決算と今期2025年3月期の予想についてご説明します。前期は、事業収益はありませんでした。事業費用については計画とほぼ同様の着地となり、約14億円を計上しています。
内訳は、研究開発費で11億1,800万円、一般管理費等で2億8,400万円となり、営業損失、経常損失、当期純損失ともに14億円を超える着地となっています。
費用については、開発パイプラインの臨床試験における、各医療機関並びに症例数の増加と、次試験に向けた治験薬の準備などに使用しました。結果として、前事業年度と比べて6.7パーセント増となっています。
2024年3月期通期決算の概略
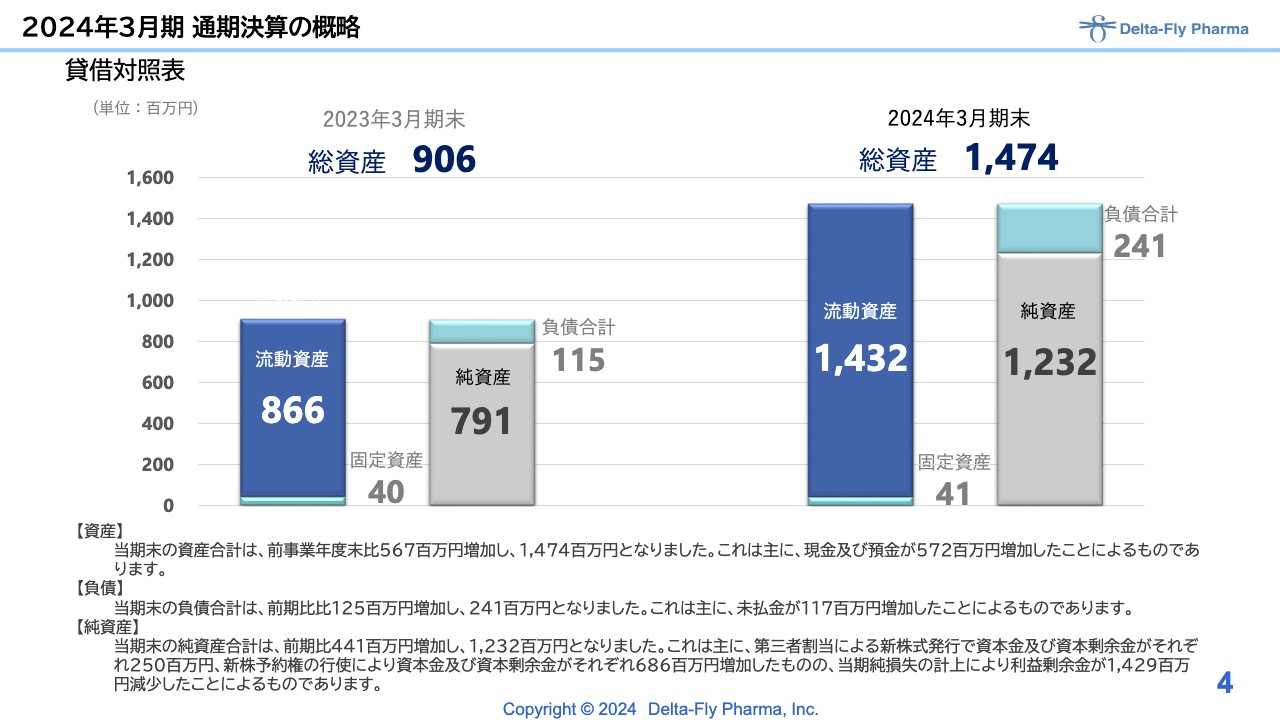
貸借対照表についてです。ご承知のとおり、2023年10月、11月に新株予約権と新株発行を行った関係で、ともに純資産が増加しています。最終着地としては、総資産が14億7,400万円で、純資産は12億3,200万円となっています。
ただし、2023年度に順調に権利行使ができたことにより、比較的短期間での調達が可能となりましたので、こちらを有効に使いながら研究開発を進めていきたいと考えています。
2024年3月期通期決算の概略
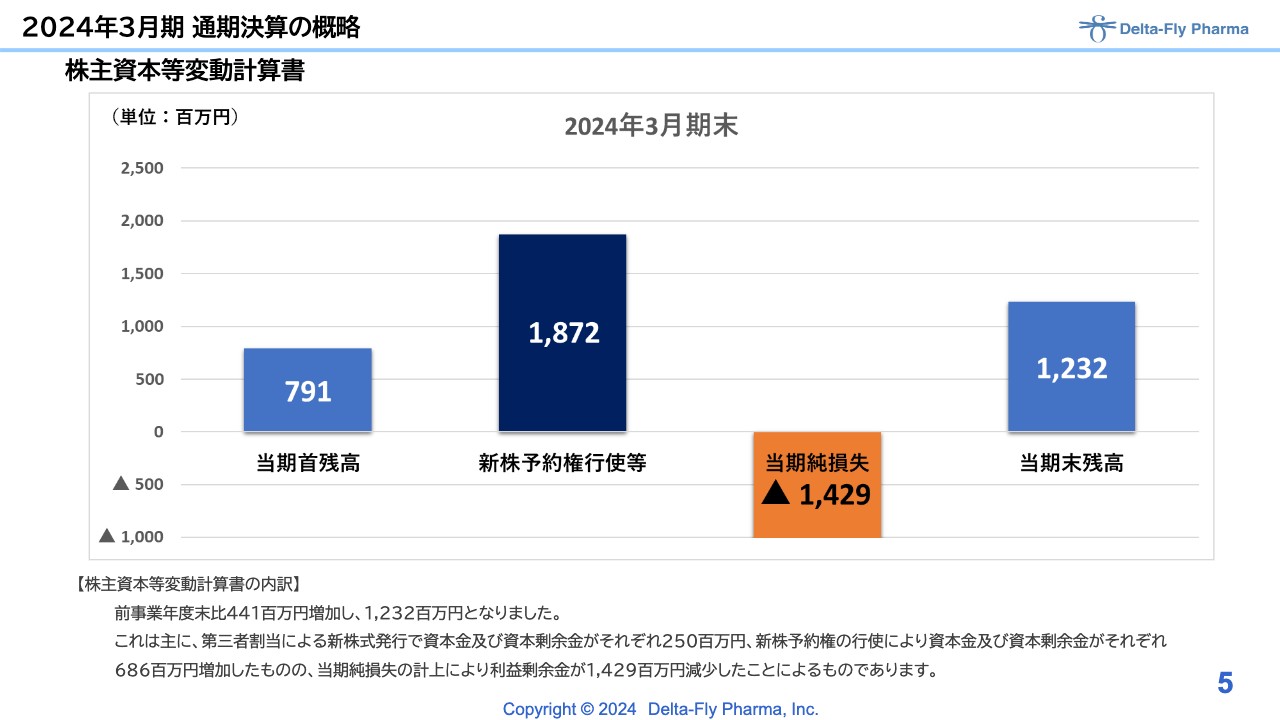
株主資本等変動計算書です。先ほどご説明した新株予約権行使等の増加分と当期純損失分を差し引き、当期末残高は12億3,200万円となりました。
事業計画(2025年3月期予想)
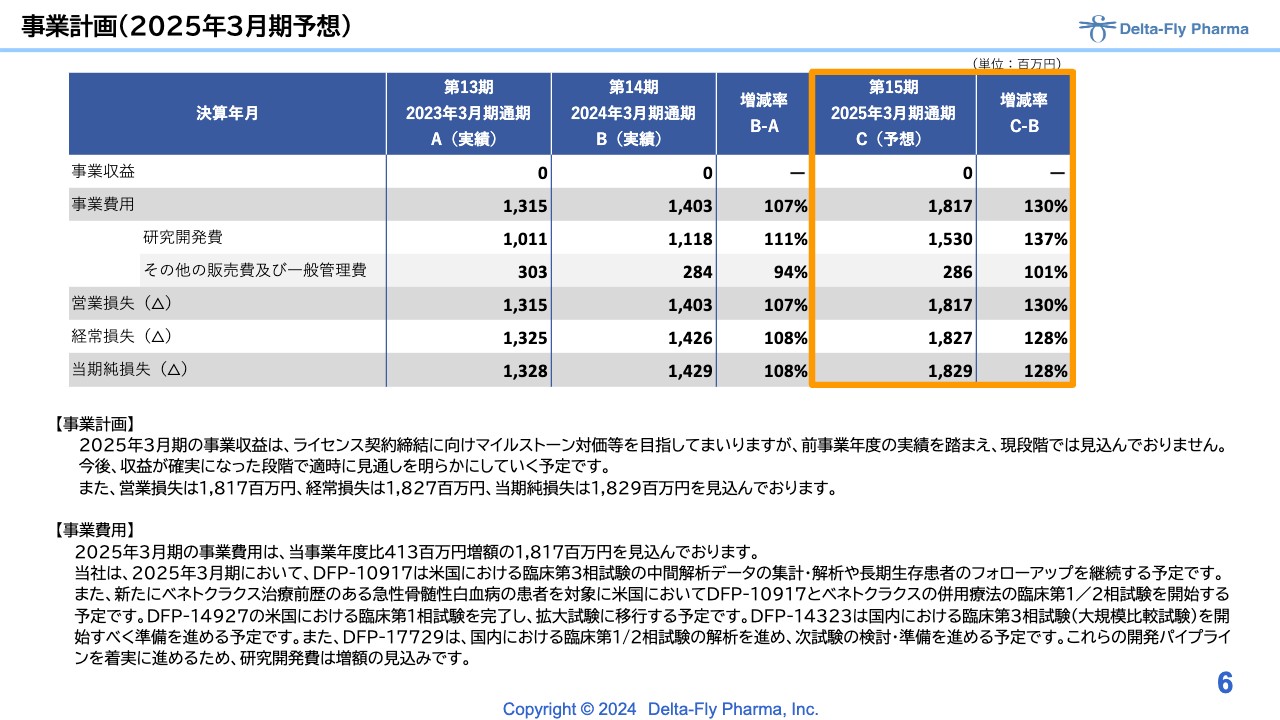
2025年3月期の予想です。現状、今回の事業計画にも昨年同様、事業収益を計上していません。ただし、今後収益が確実になった段階で適時、見通しを変更していくことを考えています。
営業損失、経常損失、当期純損失は、18億円強の営業損失を見込んでいます。事業費用については、臨床試験が佳境になっていることと、後ほど江島からご説明する新しいパイプラインのスタートのため、研究開発費に15億3,000万円を計上する見込みです。
調達資金の充当状況
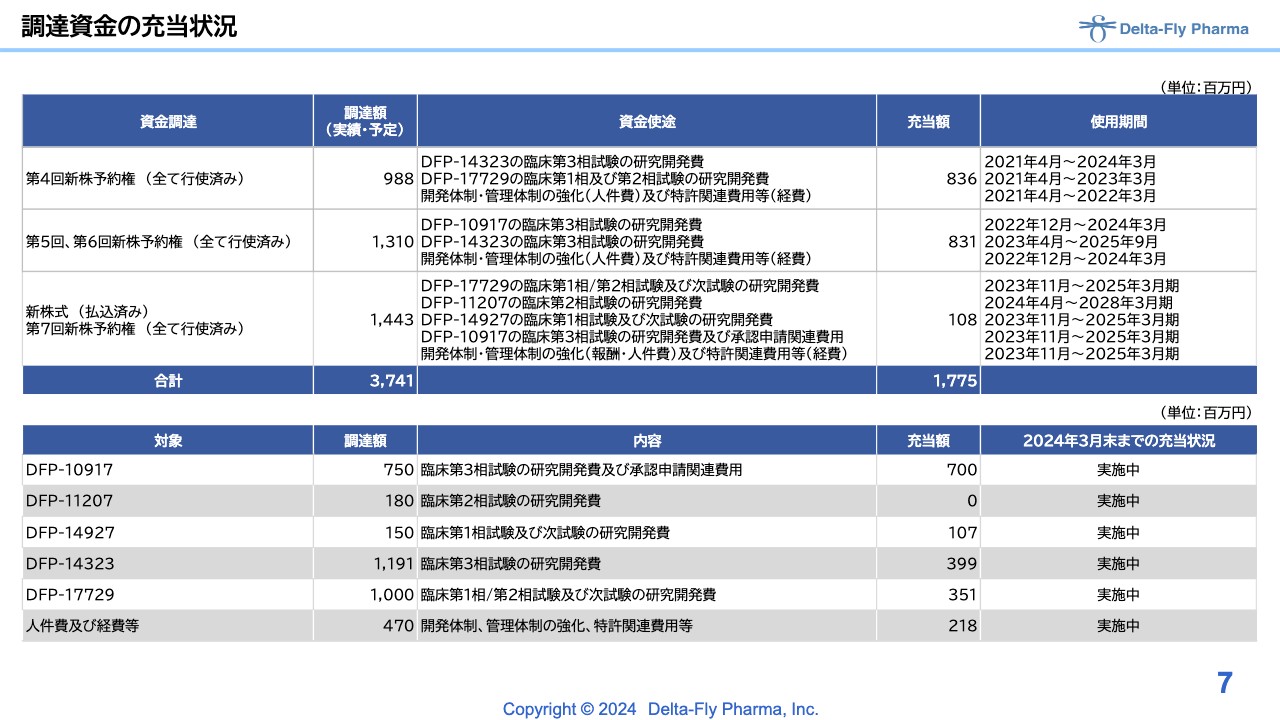
第4回から第7回の新株予約権の権利行使の調達額に対する充当状況です。スライド7ページに記載しているとおり、「DFP-10917」以降は、人件費および経費に調達した額を充当しているため、すべて実施中という状況です。
事業開発投資について
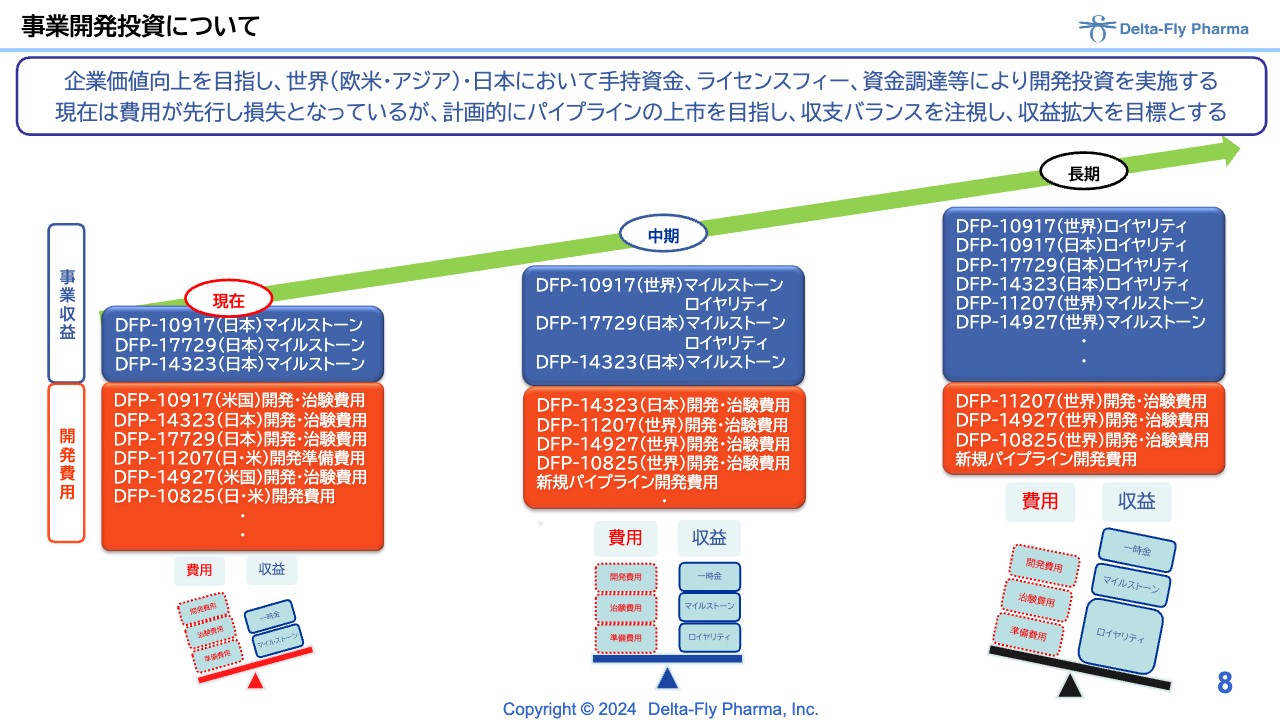
再掲載になりますが、事業開発投資の状況はスライドのとおりです。
開発パイプラインの状況と今後のスケジュール
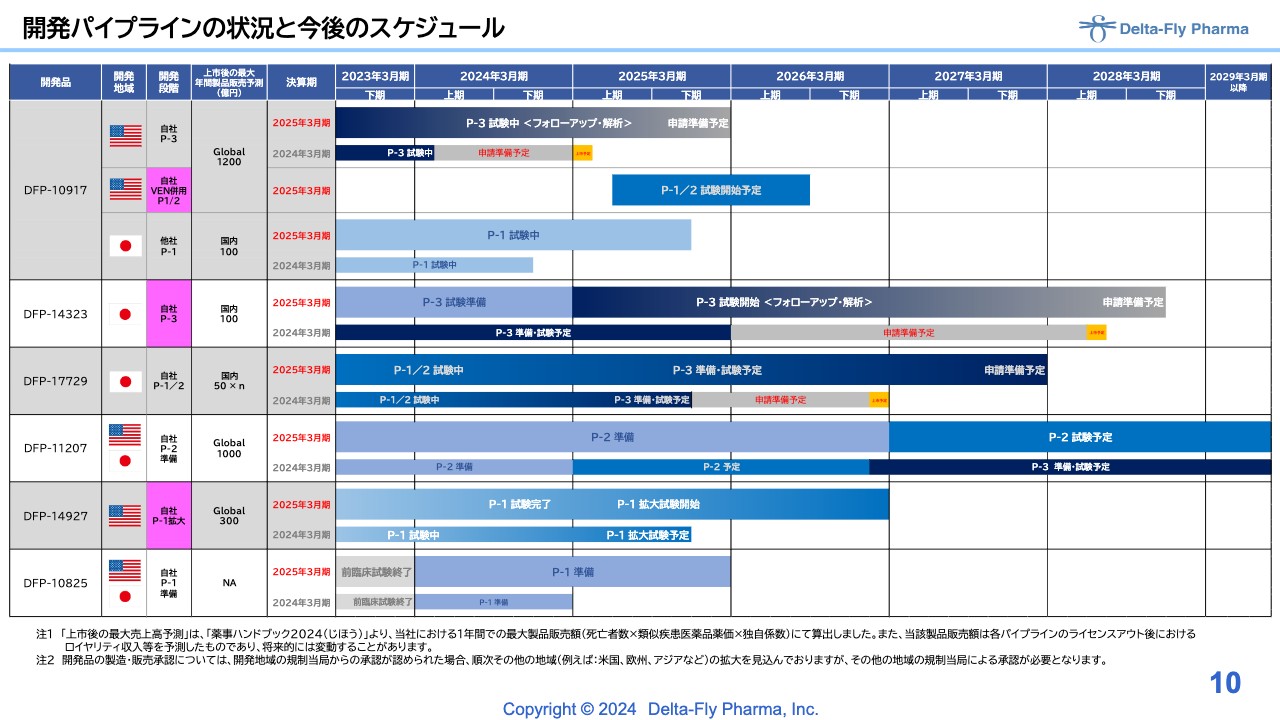
江島淸氏(以下、江島):代表取締役社長の江島です。開発パイプラインの状況と今後のスケジュールについてです。
「DFP-10917」以下、基本的に開発のスケジュールは大きく変えていません。ただし、この症例は延命されている患者さまが多いため、フォローアップ期間と照らし合わせ、いつ頃どのようなかたちで申請できるかについて検討中です。このような表現をしていますが、決して大きく申請時期が延びたということではありません。
後ほど詳しくご説明しますが、新しいパイプラインとして、「DFP-10917」単剤と比べて市場性も大きく期待できる、併用薬の臨床第1相試験/臨床第2相試験を準備しています。近々、症例登録が入りそうな時期に、またご報告する予定です。
スライドにピンクで表している部分が、新しいパイプラインおよび開発段階が新しく変わるところです。「べネトクラクス(VEN)」併用の臨床第1相試験/臨床第2相試験は、急性骨髄白血病の患者さまが対象ですが、ラインが違います。
「DFP-14323」は、独立法人医薬品医療機器総合機構(PMDA)からも臨床第3相試験を実施することを要請されており準備中で、近く臨床第3相試験がスタートする予定です。
「DFP-17729」については、臨床第1相試験、臨床第2相試験の結果解析を慎重に進めていました。次の試験として、スライドには臨床第3相試験と記載していますが、臨床第2相試験/臨床第3相試験になる可能性もあり、その準備を進めています。
「DFP-11207」についても基本的に状況は変わっていませんが、具体的なスケジュールがある程度固まってくる可能性があります。表ですと期間が長いように見えますが、そうではなく、具体化する時期の見通しがある程度立ってきているということです。
「DFP-14927」についてです。「DFP-10917」が持続点滴で2週間ほど患者さまに投薬する必要があるため、「DFP-10917」よりも利便性をもう少し改善するために、「DFP-10917」のDDS製剤として、高分子に「DFP-10917」を付けた品目です。
こちらは臨床第1相試験が終了し、臨床第2相試験、いわゆる拡大試験に入る前の段階です。患者さまの腫瘍を摘出し、腫瘍内にしっかり薬剤が入っているかどうかの確認を終えたところで、次の拡大試験の症例登録が始まっています。
「DFP-10825」については、従来と大きく変わっていませんが、前臨床試験が終了したため、次の展開の準備を鋭意進めているところです。
開発パイプラインの状況と今後のスケジュールの概要
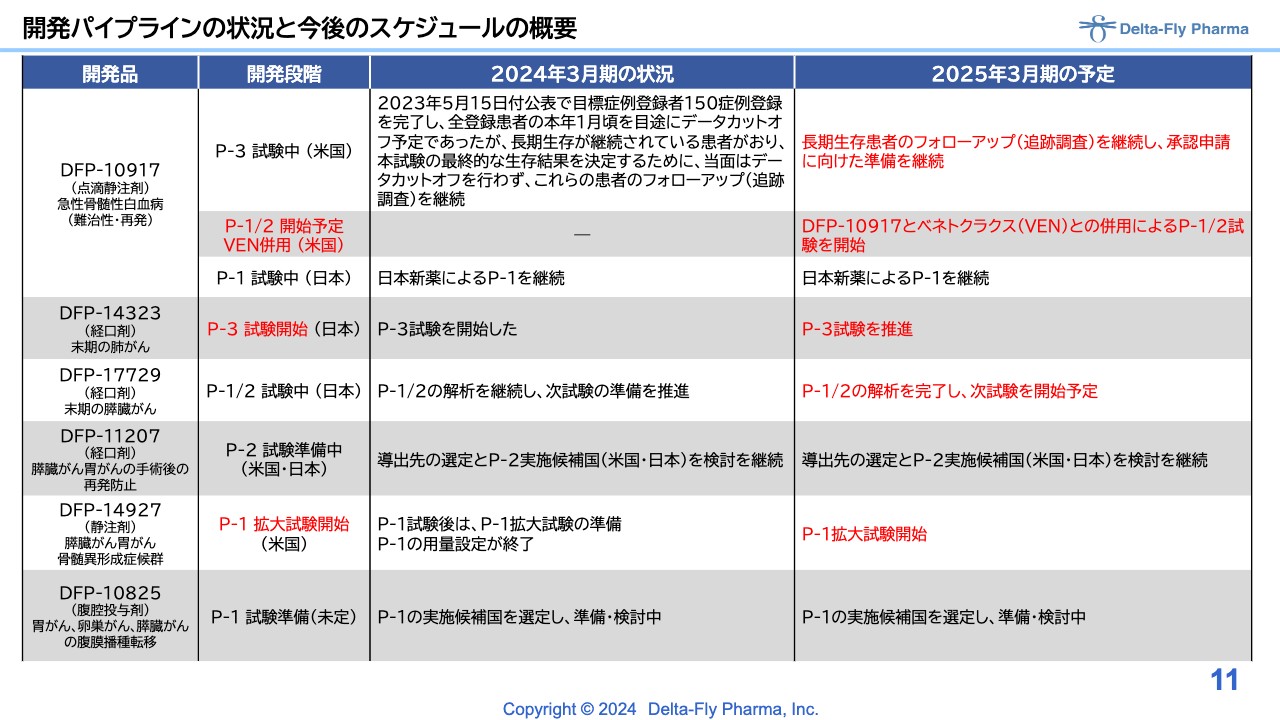
開発パイプラインの時間軸のポイントを、スライドに赤字で表示しています。「DFP-10917」併用薬については、「べネトクラクス」併用の臨床第1相試験/臨床第2相試験を米国で実施するため、準備を進めているところです。この試験も近々スタートすることになります。
一番上に記載した単剤の比較試験については、各方面から「どうなっているのか?」とご説明を求められています。ある程度の患者さまが長く生存されていますが、どちらにどれくらいの生存者がいるかについては、現状、私どももブラインドがかかっており一切見識できておらず、ご報告ができません。今後の解析結果と照らし合わせて申請に向けた準備をしていく予定です。
「DFP-14323」については、臨床第3相試験を実施する段階になりました。
「DFP-17729」については、臨床第1相試験/臨床第2相試験の解析が完了しました。この結果を受けて、次の試験をどのようなかたちで実施するか、臨床第2相試験/臨床第3相試験を行うのか、臨床第3相試験を行うのかについては、当局と相談し始めています。
「DFP-14927」については、臨床第2相試験に相当する、第1相拡大試験を開始しています。
以上が今回の要点です。
研究開発~DFP-10917

「DFP-10917」の進捗状況は従来どおりですが、赤字のところだけが新しくパイプラインとして追加したところです。
DFP-10917~米国における急性骨髄性白血病の状況
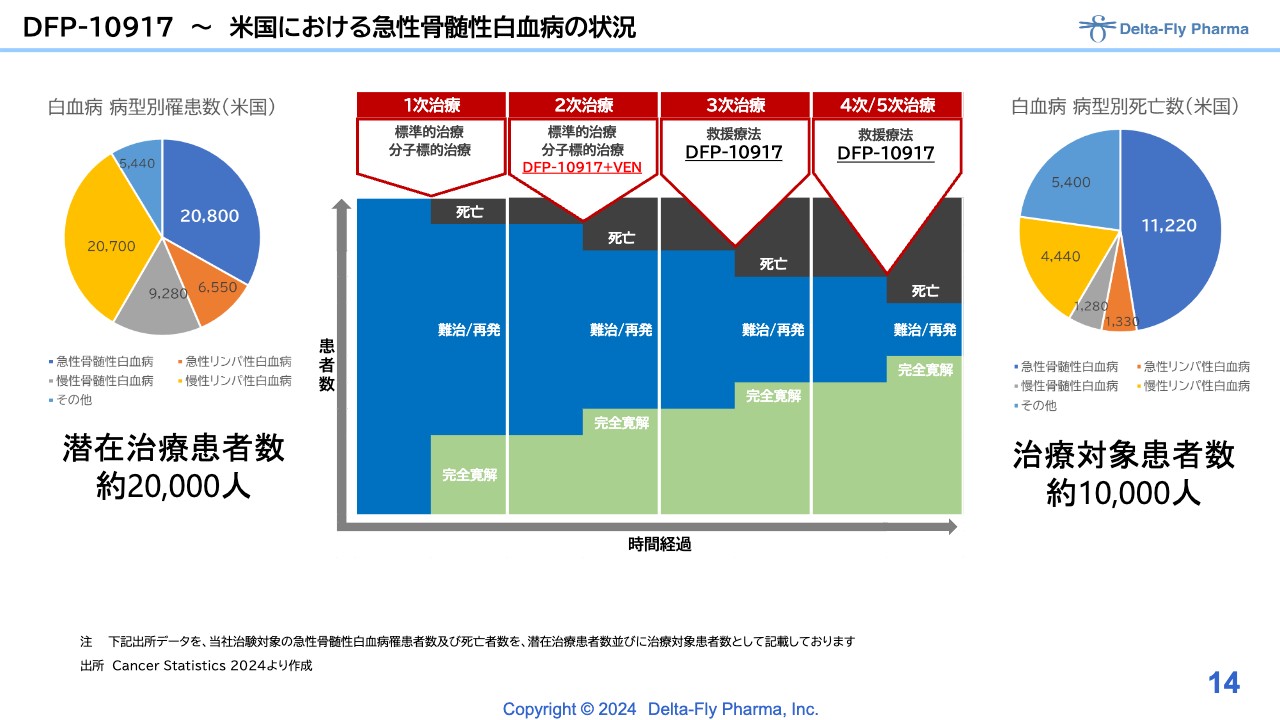
「DFP-10917」は従来の単剤で承認が取れた場合、つまり適用が3次治療、4次治療と、いわゆるエンドステージの患者さまを対象とする結果が出た場合は、その患者さまを対象にして市場導入する予定です。
それに加えて、なぜ「DFP-10917」と「べネトクラクス」の併用試験を実施することになったか言いますと、「DFP-10917」単剤のフォローアップ期間が伸びてきているためです。こちらはある意味で良い情報だと考えています。
本来は「DFP-10917」のデータがはっきりしてから、「DFP-10917」と「べネトクラクス」の併用を実施する予定でしたが、フォローアップ期間が伸びている間なにもせずにいるより、せっかくの機会を上手く活用し、次の展開を含めて実施したほうがよいと考えました。
「DFP-10917」と「べネトクラクス」は、急性骨髄性白血病の患者さまが対象がであることは同じですが、治療段階が違います。臨床第3相試験も考えてはいますが、「DFP-10917」と「べネトクラクス」の臨床第1相試験/臨床第2相試験の結果が良ければ、2次治療以降すべて適用できる見通しです。
DFP-10917の臨床第3相比較試験の症例登録完了に関するお知らせ

2024年1月30日にプレスリリースした「『DFP-10917』の臨床第3相比較試験の中間解析状況に関するお知らせ」です。先ほどもご説明したとおり、中間解析の対象となる150名の患者さまのうち、ある程度の患者さまが長期生存されています。
そのため、基本的にはデータカットオフをするよりも、慎重を期して延命効果を検証し、フォローアップを続けた上で、OSと呼ばれる延命効果を検証するデータを提出する予定です。
ただし、繰り返しのお伝えとなりますが、無作為の比較試験であるため、どちらの群がどのように延命しているのかについては、私どももまったくわかっていません。蓋を開ける時期を適切に判断し、その結果をもって当局と相談を始める予定です。
DFP-10917の臨床第3相比較試験の症例登録完了に関するお知らせ
「ベネトクラクス」は、急性骨髄性白血病の患者さまへの基本的な治療薬です。今回の「DFP-10917」併用薬の臨床試験の目的は、この基本的な治療薬への上乗せ効果があるか、また、その安全性はどのような状況になるかの検証です。
現在、急性骨髄性白血病の標準療法として承認されているのは「アザシチジン」と「ベネトクラクス」の併用療法です。臨床第1相試験/臨床第2相試験の結果により、「DFP-10917」と「ベネトクラクス」の併用は効果と安全性に優れた結果が期待できるのであれば、「アザシチジン」と「ベネトクラクス」の併用療法を凌駕する可能性があるため、それを見極めるために早く実施しようとスタートしています。
本試験については、「DFP-10917」単剤の臨床第3相試験にもご参加いただき、急性骨髄性白血病の治療剤の開発にかなり長けているWake Forest大学のほか、現時点は5施設程度での実施を予定しています。
研究開発~DFP-14323
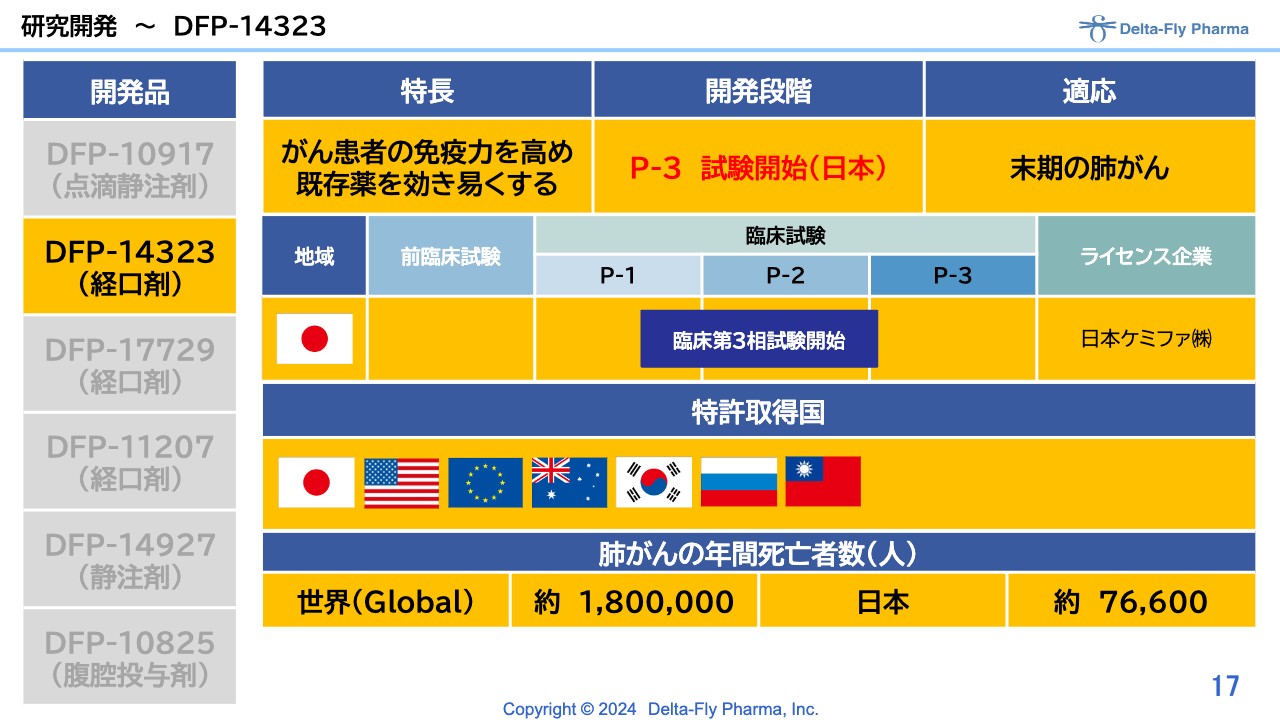
「DFP-14323」については、臨床第3相試験を開始しています。
DFP-14323 日本における肺がんの状況
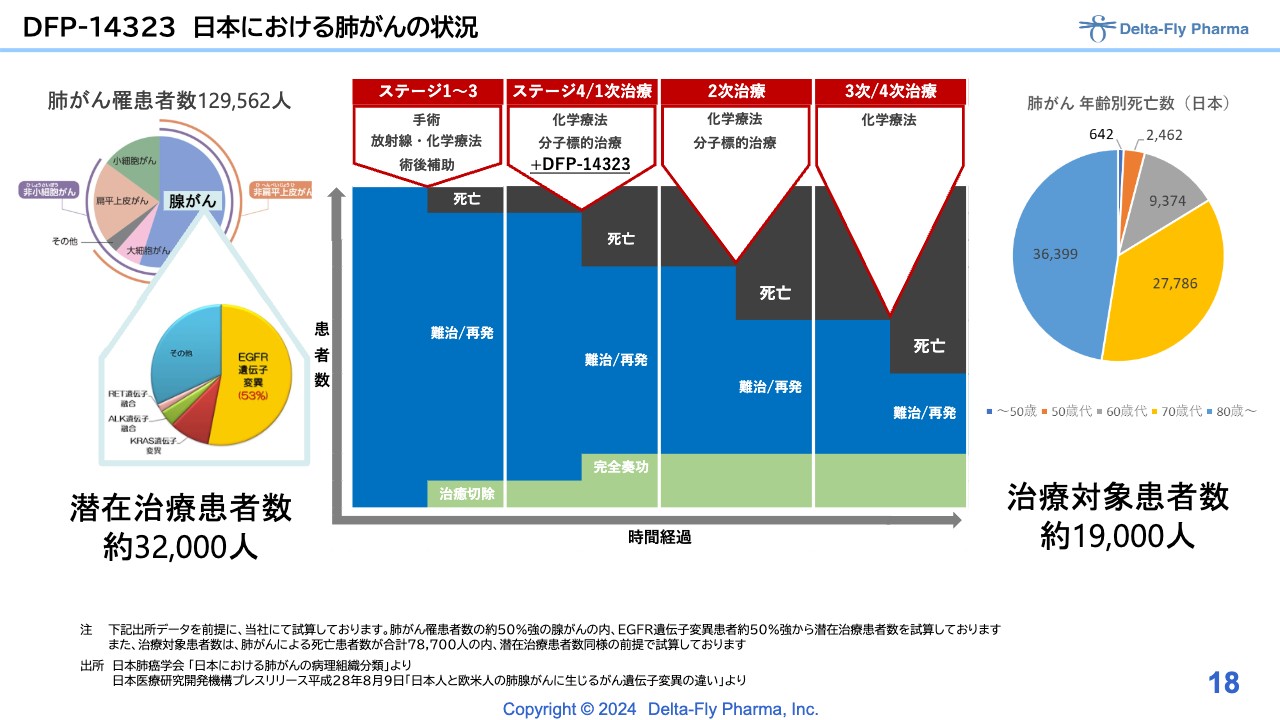
ステージ4は、肺がんの進行がんの中でも患者数が非常に多いステージです。「DFP-14323」ではこの治療ステージを対象に、臨床第3相試験をスタートさせるところです。
DFP-14323の臨床第3相比較試験の開始に関するお知らせ

2024年2月2日に「『DFP-14323』の臨床第3相試験の開始に関するお知らせ」としてプレスリリースを出しました。PMDAから、臨床第3相試験を実施する要請があったという内容です。
臨床第2相試験の結果が極めて良好だったため、条件付き承認をいただけないかと、約1年かけて当局に交渉していました。誠に残念ながら、最終的に臨床第3相試験として比較試験を実施してほしいと要請されました。その準備に何ヶ月かかかりましたが、ようやく開始できる状況になりました。
この臨床第3相試験も大規模試験です。日本国内の30施設で実施するため、大半の施設の先生方に実施の了解を得ているところです。エンドポイントは、無増悪生存期間のPFSです。
このPFSで生存期間の延長が認められれば、「DFP-14323」の上乗せ効果が検証できることになり、「DFP-14323」の位置づけがしっかりと説明できる状況になります。最近「オプジーボ」も含めてがんの免疫療法剤が脚光を浴びていますが、経口剤での開発は私どもが初めて行うものです。
研究開発~DFP-14323の米国臨床腫瘍学会(ASCO)2022の年次報告会で発表

「DFP-14323」の結果は、非常に良いものでした。延命効果が非常に良く、PFSの中央値が23.1ヶ月と既存の薬剤と比べてもかなり優れたデータであるため、昨年度、米国臨床腫瘍学会(ASCO)で発表しました。
研究開発~DFP-17729
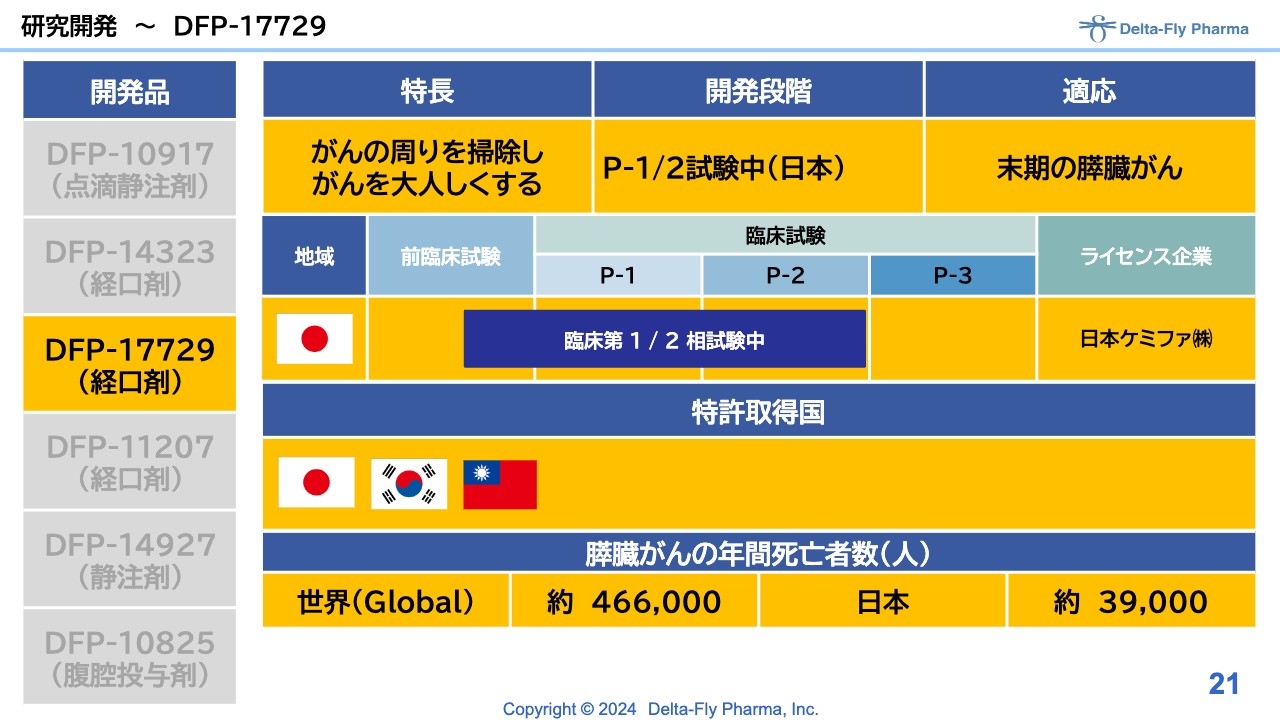
「DFP-17729」の状況については、特に変わっていません。スライドには「P-1/2試験中(日本)」と記載していますが、スタートし次第、表現を変更する予定です。
研究開発~DFP-17729 日本における膵臓がんの状況
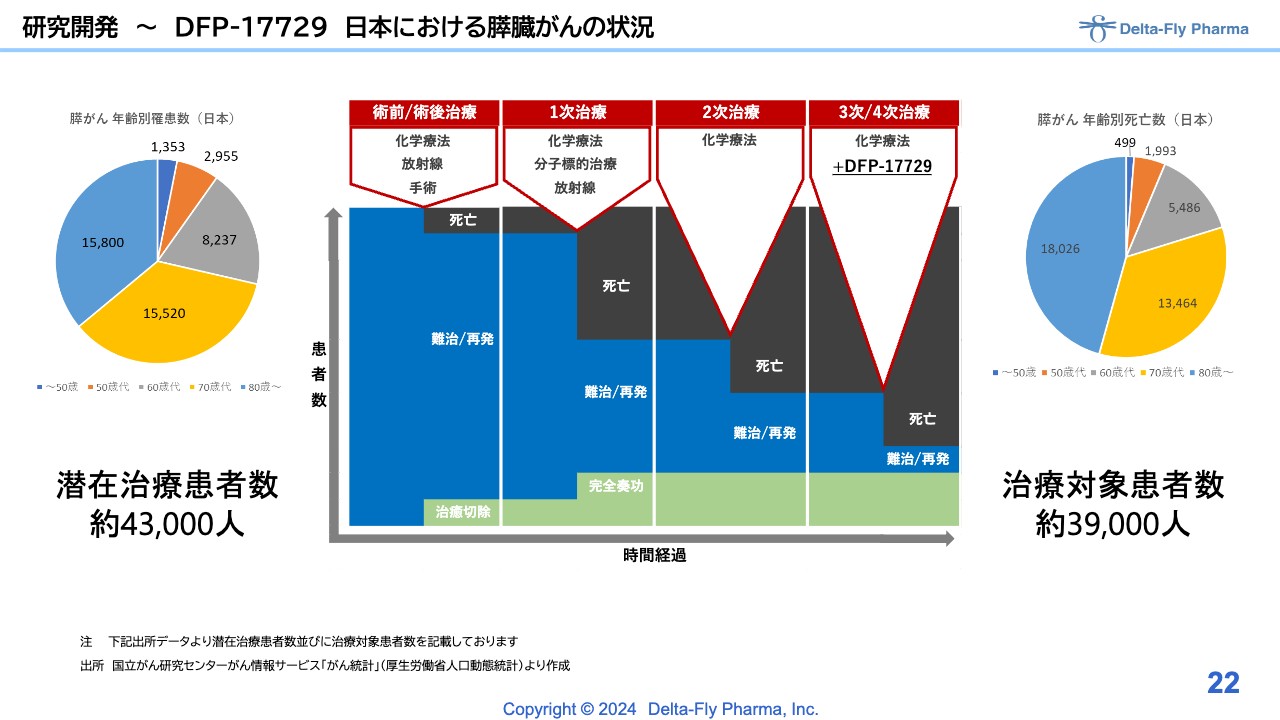
「DFP-17729」は、膵臓がんに関するものです。スライド右側の円グラフをご覧のとおり、昨今は高齢化に伴い、高齢の患者さまがかなり増えてきており、その中でも膵がんの患者さまは非常に多くなってきました。
「DFP-17729」の対象は3次/4次治療ですが、かなりの患者さまがおられます。スライドに人数を記載していますが、この層をターゲットに臨床第2相試験/臨床第3相試験、または臨床第3相試験を実施する予定です。
DFP-17729の基礎試験における抗腫瘍効果薬学系雑誌「Biol Pharm Bull」に掲載
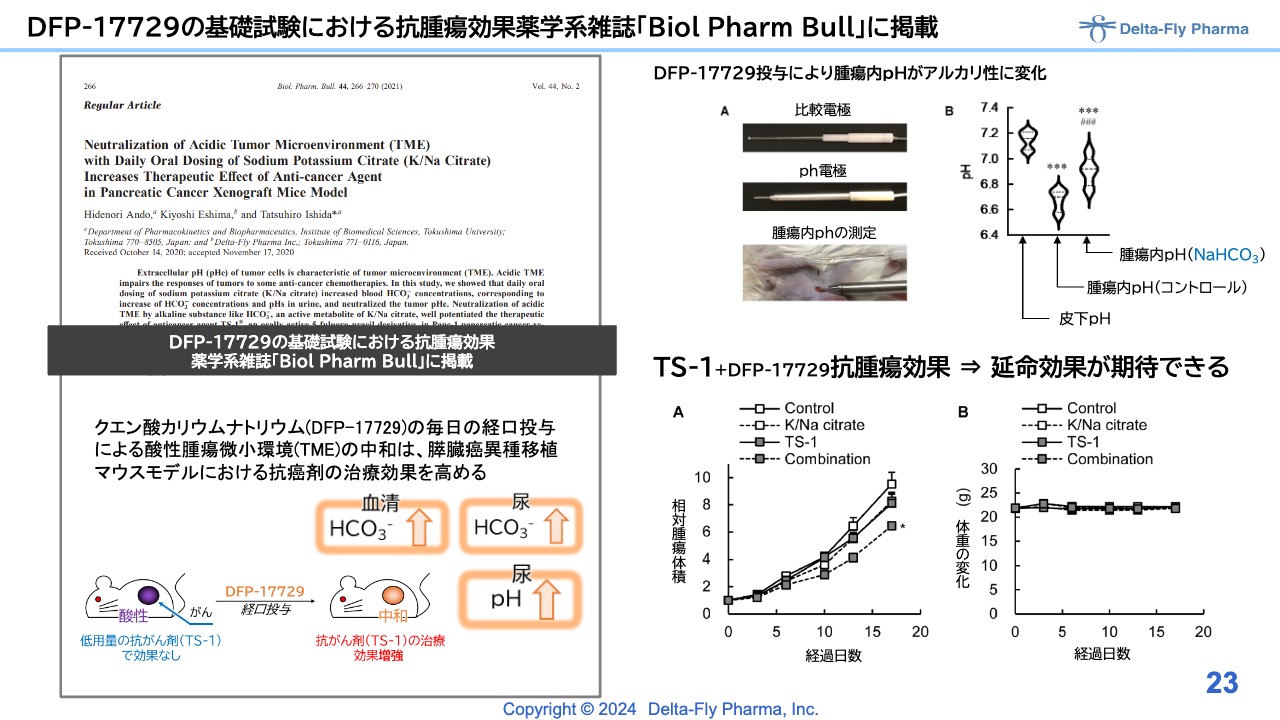
「DFP-17729」の基礎的な背景については、以前にもご説明したとおり、動物実験でもしっかりと裏付けが取れています。論文も投稿し、アクセプトされています。
研究開発~DFP-11207

「DFP-11207」は製造のほか、どの国でどのようながん種で実施するかなどについて時間を頂戴していますが、ある程度方向性が定まり始めています。
研究開発 ~DFP-11207 日本における膵臓がんの状況
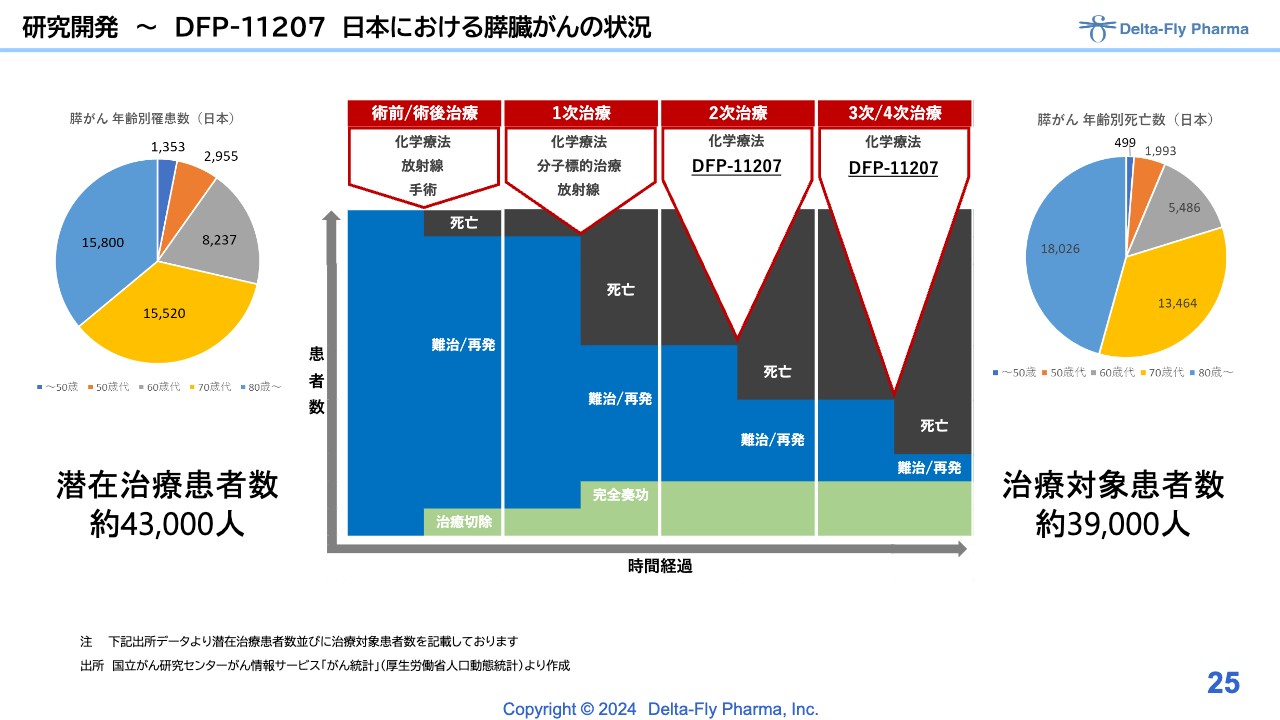
「DFP-11207」については、米国では消化器がんを対象に臨床第1相試験を実施しました。先ほどもお話ししたとおり、日本国内では膵臓がんの患者さまを対象に、2次治療から3次/4次治療に対する治療薬として開発を行う予定です。
研究開発~DFP-11207の臨床第1相試験での安全性確認
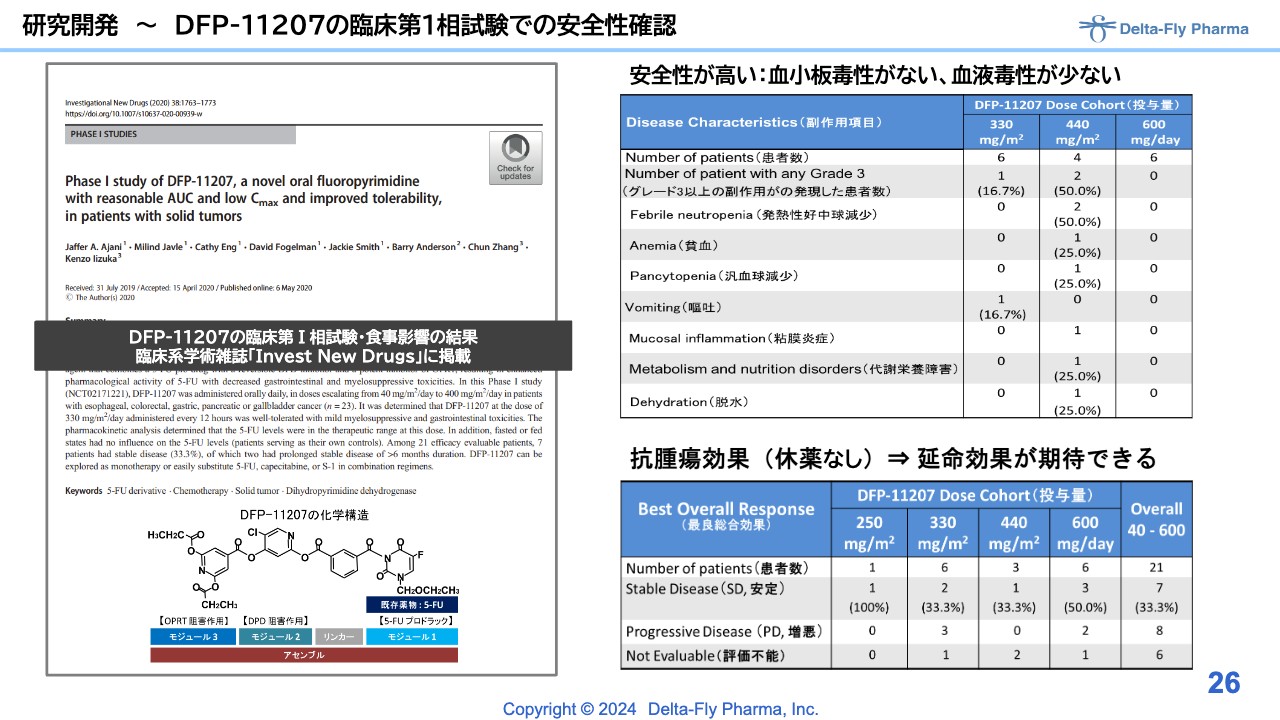
スライドは米国で実施した臨床第1相試験の結果です。すでにご報告していますのでご説明は割愛します。この結果は論文化もされています。
研究開発~DFP-14927

「DFP-14927」については、臨床第1相試験の拡大試験の開始に至りました。この臨床第1相拡大試験が臨床前期第2相試験とは何が違うかと言いますと、時間や手間暇のかかり方です。
通常は臨床第1相試験が終了した段階で当局と都度相談をする必要性がありますが、今回は「拡大試験」という表現を取り、臨床第1相試験が終わり次第、すぐに拡大試験に入れるよう準備してきました。ようやく、この拡大試験の症例登録が始まりかけたところです。
DFP-14927の基礎試験における抗腫瘍効果欧州の薬理系科学雑誌「Eur J Pharmacol」に掲載
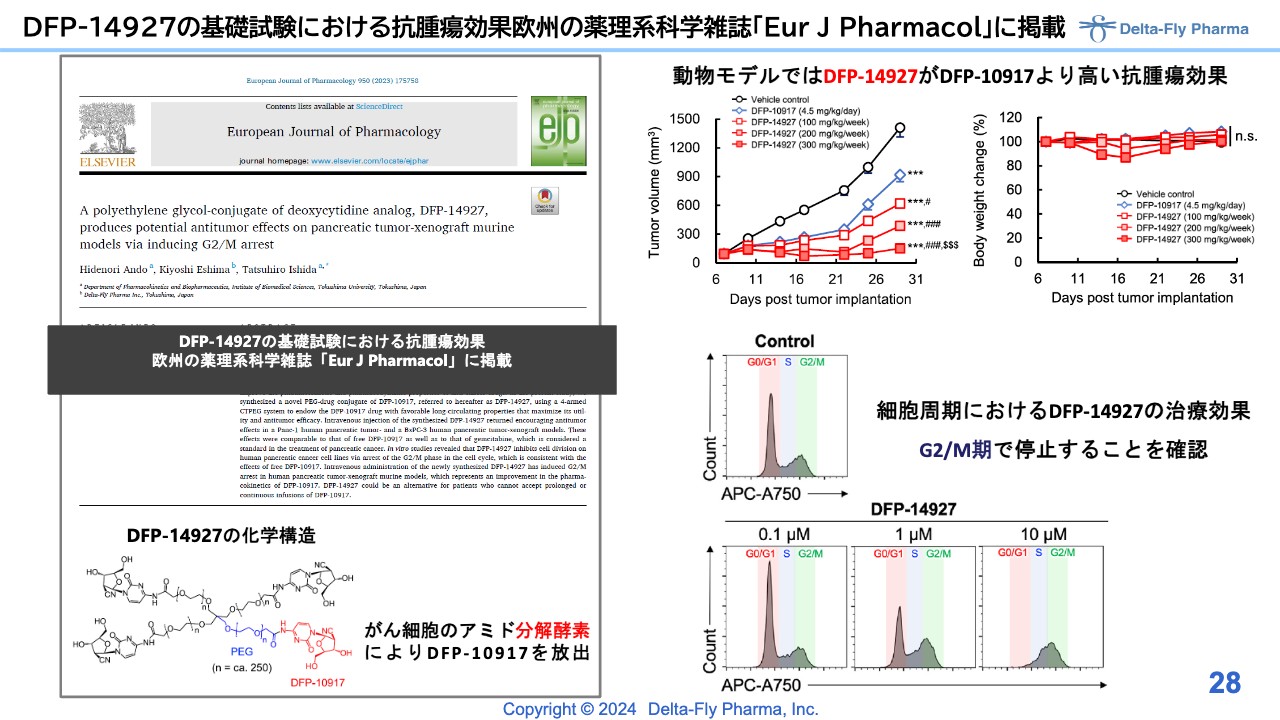
「DFP-14927」についても、基礎的なプロファイルはすでに論文化されています。米国や欧州で抗体と抗がん剤を結合させたものが脚光を浴びていますが、スライド左下に記載した構造式をご覧のとおり、それに取って代わるような医薬品としての可能性を検討しています。動物試験の結果と細胞レベルの結果で予想どおりの結果が出ています。
研究開発~DFP-10825
「DFP-10825」については、胃がん・卵巣がん、膵臓がんの患者さまのうち、腹膜播種転移の患者さまを対象に、臨床第1相試験を実施します。日本国内、または米国で実施すべきかについては、現在関係者と相談中です。
DFP-10825のRNA干渉による抗腫瘍効果の総説薬学系雑誌「Adv Drug Delivery Rev」に掲載
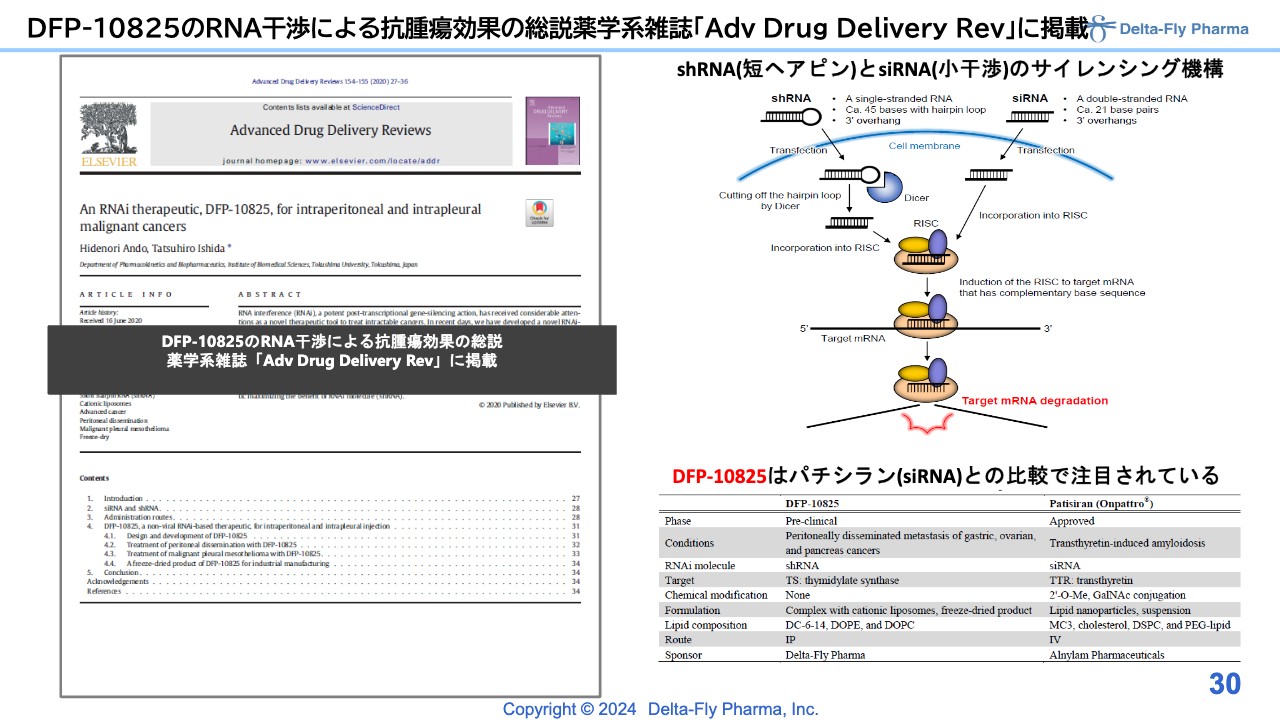
「DFP-10825」は、RNA干渉による抗がん効果を示すことができる薬剤ですが、いくつかの雑誌に論文を投稿し、アクセプトされています。メカニズムについては、この場では割愛します。
開発パイプラインの状況は以上のとおりです。ご清聴ありがとうございました。
質疑応答:「DFP-17729」の今後の予定について

質問者:「DFP-17729」の次の試験について、臨床第2相試験/臨床第3相試験なのか、臨床第3相試験なのかといったデザインはまだ固まっていないようですが、いずれにしても「次の試験を開始予定」と記載されています。
決算短信や資料の他のページでは「解析の準備」や「次試験の準備」などとあり、表現がまちまちです。2025年3月期中に次の試験に入る可能性が高いと見てよいのでしょうか? それとも、まだわからないというのが実際のところなのでしょうか?
江島:基本的には、可能性がなければこのような表現はしません。臨床第2相試験/臨床第3相試験ないしは臨床第3相試験となるのかは当局と相談する事象ですので、クリアカットな表現ができませんが、いつからどのような格好で実施するかについては、当局と相談の上、みなさまにご報告します。
質問者:今期の研究開発費が増えていますが、その要因は「DFP-17729」の部分を予算としてある程度織り込んでいるためでしょうか? スケジューリングを確認したいというのが、質問の1つの意図なのですが、その点はいかがでしょうか?
江島:ご推察のとおりです。資金を用意していなければ、当局から「すぐにできますよ」と言われた場合でも研究できませんので、そのようにご理解いただければと思います。
質問者:黒滝取締役にも確認したいのですが、こちらの予算は研究開発費に入っていますか?

黒滝:はい、入っています。スライドの10ページの中央あたり、2025年3月期のところをご覧ください。「DFP-10917」から「DFP-10825」まで、そちらに記載のあるものについては、研究開発費に盛り込んだもの・最大化したものとお考えいただければと思います。
質疑応答:事業収益の可能性について

質問者:事業収益がゼロだというのはリーズナブルでよくわかりますが、どのような可能性があるのかを確認したいです。
例えば、以前からお話しされている、ニードプログラムの「DFP-10917」は、米国で第3相試験を行っており、これから申請の予定が近づいていますが、その導出交渉による一時金の可能性はあるのでしょうか?
また、日本ケミファさまと一緒に行っているプロジェクトは2つとも次の試験に入った、あるいは入る予定となっていますが、このあたりのマイルストーンはいかがでしょうか? 収益のところの可能性のお話を、交渉も含めてお聞きしたいです。
黒滝:導出に関して言うと、今ご指摘があったとおり、「DFP-10917」単剤の臨床第3相試験の件は、昨年から各製薬メーカーと接触しながら交渉を続けている状況で、今OSのフォローアップ中です。このデータが出てきたら、かなり高い確度で上がってくると思っています。
ただし、相手があるお話ですし、私どもとしてもデータをまだ確認できていない状況ですので、事業収益については今回もなしということです。先ほどご説明したとおり、確定し次第修正をかける方法をとっていきます。
また、「DFP-14323」「DFP-17729」については、「DFP-10917」の日本新薬さまも含めて、契約の中身は非公開です。なにか確定した進展があればマイルストーンが入り、売上に計上していく予定になっていますので、その段階で公表したいと考えています。
質疑応答:「DFP-17729」の試験結果の公表時期について
質問者:「DFP-17729」の臨床第1相試験/臨床第2相試験の結果はいつ頃公表されるのでしょうか?

江島:計画どおり進めば、こちらに表現しているとおりにデータが出てくる見通しです。
質問者:つまり、今年度のわりと早い時期に出てくるということですか?
江島:そのつもりでがんばっています。
質問者:三次治療ですと普通、OSは3ヶ月くらいしかないところ、本試験では顕著に伸びているという結果が出てくるのを期待すればよいということでしょうか?
江島:おっしゃるとおりです。
質疑応答:「DFP-10917」の試験について

質問者:今度始まる「DFP-10917」併用薬の試験についてです。比較対象になるのは「アザシチジン」と「ベネトクラクス」の標準療法であって、分子標的薬と比較するわけではないということでしょうか?
江島:急性骨髄性白血病の患者さまには分子標的薬も適用とはなっていますが、やはり市場が限定されています。そのような面では、「ベネトクラクス」も分子標的薬剤ですが、これには殺細胞効果もあり、広くカバーするには「ベネトクラクス」との併用が一番よいだろうと考えています。
「ベネトクラクス」は現在、「アザシチジン」という薬剤との併用でかなりの臨床試験が進んでおり、結果が出ています。したがってこちらを標準療法とみなし、将来的にはそれとの比較試験を実施する必要性があります。臨床第1相試験/臨床第2相試験を実施するのは、そのような見通しを早く見極めるためだとご理解いただければと思います。
質疑応答:「DFP-14323」の試験について
質問者:「DFP-14323」の臨床試験のサイトを見ますと、臨床第2相試験と臨床第3相試験で患者さまが異なるかと思います。臨床第3相試験ではアンコモン型の変異の方だと思いますが、「DFP-14323」の非臨床データなどはアンコモン型で確認されているのでしょうか?
江島:臨床第2相試験はコモンミューテーションの患者さまを対象に実施しました。このコモンミューテーションのバックグラウンドとして「オシメルチニブ」との比較試験を実施する必要性がありました。
先ほど提示したとおり、臨床第2相試験の結果はすこぶる良く、私どもの治療後のほうがかなり良いデータではありましたが、残念ながらその有意差を検証するには1,000例以上の大規模試験を実施する必要性があり、当局にも「こんなことはできません」というお話をしました。
しかし、「とにかく比較試験をしてほしい」ということでしたので、やむなくアンコモン型を選びました。アンコモン型であるEGFRミューテーションの患者さまを対象にして優越性検証を行うということで当局にもご了解いただき、すでに今この試験を進める直前になっています。
質疑応答:2025年3月期のデータ公表予定について
質問者:2025年3月期に学会でデータなどの公表を予定しているものは、「DFP-10917」だと米国血液学会(ASH)なのかと思いますが、それ以外でなにかありましたら教えていただきたいです。
江島:今のところまだ予定はしていませんが、そのような可能性が出てきた時点で必要に応じて公表します。
質疑応答:「DFP-14927」の拡大試験における提携について

質問者:「DFP-14927」は今後拡大試験に入ると思いますが、これは特に他社と提携するのではなく、あくまでも御社が単独でスポンサーとして行うのでしょうか?
江島:比較試験ではなく、単剤の臨床第2相試験に相当する拡大試験で、症例登録が始まっているところです。基本的には、現状では単独で実施しています。
質疑応答:「DFP-11207」の試験における提携について

質問者:「DFP-11207」の臨床第2相試験を米国ではなく日本で行う場合には、国内の製薬メーカーとの提携・パートナーリングのようなかたちで行う可能性がかなり高いのでしょうか? それとも、今の内容とみなさまの手応えから言いますと、必ずしもそうではないのでしょうか?
江島:提携先が見えてきたということではありません。
この薬剤は最終的に、消化器がんのかなりひどい範囲に使うものとして許可を得るもので、市場も大きい薬剤です。
バーをクリアするため、たとえ小規模の市場であったとしてもリスクの高い、膵臓がんの患者さまを対象に、今のところ日本国内で実施する予定にしています。
ただし、ほかのがん種であれば海外でも別のストーリーが描けます。とりあえず今のところは、「日本国内で実施した場合はこのようになります」ということで表現しました。
質問者:日本国内のパートナーリングが関係するため国内で行うという意味ではないということでしょうか?
江島:おっしゃるとおりです。
新着ログ
「医薬品」のログ





