Delta-Fly Pharma、第三者割当による新株式と新株予約権を発行、調達資金で新薬研究・臨床試験等の進展を目指す
2024年3月期 第2四半期決算の概要
黒滝健一氏:それでは、2024年3月期第2四半期の決算についてご説明します。
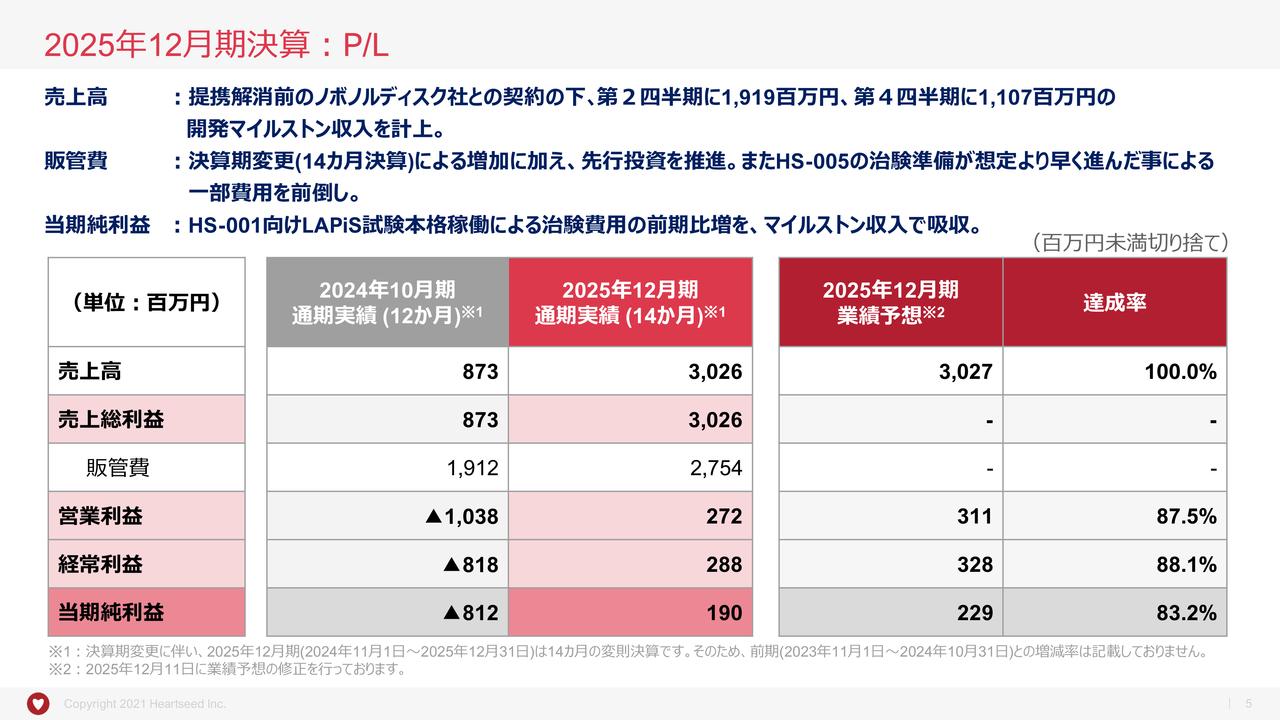
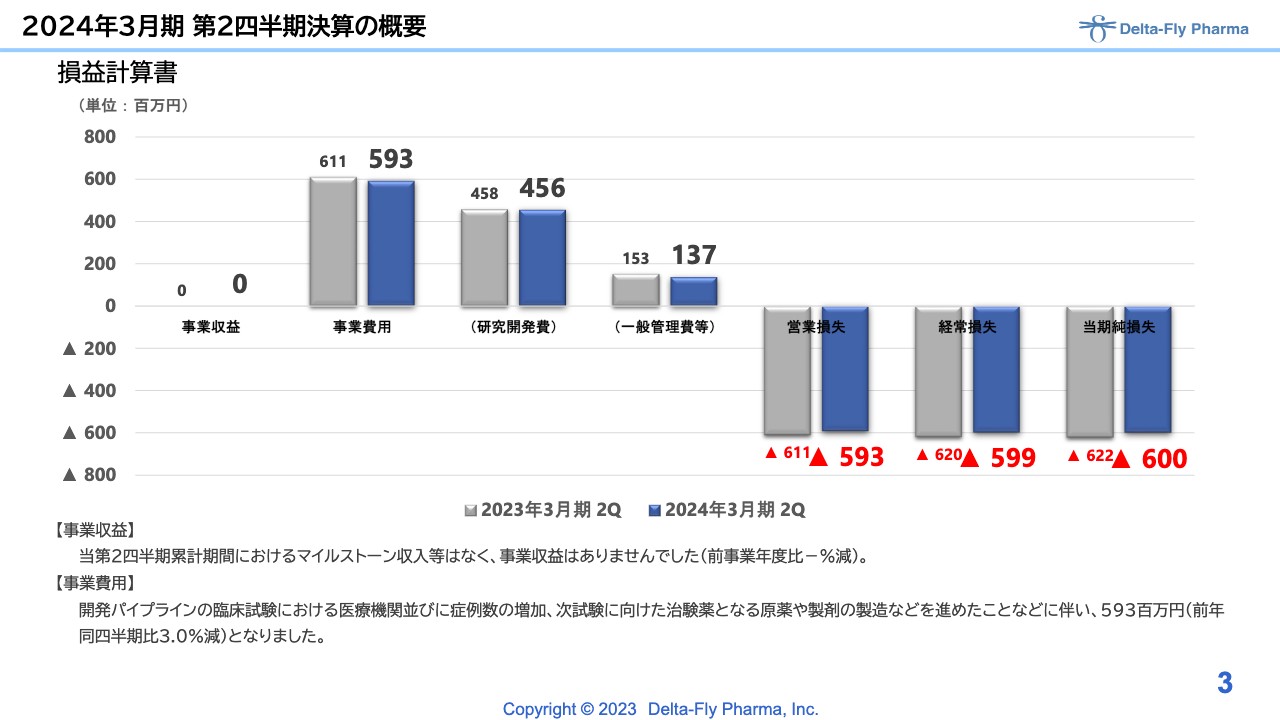
まずは、損益計算書です。当社の当期第2四半期累計期間は、5月15日に発表した短信での予想と同様で収益はありませんでした。ただし、全体的に昨年の第2四半期と同じように事業費用や研究開発費、一般管理費が推移し、最終的な営業損失は5億9,300万円、当期純損失は6億円で着地しています。
こちらは、各開発のパイプラインの臨床試験における症例数増加、次試験に向けた治験薬原薬、製剤の製造などを進めてきたことが背景となっています。
2024年3月期 第2四半期決算の概要
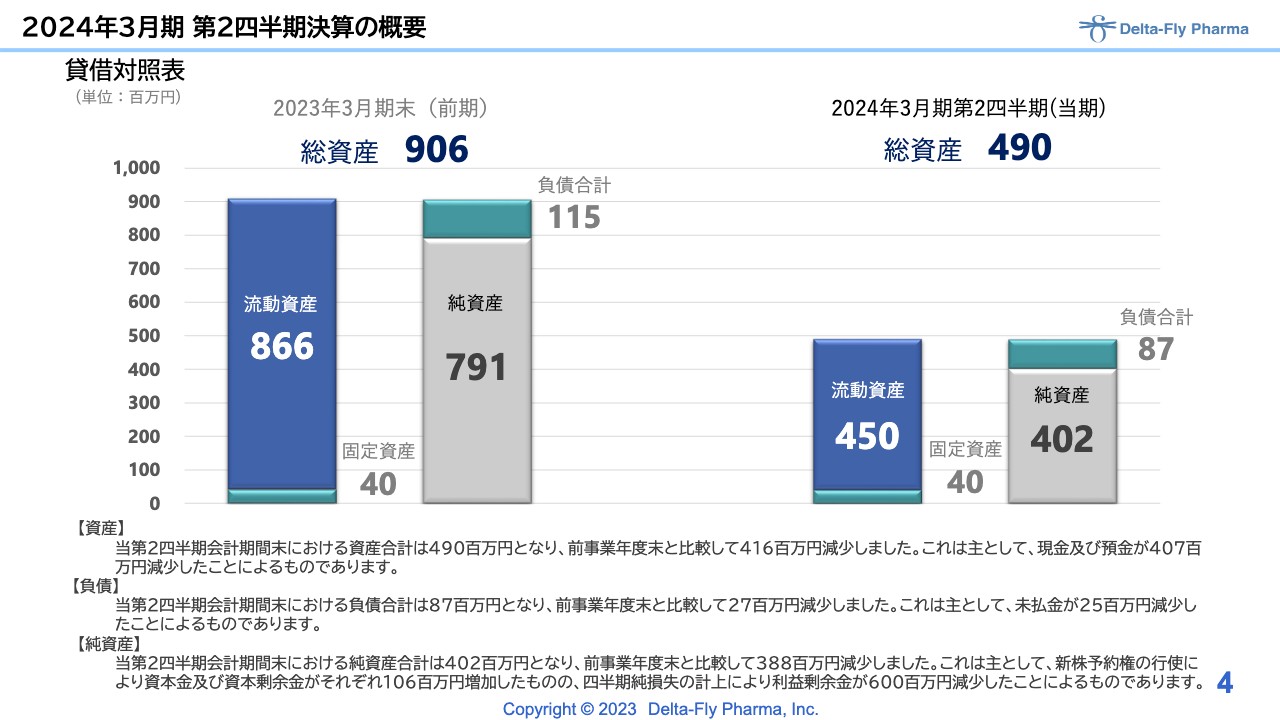
貸借対照表についてです。第2四半期は、2023年3月期末(前期)と比較して約4億1,600万円減少しました。
主な内容として、現預金の減少が4億円強あります。こちらは損益計算書に記載のとおり、開発資金に充当したものとお考えいただければと思います。
負債も、純資産のほうで純損失部分が欠損金額として計上されているため、減少している状況です。
事業計画(2024年3月期第2四半期実績の状況)
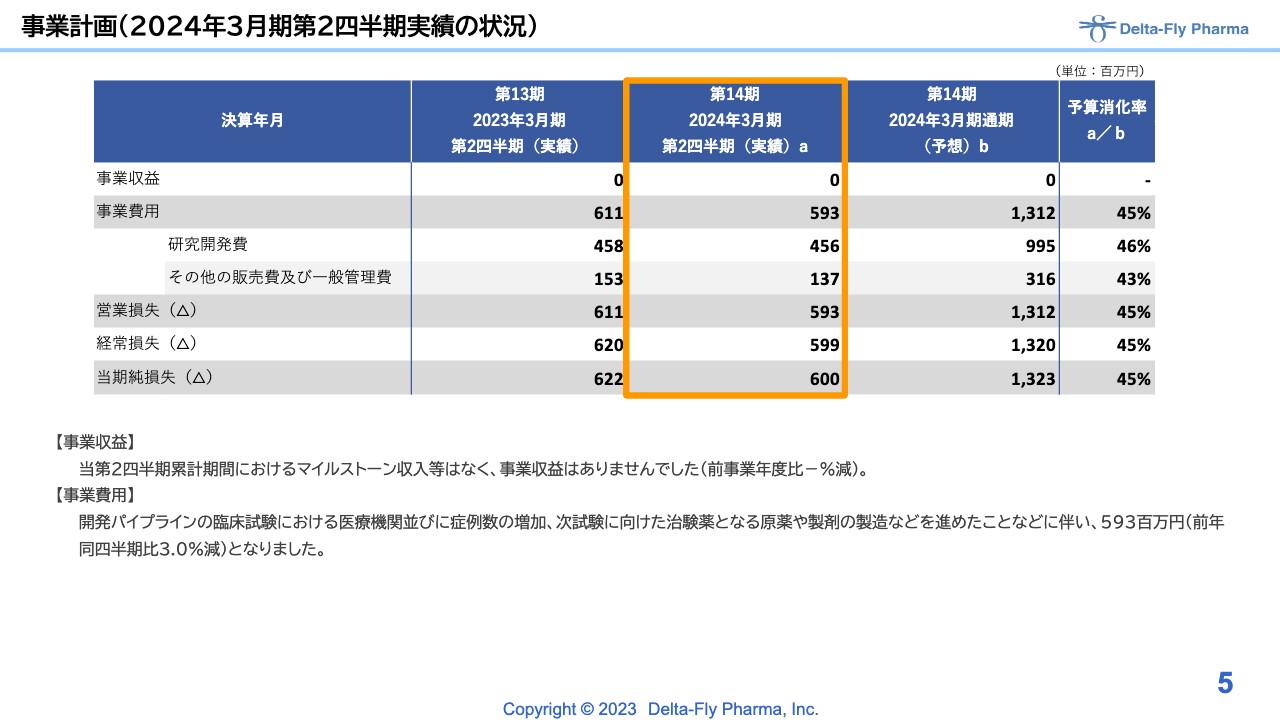
こちらのスライドは、前期の第2四半期と比較した実績の状況です。特段大きな動き はないとお考えいただければと思います。
事業計画(2024年3月期予想)
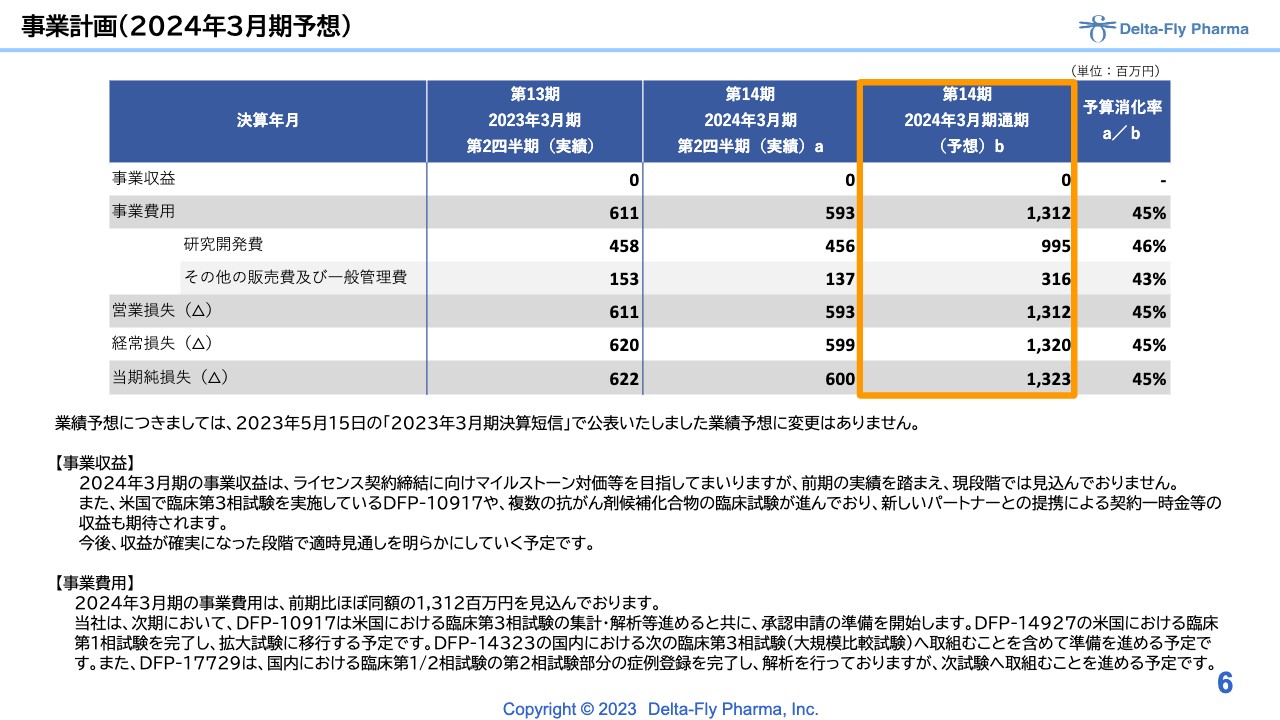
今期の予想については、5月15日の決算短信で公表した業績予想に変更はありません。
今期の予算消化率は45パーセント前後で推移しており、計画どおり開発にいろいろな費用が充当され、消化されています。
第三者割当による株式及び行使価額修正条項付第7回新株予約権の発行について

こちらは後発事象となるため、すでにご承知のことと存じますが、10月20日に発行決議して、第三者割当による新株式と新株予約権を発行しています。
目的は2つあり、第一義は財務の安定確保、もう1つは資金調達です。研究開発の実現に向けて、今回は新株式発行と新株予約権を組み合わせた資金調達を実施しました。
新株式発行については、日本ケミファ株式会社を第三者割当の引受先とし、5億円で発行しました。払い込みは無事に完了しており、効力が発生しています。
新株予約権については、マッコーリー・キャピタルバンク宛に発行しています。こちらも、今週13日から権利行使が開始されています。13日及び14日で、割り当ての全個数の行使が完了している状況です。
第三者割当による株式及び行使価額修正条項付第7回新株予約権の発行について

こちらのスライドには、新株式発行の内容を記載しています。最終的に5億8,600円を払い込んでいただいています。
第三者割当による株式及び行使価額修正条項付第7回新株予約権の発行について

新株予約権については、当初の発行価格は747円でしたが、最終的には13日と14日に1万800個すべてが権利行使されています。こちらは、後発事象に掲載します。
第三者割当による株式及び行使価額修正条項付第7回新株予約権の発行について

今回の資金使途です。「DFP-17729」の膵臓がんの国内臨床試験資金として6億5,000万円、第2相試験の準備段階にあった「DFP-11207」の開発資金として1億8,000万円ほど調達しています。
「DFP-14927」はアメリカでの第1相試験がほぼ完了しているため、次の試験に向けた研究開発資金として1億5,000万円を調達しました。
また、現在アメリカで第3相試験を行っている「DFP-10917」の開発資金及び承認申請に向けた関連費用として1億5,000万円、その他開発体制・管理体制の強化、特許の開発費用等に1億6,600万円を振り分けています。
最終的に調達した金額は若干上振れていますが、資金使途について変更はないと考えています。
調達資金の充当状況・予定(今回の調達を加算した充当状況)
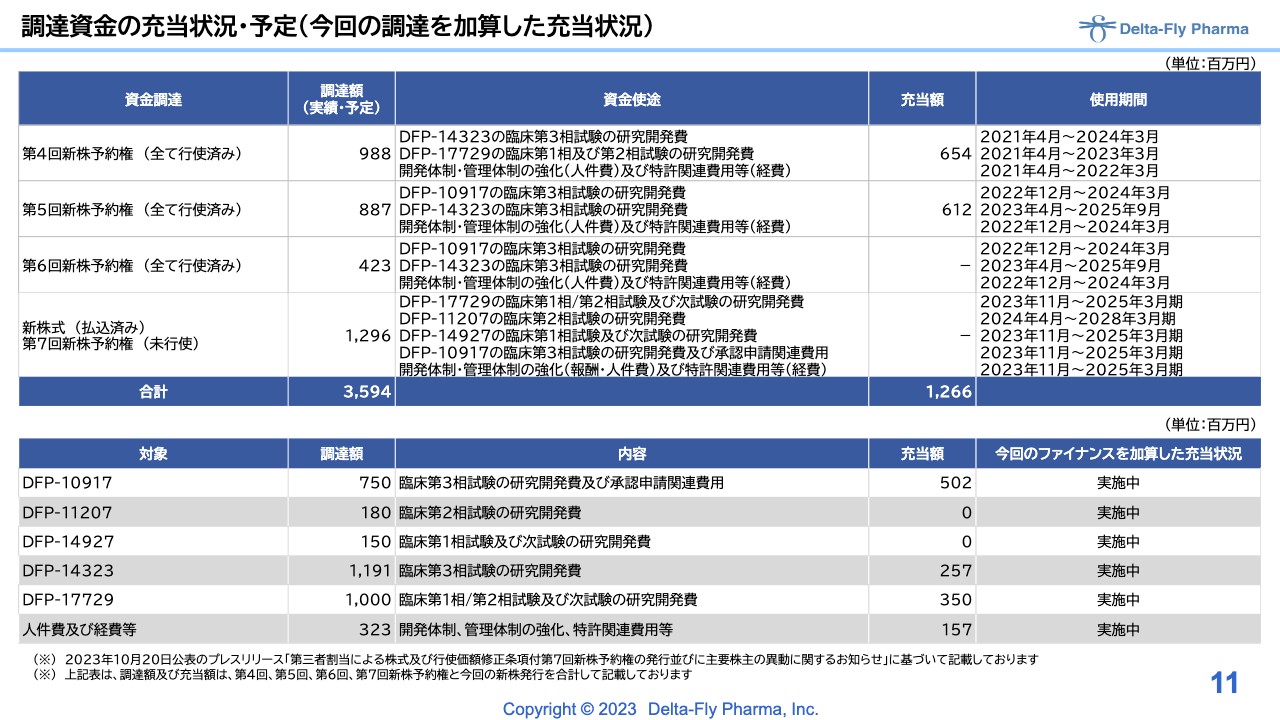
前回までは、新規上場時の状況を一番上に記載していましたが、すべての試験に充当したため、そちらを外した第4回から第7回までを載せています。
第7回は「未行使」となっていますが、こちらは「全て行使済み」に変わります。調達状況と現在の充当額は、スライドに記載のとおりです。基本的にはオンスケジュールで進んでいる状況とご理解いただければと思います。決算及び今回の後発事象によるファイナンスについての内容については以上です。
続きまして、パイプラインの状況と今後のスケジュールについて、社長の江島よりポイントを絞ってご説明します。
開発パイプラインの状況と今後のスケジュール
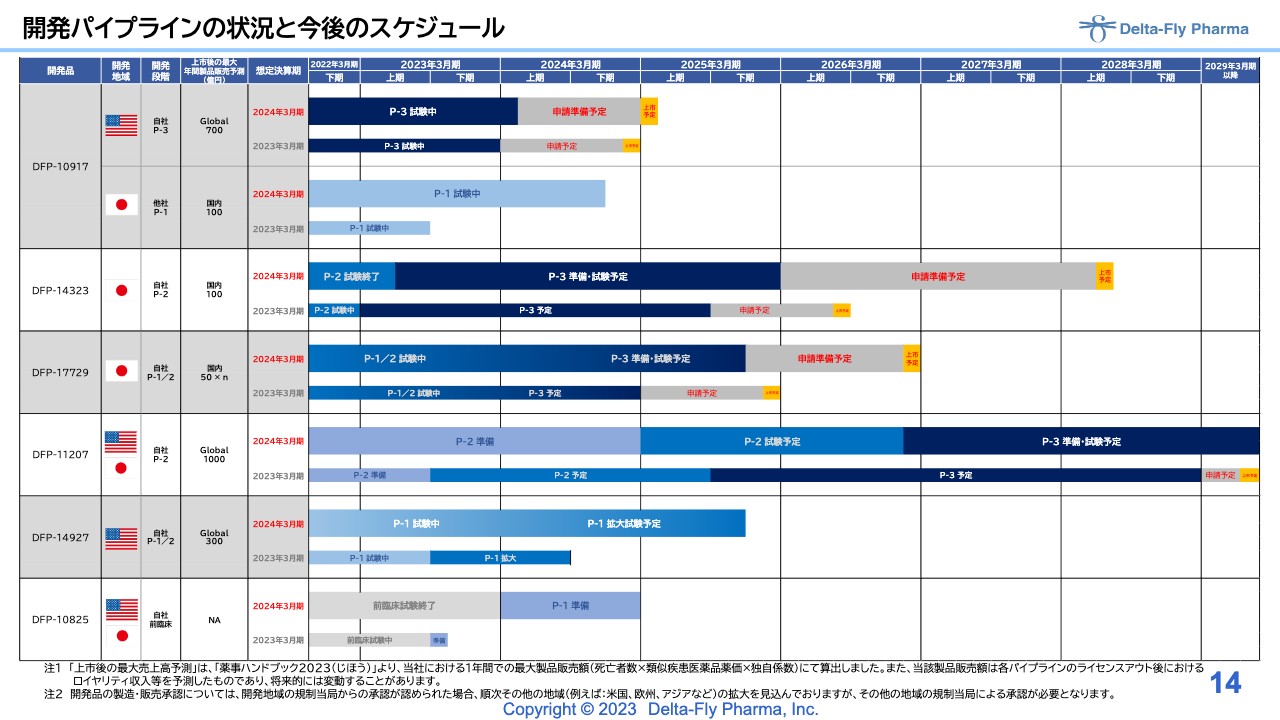
江島淸氏:代表取締役社長の江島です。パイプラインの状況と今後のスケジュールに関してご説明します。全体のスケジュール感は、スライドに記載のとおり進めています。
開発パイプラインの状況と今後のスケジュールの概要
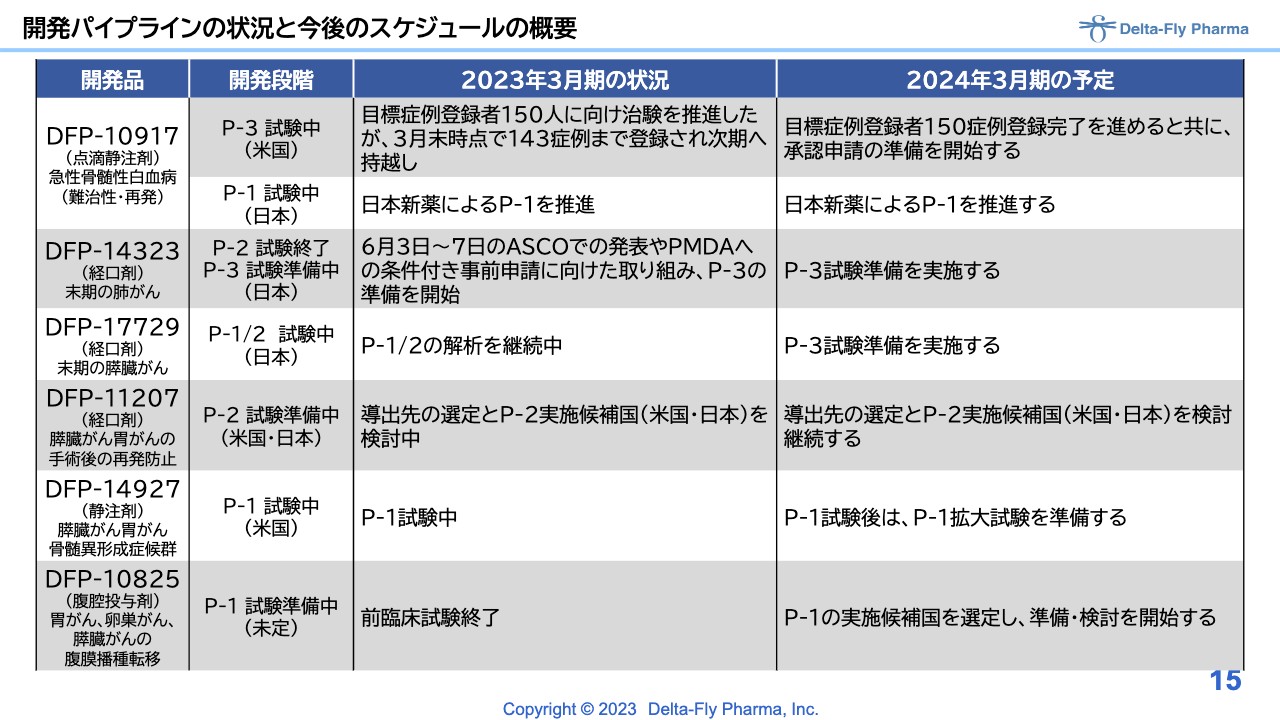
それぞれの内容についてご説明します。「DFP-10917」は、先般のニュースリリースでお伝えしたとおり、アメリカで実施中の臨床第3相試験における症例登録の進捗として、目標の150症例の登録が完了しました。その後、中間解析を実施していますが、約40施設と、非常に多くの施設があるため、時間を要しています。現在、引き続き申請に向けた解析を実施しています。
日本では、当社のパートナーであり、日本でライセンスアウトしている日本新薬で、臨床第3相試験が実施されています。フェーズ1試験は順調に進んでいると報告を受けています。
「DFP-14323」は経口剤で、末期の肺がんの患者さまを対象に、臨床第2相試験を実施しました。症例登録が終了し、結果も出たため、6月初旬にASCOで発表しました。PMDAの条件付き事前申請に向けた取り組みを行っているところですが、基本的には「臨床第3相試験を実施してほしい」とPMDAから指摘を受けています。現在、臨床第3相試験の準備を鋭意進めているところです。
「DFP-17729」は、末期の膵臓がんの患者さまを対象に開発しています。開発段階としては、臨床第1相試験、臨床第2相試験を継続しているところで、症例登録が終わりました。解析にかなり時間がかかっていますが、次の臨床第3相試験の開始に向けた準備を鋭意進めているところです。
「DFP-11207」は、膵臓がんや胃がんの手術後の再発防止というターゲットを狙っている品目で、臨床第2相試験の準備中です。今のところ、試験は日本で実施する方向性で考えていますが、ライセンス先の交渉等を含め、アメリカまたは日本での実施を検討しています。
「DFP-14927」は、2週間持続点滴療法の「DFP-10917」を高分子に結合させた、いわゆるDDS製剤です。現在、アメリカで臨床第1相試験を実施中ですが、先ほど黒滝からもご報告したとおり、ほぼ終了しています。次の拡大試験に向けて種々の準備を進めています。
「DFP-10825」は、腹腔投与剤で、胃がん、卵巣がん、または膵臓がんの腹膜播種転移というターゲットを目標にして、臨床第1相試験が開始できるように、準備を進めています。
前臨床試験には長い時間を要しましたが、ようやくすべて終了しました。時間がかかった理由として、動物実験に使用するサルを中国の武漢から調達していた経緯があり、新型コロナウイルス感染症による大きな影響を受けたことが挙げられます。現在は、次の臨床第1相試験をどの国で実施するか、またどのような適用で臨床第3相試験を実施するかを含め、鋭意作業を進めているところです。
それぞれの品目の個別の状況は、スライドの16ページ以降に記載していますが、5月に実施した説明会以降、大きな変化はありません。現在はこちらのスライドに記載しているとおりの状況です。ご理解のほどよろしくお願いします。
新着ログ
「医薬品」のログ