日本新薬、通期は増収増益 アーリーダやザイティガの販売開始など、中計の目標達成に向け順調に推移
2019年度 トピックス

前川重信氏:本日はお忙しい中、弊社の2019年度決算説明会にご参加いただき、誠にありがとうございます。本日は新型コロナウイルス感染症の影響を考慮し、動画配信による開催とします。よろしくお願いいたします。
本日は、私から2019年度業績と2020年度業績見通しを、また、研究開発品目については、「NS−018」を中心に、その他品目を含めて進捗状況について、松浦からご説明します。すでに先週の決算発表の段階で記者のみなさまにお話ししましたが、新型コロナウイルス感染症に対する取り組みに関しても、松浦から詳細をお話しします。
それではさっそく、2019年度のトピックスについてご紹介します。2019年度は、4月より新たに第六次5ヵ年中期経営計画をスタートして、さらなる独自性を追求し、持続的成長を目指すというテーマのもと、注力する6つの取り組みを公表しました。
2019年度は、本中期経営計画の目標値の達成に向けて順調に推移しました。泌尿器科領域においては、昨年5月に前立腺癌治療剤「アーリーダ」を、また本年2月からは前立腺癌治療剤「ザイティガ」について、ヤンセンファーマとの共同販売を開始しました。
血液がん領域においては、昨年9月に肝類洞閉塞症候群治療剤「デファイテリオ」を発売しました。また、デュシェンヌ型筋ジストロフィー治療剤「NS−065/NCNP−01」については、本年3月に国内での製造販売承認を取得し、間もなく発売予定です。
米国では、子会社のNS Pharmaを中心に、販売に関わる人材の採用及び販売体制の準備を進めており、ほぼ整いました。
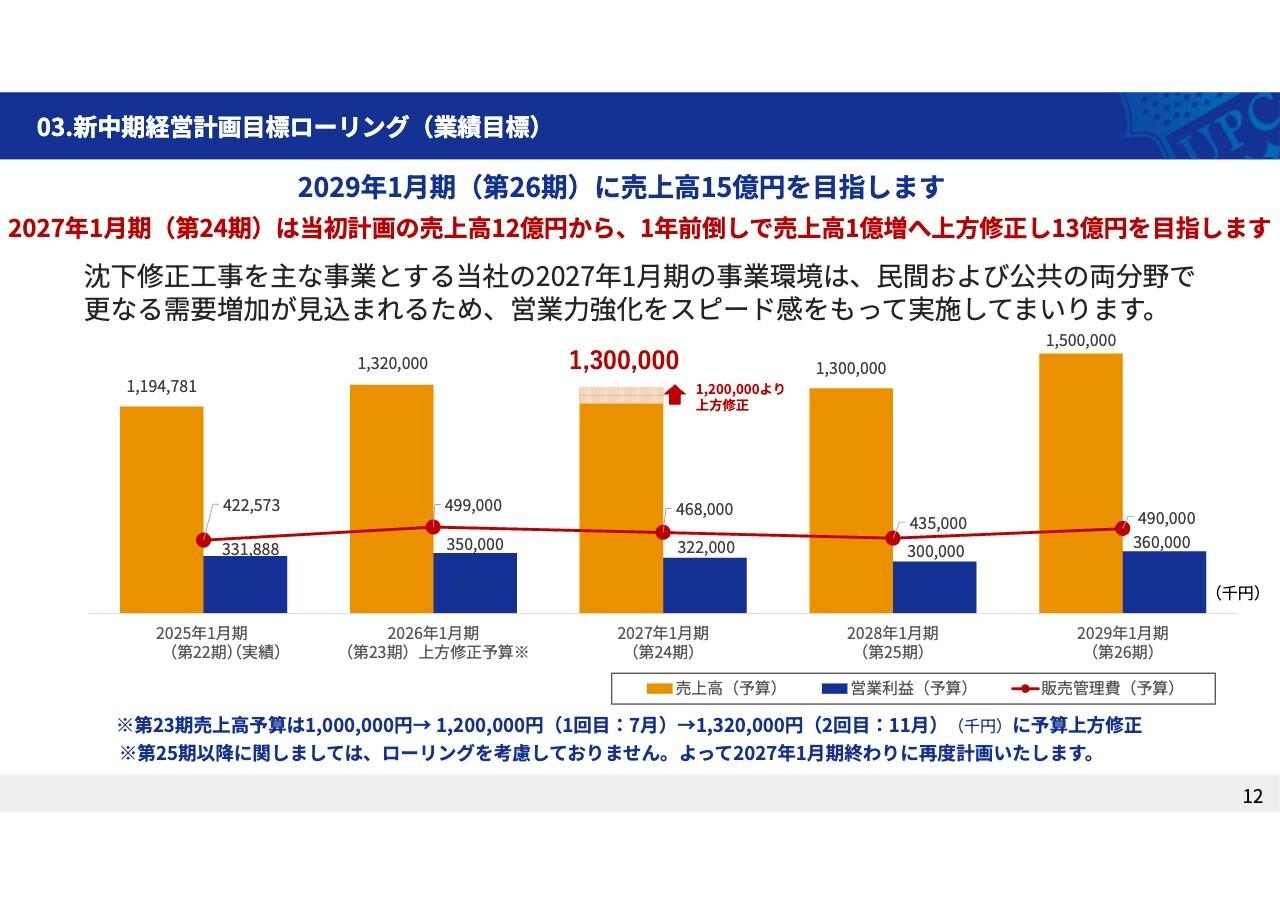
2019年度 概要
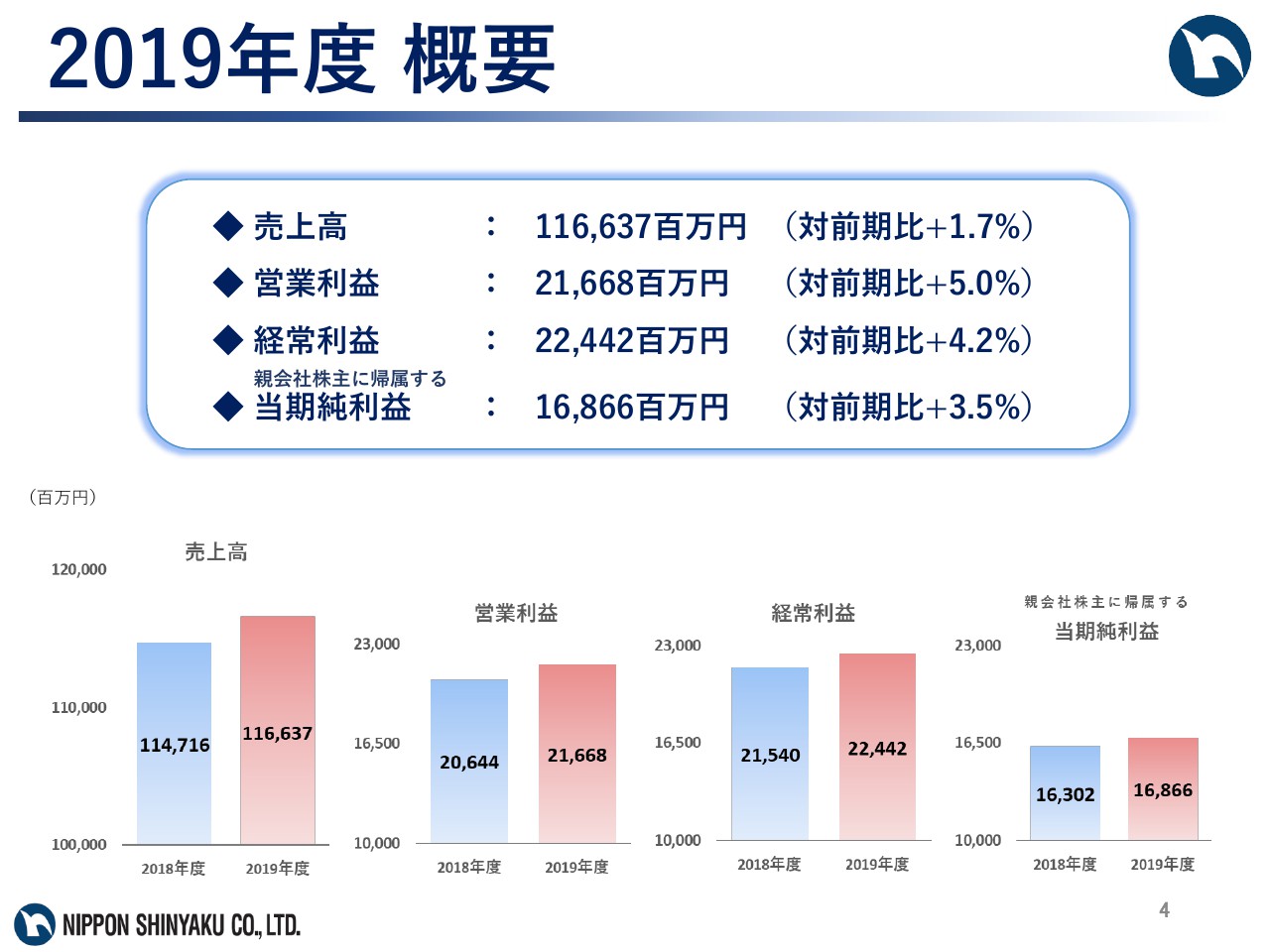
2019年度の業績の概要ですが、5月13日に発表したとおり、連結売上高1,166億3,700万円、営業利益216億6,800万円、経常利益224億4,200万円、当期純利益168億6,600万円となりました。
医薬品売上の内訳
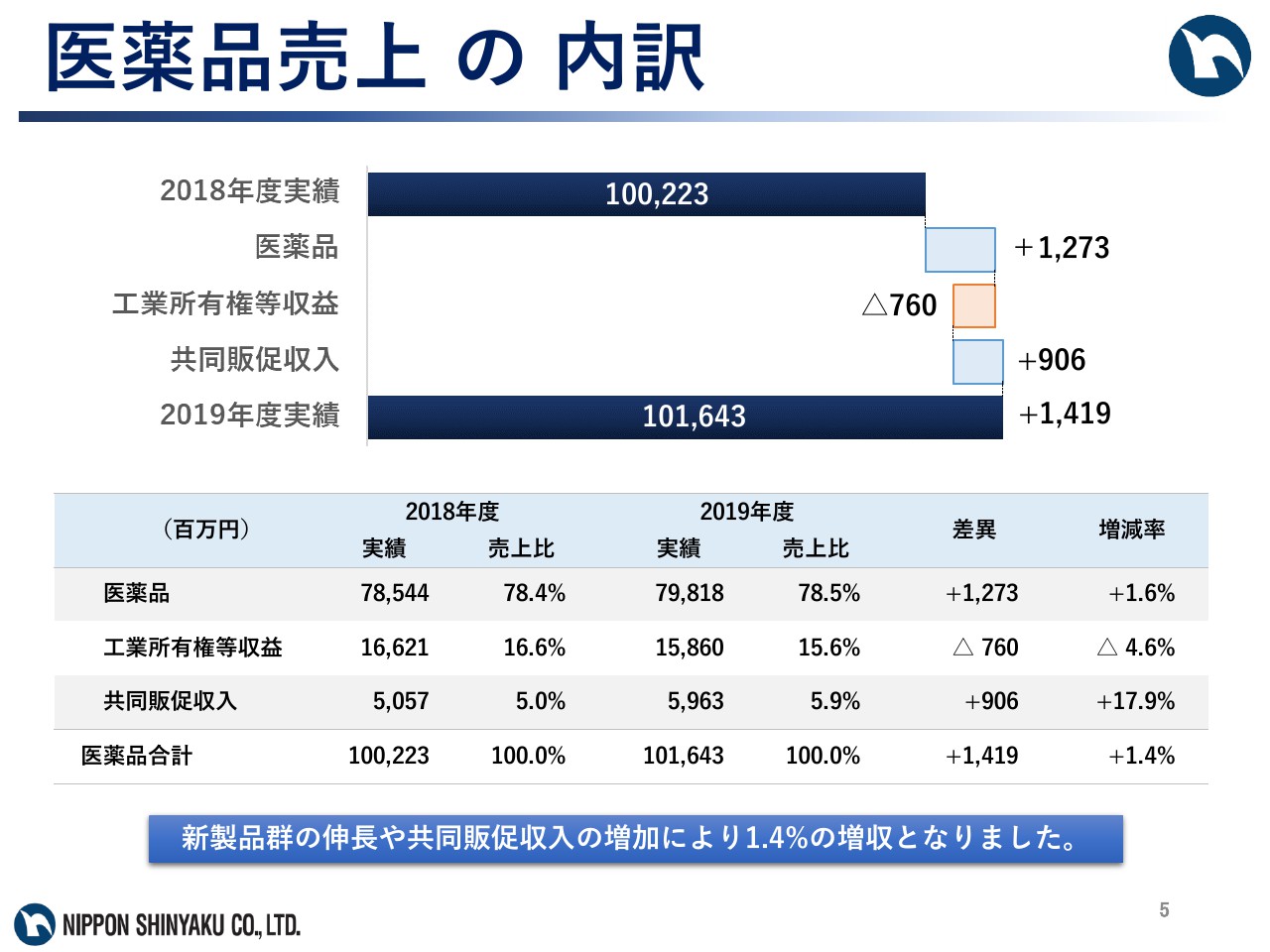
医薬品売上の内訳については、自社創薬品の肺動脈性肺高血圧症治療剤「ウプトラビ」のマイルストン収入があった前期に比べ、工業所有権等収益は減少したものの、CD20陽性の濾胞性リンパ腫治療剤「ガザイバ」、骨髄異形成症候群治療剤「ビダーザ」、肺動脈性肺高血圧症治療剤「ウプトラビ」、前立腺肥大症に伴う排尿障害改善剤「ザルティア」や、共同販促収入等が伸長し、加えて、昨年9月に発売した「デファイテリオ」の売上も寄与し、医薬品事業の連結売上高は1,016億4,300万円で、前期比1.4パーセントの増収となりました。
注力領域の売上進捗
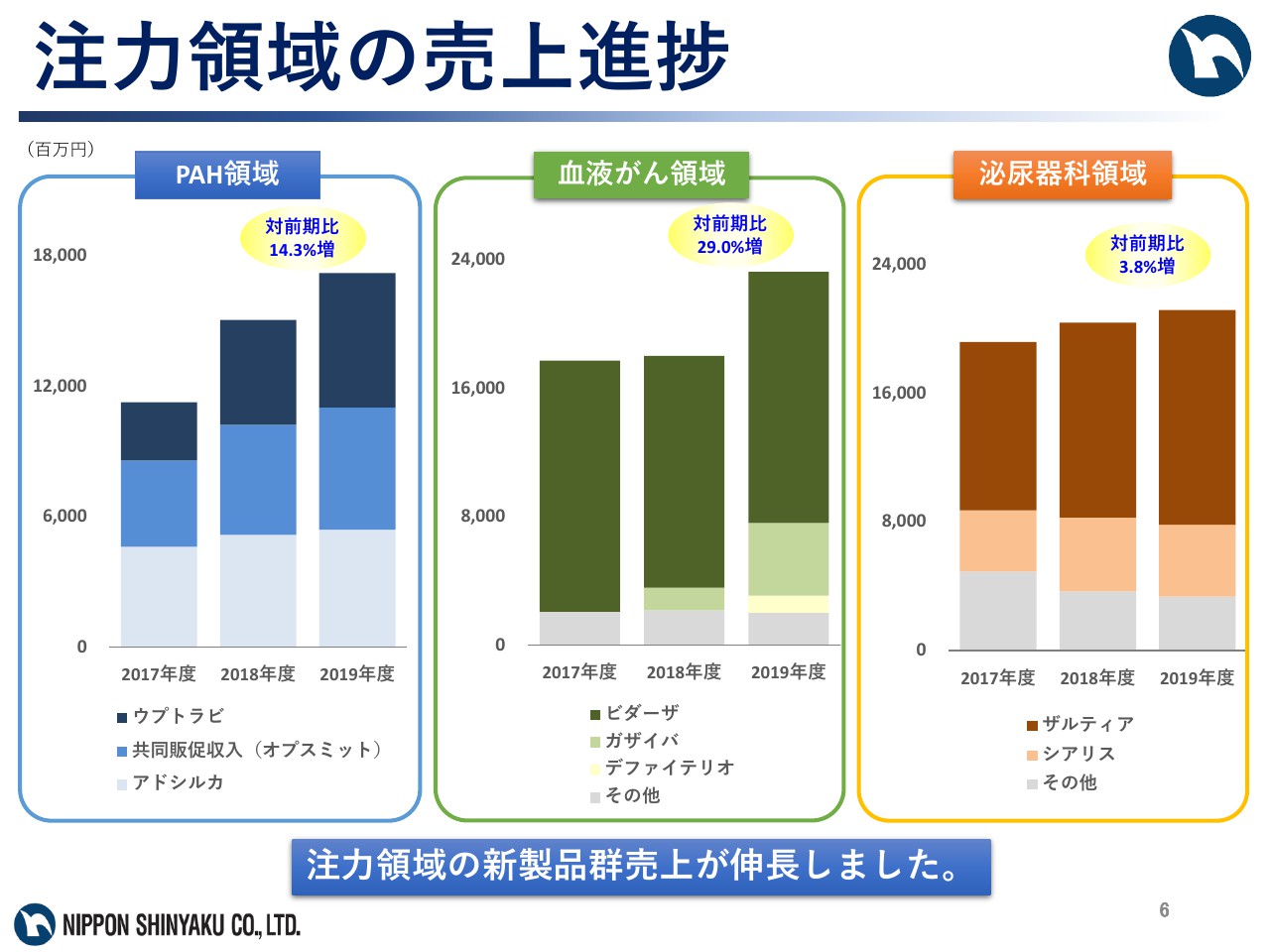
注力領域の売上進捗については、PAH領域では前期と比べ「ウプトラビ」「オプスミット」「アドシルカ」の3剤の売上がいずれも増加しました。血液がん領域では、前期と比べて「ビダーザ」「ガザイバ」の売上が伸長し、加えて「デファイテリオ」の売上も寄与しました。泌尿器科領域では、前期と比べてED治療剤「シアリス」の売上は減少しましたが、「ザルティア」の売上が増加し、またヤンセンファーマと共同で販売促進活動を行なう「アーリーダ」「ザイティガ」も寄与しました。
機能食品売上の内訳
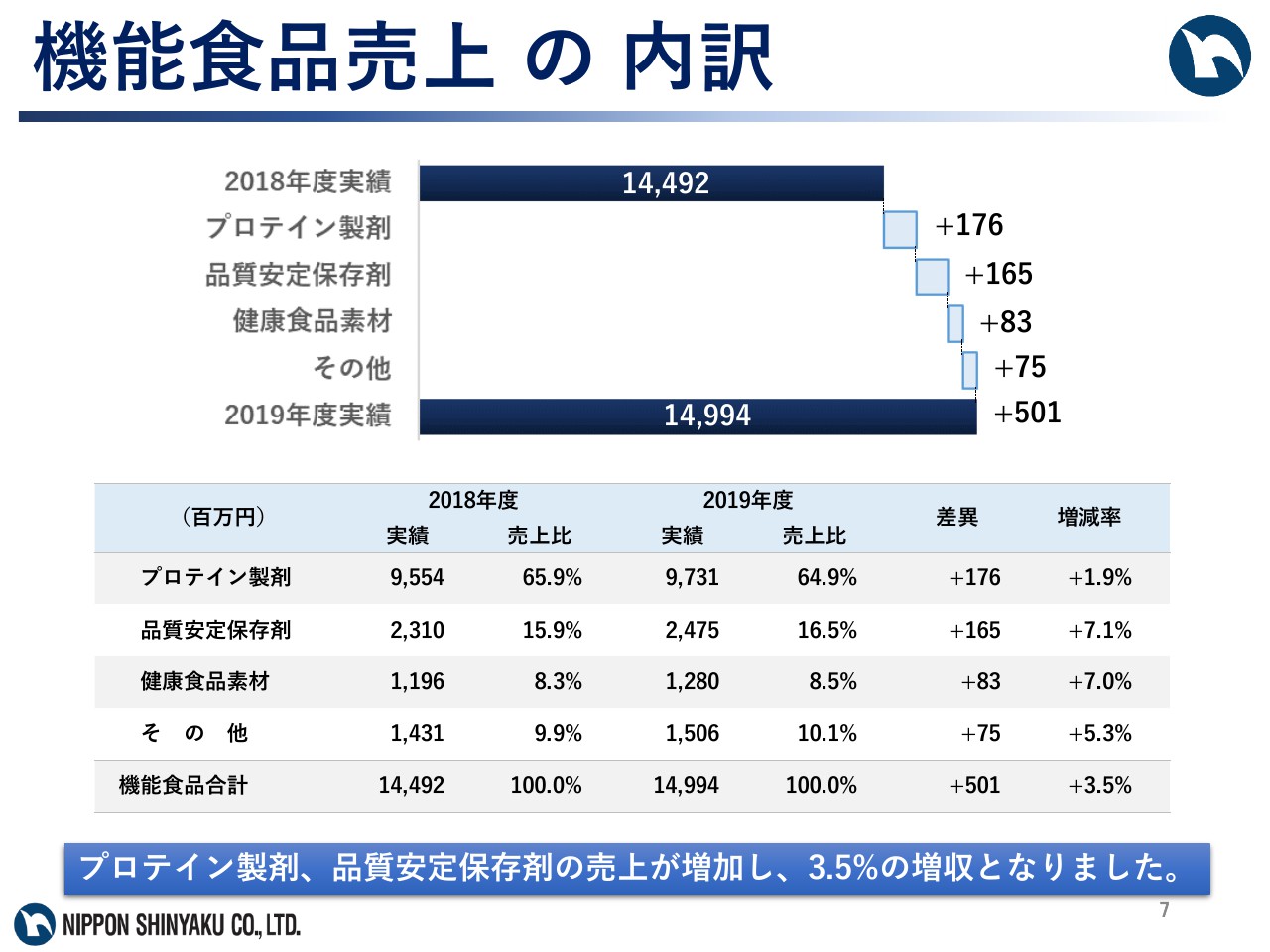
次に機能食品事業ですが、プロテイン製剤、品質安定保存剤の売上が増加し、機能食品事業の連結売上高は149億9,400万円で、前期比3.5パーセントの増収となりました。
営業利益
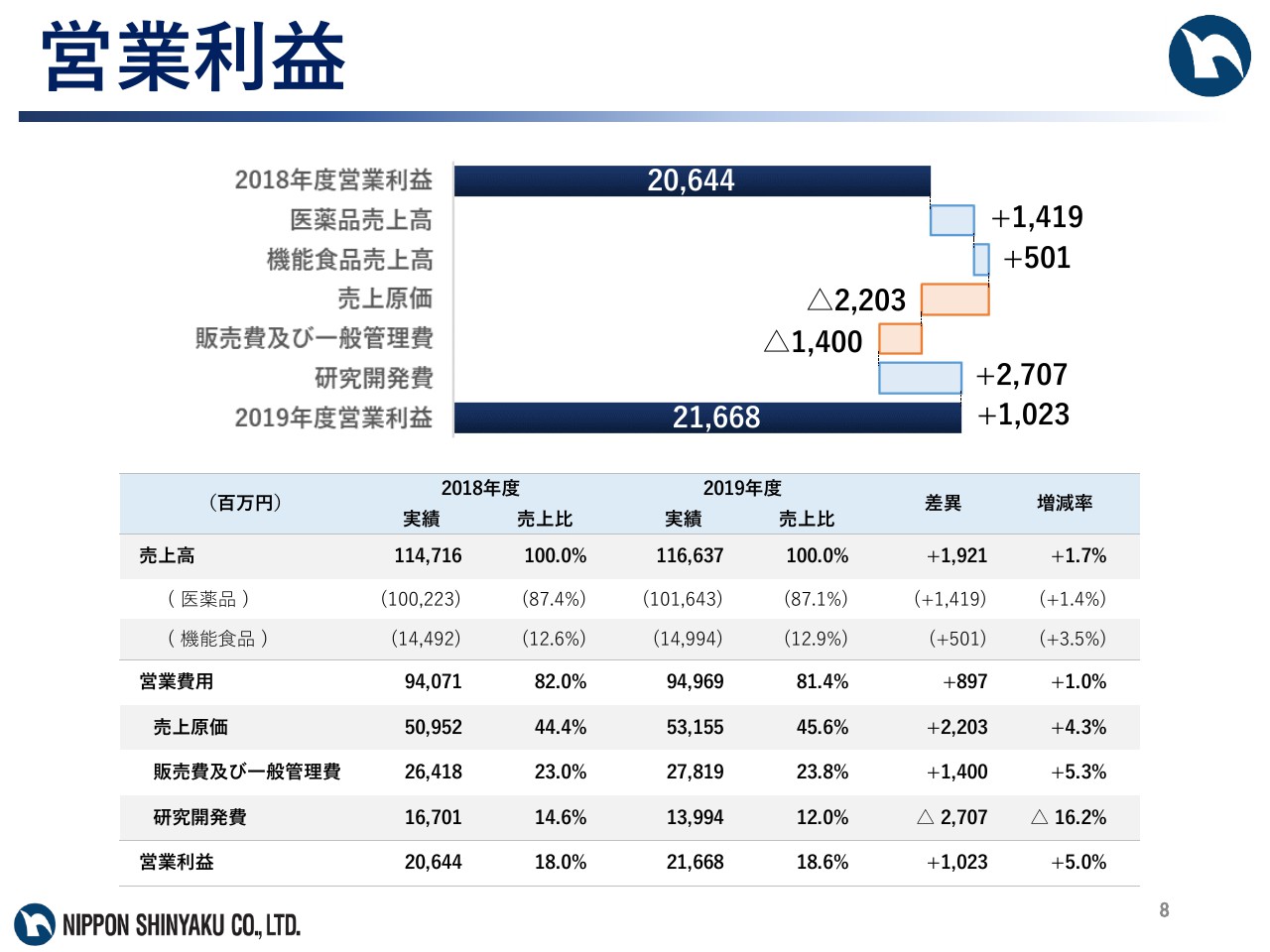
次に営業費用ですが、売上原価率は45.6パーセントと、前期と比べ1.2ポイント上昇しました。販売費及び一般管理費は278億1,900万円、研究開発費は139億9,400万円となり、結果として、営業利益は216億6,800万円、前期比5.0パーセントの増益となりました。
親会社株主に帰属する当期純利益
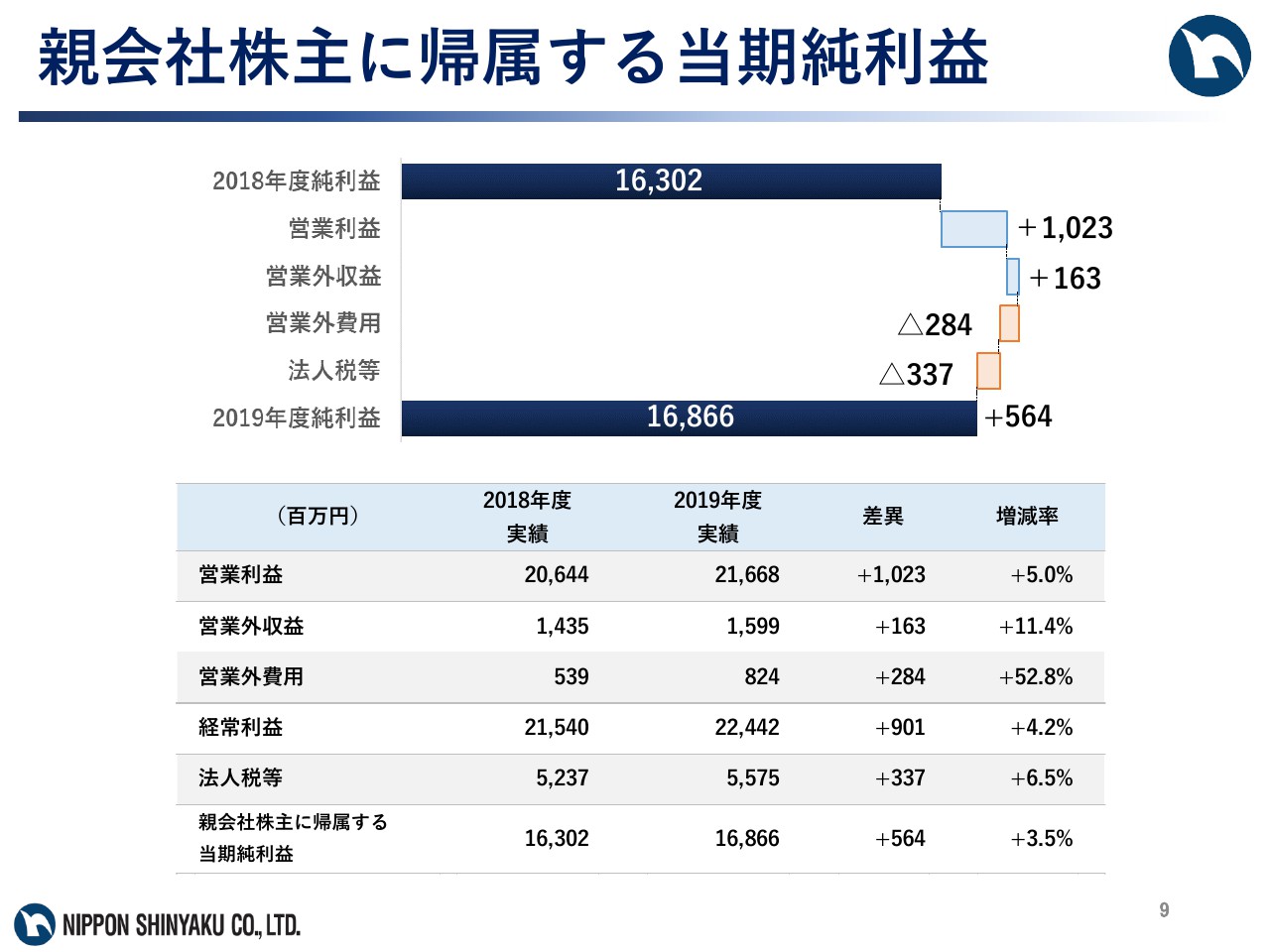
経常利益は224億4,200万円で、前期比4.2パーセントの増益、当期純利益は168億6,600万円で、前期比3.5パーセントの増益となりました。
2020年度 連結業績予想
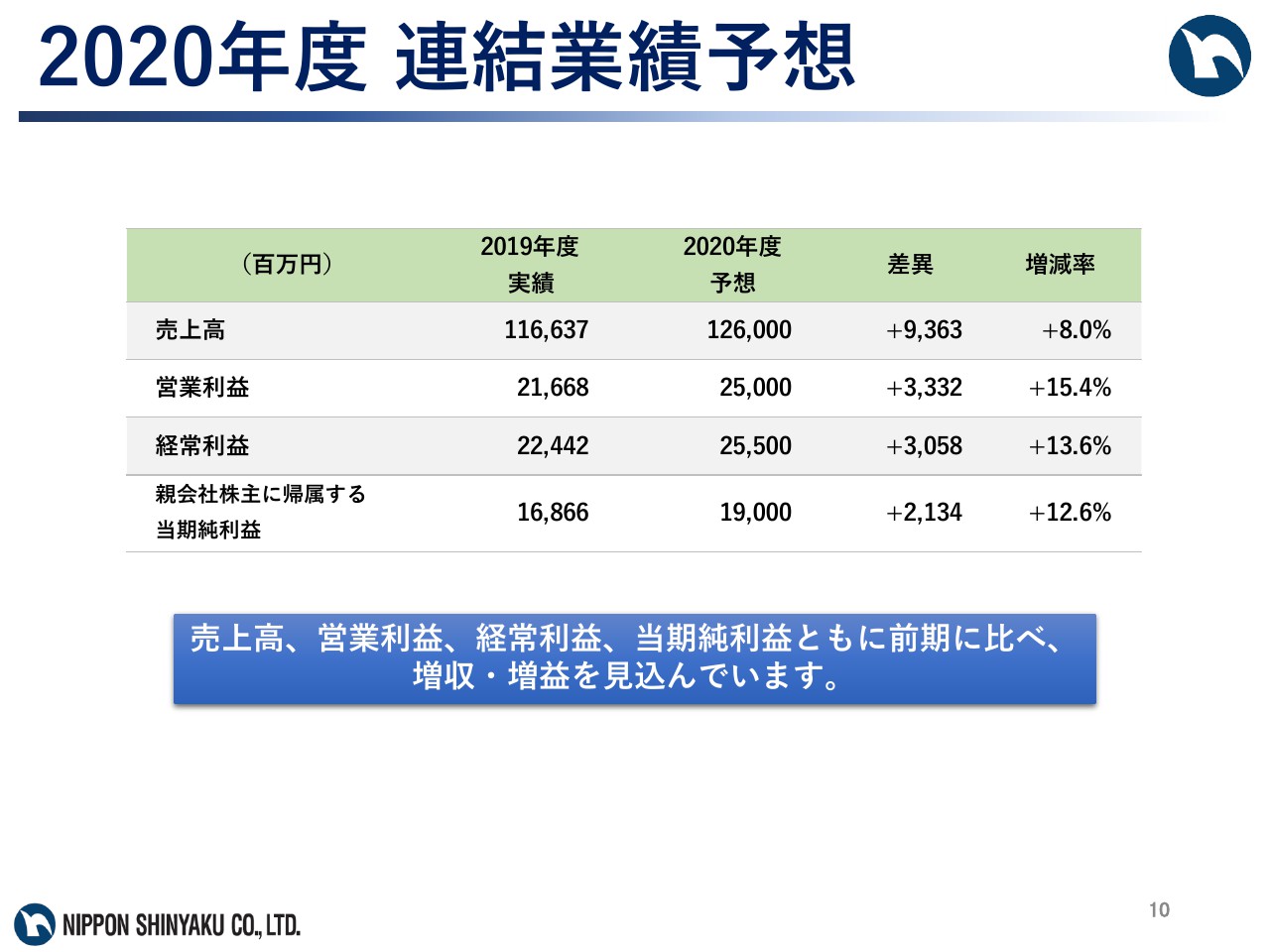
続いて、2020年度の通期業績見通しについて説明します。連結売上高1,260億円、連結営業利益250億円、経常利益255億円、当期純利益190億円を見込んでいます。
医薬品売上予想の内訳
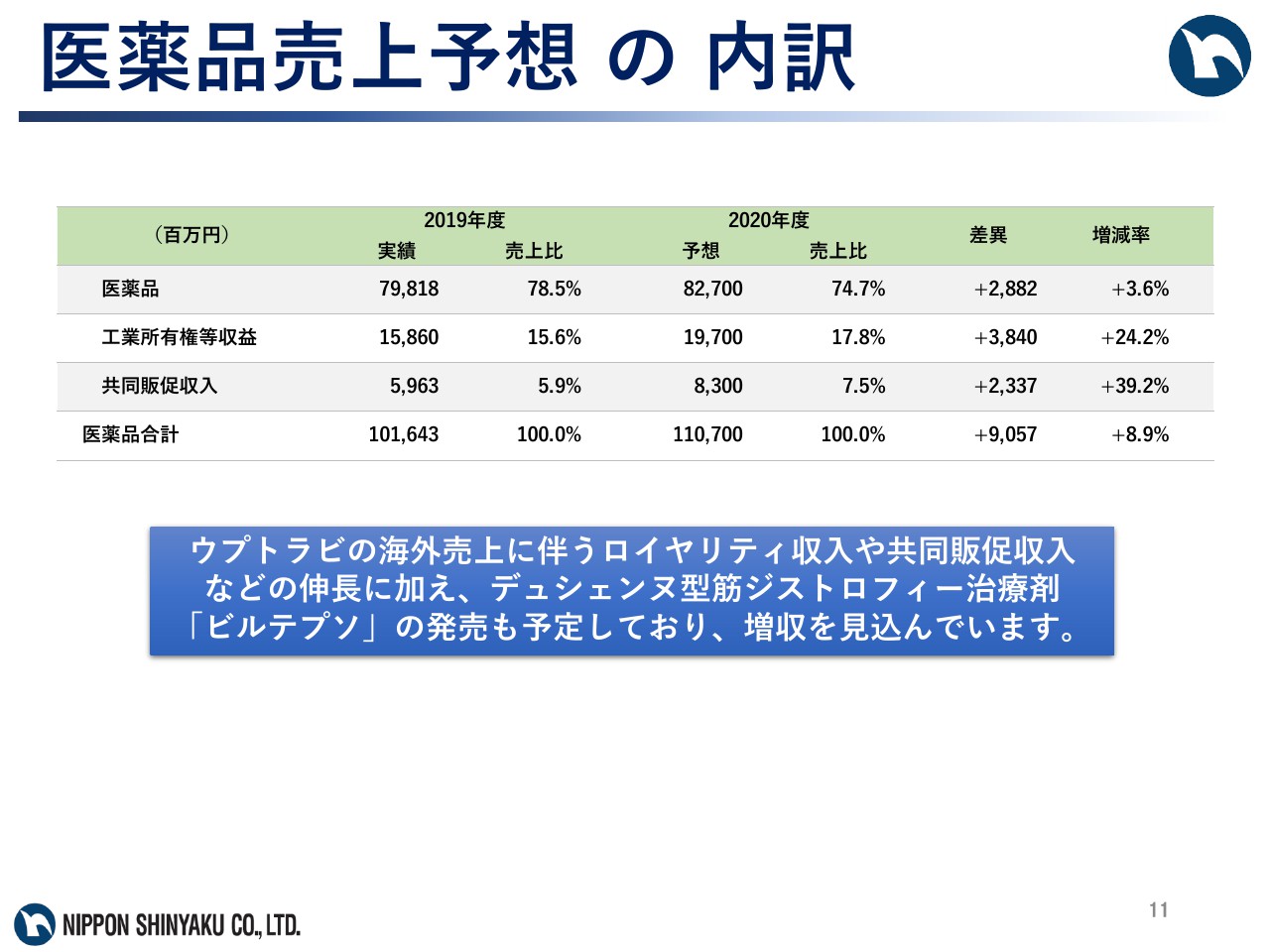
このうち、医薬品事業は売上高1,107億円で、前期と比べ8.9パーセントの増収を見込んでいます。今年度は薬価改定や「ザルティア」「シアリス」の後発品発売の影響はあるものの、「ウプトラビ」「ガザイバ」「デファイテリオ」などの新製品群の伸長、「ウプトラビ」の海外売上に伴うロイヤリティ収入及び共同販促収入の伸長に加え、デュシェンヌ型筋ジストロフィー治療剤「ビルテプソ」の発売も予定しており、増収を見込んでいます。
機能食品売上予想の内訳
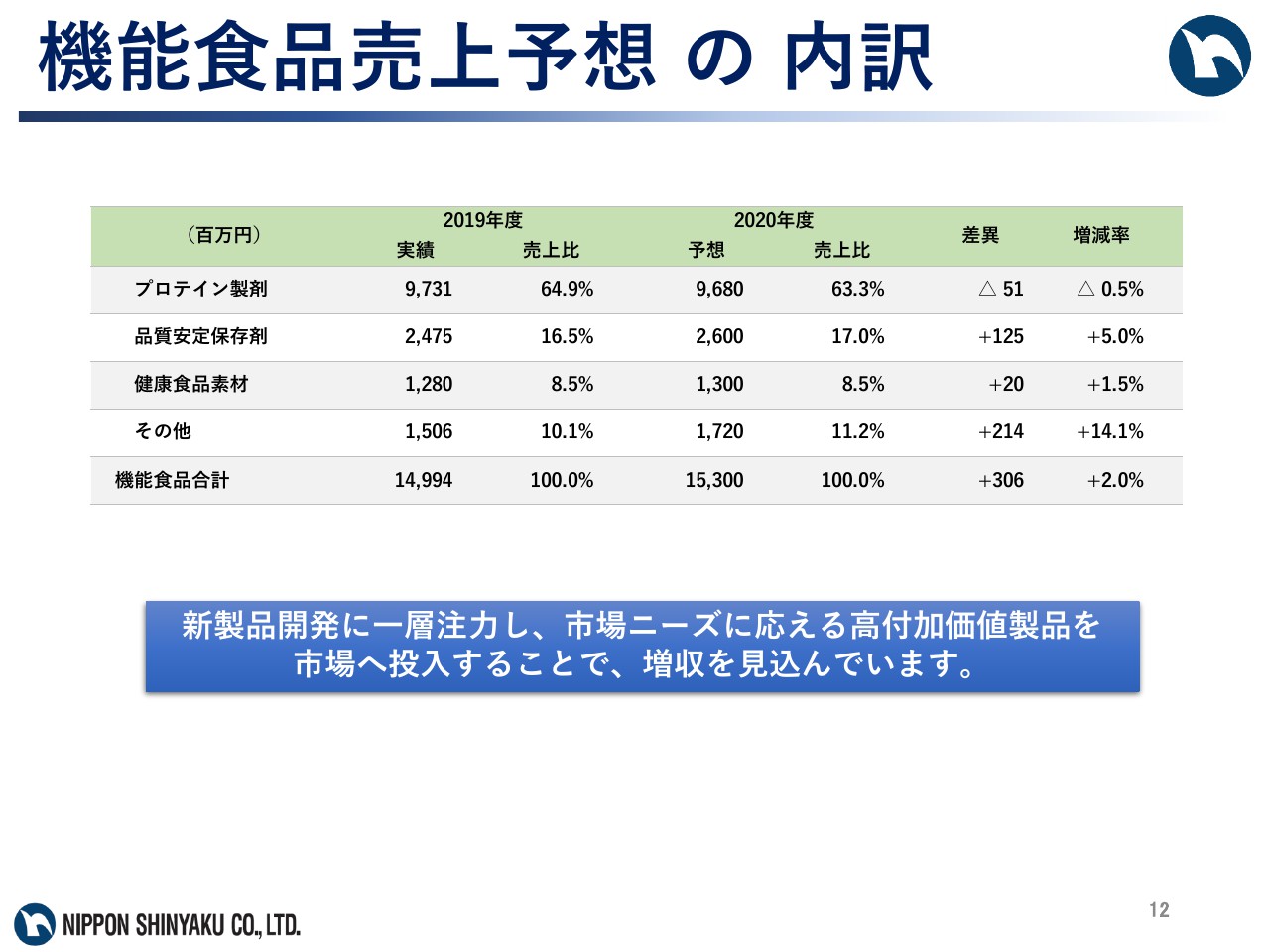
また、機能食品事業は売上高153億円で、前期と比べ2.0パーセントの増収を見込んでいます。新製品開発に一層注力し、市場ニーズに応える高付加価値製品を市場へ投入することで、増収を見込んでいます。
予想損益計算書(連結)
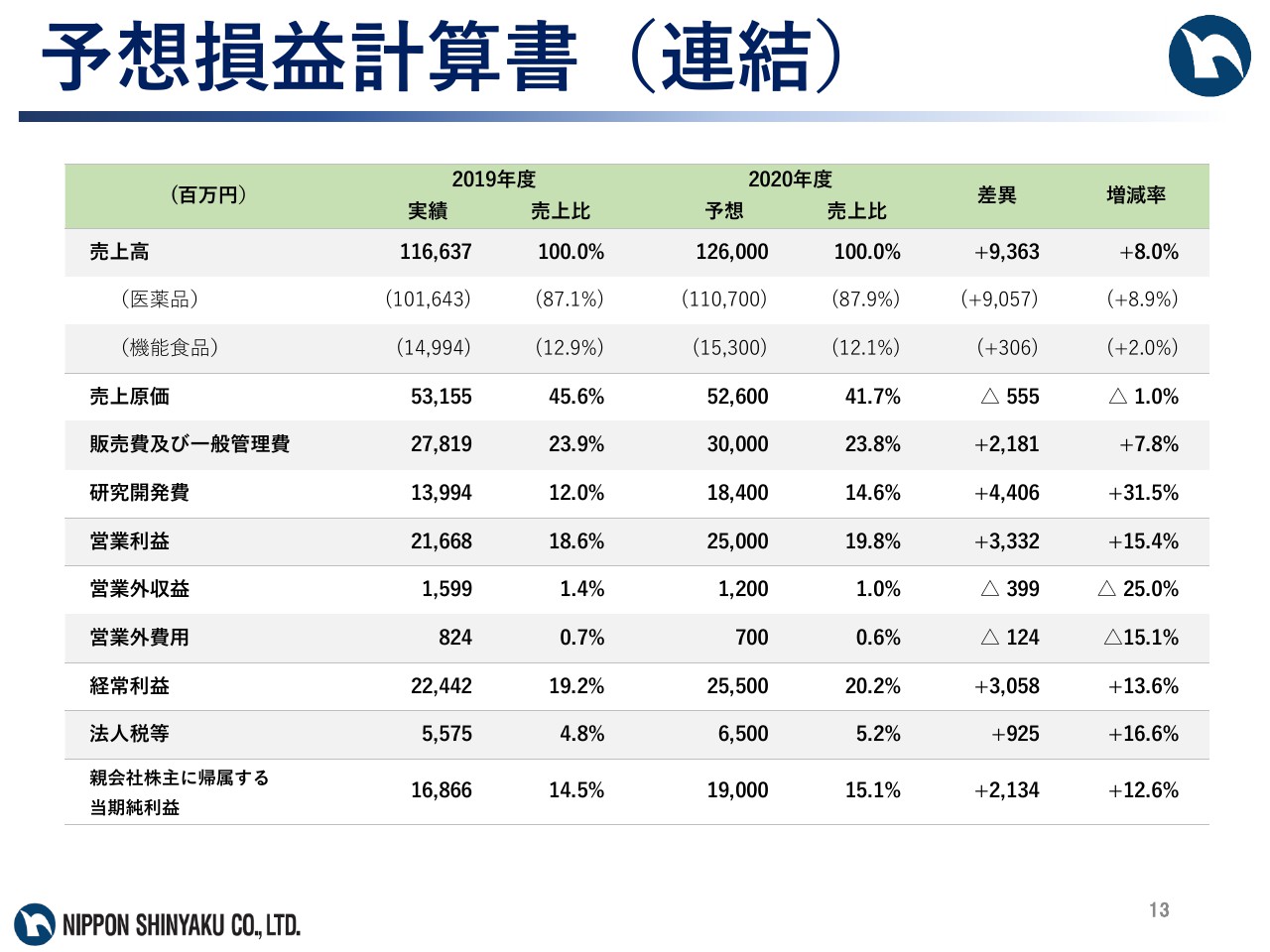
次に営業費用ですが、売上原価率は41.7パーセントと、前期と比べ3.9ポイント改善を見込んでいます。また、販売費及び一般管理費は300億円、研究開発費は184億円を見込んでいます。その結果、営業利益250億円、経常利益255億円、当期純利益については190億円と、営業利益、経常利益、当期純利益ともに前期と比べ増益を見込んでいます。
配当予想
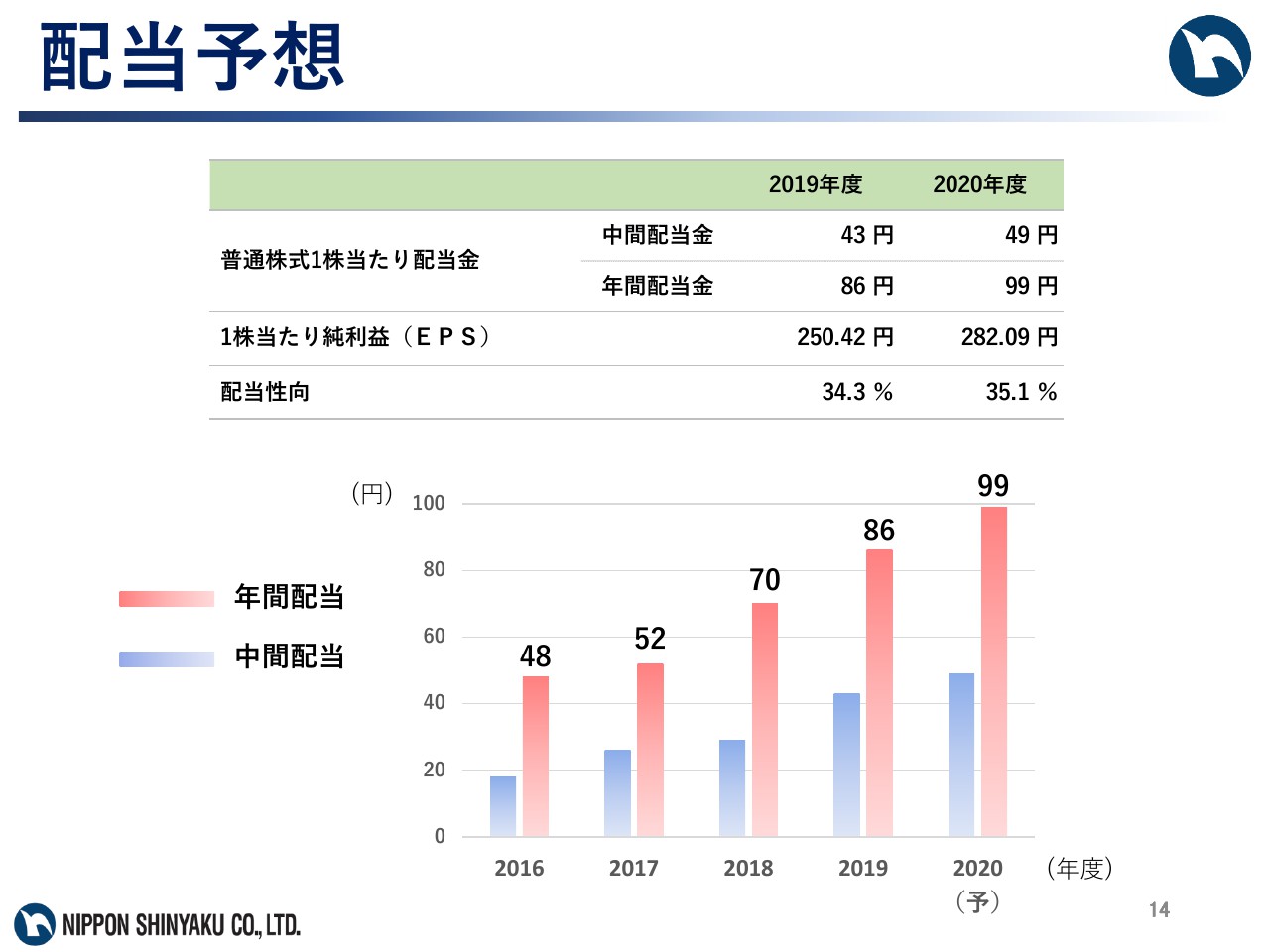
配当に関してです。第六次中期経営計画期間中について、業績連動型の配当として、連結配当性向35パーセント前後の配当を実施する予定です。当期の配当金については、本配当方針に則り、中間配当金1株当たり49円、期末配当金1株当たり50円の年間99円を予定しています。
以上、2019年度の業績と2020年度通期業績見通しについての説明を終わらせていただきます。ありがとうございました。
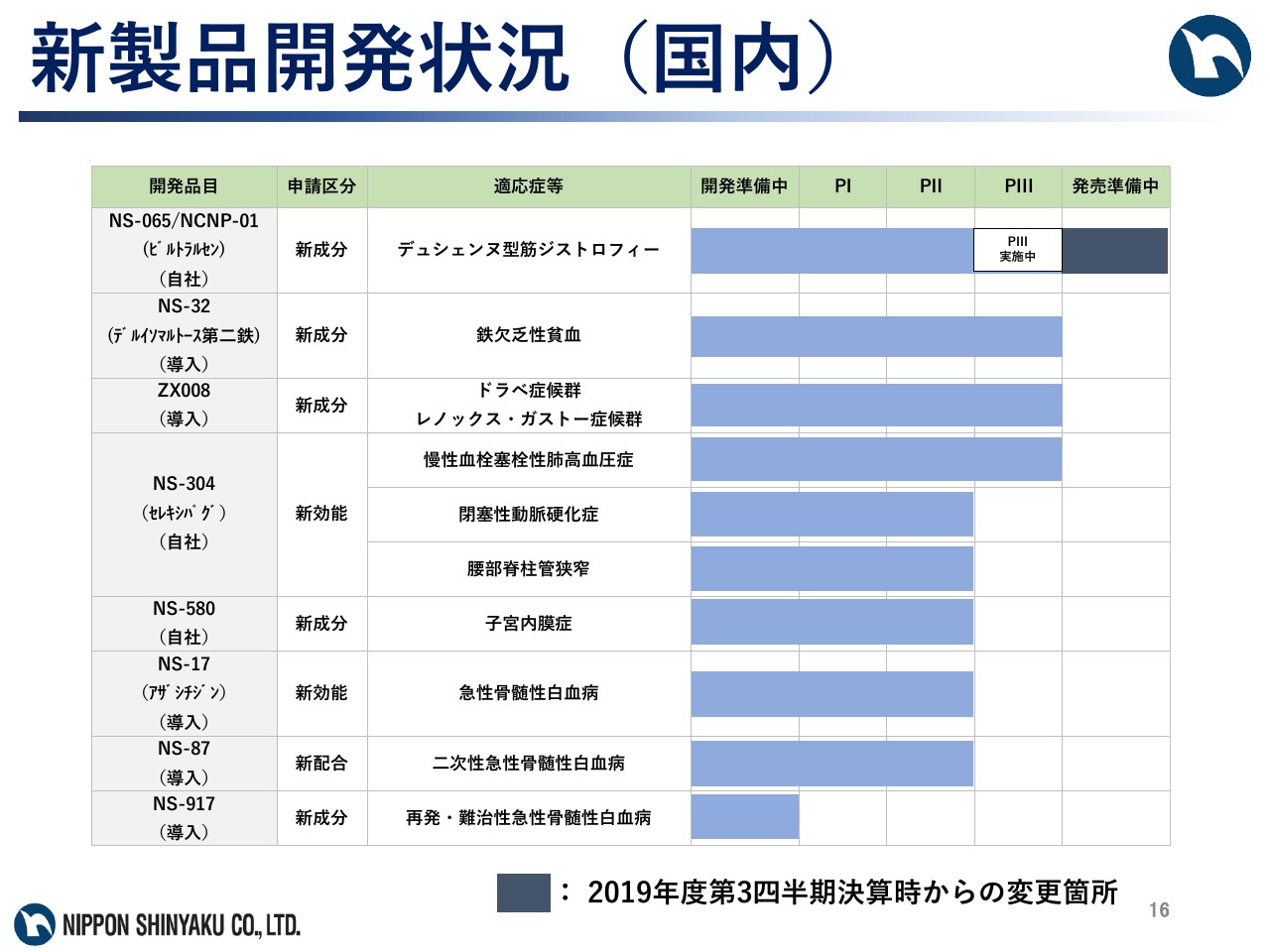
新製品開発状況(国内)
松浦明氏:研究開発担当の松浦明です。引き続き、研究開発品目の進捗状況を説明いたします。
まず国内の開発状況について説明いたします。デュシェンヌ型筋ジストロフィー治療剤「NS-065/NCNP-01」については、昨年9月に承認申請を行ない、同10月に条件付早期承認制度の対象品目として指定を受け、本年3月25日に承認されました。また、現在グローバルPⅢ試験を実施中です。
鉄欠乏性貧血治療剤「NS-32」については、PⅢ試験を実施中です。難治性てんかん治療剤「ZX008」については、ドラベ症候群及びレノックス・ガストー症候群を適応として、導入元のZogenixがPⅢ試験を実施中です。
「NS-304」については、アクテリオン ファーマシューティカルズ ジャパンと共同で、慢性血栓塞栓性肺高血圧症を対象としたPⅢ試験を実施中です。閉塞性動脈硬化症の適応では、日本新薬が単独でPⅡb試験を実施中です。腰部脊柱管狭窄の適応では、日本新薬が単独でPⅡa試験を実施中です。
子宮内膜症治療剤「NS-580」については、PⅡa試験を、「NS-17」については、急性骨髄性白血病を対象としたPⅡ試験を、二次性急性骨髄性白血病治療剤「NS-87」については、PⅠ/Ⅱ試験を、それぞれ実施中です。また、再発・難治性急性骨髄性白血病治療剤「NS-917」については、国内開発準備中です。
新製品開発状況(海外)
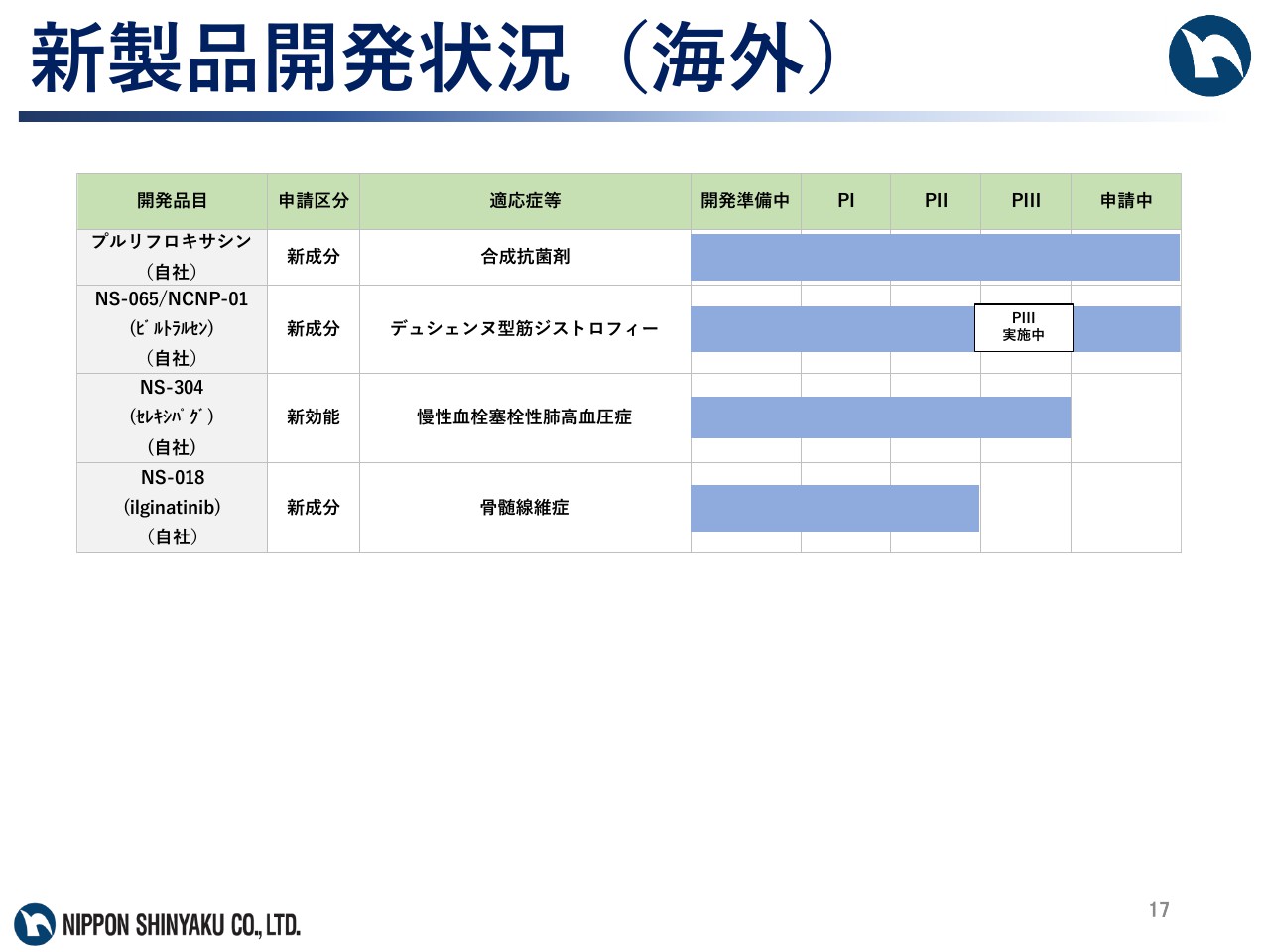
続いて、海外の開発状況について説明します。合成抗菌剤「プルリフロキサシン」については、中国で導出先の香港リーズファーマがPⅢ試験を終了し、2017年9月に申請を行ないました。
デュシェンヌ型筋ジストロフィー治療剤「NS-065/NCNP-01」については、昨年9月に米国で承認申請を行ない、本年2月7日に受理されました。また、「NS-304」については、導出先のジョンソン・エンド・ジョンソンが、慢性血栓塞栓性肺高血圧症を適応としたPⅢ試験を実施中です。
NS-018の開発方針(1)

次に、「NS-018」の開発方針について説明します。「NS-018」の進捗についてはみなさまのご関心が高い事項であり、今後の開発方針と年度内の試験開始、患者組み入れを考えている開発内容について説明します。
まずFDAとの次試験に関する協議内容について紹介します。主要評価項目の考え方については、未治療、ファースト・イン・クラスの骨髄線維症患者に対する主要評価項目である35パーセント脾臓容積縮小率を用いることは、すでに脾臓の収縮が、既存のJAK阻害剤等で起きている患者を対象とする、セカンドラインの有効性を評価するには適していないことを主張するとともに、骨髄線維症はQOLの改善が非常に重要な予後不良の疾患であることから、「NS-018」のセカンド治療薬としての有効性評価指標を、複合型主要評価項目として、緩和性対脾臓容積縮小率と50パーセント以上の症状改善率とすることについて、協議を進めてきました。
しかしながら、FDAから「複合型主要評価項目の考え方は理解できるが、複合型主要評価項目に対するエビデンスを示すように」と要請を受け、検討を進めていました。
一方欧米では、JAK阻害剤の投与により、血小板が5万/マイクロリットル以下になり、既存薬剤を継続して投与することはできなくなり、治療法がないためQOLの改善の見込みがなく、予後不良な重篤な状態になっている患者数が、JAK阻害剤投与患者の2割から3割、あるいはそれ以上、また直近の推計では17,000人程度と言われています。
このことは知られていましたが、先ほどのFDAからの要請について調査を進めていく中、ごく最近の論文で、血小板数が5万/マイクロリットル以下の骨髄線維症患者については、予後が非常に悪いという明確な疫学研究が報告されているとともに、現場の先生方の高い要望も確認することができました。
このように、治療薬がなく非常に困っている患者へ早期に治療薬を届けることは重要であり、次試験では治療薬が存在しない血小板5万/マイクロリットル以下の未治療患者とJAK阻害剤治療後患者の両方の患者を対象とすることを考えています。
投与量としては、今までの臨床試験結果から高い安全性が示されており、前の治験で用いた1日1回300ミリグラムから、1日2回投与の計600ミリグラムに投与量を増やし、主要評価項目についてはファーストラインの薬剤の主要評価項目である、35パーセント脾臓容積縮小率を用いて評価する予定です。
NS-018の開発方針(2)
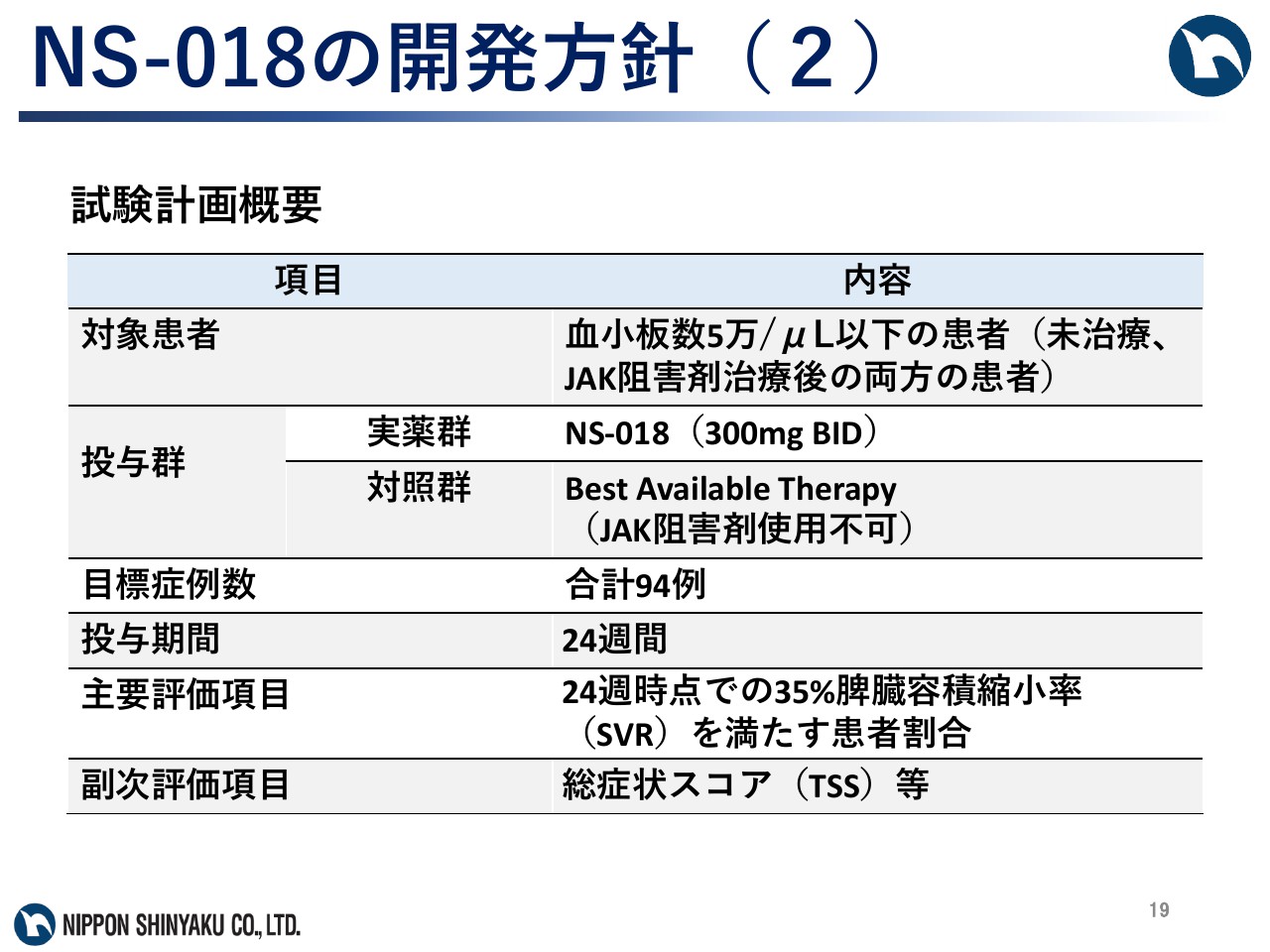
試験計画については、血小板数が5万/マイクロリットル以下の未治療患者、あるいはJAK阻害剤治療後の患者を対象に、「NS-018」だけを1日600ミリグラム投与した群と、BAT群の比較検討を考えています。主要評価項目については、24週間時点での35パーセント脾臓容積縮小率を満たす患者の割合とする予定です。
まずは迅速承認を目指し、「ルキソリチニブ」や「フェドラチニブ」が使用できなく困っている患者に早く治療薬を届けるため、早急に進めていく予定であり、ファーストラインも視野に入れて開発に取り組んでいきます。
新型コロナウイルス感染症に対する取り組み -核酸医薬品(1)-

新型コロナウイルスは長鎖のRNAウイルスであり、変異しやすい性質を持っています。新型コロナウイルスのみならず、変異型コロナウイルス感染症にも広く適応し、さらに過去のSARSやMERSをはじめ、今後出現する新規のコロナウイルス感染症にも適応できる永続的な抗ウイルス薬を目指し、核酸医薬品の開発に着手しました。
新型コロナウイルス感染症に対する取り組み -核酸医薬品(2)-

低分子医薬品やワクチンの開発は急ピッチで進められていますが、これらに対する核酸医薬品の優位性を説明いたします。低分子医薬品は既存の医薬品のリポジショニングで、短期的な効果は期待されている一方、低分子がウイルスに結合できる部位は限られているため、効果的な低分子医薬品が見出されても、その結合部位が変異したウイルスが出現した場合には、その低分子医薬品は効果を示さないため、また新たな治療薬の開発が必要となります。
ワクチンの標的はウイルスの表面蛋白質で、低分子医薬品と同様に限られています。また、効果的なワクチンが得られても、結合領域が変異したウイルスが出現した場合には、変異型ウイルスに対する効果を示さないため、新たなワクチンの開発が必要となります。
核酸医薬品の場合は、ウイルスゲノムに直接作用するため、ウイルスゲノム全体を標的とすることができます。RNAウイルスは変異しやすいウイルスですが、ウイルス増殖の必須領域は変異しにくく、こうした不変領域を標的とすることで変異型を含めたコロナウイルス感染症にも広く適応し、さらに今後出現する新規のコロナウイルス感染症にも適応する抗ウイルス薬を目指すことができます。
新型コロナウイルス感染症に対する取り組み -核酸医薬品(3)-
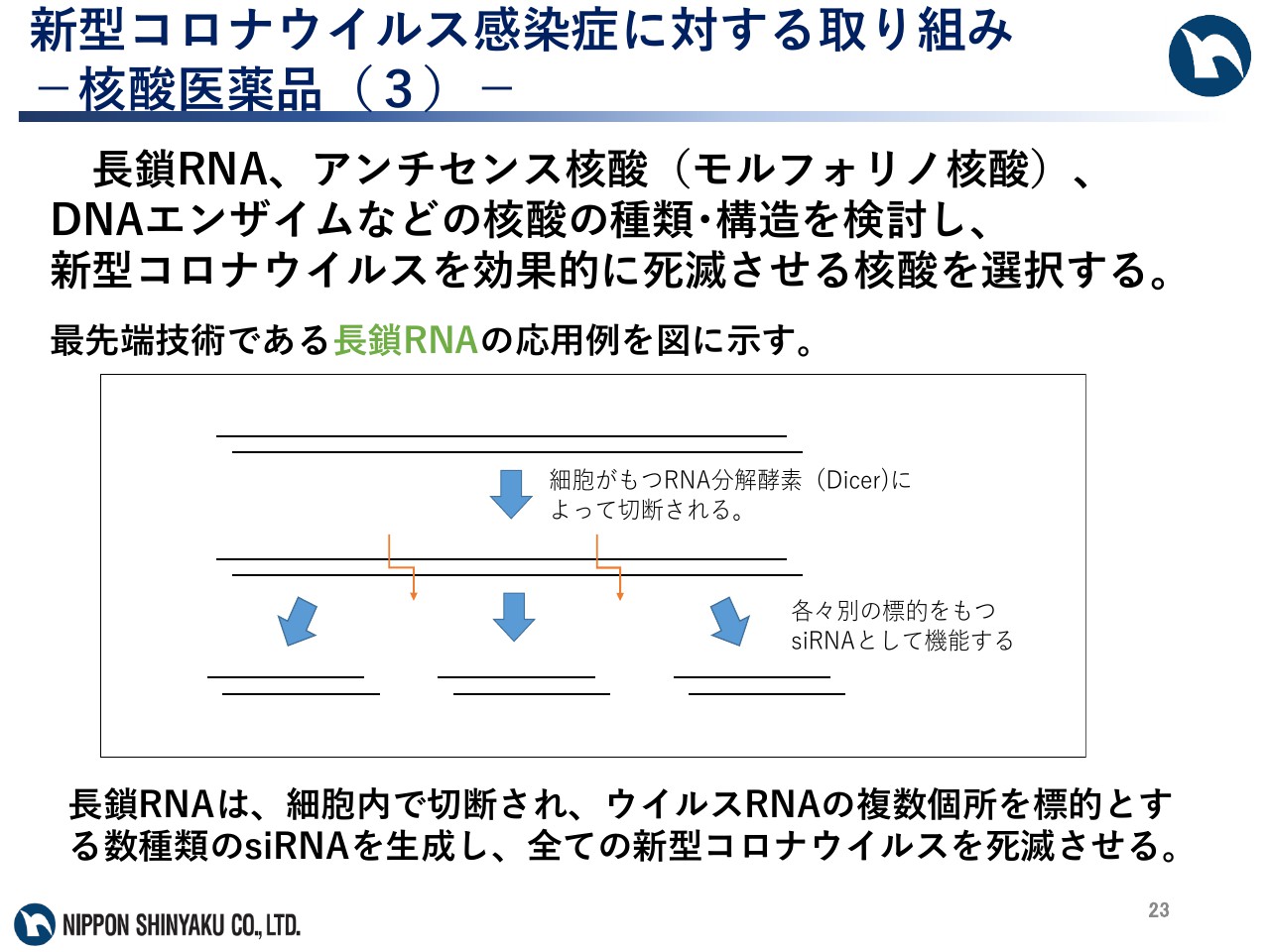
長鎖RNA、アンチセンス核酸、DNAエンザイムなどの核酸の種類及び構造を検討し、新型コロナウイルスを効果的に死滅させる核酸を選択します。
最先端の技術である長鎖RNAを応用した例を図に示します。長鎖RNAは、細胞内でDicerという酵素によって切断され、ウイルスRNAの複数個所を標的とする数種類のsiRNAを生成します。これらのsiRNAがウイルスRNAの別々の標的領域に結合して切断することによって、すべての新型コロナウイルスを死滅させることができると考えています。
新型コロナウイルス感染症に対する取り組み -リポジショニング(1)-

次に、既存薬及び現在開発中の薬剤のリポジショニングについて説明します。新型コロナウイルスによる急激な症状の悪化には、免疫系の過剰反応(サイトカインストーム)が深く関与しており、これを抑制できれば重度の呼吸不全を防ぐことができます。
JAKやIL-6を介した細胞内シグナルを抑制すれば、サイトカインストームは抑制できることが知られており、他社のJAK阻害剤、あるいは抗IL-6受容体抗体が臨床試験を開始しています。
新型コロナウイルス感染症に対する取り組み -リポジショニング(2)-

現在、米国で骨髄線維症治療剤として臨床試験実験中の「NS-018」及び臨床試験準備中の別の薬剤は、サブタイプ選択性と安全性に優れたJAK阻害剤であり、新型コロナウイルス感染症による重症肺炎や急性呼吸窮迫症候群(ARDS)治療薬としてのリポジショニングを検討しています。さらに、新型コロナウイルス感染で生じる血栓症に対しては、「ウプトラビ」のリポジショニングを検討しています。
以上、研究開発の概況の説明を終わらせていただきます。
新着ログ
「医薬品」のログ