リボミック、「RBM-007」が厚労省の希少疾病用医薬品に指定 サウジの研究機関とMOU締結
トピックス
中村義一氏:みなさま、こんにちは。株式会社リボミック代表取締役社長の中村です。本日は、2025年3月期通期の決算説明会にご参加いただきありがとうございます。
まずは、事業の進捗からご説明します。スライドには、トピックスを4つに分けてまとめています。1つ目は、「RBM-007」です。軟骨無形成症(ACH)治療薬の臨床試験を日本で行っていますが、順調に進んで成果も出ています。さらに、厚生労働省から希少疾病用医薬品指定(ODD)を受けることができました。
2つ目は、契約についてです。サウジアラビアから招聘を受け、キング・アブドラ国際医療研究センターとのアプタマーに関する提携を検討しており、そのための基本合意書を締結しています。
3つ目は、「RBM-007」「RBM-006」についてです。眼科疾患治療薬としての開発を行うために、東京大学医学部眼科学教室と包括的な共同研究契約を締結し、解析を進めています。
4つ目は、味の素株式会社との共同研究開発です。同社と共同研究を行った結果、アプタマーの体内動態を画期的に改善する技術を開発することができました。
これらについて、ご説明していきます。
2025年3月期 国際学会発表

2025年3月期は、国際学会の発表に関して非常に実りの多い1年でした。まず、9月にリスボンで開催された米国のRetina Societyの年次総会に登壇し、発表する機会がありました。続いて、マドリードで行われた骨形成不全の国際学会で、我々の軟骨無形成症のプログラムを説明する機会がありました。
11月には、サウジアラビアで行われた「Riyadh Global Medical Biotechnology Summit 2024」に招聘され、招待講演を行うことができました。こちらについては、後ほどご説明します。
2025年3月期 論文発表

論文に関しても、非常に優れた論文を発表することができました。スライドに示したような結果となっています。
東京大学医科学研究所RNA医科学社会連携研究部門

当社が、東京大学医科学研究所内に設置した寄附講座「RNA医科学社会連携研究部門」が、合計13年たち、満期を迎えて終了しました。その間、論文36報、特許4件を出願しています。これを記念し、昨年10月、東京大学医科学研究所にて国際シンポジウムを共同開催しました。非常に盛況な会議となりました。
キング・アブドラ国際医療研究センター(Saudi)とのMOU締結

サウジアラビアとの関係についてご説明します。昨年10月、サウジアラビアの大臣が当社を訪れ、11月10日に行われる「Riyadh Global Medical Biotechnology Summit 2024」への参加を依頼されました。
現在、サウジアラビアのムハンマド王太子が中心となり、「ビジョン2030」という、2030年までにサウジアラビアを中東の先端医療の中心にするという、非常に野心的なプログラムが進められています。そのため、キング・アブドラ国際医療研究センター(KAIMRC)が設立され、米国に準じたかたちの臨床試験の制度設計を完了させるなど、建物の建設も含め、非常に活発に動いています。
そのような中、サミットへの参加を依頼され、講演をする機会がありました。サウジアラビア政府も、アプタマーを使った基礎研究、臨床試験に関して非常に関心が深いということで、基本合意書を締結しました。
今日に至るまで、その内容を具体的に詰めています。我々としては、例えば「RBM-007」の滲出型加齢黄斑変性症(wet AMD)について、サウジアラビアから資金援助を受けて臨床試験を行う、また、KAIMRCの研究グループとアプタマーの共同研究を行うといったことを、ぜひ実現したいと思っています。この提携が双方にWin-Winになるような、実りあるかたちにしたいと考えています。
アプタマー(Aptamer)とは?

アプタマーに関しては、これまでも何度もお話をする機会がありました。核酸の短い1本鎖の配列がさまざまなかたちを作り、さまざまな働きをすることを利用して、医薬品の開発を進めています。
当社の重点領域

当社の重点領域についてご説明します。1つは希少疾患です。大手製薬企業があまり研究開発をしない市場で、我々の医薬品を開発します。
もう1つは、アプタマーという技術を使い、眼科領域に特化します。目の器官は非常に小さいため、使用する薬の量も少なくて済みます。また、目は閉鎖系器官で全身に漏出することが少ないため、安全性も非常に高くなります。以上の理由で、これらを当社の重点領域としています。
主要なパイプライン
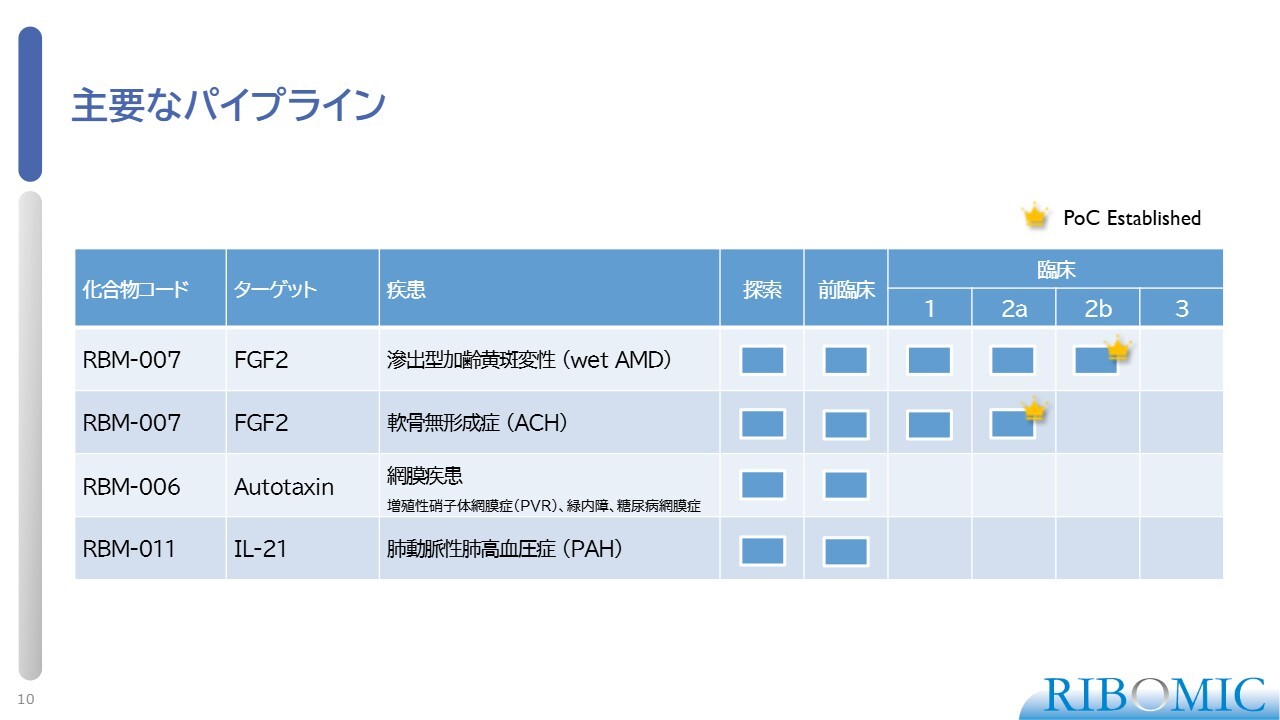
主要なパイプラインの一部を、スライドに示しています。まず、FGF2(線維芽細胞増殖因子2)に対する阻害剤「RBM-007」と、こちらを使用した滲出型加齢黄斑変性症(wet AMD)です。続いて、軟骨無形成症(ACH)です。これらのプログラムが順調に進んでおり、スライドに王冠マークで示しているとおり、Proof of concept(PoC)を獲得している状況です。
軟骨無形成症治療薬候補 RBM-007(umedaptanib pegol) 日本における希少疾病用医薬品指定

まずは、軟骨無形成症を対象とした臨床試験について簡単にご説明します。我々にとってのグッドニュースは、先月、厚労省より、軟骨無形成症治療薬候補RBM-007(umedaptanib pegol)が日本における希少疾病用医薬品指定を受けたことです。
これは、我々にとって非常に朗報で、さまざまな優遇措置が講じられます。例えば、臨床試験を行う費用の50パーセントまでの財務支援が期待できます。我々にとっては億単位の財務支援が期待できるというかたちで、今後はこれを有効に活用していきたいと考えています。
軟骨無形成症(ACH, Achondroplasia)
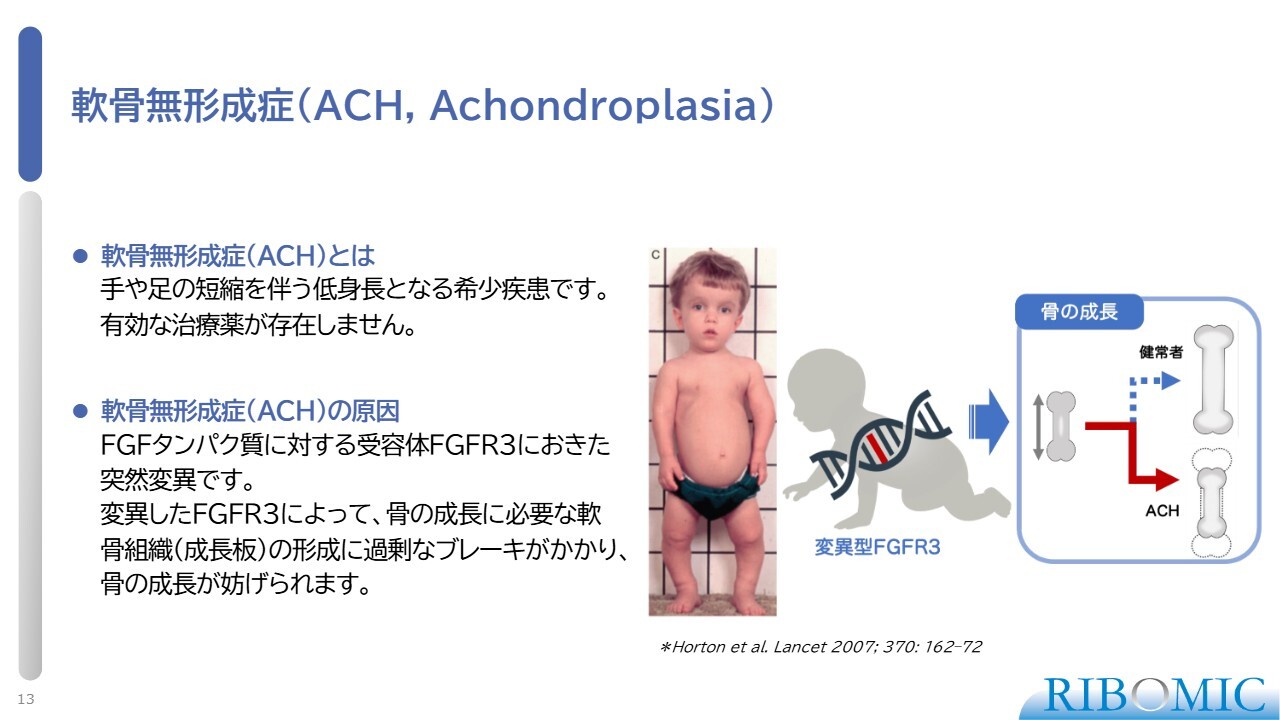
軟骨無形成症です。スライドの写真にあるように、手、足、骨が伸びないということで低身長になる希少疾患です。原因は、FGFタンパク質に対する3番目の受容体FGFR3に起きた突然変異により、骨の増殖を抑制するタイプのシグナルが発せられ、骨が伸びません。
FGFR3に作用する増殖因子としてFGF2が主力であるため、我々の「RBM-007」を使うことでFGF2をトラップし、抑制をかけることができます。その結果、骨が正常に伸びるのではないかと考えられます。
研究成果:Science Translational Medicine 掲載

試験管の中での実験、動物を使った実験を数多く行い、上記の仮説が正しいということを証明し、論文として発表しました。
臨床試験の概要
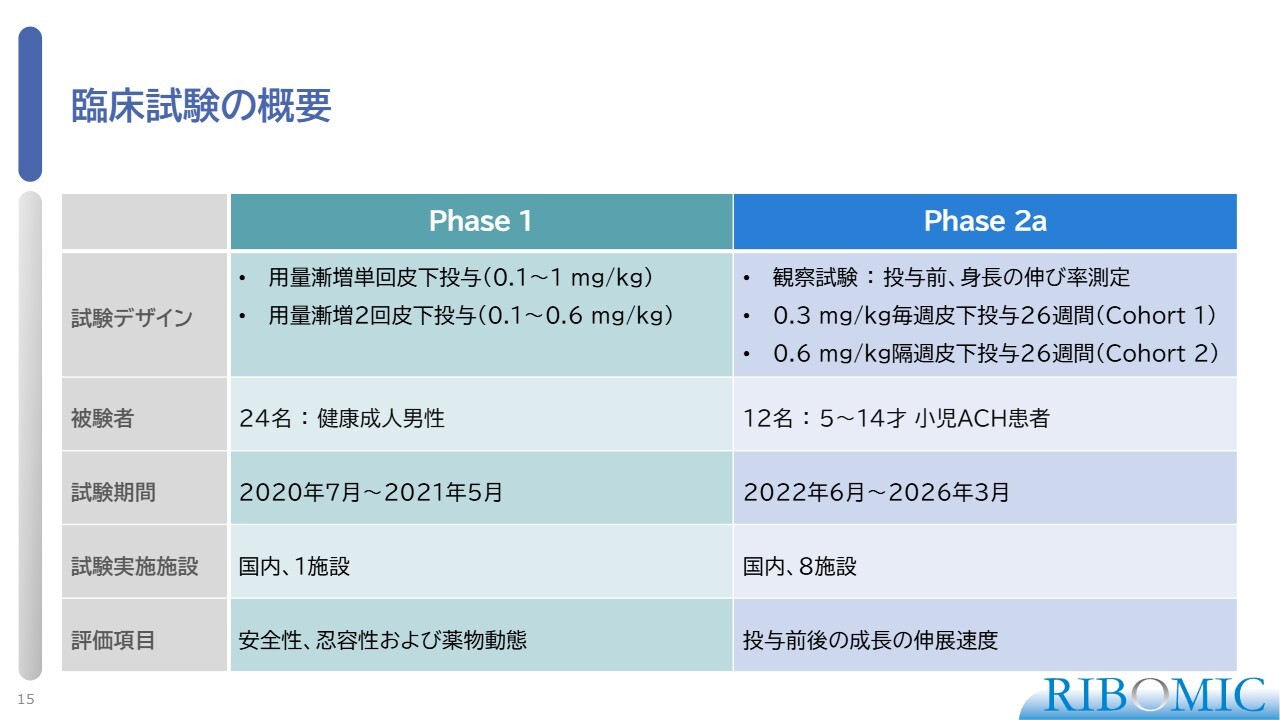
以上の経緯を踏まえて、臨床試験を進めてきています。まず、フェーズ1です。こちらは安全性、忍容性および薬物動態を調べる試験であり、薬として非常に安全だということを確認し、完了しました。
続いて、フェーズ2aです。こちらは、5歳から14歳の小児ACH患者さまに参加してもらい、我々の薬の効果を見ます。実際に、身長の伸びるスピードがどの程度獲得できるかを試験したものです。
Phase 2a 臨床試験デザイン
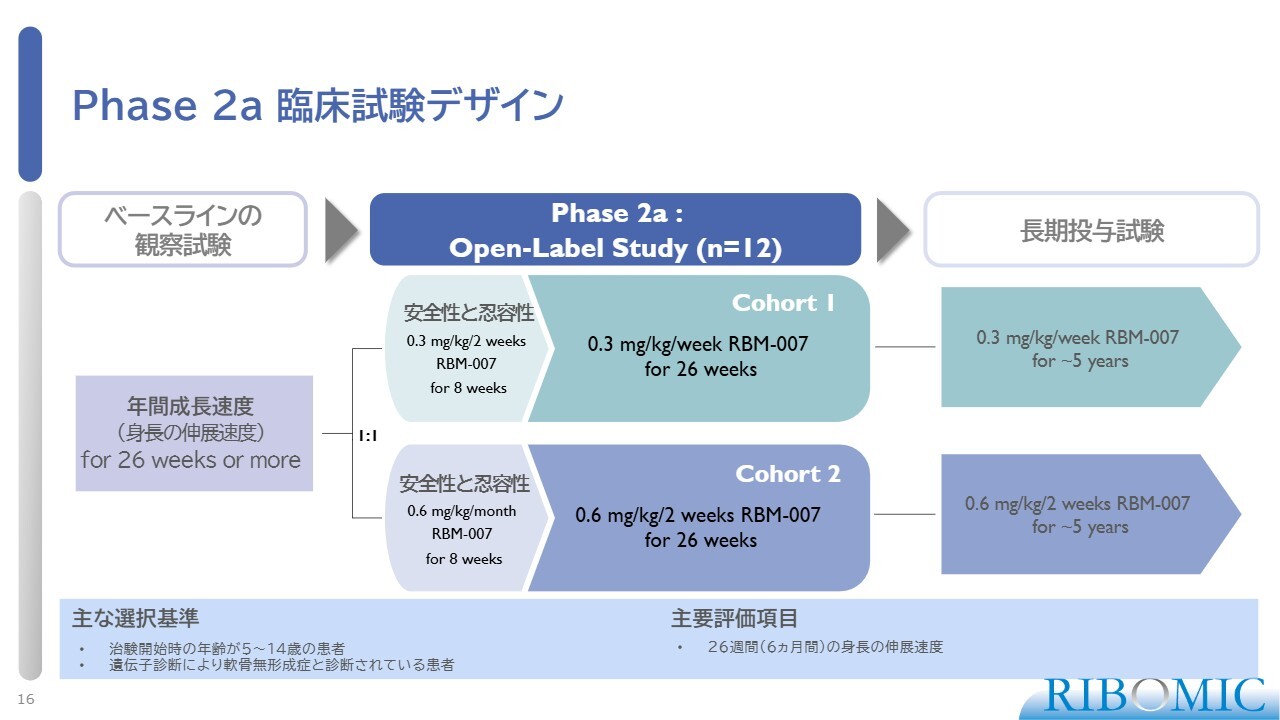
フェーズ2aの臨床試験デザインです。まず投薬する前に、半年間かけて、自然な身長の伸びのスピードがどの程度あるのかを見る観察試験を行います。その後、薬を2つのパターンに分けて投与します。1つは容量0.3ミリグラムで毎週、もう1つは容量0.6ミリグラムで2週間おきです。このようなデザインで、それぞれコホート1、コホート2と区別し、効果を見るということを行ってきています。
Phase 2a 臨床試験の進捗
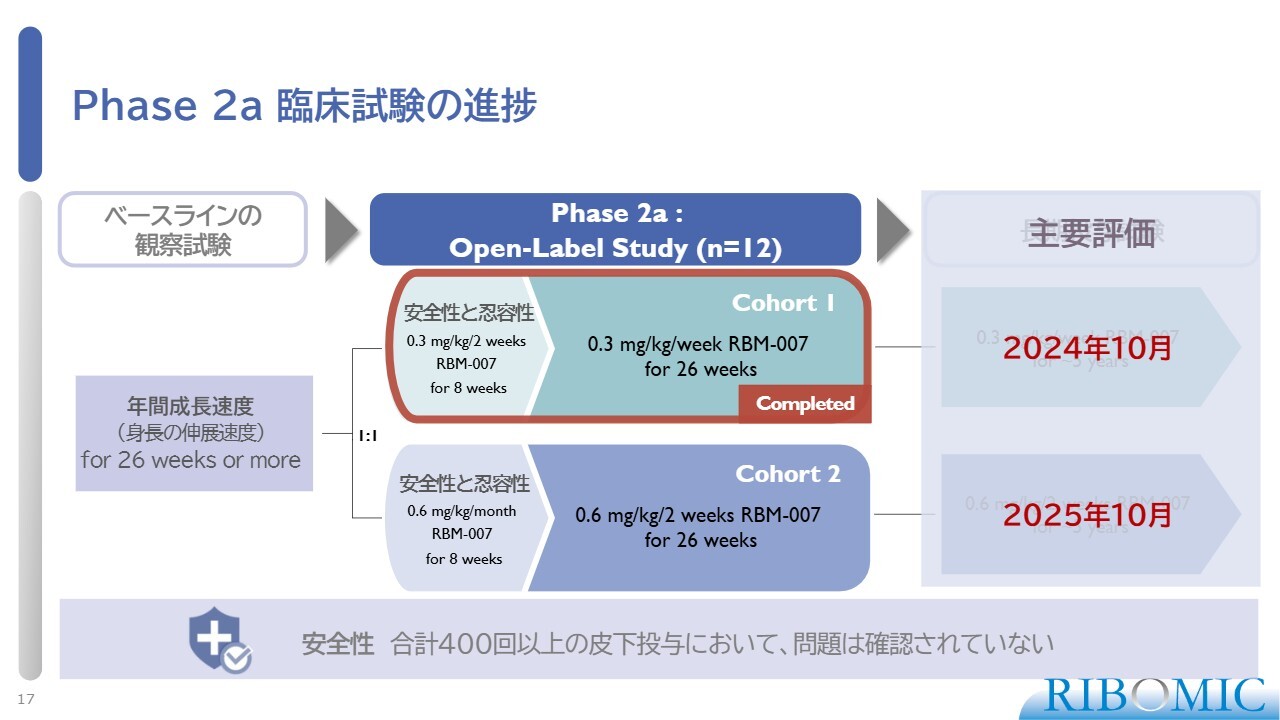
その結果、コホート1に関しては、昨年10月にすべての試験が完了しました。臨床試験の結果、安全性に関して、これまで問題は確認されていません。これまで合計400回以上の皮下投与をしていますが、安全性の懸念が出ていないということは、非常にすばらしいことです。まず、新薬は安全でなければいけないと考えています。
Phase 2a Cohort 1結果と他剤との比較
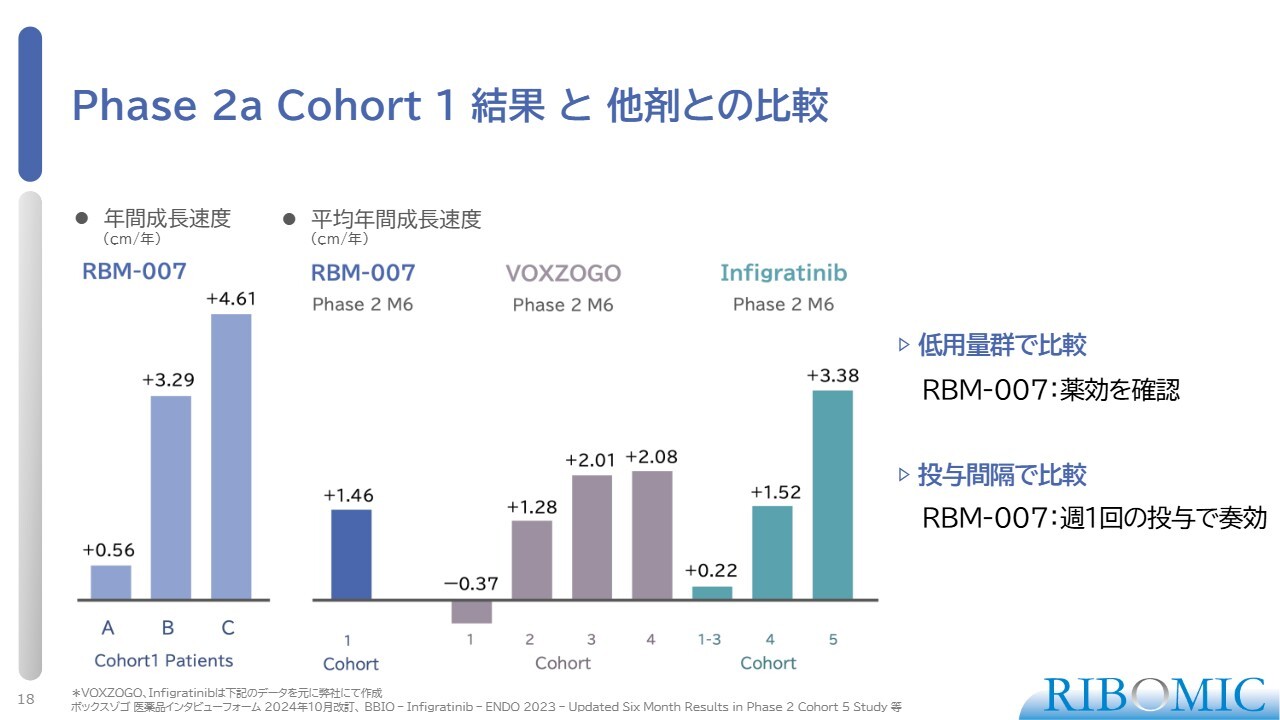
コホート1の結果と他剤との比較です。スライドの一番左のグラフは、年間成長速度を示しています。この3例に関しては、顕著に身長の伸びのスピードが出ています。左から2番目のグラフには平均年間成長速度を示していますが、平均でプラス1.46センチメートルというレベルでした。これは、すでに本邦でも承認されている「VOXZOGO」という薬とほぼ同程度の伸び率を、我々は一番低い用量で実現していることになります。
今後の方針
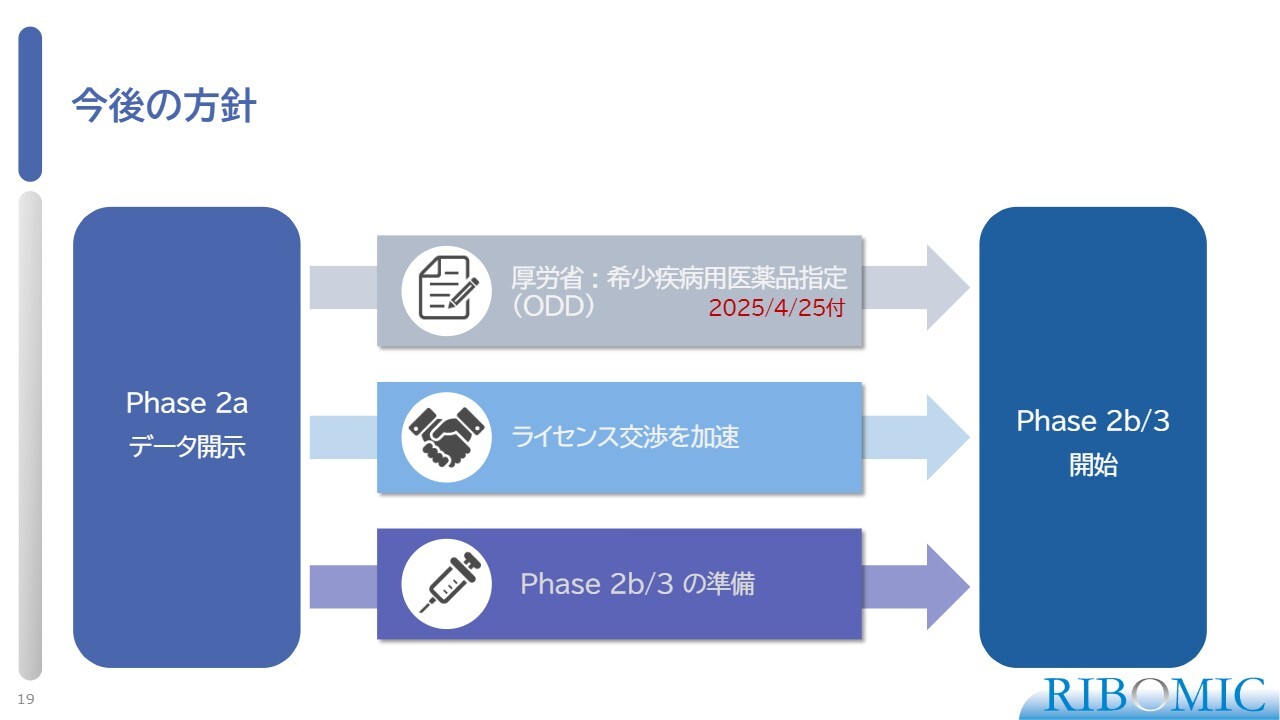
今後の方針です。我々は、実際に効果的なデータを示すことができており、また、希少疾病医薬品指定を獲得できたということで、現在ライセンス交渉を進めています。さらに、次の第3相試験に向け準備をしています。
第3相試験は、正式に厚労省から薬の製造承認をもらうための最終的な試験です。スライドには2bと書いてありますが、場合によっては直接第3相試験に入り、製造承認を求める方法を検討するかもしれません。今後は、そのようなかたちで開発を進めていきます。
ACH治療薬の作用機序
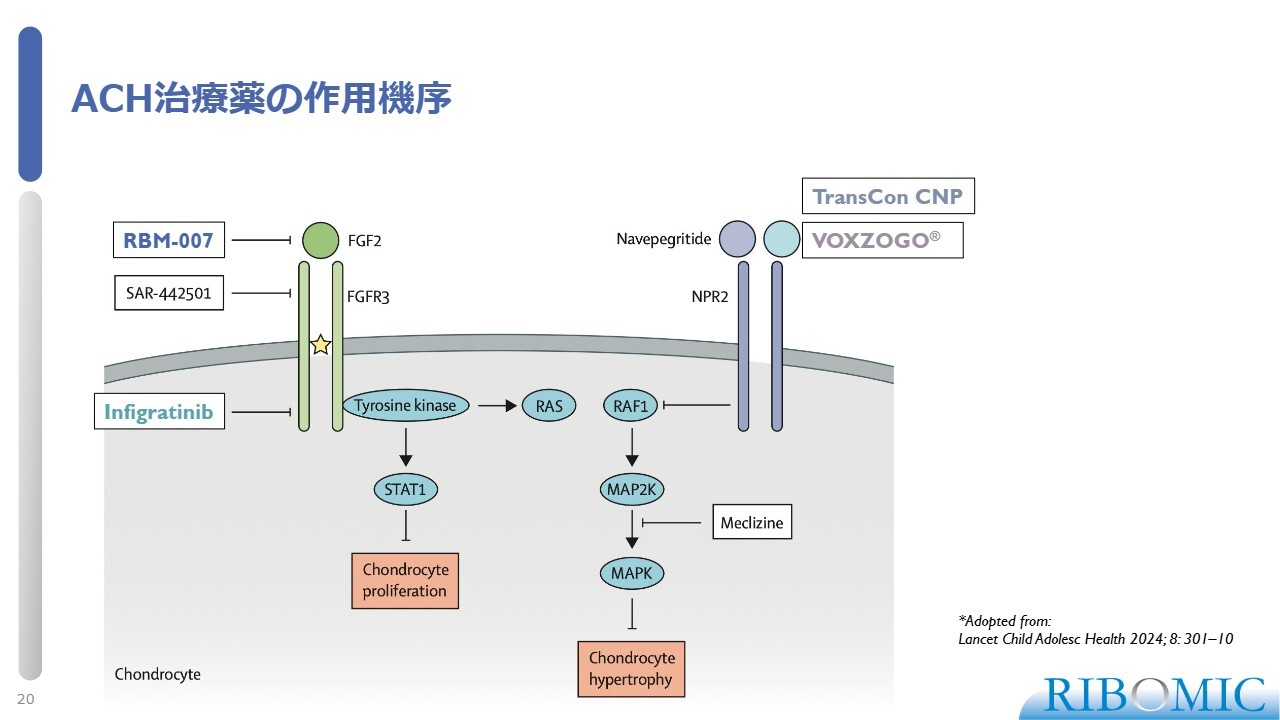
ACH治療薬の作用機序です。軟骨無形成症(ACH)に関しては、先ほどお話しした「VOXZOGO」という治療薬もあります。スライドに示すように、作用機序が各々異なっています。
我々の「RBM-007」は、FGF2をトラップできます。「VOXZOGO」やその誘導体である「TransCon CNP」は、別のシグナルのパスウェイに作用します。それぞれ異なる作用機序を持ち、いずれも軟骨の成長を回復させる作用があります。
他社開発品との差別化
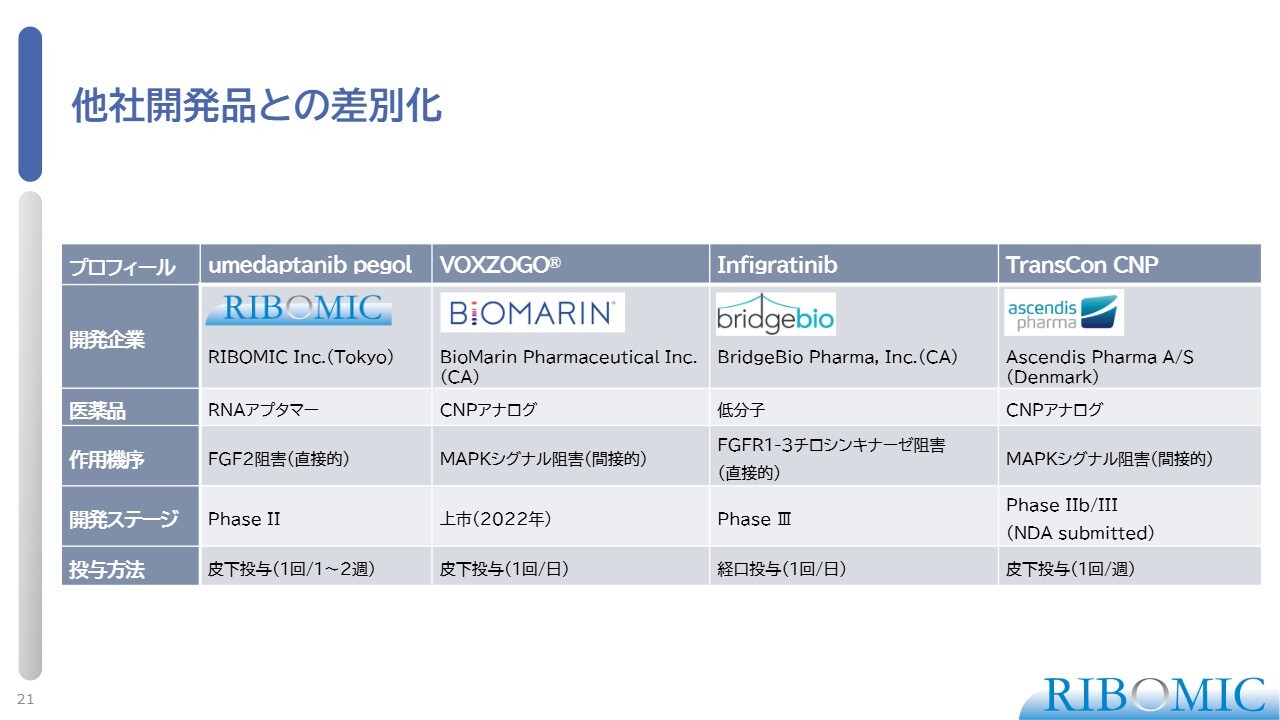
他社開発品との差別化を表にまとめています。スライドに記載の企業は、当社も含め、特徴的な医薬品開発を行っています。4つの開発品がありますが、作用機序が違うことをうまく利用すれば、1剤だけではなく2剤のコンビネーションも十分あり得ます。そのような中で当社の立ち位置を確立することで、患者さまに我々の薬を届けたいと考えています。
拡大する網膜疾患の市場
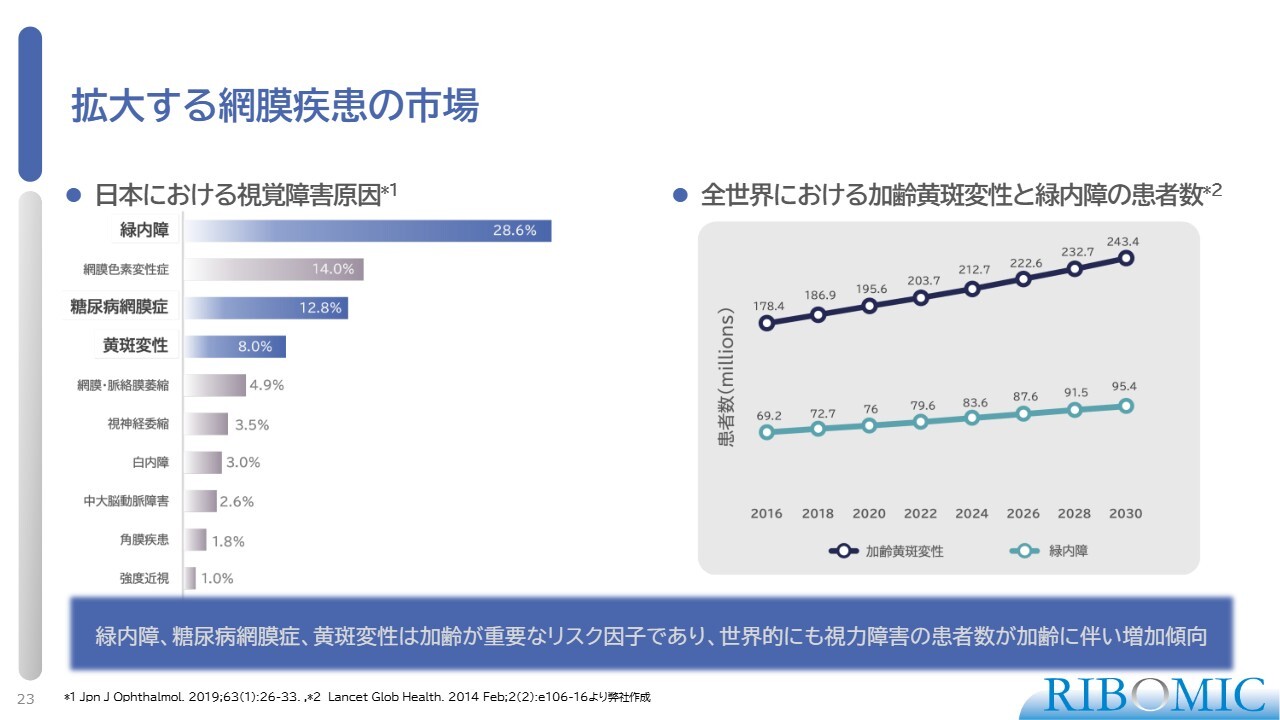
続いて、アプタマーの網膜疾患治療薬への展開についてご説明します。まず、拡大する網膜疾患の市場についてです。日本においては、緑内障が視覚障害原因の第1位です。スライドでは続けて、糖尿病網膜症、黄斑変性とあります。世界的には、加齢黄斑変性の罹患率が一番高く、緑内障も増加傾向にあります。依然として、目の疾患に対する新しい薬剤が必要な状況です。
RBMアプタマーの網膜疾患への適応
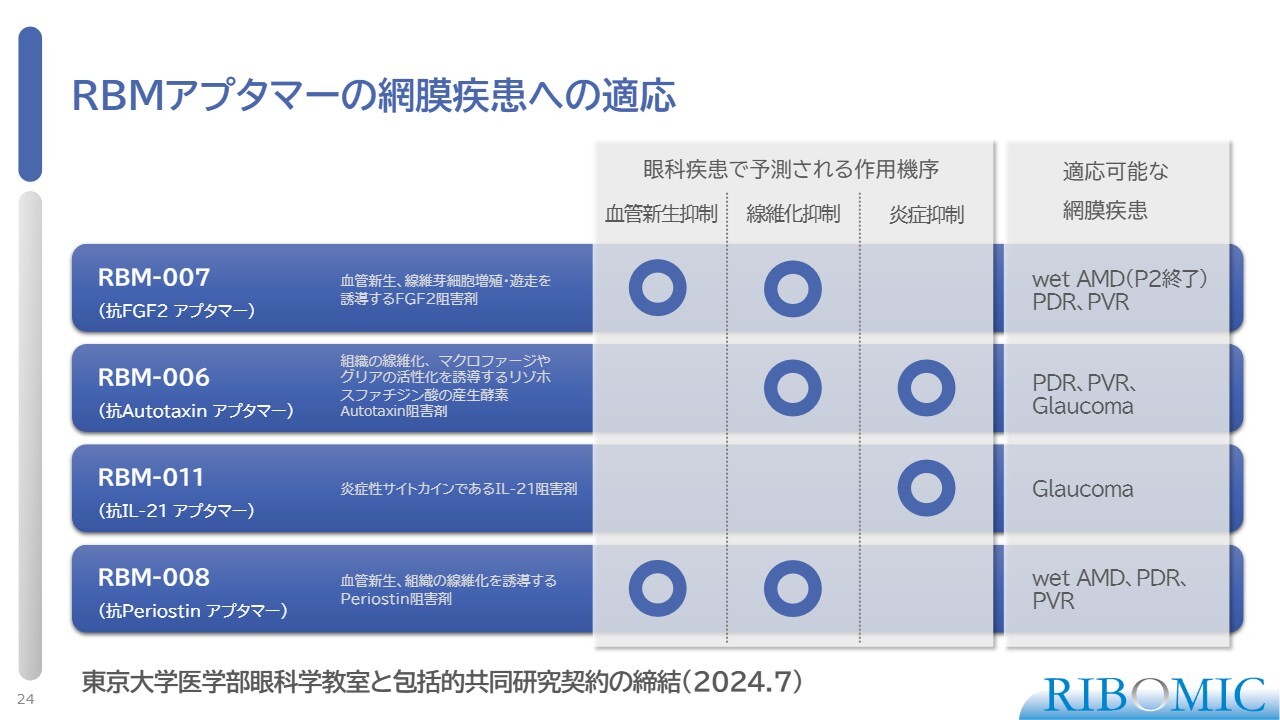
ほとんどの眼科疾患は、血管新生、線維化、炎症が原因です。そのため、このうちの1つ、もしくは複数のステップを阻害する薬を開発しています。
スライドに示した当社のアプタマーは免疫系や炎症系への阻害作用を持っており、さまざまな眼科疾患に関する医薬品の開発が可能だろうと考えています。現在、東京大学医学部眼科学教室と包括的共同研究契約を締結し、鋭意解析を進めています。
滲出型加齢黄斑変性(wet AMD)
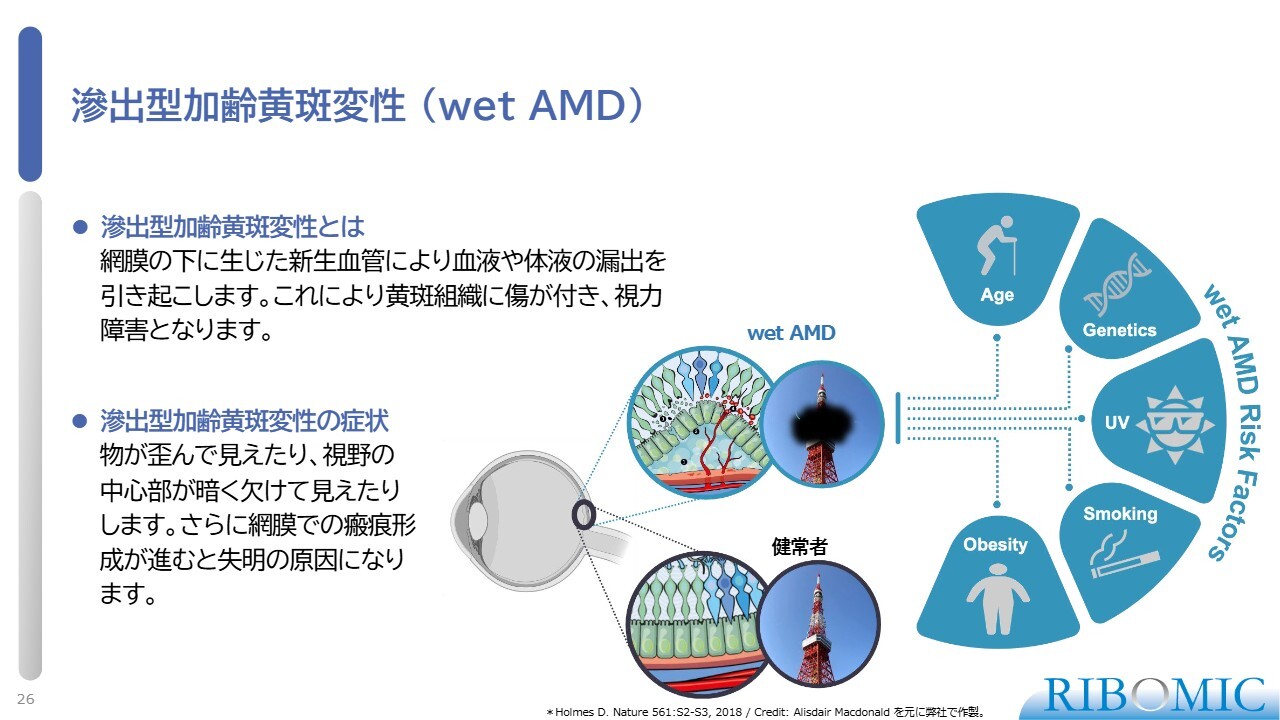
「RBM-007」を使用したwet AMD治療については、これまで何回もご説明してきました。wet AMDに罹患すると、スライドの図にあるように、目の奥のほうで炎症が起き、血管新生が起きます。新しい血管は血液などが漏れやすく、眼底に溜まった血液が目の視神経部分を破壊します。そのため、血管新生を促進するVEGFという増殖因子の働きを抑える抗VEGF薬が広く使われ、標準治療とされています。
標準治療(抗VEGF薬)のUnmet Need

標準治療に使用されている抗VEGF薬は、非常にすばらしい薬ですが、万能というわけではありません。標準治療を行っていても、目の奥のほうで線維化が進み、瘢痕、いわゆるかさぶたが目の奥に発生してしまいます。これを完全に防ぐことは難しく、最終的に失明に至る可能性があります。そのため、この線維化を抑制する薬の開発が世界的に求められていますが、現時点ではまだ実現していません。
臨床試験の概要
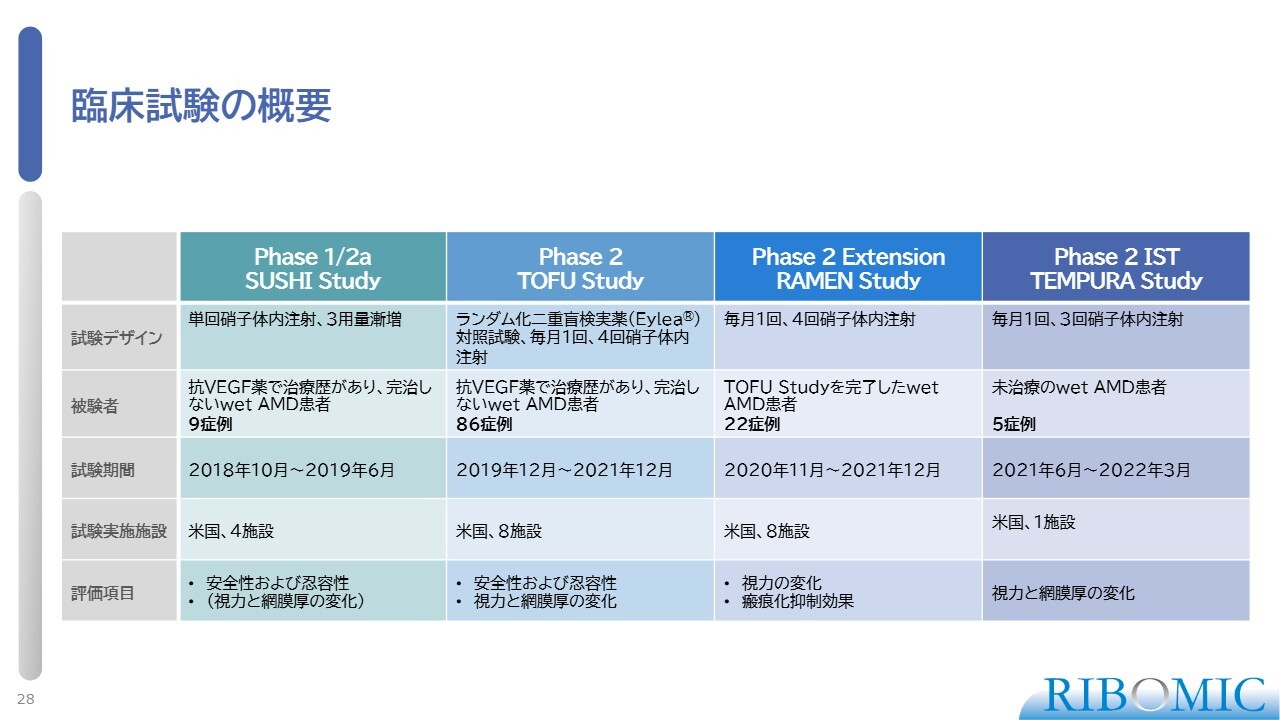
我々は「RBM-007」に瘢痕抑制作用がある可能性を見出し、それを検証するためにこれまで臨床試験を進めてきました。
臨床試験の概要をスライドにまとめました。フェーズ1/2aでは、患者さまに薬剤を投与し、安全性と忍容性を確認しています。メイン試験となるフェーズ2のTOFU Studyはランダム化した二重盲検試験で、「Eylea」という実薬との比較検証を行っています。これまで標準治療を長く受けてきたものの完治していない患者さま86名に参加していただき、我々の薬の作用を確認しました。
さらに、その次のRAMEN Studyでは、TOFU Studyを完了した患者さま22名に対して、さらに続けて、1ヶ月間隔で4回、我々の薬を硝子体眼球注射する試験を行いました。また、スライド一番右側のTEMPURA Studyでは、これまでまったく治療歴がない患者さまに対して我々の薬の効果を確認する試験を行いました。
RBM-007 の臨床POC(Proof of Concept)確立
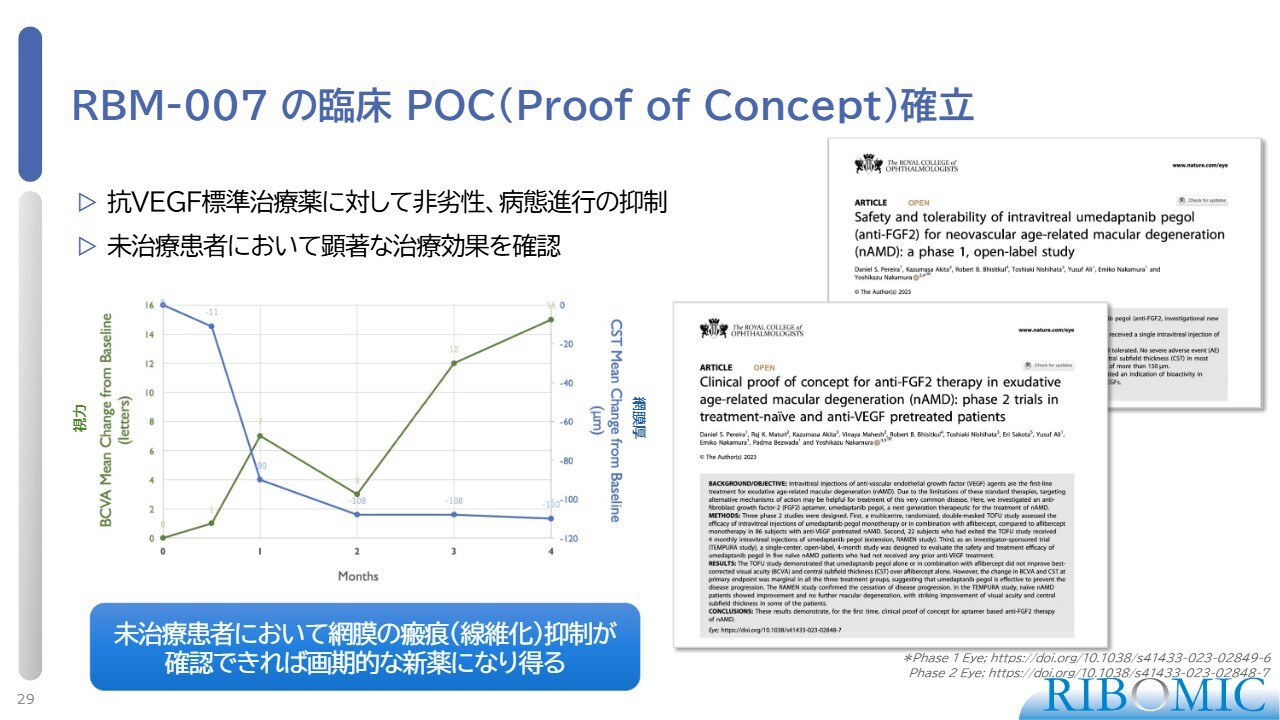
それらの結果をスライドにまとめました。「RBM-007」は、既存の「Eylea」という抗VEGF治療薬とほぼ同等の効果があり、非劣性でした。そして、病態の進行を抑制できることが明らかになりました。
さらに、未治療の患者さま5例において非常に顕著な治療効果を確認することができました。このような結果から、我々はPoCを確立することができました。
また、この結果については、昨年、英国王立眼科学会の機関誌で2報の論文を発表することができました。今後は、さらに拡大した試験に結びつけていきたいと考えています。
今後の計画:提携実現と承認申請のための臨床試験の実施
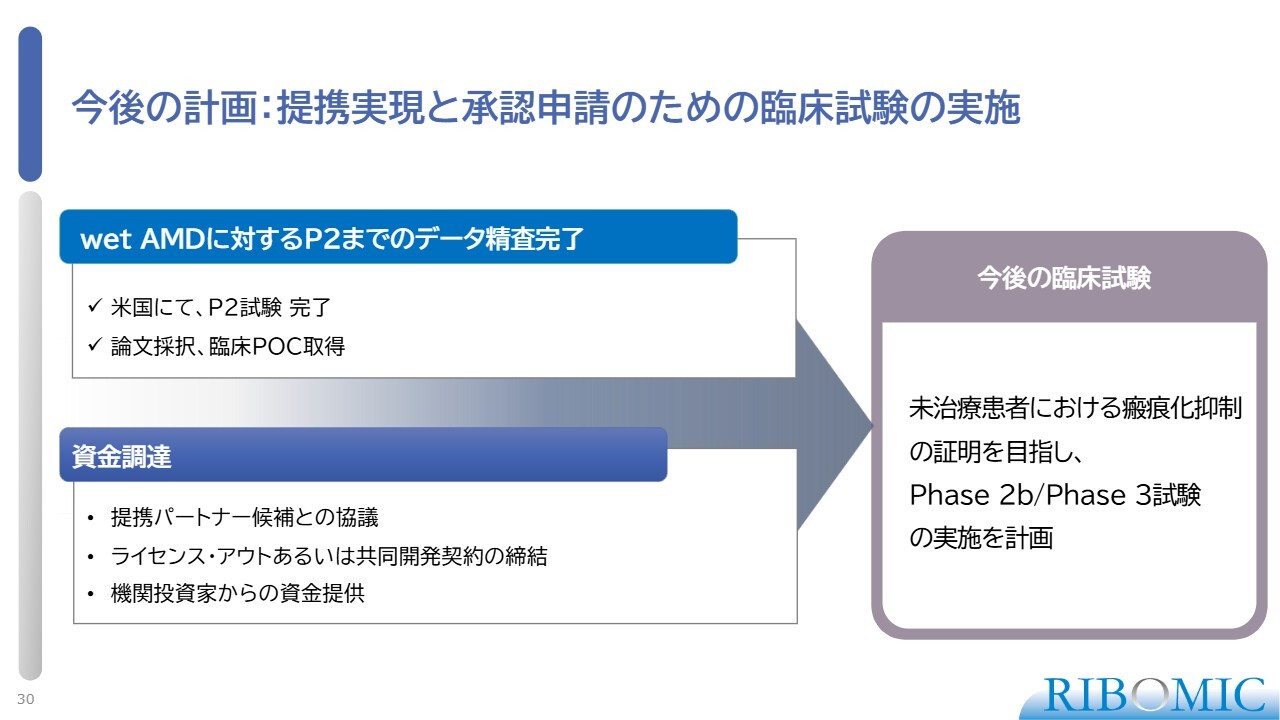
今後、我々はパートナーを見つけるか、あるいはサウジアラビアの支援のもと、可能であればサウジアラビアにおいて、wet AMDの未治療の患者さまを対象にフェーズ3の臨床試験を行いたいと考えています。試験が成功すれば、世の中が変わるような画期的な薬が登場すると期待しています。
RBM-006 (抗Autotaxin アプタマー)
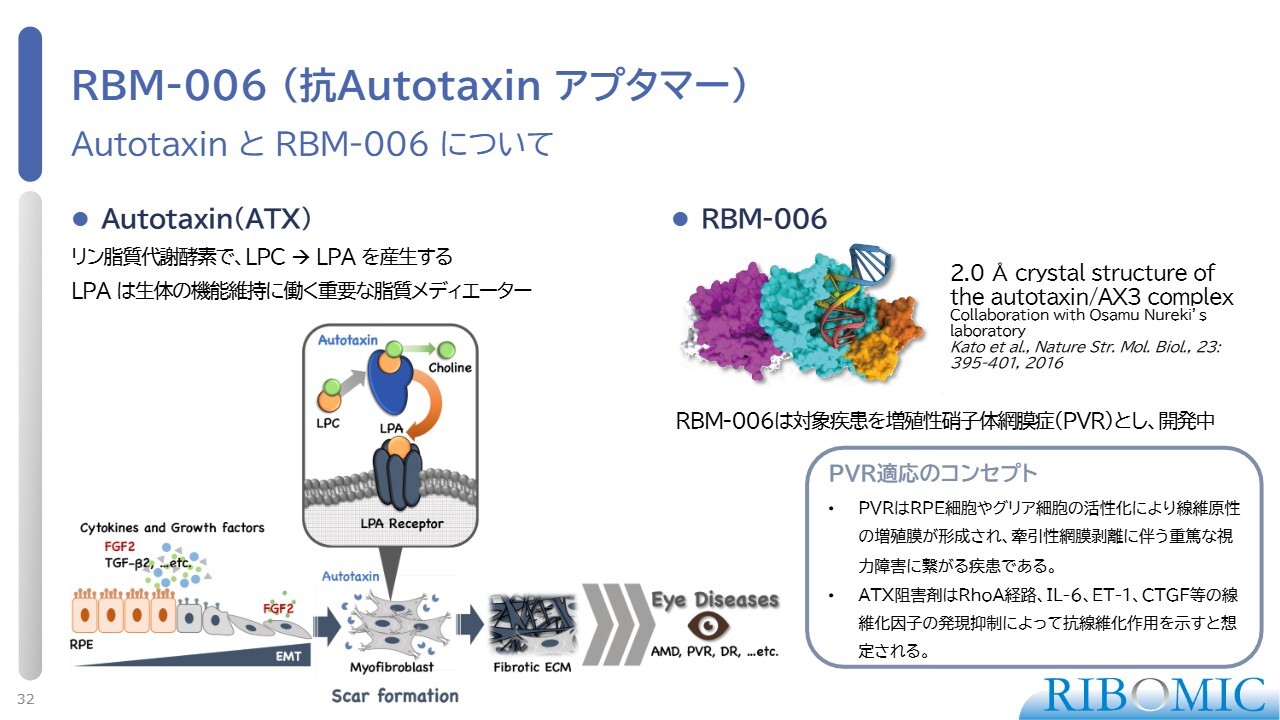
「RBM-006」は、Autotaxinに作用し、眼科疾患において非常に有望なアプタマーです。Autotaxinは、リン脂質代謝酵素でLPAというリン脂質を作ります。LPAは、生体の中に非常に多くあるもので、目の中にもたくさんあります。LPAの働きが強すぎると線維化が起き、線維化が起きると、さまざまな病気の発症につながります。
例えば、増殖性硝子体網膜症(PVR)や緑内障、糖尿病網膜症といった、非常に重篤な疾患につながることがあります。我々は、次に抗Autotaxinアプタマー「RBM-006」に集中して取り組み、解析を進めていきたいと思っています。
RBM-006 (抗Autotaxin アプタマー)

スライドは、現在は旭川医科大学に移られた長岡先生と共同で行った実験結果です。網膜剥離の原因となるPVR(硝子体網膜症)について、ブタのモデルを使用し、非常に良い成果を得ることができました。これを皮切りに、我々は他の網膜疾患に対しても「RBM-006」の薬効を確認するため、現在、東京大学医学部眼科学教室と一緒に解析を進めています。
次世代型アプタマー医薬品の体内動態制御に向けた新規技術開発
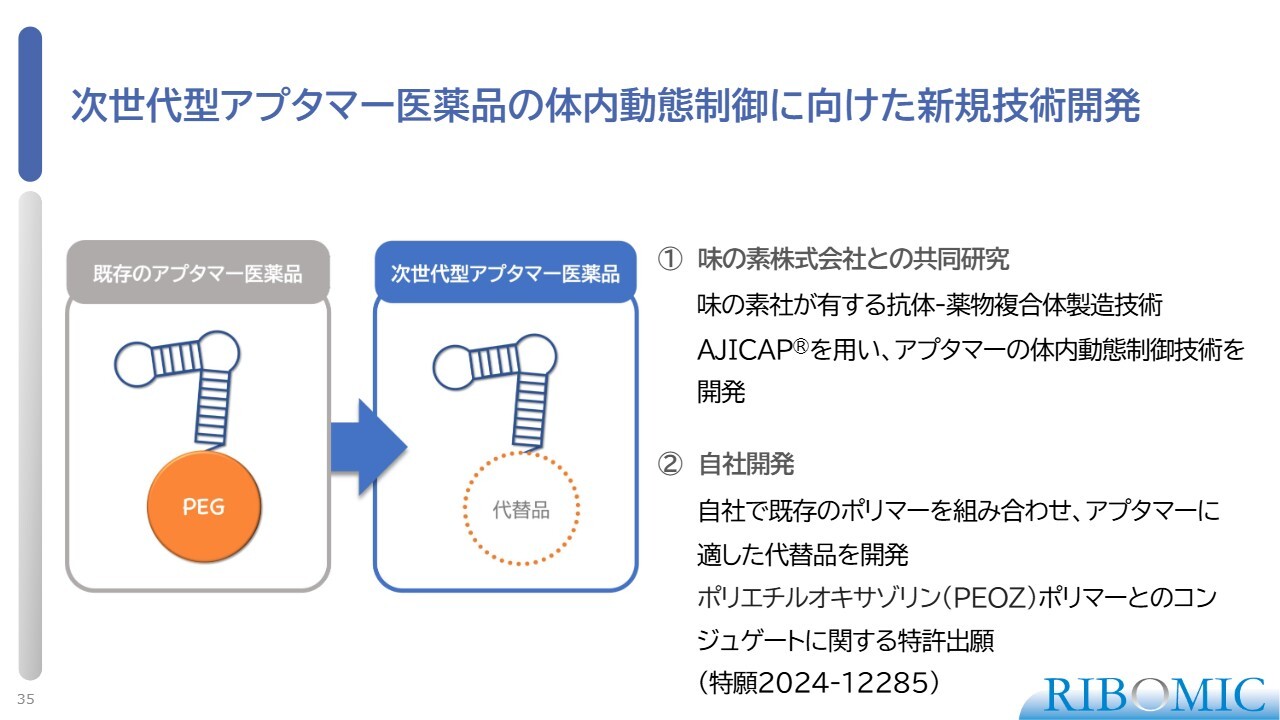
次世代型アプタマー医薬品についてお話しします。まず、アプタマーはそのままの状態では体内で非常に不安定なため、安定化させる必要があります。そのため、我々は日頃から使用しているポリエチレングリコール(PEG)という安定化用のポリマーをアプタマーに付けています。
しかし、粘性が高いという問題があるため、我々はPEGに代わる良い代替品を見つけるべく開発を進めてきました。その結果、スライドにあるように、PEOZという新しいポリマーを代替品として開発し、特許出願を完了しています。
次世代型アプタマー医薬品の体内動態制御に向けた新規技術開発
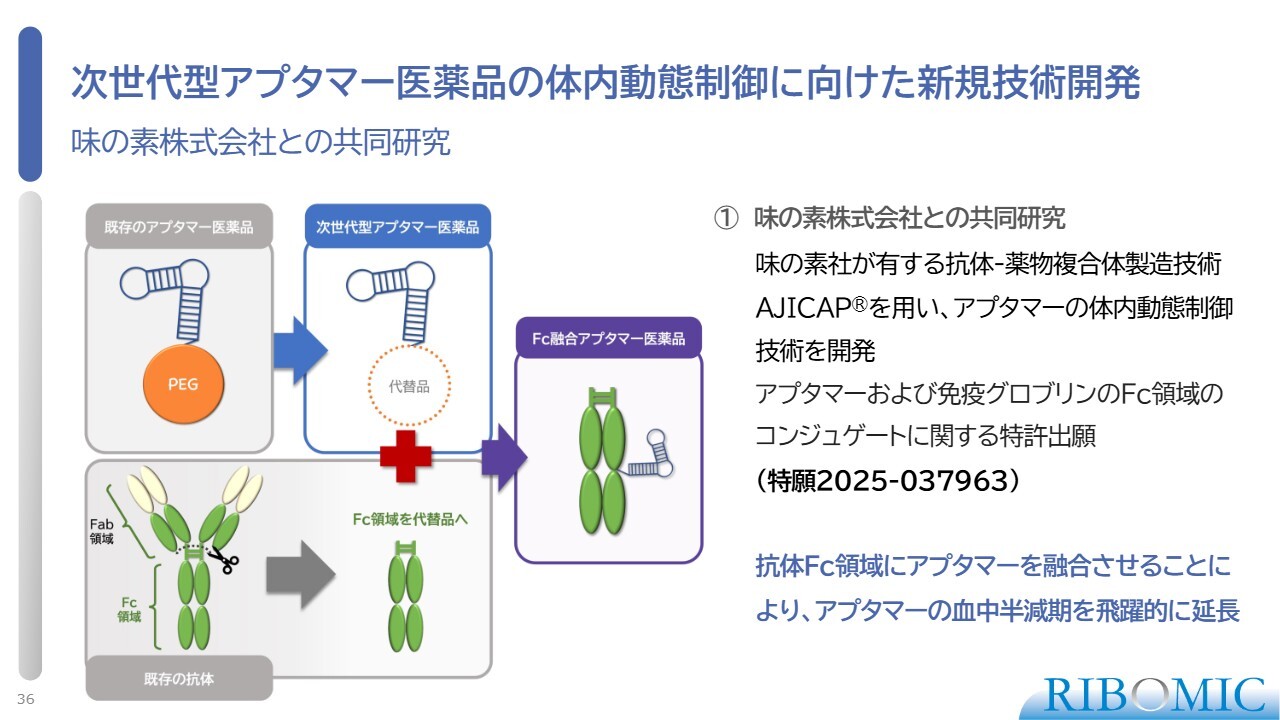
抗体は、Fc領域というY字型をした根元部分があるため、体内動態が良く、非常に長い時間、体内に滞留します。このことに注目し、味の素の技術を用いてFc領域を切り取り、直接アプタマーに結合するという開発を共同で行いました。その結果、体内動態の画期的な改善が見られました。こちらも特許出願を完了しています。
今後、この技術が、核酸医薬あるいはアプタマーを安定化させる世界標準の技術になるのではないかと期待しています。
AI アプタマーのコンセプト
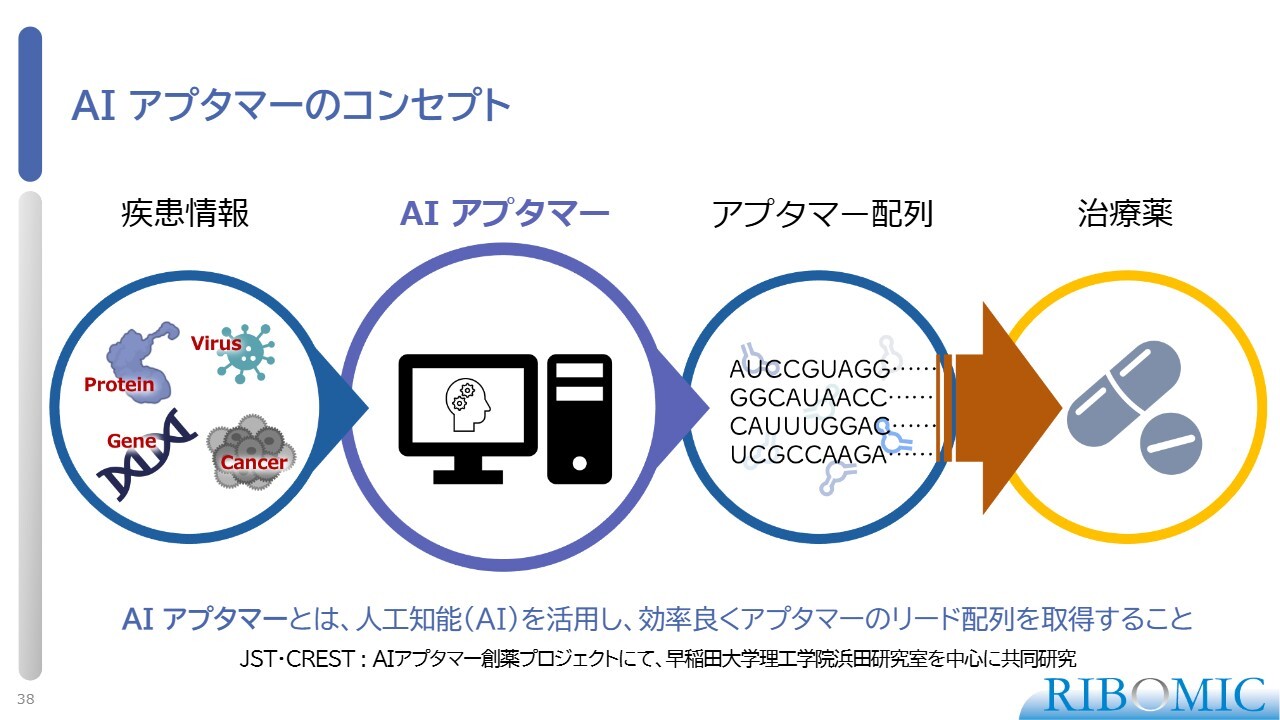
人工知能の活用についてです。アプタマーは、A、U、G、Cといった核酸塩基配列の繰り返しで構成されているため、AIの深層学習を用い、さまざまなアプタマーの配列を統合的に整理することで、いろいろなことができるようになります。この分野について、早稲田大学の浜田教授と共同研究を長年続けており、アプタマーにAIを活用した技術開発では、我々が世界でトップクラスだと考えています。
AI アプタマーの進捗
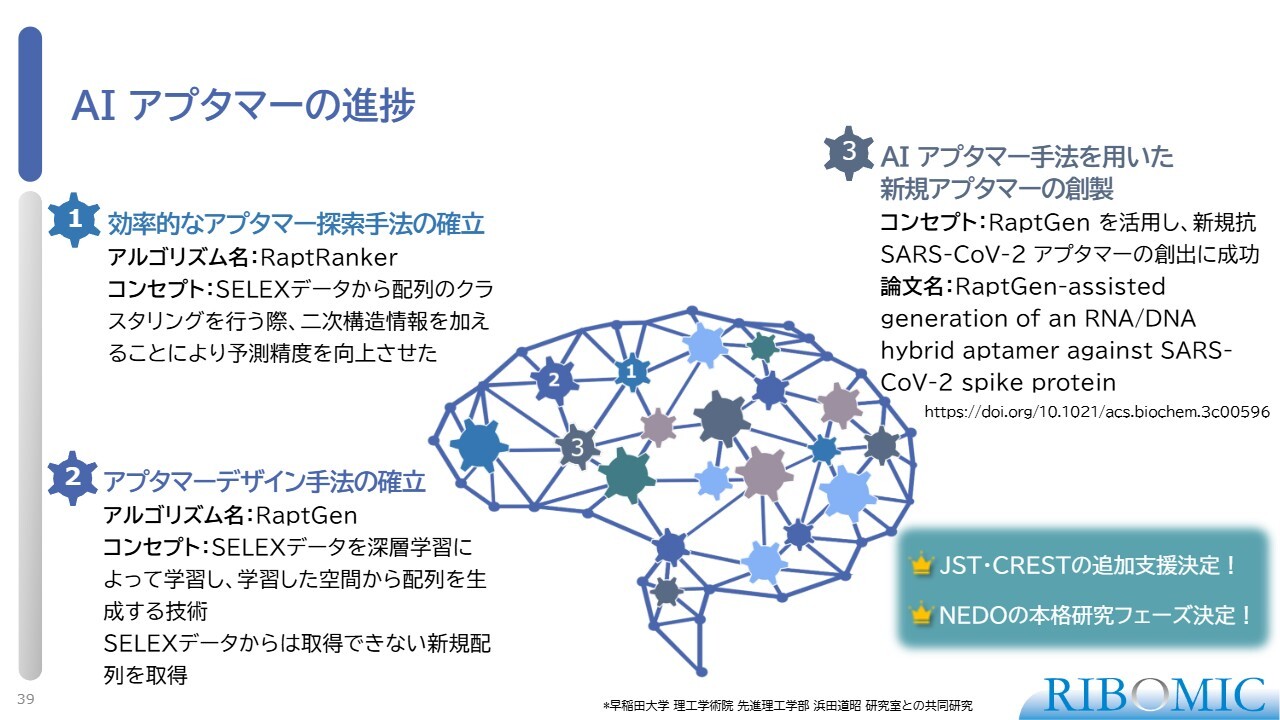
その結果、AIを活用して「RaptRanker」という新しいアルゴリズムを開発しました。また、実験では得られていない新規の配列を入手する「RaptGen」というアルゴリズムも開発しました。このようなアルゴリズムを用いて、例えばCOVID-19に対するアプタマーを創出するなど、現在その応用は大きく広がっています。我々は、この領域で他の追随を許さないトップランナーとして取り組みを進めている状況です。
DDSアプタマーのコンセプト
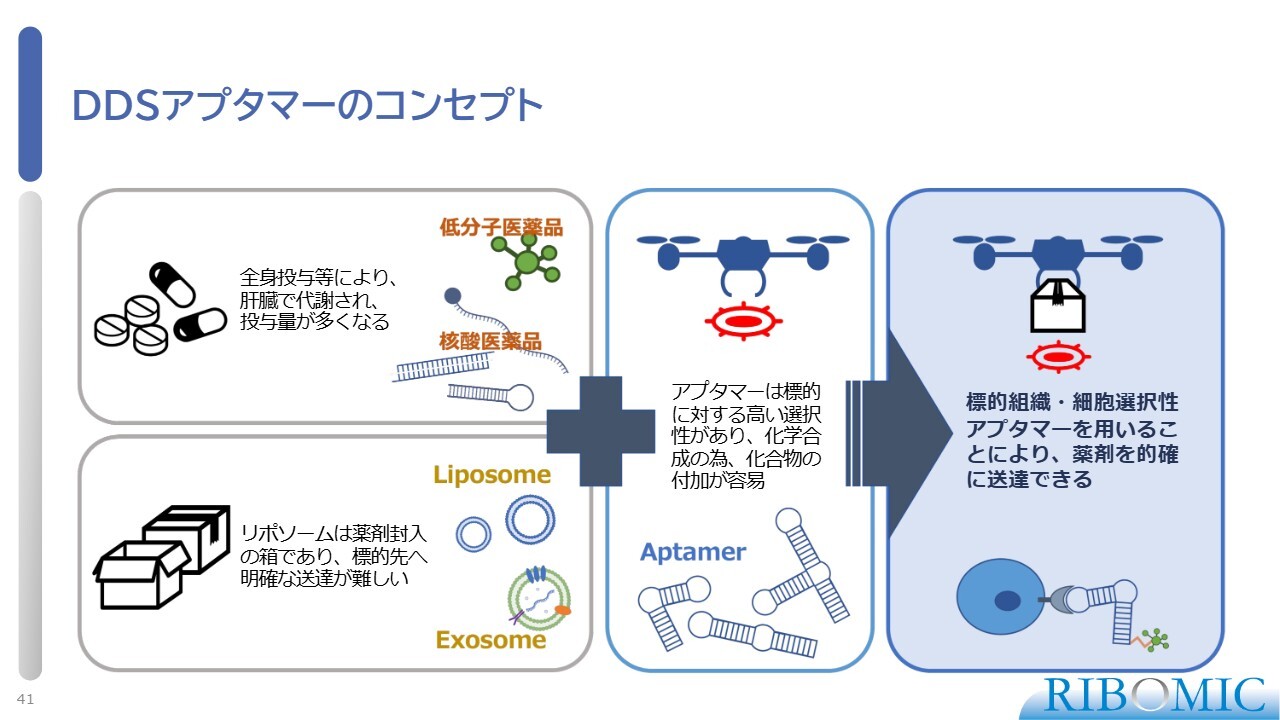
DDSアプタマーについてお話しします。DDSは、核酸医薬を狙った臓器に届けるために、必須となる技術です。そのためにはさまざまな方法がありますが、我々は、アプタマーがターゲットとなる臓器や細胞の表面を狙って結合するという特性を利用して新しいDDS技術を開発し、当社のプラットフォームとして世界展開したいと考えています。
新規DDSアプタマー技術開発の進捗
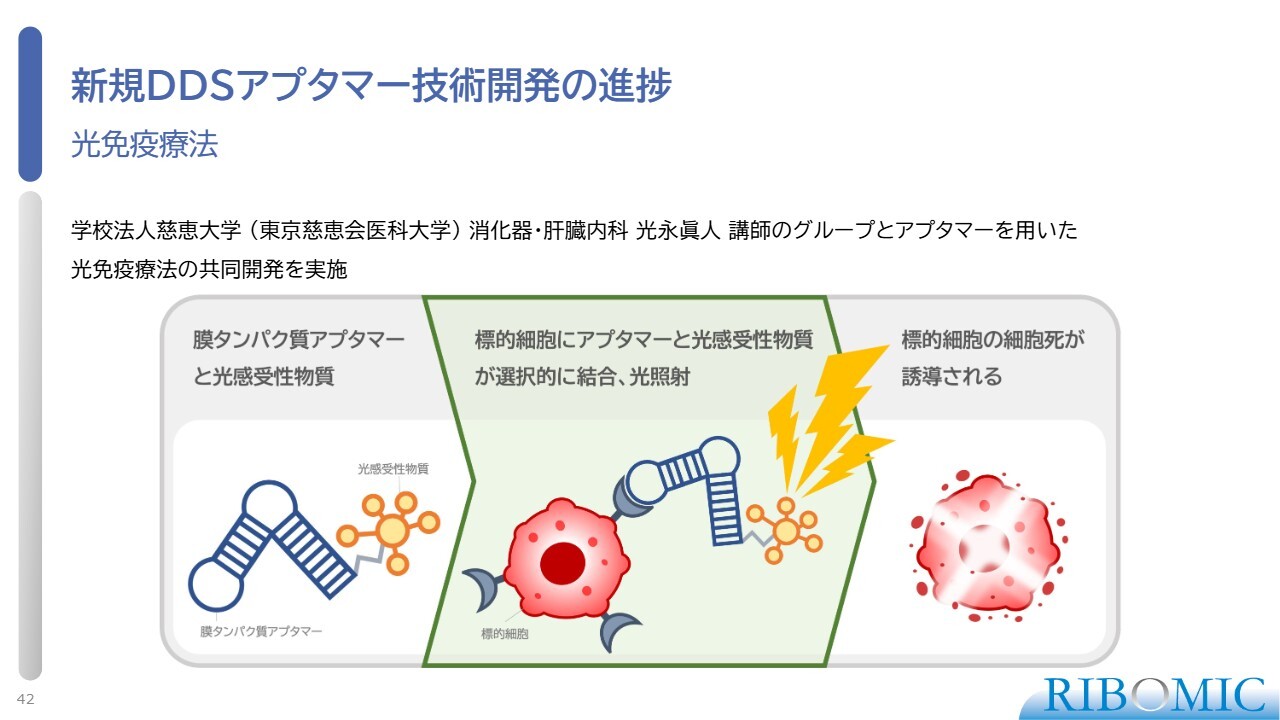
新規DDSアプタマーの1つがこちらです。スライドにある光免疫療法は、光感受性物質とアプタマーががん細胞に結合し、光を照射すると光感受性物質が励起し、がん細胞を破壊するという治療方法です。このようなDDSアプタマーの技術開発を、東京慈恵会医科大学の光永先生と共同で行っています。
新規DDSアプタマー技術開発の進捗
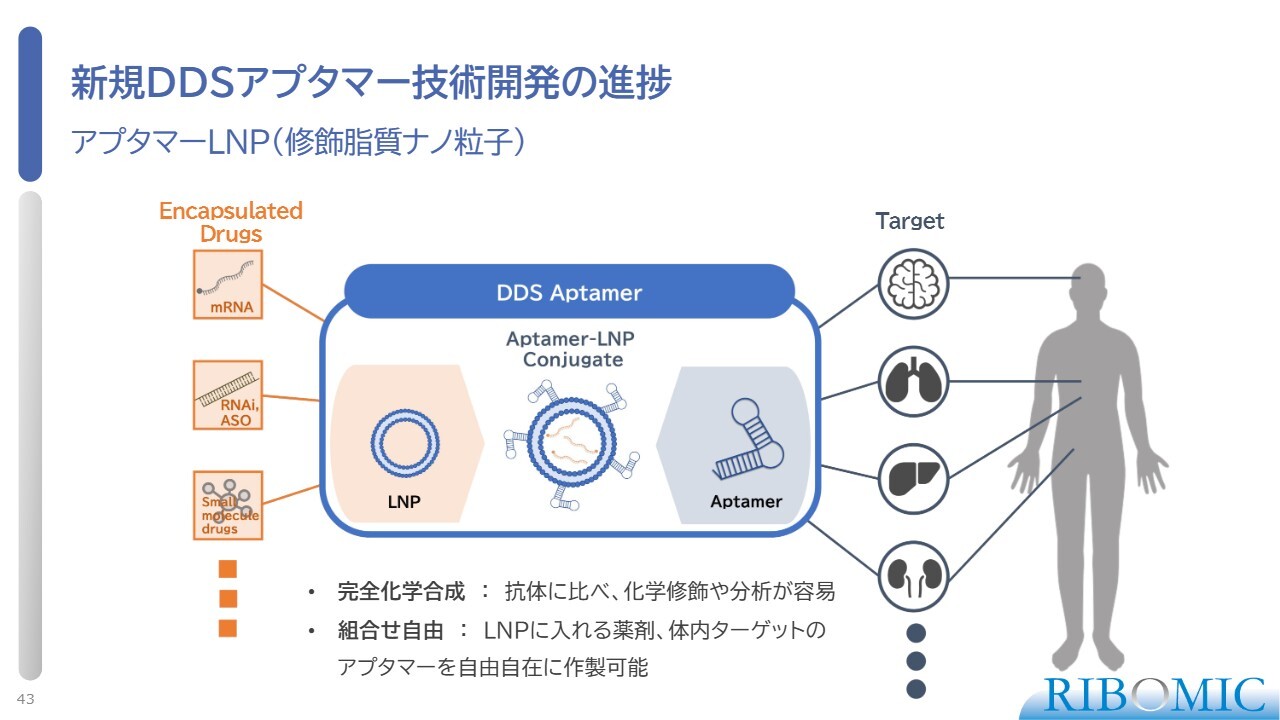
また、アプタマーLNPは、LNPという修飾脂質ナノ粒子の中にさまざまな薬を入れ、表面にアプタマーを付けることで、目的とする臓器に薬を運ぶという仕組みです。ターゲットは、例えば脳、肺、腎臓、血球といった、通常薬が到達しにくい部位です。アプタマー付きのLNPを用いることで、こうした部位にも薬を届ける治療方法の開発に取り組んでいます。
現在、当社ではこの技術に関する新しいデータを次々と取得しており、さまざまな会社とディスカッションを行っています。今後、我々の専売特許のプラットフォームとして、世界展開していきたいと考えています。
損益計算書の概要
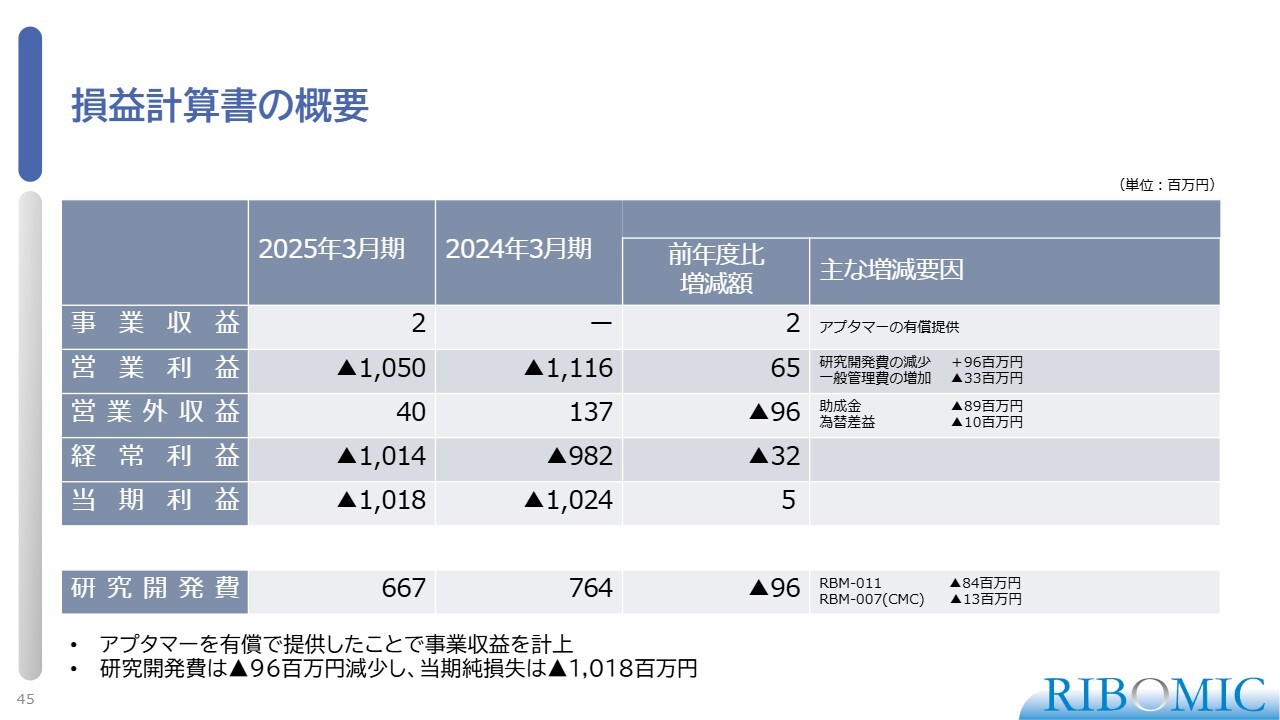
損益計算書の概要です。支出を約10億円に収めることができました。
貸借対照表の概要
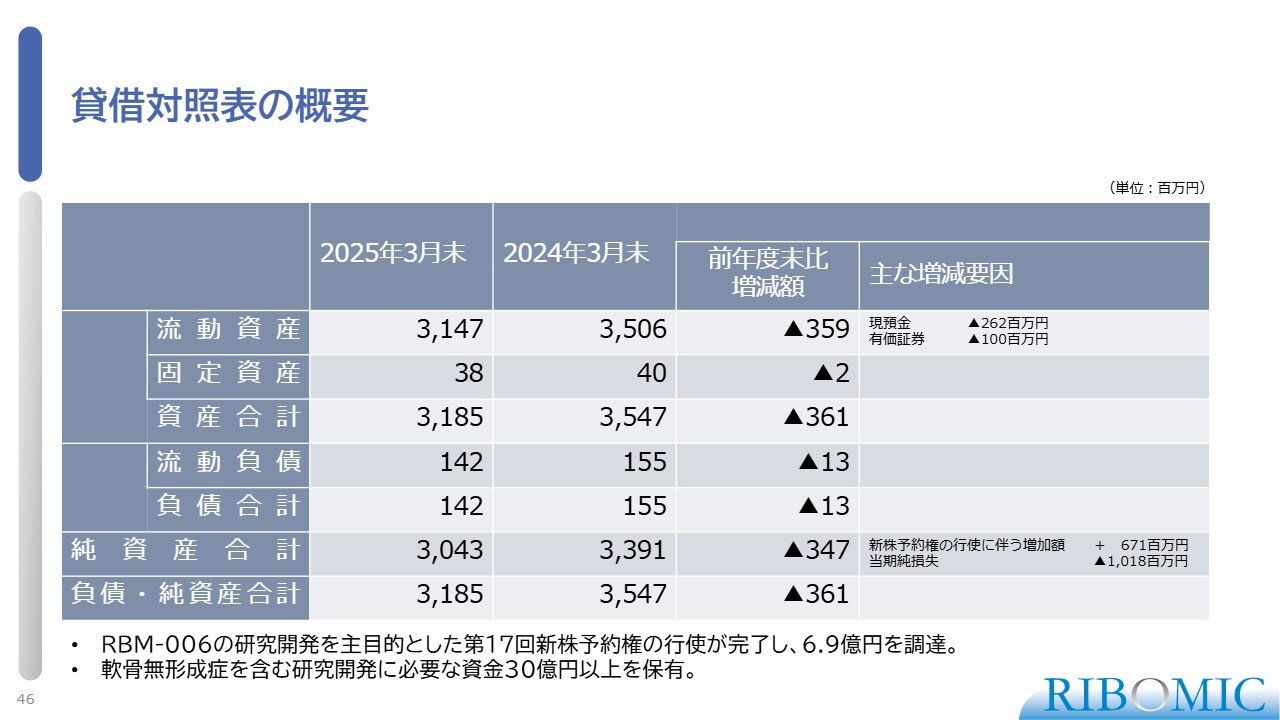
貸借対照表です。現在、手持ち資金は30億円強です。今後、約2年から3年間の資金は確保できており、現時点で事業の遂行に支障はありません。
資金調達

昨年3月に第17回新株予約権の割当を実施し、6億9,000万円を調達することができました。
公的研究助成金

NEDOから公的な助成金も頂戴し、研究開発を進めている状況です。
ご説明は以上です。ご清聴、ありがとうございました。
新着ログ
「医薬品」のログ