サンバイオ、上期は増収増益 スズケンと提携し患者サポートシステムR-SATを共同開発
連結損益計算書
森敬太氏:あらためまして、こんにちは。サンバイオの森でございます。本日もお越しいただきましてありがとうございます。
先日来申し上げていますが、我々は「R&Dのバイオベンチャーからフルスペックの製薬企業に」「再生医療のグローバルリーダーになる」を掲げて進めております。本日は日本での承認、グローバルでの開発事業化についてお話します。
先ほどプレスリリースをしたばかりのアメリカFDAからのRMATは、先駆けに準じる非常に重要なマイルストンを達成したと考えていますが、この話につきましては、昨日アメリカより来たチーフ・メディカル・オフィサーのビジャン・ネジャドニクから、しっかりとお話をしたいと思います。
それでは私から、手短に決算報告にまいりたいと思います。
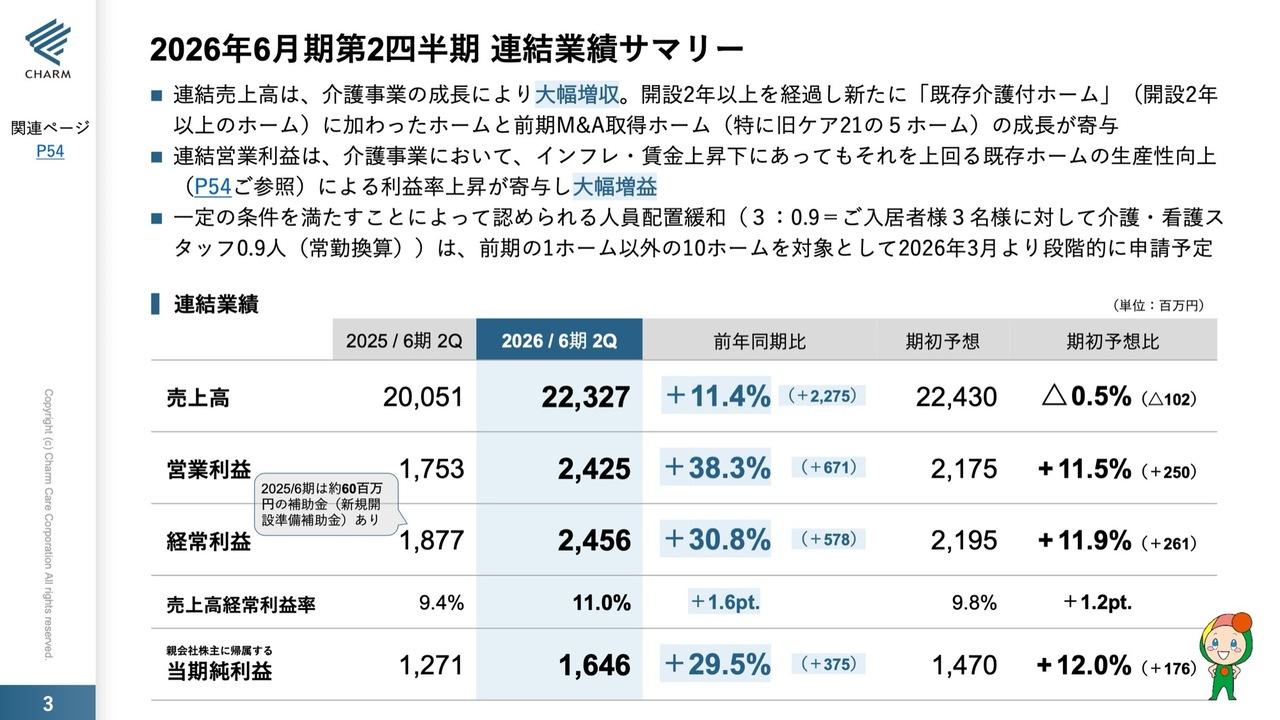
今期の連結の損益計算書でございます。我々は、アメリカやヨーロッパのバイオベンチャーに負けない、あるいは大きく勝っていくために、赤字になっても積極的に開発を続けてきています。
今期につきましても、その方針は変わらず、実績としては半期で研究開発費20億円強を使っています。数字としては、期ズレの要因の差異がありますが、開発は順調に進捗しています。
連結貸借対照表
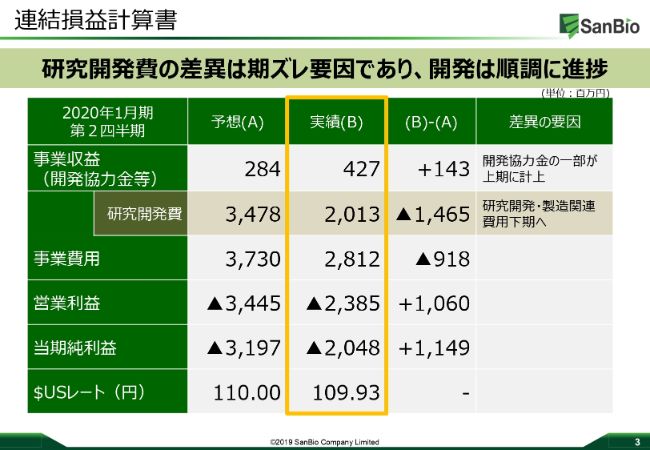
「積極的に研究開発を進めていくために、キャッシュについてもしっかり持っていこう」という方針のもと、今期は71億円の増資に成功しています。これによって財務基盤は強固になり、現金及び預金で約167億3,200万円を保有し、安定的で積極的な研究開発を続けてきています。
事業目標
昨年くらいから、研究開発に加えて「製薬企業に脱皮」するために、実際に自販を行うためのインフラも整えてきています。今日プレゼンをいたします山本、ドクター・ビジャン・ネジャドニク、辻村……みな、「グローバルにリーダーになる」ビジョンのもと、この1年にサンバイオに参画してきておりまして、非常にありがたいことだなと感じています。
来年の「製薬企業へ脱皮する」と「グローバルリーダーに成長する」に関する、実際の詳しい話を、各責任者からお伝えしていきたいと思います。それでは、山本さんよろしくお願いします。
山本寛氏:山本でございます。それでは、私から今の日本の国内の事業の準備状況について、1つずつご説明いたします。
国内流通-スズケンと提携

まず、8月5日にニュースリリースをした件でございます。大枠で決定していることは、再生細胞薬に関して、スズケンさんと基本的に流通業務で合意したことと、患者さんのサポートシステムを実際に開発していくにあたり、共同開発が始まったということでございます。
なぜ、スズケンさんとの提携かと申しますと、医薬品卸業界の、スペシャリティ医薬品の流通に関しては、スズケンさんがかなりノウハウを持っていることが1つの理由です。厳格な温度管理などをしつつ物品を医療機関まで届けるときに、「スズケンさんがベストだろう」という回答に至りました。実は弊社で、「患者さんにしっかり根付いてサポートしていけるシステムを作りたいんです」という相談を投げかけたときに、賛同してもらったのがスズケンさんであったということでございます。
では実際のサポートシステムに関して、ご紹介いたします。
R-SATシステムとは
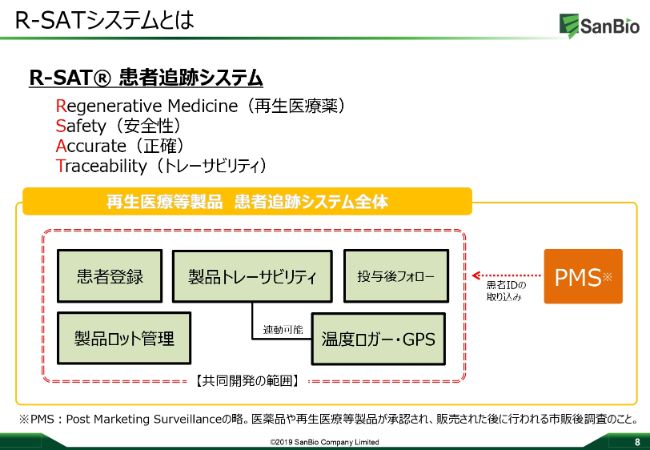
「R‐SAT®」という名称でございますが、これは現在商標登録しており、特許も申請しています。「R‐SAT®」は由来はと申しますと、再生医療薬のRegenerative MedicineのR、安全性のSafetyのS、正確のAccurateのA、そしてTraceabilityのT、この頭文字4つから来ています。
この「R‐SAT®」のシステムが、どのような機能を有するのかについてご説明いたします。
比較的高額になる製品に類似品があってはいけませんので、クラウドを使った患者さんの登録、製品のロット管理など、そしっかりとチェックしていく機能を持たせます。
また、マイナス150度のコントロール下で、製品を医療機関に届けないといけません。そのときに温度逸脱があってはいけませんので、温度ロガーをきっちりとつける、製品が今どこにあるのかをしっかりと把握してするためにGPSをつけるなど、製品トレーサビリティをしっかりと担保していきます。
実際に患者さんに投与される以前だけでなく、投与中、投与後もしっかり患者さんをサポートしていきたいと考えているシステムでございます。
物流構想
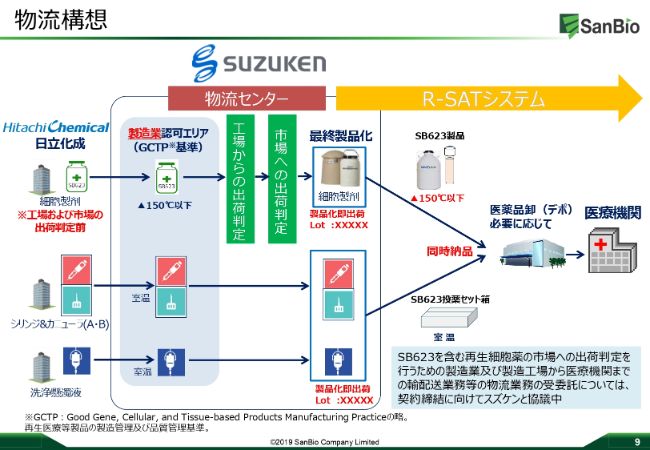
こちらが実際の物流の流れになります。細胞製剤は日立化成に委託していますので、日立化成で細胞が製造され、スズケンの物流センターにありGCTPのコントロール下にあるエリアの中で保管されます。
腹腔製品と呼ばれる「シリンジ」「カニューラ」「洗浄懸濁液」といったものも、パートナー企業から入手し、同様にスズケンの物流センターGCTPのコントロール下で保管いたします。
このGCTPコントロールの下で、液体窒素を詰めたドライシッパーの中に細胞を移管し、最終製品とします。これらの最終製品を投薬セット箱に詰め込み、オペ日の前日に医療機関に届けるというシステムを、「R‐SAT®」を使って進めていきたいと考えています。
情報の流れ
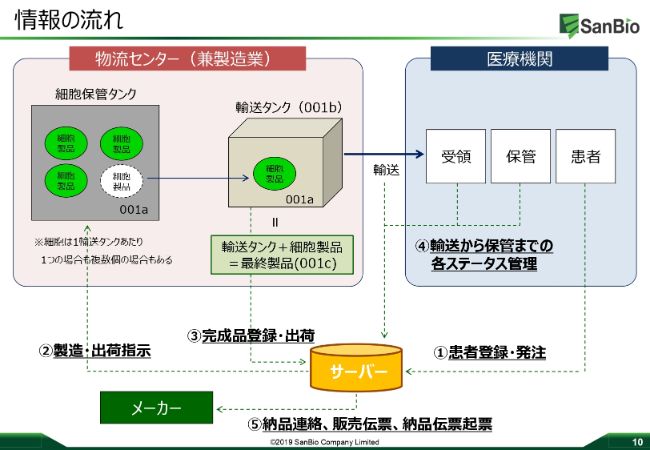
「R‐SAT®」が、実際にどういうかたちで動いていくか、というのがこちらのスライドになります。この「R‐SAT®」は実は、情報を管理し、しっかりとシェアしていくシステムになっており、医療機関において先生方やオペに関連する方々に、患者さんのオペ日や患者さんの情報といったものをクラウド上にインプットしていただきます。
このインプットしていただいた情報をいろんなかたちでスケジュール化し、私たちサンバイオや、製造のスズケン、トラックの運転手さんなど、すべてのステークホルダーにその情報がシェアされるというものでございます。
スケジュールが決まったら製造の指示が始まり、物流センターの中に入っている細胞保管タンクの中から細胞を取り出して、ドライシッパーの中にその細胞を移し替えます。そしてそれが最終製品として登録され、トレーサビリティを担保しながら、オペ日の前日に医療機関に届く、といったシステムになっています。
R-SATシステムの一部
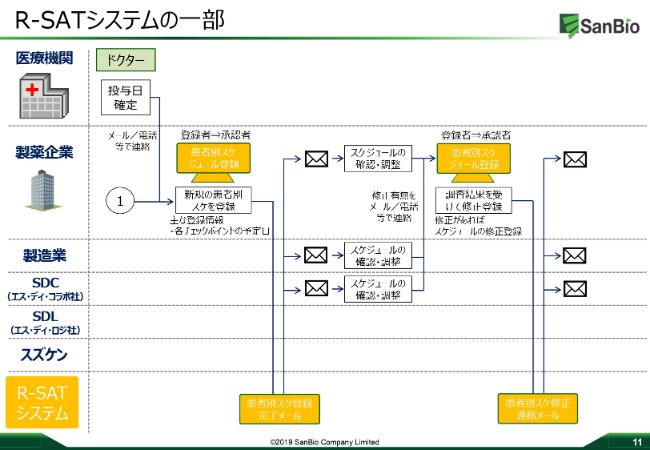
これが実際のシステムの概要の一部でございます。先ほどお話いたしましたように、投与日をいただきますと、どういったかたちで製造が始まるのか、どういったルートで医療機関に物が届くのか、どういったトラックのナンバーで届くのか、どこを受け渡しのポイントになるのか、といったすべての情報がスケジュール化されます。それが一斉に関係者に送信され、みながOKした段階で、物品が前日までに届くシステムになっています。
R-SATシステムの特徴

このシステムの特徴に関して、私は病院さまに対しても、患者さん・医師・私たち自身卸し・メーカーにとってもメリットがあると思っています。
例えば、先ほどスケジュールを一元管理すると申しましたが、手術日を明確化し、手術室の確保や細胞調整を誰が担当するのか、担当者が休んだ際にどなたがバックアップするのか、といったかたちで病院さまに対しても貢献できるだろうと考えています。
当製品は、市販後調査が必須になってくると思われます。非常に忙しい先生たちは市販後調査を忘れがちになりますが、ここに対してリマインドメールを届けます。
このリマインドメールは医師だけではなく、私たちサイエンティフィックアプローチをするメディカルメンバーにも届きますし、物を納入したMSさんにも届きます。こういったかたちで市販後調査もしっかりとすることが、患者さんへのフォローアップに繋がると考えています。
また、ドライシッパーに動画をつけ、GPS機能を有していますので、その製品を実際にドライシッパーから開けたかどうかがわかります。開けていない製品は、オペがされなかった場合には返品を可能とし、細胞に関して無駄をなくしていきたいと考えています。
このシステムの開発に関しましては、かなりの費用がかかります。ただ、「それでもこのシステムを開発したい」という思いの裏には、実はこうした構想がございます。
再生医療プラットフォーム構想
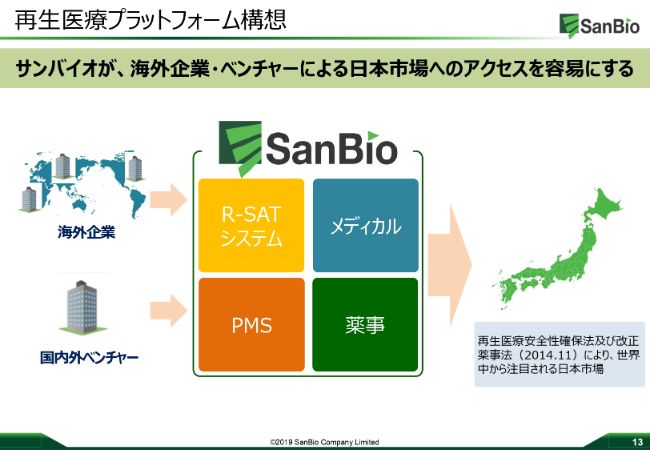
サンバイオにつきまして、私は日本で再生医療のプラットフォームを作りたいと考えています。
2014年11月に、再生医療に関する薬事法が変更になり、日本で再生医療を開発することが非常に有利になっていますし、承認申請も比較的早く申請まで至るという工夫になっています。実際、アメリカの企業に聞いてみますと、優先度はやはりアメリカや、最近市場が伸びている中国という意見をよく聞きます。
また、日本は非常にユニークな市場で参入が難しいということもかなり多く聞いています。その一方で、国内外のベンチャー企業に関しては、資金が不足していて薬事申請ができない、サイエンティフィックなアプローチのプロモーションができないなどということを嘆いている方がいらっしゃいます。
サンバイオに関しては、メディカルメンバーを既に有しており、再生医療申請に関するノウハウをすべて持っていて、PMS業務をしっかりとできます。それに加え、「R‐SAT®」のシステムを構築していますので、私たちが築き上げたこのプラットフォームをしっかりと使っていただいて、日本における再生医療自体をしっかりと普及させていきたいと考えています。
実際、この「R‐SAT®」のシステムを開発するといった地点から、かなりの多くの企業に「このシステムはどうなるのか」「使わせてほしい」と、引き手数多な現状でございます。
学会発表(STEMTRA試験)
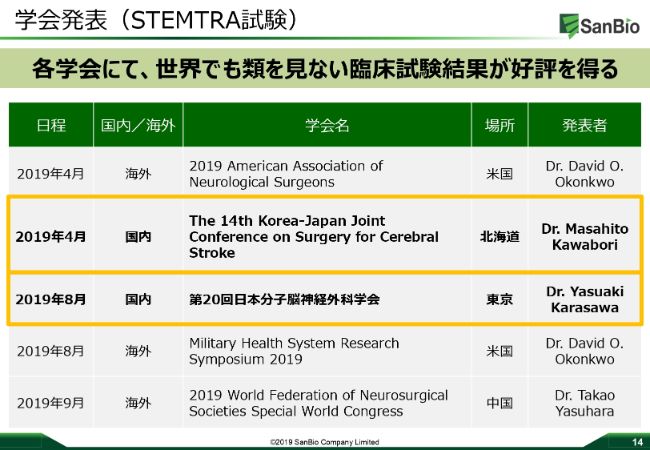
「製薬企業になる」と宣言しましたので、やはり科学的なアプローチはしっかりとしていきたいと考えています。2019年の4月にSTEMTRA試験をアメリカで発表したあとも、日本国内では韓国と日本のジョイントの学会や、日本分子脳神経外科学会、中国の世界の脳神経外科学会などで、しっかりと継続して学会発表・データのクリエーションに努めていますので、今後も継続していきたいと考えています。
今後のスケジュール
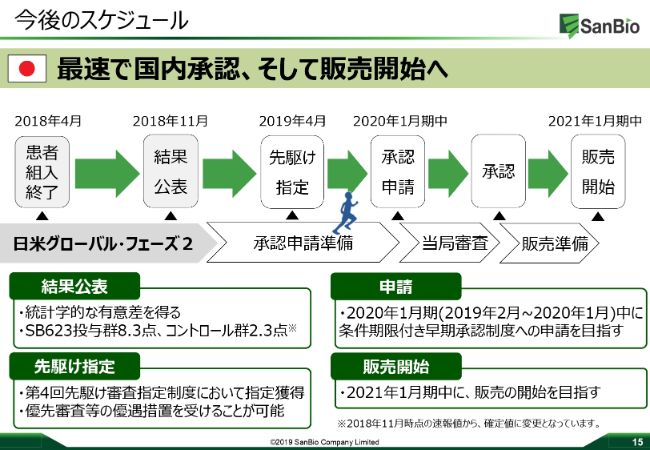
最後になりますが、今後のスケジュールに関しましては、みなさまご存じのとおりに2019年4月に先駆けの指定を受けましたので、現在承認申請の準備中でございます。遅くとも2020年1月末にファイリングを終わらせて、承認制度へしっかりと申請していきたいと考えています。
その後、2020年度中にしっかりと承認をいただき薬価を取得して、遅くとも2021年1月期中には、日本の国内に発売していきたいと考えています。
以上でございます。
はじめに

ビジャン・ネジャドニク氏:みなさん、こんにちは。みなさんとお話できること、大変光栄に思います。サンバイオのチームとともにこちらに来て、グローバル・臨床開発の最新情報をみなさんにお話ししたいと思います。
まずは自己紹介をいたします。私は医師で、ベルギーの医学部で訓練を受けた後、アメリカに行き、そのほかいくつかの大学に行きました。コーネル大学・ジョンズ・ホプキンズ大学などでも研究をし、免疫療法・細胞療法に関心を持ち、Johnson and Johnson Pharmaceuticals に入社し、免疫療法に焦点を当てました。アルツハイマー病・がん・その他免疫介入・媒介の疾患などに集中し、その後はJazz Pharmaceuticals に移り、急性リンパ性白血病やその他の病気に取り組みました。
Johnson and Johnson Pharmaceuticals、Jazz Pharmaceuticals の勤務中にはいくつかの生物製剤の承認を獲得しました。Galena Biopharma、Eureka Therapeuticsでもチーフ・メディカル・オフィサーを務めており、がんの免疫療法や細胞療法、とくにT細胞の療法に取り組みました。
サンバイオに入社したのは4ヶ月ほど前です。なぜサンバイオに入社したのかというと、非常に成功の兆候が見られたからです。私はやはり成功に貢献したいと思っていますが、再生医療は最先端への医療であり、なかなか成功が難しいところでもあります。
しかし、この領域は拡大していく領域だと思っています。まったく新しいパラダイムが医療にもたらされます。
過去における疾患の治療は、がんを殺傷するか、患者さんをなんらかのかたちで治療してきました。今は疾患の経路を逆転させているわけです。つまり、失われた組織の再生という、まったく新しいパラダイムであり、我々はこれを進めています。
サンバイオがまさにこの分野でのパイオニアです。そして、成功の兆候が見られております。では、その成功の兆しとはなにかということです。
RMATの対象品目に指定(2019年9月19日)

こちらのスライドはプレスリリースとして最新のものでございます。RMATは、FDAからの承認で、再生医療におけるBreakthrough Therapy指定でございます。
RMATとは

みなさんはもうRMATのことはよくご存じだとは思いますが、簡単にBreakthrough Therapyの指定と比較させていただきたいと思います。Breakthrough Therapyの指定が、これまではベストな指定で、承認をいただくことは、開発者にとっては夢のような指定だったわけです。
それに対して、RMATは最近FDAにより設定されたもので、より再生医療にフォーカスした指定になっています。これはBreakthrough Therapyと同等であるだけではなく、追加の特徴があり、それはとくに再生医療・細胞療法などに向けて作られたものであります。
その条件としては、まずそれが再生医療の治療薬でなければなりません。そして治療を行い、重篤な状態を治癒できるものを目指していくものであるということで、「修復」がキーワードになります。
外傷性脳損傷(TBI)を見ますと、例えば腕を動かすことができない、足を動かすことができない、両方動かすことができないという事例があります。それを修復できるのはなかなか考えにくく、奇跡のようなものだ考えられるわけです。
サンバイオが、この新たな治療にどのように至ったのかということです。患者さんのなかで修復が見られ、脳の損傷を受けて以降、何年も動かすことができなかった腕を、初めて動かすことができるようになった方がいらっしゃいました。目を見張るような、医学におけるとても重要な瞬間と言えます。
それ以外の条件といたしましては、臨床試験において一定のエビデンスを示さなければならないということです。
そうすることで、FDAがまず、先に進めることができるような投資をしてくださることになります。つまり、相当有望でなければFDAとしても、時間を割きたくない、お手伝いをしたいとは思わないわけです。
RMATの指定内容とそのインパクト

どうしてFDAは、我々が成功の可能性を持っていると判断したのでしょうか。そして、FDAはどうしてこのRMATの指定を私たちにくださったのでしょうか。
フェーズ2の試験が行われましたが、これはSTEMTRA試験であり、慢性期の外傷性脳損傷の患者さんを対象にしたものです。運動機能が、上肢下肢において損なわれ、動かすことができない患者さんに対して、この治療薬の投薬を行いました。その結果、これらの患者さんは十分に運動機能を回復することができ、統計学的な有意差を出すことができました。
統計学的な有意差をフェーズ2で出すことができたことは、大変強力な兆候ということになります。この薬に大きなポテンシャル、潜在性があることを示すものだからです。
そういった意味でRMATは、FDAがそれを認識し、強力なかたちでFDAが支持をしたということであります。その結果、サンバイオの「SB623」の製品のポテンシャルが、成功に向かって大きく高まったということです。
もちろん、これは承認が自体ではありません。しかし今のところは、FDAから得ることができるものとしては最高のものと言えるでしょう。
みなさんもご存じだと思いますが、日本の先駆けの指定もいただいています。そして我々は今、日本での承認に向けて大変迅速に進めているところであります。
開発スケジュール-外傷性脳損傷プログラム(グローバル)
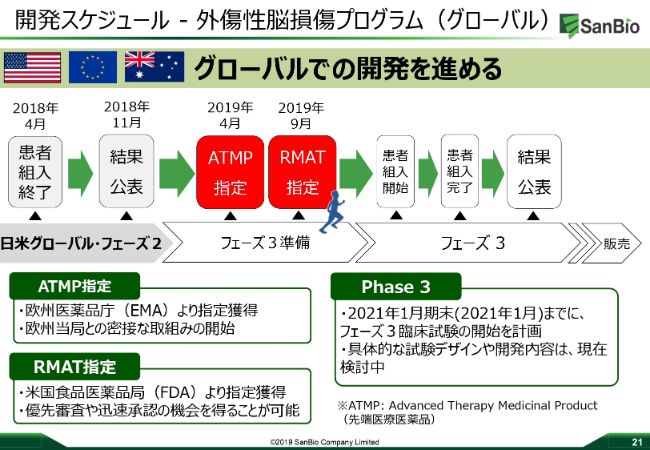
この先の予定についてです。フェーズ2のデータの分析はもちろん行って、そして発表をしていきます。
先端医療医薬品の指定を欧州医薬品庁からいただいており、FDAからRMATの指定をいただきました。次のステップとしてはもちろん、フェーズ3の試験をデザインしていくということになります。
我々はできる限り早く承認を得たいと思っています。フェーズ3のデザインについては、慢性期のTBIに関してはだいたいわかってきています。世界中のキーオピニオンリーダー、アメリカ・ヨーロッパの先生方ともディスカッションをしており、試験のデザインができあがろうとしています。
サイトのアクティベーションも、これからなされますが、多くのサイトもすでに特定しています。我々の製造に関しても、フェーズ3に向けてしっかり合わせていくことになります。
開発スケジュール-慢性期脳梗塞プログラム
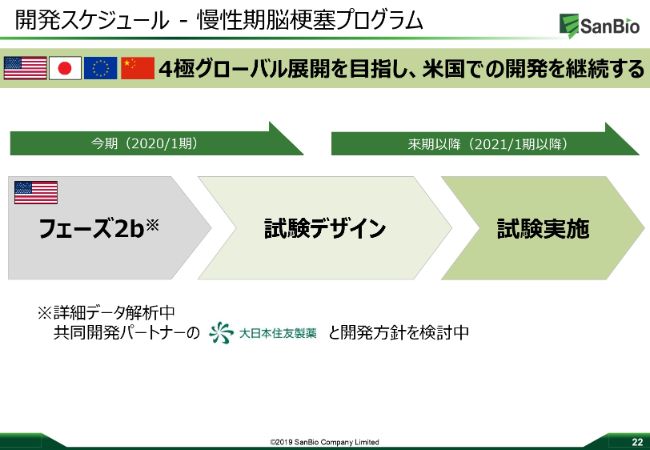
それ以外には脳梗塞のプログラムがありますが、こちらも自信をもって進めることができます。我々は、これから脳卒中、脳梗塞のプログラムを追加の試験で進めていこうと思っています。そしてそのあとは、第3相の試験にも入っていきたいと思っています。
私からは以上です。ご清聴ありがとうございました。
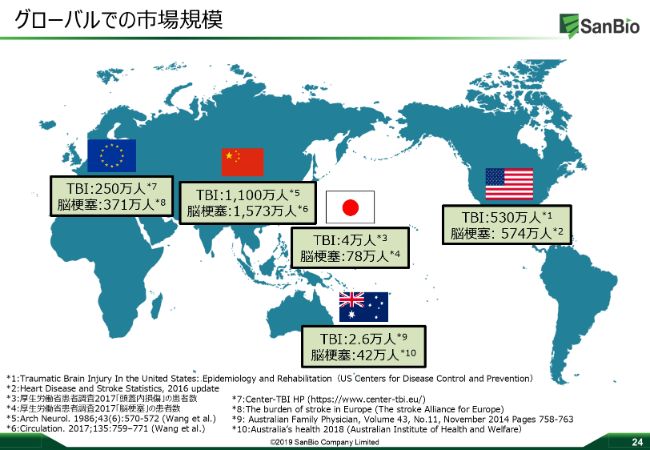
グローバルでの市場規模
辻村明広氏:みなさん、こんにちは。辻村でございます。最後に「グローバルリーダーを目指して」ということで、何枚かのスライドをご説明いたします。
グローバルでの市場規模ということで、サンバイオでいろんなデータソースを使って、現在把握している脳梗塞とTBIの患者数がこのスライドに記載されています。
ここで強調したいのは、脳梗塞の患者さんがアメリカ・日本・オーストラリア・中国・ヨーロッパで、だいたい2,000万人強いらっしゃって、TBIについては2,000万人弱ですが、そうした多くの患者さんがこうれらの疾患で今苦しんでらっしゃるのです。ですから、TBIと脳梗塞、そんなに変わらない数の患者さんが今世界にはいらっしゃると我々は認識しています。
さらに「SB623」のターゲットにしている中小度から重度の患者さんについては、非常にアンメットニーズがありまして、これについては薬物治療を含め、リハビリが終わったあとのいろんな治療オプションがまったくない領域でございます。
私はこの会社に入って1年くらいなのですが、アメリカや日本などの先生といろいろ話す機会があります。「この慢性期の疾患に対するアプローチをどうしようか」ということを、みなさん本当に真剣に考えられていらっしゃいまして、非常にアンメットニーズの大きい疾患領域だなと感じています。
外傷性脳損傷:競合分析

TBIの競合については、このスライドに記載されているような会社が臨床段階に入っていますし、一部下の方には臨床に入ってないpreclinicalのものも書いてあります。これらの競合の製品はすべてが急性期のTBIを対象にしたもので、少なくとも私が認識している限り、慢性期のTBIを対象にして臨床試験を行い、開発をしているという会社はございません。
また、これらの会社はほとんどアメリカで開発を続けており、日本に関してはTBIの慢性期で開発を続けている会社で、上市に近い会社というのはサンバイオの「SB623」のみと認識しています。つまり、日本のみならずグローバルに見ても、「SB623」のTBIについては競合がほとんど見当たらないと私は認識しています。
商業化に向けた取り組み(グローバル)
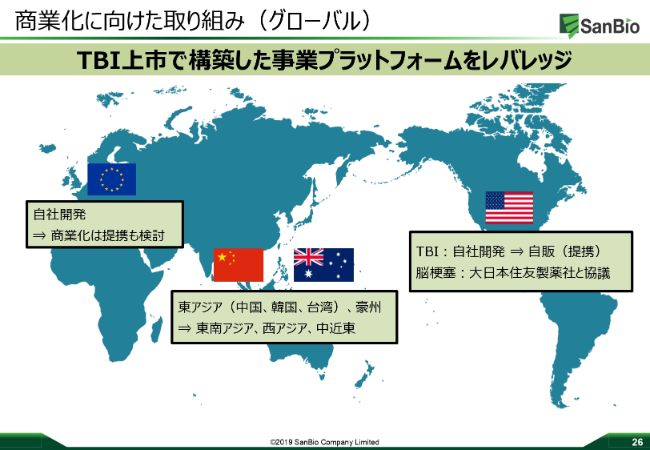
商業化に向けた取り組みは、先ほどビジャンからも説明がありましたが、今回は先駆け指定も含めてRMATの指定を受けました。ですから、開発につきましては今のスケジュールどおり進めていきますし、ヨーロッパ・オーストラリア・アメリカなども含めて次のフェーズ3を検討しています。
開発については自社開発を基本としていますが、そうした開発をしたうえで、商業化ということについて自販を基本にしつつ、「SB623」の価値の最大化という視点から、さまざまなオプションをフレキシブルに考えていきたいと思っています。
グローバルリーダーになるための組織構築①

先ほど、ビジャンと山本からそれぞれプレゼンテーションさせていただきましたが、私が1年前にサンバイオに入社してから、ほかにもたくさんいろんなタレントが入社してきています。
私が今いるカリフォルニアの人材マーケットは非常に難しいところなのですが、この段階のベンチャーにたくさん賛同していただきまして、クオリティやマーケティングなどさまざまなファンクションで、非常に優秀でポテンシャルの高い方々に入っていただいています。
グローバルリーダーになるための組織構築②

日本の会社ではそういうポテンシャルの高い人を採っても、どのようにリテインするか、どのように仕事してもらうか、といったところがやはり非常に難しく、みなさん悩んでいらっしゃるところだと思います。私としては、これまで海外でビジネスをしてきた経験もありまして、こうした方々に権限移譲を適切に行い裁量権を与えて、その現場でスピード感を持って、クオリティの高いDecisionをしてもらうことが一番大事だと思っています。
ですからサンバイオでは、そういうプロセスを導入すると同時に、報酬体系も非常にやはりcompletiveですので、こうした優秀な人財をリテインして、仕事をしてもらえるような報酬体系についても今検討している最中です。
SB623×TBIの大きなポテンシャル
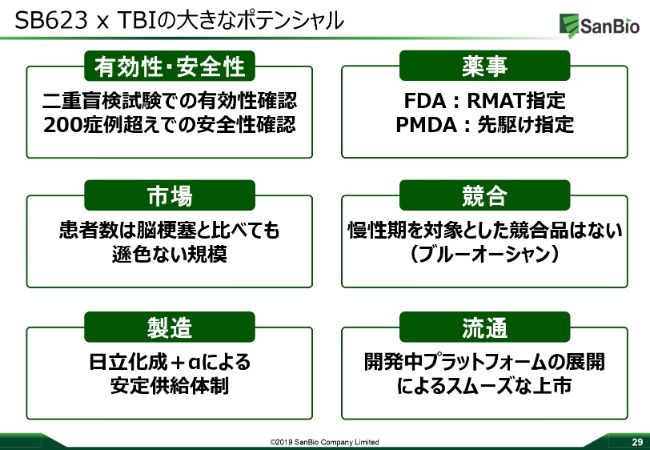
「SB623」のTBIにつきましては、過去のトライアルで非常に有効性の確認できるデータが取れています。また、「SB623」自体としては、ストロークのデータも含めて安全性が非常に高くなっています。
薬事的にもFDAからRMAT指定を受け、PMDAから先駆け指定も受けて、市場も非常に大きく、強いアンメットメディカルニーズがある領域です。競合もほとんどいないという、ブルーオーシャンでございます。製造も、これまでの治験から十分なキャパを確保していますし、これからもキャパの増強を考えていきます。
流通プラットフォームについても、日本で最初に上市しますから、先ほど山本から説明したようにポロプラットフォームを使うこともできますし、さらにこれらを動かす優秀な人財も、サンバイオには集まってきていると考えています。
グローバルリーダーへ
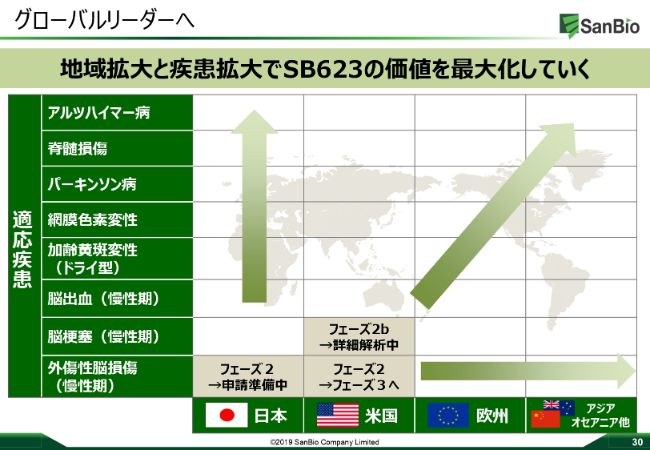
サンバイオは、「2025年に再生医療のグローバルリーダーを目指して」いまして、「SB623」、慢性期のTBI、慢性期の脳梗塞以外にも、さまざまなインディケーションの拡大や地域の拡大をこれから考えていきたいと思っています。
ファーストプライオリティとしてTBIで地域拡大を目指し、そのあと、そのプラットフォームを使って、疾患拡大を考えていきますし、その段階でいろんなかたちでのビジネスディベロップメントも積極的に行い、「SB623」の価値最大化を図っていきたいと考えています。先ほど山本からも少し話がありましたが、日本の再生細胞薬のフロントランナーとして、実際にいろんな企業からいろんなお話をいただいています。
日本発、再生医療グローバルNo.1
ですから、そういう話も含めて、これからグローバルに戦っていけるサンバイオとして、「2025年 グローバルリーダーを目指して」進めていきたいと思っています。
私からのプレゼンテーションは以上になります。
新着ログ
「医薬品」のログ