ナノキャリア、2Qは赤字幅が大きく減少 純損失が前期の20億円から9億円に
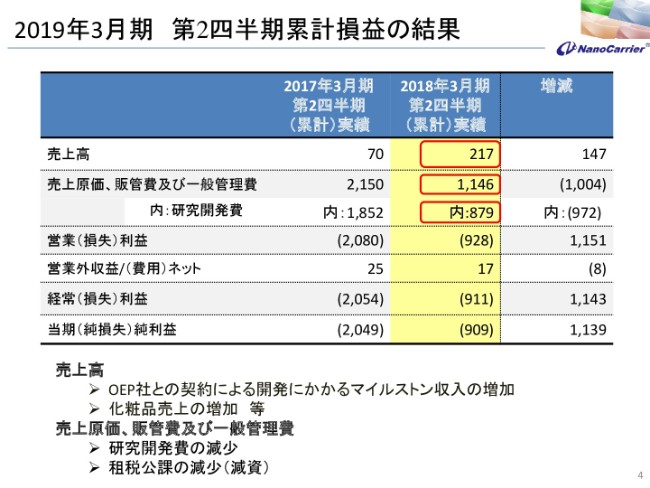
2019年3月期 第2四半期累計損益の結果
中冨一郎氏(以下、中冨):本日は大変お忙しい中、2019年3月期第2四半期の決算説明会においでいただきまして、どうもありがとうございます。
まずは第2四半期の決算概要についてです。これは松山CSFOから説明いたしまして、そのあとにパイプラインの状況、事業開発の状況、化粧品事業、それから2019年3月期の下期の取り組みについてお話を順次進めたいと思います。どうぞよろしくお願いいたします。
松山哲人氏:松山でございます。よろしくお願いいたします。さっそくですが、第2四半期のPLからご説明させていただきたいと思います。
売上高が、この半年で2億1,700万円となり、前期に比べまして、1億4,700万円増えています。もう公表済みですが、OEP社さんとの契約によるマイルストン収入の増加と、化粧品も前期に比べて増えておりますので、その分の売上の増加で2億1,700万円となっております。
売上原価、販管費ですが、11億4,600万円ということで、昨年度に比べますと約10億円減少しております。実は、昨年度に集中して経費が出ておりました関係もあって、今年は比較的巡航速度となっております。
販管費のうち、研究開発費が8億7,900万円です。前期に比べても9億7,200万円減っていますが、そこの部分の減少が多いということです。結果としまして、営業損失が9億2,800万円、経常損失が9億1,100万円、当期純損失が9億900万円になっております。
2019年3月期 第2四半期末貸借対照表
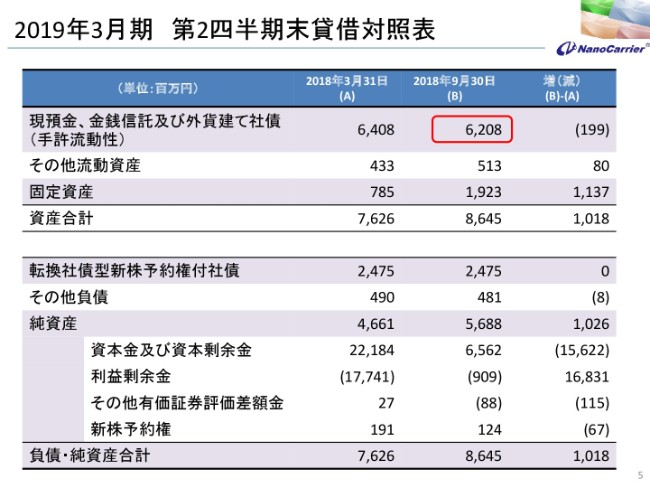
続きまして、貸借対照表です。バランスシートですが、現預金などの手許流動性が62億800万円で、3月末の64億800万円に比べて、2億円ほどしか減っておりませんが、実際には先ほど見ていただいたように11億円ぐらい使っております。
資金調達
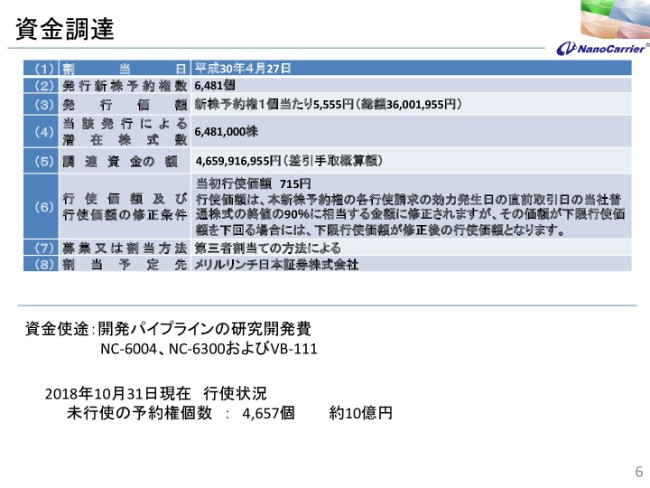
現在資金調達中で、この半年ぐらいで10億円を調達していますので、あまりキャッシュの変動はないということです。併せて説明させていただきます。62億円ですと……もちろん弊社では、年間で20億円や25億円を使っていますが、まだ2年超の資金を確保している状況でございます。
これも公表済みの内容ですが、(スライドの)一番下のところに10月末現在の行使状況ということで、約10億円調達しております。
2019年3月期 通期業績予想 ※8月13日付修正
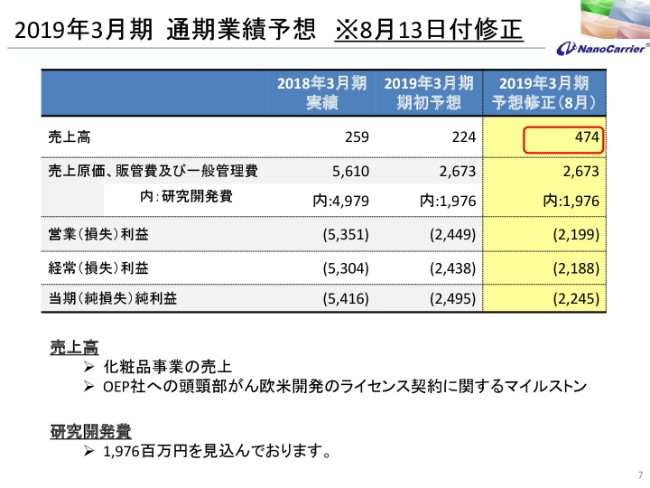
通期の業績予想です。もう3ヶ月前ですが、業績予想を修正しております。OEP社との頭頸部がんに関わる欧米開発のライセンス契約に関するマイルストン分や、化粧品部分の売上を見込んでおり、2億5,000万円の売上を増額して予算修正しております。
結果として、営業損益、経常損益、当期純損益も約2億5,000万円ずつ改善しているという業績予想を出させていただきました。以上でございます。
中冨:それではパイプラインの状況についてご説明いたします。ここのリストに書いてございますけれども、自社開発のパイプライン、同質のパイプラインです。それから導入のパイプラインを書いております。
臨床パイプラインの開発状況

とくに臨床パイプラインのうちのNC-6004、NC-6300についてご説明いたします。臨床第Ⅲ相の膵臓がんについては2018年8月に再開いたしまして、患者登録の最中でございます。次のPhaseⅡになりますけれども、第Ⅱ相のバスケットデザインは米国でやっておりますが、胆道がん、肺がん、膀胱がんについて、胆道がんは症例完了しています。引き続き、患者への投与が行われておりまして、観察期間に入っています。
第Ⅱ相になりますが、頭頸部がんについては先だってご案内しておりますとおり、免疫チェックポイント阻害剤との併用試験を採用して開始する予定でございまして、今年の9月に申請を行いました。ヨーロッパ、アメリカ、アジアを統合した共同治験になっております。
NC-6300ですが、これは軟部肉腫を対象にPhaseⅠを実施しておりますが、Ⅱパートに移行している段階でございます。ですので、いま、準備を開始している状況です。
NC-6004 米国Phase Ⅰb 臨床試験結果
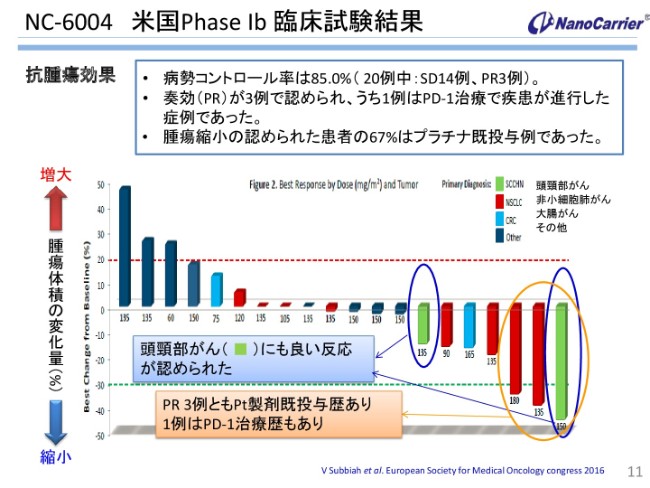
とくにこのNC-6004の頭頸部がんに関しては、前からPhaseⅠbについてのがんの縮小、体積の変化の量を書いていますが、その理由としましては水色のカラムに書いております。頭頸部がんに非常に(よい)徴候を示し、奏効率が高かったということと、この3人の患者さんについてはプラチナ既投与例であったこと、それからその中の1例はPD-1の免疫チェックポイント阻害剤を使っていた経歴があったことなどです。
こういうことを踏まえて、免疫チェックポイント阻害剤とオキサリプラチンの間では、非常に相加効果あるいは相乗効果があると言われていますので、その内容から私どもも、併用に取り組んでおります、
OEP社とのライセンス契約(NC-6004)

頭頸部がんに対しては、以前はそれぞれOrient Europharma社と7キャリアでやっていました。同じ適用所なんですけれども、その試験で薬物が違っていたのですが、キイトルーダ®を併用することにして、1ヶ所に統合して、欧米・アジアで開発を行うことにしました。
そのために、OEP社が持っていなかった欧米を対象にライセンスを行いまして、共同開発を実施しています。臨床試験は、だいたいPhaseⅡ試験が終わりましたら、ライセンスを共同で探す予定にしております。
NC-6300 PhaseⅡ Part 計画案
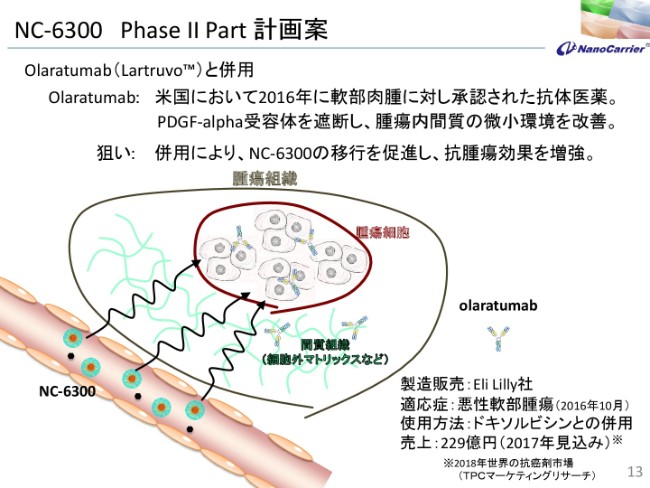
続きまして、NC-6300です。このPhaseⅡPartについてお話しいたします。これはOlaratumabという抗体がございます。2016年にアメリカのEli Lilly社が軟部肉腫に対して承認を取ったもので、これは血小板由来の成長ファクターです。
alpha受容体を遮断して、腫瘍内の間質の微小環境を改善する……生成血管も含めて、そのマトリックスがあるのですが、それを改善して内圧を下げる作用がございました。そのために、狙いといたしましては1種に併用することによって、NC-6300の粒子が腫瘍に移行しやすいということで、抗腫瘍効果増大を狙っているものでございます。
(スライド)下のほうに書いてございますけれども、ドキソルビシンそのものと併用して、PhaseⅢを実施せずに承認が取れたものです。2年ほど前ですが、2017年には約230億円ほどの売上を示しているものでございます。
次世代型ミセル化ナノ粒子
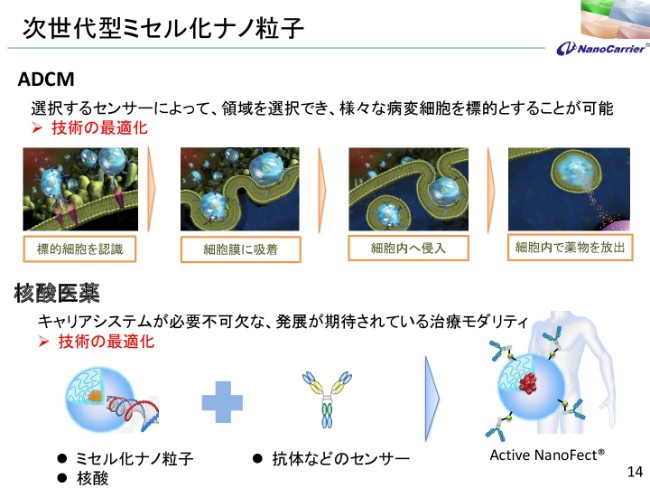
次の世代の我々の技術といたしましては、ADCMというものがあります。この最適化とステージアップを期待しており、同じく核酸医薬についても類似のシステムで行っております。これも年度内にステージアップの目処をつけないといけないと考えております。
主な事業開発
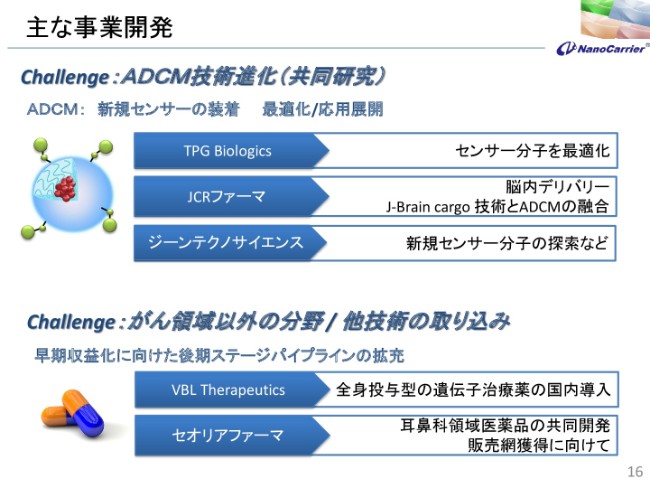
事業開発についてのお話はここに書いておりますが、TPG Biologicsという会社がありまして、センサー分子を最適化するための会社です。いま、いろんなセンサーといいますか、抗体がございます。その中でも最適化できる抗体があるということで、供給を受けて、実際に先ほどご説明したADCMの技術の進化に対する検討をしています。
JCRファーマについては、J-Brain cargoのタンパクを表面につけて、脳内のデリバリーを行っています。3番目は、ジーンテクノサイエンスですが、新規のセンサーです。主に抗体なんですが、抗体の探索において、一緒に新しい抗体を探して、共同開発するかしないかを模索している段階です。
他分野、あるいはがん以外のものでも取り組みを行っております。VBL Therapeuticsとは、遺伝子治療薬の国内導入を図っており、現在も進行しています。セオリアファーマとは、耳鼻科領域について共同開発を行っています。
VB-111の開発状況(VBL社)

VBLのVB-111の開発状況について簡単にお話しします。米国を中心として臨床開発が行われているのは、臨床第Ⅲ相のプラチナ耐性卵巣がんです。これは、パクリタキセルとの併用でございます。2017年12月に1例目が登録されて、2019年第4四半期に中間解析を行いまして、発表される予定であります。
同じくPhaseⅢの再発悪性神経膠芽腫。これは脳腫瘍の1つで、一番難しい脳腫瘍です。これについてですが、商品名はアバスチン……有名なのでアバスチンと言いますが、それとの併用を行いました。今年の3月にTopline(発表を行いましたが)結果が残念ながらよくなかったということで、現在は解析を行っており、さらに観察を行っています。
VB-111 GLOBE試験(PhaseⅢ) rGBM 成績概要
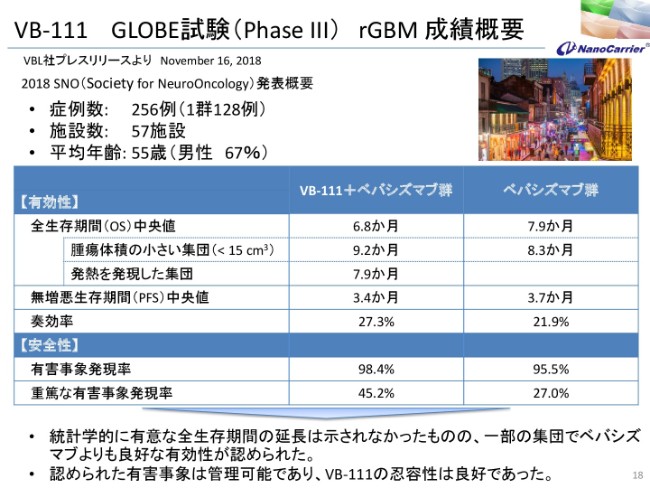
ちょうど先週なんですけれども、ニューオリンズでSNO(Society for NeuroOncology)で概要を発表しております。この脳腫瘍の結果を、わりと細かく発表したわけですけれども、症例数は256例中、1群128例で、施設数は57施設、平均年齢が55歳です。
有効性、安全性について、それぞれアバスチン群と、アバスチンとVB-111を併用した群が示されておりますが、平均のOverall Survival生存期間は(アバスチン群が)7.9ヶ月に対して(VB-111+アバスチン群が)6.8ヶ月と、差がありませんでした。
腫瘍が小さい群の患者さんに対しては、若干の差が見られていますけども、全体ではなかったです。また発熱を発現した集団……これはウイルスを投与していますので(熱が出ますが)、発熱を起こした集団では7.9ヶ月であったということです。
それからPFS、無増悪生存期間の中央値は3.7ヶ月に対して3.4ヶ月。奏効率は21.9パーセントに対して27.3パーセントでした。安全性も含めまして、統計学的に有意な生存期間の延長は示されなかったんですけれども、一部の集団ではアバスチンよりも良好な有効性が見られました。
見積もられた中の有害事象でも発熱Phaseでありまして、管理が可能であって、忍容性は良好であったと発表しております。なぜこういうかたちになったかということを、実はこのSNOの会議でも示していますが、こういった(スライドに記載の)内容でございます。
VB-111 再発悪性神経膠芽腫(rGBM)
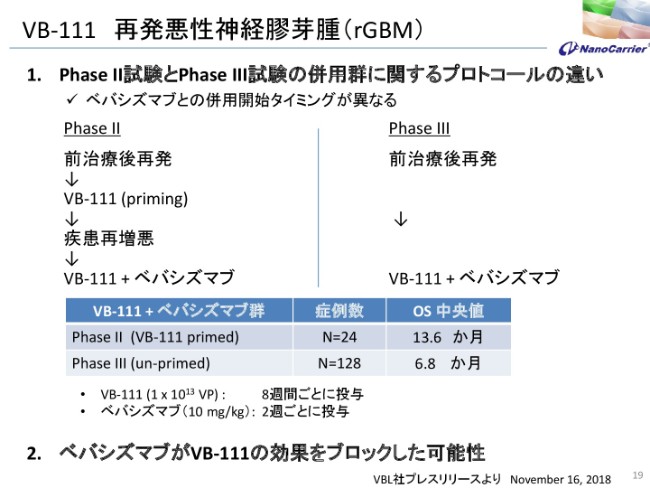
我々は、結果をもとに導入を決めたわけです。従来からお話をしていましたが、PhaseⅡ試験……ここにプロトコールと書いていますけれども、前治療後の再発……前治療というのは、手術、薬物、放射線です。脳腫瘍は非常に大変なので、手術してもだいたい半年後に再発します。そこで、再発したあとにPhaseⅡ試験でVB-111を投与して、また増悪した場合、今度はVB-111とアバスチンを投与したものが、PhaseⅡ試験の結果でございます。
ここにPhaseⅡ試験の結果を書いてありますように、症例数24はやや少ないですが、OS(中央値)が13.6ヶ月で、通常が7ヶ月ぐらいですから、2倍程度伸ばすということで、我々も導入して期待していましたが、PhaseⅢ試験は、前治療後再発のあとにVB-111とアバスチンを投与したということです。
VB-111 今後の展開

このプロトコールの違い(を調べる試験)はFDAの推薦のもとに行われましたので、自分たちが買って先生方と一緒に実施したわけではありません。どうも最初からアバスチンを投与することで、効果を減弱させたのではないかという可能性を示していますが、正式にはまた、MRIの解析などを行って、比較してお知らせすることになろうかと思います。現在はUCLAの先生がMRIの解析を行っております。
PhaseⅢ試験をアメリカで行っていますけれども、もう1つはプラチナ耐性卵巣がんです。これについては、併用薬はアバスチンではなく、パクリタキセルを使っています。これはPhaseⅡ試験とPhaseⅢ試験の投与レジメンは一緒でございます。
2019年第4四半期に中間解析の結果が発表されます。先ほどの脳腫瘍の件につきましてもMRIの解析結果を見て、それから国内の開発について方針を決定したいと考えております。
セオリアファーマとの共同開発

セオリアファーマとの共同開発についてです。もうセオリアファーマにつての案内は差し上げていますけれども、2~3年後を目処に販売承認の取得を狙っております。これについては、現在国内で第Ⅲ相臨床試験を準備しております。
セオリアファーマとの間で契約等があったり、またこの会社はプライベートな会社なものですから、開示については少し控えるようにとの要望があったりします。よって、なかなかお話はできないんですけれども、現在第Ⅲ相の試験準備を行っております。
Depth販売

化粧品事業です。スライドに書いているのは「Depth」ですが、昨年、女性用に「Depth For Share」を発売いたしまして、現在、美容室の取り扱いは160店舗ほどまで増やしております。いままでどおりネット販売は行っており、アルビオンと共同で進めているものでございます。
化粧品事業 原料
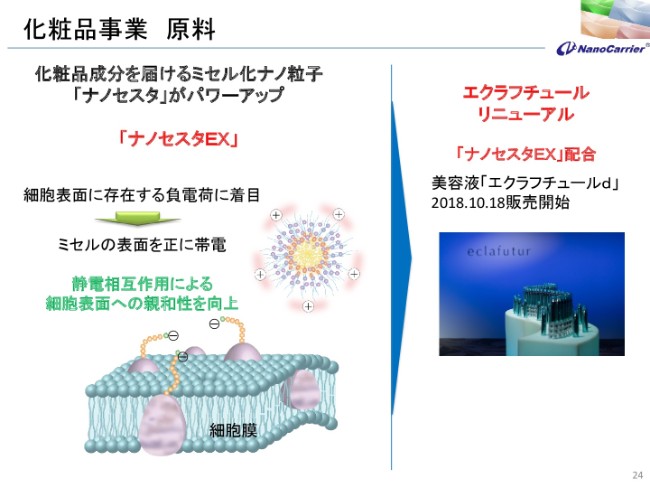
アルビオンのほうが、今年の10月に「エクラフチュールd」という……「d」は、「アン・ドゥ・トロワのドゥ」なのですが、それを発売いたしました。それにともないまして、私どもも従来から開発の内容を開示していませんでしたが、新しい「ナノセスタ」です。
従来のオイル成分……抗酸化作用のあるフルーツのオイル成分については変わらないんですけれども、システムが変わって浸透をよくしています。その浸透は静電相互作用を使ったものでございまして、新しい「エクラフチュール」も、デパートで発売されております。
この「エクラフチュール」や、ほかの化粧品を扱っているうちに、疎水性物質の溶解度を上げることができますので、その関係で皮膚からの吸収が非常に伸びたという結果が出ています。これを利用して、これまで(開発が)困難であった皮膚科治療薬といったものに活用を広げていこうということで、新たにダーマトロジーのディヴィジョンを作って、皮膚科用の治療薬を進めていくことにいたしました。
そもそも皮膚科領域といいますと、角質層だけではなく、表皮あるいは真皮……これは特徴といたしまして、表皮への浸透を蓄積するという非常に面白い傾向がございますので、この内容を医療分野においても展開しております。
2019年3月期 下期の取り組み

最後に、2019年3月期の下期の取り組みです。自社技術に関しては、実用化に向けてNC-6004、NC-6300に集中投資をしています。研究におきましては、ADCM、核酸キャリアについて、ステージアップを行っている段階です。
経営基盤の強化に向けては、耳鼻科領域で第Ⅲ相試験の推進を行っています。また、後期の臨床ステージのパイプライン拡充など、これらの事業開発として拡充することを考えています。皮膚科領域については、展開を新たに始めるということで、下期の取り組みはこういったところとなります。
本日はお忙しい中、どうもありがとうございました。
新着ログ
「医薬品」のログ