第一三共、4-12月期は純利益17.7%減 麻薬性鎮痛剤「CL-108」開発・販売契約の解約が響く
2017年度第3四半期決算説明会
廣川和憲氏:本日はご多忙のところ、第3Qの決算カンファレンスコールにご参加いただきありがとうございます。本日13時に発表いたしました第3四半期決算に関しまして、カンファレンスコール資料に基づき、私から説明させていただきます。
本日お話しする内容ですが、2017年度第3四半期の決算内容、2017年度連結業績予想の修正、「エドキサバン」アップデート、研究開発アップデートとなります。その後みなさまからのご質問をお受けいたします。まず2017年度第3四半期の決算内容についてご説明いたします。
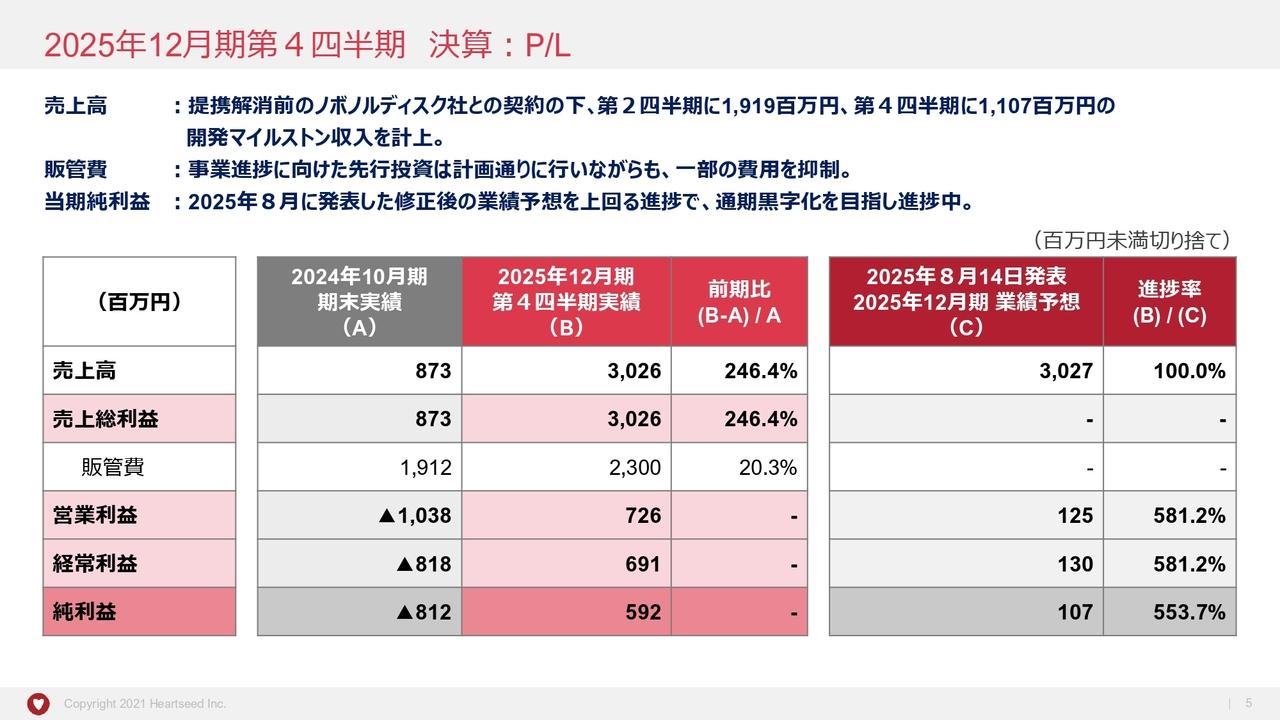
連結業績の概要

2017年度第3四半期決算の概要でございます。連結売上収益は7,410億円。前年同期比66億円増。0.9パーセントの増収となりました。売上原価は前年同期比137億円増。販売費・一般管理費は37億円減。研究開発費は321億円増となっています。その結果、営業利益は932億円。前年同期比355億円減。27.6パーセント減益。
税引前利益は前年同期比347億円減の、977億円。そして親会社帰属の当期利益は726億円。前年同期比156億円減。17.7パーセントの減益となっています。為替レートの実績でございますが、1ドルは111円71銭となり、前期よりも5円3銭の円安。1ユーロは128円53銭となり、前期よりも10円44銭の円安となりました。
売上収益増減

前年同期比での増益要因について説明いたします。売上収益は前年同期比66億円の増収となりましたが、その内訳を主要事業ユニット別にご説明いたします。
まず国内医薬、ワクチン・OTCを含む日本事業では、抗凝固剤「リクシアナ」が大きく伸長し、骨粗鬆症治療剤「プラリア」、抗潰瘍剤「ネキシウム」、抗血小板剤「エフィエント」に加え、「テルミサルタン」、「オルメサルタン」、「ロスバスタチン」のAGを含めた第一三共エスファ品などを中心に売上が拡大しました。一方高血圧症治療剤「オルメテック」などは減収となりました。第一三共ヘルスケアも売上を伸ばしています。
以上、日本事業全体では326億円の増収となりました。次に海外事業について説明いたします。ここでは為替変動の影響を除外したかたちで記載しています。
米国の第一三共Inc.は高血圧症治療剤「オルメサルタン」、抗血小板剤「エフィエント」、高コレステロール血症治療剤・2型糖尿病治療剤「ウェルコール」の減収等により、547億円の減収となりました。
一方、米国ルイトポルドは鉄欠乏性貧血治療剤「インジェクタファー」、およびGE注射剤の伸長により121億円の増収。第一三共ヨーロッパは「リクシアナ」の寄与があったものの、「オルメサルタン」の減収により9億円の減収となっています。またアジア中南米地域を担当するASCA事業では、32億円の増収でした。なお円安による増収は全体で143億円でした。
営業利益増減

営業利益の増減要因をお示ししています。先ほどの説明のとおり、売上収益は為替影響による増収143億円を含めて、66億円の増収となっています。次に経費関連を為替影響・特殊要因を除いて説明すると、売上原価は「オルメサルタン」の特許切れによりプロダクトミックスが変わった影響で161億円増。販売費・一般管理費は15億円増。研究開発費は13億円減となりました。
為替影響による費用増は合計で124億円。その内訳は売上原価で37億円、販売費・一般管理費で54億円、研究開発費で33億円でした。特殊要因は前期は欧州における事業再編費用106億円を計上しましたが、今期は有形固定資産の売却による61億円の費用減があったものの、CL-108の権利返還による278億円を含む、無形資産の減損を302億円計上したため、前期から135億円の費用増となっています。
この結果、営業利益は前期比355億円減の932億円となりました。なお為替と特殊要因による影響を除外すると、実質で239億円の減益だったことになります。
当期利益増減(親会社帰属)

当期利益に関してご説明いたします。営業利益が355億円の減益でありましたが、米国税率の引き下げの影響により法人税率が減少した結果、親会社帰属の当期利益は726億円。対前年156億円の減益となっています。
主要ビジネスユニット 売上収益増減(為替影響を含む)

このスライドは主要ビジネスユニットの円ベースでの売上増減でございます。先ほどのスライド6では、為替影響を除いた各ユニットの状況をご説明しましたが、ここでは為替影響を含んだ実績をお示ししています。
「オルメサルタン」のパテントクリフの影響による米国の第一三共Inc.が大きく減収となりましたが、国内医薬事業は前期に比べ売上を確実に伸ばしています。第一三共ヘルスケアも好調です。海外では米国のルイトポルドが大きく売上を伸ばしています。
国内主要製品 売上収益増減

国内主要製品の売上増減です。「リクシアナ」、「プラリア」、「ネキシウム」といった主力製品は順調に推移しています。一方長期収載品に関しては、GE医薬品の拡大の影響等により、前年同期と比較して苦戦をしている製品が多くなっています。
2017年度 連結業績予想の修正

次に2017年度連結業績予想の修正についてお話します。
売上収益に関してはASCA事業での減収はあるものの、第一三共ヘルスケアに加え、為替の影響もある第一三共Inc.、ルイトポルド、第一三共ヨーロッパの増収から合計200億円の増収を見込み、9,500億円といたしました。売上増加に伴う原価増だけでなく、ここではお話できませんが、50億円近くの一過性費用を含め100億円の原価増を見込んでいます。
また研究開発費につきましても、がんを中心とした研究開発の加速に伴い、100億円の費用増とし、営業利益750億円、親会社帰属の当期利益500億円を維持したいと思います。
リクシアナ:製品価値最大化へ向けた取組み

次に「エドキサバン」のアップデートについてお話します。「リクシアナ」は上市以来、製品価値最大化への取り組みを進めていますが、2017年11月に日本で経口抗凝固薬(DOAC)で唯一となるOD錠(口腔内崩壊錠)を発売しました。飲みやすく設計されたOD錠は、とくに高齢の患者さんにとって役立つと先生方からも高い評価をいただいています。
また2017年12月にはがんを合併した静脈血栓塞栓症(VTE)患者を対象としたHokusai-VTE CANCER試験において、欧米の標準治療薬である「ダルテパリン」に対して、主要評価項目で非劣性を達成しました。「リクシアナ」は注射剤の「ダルテパリン」に対して、非劣性を達成した初のDOACとして、結果を米国血液学会(ASH 2017)のLate Breaking Sessionで発表しました。
がんを合併したVTE患者さんがより安心して使っていただけることになり、幅広い患者さんのお役に立てると考えています。
DS-8201:広範かつ果敢なプログラム

ここからは研究開発の進捗です。昨年12月に行ったR&D Dayでお示しした「DS-8201」の現時点での開発計画です。先般、現在進行中のフェーズ1試験の胃がん症例の進捗を、サンフランシスコで開催されましたASCO GI 2018で発表しましたので、本日はその内容をご説明させていただきます。
DS-8201:P1試験 試験デザイン

こちらはフェーズ1試験の試験デザインです。ASCO GI 2018では、用量漸増パートでありますパート1の胃がん症例に加え、用量展開パートであるパート2のうち胃がん症例を組み入れているパート2-bのデータを発表いたしました。
DS-8201:患者背景

スライド18をご覧ください。こちらでは患者背景をお示ししています。トータル45例のうち、標準治療である「トラスツズマブ」による治療歴のある症例が44例。また「CPT-11(イリノテカン)」による治療歴のある症例が24例でした。
DS-8201:P1試験 Part 1+2b 有効性

奏効率を示した表であります。評価可能症例44例における奏効率は45.5パーセントでした。また「DS-8201」の搭載薬物(ペイロード)は「CPT-11」となり、「イリノテカン」を改良した化合物ですが、CPT-11の治療歴のある症例においても43.5パーセントの奏効が認められました。無増悪生存期間、Progression-Free-Survival(PFS)の推定中央値は5.8ヶ月でした。
このラインでの治療薬のPFSが約2ヶ月と言われていますので、5.8ヶ月というのはとても良い結果だと考えています。
DS-8201:P1試験 Part 1+2b 有効性

このグラフは腫瘍の縮小率と「DS-8201」の治療期間をまとめたものであります。縦軸が腫瘍の最大縮小率を表しており、グラフのバー1本、1本が一人ひとりの患者さんを表しています。棒グラフが下に行くほど腫瘍が小さくなったことを示しています。ピンクの棒グラフは「イリノテカン」での治療歴がある症例、黄色の棒グラフは「イリノテカン」での治療歴がない症例です。どちらの症例でも差がなく効果が認められています。
青い棒グラフは「DS-8201」を投与している期間を表しており、棒グラフの先にある青い矢印は治療を継続している患者さんを表しています。17名の患者さんが治療を継続していることが見て取れるかと思います。
DS-8201:P1試験 Part 1+2b 有効性

このグラフは縦軸が腫瘍の縮小率、横軸が治療期間を表しています。個々の患者さんの主要の縮小率が、時間とともにどう変化したかがわかります。投与初期から主要の縮小が認められ、また治療効果の継続が確認できました。
たいへん見にくくて申し訳ありませんけれども、黄色の線がグラフ中に1本ありまして、この線がHER2低発現の症例を表しています。1例ではありますが、他のHER2陽性症例と同様の効果が認められました。
DS-8201:奏効例CT画像

こちらは奏効例のCT画像です。症例は76歳の男性患者さんで、胃がんの肝転移があります。「トラスツズマブ」、「イリノテカン」を含む薬剤で治療をされていました。上段の写真は治療前の画像で、赤い矢印の先に見えるのが胃がんから肝臓にがんが転移した部位であります。下段が「DS-8201」を3週間に1回投与し、13サイクルを終えた約1年後の画像で、転移病変が小さくなっているのがわかるかと思います。
DS-8201:20%以上発現した有害事象(N=45)

この表は有害事象の発現状況を表しています。重症度を表す指標としてグレード1から5まであり、5が最も重症な有害事象であります。「イリノテカン」では重症な消化器系の有害事象の発現が多いですが、今回発表した45例ではグレード4以上の消化器系の有害事象は発現していません。またグレード5の有害事象も発生していません。
なお胃がん症例のうち、間質性肺炎の疑いのある肺炎が2例発現しました。重症度はグレード1とグレード3、それぞれ1例ずつでありまして。今後、間質性肺炎判定委員会により判定される予定であります。
DS-8201:ASCO GI発表内容の結論

ASCO GI 2018で発表された内容のサマリーです。今回お示ししたように、「DS-8201」は「トラスツズマブ」を含む複数の薬剤での治療歴のあるHER2陽性の胃がん患者さんにおいて、「イリノテカン」治療歴の有無にかかわらず、良好な安全性と顕著な有効性を示しました。現在、Pivotal試験としてHER2陽性の切除不能、転移性胃がんの3次治療以降における「DS-8201」の効果を確認する、フェーズ2試験を行っています。この試験で「DS-8201」のさらなる有効性と安全性を確認します。
DS-8201:ネラチニブとの併用意義

昨年12月に「DS-8201」と米国Puma社が開発しました「ネラチニブ」のHER2変異固形がんに対する併用療法を評価するための前臨床試験を、米国メモリアル・スローン・ケタリングがんセンターと共同実施する旨を報告させていただきました。「DS-8201」と「ネラチニブ」の併用意義について、R&D Dayで口頭ではお伝えさせていただきましたが、本日スライドを用い、もう少し詳細をご説明させていただきます。
「ネラチニブ」はHER2等を標的としたチロシンキナーゼ阻害薬で、すでに上市されている製品であります。「ネラチニブ」はHER2のシグナルをブロックし、細胞増殖や細胞生存を抑制する作用があることが知られています。「DS-8201」と併用することでHER2の二重阻害を期待し、前臨床試験にて評価をする予定であります。
さらに「ネラチニブ」にはHER2の内在化促進機能があると言われていまして、内在化率が上昇することで「DS-8201」がHER2に結合した後、腫瘍内に取り込まれる割合が増加することで、相乗効果が見られる可能性があります。本仮説についても併せてこの前臨床試験で評価をする予定であります。

Appendixとして研究開発のマイルストン、主要研究開発パイプライン表、導出予定品目一覧、「エドキサバン(リクシアナ)」・「インジェクタファー」アップデート、略語一覧を添付していますので、後ほどご確認ください。私からの発表は以上となります。
新着ログ
「医薬品」のログ