オンコリスバイオファーマ、がんのウイルス療法と重症ウイルス感染症治療薬の事業領域で『ウイルス創薬』を推進
事業説明会
浦田泰生氏(以下、浦田):それでは、私以外の取締役より挨拶を申し上げます。
吉村圭司氏(以下、吉村):今回選任いただきました吉村でございます。またこの1年間がんばってまいります。
私の担当は、リスク管理と管理部門全般です。管理部門の中では財務、経理、業務管理を担当します。我々は「ウイルス創薬」の会社を目指しています。管理部門から支え、盤石な基盤を作りたいと考えています。1年間よろしくお願いいたします。
樫原康成氏(以下、樫原):樫原でございます。海外渉外および製造開発を担当しています。海外渉外については、海外の子会社ならびに提携先とのビジネスを進めるために、密なコミュニケーションを取って、社業の発展に貢献したいと考えています。
製造開発は、2024年の「テロメライシン(OBP-301)」の製造販売承認を目指しています。これに向けて製造開発を終了させるとともに、商用製品を安定供給する体制を整えていくように尽力してまいります。引き続きご支援のほど、何卒よろしくお願いいたします。
斎藤泰氏:斎藤でございます。浦野取締役の後任の社外取締役としてご承認いただきました。会社法ならびに東証のコーポレートガバナンス・コードに基づく独立取締役としての職務を全うするのは当然のこと、現在オンコリスバイオファーマの直面している経営課題について、社外取締役として貢献できるように努めてまいります。どうぞよろしくお願いいたします。
浦田:あらためまして、 代表取締役社長の浦田でございます。今回も事業説明会まで残っていただき、どうもありがとうございます。本日は当社のパイプラインについて、みなさまのご要望に応えられるような、できる限りわかりやすい説明をしていきたいと考えています。
オンコリスのポリシー①
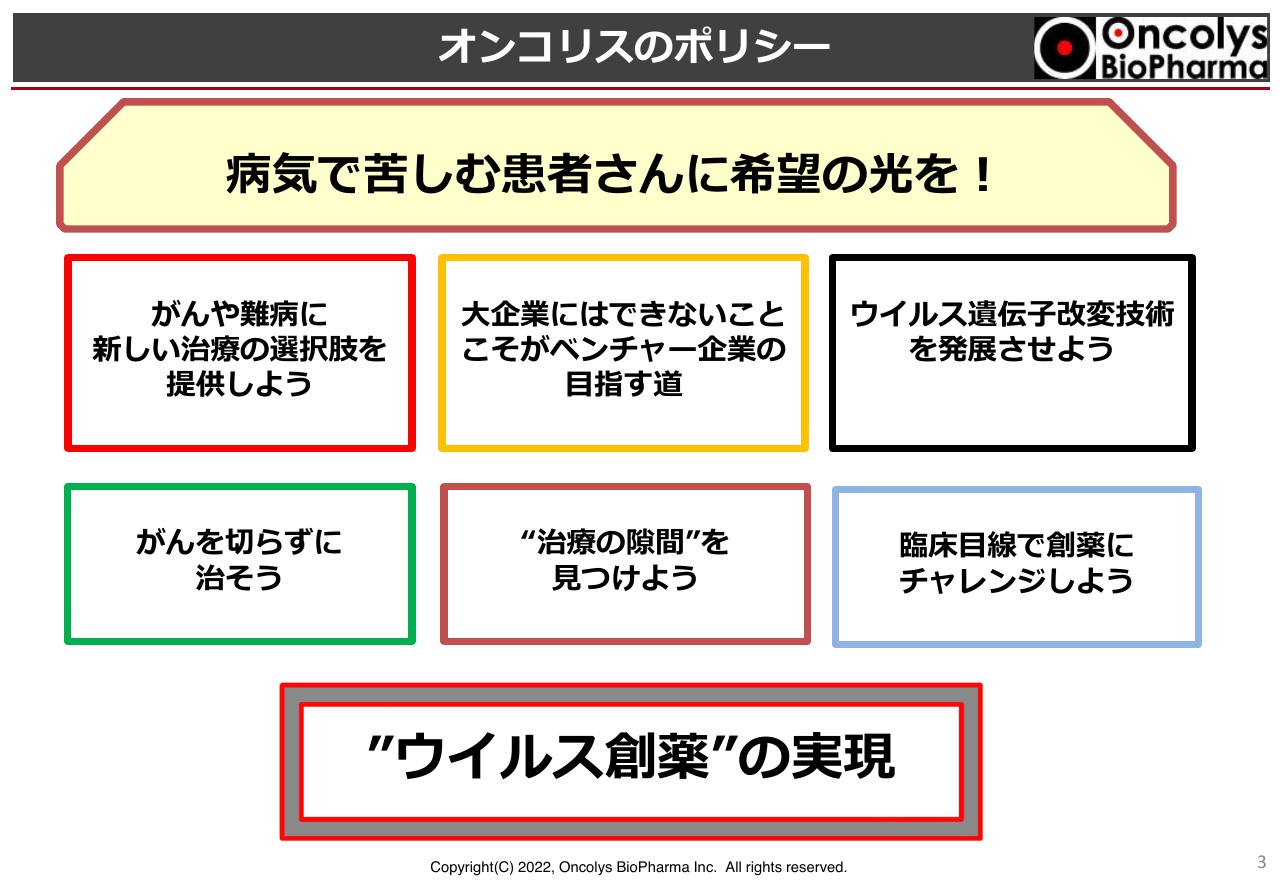
当社は18回目の株主総会となりますが、私は2002年くらいから起業するきっかけを考えてきました。「がんを切らずに治す」は後から出てきた言葉ですが、病気、特に抗がん剤による副作用に苦しんでいる私の身内もおり、よく効くのは当然として、なんとか安全性の高い薬を作っていきたいと考えました。
また、我々が手掛けている食道がんは、大企業がなかなか取り組まないような領域ですので、この領域をカバーするためにオンコリスバイオファーマを創業しました。私は一貫してこのポリシーを持ち続けています。
そして近年、我々が取り組んでいる領域は「ウイルス創薬」という名前を付けてもよいのではないかと考えています。「ウイルス創薬」を手掛けているベンチャー企業は、日本、アメリカ、そして世界においても当社が際立っており、このようなことを考えている会社は他にはないと思います。
オンコリスの創薬技術①
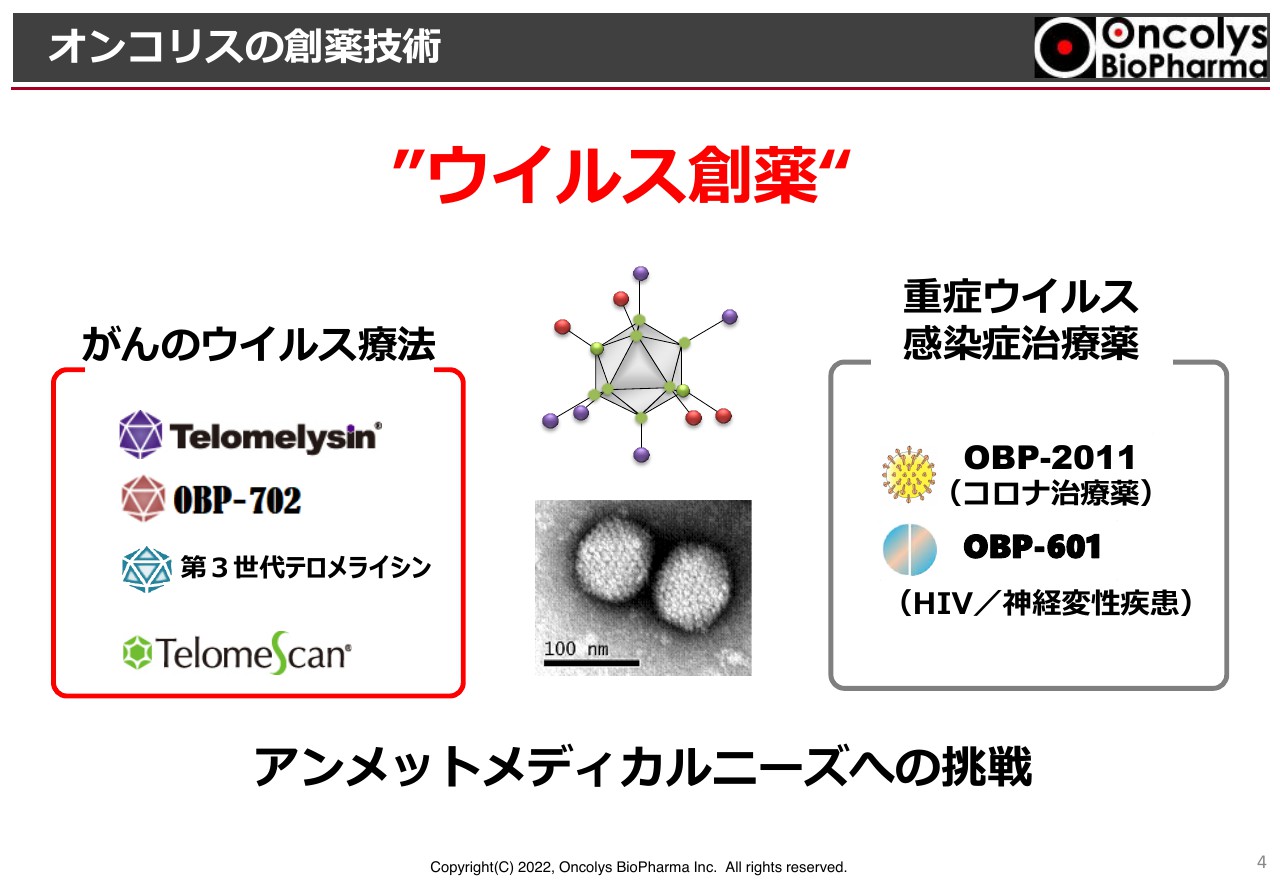
がんのウイルス療法、そして、重症ウイルス感染症治療薬についてです。がんのウイルス療法では「テロメライシン」をはじめとして、第2世代の「OBP-702」第3世代の「テロメライシン」やがん検査薬「テロメスキャン」があります。
重症ウイルス感染症治療薬は、これまで「OBP-601」をHIVの治療薬として開発してきましたが、近年、神経難病に対して効果があるのではないかという新たな研究結果が出てきており、臨床試験が進められています。
また、過去の重症ウイルス感染症治療薬のプロジェクトから派生してきた「OBP-2011」が新型コロナウイルスに非常に強く作用することがわかってきており、開発を進めています。
主力事業領域の市場規模と競合環境①

現段階では、スライドに記載のような主力パイプラインを中心に開発しています。左側の「テロメライシン」は、食道がんの治療薬を目指して開発しています。「OBP-2011」は、先ほどお伝えしたように経口コロナ治療薬の上市を目指しています。「OBP-601」は、神経難病を対象にしています。
「テロメライシン」の対象疾患は食道がんです。大手はあまり相手にしない領域ですが、日本国内だけでも患者数は2万人、全世界を見ると中華圏など大きいマーケットで、78万人という数字が出ています。
最大500億円以上という大きなマーケットのため、我々は「食道がんと言えば『テロメライシン』」というポジションまで、なんとか持っていきたいと考えています。今後は頭頸部がんや肝臓がん、あるいは乳がんという非常に幅広い範囲に適用させたいと考えています。
経口コロナ治療薬「OBP-2011」についてです。みなさまも新型コロナウイルスに対してはかなり勉強されていると思いますが、我々は「OBP-2011」で、日本国内の市場も目指しつつ、世界展開も考えています。
このようなウイルス感染症治療薬を開発できる会社は、世界でも限られており、海外ではメルク、ロシュ、ファイザー、ギリアド・サイエンシズ、あるいはグラクソ・スミスクライン、国内では塩野義製薬がリードしています。
「OBP-601」については、対象疾患は神経変性疾患とお伝えしました。数字としてなかなか表しにくいものの、今狙っている患者だけでも世界で12.4万人います。
今後の拡張性についてメカニズムから考えると、アルツハイマー病の進展用というよりは、アルツハイマーの根本的な治療とまではいかないものの、非常に根本的なところに作用する可能性があるということで、市場規模は数千億円になっていくと考えています。
本日は、この3つのパイプラインについてお話ししたいと思っています。
オンコリスバイオファーマ ガバナンス体制

先ほど株主総会でも選任いただきましたが、当社のガバナンス体制について、ご説明します。取締役は先ほどご紹介したとおりです。
スライド右下には監査役を記載しています。左下はOncolys USAですが、大手製薬メーカーを担当してきた社長のTalia Biranが、現在アメリカでの開発およびビジネス活動を担っています。
また、今回初めてご紹介しますが、3名の執行役員がいます。スライド右上の秦執行役員が財務の担当です。その下の磯山執行役員は事業開発担当で、特にライセンスビジネスに対して力を発揮しています。もう1人は、人事において新たに田口執行役員を採用しています。
当社マネジメントの多様なスキルセット
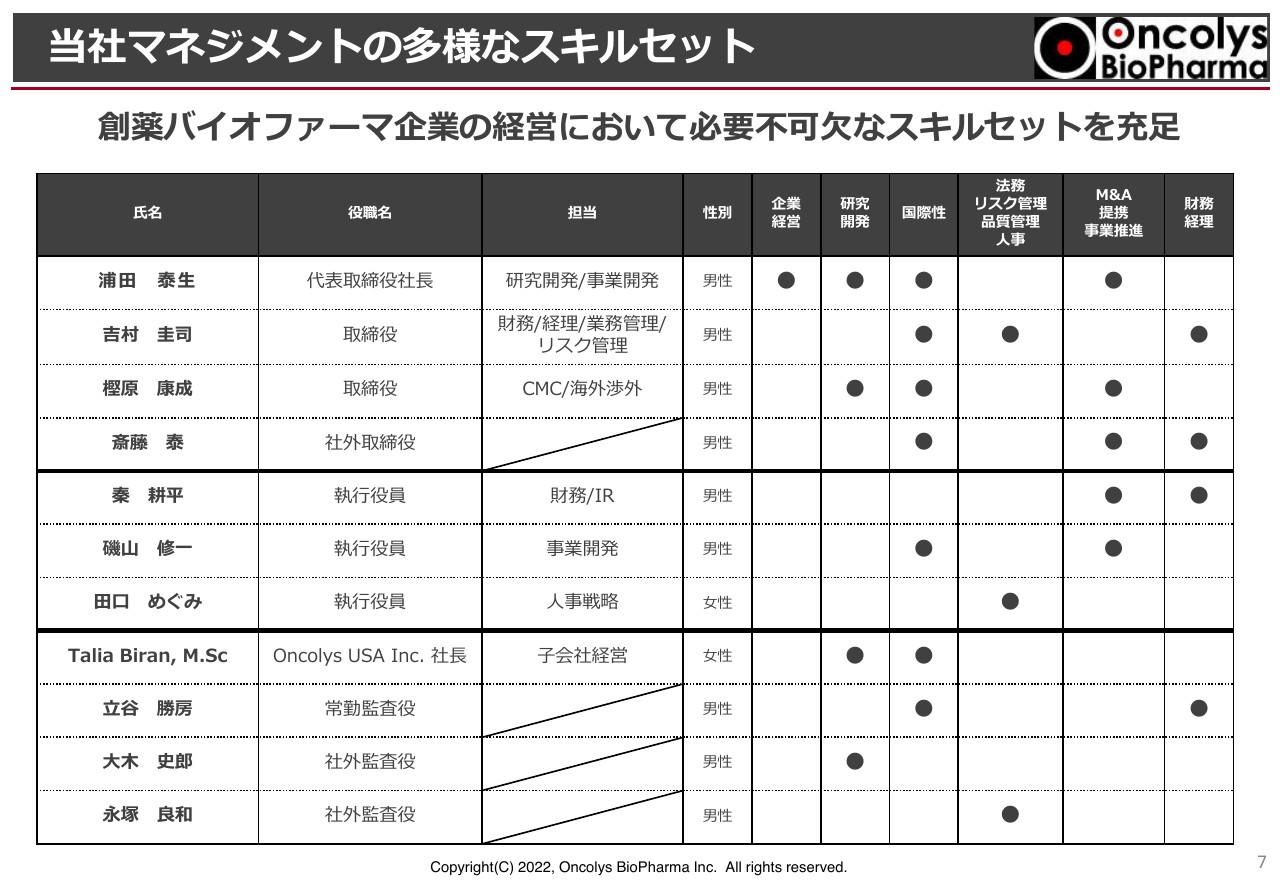
多様なスキルセットを持ち合わせるバランス体制で、当社は切り盛りしています。企業経営・研究開発・国際性・人事・事業推進・財務経理といった専門分野があり、スライド上部の方が取締役ですが、非常に多様なスキルセットになっていると考えています。執行役員も含め、かなりの領域をカバーできる体制にしています。
オンコリスグループの機能
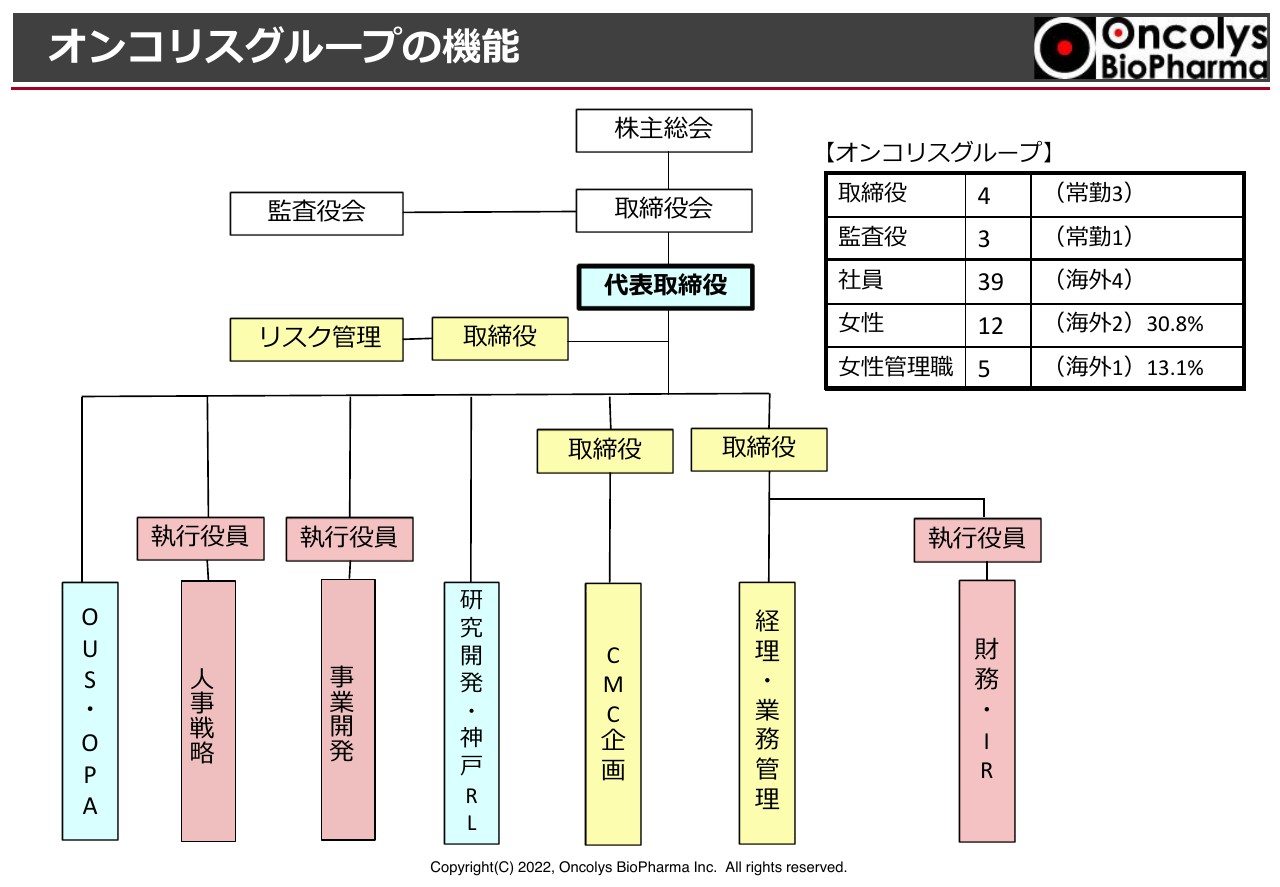
当社の組織として、現在39名の社員がいます。そのうち女性社員が海外も含め12名、女性管理職が5名おり、社員の約13パーセントが女性管理職になっています。
組織としては財務・IR、経理・業務管理、ウイルスを含めた製造開発のCMC企画、研究開発・神戸RL、事業開発、人事戦略とあり、Oncolys USAとOPA Therapeuticsというような子会社があります。
スライドの青色部分は私が直轄している部門です。それ以外は取締役ないしは執行役員が担当しています。吉村取締役にはリスク管理も担当しています。このような状況で開発が進んでいます。
本日は、当社概要から2022年の見通しの後、パイプラインについてお話しします。特に「テロメライシン」は現在開発が進んでおり、2024年の承認申請を目指しているため、マーケット、あるいはそこに持っていくまでの開発戦略についてもご説明します。そして、今後の見通しと、当社全体の成長戦略についてもお話ししたいと考えています。
それでは、当社の概要および2022年の見通しについて、吉村取締役からご報告します。
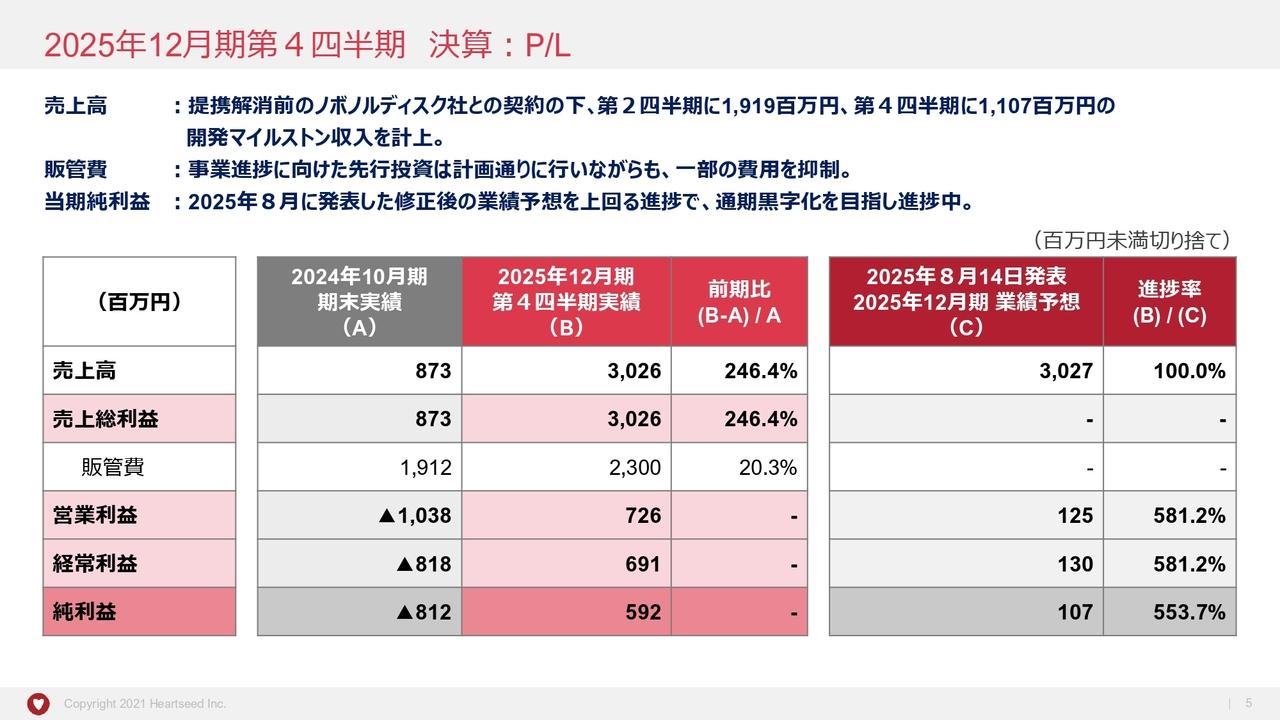
2021年業績結果
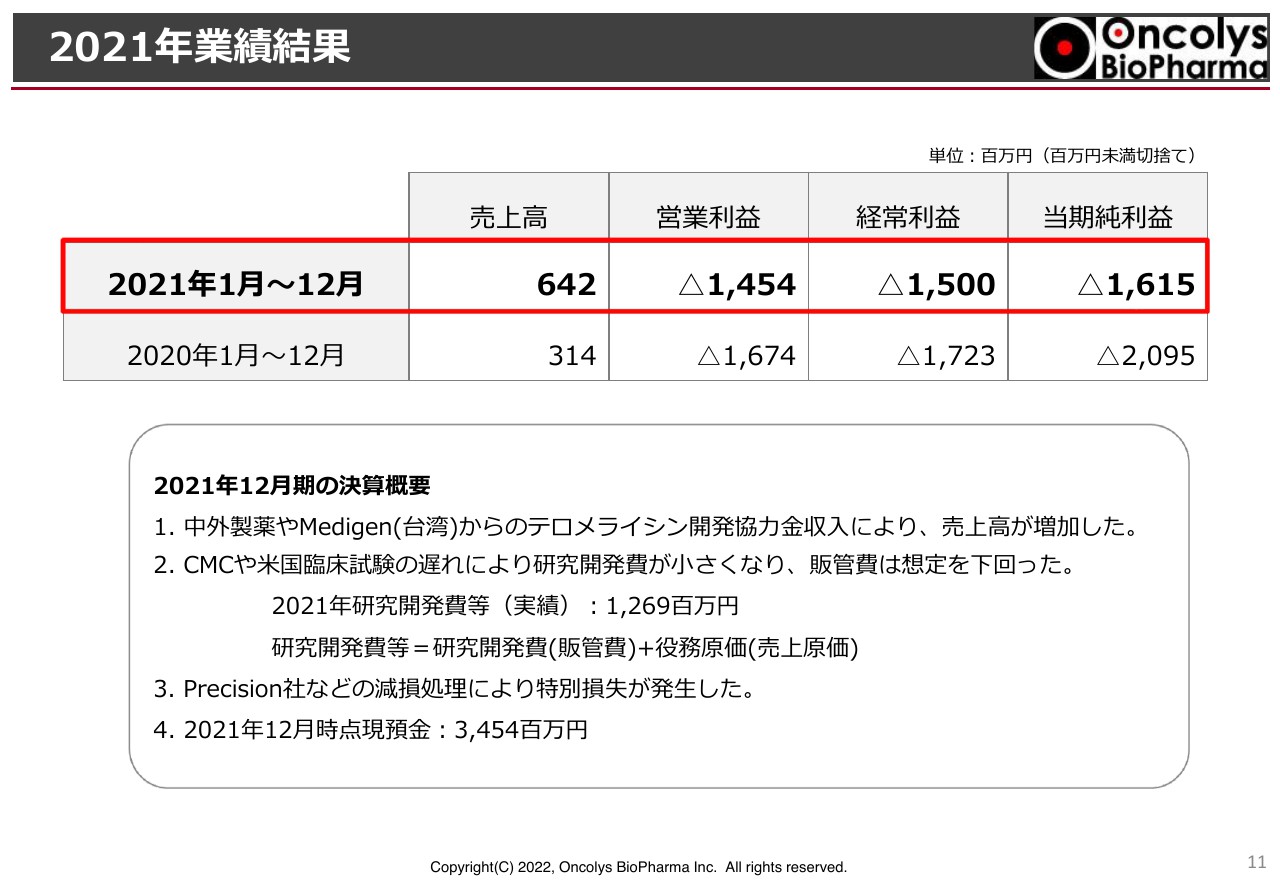
吉村:2021年度の業績結果をご報告します。株主総会の報告事項にもありましたが、今期の売上高は6億4,200万円でした。これは一昨年に比べほぼ倍増ということになります。
主な要因として、研究開発が進んだことによる中外製薬やメディジェン社からの開発協力金等の収入で売上が増加しました。研究開発が進むと、売上が増えるという仕組みです。
研究開発費は、損益計算書上は開発費となるため、売上が計上されると開発費が減少します。ですので、我々の経営の指標としては「研究開発費等」という言葉を使っています。販売管理費に含まれる研究開発費と売上原価ですが、協力していただいた企業等含め、「研究開発費等」という言葉を使って12億6,900万円とご報告しています。加えて、特別損失としてPrecision社等の減損処理をしています。
2022年12月期の業績見込み
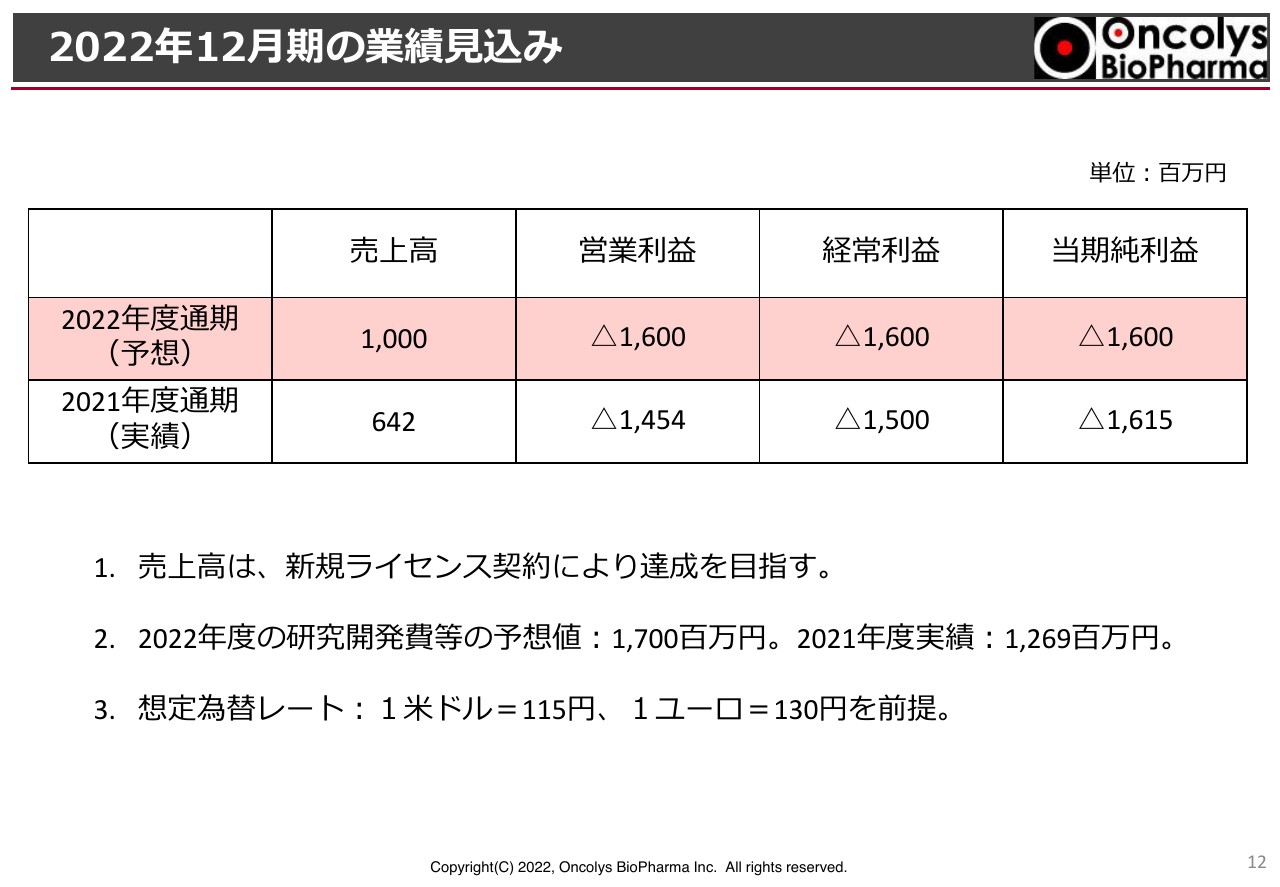
今期、2022年度の業績見込みとしては、昨年は一昨年に比べて売上が倍増したとお伝えしましたが、今期も引き続き開発が進むと開発協力金の収入が発生します。さらになんらかのライセンス収入を見込んで、売上高10億円という目標を立てています。
研究開発費については、先ほどご説明した「研究開発費等」という売上原価を含めたもので17億円を予定しています。
為替レートはスライドに記載のとおりです。昨今の為替レートの動きですが、1円の変動で米ドルは300万円、ユーロは100万円の損益計算書に対する影響が発生する可能性があります。
2021年12月末の財務状況
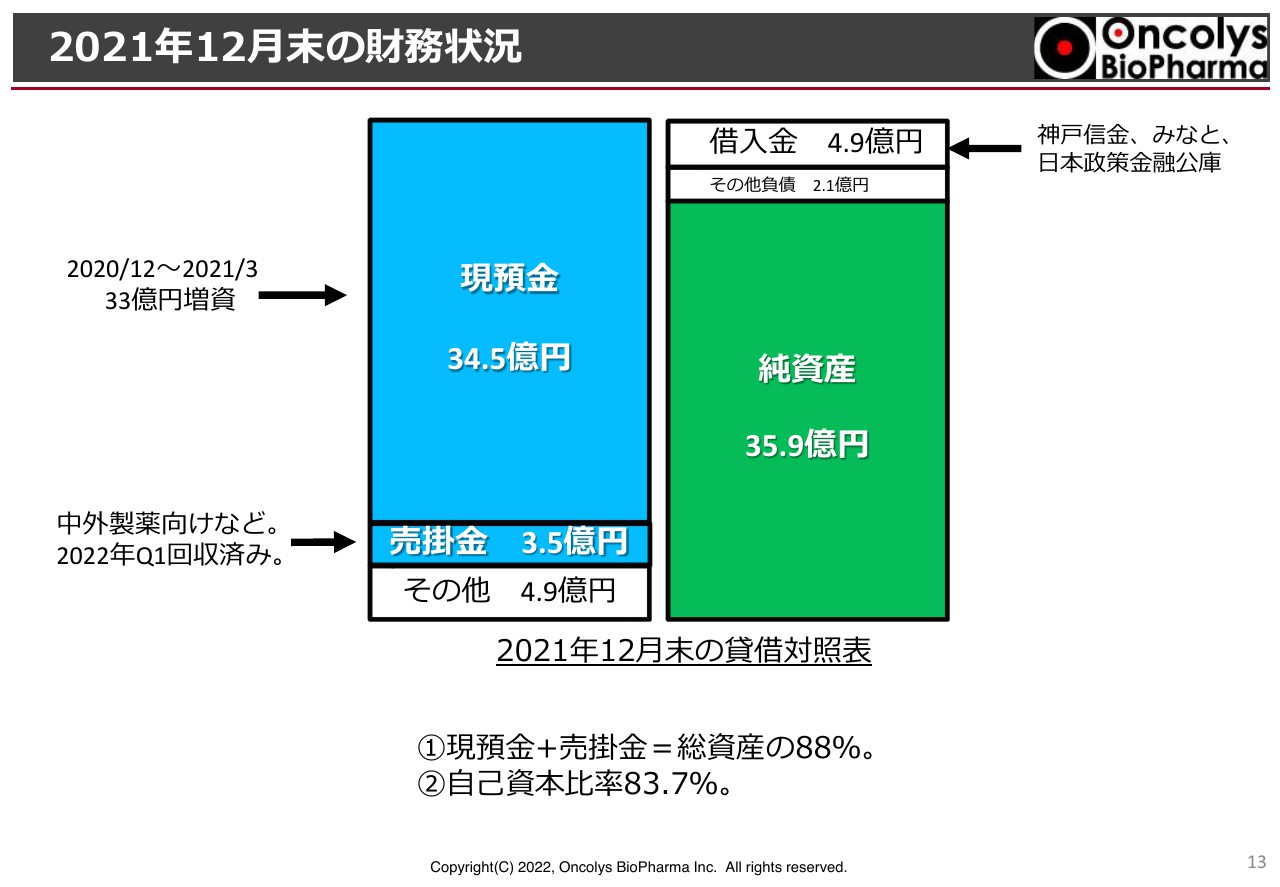
貸借対照表です。これも事業報告にありましたが、スライドに記載のとおり、私どもの資産のほぼ90パーセントは現預金と売掛金が占めており、その他の資産はほとんどありません。負債についても借入金が若干ありますが、ほとんどが資本金で、自己資本比率は83.7パーセントとなっています。
研究開発費等の推移と予想
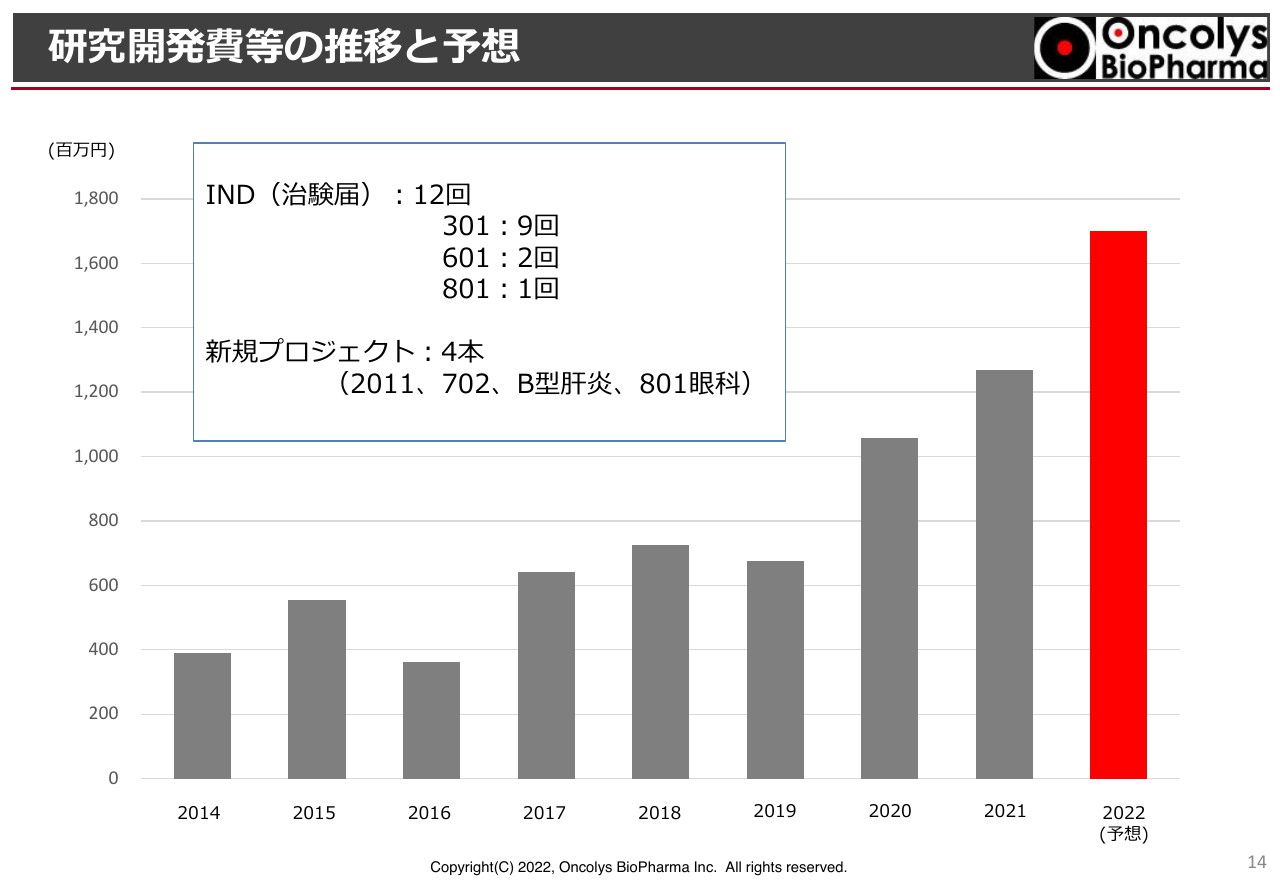
2022年度の研究開発費等は17億円を予定しています。スライドは過去の推移ですが、IND(治験届)を12回行っています。「OBP-301」で9回と記載していますが、肝細胞がんや放射線併用、放射線化学療法併用、加えて頭頸部がん等のさまざまなINDを行っています。
資金調達に関する説明
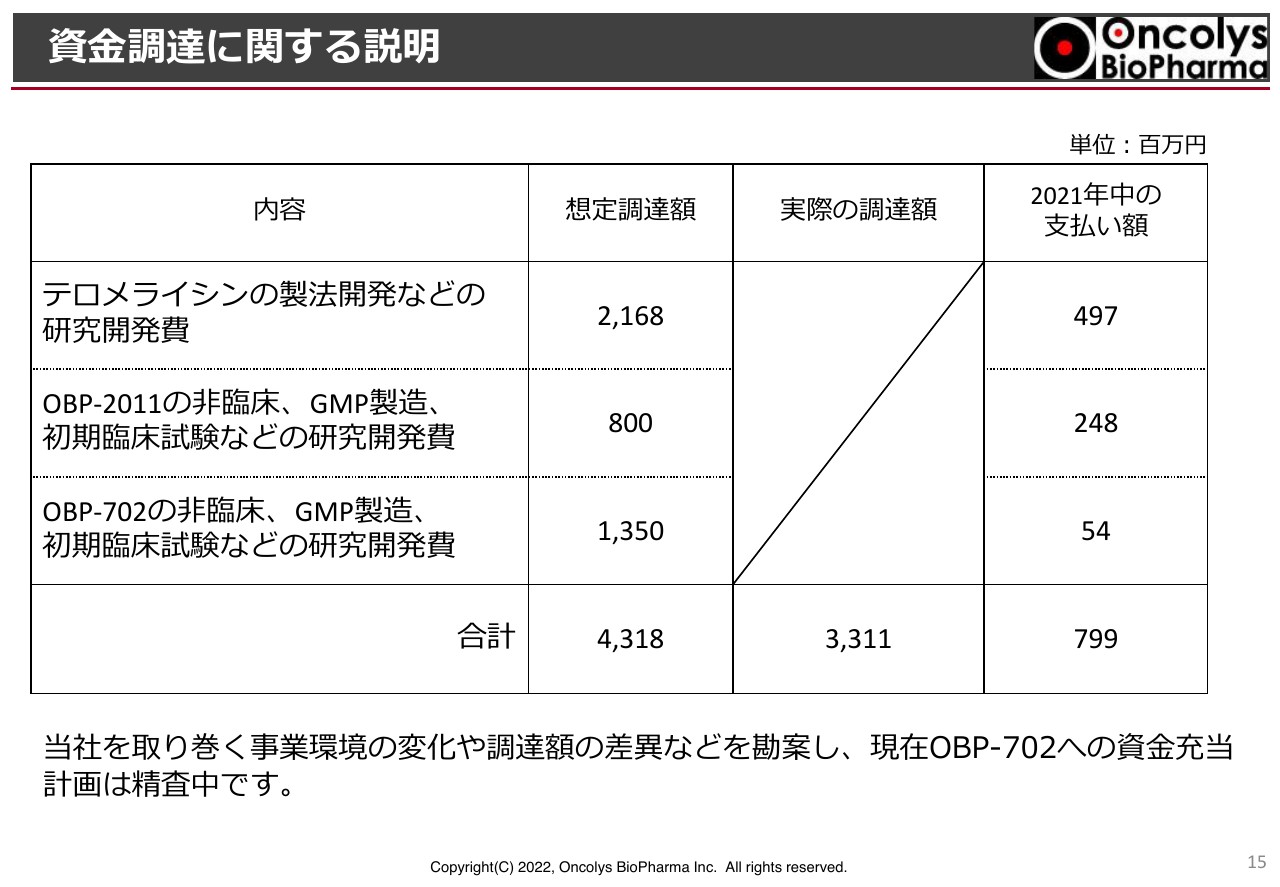
資金調達ですが、一昨年の暮れから昨年にかけて、約43億円の資金調達を予定していましたが、実際には約33億円の資金調達ができ、2021年度は約8億円の支出が行われました。
特に力を入れているのが「テロメライシン」「OBP-2011」で、資金調達でショートした部分はありますが、「OBP-702」については優先順位を下げて検討しています。
株主数の推移
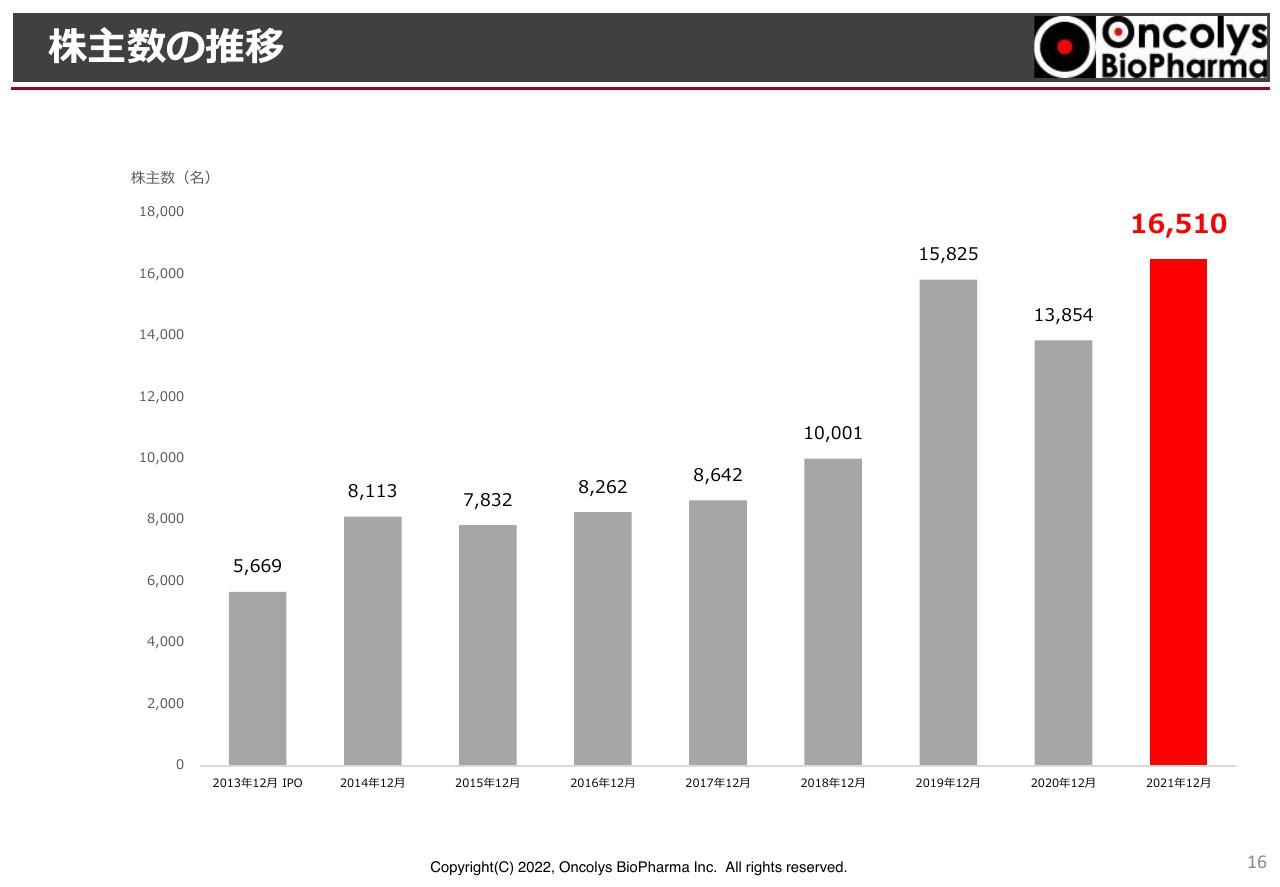
株主数の推移です。年度末を見れば、2021年12月が過去最高数だったことがわかります。
2021年のトピックス①

浦田:トピックスとして、昨年度の進捗です。「テロメライシン」は、ご存知のように昨年10月に中外製薬とのライセンス解消がありました。後ほど詳細や経緯についてお話ししたいと思いますが、中外製薬との間で承認申請事業は2024年と決定し、現段階でもそのように進めています。
ヘノジェン社というベルギーの製造会社と、製造に関する契約を締結しています。また、食道がんについて、現在行っている「Phase2」試験および「先駆け指定」を中外製薬から引き継ぐことも合意しています。
一方、アメリカの頭頸部がん、あるいは食道がんでのCRT(ケモラジ)試験の投与が昨年、実際に開始され、現在、試験は継続されています。
「OBP-2011」については、昨年さまざまな変異型のコロナウイルスに対してチャレンジし、アルファ、ガンマ、デルタ、ベータ、最終的にオミクロン株に対しても強い効果を示していることが示されました。SARSあるいはMERSといった過去のウイルスに対しても効果を確認しています。
さらに、治験用原薬のGMP製造もすでに完了しています。今後は治験申請、あるいはライセンスに向けてのメカニズムの解明が残っており、鹿児島大学でも行っていますが、新たに国立感染症研究所との共同研究も開始しました。また、ライセンスにおいて非常に重要な、筑波大学とのマウスにおける実験モデルも開始しています。
2021年のトピックス②

「OBP-601」に関しては、当社の費用負担は一切なしで、アメリカのTransposon社がすべて費用を負担し、二重盲検による2つのPhase2a臨床試験が開始しています。1つがPSP(進行性核上性麻痺)という少し聞き慣れない名前ですが、進行性核上性麻痺という領域で、神経内科の病気です。また、ALS(筋委縮性側索硬化症)という筋肉が段々と働かなくなるもの、あるいはFTD(前頭側頭型認知症)といったものを対象にした試験も進行しています。
中外製薬との契約解消により、当社は「OBP-301」の開発にかなり注力しなければならないということで、「OBP-702」の優先順位は引き下げています。ただし、岡山大学のAEMDからの研究費で前臨床試験を進めている状況です。
「テロメスキャン」については、昨年6月から順天堂大学と共同研究講座を開設しています。3月29日に発表しましたが、AIを用いたCTC検出プラットフォームについて、CYBOという会社と共同開発契約を結んでいます。
また、アメリカのLiquid Biotech社については、経営が若干危なくなってきたことを理由にライセンス契約を解消し、新たな提携先を考えているという状況です。
パイプライン開発一覧①
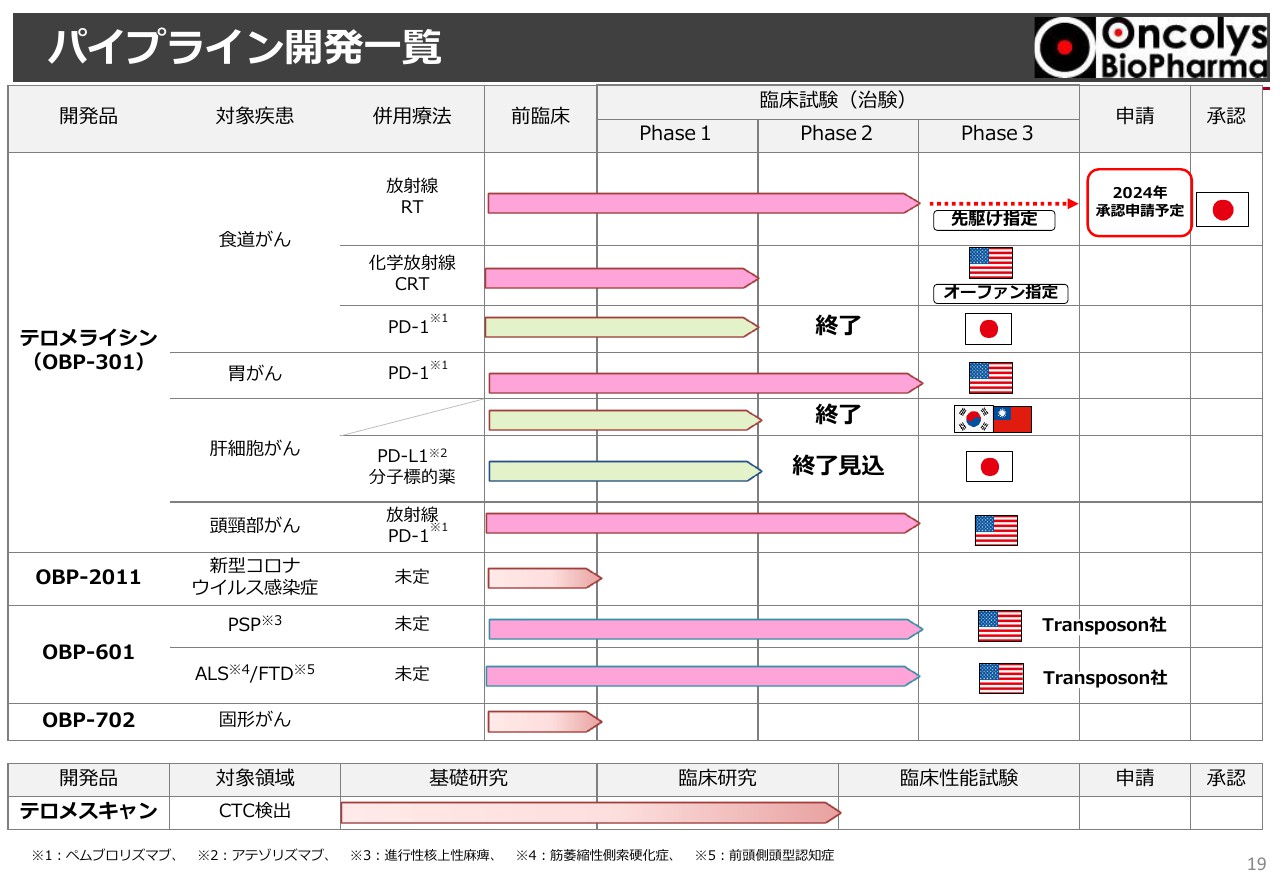
パイプライン開発一覧ですが、スライド上半分が「テロメライシン」のさまざまな試験となっており、「Phase2」まで進んでいます。
「終了」と記載しているのは、組入れ終了というもので、中外製薬が今も行っている肝臓がん試験も、合意のもとで今年10月までに終了することになっています。
ライセンス解消までの主な経緯

当社「ウイルス創薬」のそれぞれのパイプラインについてご説明します。まず、中外製薬とのライセンス契約の解消の経緯です。スライド上部から、2019年4月8日、ほぼ3年前に中外製薬と契約しました。同日に「先駆け指定」を行っています。
その段階で中外製薬は食道がんの「Phase2」試験以外にも、肝臓がん、頭頸部がん、CRTによる食道がん試験の治験を開始しています。2020年に入ると再び新型コロナウイルスの感染が広がり、日本とアメリカで医療がひっ迫し、臨床試験がかなり滞ってきました。
それと同時に、当社はロンザ社というアメリカのヒューストンにある会社に治験薬を依頼していたのですが、ウイルス製造に対する資材の調達が徐々に難しくなりました。
そして、世界中で新型コロナウイルスのワクチンを作るために資材がどんどん使われ、我々のような治験薬のプライオリティが非常に下がってしまいました。その中で、ロンザ社でのウイルス製造も複数回失敗したということです。
その頃、中外製薬は頭頸部がんやCRTによる食道がんなどの治験の中止を発表しました。一方で、今実際に行っている製造承認を取得するための放射線併用の「Phase2」試験はしっかり継続するという判断をされています。
その後、中外製薬と協議を行い、ロンザ社ではやや頼りないということで、ベルギーのヘノジェン社と今後の商用製剤の製造開発を行っていくことで契約を締結しました。新型コロナウイルスの影響もあると思いますが、中外製薬の中では承認申請を2年延期する判断も出されています。
しかし、2021年10月に中外製薬からライセンス契約を解除するという通告がありました。少なくとも「テロメライシン」の安全性や有効性に問題があったわけではないということまでしか聞き出すことができませんでした。
このような経緯により、中外製薬とのコラボは順調にはいかず、やはりコロナ禍が影響を及ぼしたことは否定できないと思っています。
十分と言えるかどうかはわかりませんが、我々は最大限の努力をしてきましたが、製造の遅延も中外製薬にとってはネガティブなインパクトだったのではないかと思っています。
全体的に勘案すると、中外製薬と最後まで話が合わなかったのは、やはりウイルス製造に対しての考え方に原因があると見ています。
ライセンス契約解消の通告後も、今後の終わらせ方についての話し合いに相当時間がかかりました。
中外製薬との主な合意事項

昨年末に行った、いわゆる中外製薬との契約解消に伴う最終的な合意事項です。大きく4つあります。
1つ目は、今年の10月15日までに食道がんの「Phase2」の臨床試験を中外製薬からしっかり引き継ぐということで、中外製薬も協力するとのことです。
2つ目は、当社が引き継ぐまで中外製薬の費用負担で臨床試験を実施することへの合意です。したがって、現段階では中外製薬が「Phase2」の臨床試験を実施していきます。
3つ目は、一番話し合いが長引いたGMP製造についてです。我々はGMP製造についてできる限り承認申請まで持っていきたいと考えていますが、今年の10月15日までに受領したヘノジェン社からの請求額の50パーセントを中外製薬が負担することで合意しています。
4つ目です。中外製薬が継続して実施していた肝細胞がんの臨床試験は、中外製薬の商品の抗体医薬とチェックポイント阻害剤である「アテゾリズマブ」の併用を主眼にした治験です。
仮に継続して「Phase2」「Phase3」に進んでも、中外製薬あるいはロシュの製品を使うことになるため、我々にとってあまり大きなメリットはありません。他と組んだほうがよいということで、協議により治験は中止することになりました。
そして、10月までに正式なレポートを入手する約束になっています。これが中外製薬との契約解消に伴う経緯と結論です。
パイプライン開発一覧②
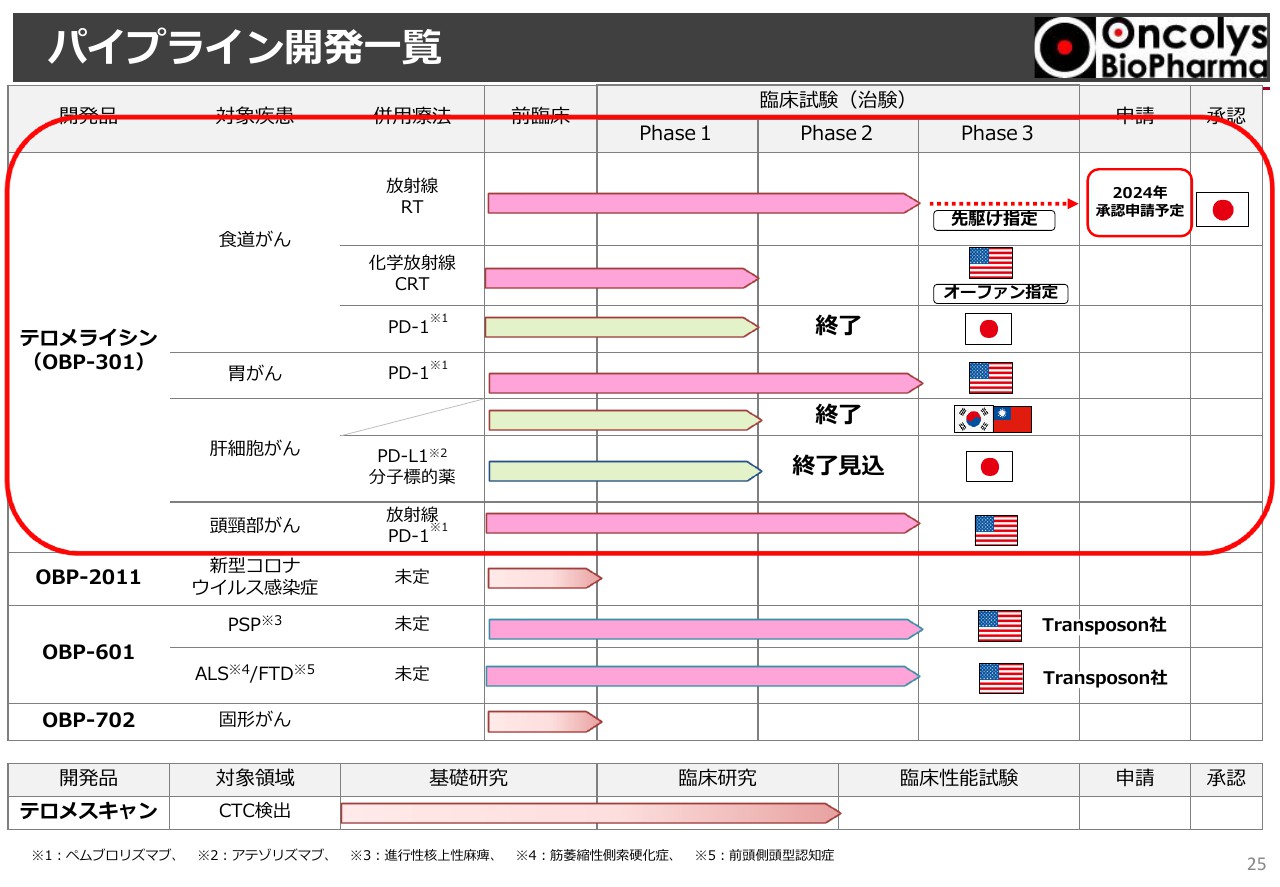
スライドの赤色で囲った部分が「テロメライシン」の開発状況です。主題になっている臨床試験については後ほどお伝えしますが、目標症例が37例と大変少ないポピュレーションです。
食道がんの手術はあばら骨の間を切る手術になりますので、8時間ないしは10時間かかります。高齢の方、心臓が悪い方は手術に耐えられないということで、手術ができない方、肝臓や腎臓、心臓などに障害があるため化学療法やケモセラピーが受けられない方といった非常にマイナーポピュレーションですが、放射線治療しかできない方が対象となります。
テロメライシンと放射線による治療
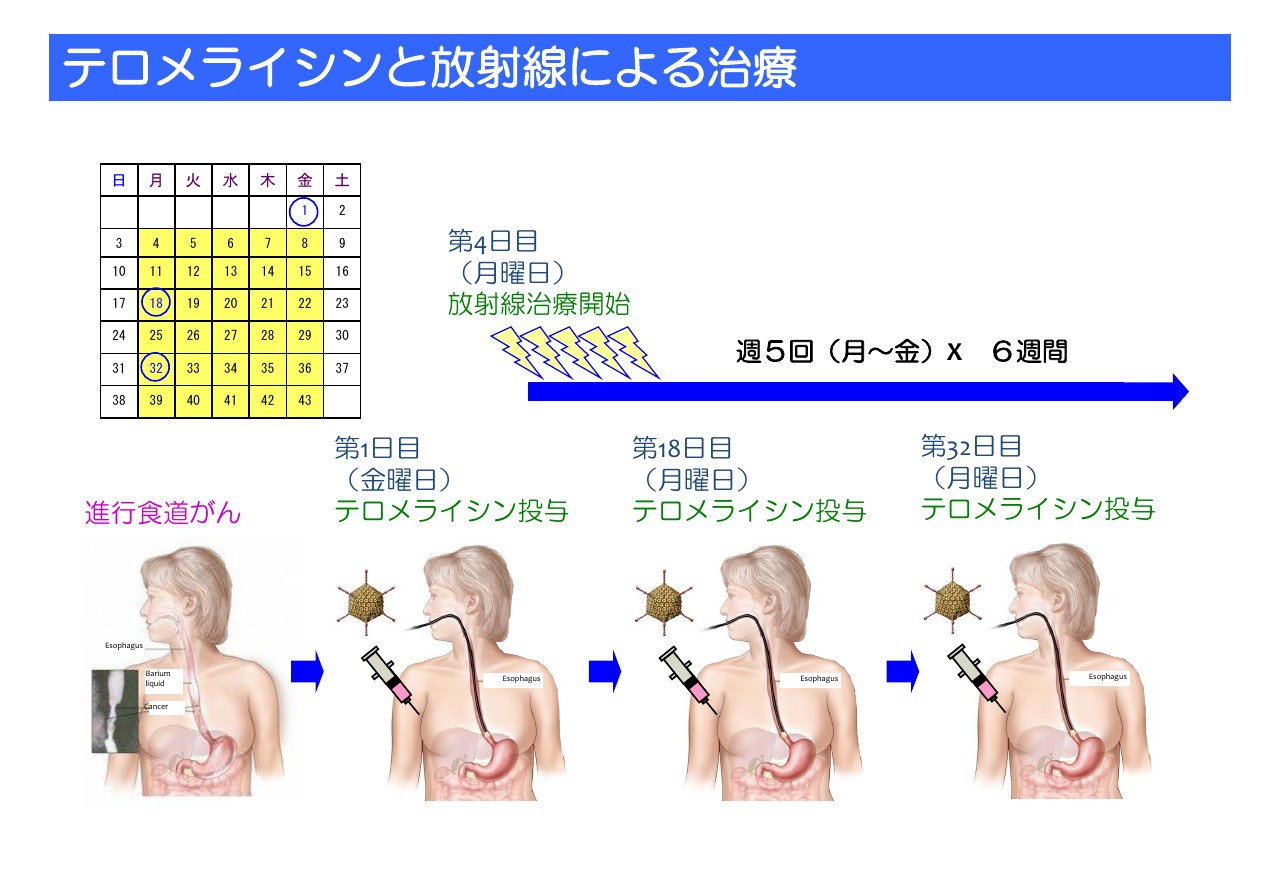
放射線治療は月曜日から金曜日までおおよそ6週間、毎日少線量ずつ放射線を当てていくという治療ですが、それに対して、2週間に1回胃カメラの中にカテーテルを入れ、そこから食道がんの局所に「テロメライシン」を注射していくというものです。
食道がん 臨床試験
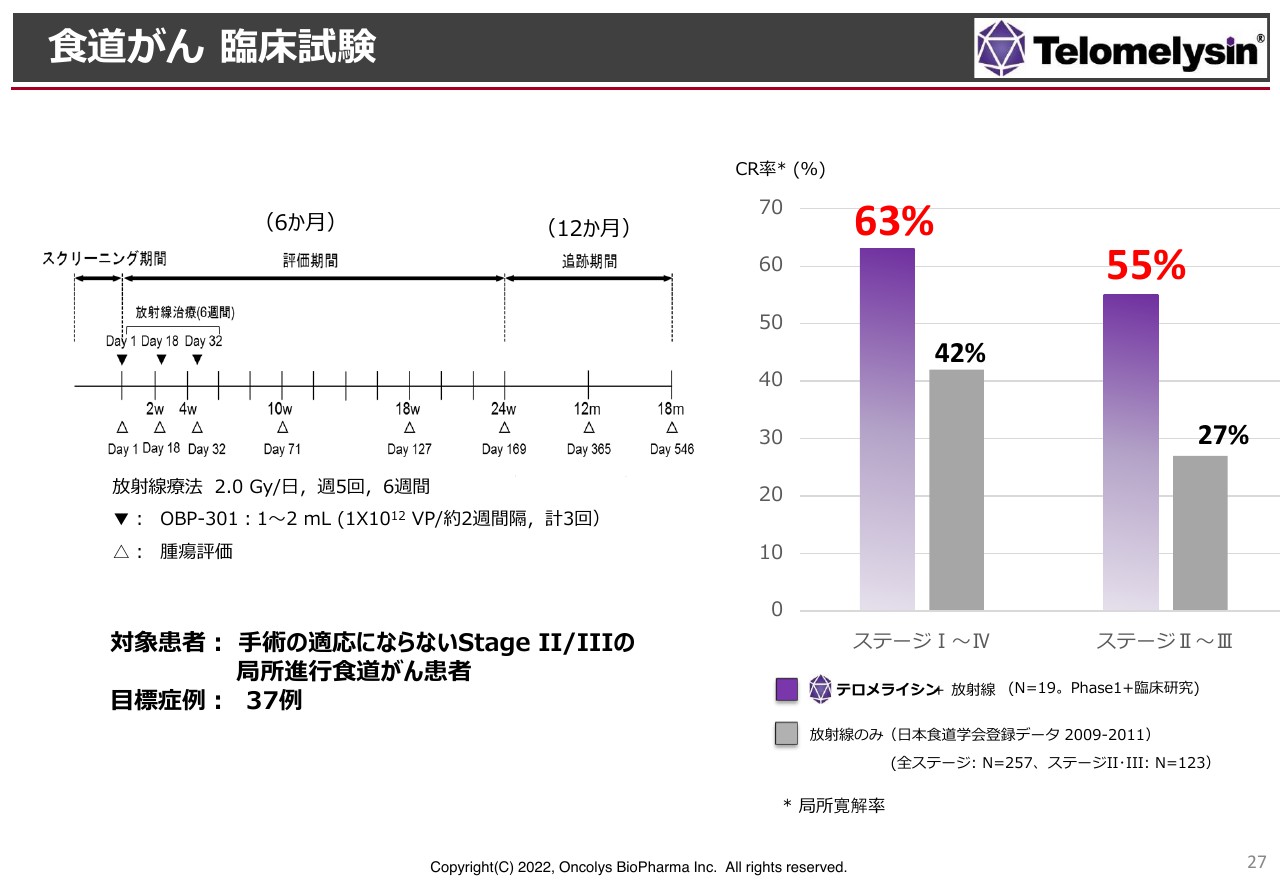
食道がんの臨床試験結果をまとめたものです。ステージⅠからステージⅣまでのすべての患者さまの治癒率を表しています。
紫色の棒グラフが「テロメライシン」の結果で、完全治癒率は63パーセントです。放射線単独のグレーの棒グラフは42パーセントですが、こちらはステージⅠの患者さまがかなり多いため高い数字となっています。
右側の2つの棒グラフはステージⅡとステージⅢの若干進行した食道がんの結果です。放射線単独ではこれまで27パーセントの方が局所での完全寛解を示しましたが、「テロメライシン」を上乗せすると55パーセントと、ほぼダブルスコアの効果が得られています。現在、岡山大学臨床研究とPhase1臨床試験の結果が再現できるのか、日本の17施設でPhase2臨床試験を進めています。
Henogen SA

樫原:先ほどから何度かお話が出てきていますが、ヘノジェン社と製造開発がスタートしています。
スライドの右上の写真は、当社の社員がヘノジェン社を訪問し、実際にどのような製造の結果が出ているかをディスカッションして、今後の製造開発の方針を決定するミーティングの様子です。
ヘノジェン社自体はベルギーにあります。ベルギーはもともと生物製剤の製造に非常に強い国で、ヘノジェン社も「アデノウイルス」を使った製造に関して、すでに承認取得した製品を作っています。具体的には、アストラゼネカ社の新型コロナウイルスのワクチンもこちらで作っています。
従業員は400名程度です。1991年創業で非常に歴史があり、ウイルスの製造に長けた会社です。ベルギー内に4施設を持っており、製造開発から商用製品の充填までのすべての工程が実施可能となっています。
テロメライシンの製造
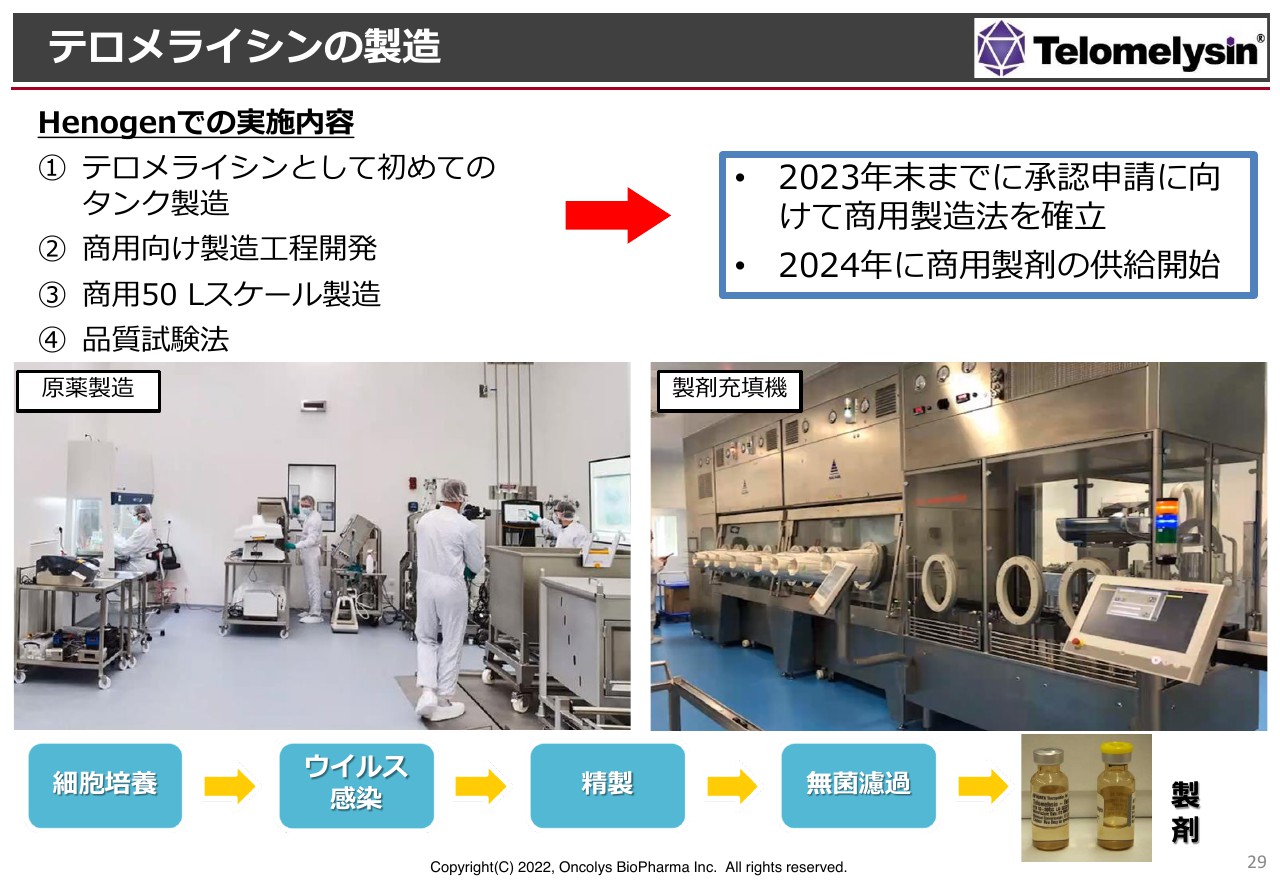
製造の概略です。先ほど浦田からも説明がありましたが、ロンザ社では「ウェーブ」というテーブルの上にバッグを乗せ、揺らして培養するという仕組みを使って治験薬を製造していました。今回は製造タンクを使って製造するということで、製造方法を大きく変えており、非常に効率的にウイルスが製造できるようになりました。
現在は2リットルのスケールで製造していますが、今後はスケールを大きくして商用の製品を作っていくという流れになります。
ウイルスの製造には、培養した細胞にウイルスを感染させ、細胞の中で増えたウイルスを回収するという工程があります。日本ではこれまで「デリタクト」という製品が承認されており、アメリカでは「IMLYGIC」という薬が承認されています。
世界に2剤しかない状況ではありますが、3剤目は当社が承認取得を得られるように、2024年の承認に向けてしっかりと製造を進めていきたいと考えています。
食道がん Phase 2

現在、「テロメライシン」の承認申請に向け、目標を2024年上半期と定め、できれば2024年の株主総会で承認申請をご報告したいと考えています。臨床試験の組入れは、年内には終わると予測しています。
中外製薬からの引き継ぎも10月までに完了する予定です。データベースなど当社への移管がなかなか難しい状況でしたが、医薬品開発支援機関(CRO)の力などを借りて、10月までに収めることができると考えています。
製造についても先ほどお話ししたとおりです。前臨床試験はすでに完了していますので、2024年の承認申請まで持っていきたいと考えています。
海外の医師主導治験の状況

海外の状況です。今は海外で3つの試験が行われています。胃がんの「Phase2」は、目標の18例のうち13例が組入れられているところです。スライド右側に記載のとおり、ペンシルベニア大学やダナ・ファーバーがん研究所など、施設を増やして実施しています。
2番目はCRT(化学放射線)とありますが、食道がんの治験がようやくスタートしました。目標の15例のうち4例まで進んでおり、施設も増やしています。「テロメライシン」と化学療法の初の併用となりましたが、現段階で安全性を懸念するようなことは起こっていません。
最後に、頭頸部がんです。こちらも施設を増やしながら行っていますが、まだ1例目です。局所でよく効いたのですが、担当医から企業主導の治験に切り替えてほしいという強い要望が出ています。
アメリカの先生方はもちろん自主研究で行うのですが、インセンティブの意味でも「企業治験に切り替えたらちゃんとやるよ」というお話もあります。現段階では我々は国内の承認申請に注力していますので、もう少し様子を見ていきたいと考えています。
テロメライシンのマーケット戦略
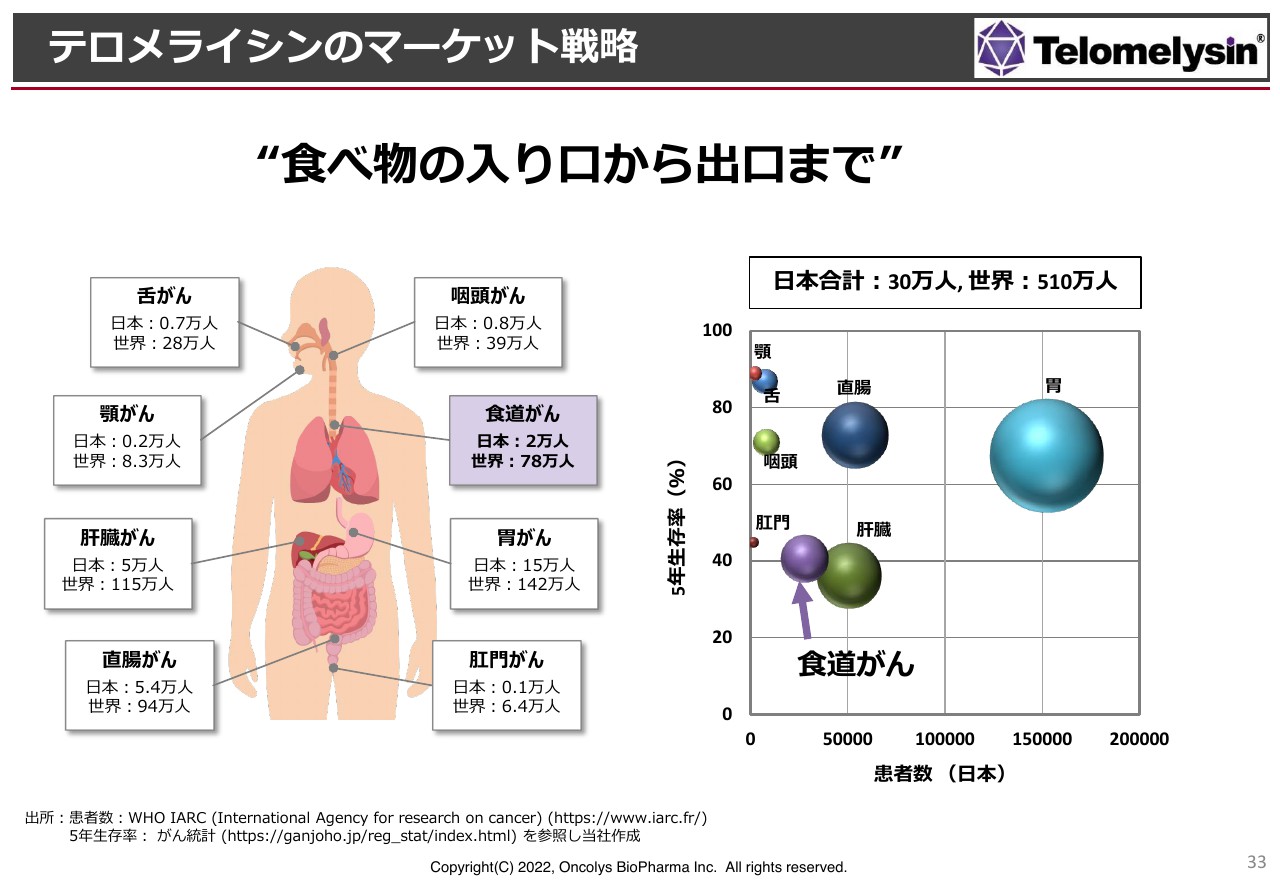
「テロメライシン」の今後のマーケットの考え方と開発戦略です。「テロメライシン」については、創業の頃から岡山大学の消化管外科の先生方といろいろなディスカッションを行ってきました。
スライドに「食べ物の入り口から出口」までと記載していますが、これは口からお尻の穴までのことです。特に舌がんや咽頭がん、顎のがんなど、非常に治療が困難な状況です。
また、食道がんや、その下の胃がん、肝臓がんも1つの消化器として捉えています。今後、問題としていきたいのは直腸がんから肛門がんですが、これらの治療薬はほとんどありません。
特に肛門がんは、がんをオペで取ってしまうと人工肛門にしなければならず、大変予後の悪いがんです。ただし、あれもこれも行うわけにはいきませんので、現段階で日本国内は食道がんに絞っています。
スライドの右側の図はマーケットを示しています。横軸が日本の患者数、縦軸が5年間の生存率です。食道がんは生存率が非常に低い状況ですが、患者数は胃がんに比べるとそれほど多くありません。
しかし、非常に重要な器官であるにもかかわらず、なかなか治療薬がないということで、このようなものに今狙いをつけています。将来的にはもう少し拡大していきたいと思っていますが、まずは食道がんから取り組んでいきます。
テロメライシンー食道がんでの展開

臨床試験がうまく進んで承認申請段階まで進むと、「テロメライシン」がすべての食道がんで使えるかという問題が出てきますが、保険適用となるのは手術適用とならない方で、なおかつ「放射線療法との併用」という縛りがある可能性が出てきます。
ただし、臨床試験のプロトコル上では、手術を拒否する食道がんの患者さまも試験に出ていますので、このような方も保険適用になる可能性が高いと考えています。
食道がん治療の現状(日本国内)
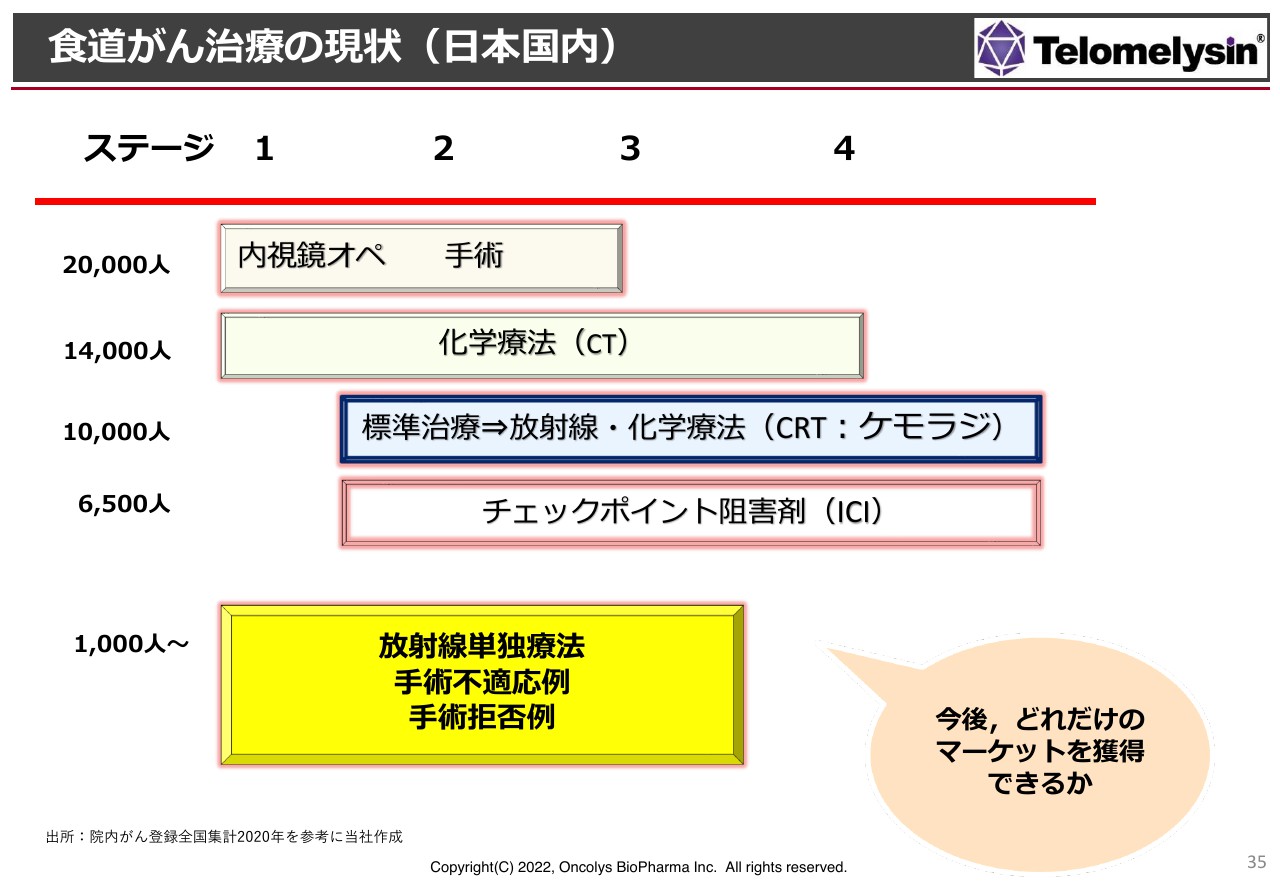
日本国内における食道がん治療のマーケットについて、スライドに現状を示しています。上部の赤い線に沿って、左からステージ1、2、3、4とあり、ステージ4は末期です。
食道がん患者の方は、日本国内にだいたい2万人います。初期の軽いものは内視鏡で取ったり切ったりすることもできますが、すぐに手術をするわけにもいきません。ステージ1のできたばかりのものはともかく、ステージ2くらいになるとなかなか難しい状況になります。
まずは化学療法(CT:ケモセラピー)を行いますが、患者数は1万4,000人くらいです。次に標準治療、放射線・化学療法(CRT:ケモラジ)とありますが、ステージ2くらいで見つかった場合はCRTの治療を行います。このような方は1万人以上います。
チェックポイント阻害剤については、「ペムブロリズマブ」「キイトルーダ」「オプジーボ」があり、臨床試験でさまざまな結果が出てきています。将来的には標準治療と言いますか、最初からCRTとチェックポイント阻害剤を併用するというレジュメができてくるようです。
このような中で、当社が今取り組んでいる放射線単独療法、手術不適応例、手術拒否例にあたる方は1,000人以上いると思いますが、食道がん患者全体の約2万人の中では非常に少ないことがわかります。
しかし、これだけでマーケットを拡大していけるとは思っていません。将来的には、我々が対応するのか、ライセンス先で対応するのかはわかりませんが、さらなる適応拡大を考えていきます。
テロメライシンの成長戦略
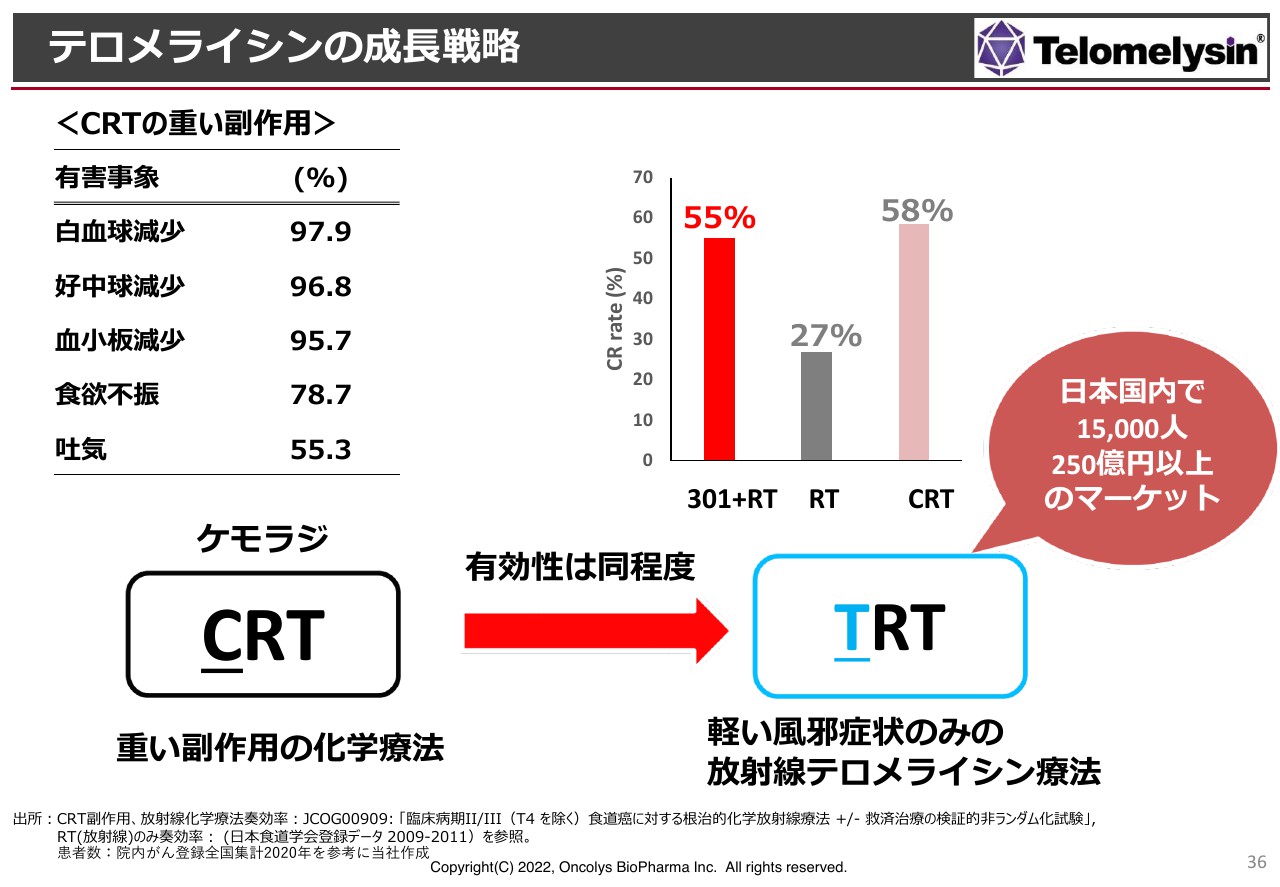
マーケットを大きくしていくために、CRTというがん療法を「テロメライシンRT」、通称TRTという治療法に置き換えた治療体系を作っていきたいと思っています。これがうまく進められれば、日本国内だけでも1万5,000人、250億円以上のマーケットを築くことができると考えています。
なぜCRTをTRTに変えるのかと言いますと、スライド左上に記載のとおり、CRTは重い副作用がある化学療法であることが要因としてあります。白血球、好中球の減少など、免疫機能の低下はほぼ全例で出ていますし、血小板減少や食欲不振、あるいは吐気という消化器症状も高頻度で出ています。これに抜け毛も加わり、患者さまにとっては大変つらい治療法です。
一方、右側の棒グラフで示していますが、ステージ2、ステージ3で「テロメライシン」と放射線療法を併用すると、局所の寛解率は約55パーセントです。少なくとも、内視鏡ではがんが見えなくなります。
論文等を検索すると、日本国内でのCRTの臨床試験で、がんが局所で消えたと考えられる症例は約58パーセントと、ほぼ同程度の治療効果があると言えます。しかし、放射線療法だけではダメということは明らかです。
アメリカでのCRTの結果は約48パーセントですので、TRTのほうが局所の効果が高いということがわかっています。これらの結果を受けて、我々はTRTの治療体系を作りたいと考えています。
食道がん市場における成長(日本国内)
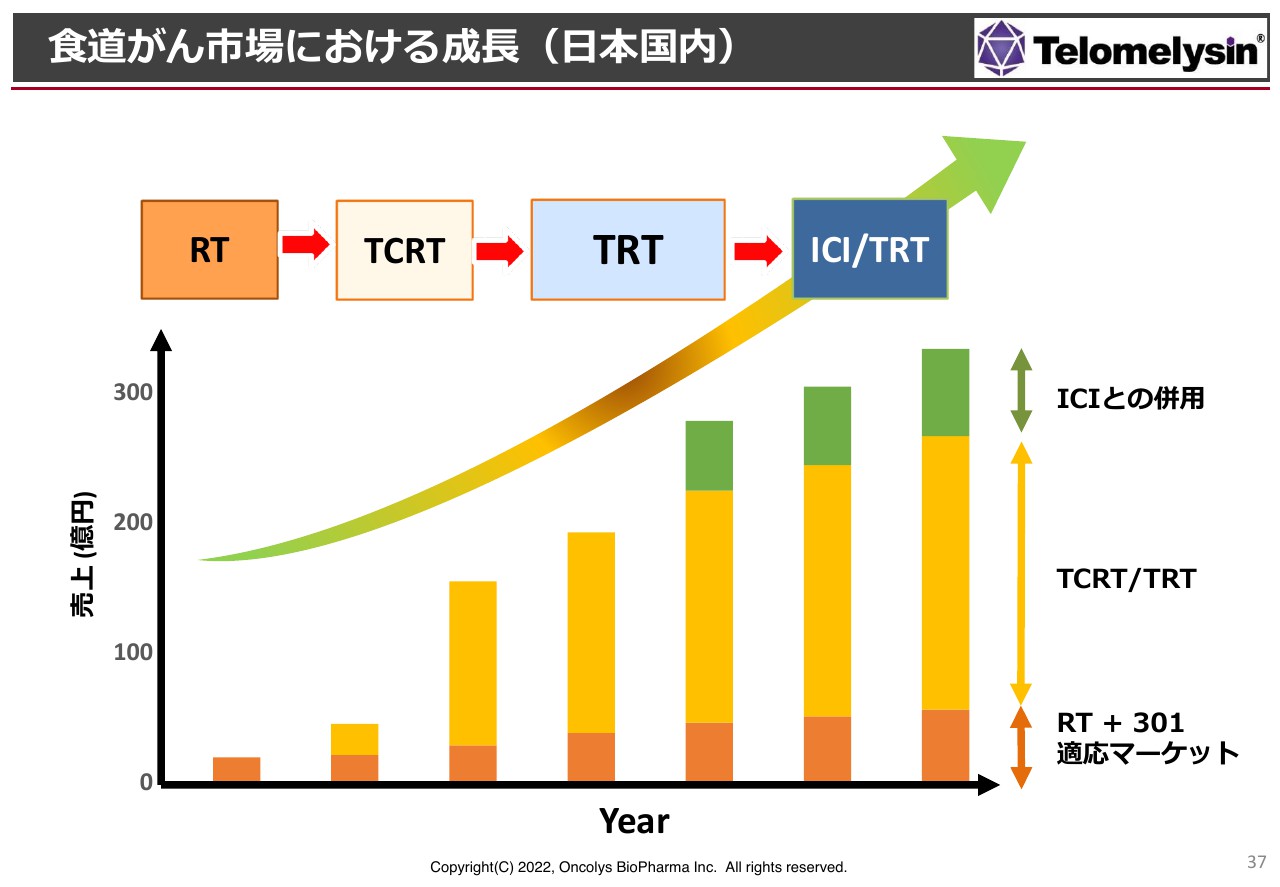
TRTの治療体系をいきなり確立することはなかなか厳しいため、マーケットサイズに鑑み、最初は放射線併用のRTから始めます。スライド上部の左側の枠から右に向かって、RTからTCRTと記載していますが、これはCRTに「テロメライシン」を上乗せするというものです。
お金は若干かかってしまいますが、このような治療体系ができたら、そこからさらにケモを抜いて、TRTという体系にしていきます。初期の患者さまからたくさん使っていただき、局所をなくしていくということです。最終的には、チェックポイント阻害剤との併用を可能にしていきます。
この流れでは、初期の売上は大きくはないものの、適応が広がるにつれて、将来的には大きなマーケットをつかむことができる可能性があります。
日本国内では売上高200億円から300億円のマーケットですが、海外で特に多いのは、日本の15倍ほどの患者数がいる中国です。欧米は日本と同等か、少し少ないくらいですが、欧米のマーケット拡大が可能となれば、総売上高500億円から700億円のマーケットが築けるのではないかと考えています。
食道がんの局所療法に関しては、医薬品では競合品がまったくありません。この状況は、我々の「テロメライシン」が非常によいポジションにいることを示しています。
将来的に頭頸部がんや肝臓がん、乳がんまで適応拡大できれば、潜在的な市場ではありますが、「テロメライシン」単独で1,000億円以上の売上が見込める規模のマーケットが築くことができると期待しています。
オンコリス 重症ウイルス感染症挑戦の歴史

経口コロナ治療薬の「OBP-2011」についてです。当社は、2008年頃から重症感染症の研究に取り組んできました。
スライド一番上に「OBP-601」について記載がありますが、2006年にイェール大学から導入し、その後、2010年にBristol-Myers Squibbというアメリカの大手製薬メーカーと、総額2億8,600万ドルでライセンス契約を締結しています。
Bristol-Myers SquibbはBMSと呼んでいますが、BMSは国際臨床試験「Phase 2b」を2011年に開始し、さまざまな試験を行い、結果的に、当時一番売れていた「テノフォビル」という薬の非劣性を証明しました。
非常によい結果が出たのですが、BMSからHIVのプロジェクトをやめるという発表があり、その段階で当社の「OBP-601」のライセンスも解消されてしまいました。これは中外製薬のケースと似ているかもしれませんが、大変アンラッキーだったと考えています。
その後、再ライセンスを模索してきましたが、2020年にTransposon社とのライセンスに対して、新たな適応症として神経難病を提示され、総額3億ドル以上の金額でのライセンス契約に成功しています。
それ以外にも、C型肝炎、B型肝炎の新しいタイプの治療薬の開発を鹿児島大学と模索してきましたが、残念ながらよい成果は出ませんでした。しかし、開発の中で「OBP-2011」のもとになる化合物が見つかり、2019年に新型コロナウイルスに対してチャレンジしたところ、非常に強い活性があるということがわかってきました。
パンデミックへの挑戦
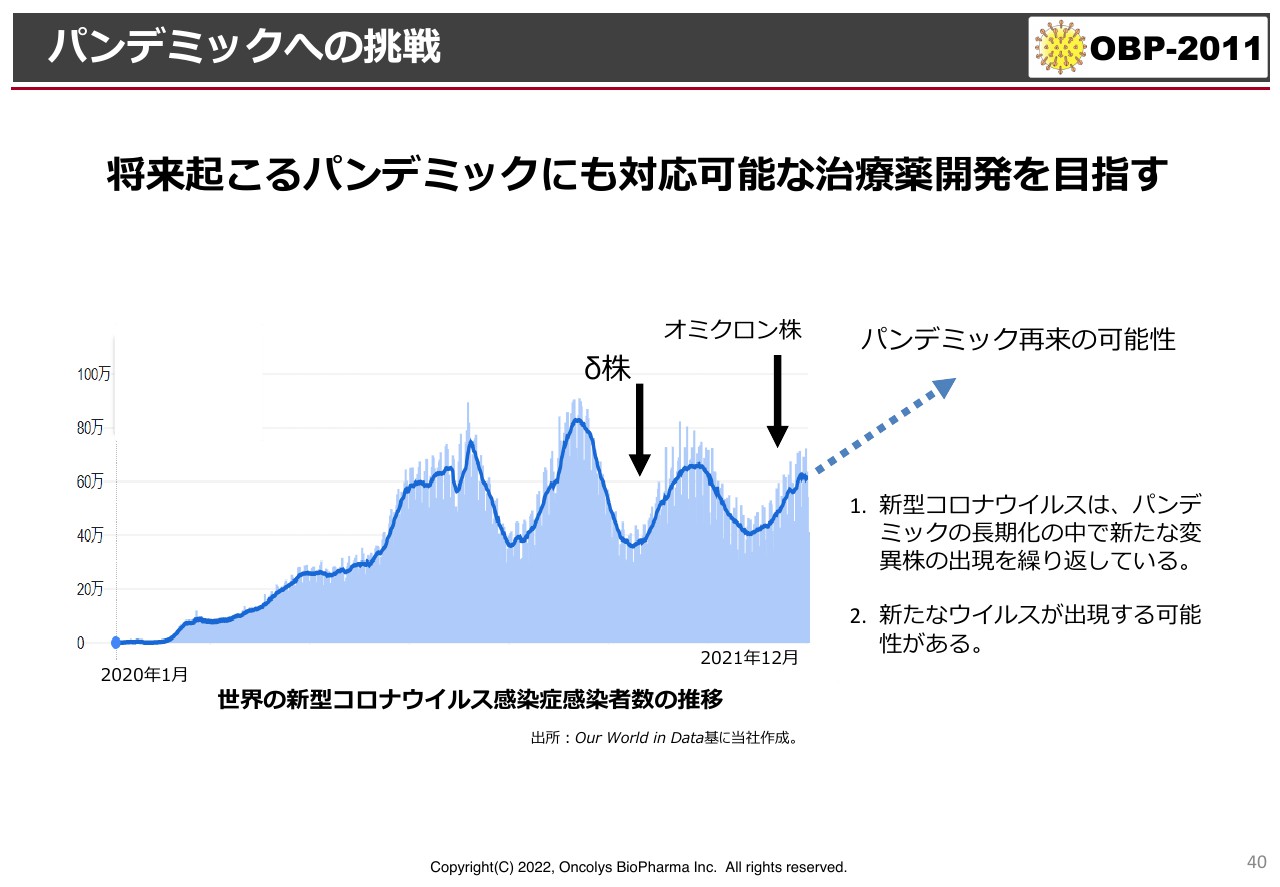
スライドのグラフは、現在起きているパンデミックの状況を示しています。デルタ株からオミクロン株に移行し、徐々に数が増えてきています。少し古いデータですが、今年はみなさまもご存知のように、症状は軽いのですがオミクロン株が非常に広がりました。
日本では感染者数がどんどん減ってきてはいますが、韓国では34万人が感染しています。国によって状況はさまざまですが、オミクロン株は状況が少し落ち着いても、すぐにまた感染が広がってしまいます。
「BA.2」という新しい系統も出てきている中で、現在は3回目、あるいは4回目のワクチン接種が行われています。確かにワクチンは中和抗体を作りますが、世界の研究結果を見ると、モデルナやファイザーのワクチンが作る抗体は、オミクロン株にはかなり活性が低下していることが証明されています。そのような意味で、今後もこのようなパンデミックが継続していくのかが注目されています。
コロナ禍がいったん収束したとしても、おそらく5年から10年以内に、呼吸器症状を起こすような新たなコロナウイルスのパンデミックが起こる可能性が非常に高いと言われています。今回のパンデミックに関しては、我々は塩野義製薬にスピードで負けましたが、次のパンデミックには必ず間に合うように開発を続けていきます。
治療薬開発に向けた共同開発体制
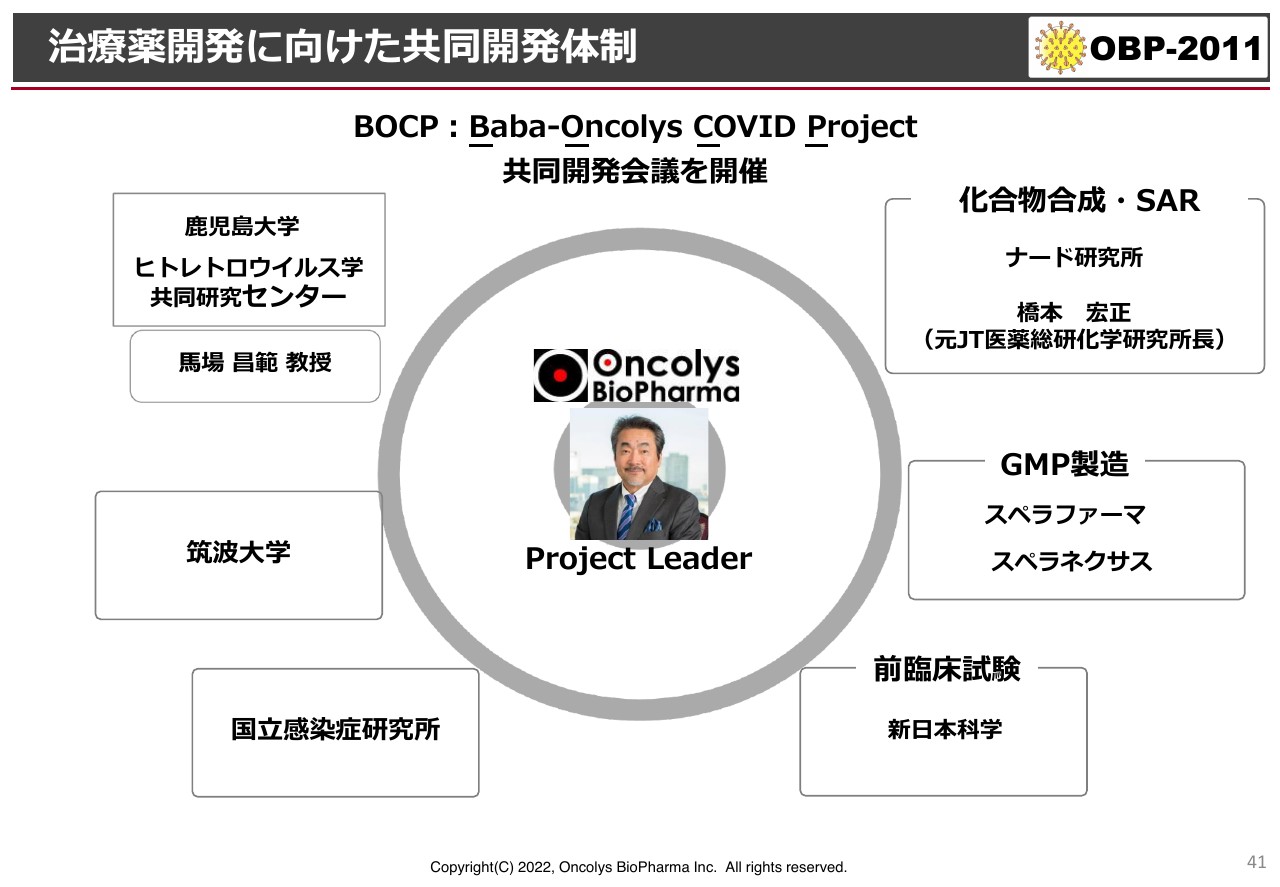
現段階での共同研究体制です。私自らがプロジェクトリーダーとして、鹿児島大学や国立感染症研究所、筑波大学、企業では神戸の小規模製造会社のナード研究所、GMP製造ではスペラファーマ、スペラネクサス、前臨床試験では新日本科学との体制を組んで、定期的な会議を行い、進捗確認および進捗の修正を行っています。
OBP-2011 抗ウイルス活性
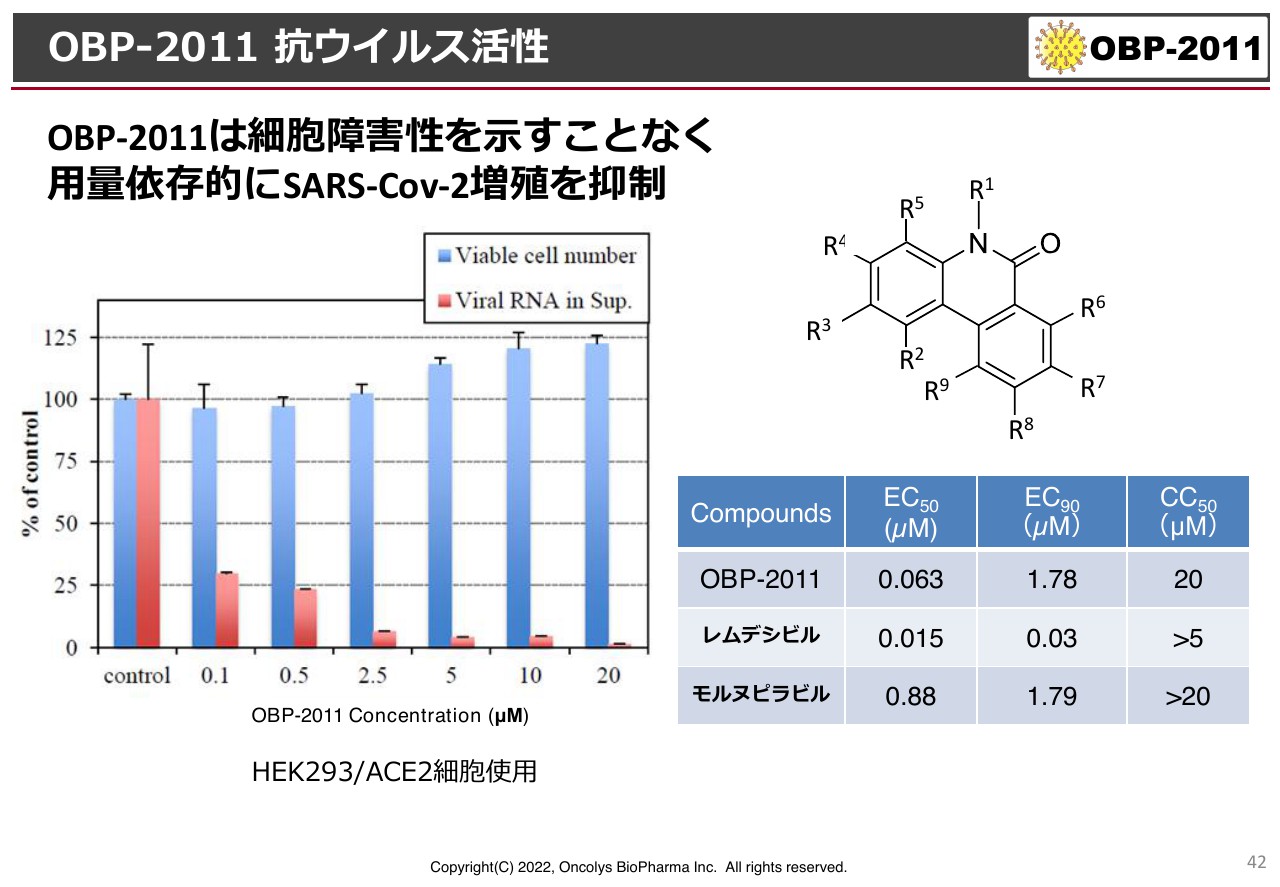
「OBP-2011」のプロファイルについて、特許の関係上、残念ながらまだ具体的に示すことができないのですが、スライドにあるようなフェナンスリジノン骨格というかたちをしています。
「EC50」はウイルス増殖を阻害する濃度が50パーセントというもので、この値が小さければ小さいほど活性が強いということですが、ギリアド・サイエンシズの「レムデシビル」と同じくらいの桁数であり、また、MSDから許可が出ている「モルヌピラビル」よりも活性が強いという結果が出ています。
OBP-2011の抗ウイルス作用
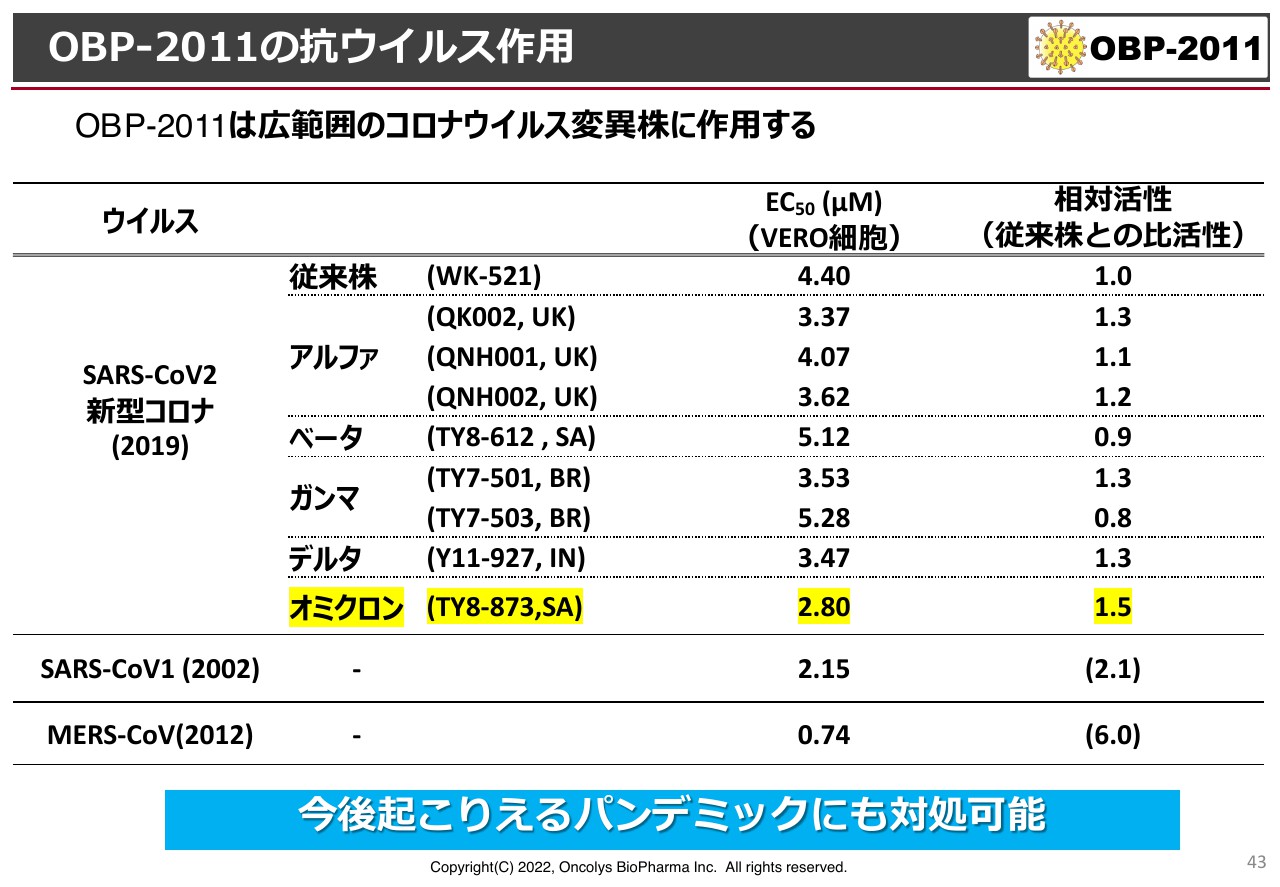
スライドの表はアルファ、ベータ、ガンマ、デルタ、オミクロンなど、さまざまなウイルス株に対する「OBP-2011」の抗ウイルス作用結果です。非活性ですが、従来株の活性を「1」として、それぞれの株に対してどの程度の活性があるかを示しています。数字が大きいほうがよく効くということで、野生株と同等、あるいはそれ以上の効果を示しています。
さらに、SARS、MERSに対しても非常によく効いています。これを受けて、今後また発生すると思われるパンデミックに対しても対処できると期待しています。
ポリメラーゼおよびプロテアーゼ阻害活性
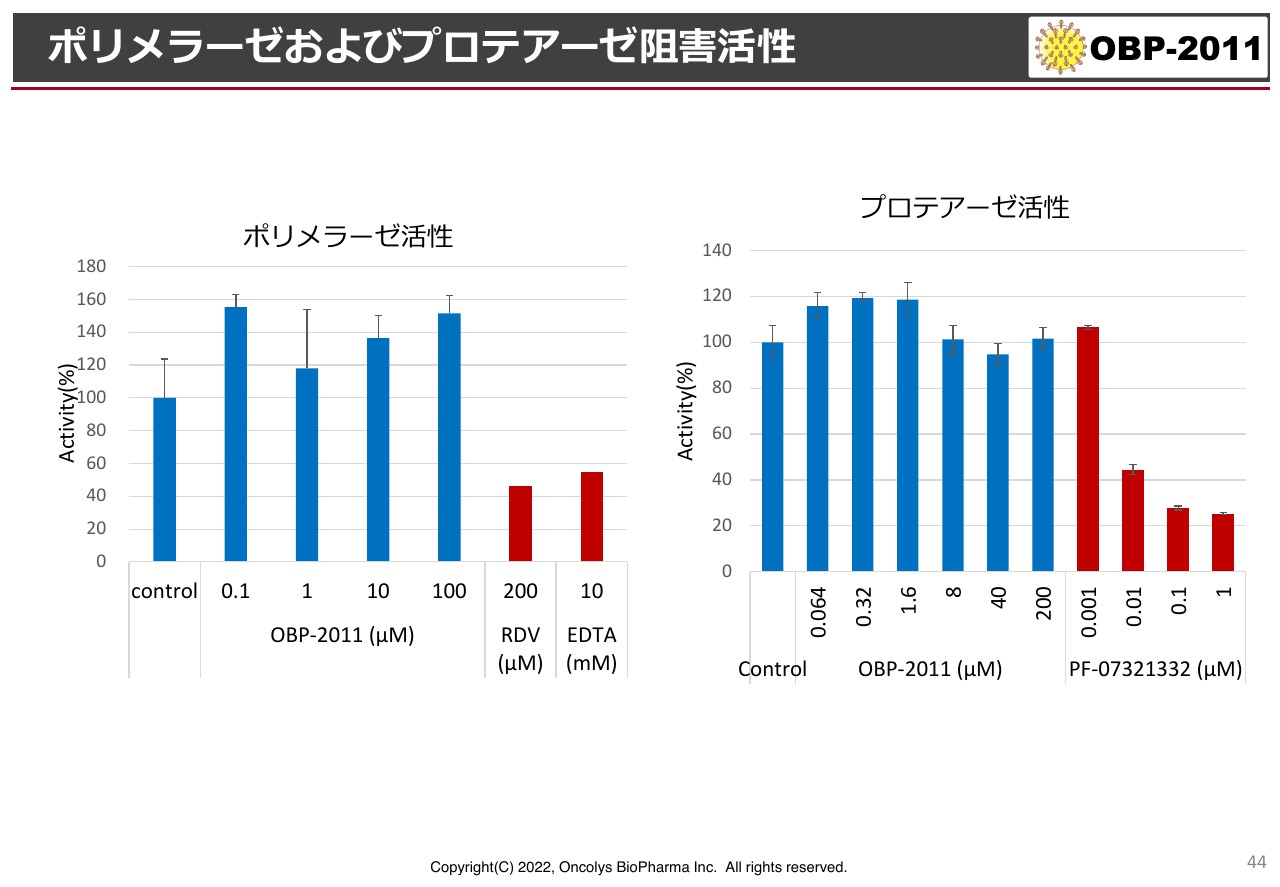
スライド左側に記載していますが、メルクの「モルヌピラビル」はポリメラーゼ阻害剤です。また、塩野義製薬が開発中ですが、右側にあるファイザーの「パキロビッド」はプロテアーゼ阻害剤です。当社の化合物はグラフの青色部分にあたりますが、ほとんど阻害しておらず、少なくとも塩野義製薬、ファイザー、メルクの化合物とは活性が違うことがわかっています。
ヌクレオカプシドタンパク質の機能
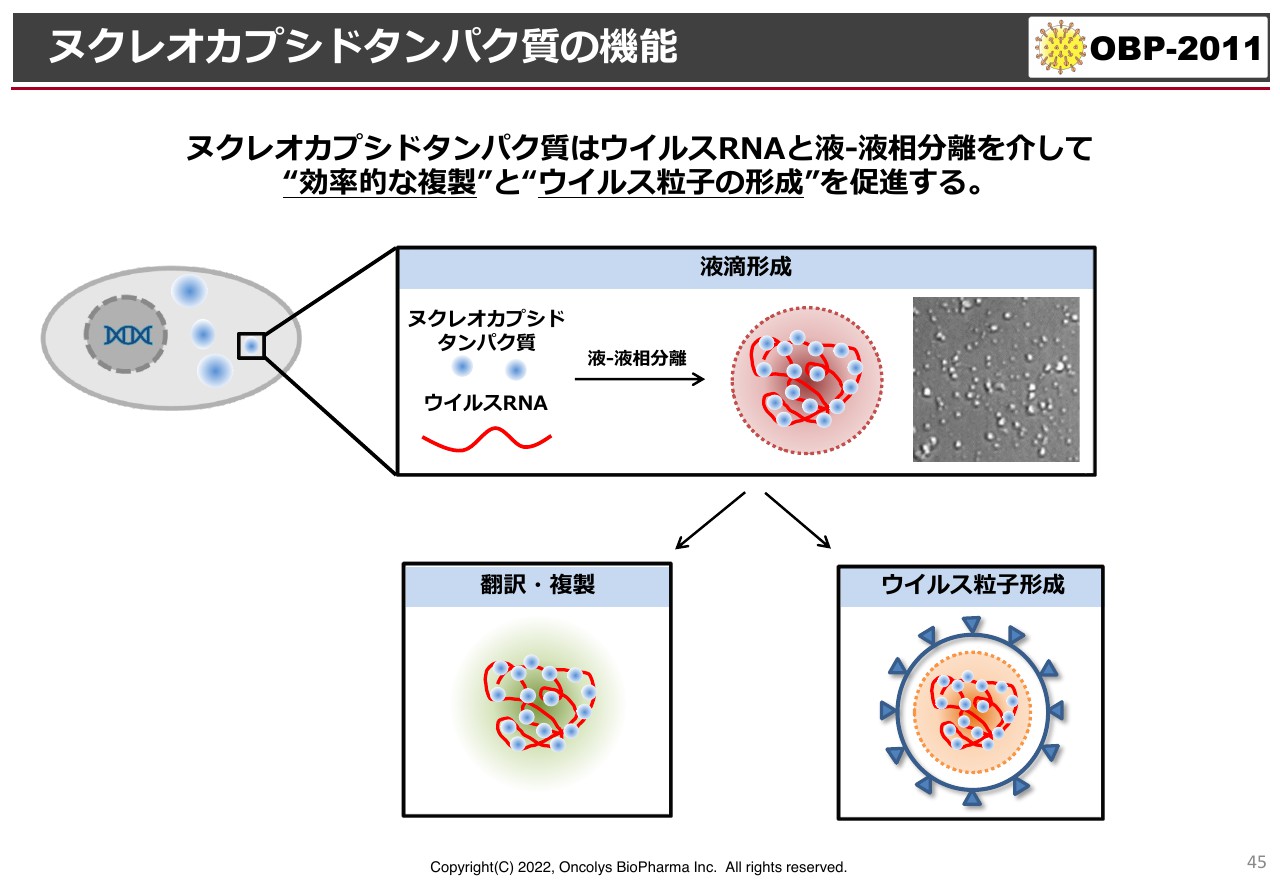
メカニズムが完全にわかったということではありませんが、今年2月に行った機関投資家説明会でお伝えしたメカニズム解明の結果です。スライド下部の図にある赤いグニャグニャしたものは、試験管の中でコロナウイルスがのっているヌクレオカプシドタンパク質というものです。
コロナウイルスがのっているRNAが結合してウイルスの中に閉じ込められているのですが、これを試験管の中で再現すると、ある一定の条件でウイルスのような顆粒が試験管でできるモデルがあります。
OBP-2011 ヌクレオカプシドタンパク質阻害作用
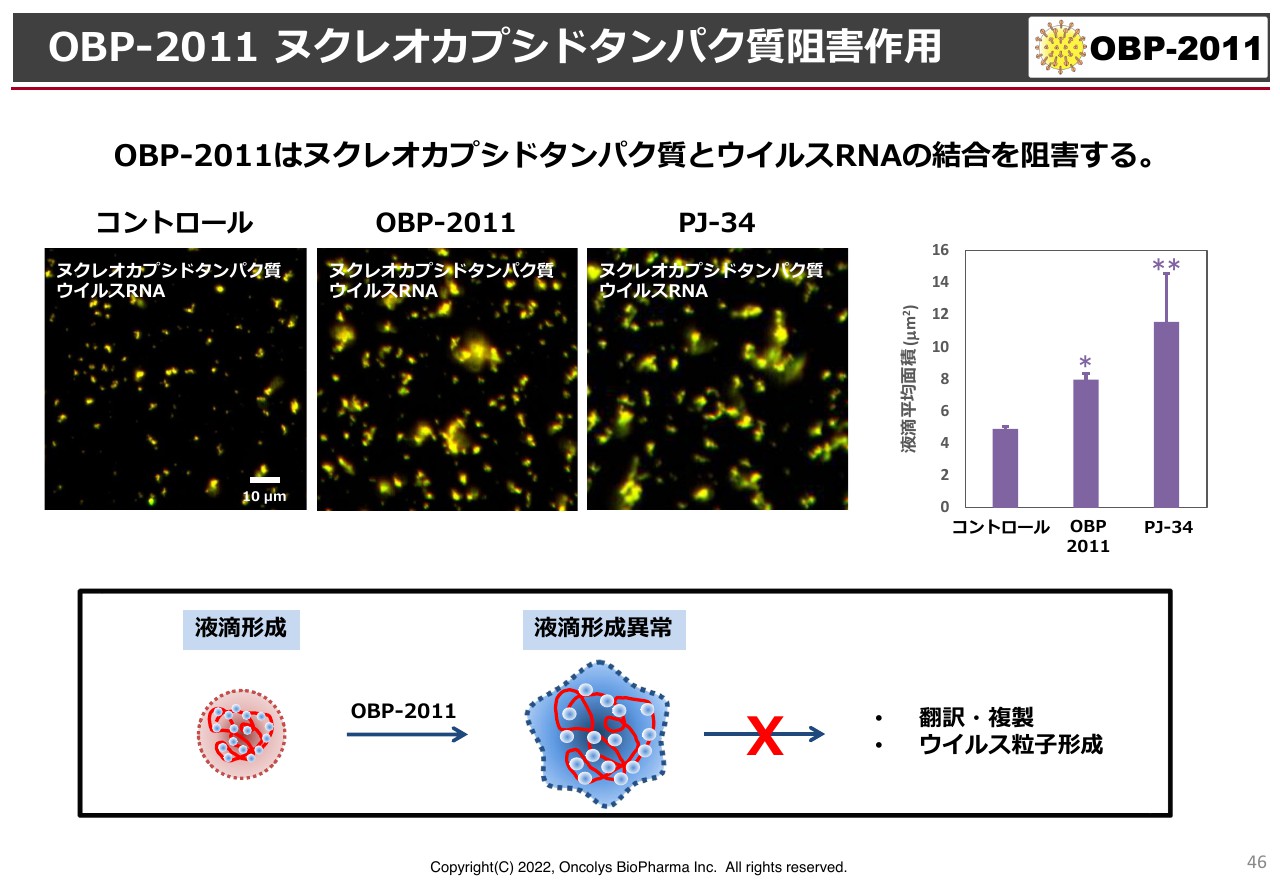
ウイルスRNAとヌクレオカプシドタンパク質の結合がうまくいかずに阻害されていると、きれいな顆粒ができません。この経緯を検討した結果、顆粒がグニャグニャと大きくなっていることがわかりました。
要するに、ウイルス粒子ができず、モヤモヤとしている中央の2枚の画像のように、ヌクレオカプシドタンパク質とコロナウイルスのRNAとの結合を抑えているのだろうということです。ただし、国立感染症研究所の先生は、「これだけでメカニズムがクリアになったわけではない」とのことです。そのため、感染症研究所では、ヒトの細胞を使ってさらに詳しい実験を行ってもらうことになっています。
OBP-2011ヌクレオカプシドタンパク質阻害剤
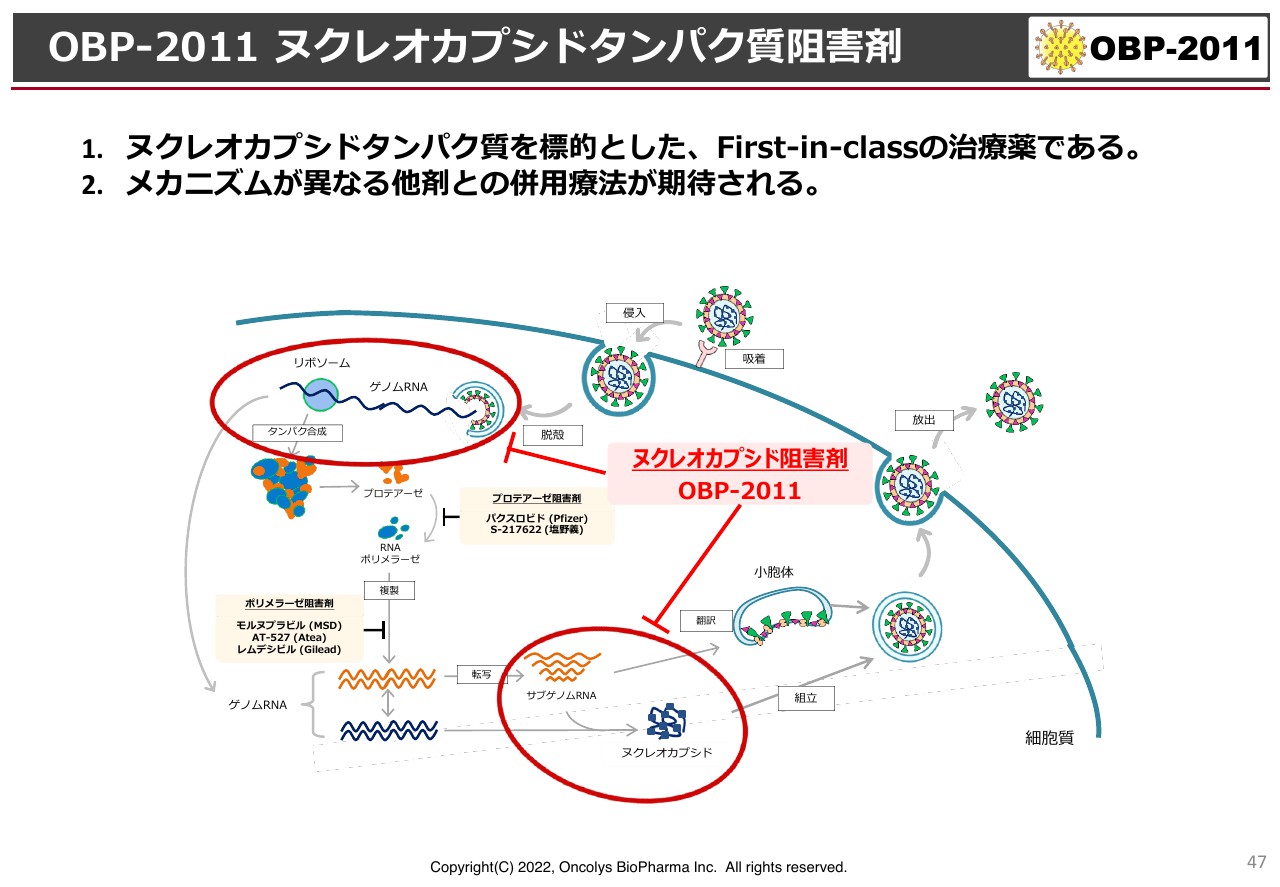
少なくとも現段階で言えるのは、新型コロナウイルスが細胞に入ってくると、脱殻し、ヌクレオカプシドタンパク質とRNAが飛び出してきます。そして、DNAをRNAに変えて再度組込み、新しいウイルスを作ります。
このような動きが細胞の中で繰り返される中、ヌクレオカプシドタンパク質がむき出しになるようなウイルスが入ってきた直後、あるいはウイルスが出ていく少し前の段階で、「OBP-2011」が作用しているだろうと推察されるようになりました。
国立感染症研究所のデータとあわせて、最終的にはメカニズムとしてきちんと公表していきたいと思っています。その段階で、ライセンスも一歩進むのではないかと考えています。
開発計画
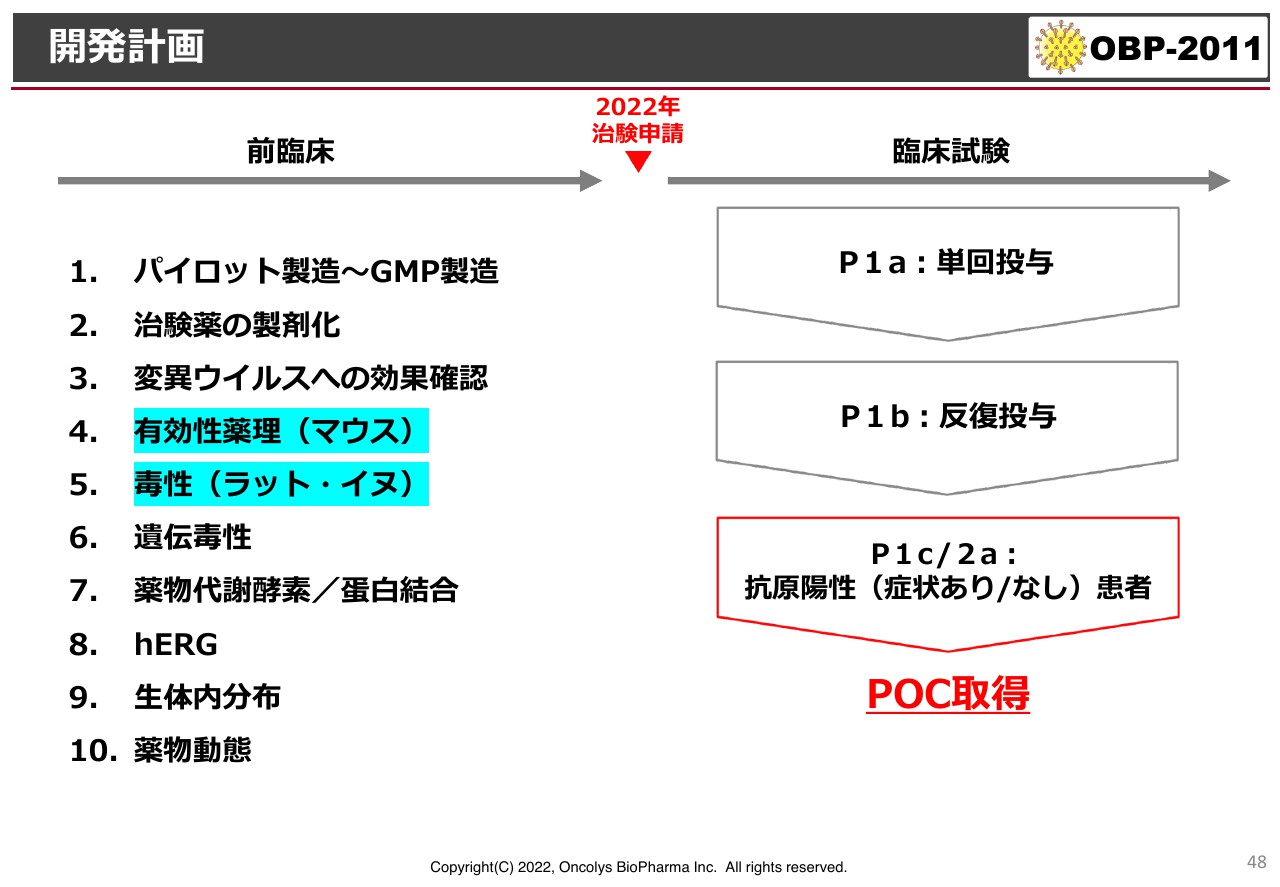
開発について、現段階では一部の前臨床試験を残して、9割は完了しています。残りはマウスなどを使った有効性実験でメカニズムを明確にできれば、年内に治験申請を行い、臨床試験の「Phase1」「Phase2」に進めるのではないかと考えています。ただし、早期にライセンスを行い、ライセンス先の会社に臨床試験を実施してもらうほうがよいと考えています。
経口コロナ治療薬の概況
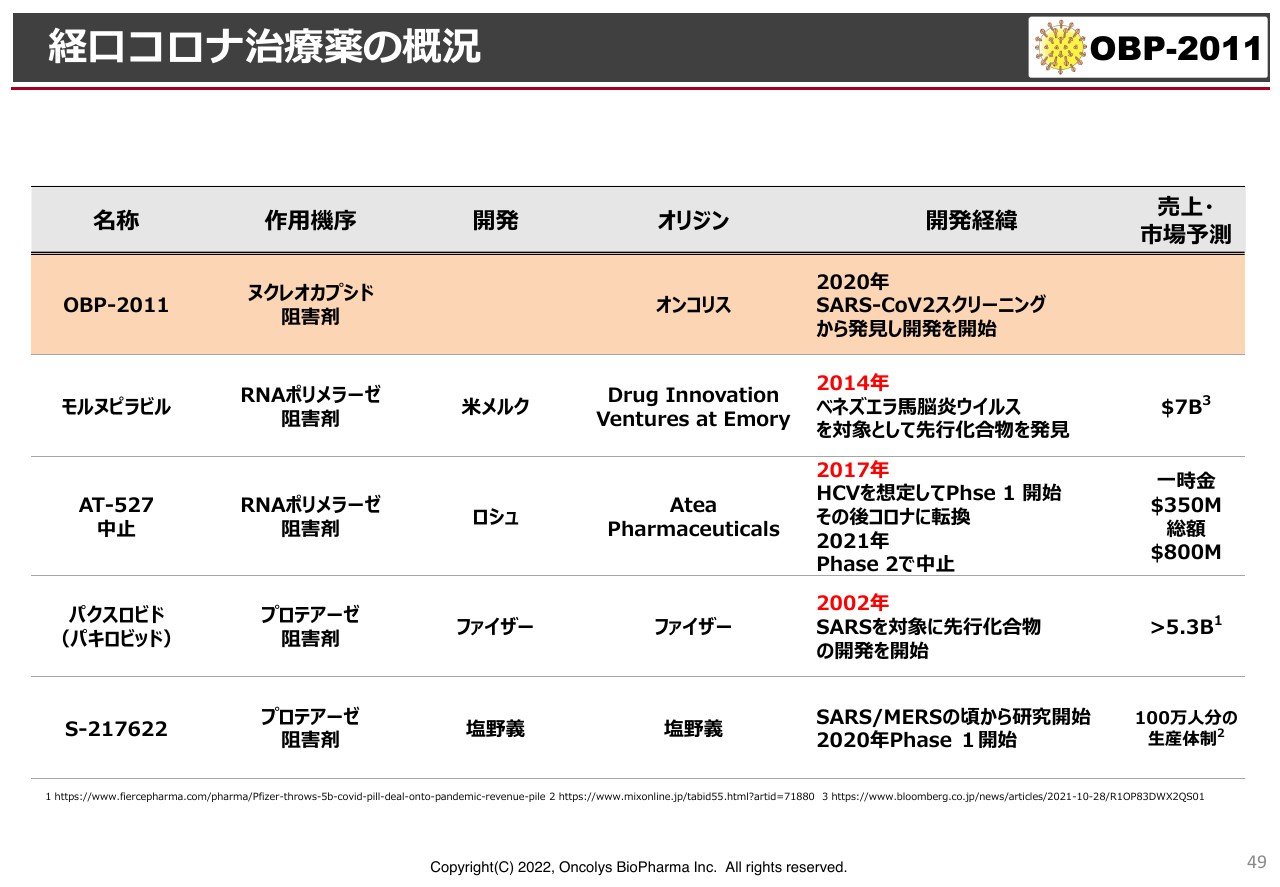
スライドには、世界での新型コロナウイルス治療薬の状況を記載しています。一番上が当社の「OBP-2011」です。続いて、メルクの「モルヌピラビル」で、ロシュの「AT-527」は中外製薬が開発すると言っていた化合物です。さらに、ファイザーの「パキロビッド」、塩野義製薬の「S-217622」があります。
例えば「モルヌピラビル」は、2014年頃にアメリカのエモリー大学の研究で他のウイルスの治療薬として開発されたものです。これが新型コロナウイルスにも使えることが判明し、最初に臨床試験をしたのがメルクの化合物です。
また、「AT-527」はポリメラーゼ阻害剤で「モルヌピラビル」と同じメカニズムです。これはAtea Pharmaceuticals社というアメリカのベンチャーがC型肝炎の治療薬として開発したもので、ロシュにライセンスしています。
その際の一時金が350ミリオンで、現在では400億円くらいです。総額では約800ミリオン、つまり900億円くらいのライセンスがロシュに出されました。残念ながら、「Phase2」の臨床試験であまりよい結果が出なかったため、開発中止となり、中外製薬も中止すると発表しています。
ファイザーの「パキロビッド」は、2002年にSARSが起こった段階ですでに研究開発を始めており、今回の新型コロナウイルスのパンデミックにおいていち早く臨床試験を行い、世に出したものです。
塩野義製薬も同様に、北海道大学とのSARS・MERSの研究をもとに、臨床試験が終わった段階です。次のパンデミックが起こることがわかっていれば、Atea Pharmaceuticals社の事例のように非常に大きなライセンスになる可能性があると考えています。
OBP-2011のライセンスに向けて

このような感染症治療薬を開発できる会社は、メルク、ファイザー、グラクソ・スミスクライン、ギリアド・サイエンシズ、ジョンソンエンドジョンソンなどの大手製薬会社しかありません。そのような会社に今集中的に面談を申し入れ、「なんとかライセンスとして一緒にやらないか?」という話をしています。
しかし、「『プロテアーゼ』『ポリメラーゼ』は要らないけど、新しいメカニズムなら話を聞いてあげましょう」と言われることもあり、そのような意味では、我々は大変よいポジションにいます。
メカニズムについては若干浅いところがありますが、このあたりを片付ければ、ライセンスが可能になるのではないかと考えています。なるべく早い時期にみなさまにご報告できるよう努力します。
レトロトランスポゾンとは
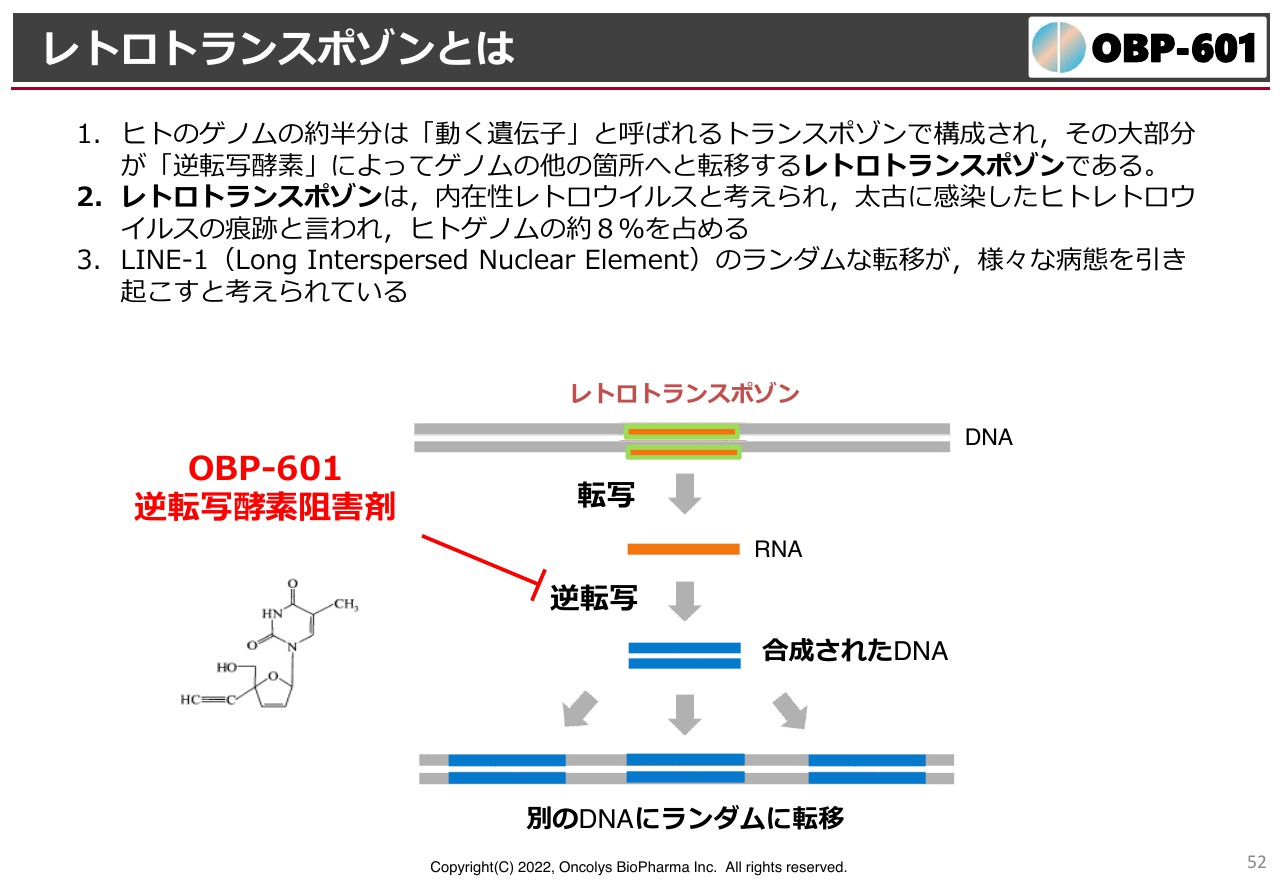
「OBP-601」は、神経難病への可能性を追求しています。アメリカのTransposon社にライセンスしています。
先ほどから難しい話ばかりで申し訳ないのですが、レトロトランスポゾンはDNAの二重らせん上にあり、我々の体の中に点在しています。人間のゲノムのうち、半分くらいは動く遺伝子、すなわちトランスポゾンだと解析されています。
トランスポゾンがどこかに集中的に入ってしまうと病気になってしまうため、トランスポゾンが他のDNAに移る時には、逆転写構造という誰しも持っている酵素を利用しています。そのため、体内のあちらこちらにトランスポゾンが入っているということです。
我々の祖先が海から地上に上がってきた頃に、ウイルスにどんどん感染し、その感染の痕跡がトランスポゾンというかたちで我々のゲノムの中に残っています。これをできるだけランダムに転移しないようにするのが「OBP-601」の新しい考え方です。
開発の着眼点
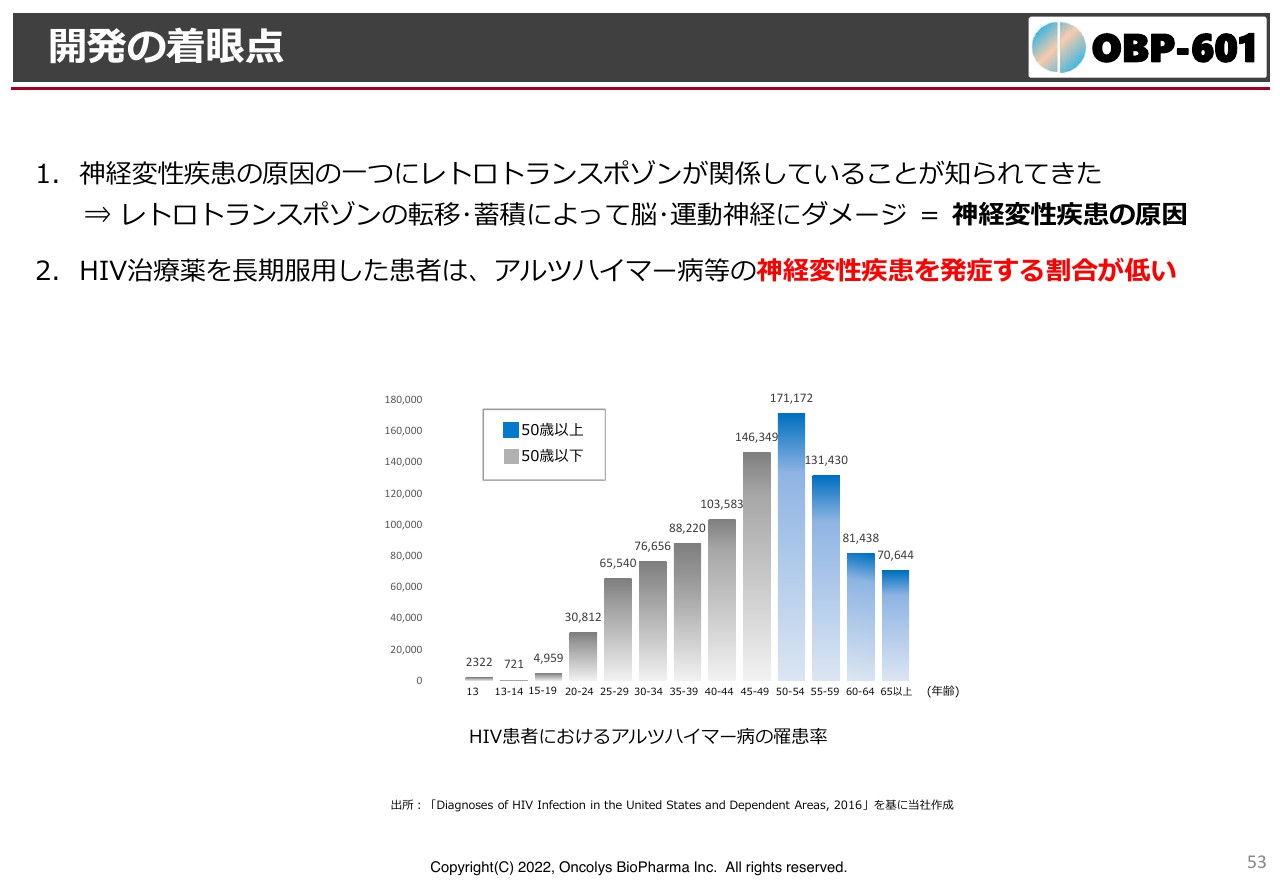
開発の着眼点として、スライドのグラフにHIV患者におけるアルツハイマー病の罹患率を示しています。HIVはDNAの中に入ってしまうため、一生薬を飲むことになります。薬を飲まないとHIVが悪化し、免疫が下がり、寿命が短くなるためです。HIV患者だと診断されるようになったのは1978年で、薬ができたのが1980年頃ですので、長い方では30年近く抗エイズ薬を飲んでいます。
グラフを見ると、HIV患者は高齢になるにつれアルツハイマー病の罹患率が少なくなっています。普通のポピュレーションでは、加齢に伴って認知症になっていく可能性は高くなりますが、HIV患者で減っているのは逆転写酵素阻害剤を飲んでいるためだとわかりました。
OBP-601の特徴
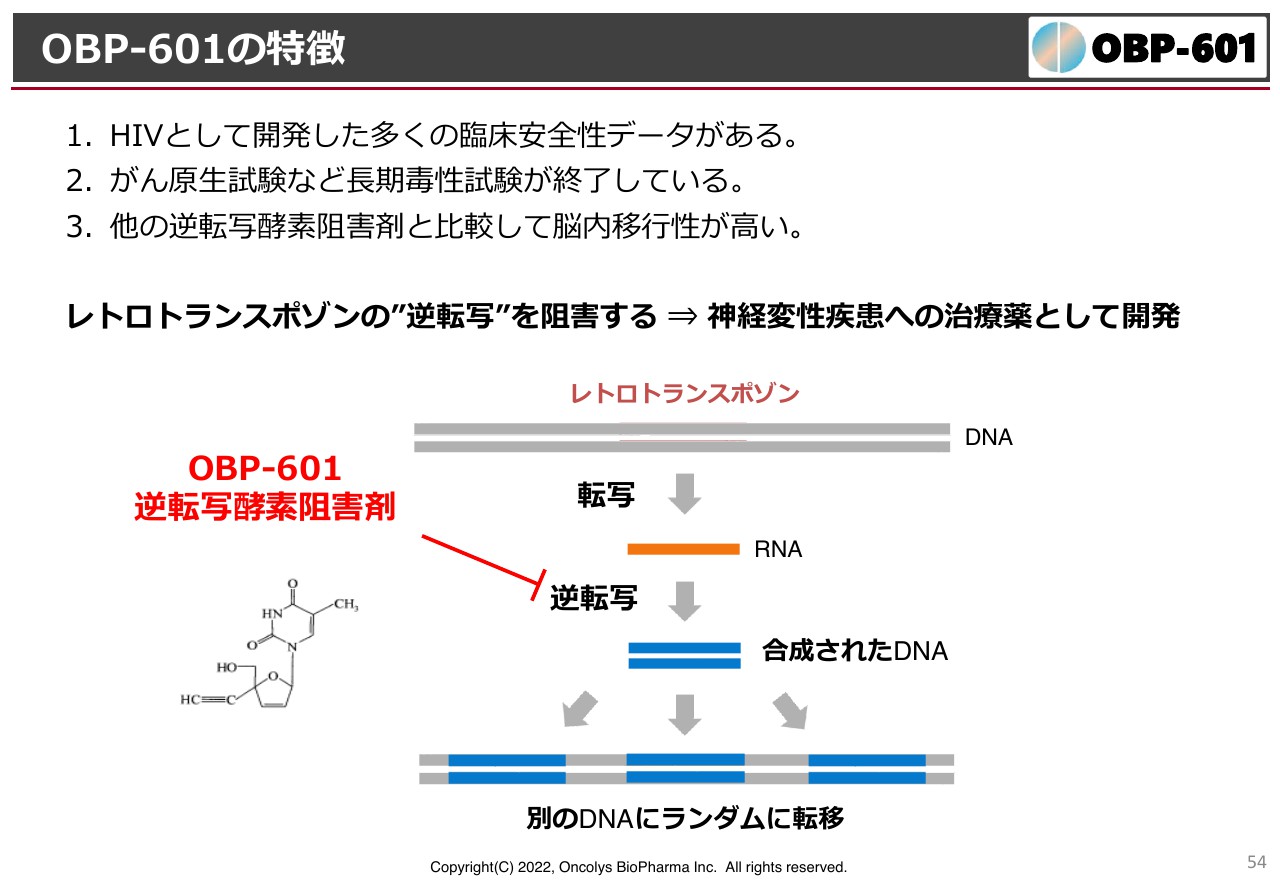
このような研究の発端により、アメリカ・ニューヨークにあるブラウン大学のさまざまな結果をもとに、レトロトランスポゾンのランダムな逆転写を「OBP-601」が非常に強く抑制していることがわかりました。なおかつ、「OBP-601」は脳神経の中によく入ってくるということもわかっています。
そのため、他社の治療よりも優れていることがわかり、Transposon社ができたきっかけになりました。そして、我々はそこにライセンスし、今は神経難病だけを対象にしていますが、将来的にアルツハイマー病も対象にできるのではないかと期待しています。
ライセンスと開発状況

Transposon社へのライセンスは神経性疾患を対象として、全世界で3億ドル以上、そして、非公開ではありますがロイヤリティをいただくことになっています。また、製造開発などのコストはすべてTransposon社が負担することになっています。
現在、スライド下部に記載した2つの二重盲検比較試験をアメリカおよびヨーロッパで実施しています。コロナ禍で若干遅れましたが、PSP、ALS、FTDの試験の組込れは順調に進んでいると聞いています。
OBP-601 対象疾患

いろいろ難しい話をしてきましたが、少なくともPSP、FTDには根本的な治療薬がなく、震えや失語、認知障害などの症状を抑えることしかできません。ALSは筋肉が動かなくなることで、「リルゾール」「ラジカヴァ」といった抗酸化剤の投与も許可されますが、ほとんど効きません。症状を抑えるためのドーパミン薬や抗うつ薬しかありません。
神経難病にはアンチセンスなどの遺伝子治療もチャレンジされていますが、まだまだ時間がかかりそうです。しかし、我々は飲み薬で簡単に治療できる可能性があると考えています。そして、ここが非常に大きなアドバンテージになると思います。
OBP-601 市場性
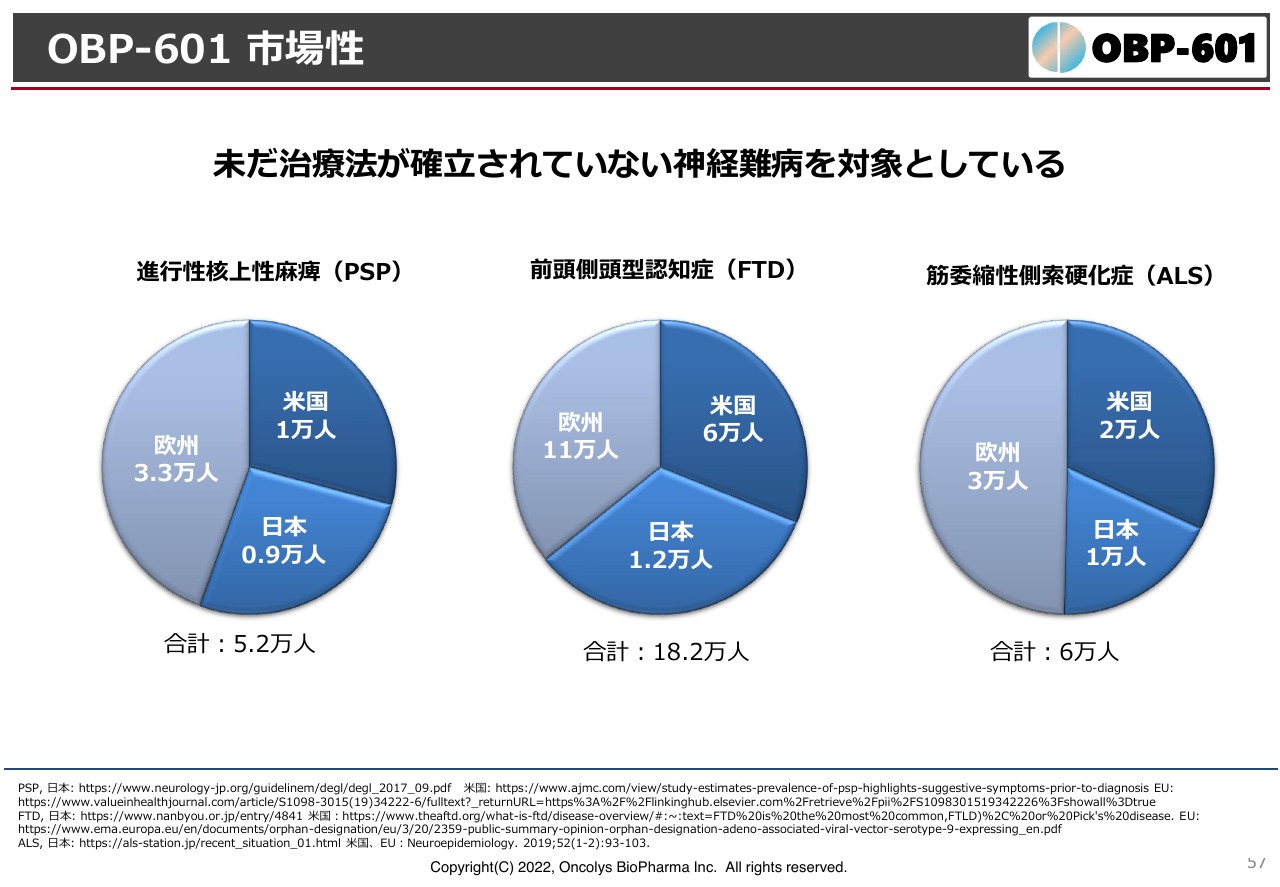
日本にはそれぞれの疾患の患者数は約1万人ずついます。FTDは18万人と多いのですが、ALSは世界でも6万人と非常に少ないです。根本的な治療薬ができれば高薬価も期待できますし、Transposon社が大手製薬メーカーにライセンスできる可能性が非常に高いと思っています。
2023年末から2024年にかけて、先ほどお伝えした二重盲検比較試験の結果が出てきます。よい結果が出れば、大きなライセンスにつながるのではないかと考えています。以上が主力の開発プロジェクトです。
2022~2023年の見通し

スライドには当面の見通しをまとめています。「テロメライシン」は2024年の承認申請を目指しており、組入れは年内に行われます。
GMP製造は、来年末くらいには品質管理法とともに確立し、2024年には商用製品ができると考えています。2022年、遅くとも2023年には、国内あるいは世界でそれぞれ再ライセンスを実施していきたいと思っています。
コロナウイルス治療薬については、早ければ年内に治験届を申請し、来年には治験に入ります。ライセンス先を早めに見つけるべく活動していきます。
「OBP-601」は、組入れをさらに進めてもらうようTransposon社を応援するしか現段階でできることはありません。
「OBP-702」は第2世代のウイルスですが、「Phase1」に進む前臨床ができるように、政府の助成金でできる限り治験を進めていこうと考えています。
「テロメスキャン」は、CYBOとのAIを用いたプラットフォームを確立し、来年半ばにはみなさまにご報告できるようにしたいと思っています。
主力事業領域の市場規模と競合環境②

最後に、当社の成長戦略についてお話しします。スライドに記載のとおり、3つが主力商品です。
オンコリスの成長戦略①

「テロメライシン」について、実行するかどうかは別ですが、自力で承認申請を行い、自販体制を確立し、食道がん放射線併用患者の60パーセント以上のシェアを取り、かつ治療・オペを拒否する患者にも投与されることを前提としています。
「OBP-2011」は、早期にメカニズムが解明され、動物実験の結果もクリアに出て、メガファーマにライセンスできることを前提としています。
そして、新たなウイルスのパンデミックが再び発生することを想定し、緊急承認を目指しています。これらが「OBP-2011」成長の大前提です。
「OBP-601」も臨床結果が出ると、来年からの5年間で国内販売を自社で行った場合の売上高は50億円くらいになります。ちなみに、5年と言っても、実際に許可されるのは2024年から2025年になりますので、厳密には5年間ではありません。加えて、うまくいけば10億円のライセンスフィー、あるいは欧米でのライセンスフィーが上乗せされる可能性もあると考えています。
オンコリスの成長戦略②
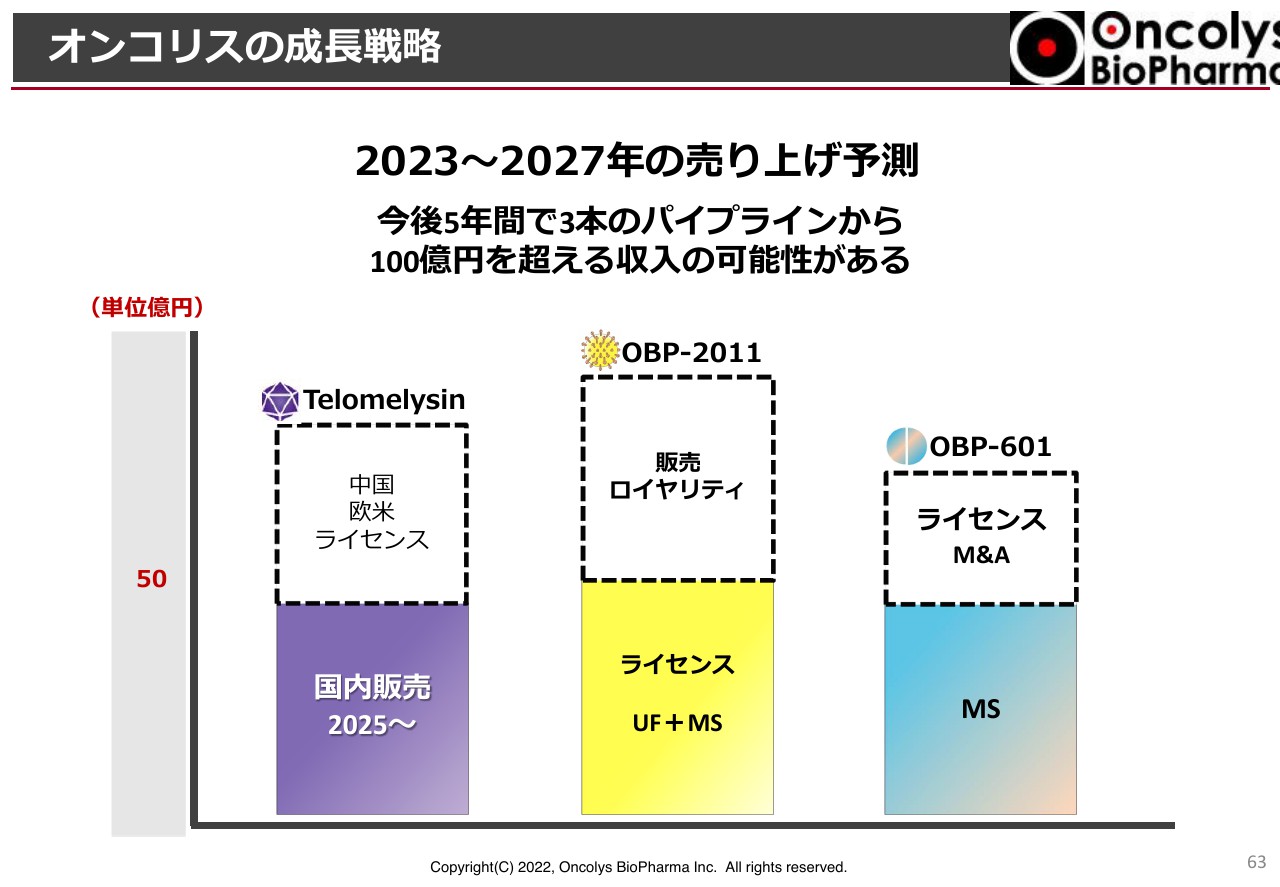
「OBP-2011」もアップフロントと考えると、マイルストーンも含めて50億円以上の売上高になります。もう少し狙いたいとは思っていますが、緊急承認になった場合には販売ロイヤリティも取れるのではないかと考えています。
「OBP-601」については、マイルストーン収入を控えていますし、ライセンスあるいはTransposon社自体がM&Aを受けた後でも当社はロイヤリティを受け取ることができます。当然、Transposon社から成功報酬を受け取る仕組みになっていますので、大きな収入になります。
これら3本のパイプラインについては、2023年からの5年間で100億円以上の収入を得る潜在的価値があると考えています。できるだけこのとおりに達成できるよう、努力していきたいと考えています。
オンコリスの創薬技術②
当社は「ウイルス創薬」という他にない開発・創薬技術を持つ会社として羽ばたき、株価を上げることによってみなさまにも貢献していきたいと考えています。
オンコリスのポリシー②
今後も、ポリシーを変えることなく経営を進めていきたいと思っています。ご清聴ありがとうございました。最後に、新しい執行役員からご挨拶をさせていただきます。
秦耕平氏:執行役員の秦耕平でございます。本日は株主総会ならびに事業説明会にたくさんの方にご参加いただきまして、誠にありがとうございました。
2013年の株式上場時は5,000名強でしたが、昨年末時点で1万6,500名ほどの方に株主になっていただいています。みなさまからのご期待に応えられるよう努めてまいりますので、引き続きよろしくお願いいたします。
磯山修一氏:事業開発部を担当している磯山でございます。私は大学を卒業してからすぐ、バイエル薬品というドイツの製薬会社の日本法人に就職して、そこで25年ほど働いていました。
2015年12月にオンコリスバイオファーマに入社し、今までに、中外製薬との「テロメライシン」のライセンス契約、Transposon社のグローバルディールを締結してきました。
浦田からの説明にあったように、「テロメライシン」の再ライセンスや、新しい作用機序を持ち、可能性を秘めた低分子の「OBP-2011」を1日でも早くライセンスできるように日々準備しています。今後ともご支援のほど、よろしくお願いいたします。
田口めぐみ氏:この度、人事担当執行役員を拝命した田口でございます。私は、現在の市場区分で東証一部・JASDAQ・マザーズの上場企業で、業種では商社・繊維・小売・エネルギー・半導体で、それぞれ採用・育成・制度設計・風土改革・ダイバーシティ・経営理念の浸透活動に従事してきました。そして、それぞれの事業内容と企業フェーズに合った人材の活躍、そして強い企業の仕組みづくりに取り組んできました。
病気で困っているみなさまにいち早くパイプラインを届けるという理念に共感し、当社にジョインしました。当社にはポテンシャルも含め、優秀な人材が多くいます。「企業は人」と言いますが、会社にとって大切な財産である人材が最大限に活躍できる場と強い組織づくりに貢献していきたいと考えています。
株主総会において、みなさまから人事に関してすごく期待を持っていただいていると知り、身が引き締まる思いではありますが、強いエネルギーになっています。今後とも、引き続きご支援をよろしくお願いいたします。
質疑応答:「OBP-2011」の見通しについて
質問者:「OBP-2011」は現在、前臨床で安全性を探索する段階にあるとうかがいましたが、経口剤として製剤化できるか、また、他社の先行の薬剤に比べてアドバンテージがあるのか、見通しを教えてください。
浦田:まずアドバンテージについては、他社の化合物と同じ流れで、例えば、ネズミを使う実験などではそれほど自由にできない状況にあり、理論的にしか話せないと思います。
そのため、差別化をするというよりは、併用によってより効果を高める方法がよいのではないかと考えています。ご指摘のように「ここが違う」「こういうふうに効き方が違う」というところまで、できる限り持っていきたいと思いますが、これは大手製薬会社メーカーと組んだ上で行っていきたいと思います。
前臨床試験・毒性試験も行っているのですが、「OBP-2011」も物性の問題で非常に溶けにくく、おそらく「パキロビッド」「モルヌピラビル」も同じように溶けにくい化合物です。
このように毒性試験も進行する上でいろいろな障害は出てくるのですが、少なくとも現段階で開発を進めることが困難になるような副作用はまったく出ていません。安全性においてはそれほど大きな問題はないと考えています。
一方で、製剤化についてはスペラファーマ、スペラネクサスと検討していますが、錠剤を作るのはなかなか困難なため、当面はカプセルに詰めて投薬するということで、治験の段階は手詰めになると思います。
「パキロビッド」「モルヌピラビル」も同じようにカプセルですので、特徴付けまではまだたどり着いていない状況です。問題は、臨床でどのくらいのカプセルを投与するのがよいかということで、このあたりは今後の検討に委ねられてくると思います。
質疑応答:「OBP-2011」上市までの見通しについて
質問者:「Phase1」の開始は2023年とのことですが、緊急承認という話もあり、どの程度のスピード感で上市できるのか、見通しを聞かせてください。
浦田:ファイザーやメルクはかなり昔から研究しており、パンデミックが起こってからはかなりのスピードで臨床試験を行いました。我々もそのようにしたいのですが、そこまでの勢いは出せないため、とにかく何かが起こった時はすぐに対応できるようにしています。
治験届を出し、健康な方にその薬を何ミリグラム投与すると血中濃度がどの程度上がるか、また安全性について、1週間くらいの投与で副作用が出ないかなどを見る試験を2023年に行います。
このように、いつでも患者に投与できる状況を作るのが、我々にできる最大限の努力だと思っています。その間になんとかライセンス先を見つけ、特徴付け、あるいは臨床試験について考えていきます。
質疑応答:「テロメライシン」のデータについて

質問者:「テロメライシン」グラフについて、ダブルスコアであるというご説明がありましたが、そのデータは有意差検定されたものでしょうか?
浦田:先ほどダブルスコアとお伝えしたデータですが、これは有意差検定をしていません。
放射線単独のデータは、日本食道学会が過去の症例を集めて論文を書いたもので、その時の数字が27パーセントということです。そして55パーセントというのが、岡山大学と当社が行った「Phase1」の臨床試験を合わせた数字です。したがって、同時比較試験によるものではありません。
質疑応答:ほかのがん療法との併用について
質問者:がんの分野ではステラケミファの子会社のステラファーマがBNCT(ホウ素中性子捕捉療法)を開発しています。開発の難所は中性子を照射する機械の大きさで、原子力発電所レベルの大きさから小型化への開発を推進しており、遠くない未来には実現すると言われています。
ホウ素の必要なものだけを高純度に固めるという技術をステラケミファだけが持っており、一般的な細胞は取り込まず、がん細胞のみを破砕するという方法は御社と似通っており、競合となると非常に脅威かと思います。
また、放射線療法では数十回かかるものを1回で治療できる画期的な技術だと言われています。
ホウ素中性子捕捉療法にも、患部の深いがんになかなか効かないという盲点がありますが、今後、そのような類似のがん療法と「テロメライシン」を併用する可能性もあると思うのですが、いかがでしょうか?
浦田:ボロン(ホウ素)を注射してがん細胞を取り込ませ、レーザーを当てる治療法は脳腫瘍で開発が行われていますが、頭部頸がんなどの局所を狙うということでは、我々が取り組んでいる事業と大変近いところがあると認識しています。
私は、ボロンを扱っている先生方に会ったことがあるのですが、昨今の臨床データではボロンを使用したほとんどの例でがんが再発してしまったそうです。ボロンも我々の「テロメライシン」と同じくいろいろな問題を抱えています。当面は競争になると思うのですが、併用は考えていなかったため、そのようなことも視野に入れて考えていきたいと思います。
それ以外にも中性子や重粒子線など、局所のがんの治療法が開発されています。私も重粒子線の施設をいくつか見に行ったのですが、ビルの中で加速器を使って行われます。
一番の問題は、動く臓器を標的にできないことです。食道がんは下部で動いており照射しにくく、近くには心臓と肺があるため理論的には可能ですが、なかなか難しいという話も聞いたことがあります。
しかしながら、これらを理由に無視するのではなく、共存も視野に入れながら開発していきたいと思います。
質疑応答:新規ライセンス契約の見通しについて
質問者:今期の業績見通しで「新規ライセンス契約」とありましたが、株価対策として掲げているのか、ある程度蓋然性の高いものなのか教えてください。
浦田:今期の売上高目標は10億円としています。この中には中外製薬から入ってくる開発協力金がある程度見込まれていますが、それ以外に新規ライセンス契約による売上高も見込んでいます。
ライセンスについては、「テロメライシン」を例に挙げると、中外製薬のように「オプション付きで全世界に」という考え方もありますし、日本国内だけ、あるいは日本と台湾と韓国だけというように切り分けたライセンスにすることも視野に入れています。少なくとも1つの地域でライセンスを決めれば、10億円は達成できるのではないかと考えています。
もちろん10億円どころか、売上高のさらなる拡大を目指していますが、今期はそこまでではなく、「テロメライシン」だけではなく他のパイプライン、あるいは他の新しい共同研究開発での収入も見込みたいと思っています。
努力はしていきますが、蓋然性については、このような回答になるかと思います。
質疑応答:「OBP-2011」の科研費について
質問者:「OBP-2011」について以前、動物実験が終わっていなかったために補助金の選考に落ちたとの話がありましたが、そちらはどのようになっていますか?
浦田:国の補助金について、我々も新型コロナウイルス治療薬の助成金募集には目を配ってきました。最近は興和が「イベルメクチン」という虫下しの臨床試験で20億円の補助金を得ています。
そして、ようやく予算が決定し、4月以降に新型コロナウイルスワクチンと治療薬の科研費を募集する可能性があると聞いているのですが、かなり遅れており、いまだ公示されていません。当然のことながら、我々は公募に参加したいと思いますし、1回目の動物実験の結果では、有意差が出ています。
甘い考えかもしれませんが、前回よりは一歩前進しており、もう一段階上を見て、メカニズムの解明とともにAMEDの補助金に応募したいと考えています。
浦田氏からご挨拶
本日はパイプラインについて詳細をお話ししました。なかなか、みなさまにご納得いただけない状況もあるかと思いますが、できる限り早い段階で中外製薬から契約解消された穴埋めをお知らせできるよう、社員一丸となって努力していきたいと思います。
今後ともご指導、ご叱責、ご鞭撻のほどをよろしくお願い申し上げます。本日は長時間にわたり、事業説明会にご参加いただきまして、誠にありがとうございました。
新着ログ
「医薬品」のログ