【QAあり】PRISM BioLab、PepMetics技術とAI創薬プラットフォームで研究 「あたらしい研究」を邁進
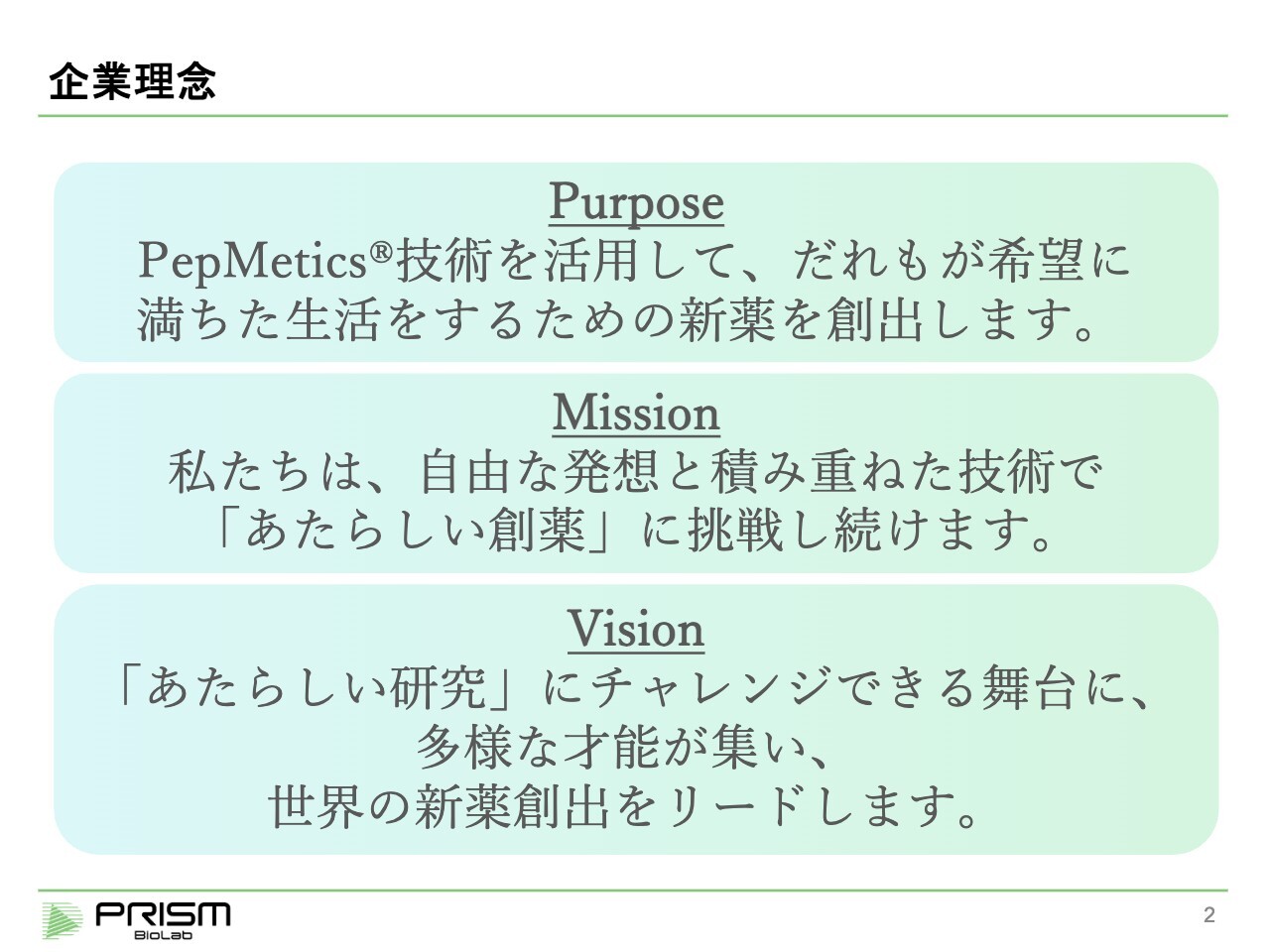
企業理念
竹原大氏(以下、竹原):本日は、株式会社PRISM BioLabの2025年9月期第2四半期決算説明会にご参加いただき、誠にありがとうございます。代表取締役の竹原です。今期の進捗についてご説明します。
当社の企業理念です。当社は創薬企業として薬を創り出すことを社会的な使命としていますが、中でも当社独自の「PepMetics」技術を使い、他ではなかなかできない新薬を創り出すことを目標としています。
「Mission」は、「あたらしい創薬」です。独自技術を使って創薬をしますが、これは技術があればすぐできるものではなく、努力して研究を進めていくことによってやっと薬ができます。自由な発想と技術を積み重ねながら、新しいものを創り出していきます。
「Mission」を実行するために、組織の「Vision」として「『あたらしい研究』にチャレンジできる舞台に、多様な才能が集い、世界の新薬創出をリードします」を掲げています。
世界でトップレベルのサイエンティストたちを集め、彼らがモチベーションを持って進めることで、やっと薬ができます。薬は成功確率が非常に低い事業ですが、できる限り成果が出せるよう、優秀な人材に集まってもらっている状況です。
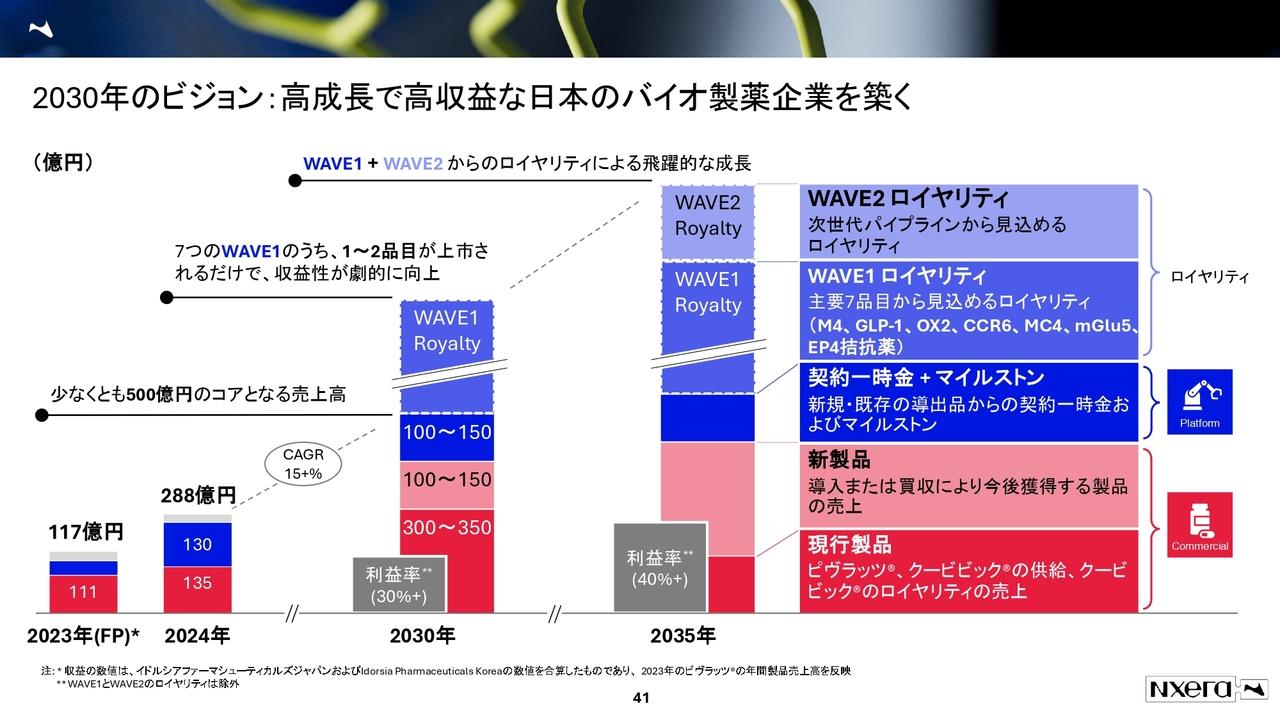
2025年9月期 第2四半期のハイライト

今四半期の業績についてご説明します。トピックとしては、先日リリースしましたが、AI創薬のベンチャー企業であるElix社と業務提携しました。
昨年から、いくつかパイロット的なプロジェクトを複数のAIベンチャーとも実施していますが、中でもElix社との間に大きな可能性が見えてきたため、本格的なプロジェクトをスタートするために業務提携しています。
当社の技術は、基本的には化合物を作ることをベースにしています。それにAI技術を組み合わせることで、飛躍的に新しい薬を作り出せるような技術にしていこうと考え、Elix社と提携しました。
2025年9月期 中間会計期間 損益状況
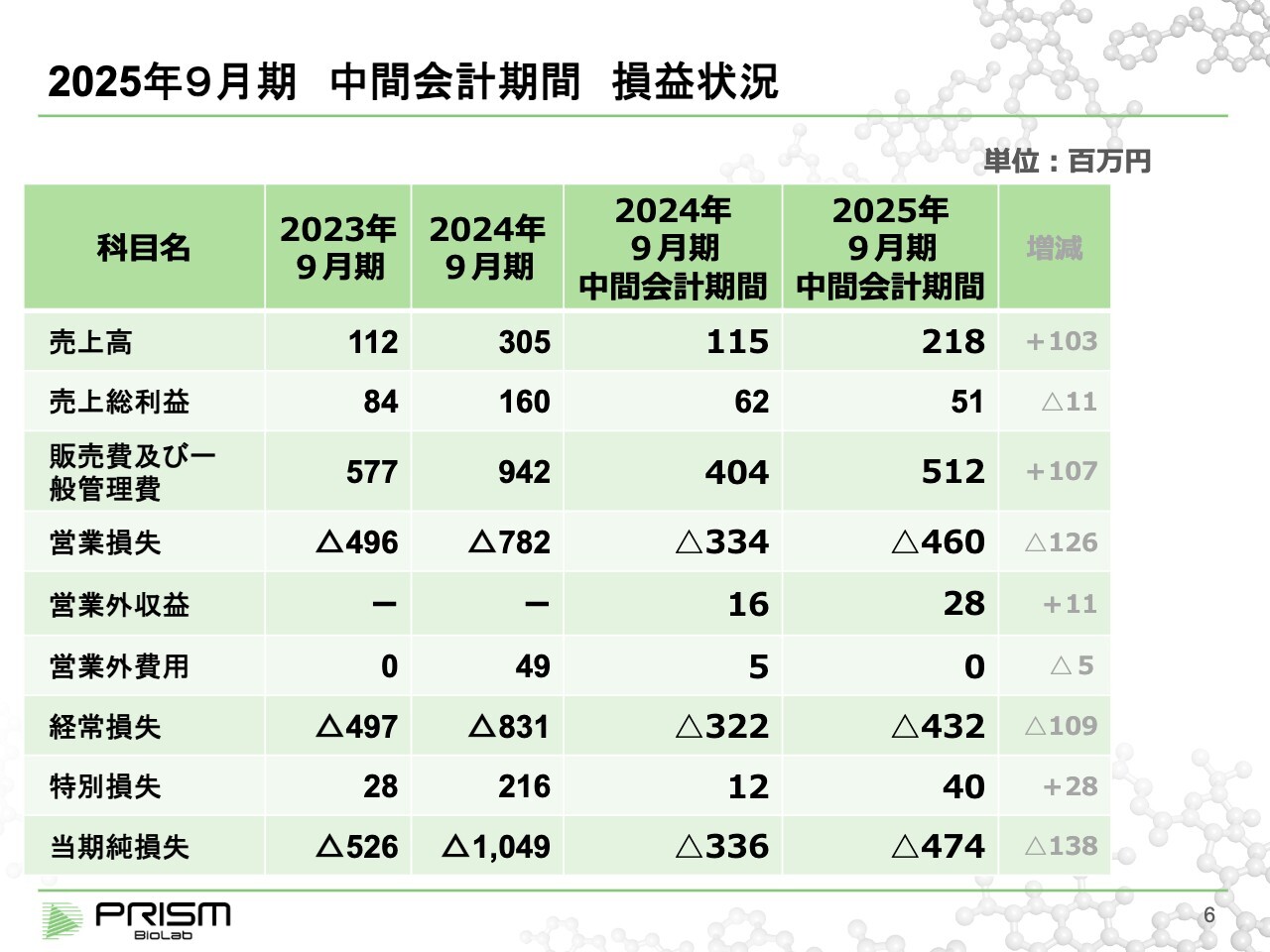
今期の数字についてご説明します。売上高は前年同期比で約倍の2億1,800万円となっていますが、前期の実績は3億円だったことから、今期はそれを上回る見込みです。売上総利益はあまり変わっていませんが、研究開発や基盤整備も含めて大きく投資しています。こちらの詳細は、後ほどご説明します。
販管費は、従来より少し多めに出ています。その結果、半期の営業損失は4億6,000万円と、前期よりも少し増えています。当期純損失は、4億7,400万円です。
2025年9月期 中間会計期間 財政状況
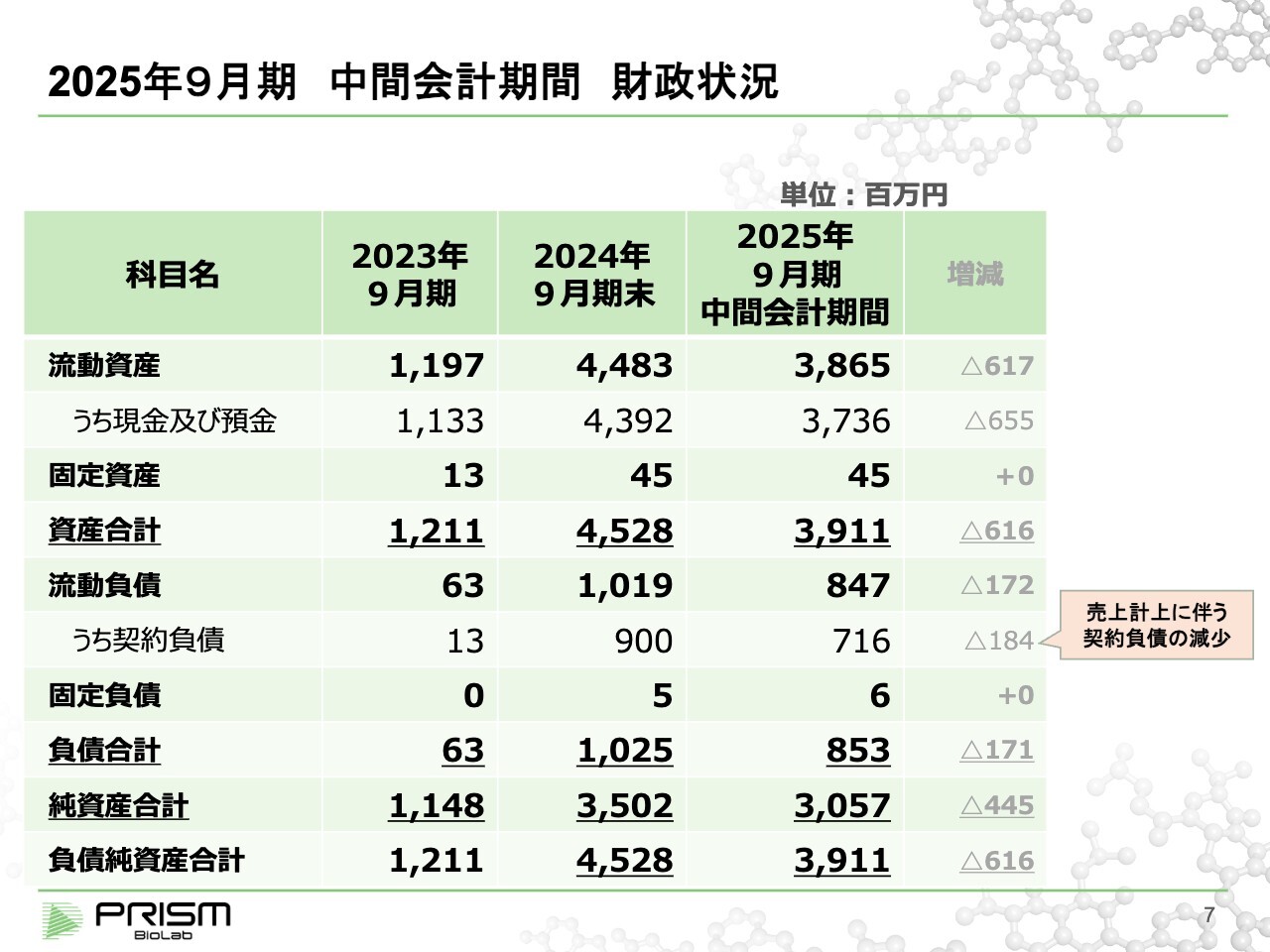
貸借対照表です。現金及び預金が約37億円という状況になっています。期首に比べて約6億5,500万円の減少となるため、後ほどキャッシュ・フローでもご説明します。
当社の場合、大きな契約をいくつか受注していますが、その分が契約負債、すなわち前受金としてB/Sに乗っています。今期はこの1億8,400万円が売上に回り、契約負債が減少しています。
2025年9月期 中間会計期間 キャッシュフロー状況
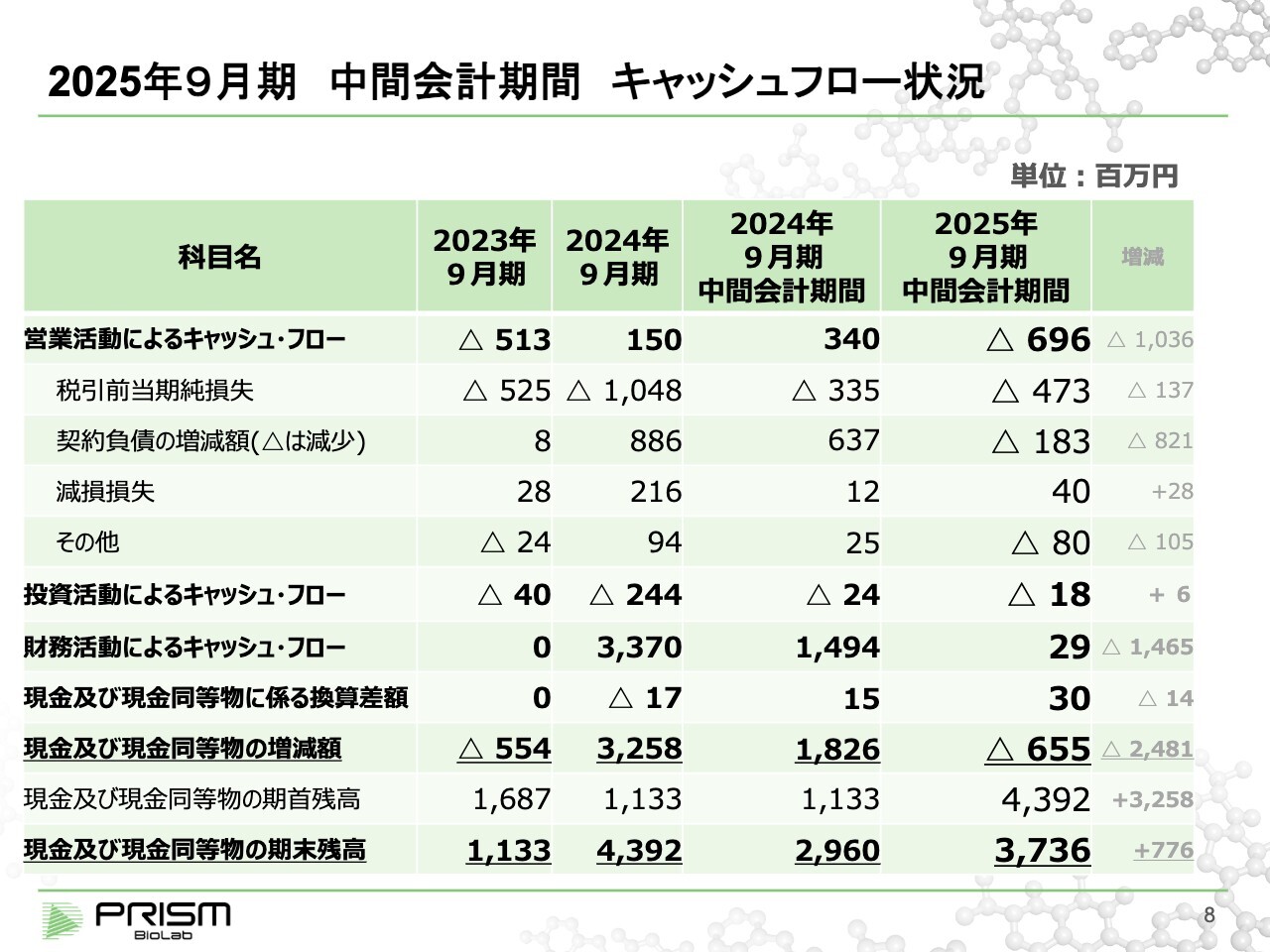
キャッシュ・フローを見ると、税引前当期純損失は4億7,300万円です。こちらに契約負債の減少分とその他を含め、営業活動によるキャッシュ・フローは約7億円のマイナス、全体で約6億5,500万円のマイナスとなります。
事業進捗を示す指標:段階別プログラム数の推移
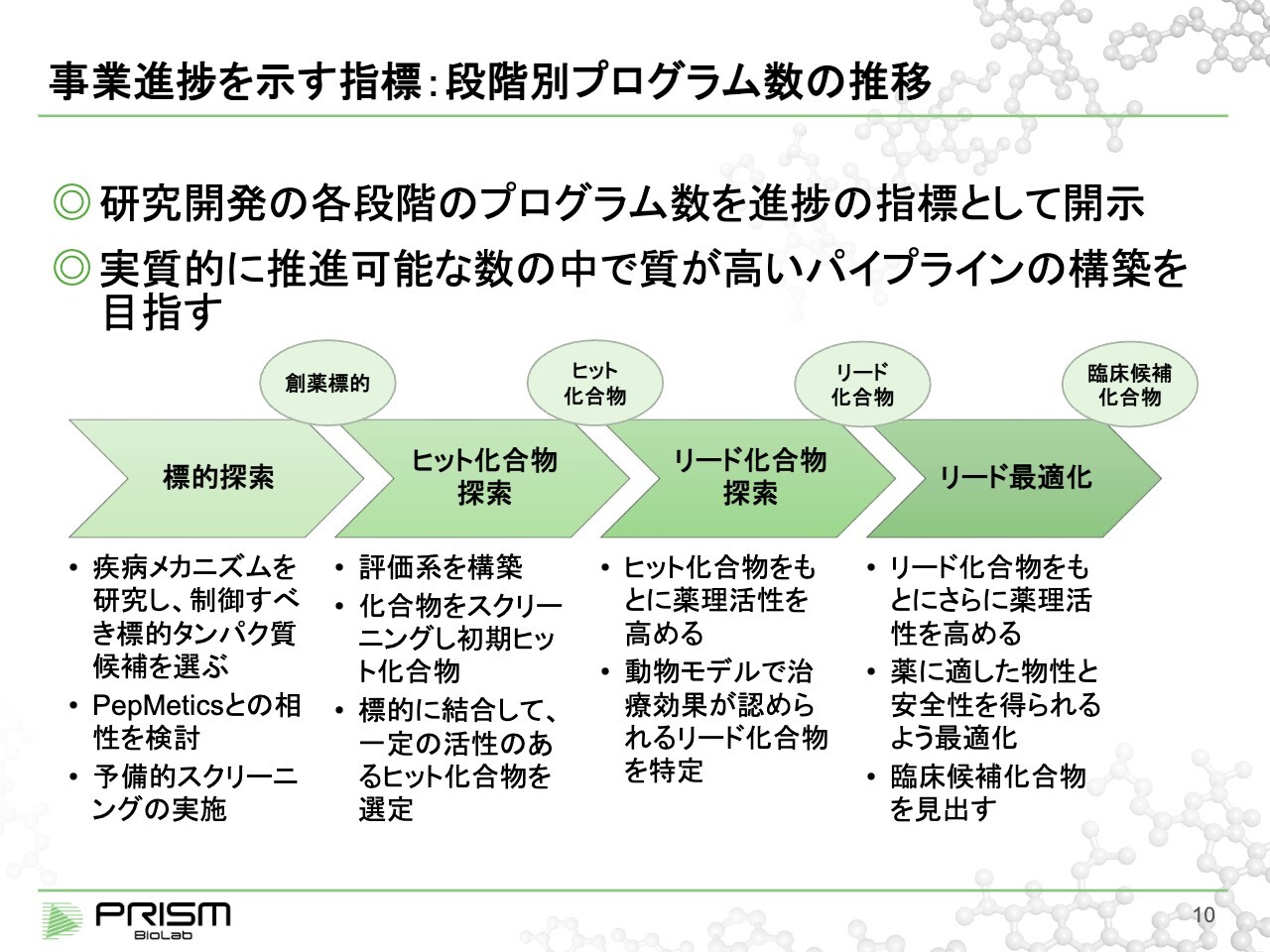
事業の進捗と成長戦略についてご説明します。
通常、製薬会社では、事業進捗に臨床試験の進捗を出すことが多いのですが、当社の場合は臨床試験に入る臨床候補化合物を出す段階までが実際のアクティビティのメインとなっています。その部分まできちんとご説明するため、4つのステップに分けて管理しています。
まずは、創薬標的の選定です。正しい標的を選ぶことが極めて重要となります。そして、選んだ標的に対してヒット化合物、すなわちスタートとなる化合物を見出します。我々が行っているPPI創薬において極めて難しい部分ですが、ここに我々の大きな価値があります。
見出したヒット化合物を、次はリード化合物という動物でもきちんと効果が確認できる化合物に仕上げていきます。最後に、それを人の薬として使えるような臨床候補化合物に仕上げるリード最適化という、以上の4つのステップで進めています。
パイプラインと言うと数を競うようなかたちがありますが、単に数が多ければ良いというわけではなく、むしろ限られたリソースを適切に使うためには、可能性が高いものに集中して投資していくことが重要です。
すなわち、可能性が低くなった場合には途中で止めることも含め、常に限られた中で質の高いパイプラインを作っていくことを目指しています。
自社開発事業(期首設定目標と進捗状況)
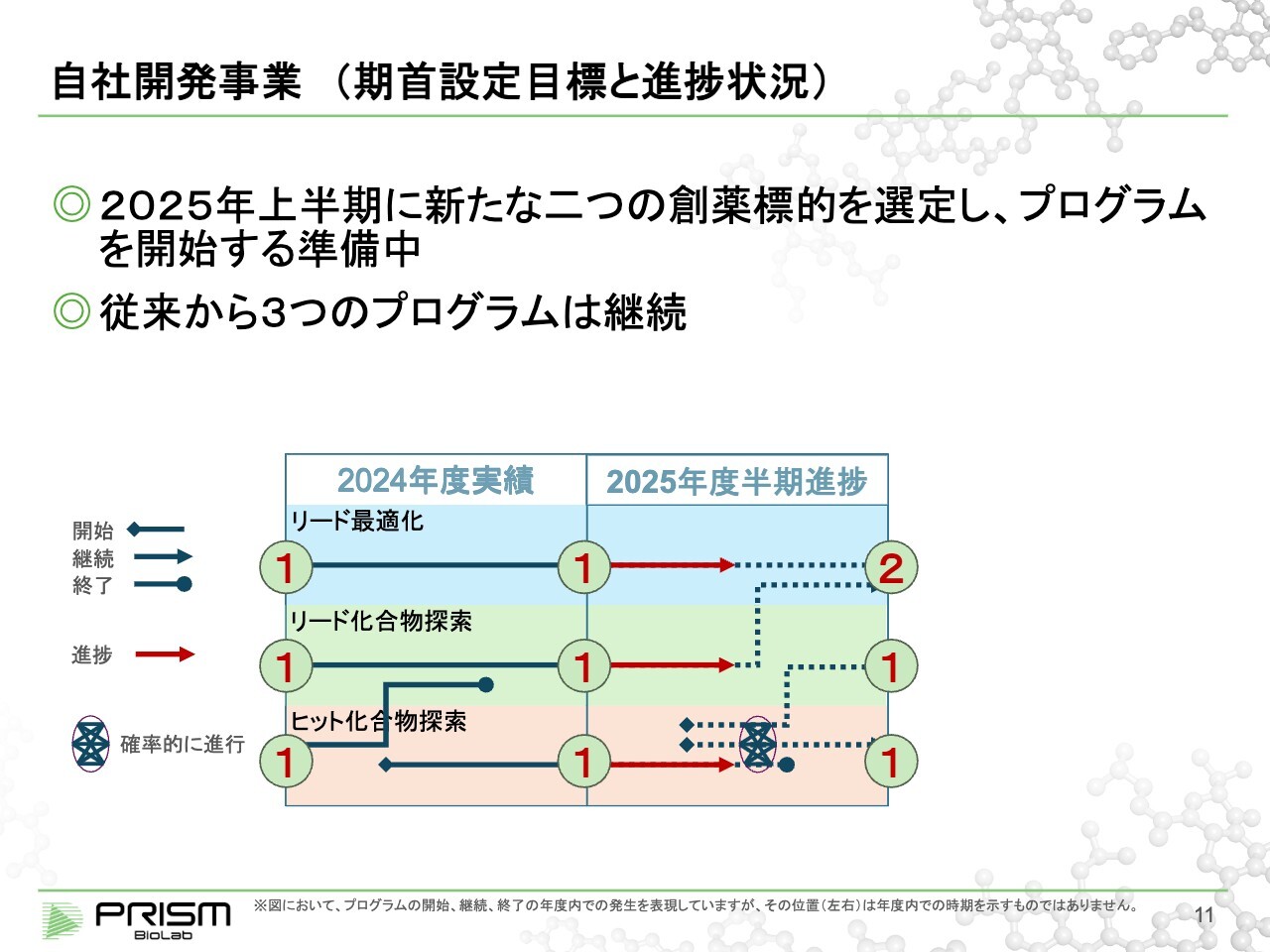
目標については、期首にもご説明しました。自社開発事業の中、昨年度はリード最適化の段階のものが1つ、ヒット化合物が見つかりリード化合物を探索しているものが1つ、ヒット化合物をスクリーニングで探そうとしているものが1つという状況でスタートしました。これらを今期末までに2・1・1のかたちにすることを目標に進めています。
この目標に対し、現在の進捗は、従来の3つのプログラムを継続しています。「新たな二つの創薬標的を選定し、スタートする」という目標については、創薬標的の選定はほぼ終わり、現在はプログラムを開始する準備をしているため、期末までには予定どおりスタートできるだろうと見込んでいます。
共同開発プロジェクト(期首設定目標と進捗状況)
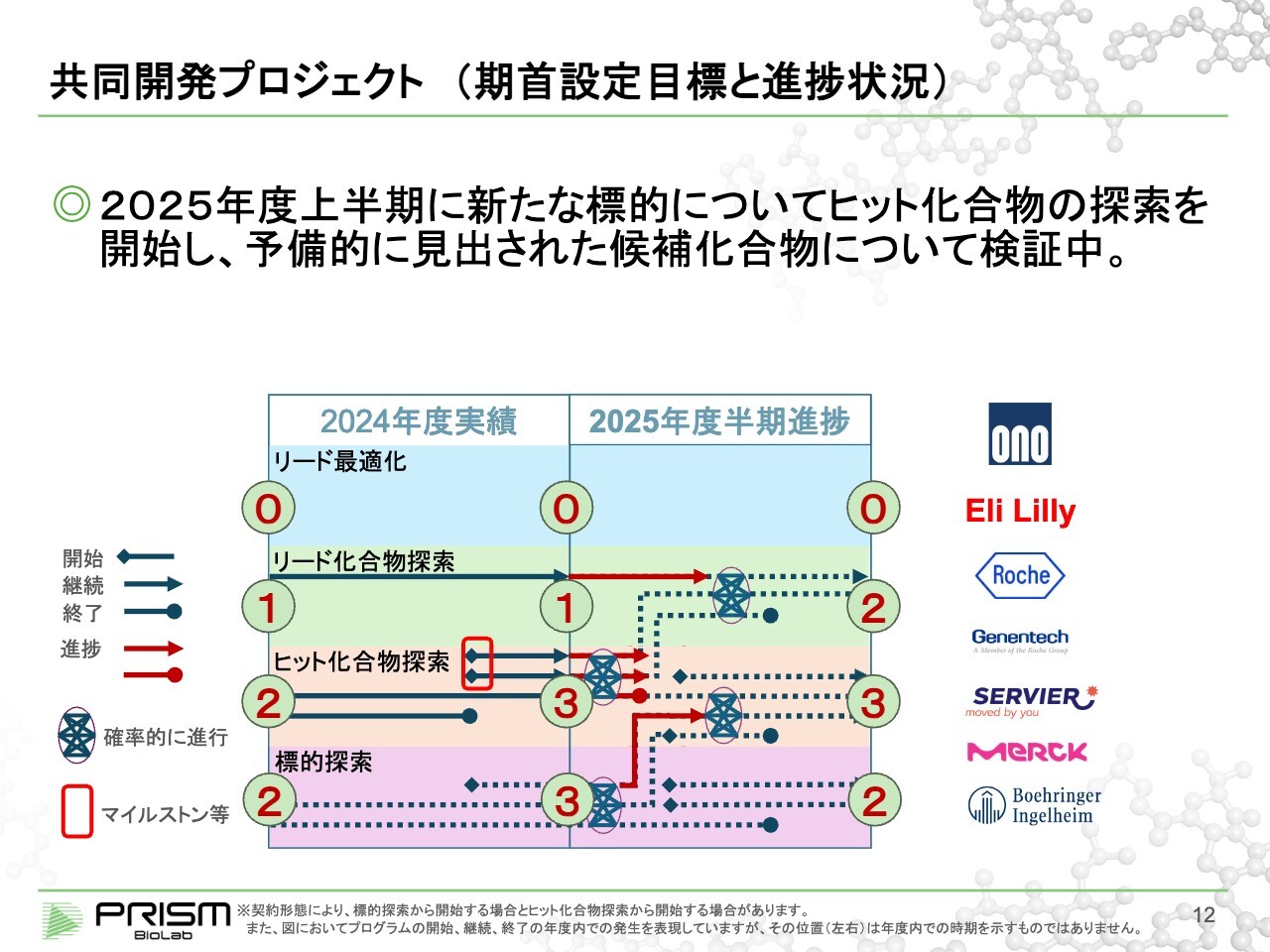
共同開発プロジェクトです。こちらも同様に、期首にスライドに記載した目標を立てています。2025年はリード化合物探索が1つ、ヒット化合物探索が3つ、標的探索が3つでスタートし、それをいくつかのマイルストーン等を経ながら、2・3・2というかたちに持っていくことを目標にしていました。
進捗としては、ヒット化合物探索を3つ進めていましたが、1つはなかなか難しく、ストップしています。一方で、標的探索していた中に1つに、ヒットの可能性のあるものが出てきており、現在はヒット化合物の確認をしています。
期末までにスライドに記載したかたち(期首の計画どおり)に仕上げるという目標については、現状では変更ありません。
創薬基盤ベンチャー⇒PPIの総合的先端技術をリードする創薬企業
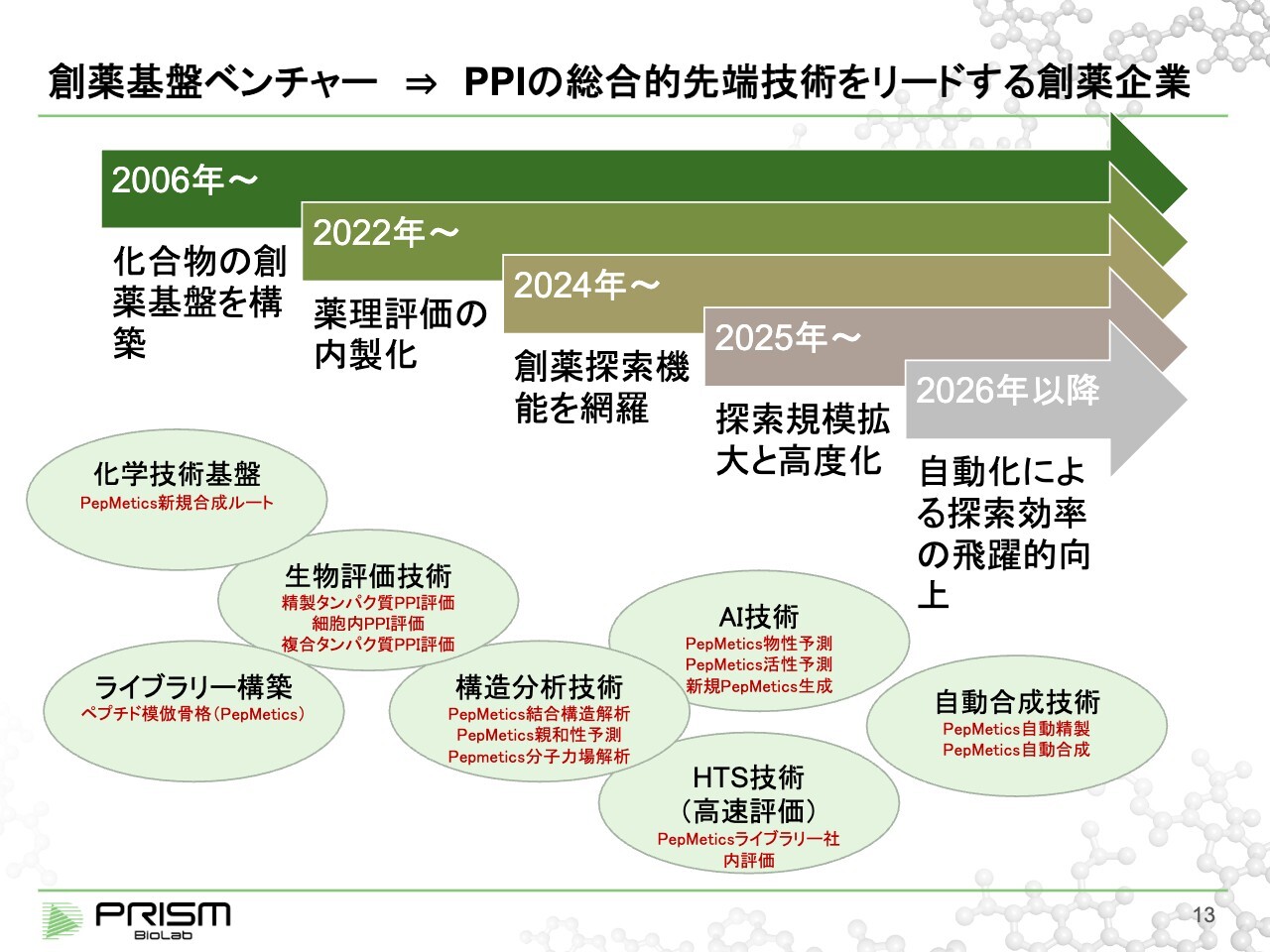
各プログラムの進捗も記載しているとおり、我々は創薬基盤自体もどんどん発展させています。設立は2006年ですが、当初想定していたのは創薬基盤ベンチャー、すなわち有機化学を中心として化合物を作ることを一番大きな差別化としていました。
化学合成、ライブラリー構築を行い、これらをいろいろと提案していたのが当初のプラットフォームです。
それに対して創薬事業には、化合物の合成に加え、バイオロジー、バイオフィジックスなどさまざまな機能が必要です。当初はそれらをすべて外注していましたが、2022年頃からは内製化していく方向で進めており、それによって飛躍的な効率の向上を図ることができます。
特に生物評価について、我々が標的としているタンパク質間相互作用(PPI)は非常に難しい標的であり、評価自体にも「何が本当に適しているか?」というさまざまな探索が必要です。
従来、外部の専門のCRO、実験を行う会社にアウトソースしていましたが、それを内製化することで、生物評価自体にも我々の標的群に合ったノウハウがどんどん蓄積しています。そのような意味では、標的に合わせた総合的な技術を獲得しようとしています。
それは他の分野も同様です。構造分析でも、タンパク結合に合った、もしくは我々の「PepMetics」という化合物に合った分析技術を蓄積しています。
今年度からは、従来も活用しているAI技術に加え、活性予測、いわゆる新たな化合物の生成をAIで行うことを、Elix社と一緒に始めています。
また、HTS技術は、多くの化合物を自社でスクリーニング評価し、そこからヒット化合物を出していく技術です。こちらもさまざまな設備などが必要で、従来はできていませんでしたが、内製化によって飛躍的に効率良くヒット化合物が見つけられるようにすることを目指しています。
今後は、合成をどんどん自動化することで、飛躍的な効率向上、ヒット化合物の探索を進めていきたいと考えています。
PepMeticsがあたらしい創薬領域を創る可能性
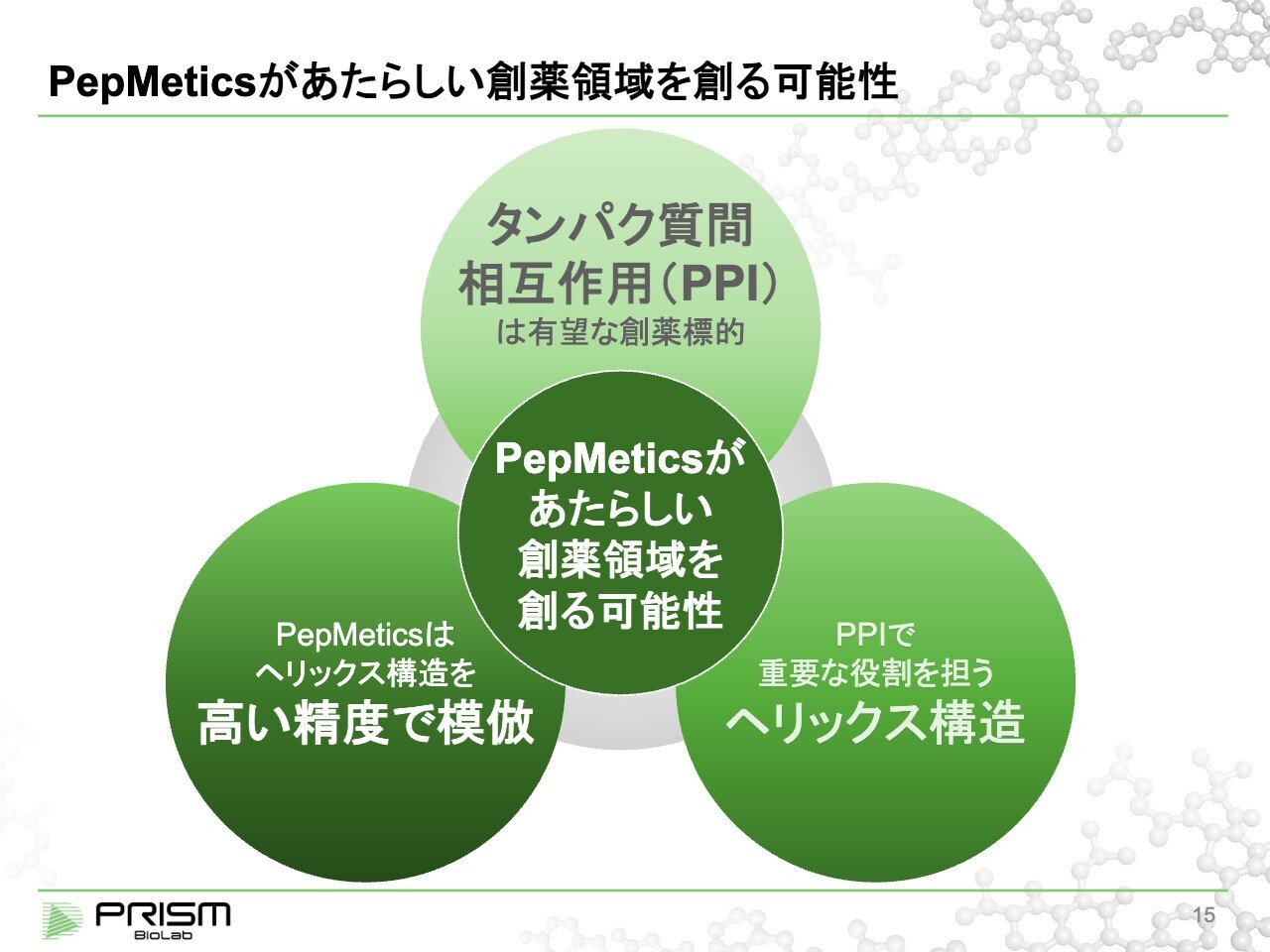
先ほどからご説明しているタンパク質同士の結合を含め、我々の技術がどのようなものであるかについて、あらためてご説明します。技術自体は3ヶ月や1年ですぐに変わるものではないため、このご説明は従来と同じです。
当社の「PepMetics」という新技術が新しい創薬領域を創り出す可能性について、3つのステップでご説明します。
タンパク質間相互作用は、人の体にとって非常に重要で、薬の標的として極めて可能性がありますが、非常に難しい領域です。
タンパク質同士の結合の中で重要な役割を担うのが、ヘリックス構造です。これは短いペプチドですが、こちらが重要であることについてもご説明します。
また、「PepMetics」という我々の技術は、ヘリックス構造を高い精度で模倣する、初めての低分子化合物です。これにより、従来できなかったタンパク質間相互作用による創薬ができるようになります。
タンパク質間相互作用(以下「PPI」)は有望な創薬標的
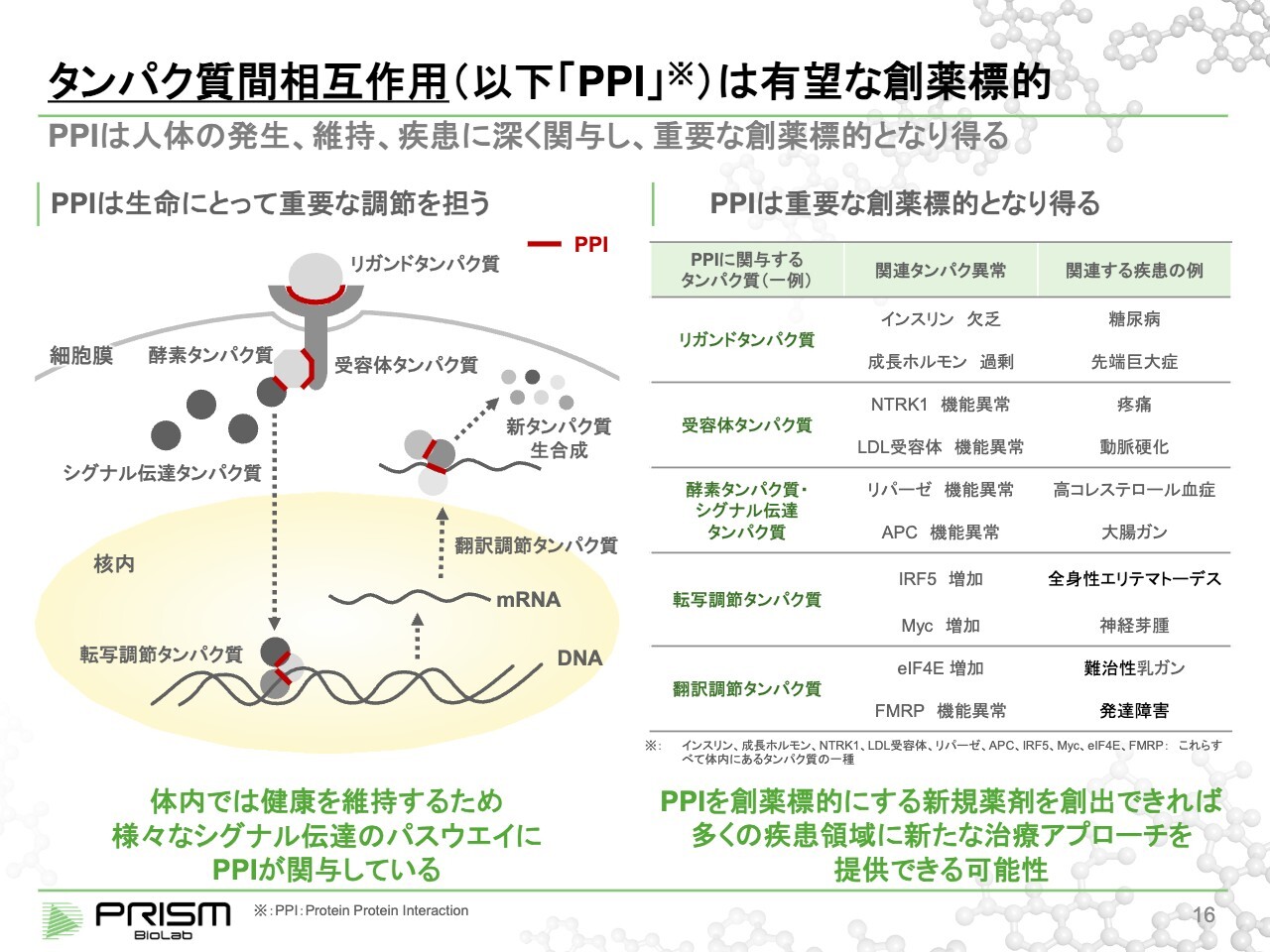
まずは、タンパク質間相互作用についてです。
人間の体は、基本的にタンパク質によってコントロールされているといっても過言ではありません。これは細胞の話ですが、人間が生まれたり成長したり、恒常性の維持や疾患と戦うことに対して、タンパク質同士の結合はさまざまな領域で役割を果たしています。
例えば、1つの新しいタンパク質を作り出すためには、まず、リガンドタンパク質というものが細胞の外側から受容体タンパク質にくっつきます。これが「PPI(タンパク質間相互作用)」です。
これにより、受容体タンパク質は細胞の中のシグナル伝達タンパク質や酵素タンパク質に信号を伝えます。これもPPIであり、タンパク質とタンパク質が選択的に結合することで行われます。
それによってシグナル伝達タンパク質が細胞の核の中に入り、今度はDNAからmRNAを読み出すコンプレックス、要するに複数のタンパク質が選択的に組み合わさることで、機械仕掛けのようにmRNAを読み出していきます。
そして、mRNAからタンパク質を合成しますが、この翻訳の機構も同様にタンパク質同士の結合によって制御されています。
このような複雑な機構が正確に動くことで人間の体はコントロールされていますが、これがうまく動かなくなった際、さまざまな疾患になってしまうとお考えいただければと思います。このPPIを制御することで、病気を治していこうということです。
PPIで重要な役割を担うヘリックス構造
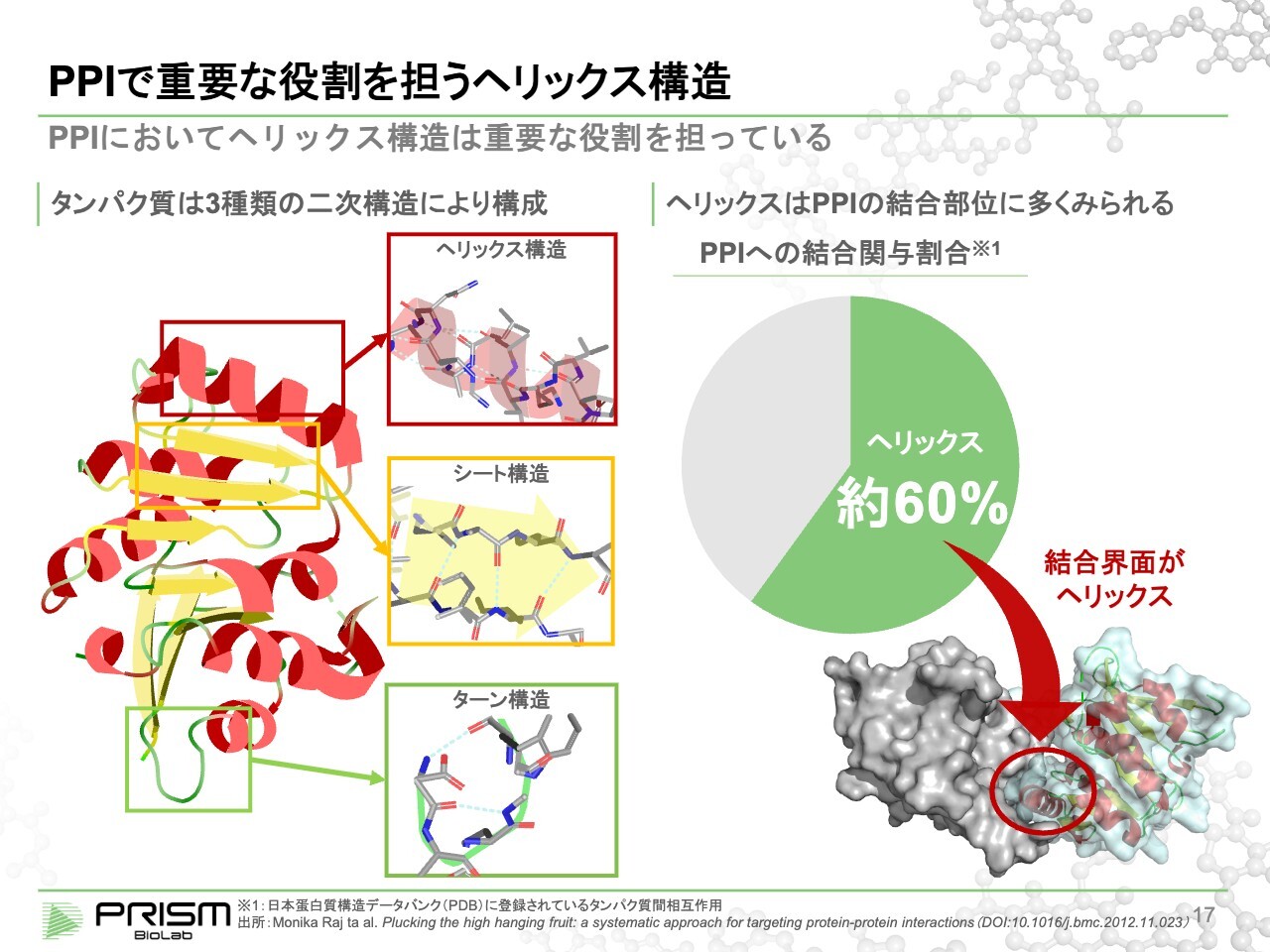
PPIの構造はタンパク質同士の結合ですが、タンパク質は1本のアミノ酸の長い紐です。数百から数万のアミノ酸が1本の紐状になっているものが正確に折り畳まれ、機械仕掛けのように働きます。この折り畳まれる構造を正確にするために、3つの基本的な安定構造があります。
それが、ヘリックス構造、シート構造、ターン構造の3つです。この中で、タンパク質同士の結合(PPI)に最も重要だといわれているのが、ヘリックス構造です。タンパク質とタンパク質が結合する部位において、最もヘリックス構造がたくさん使われている、すなわち選択的に相手を認識する時に重要なモチーフであると考えられています。
当社のプラットフォーム基盤技術「PepMeticsテクノロジー」
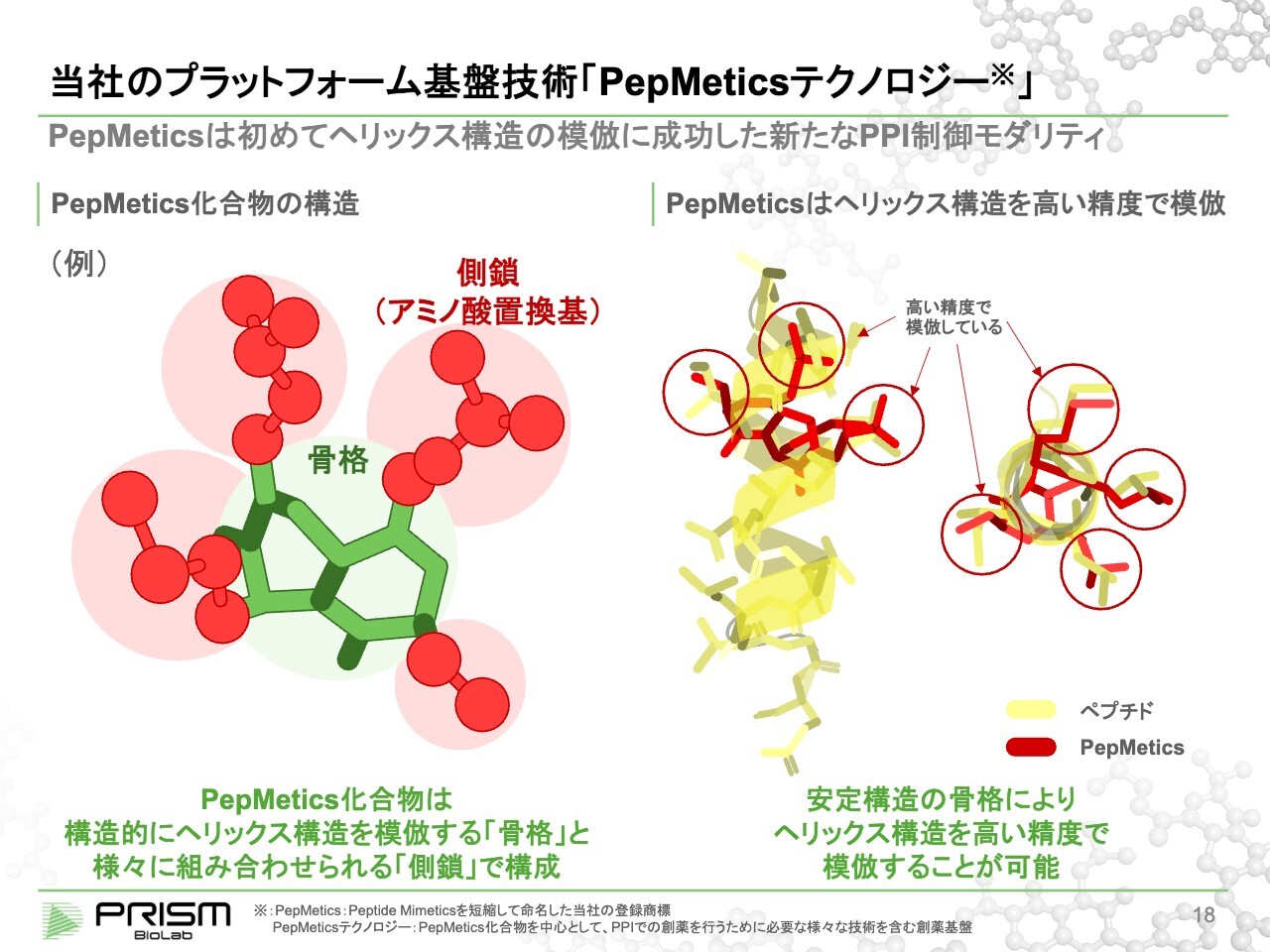
このヘリックス構造を低分子で真似て、阻害することが考えられますが、ヘリックス構造は名前のとおりらせん状をしており、4つのアミノ酸で約1回転します。
アミノ酸を模倣しようとすると360度、さまざまな方向に3次元的に手が生えています。しかし、従来の低分子は平面的で、3次元的なものを模倣するのに向いていないと言われていました。
そこで我々は、2つの輪っかがある角度でかっちりと固まるような骨格を作りました。すると、3次元的に手を生やすことができるようになりました。この手はアミノ酸の付け根になり、それがヘリックス構造の手の生え方と同じような位置関係になるように骨格をデザインしました。
この手にさまざまなアミノ酸を自由にくっつけられるような合成方法を確立することで、低分子でありながらもヘリックス構造と同じようなかたちのアミノ酸の配列を作ることができるようになりました。これが、従来にないヘリックス模倣の低分子化合物の技術です。
化合物の設計におけるPepMeticsの柔軟性
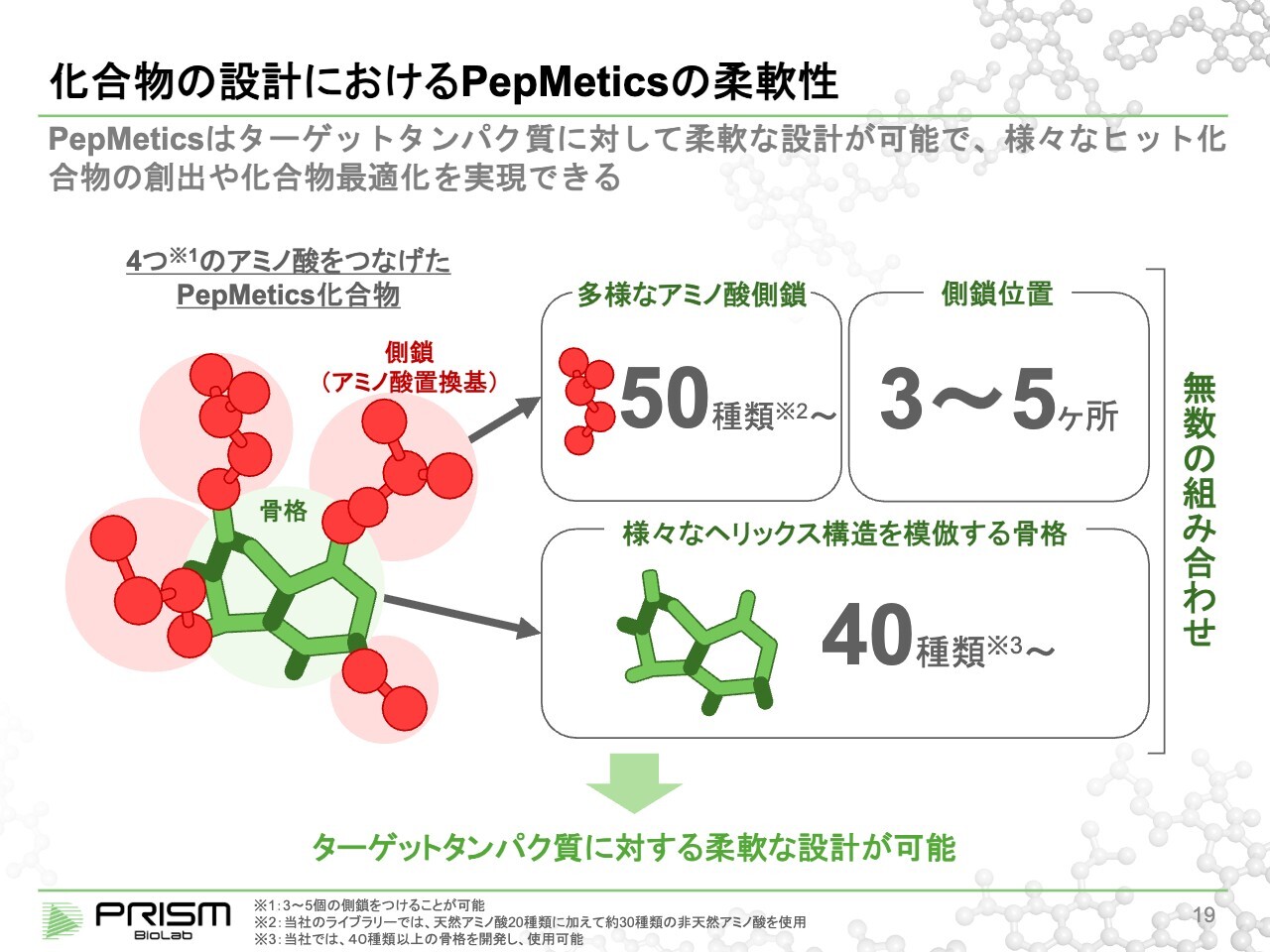
現在、当社は40種類以上の骨格を持っています。同じヘリックス構造といっても、形が伸びていたり歪んでいたりと多少違っており、標的に合わせて40種類の中から適切なものを選びます。
人間の体は20種類のアミノ酸しか使わないのですが、標準的なものとして50種類程度用意しており、これらを組み合わせることでライブラリを作ります。
例えば、4つの手の低分子を作ろうとすると、40×50の4乗で2億5,000万通りのライブラリの設計が可能です。その中で、現在すでに約3万の化合物を合成しており、それらをライブラリとして活用しています。
「細胞内」PPIをターゲットとする創薬の課題
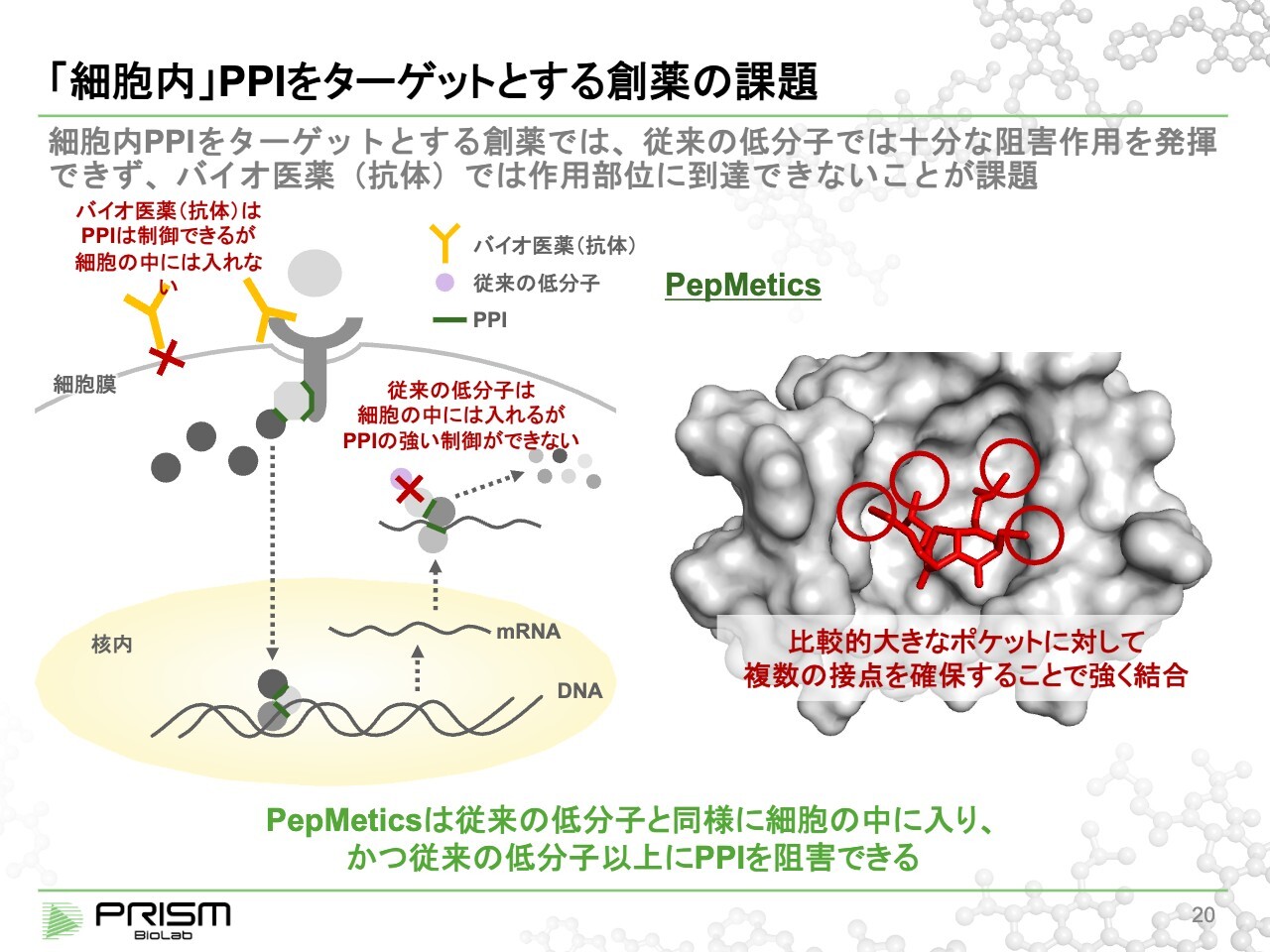
従来の低分子では、PPIを制御することは難しいと思われていました。スライドにあるグレーの画像の中央には、ヘリックス構造が入るポケットがあります。
このポケットは従来の低分子からすると大きすぎて、十分な活性が得られないと思われていましたが、我々の化合物はこのヘリックス構造をうまく真似ることで、複数のポイントで同時に結合し、十分な活性を得ることに成功しています。
従来はPPIが低分子でできないため、大きな分子であるタンパク質などを使っていました。抗体やタンパク医薬は細胞の外のPPIの制御、例えばリガンドと受容体のような場合には大変有効ですが、大きすぎて細胞の中には入りません。
すると、先ほどご説明したような細胞の中のPPIでは、創薬の可能性があってもコントロールするツールがないため、なかなか制御できませんでした。これはアンドラッガブル標的と呼ばれ、創薬に適さないと言われていました。
一方で我々の化合物は、細胞の中に入って制御できるため、今後の新しい創薬領域を作り出す可能性があると考えています。
細胞内PPIに対する他モダリティとの比較優位性
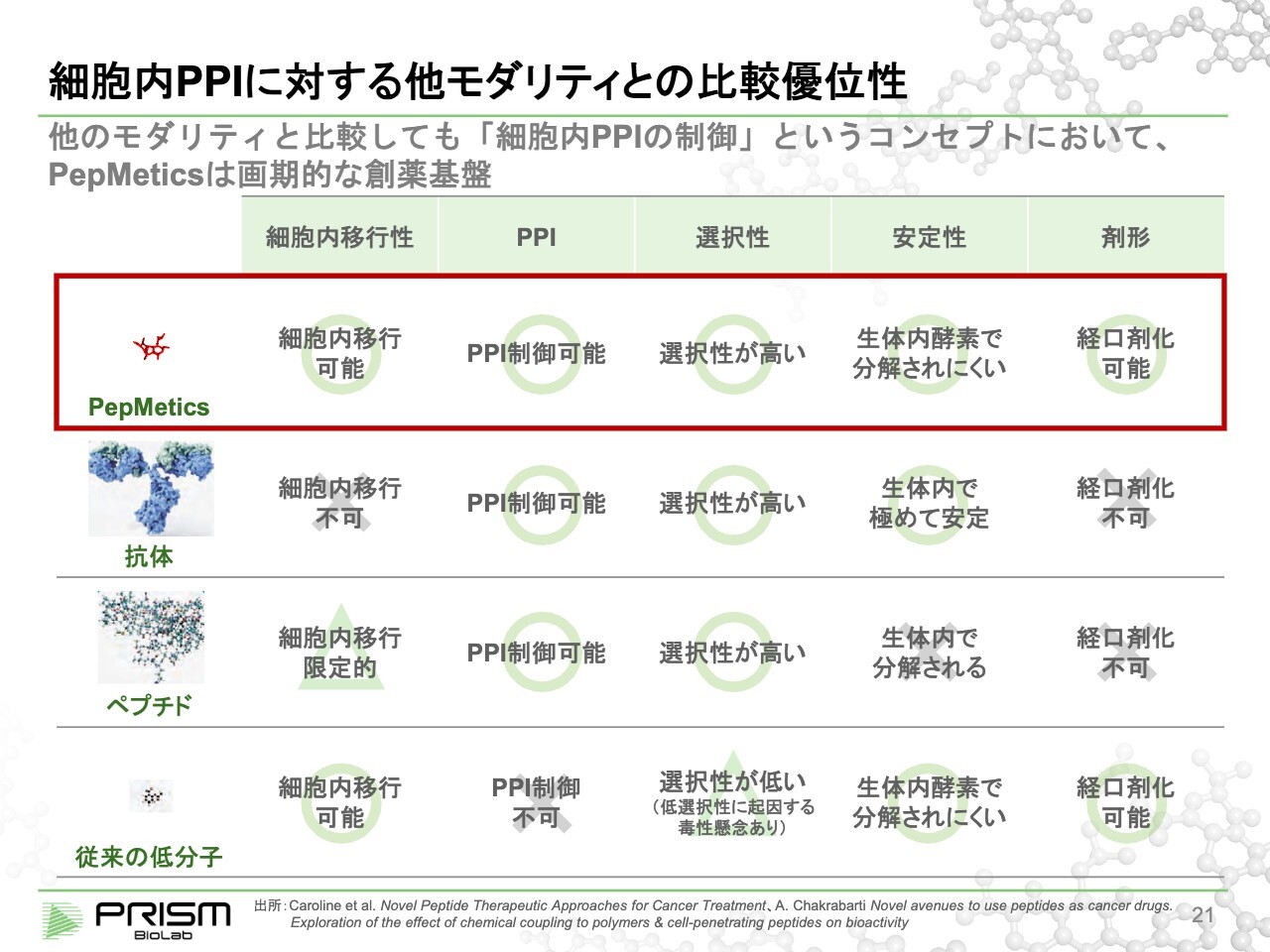
整理すると、従来の低分子では、細胞内移行は可能ですが、PPIを制御できませんでした。一方、PPIを制御できる抗体ペプチドは細胞内移行が限定的で、分解されやすい面がありました。
当社の化合物は、細胞の中に入ってPPIを制御し、経口剤まで持っていくことのできる、理想的なモダリティであると考えています。
天然物に類似する構造を有するPepMetics
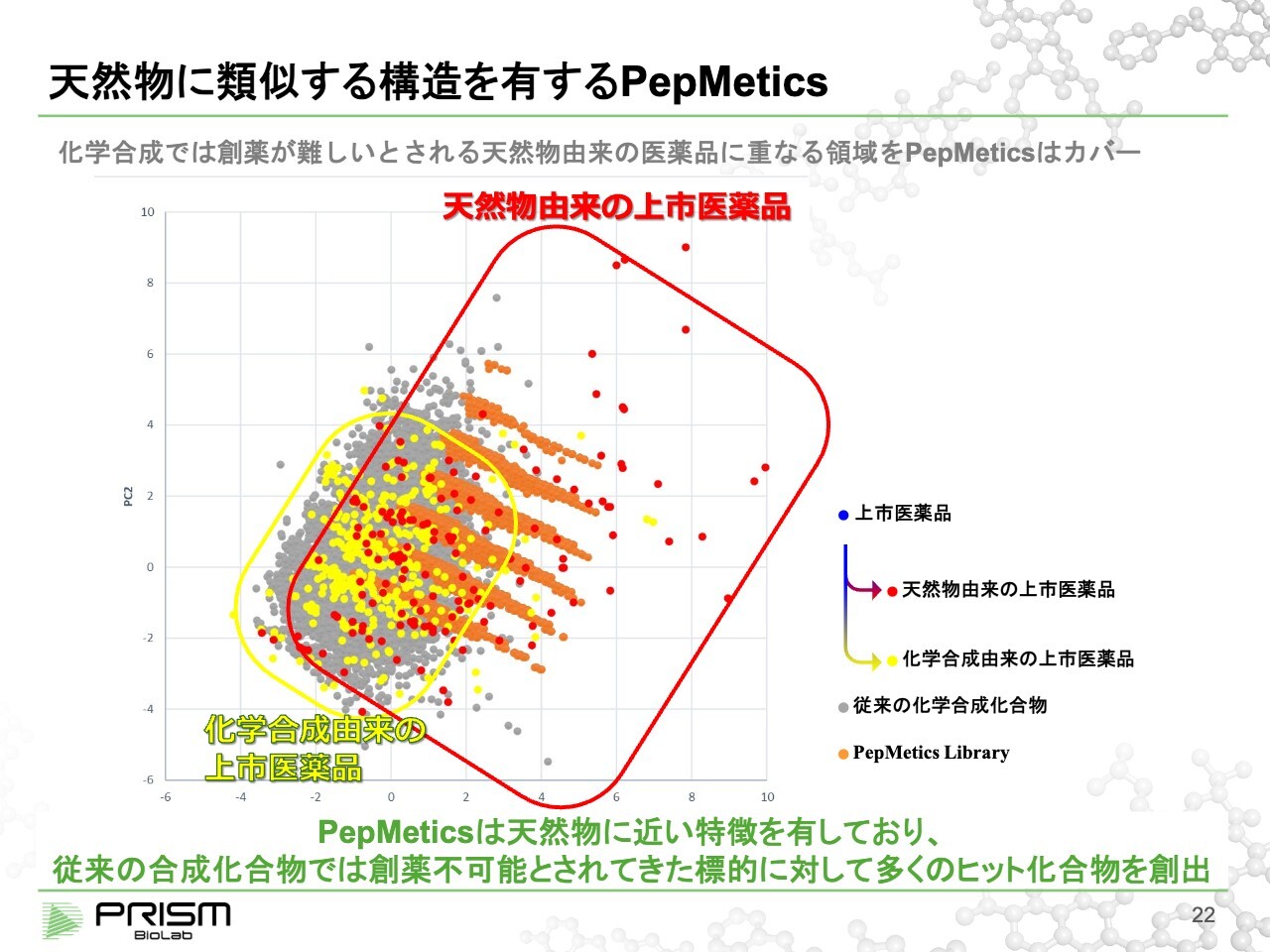
従来の低分子との違いを少しわかりやすく説明したものです。
上市された低分子医薬品を、主成分分析という数学的なモデルを使い、2次元平面にできるだけ分散させました。そこに従来使われてきたスクリーニングの化合物、従来の低分子を重ね合わせると、領域が広く重なります。これは、スクリーニングからたくさんの薬が作られてきたことを示しています。
当社の化合物は、重なった領域から少しずれているところにあります。これを分析するために、上市された医薬品を天然物由来と合成物由来に分けると、当社は天然物由来が多くあるところをカバーしていることがわかります。
天然物は見つけることも合成も大変で、なかなか薬にしづらいことから、研究があまり進んでいませんでしたが、我々の低分子を使うことで、この分野を開拓することができます。
当社のビジネスモデル
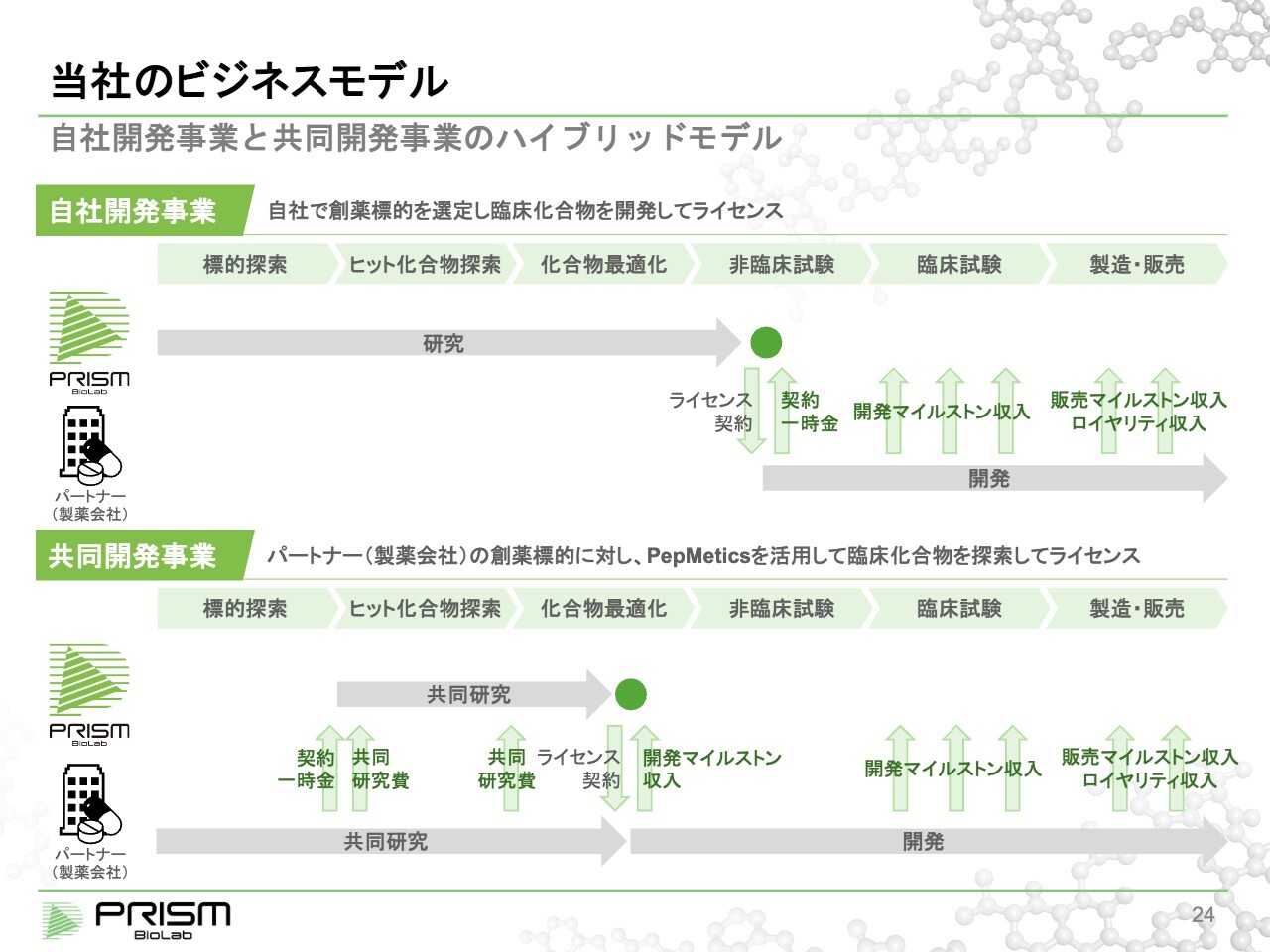
当社のビジネスモデルは、自社開発事業と共同開発事業の2つを柱としています。
自社開発事業では、自分たちで標的を見つけて臨床候補化合物まで持っていき、それを製薬会社にライセンスします。当然ながら、この間には3年から5年の期間や数億円の投資が必要で、ハイリスクハイリターンではあるものの、大きな成果が得られます。
対して共同開発事業では、製薬会社がすでに選んだ標的で、自分たちではヒットが出せない部分に関して共同で研究を行い、臨床候補まで持っていってライセンスします。この場合、共同研究の間も共同研究費が支払われるほか、マイルストン収入もあるため、プロジェクト単体で見ると、初めから黒字化できる事業です。
そのような意味では、共同開発事業のほうがリスク的にマネージできる上に採算も取りやすいといえます。ただし、収益規模では自社開発のほうが高くなります。
当社の各事業の特徴
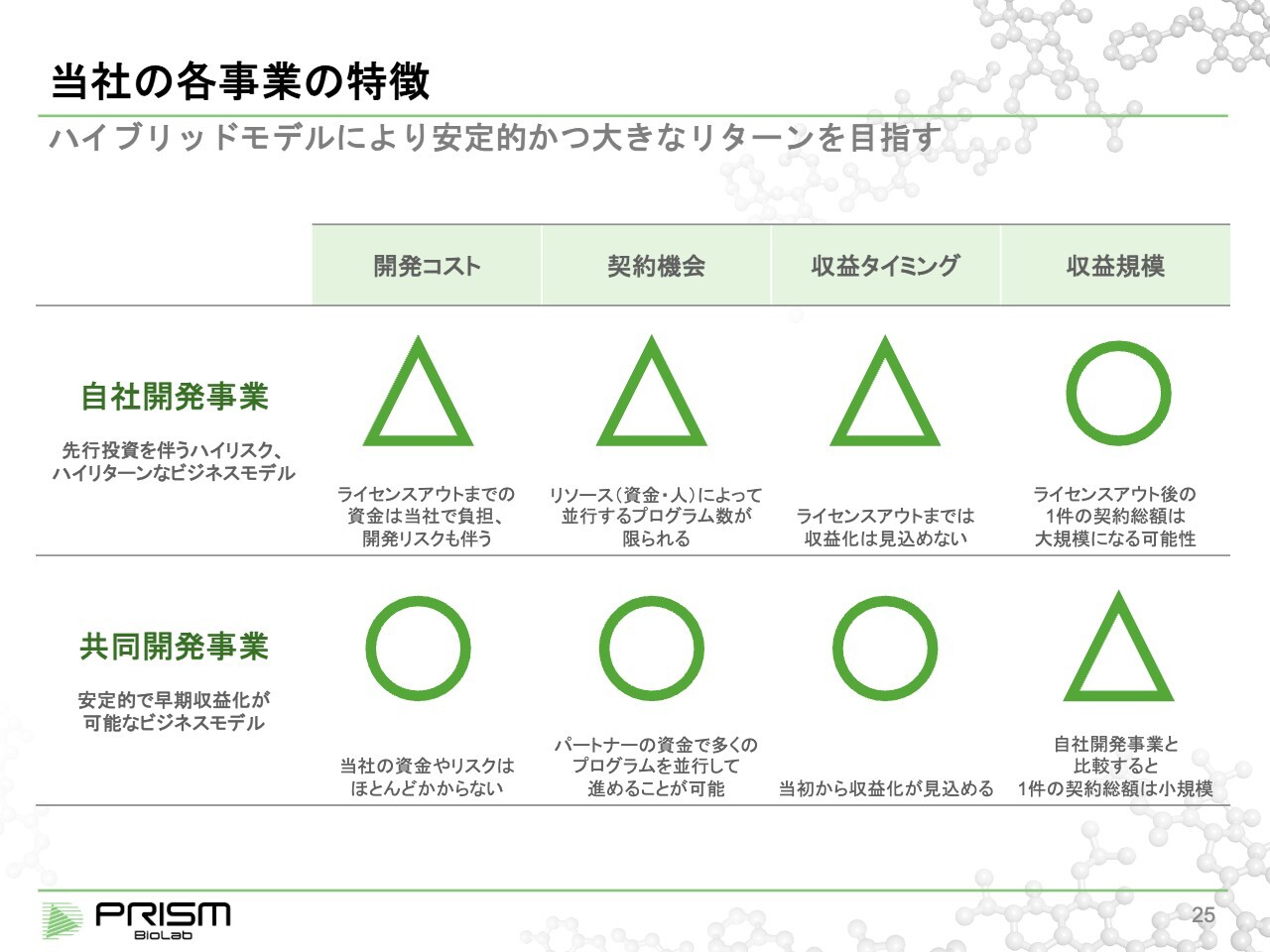
我々は共同開発と自社開発を組み合わせ、安定的に事業を進めながらも大きなリターンを目指して開発を進めています。
自社開発から共同開発への展開
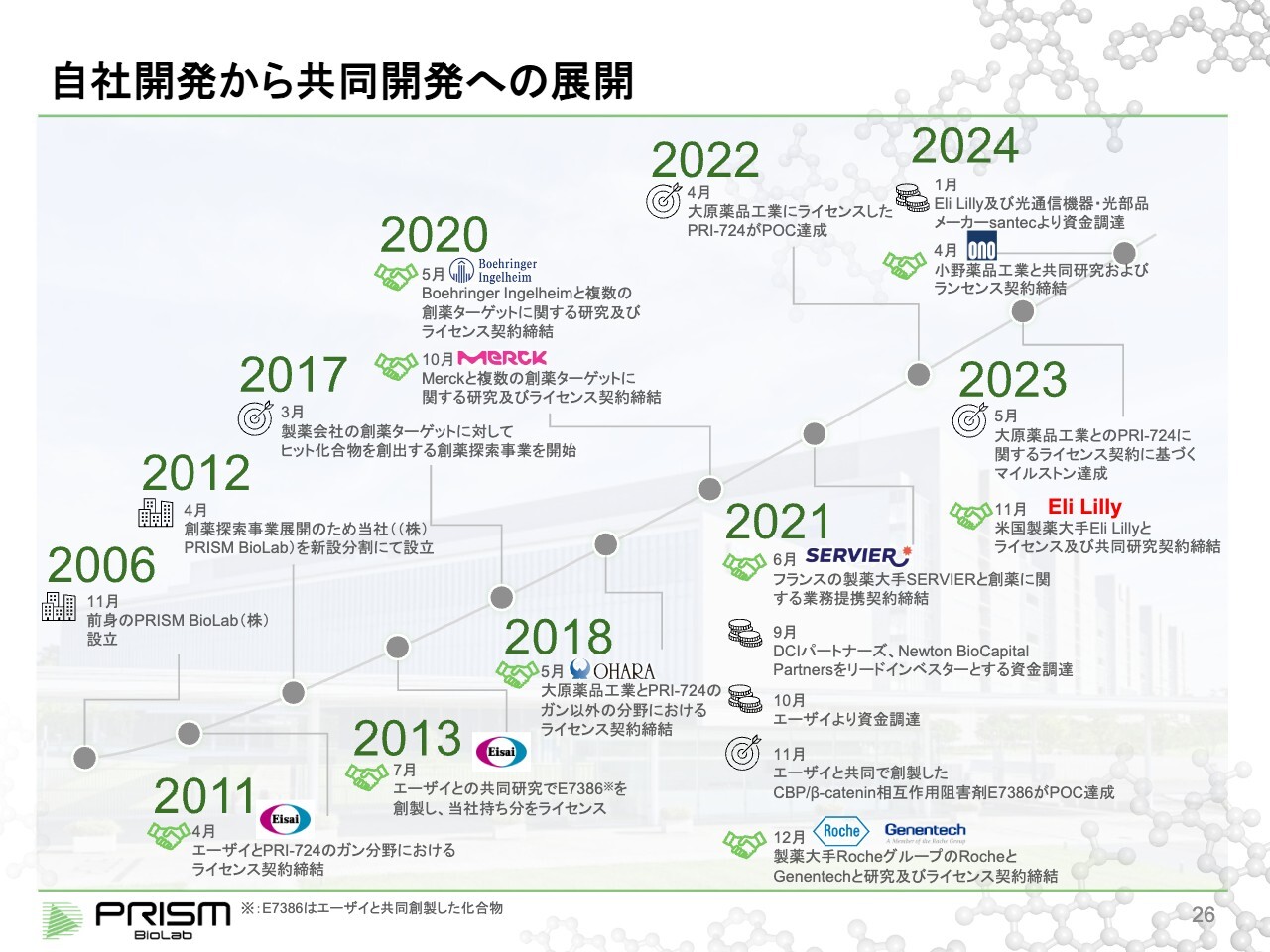
当社を歴史的に見ると、2006年に設立し、プラットフォームを作り上げました。このプラットフォームが有用であることを示すために、まずは自社で1つのプログラムを開始し、2011年にエーザイ社とライセンス契約を結び、現在まで継続しています。
その後は大原薬品工業にもライセンスアウトし、製薬会社の標的に対して創薬するビジネスを始めました。以来、Boehringer Ingelheim、Merckをはじめ、多くの製薬会社にご契約いただいています。
自社開発事業

すでにライセンスアウトした2つの創薬についてご説明します。実は、どちらもPOC、ヒトでの効果が確認されています。
大きな進捗では、現在、エーザイ社のプログラムの臨床試験が進んでいます。E7386は「レンビマ」との併用試験において大変良いデータが出ました。昨年9月にESMO(欧州臨床腫瘍学会)でも発表し、子宮内膜ガンを中心に積極的に進めています。
今年5月のASCO(米国臨床腫瘍学会)においても、また新しいデータを発表する予定だと聞いています。また、この子宮内膜ガンのプログラムについては、エーザイ社が2031年3月までに承認取得を目指すと発表しています。
大原薬品工業には、「PRI-724」という肝硬変の薬をライセンスアウトしており、こちらも臨床試験を進めている状況です。
自社開発事業:E7386
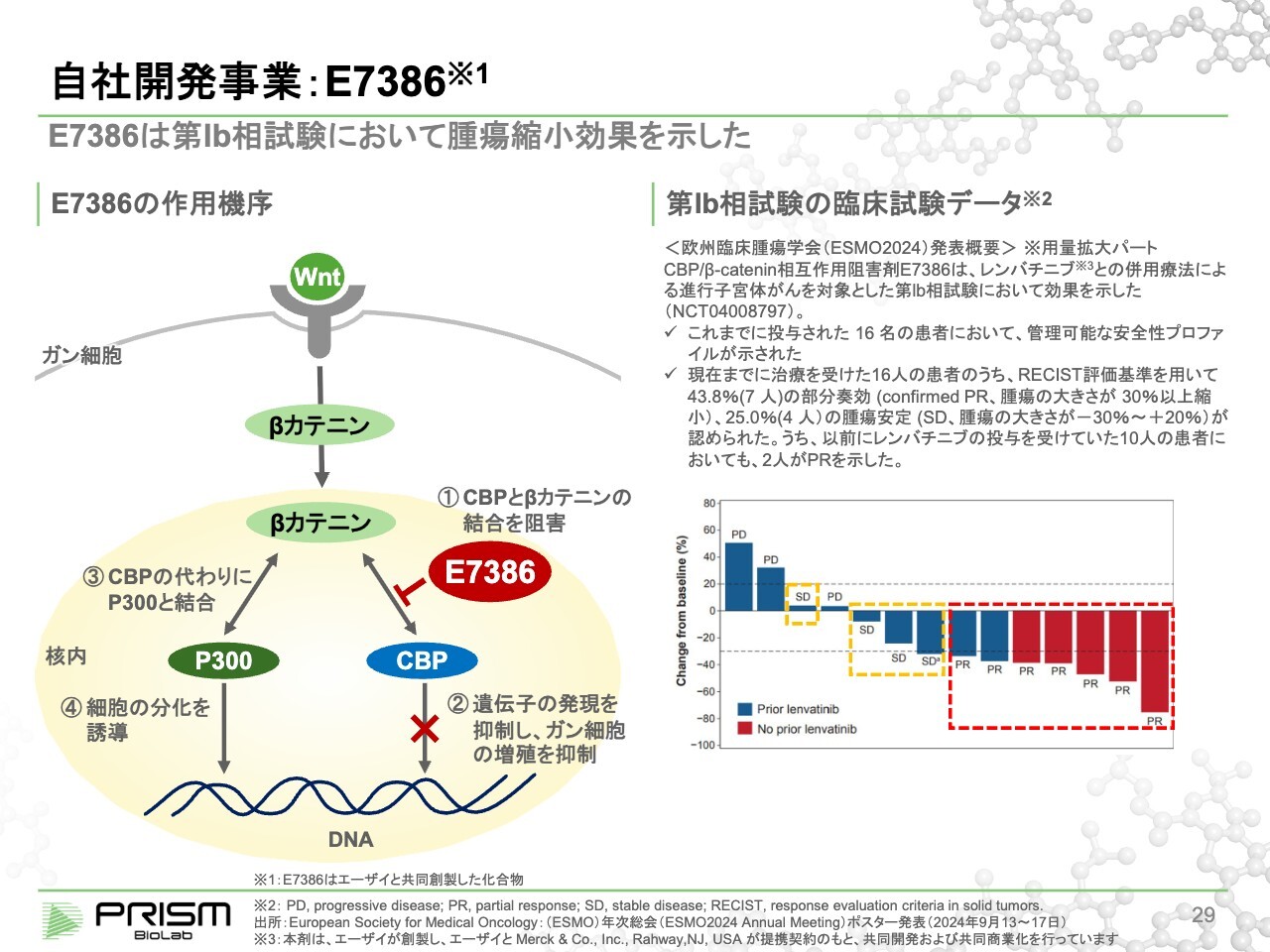
メカニズムをご説明すると、どちらもWntパスウェイを標的にしています。Wntパスウェイは、がんならびに線維症できわめて重要であることが知られており、2000年代に臨床試験も数多く行われましたが、すべて毒性でストップしています。
Wntを止めると毒性が出ることで有名だったため、基本的には外からすべて止めていました。
Wntが細胞の中に入り、シグナル伝達をするβカテニンというタンパク質が核内に入ってCBPと結合することで、増殖因子を出します。これが、がんの増殖の元になります。
我々の化合物は、細胞の中に入ってCBPと結合し、βカテニンとCBPの結合を切ることで、がんの増殖シグナルが止まります。しかしこのβカテニンは、CBPとよく似たP300という別のタンパク質と結合し、細胞を分化させるシグナルを出します。
細胞が分裂するには増殖または分化するしかないため、これをすべて止めてしまうと細胞分裂も止まってしまいますが、「E7386」は増殖を止めても分化は止めず、毒性がそれほど出ない化合物となっています。
この「E7386」を使い、昨年のESMOでエーザイ社が発表したデータが、スライド右側の図です。当時はまだ中間発表でしたが、16名の患者のうち、7名でPR(Partial Response)という腫瘍が有意に小さくなる効果が認められています。
自社開発事業:PRI-724
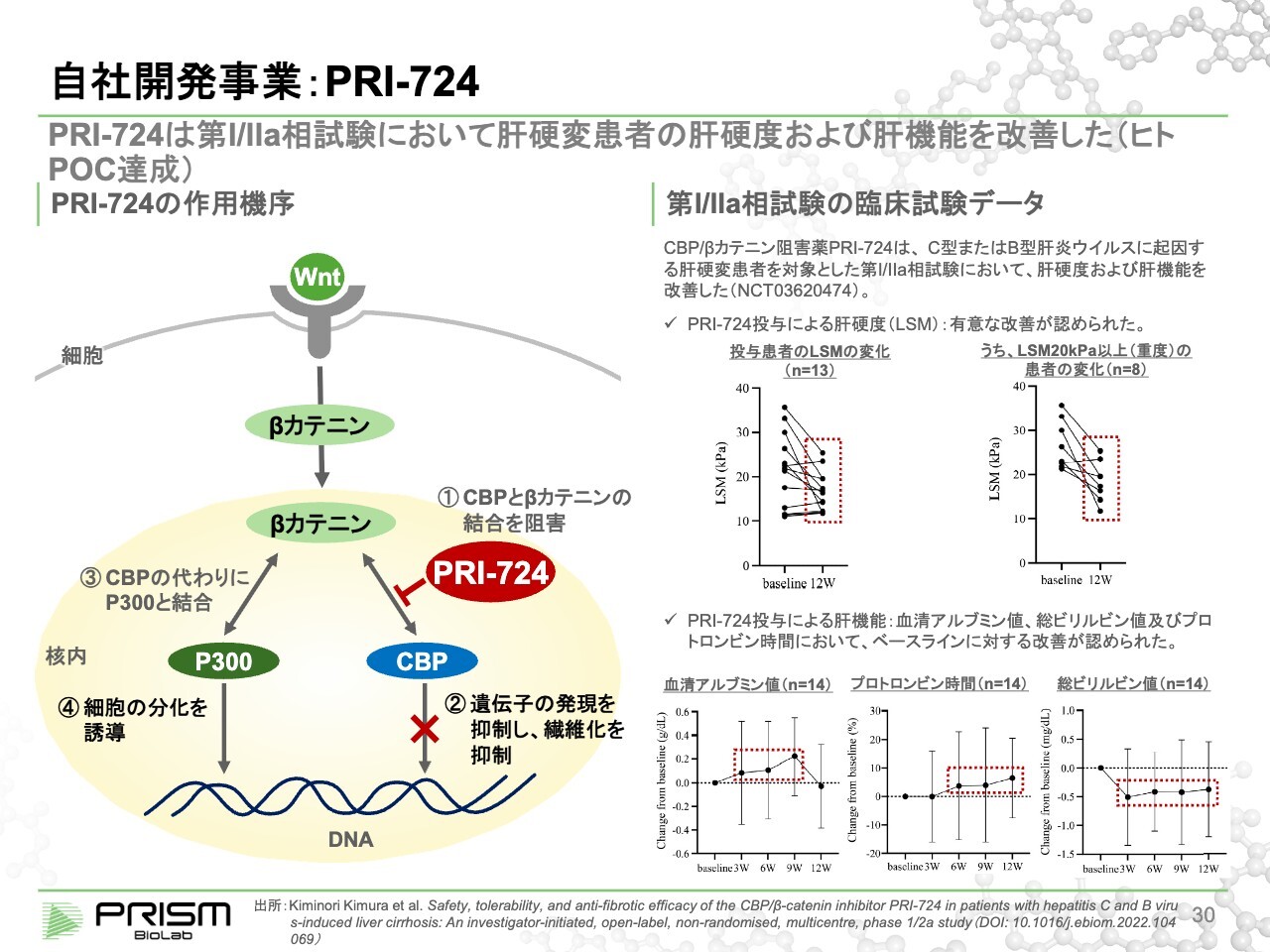
同様に、Wntパスウェイは線維症にも関係しており、肝臓の線維化を起こしてしまうパスウェイとなっています。こちらの「PRI-724」は、大原薬品工業にライセンスアウトしています。
LSM(Liver Stiffness Measurement)とは、肝臓の硬さを測る指標です。線維化が進み、肝臓が硬くなるのが肝硬変です。通常、LSM(肝硬度)は10未満ですが、肝硬変患者は20から30、40まで上昇します。
臨床試験において、「PRI-724」の3ヶ月の投与でかなり柔らかくなっており、線維化が元に戻りつつあることが示されています。肝機能の改善も見られることから、開発が進められています。
開発プロセスのイメージ:自社開発事業
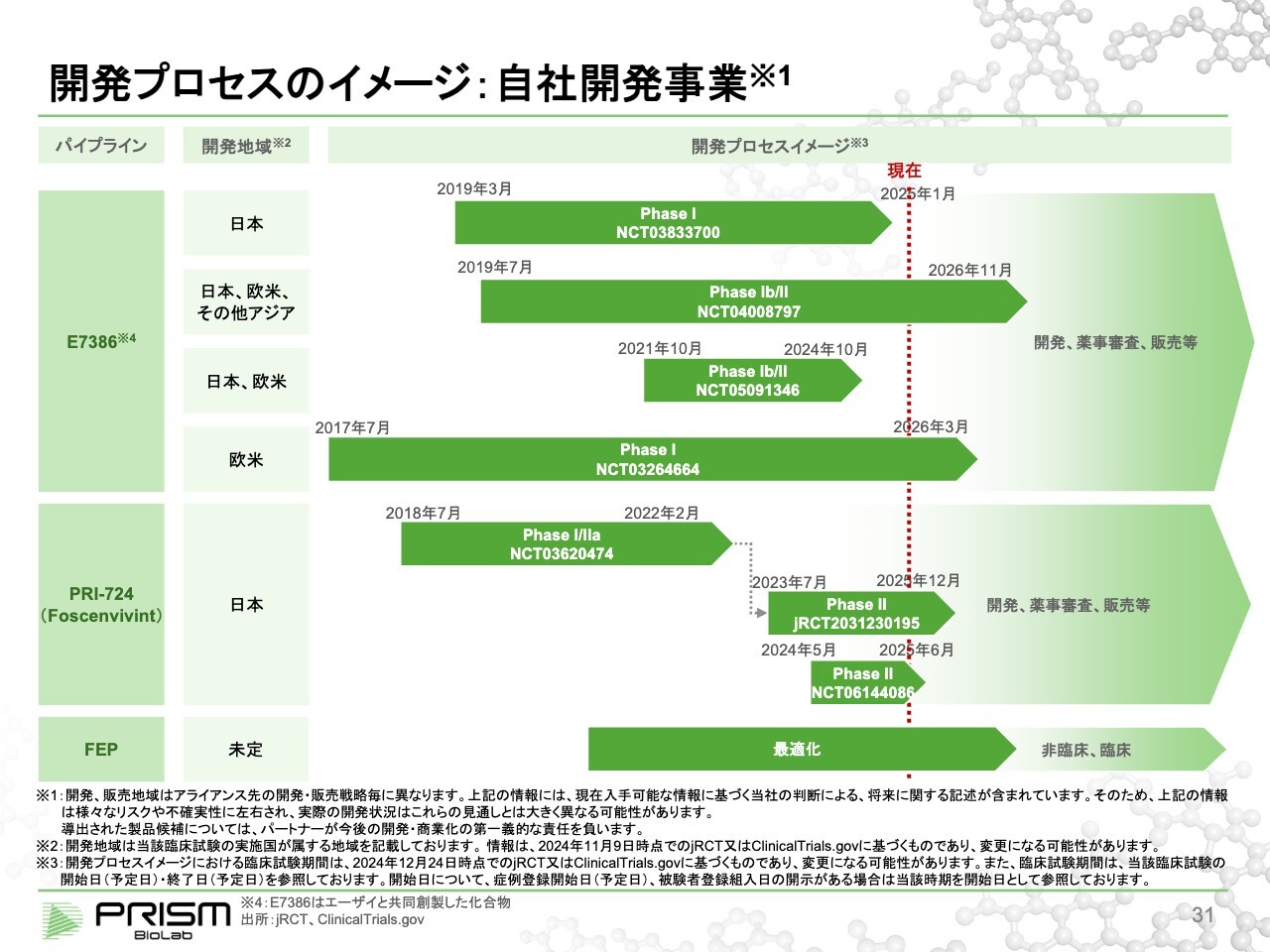
開発プロセスのイメージです。スライドに記載のとおり、さまざまな臨床試験を進めています。
共同開発事業:創薬共同研究

共同開発事業の状況です。現在、7社のパートナーと契約を締結しており、それぞれさまざまなステージで開発を進めています。秘密保持の関係で詳しくはご説明できませんが、進捗状況については、先ほどご説明した全体図でご理解いただければと思います。
創薬業界のパラダイムシフト

最後に、我々が目指しているのは新しい創薬領域を作ることです。
歴史的に見ると、薬の開発は天然物から始まり、単離した物質を薬にしたり、ヒトが合成した低分子医薬品もできました。20世紀は低分子医薬品の時代でしたが、世紀末にはタンパク医薬品・バイオ医薬品が誕生しました。これら技術革新のたびにたくさんの薬ができて、多くの治らなかった病気が治るようになってきました。
昔、がんは治らない病気でしたが、現在ではかなり治る病気になってきています。そのような中、我々は、低分子による細胞内タンパク阻害を制御することで、従来治らなかった病気のために新しい薬の領域を作り出していくことを目指しています。
このような新しい領域を作るには、これまでもバイオベンチャーが大きな役割を果たしており、新しい領域を作ったバイオベンチャーは飛躍的に成長しているといえます。
以上で、説明を終わります。ご清聴いただき、ありがとうございました。
質疑応答:探索中案件の進行状況について

司会者:「1案件について、前々四半期からリード化合物探索中の状態が続いていますが、次のステップに至るまでどのくらいの時間がかかるのでしょうか? また、他の2件のヒット探索中の案件についても、同様の時間がかかると考えてよい
新着ログ
「医薬品」のログ