大塚HD、グローバル4製品の伸長が連結業績に貢献 事業利益は修正計画を上回るペースで推移
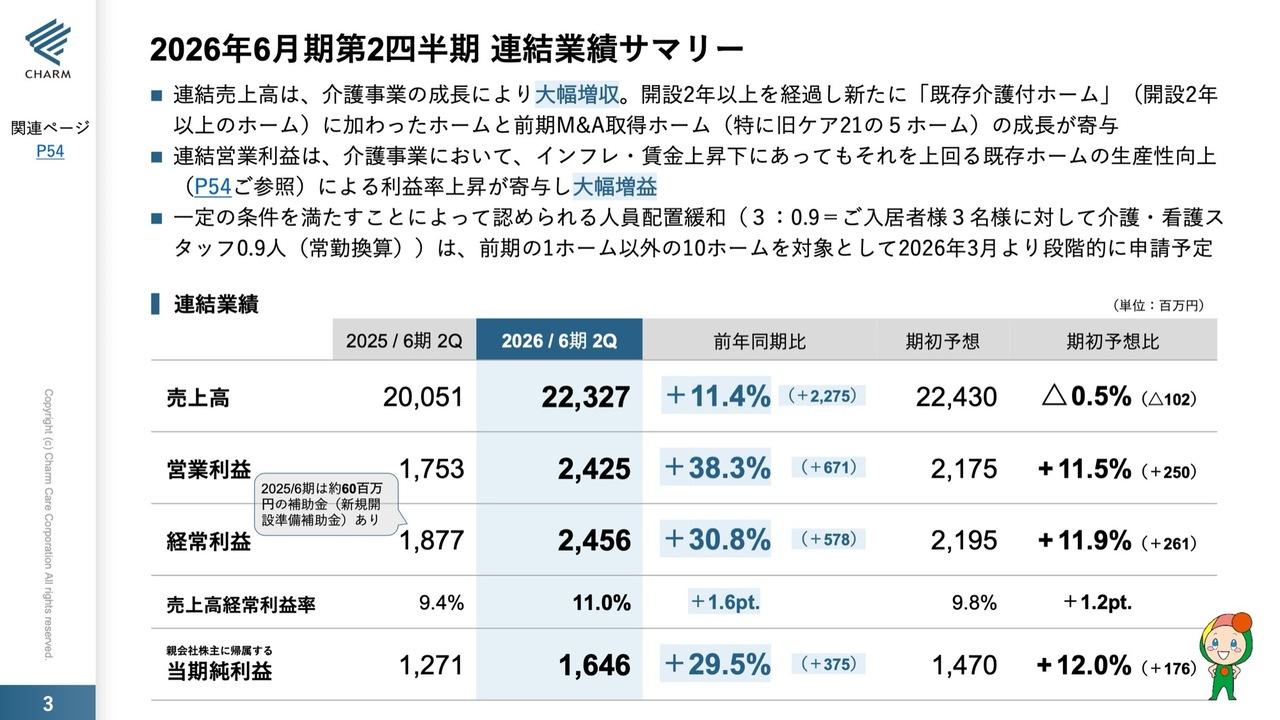
連結業績の概要|2019年度 第3四半期
牧野祐子氏:それでは、2019年度第3四半期の連結業績についてご説明します。4ページをご覧ください。
まずはじめに、2019年度第3四半期の連結業績の概要についてご説明します。医療関連事業におけるグローバル4製品は前期比37.5パーセントと引き続き増加し、連結業績に大きく貢献しております。
また、第3次中期経営計画における重要な業績目標の1つである研究開発費投資前事業利益は前期比プラス30.8パーセントで推移し、事業からの収益力は着実に向上していると確信しております。
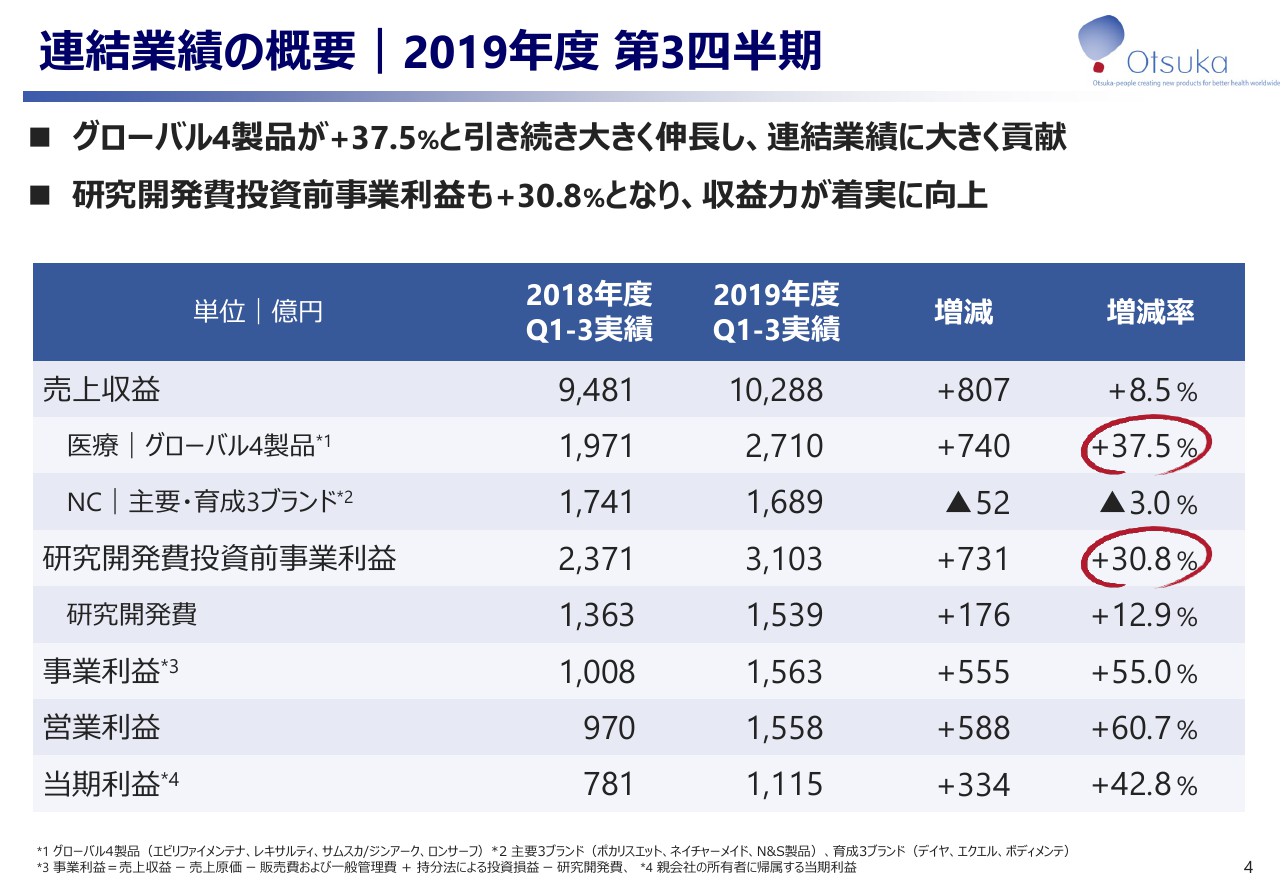
事業利益|2018Q1-3 vs 2019Q1-3
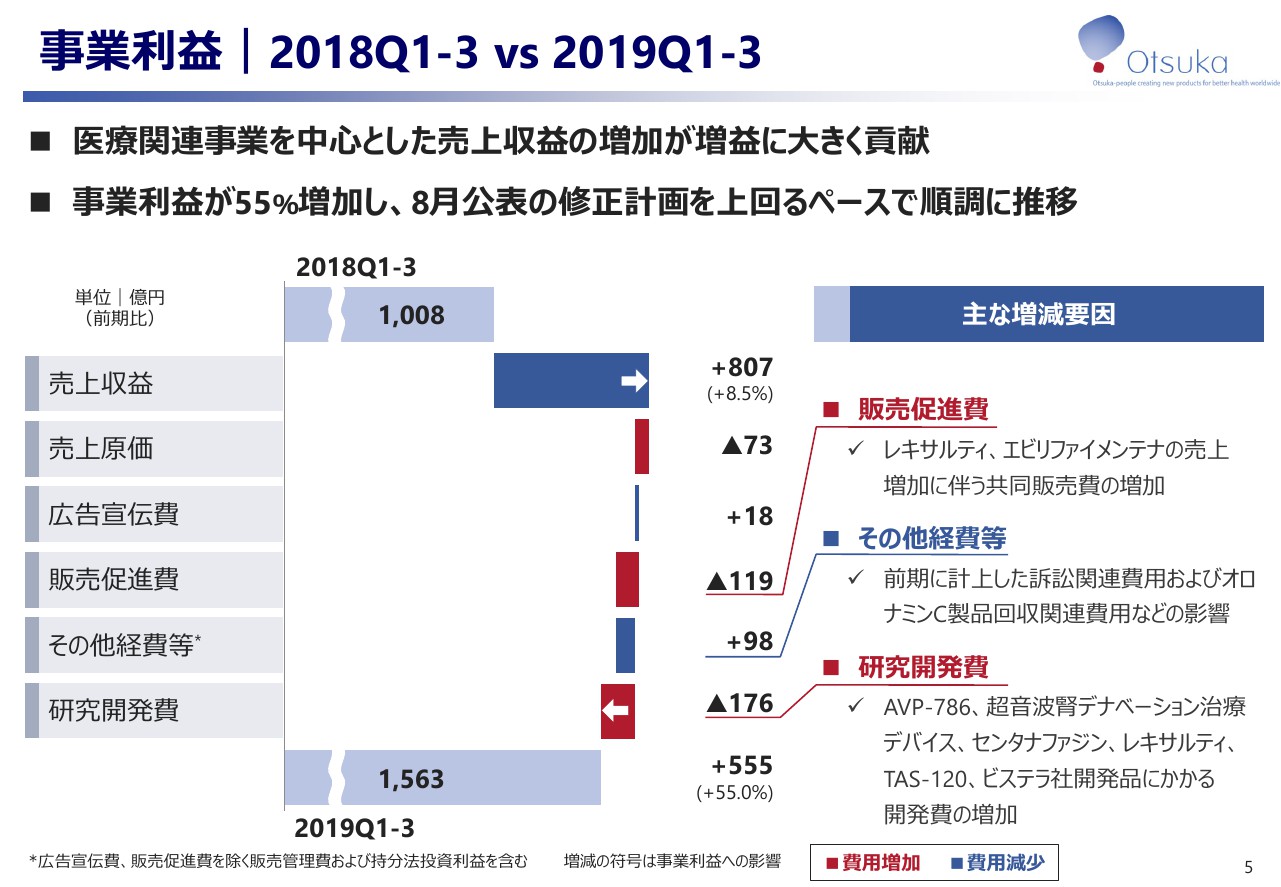
5ページのスライドは事業利益の前年との対比を示したものでございます。先ほどご説明したとおり、医療関連事業における自社創薬品であるグローバル4製品の貢献により売上収益が807億円増加いたしました。詳細は、後のスライドで事業別にご説明いたしますが、事業利益は55パーセント増加、1,563億円となり、8月に公表した修正計画を上回るペースで順調に推移しております。
連結業績の概要|事業セグメント別
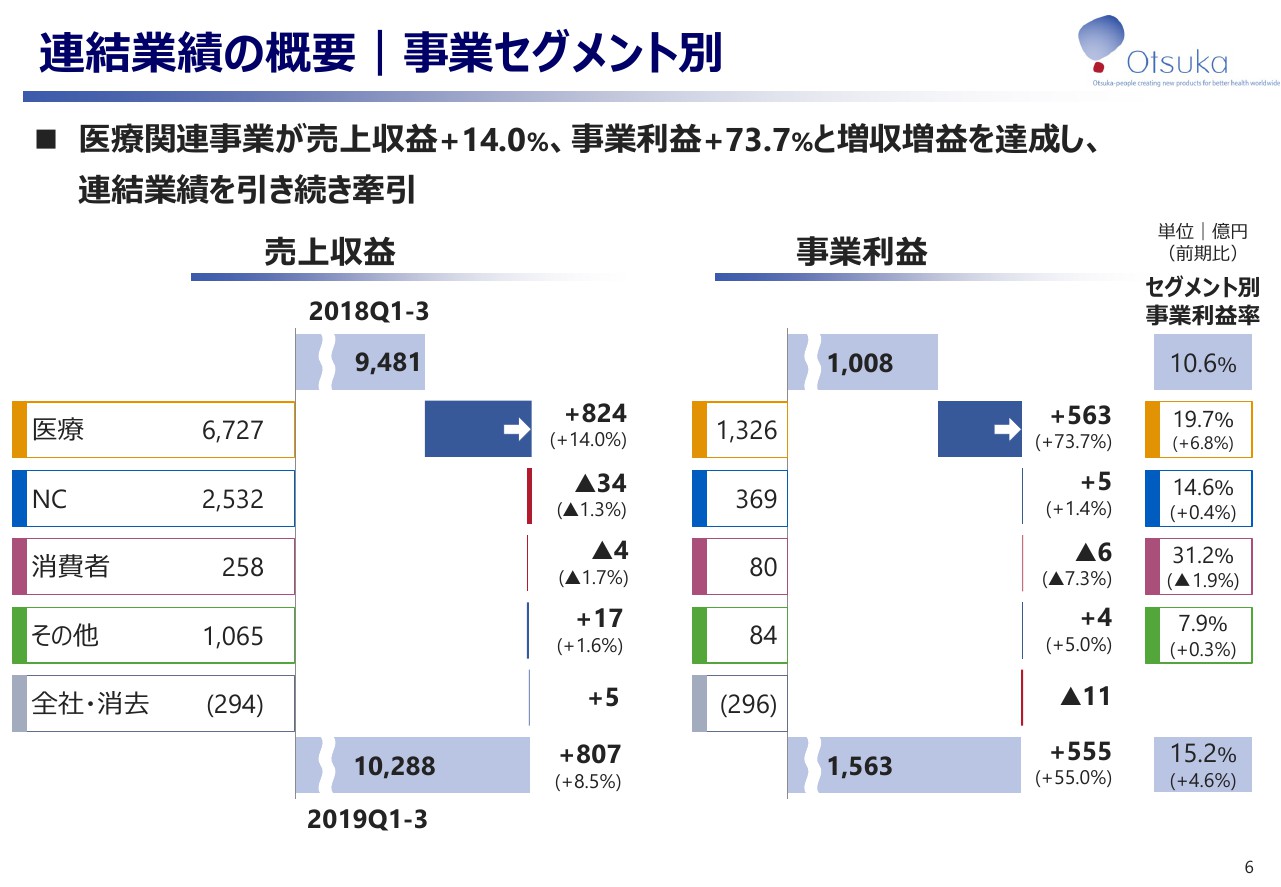
続きまして、事業セグメント別の売上収益、事業実績についてご説明します。医療関連事業が前期比で売上収益プラス14パーセント、事業利益プラス73.7パーセントと、増収増益を達成し、連結業績を引き続き牽引しております。
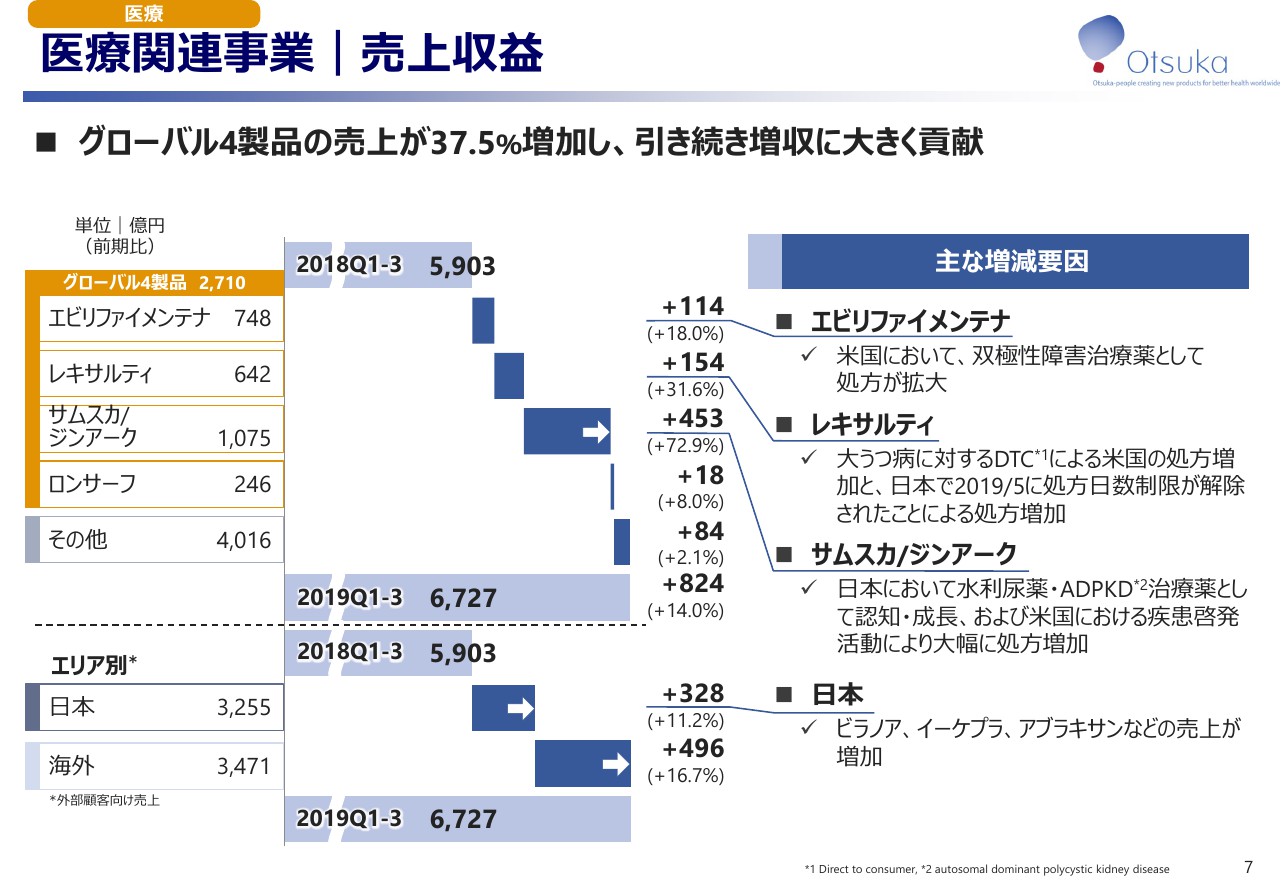
医療関連事業|売上収益
ここからは医療関連事業とNC関連事業についてご説明します。
まず医療関連事業の売上収益です。第3次中期経営計画における成長を牽引するグローバル4製品の売上は37.5パーセント増加して2,710億円となり、引き続き増収に大きく貢献いたしました。「エビリファイメンテナ」「レキサルティ」「サムスカ/ジンアーク」及び国内の医薬品が好調に推移していることが主な要因です。
中でも「ジンアーク」が業績を大きく牽引しており、その状況を次のページでご説明します。以上の結果、売上収益は14パーセント増加して6,727億円となりました。
ADPKD治療へのさらなる貢献と製品価値の最大化
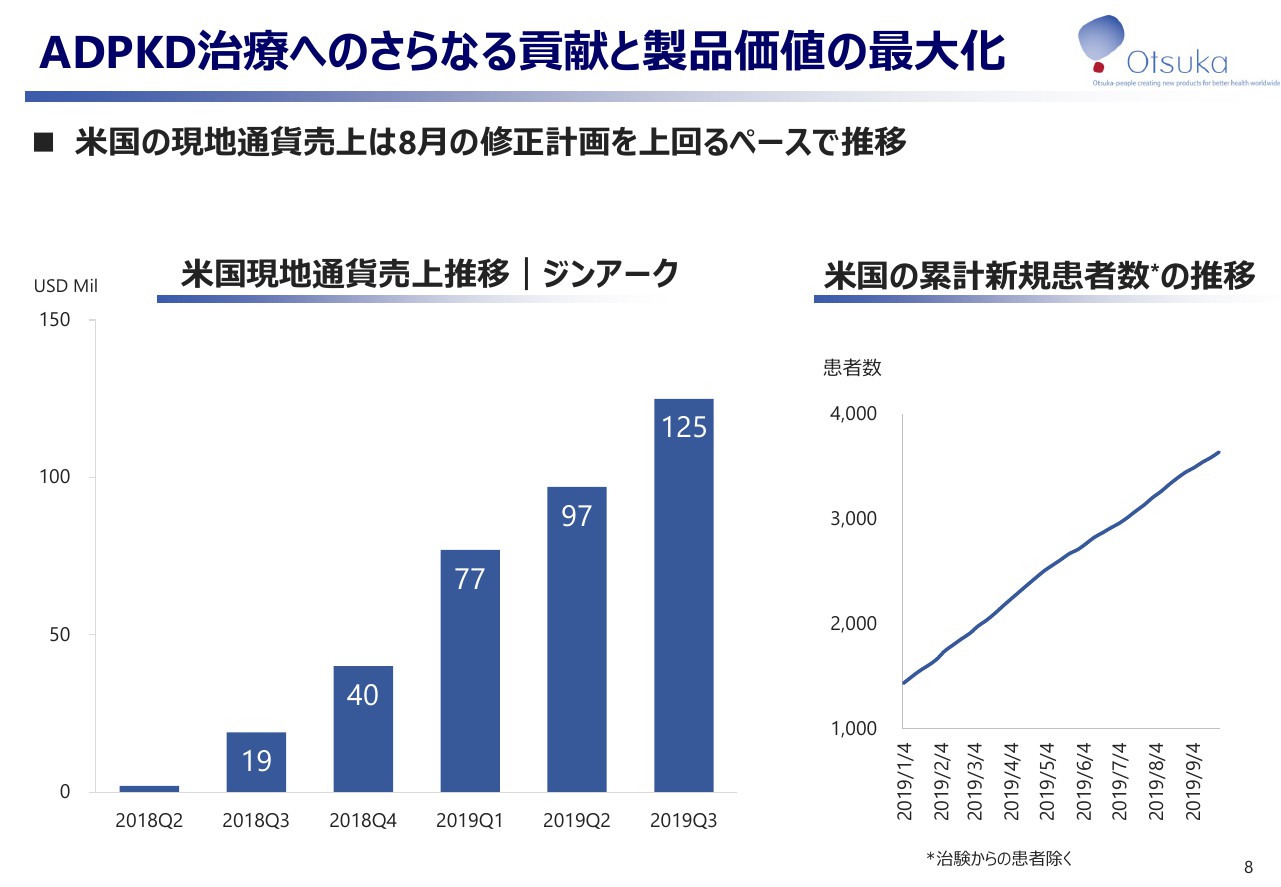
こちらが「ジンアーク」の状況です。四半期毎の米国現地通貨ベースの売上推移は上市した2018年以降拡大し、8月の修正計画を上回って順調に推移しております。また、月別の累計の新規患者数も順調に増加しております。
引き続き、ADPKD治療へのさらなる貢献と製品価値最大化を目指して確実な安全性対策を継続しつつ、疾患啓発と臨床データの情報提供活動等に取り組んでまいります。
医療関連事業|事業利益
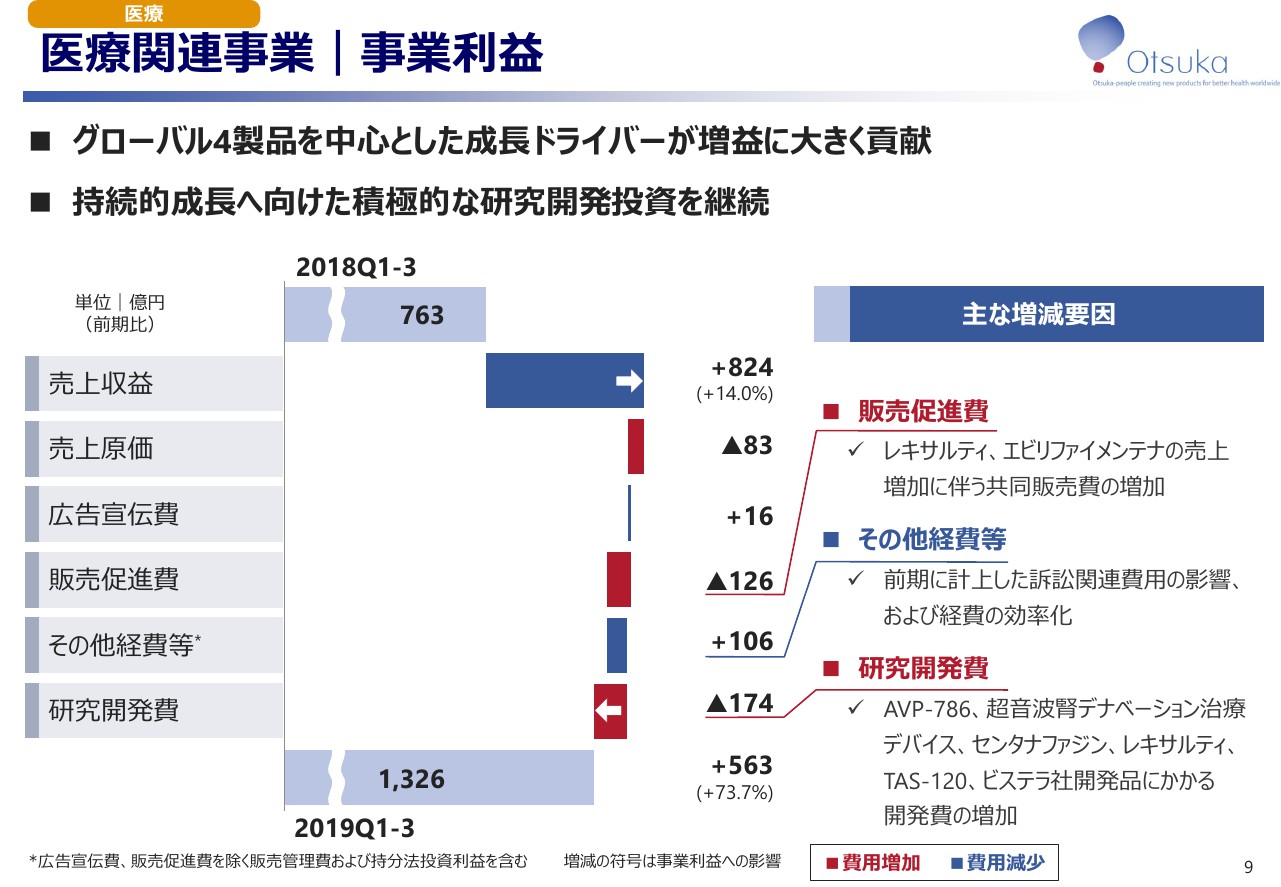
医療関連事業の事業利益についてご説明いたします。先ほどご説明したとおり、グローバル4製品の貢献によって売上収益が増加し、増益に大きく貢献いたしました。その他の経費等は前期の訴訟関連費用がなくなったこと、及び経費の効率化により増益要因となっております。
研究開発費では主に、「AVP -786」「超音波腎デナベーション治療デバイス」「センタナファジン」「レキサルティ」「TAS-120」およびビステラ社開発品の臨床試験に掛かる費用が増加いたしました。以上の結果、事業利益は73.7パーセント増加して1.326億円となりました。
NC関連事業|売上収益

ここからはNC関連事業の売上収益についてご説明いたします。機能性飲料等は、国内における2019年7月の天候不順の影響及び2018年の猛暑の反動によりカテゴリー全体の売上が減少いたしましたが、海外では各地域の特性やニーズに基づいたプロモーション活動による製品理解が進み、ポカリスエットなどの売上が増加しております。
機能性食品等は主に為替変動の影響によってN&S社の売上が減少しましたが、バリューチェーンを含む事業構造改革を推進しております。また、デイヤフーズ社のプラントベース食品の売上は順調に増加しております。
以上の結果から、NC関連事業の売上収益は前期比で1.3パーセント減少し、2,532億円となりましたが、為替影響を除きますと、前期比で微増しております。
NC関連事業|事業利益
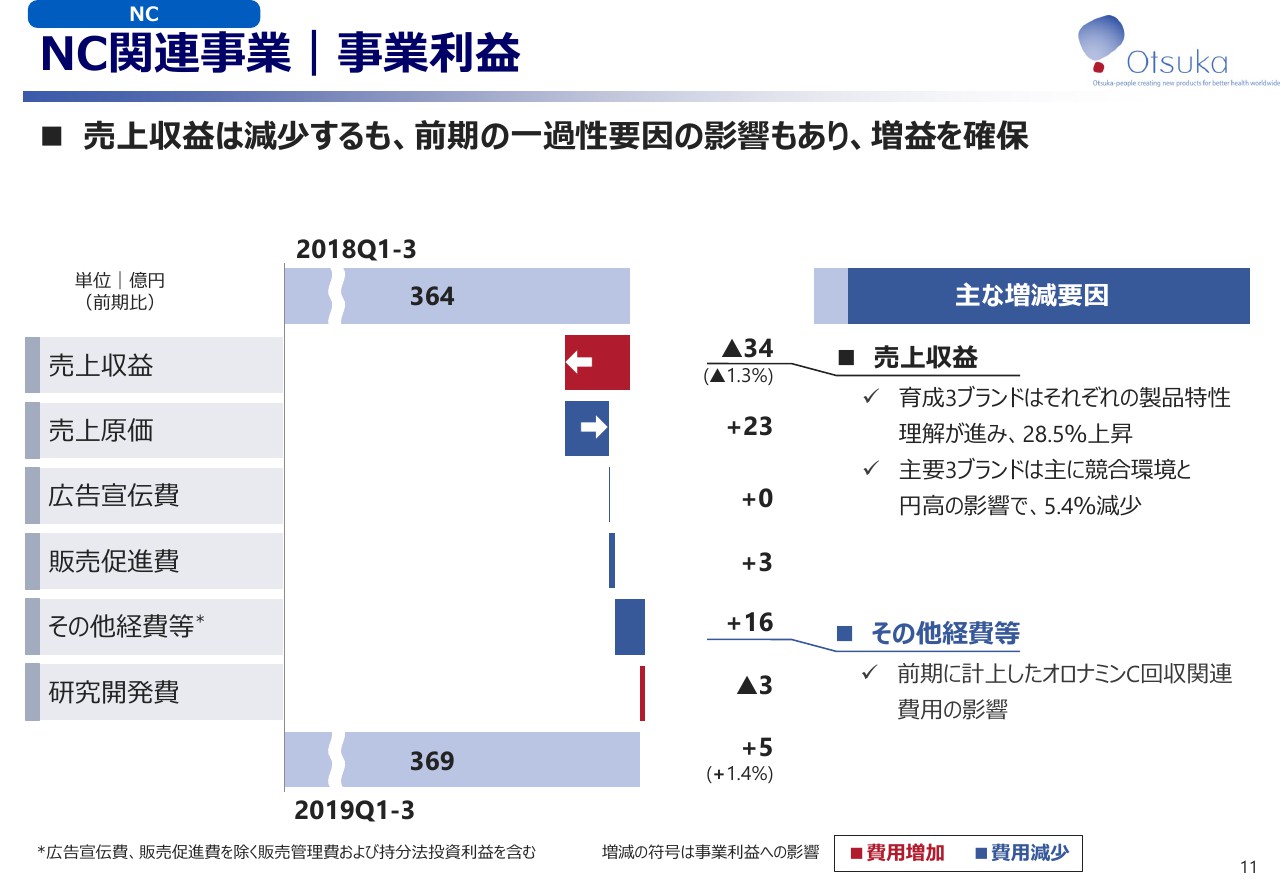
NC関連事業の事業利益の主な増減要因についてご説明いたします。4ページでもご説明したとおり、第3次中期経営計画で大きな貢献を予定している育成3ブランドはそれぞれの製品の特性理解が進み、売上は28.5パーセント上昇いたしましたが、主要3ブランドは、主に競合環境と円高の影響で売上が減少いたしました。
以上の結果、事業利益は前期比で1.4パーセント増加の369億円となりました。
2019年度 連結業績見通し
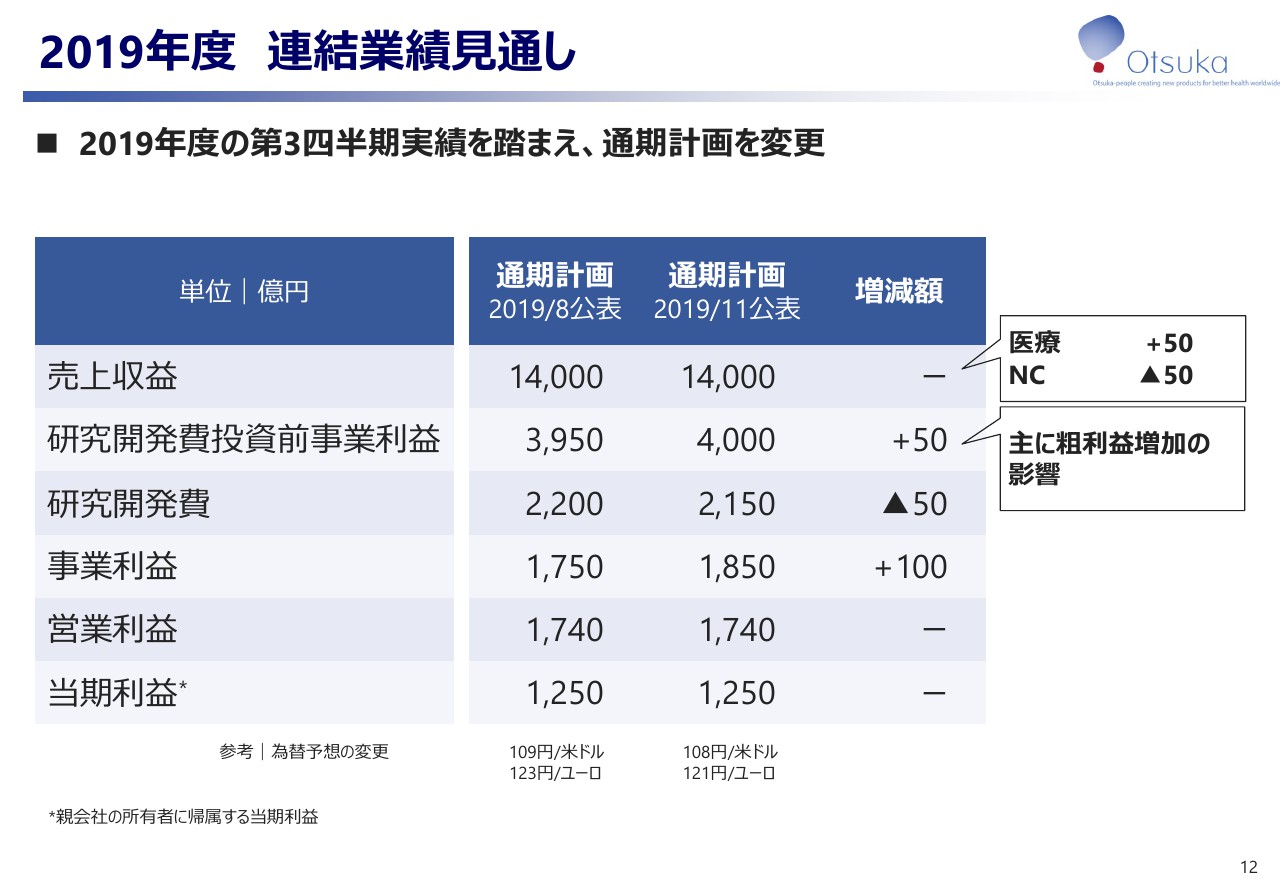
最後に2019年度の連結業績の見通しです。主に医療関連事業におけるグローバル4製品の売上収益、及び研究開発費を見直したことから、事業利益は8月の修正予想を100億円上回る見込みとなりました。
一方、第4四半期に有形固定資産などの減損損失が発生する可能性を考慮して、営業利益、当期利益は前回発表予想を据え置きました。
なお、「AVP-786」の開発継続を決定いたしました。現時点において、本件が当社2019年度の連結業績予想に与える影響はございません。以上、2019年度第3四半期の連結業績のご説明を申し上げました。ありがとうございました。
2019年度第3四半期における主な進捗(2019年9月末時点)
江村智博氏:続きまして、医薬品開発品目進捗状況について江村より説明申し上げます。それでは医療関連事業における開発品のアップデートについてご報告申し上げます。
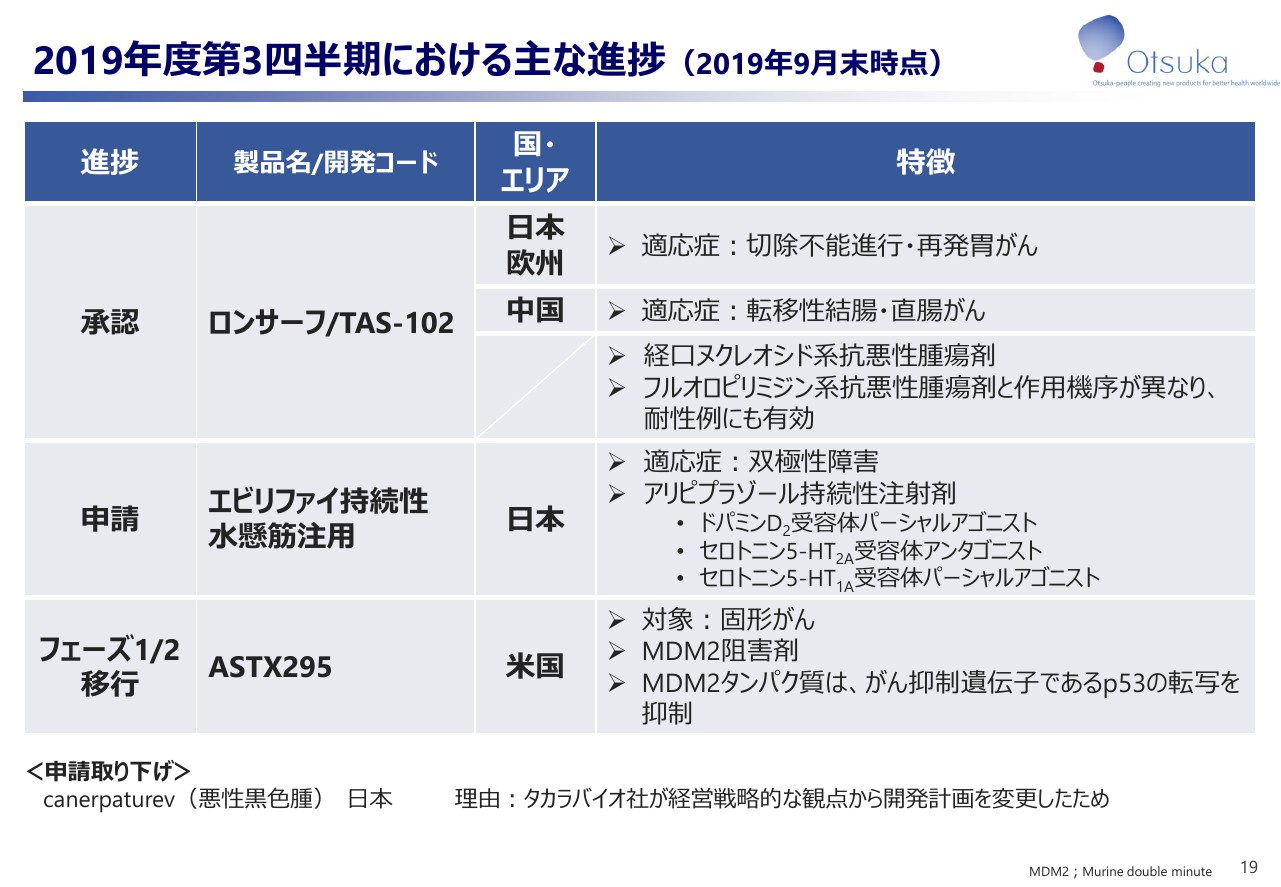
2019年9月末時点における開発品の主な進捗状況でございます。「ロンサーフ」は切除不能進行・再発胃がんの適応で2019年8月に日本、2019年9月に欧州で承認されました。2019年2月の米国承認に続き、これで日本、米国、欧州の3極で胃がんの承認を取得することができました。
また、日本では9月に胃がん治療ガイドライン速報版がWeb公開され、切除不能進行・再発胃がんの3次治療以降の選択肢として、ロンサーフが推奨度Aとして追加されました。
結腸・直腸がんの進捗状況といたしまして、中国にて8月に「フルオロピリミジン」「オキサリプラチン」系抗悪性腫瘍剤の治療歴を有する転移性結腸・直腸がん患者への適応で承認を取得いたしました。
「エビリファイ持続性水懸筋注用」は日本にて9月、双極性障害における気分エピソードの再発・再燃抑制の適応で申請いたしました。双極性障害は長期にわたる治療が必要で、持続性注射剤である同剤は患者さんに安定した治療効果をもたらすことが期待されます。
「ASTX295」は、米国にて7月、固形がんを対象にフェーズ1、2試験を開始いたしました。本剤はアステックス社が創生したMDM2阻害剤です。MDM2はがん抑制遺伝子のp53を制御するタンパク質で、MDM2を阻害することでp53を活性化いたします。本試験では諸試験で得た治験を基に本剤の特性を見極めてまいります。
canerpaturevは、9月に日本での悪性黒色腫の申請をタカラバイオ社が経営戦略的な観点から開発計画を変更したのに伴い、取り下げいたしました。
トピックス TAS-115(その他領域)
20ページをご覧ください。
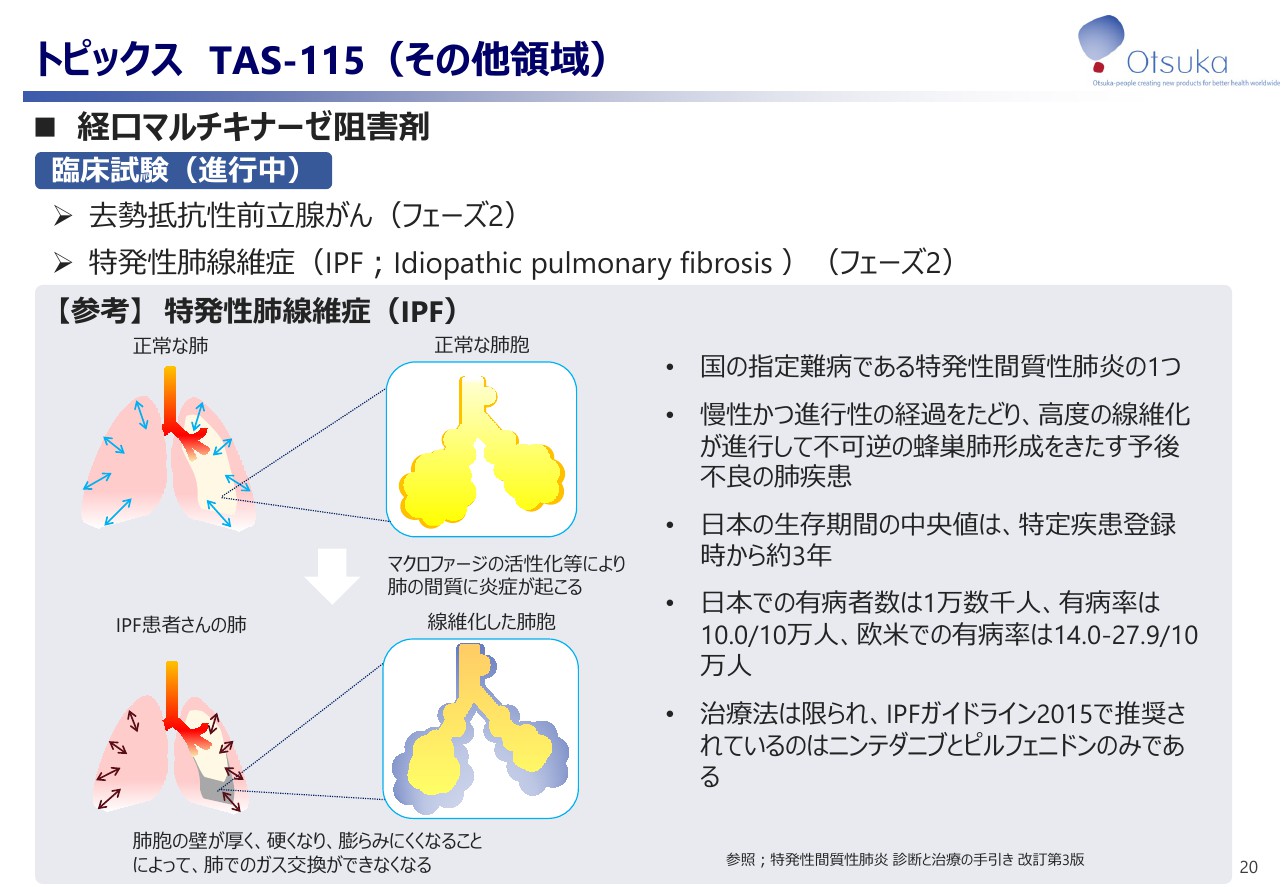
トピックスといたしまして「TAS -115」についてご紹介いたします。本剤は、第2世代のマルチキナーゼ阻害剤として開発を進めており、現在、去勢抵抗性前立腺がんと特発性肺線維症の2つのフェーズ2試験を実施しております。その内、本日は特発性肺線維症に対する状況についてご紹介いたします。
特発性肺線維症は国が指定する難病である特発性間質性肺炎の一つで、慢性かつ進行性の経過を辿り、高度の線維化が進行して不可逆の蜂巣肺形成をきたす予後不良の肺疾患で、日本における生存期間の中央値は特製疾患登録時から約3年と、進行がん同様に予後不良の肺疾患でございます。
日本での有病者数は1万数千人、有病率は人口10万人に対し10人程度と言われております。また、治療法は極めて限られており、IPFガイドライン2015年版で推奨されているのは、現在のところ「ニンテダニブ」と「ピルフェニドン」のみとなっております。
トピックス TAS-115(その他領域)
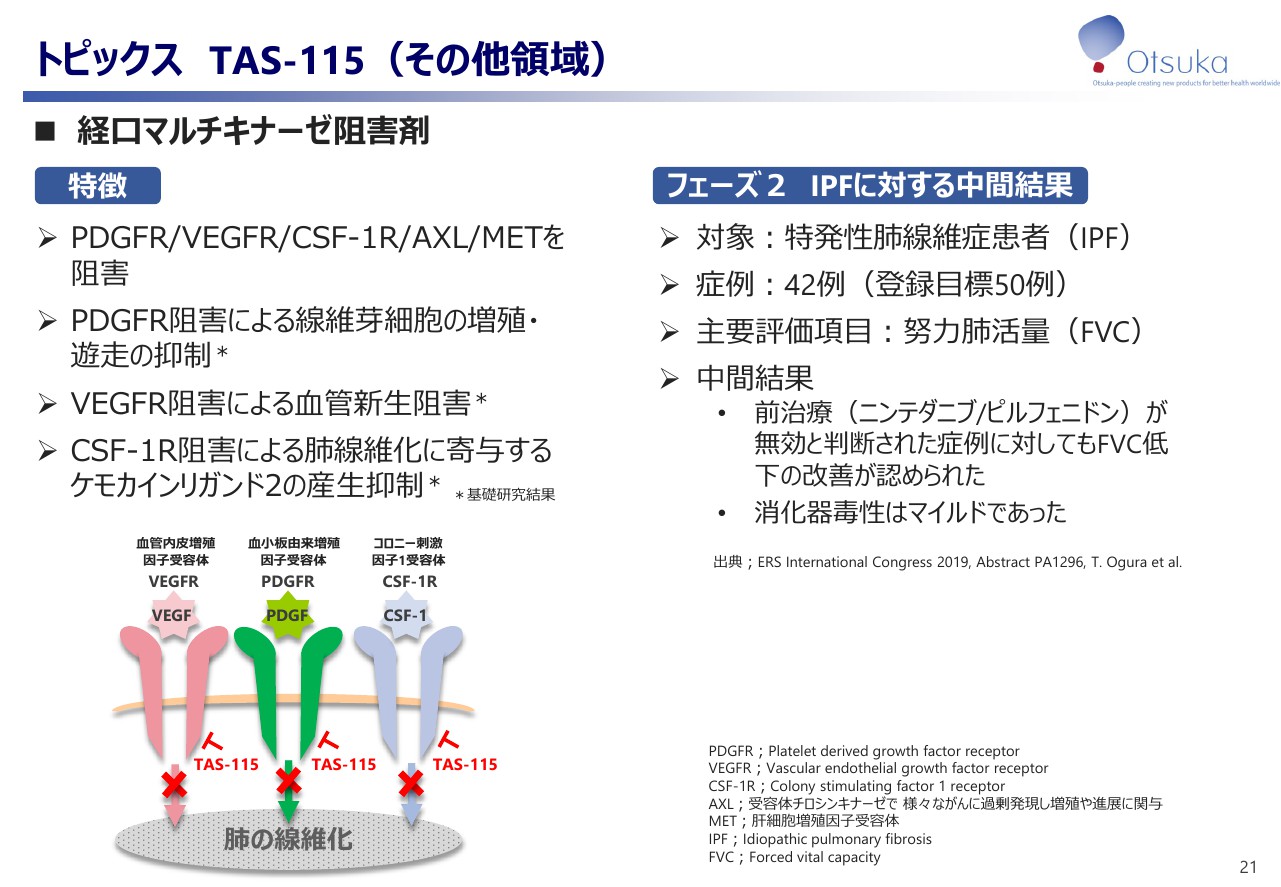
「TAS -115」は経口マルチキナーゼ阻害剤で、採用機序の特徴といたしまして「PDGFR」「VEGFR」等に対する阻害が確認されております。特発性肺線維症という疾患に対しては、線維芽細胞の抑制が重要な役割をすると考えられております。その機序といたしまして「PDGFR」阻害がキーとなりますが、加えまして「VEGFR」阻害による欠陥阻害作用及び「CSF-1R」阻害によるケモカインの産生抑制が総合的に線維化を抑制していると考えられています。
フェーズ2試験の中間結果では、前治療の「ニンテタニブ」または「ピルフェニドン」が無効と判断した症例に対しても努力肺活量低下の改善が認められました。また、既存薬の課題である消化器毒性は比較的マイルドでした。本試験の最終結果をもちまして、現在次のステップに進めるための準備を開始しております。
重要開発品のフェーズ3試験 終了予定時期
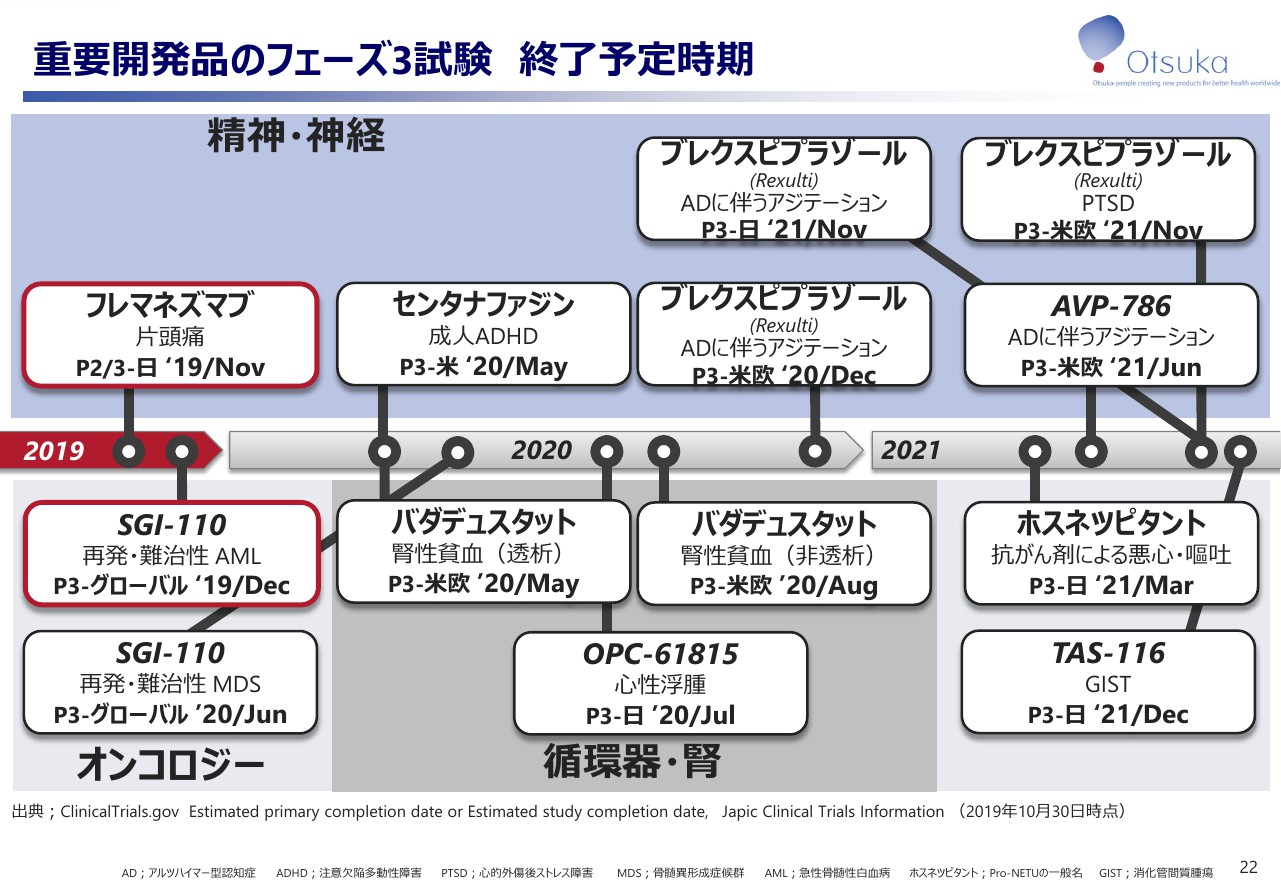
重要な開発品のフェーズ3試験の終了予定時期をお示しします。左側の赤い枠で囲んだ試験は2019年中に終了を予定しています。尚、ここに示す「AVP–786」の305試験につきましては、本日の適時開示報告どおり引き続き進めてまいります。
2019年度の主な申請・フェーズ3移行プロジェクト進捗
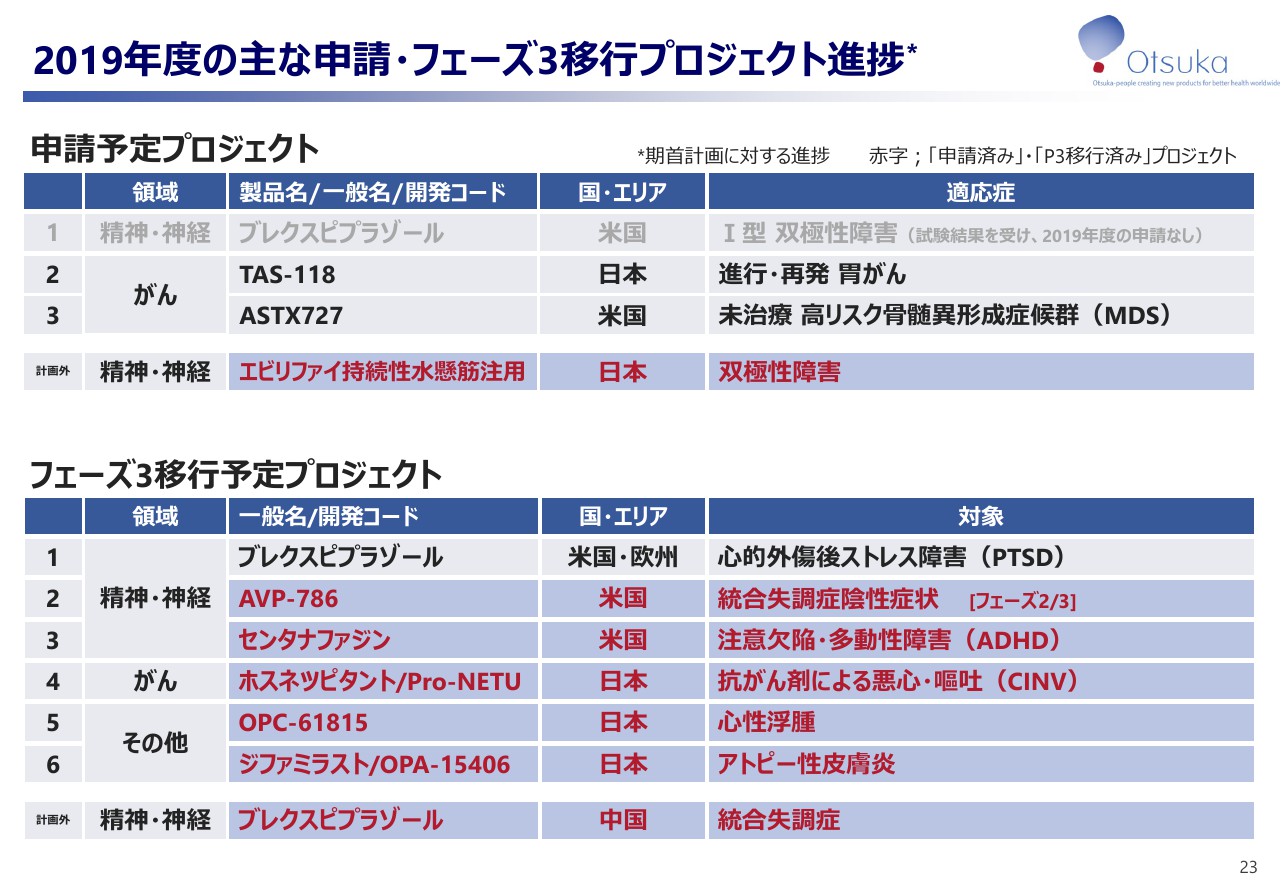
2019年度に予定している主な申請及びフェーズ3移行プロジェクトの進捗状況をお示しします。赤字は今季中に移行したプロジェクトでございます。「ブレクスピプラゾール」はPTSDに対するフェーズ3試験を2019年10月に開始いたしました。本件につきましては、第4四半期決算時に改めてご報告申し上げます。
以上、医療関連事業の開発状況についてご報告申し上げました。どうもありがとうございました。
新着ログ
「医薬品」のログ