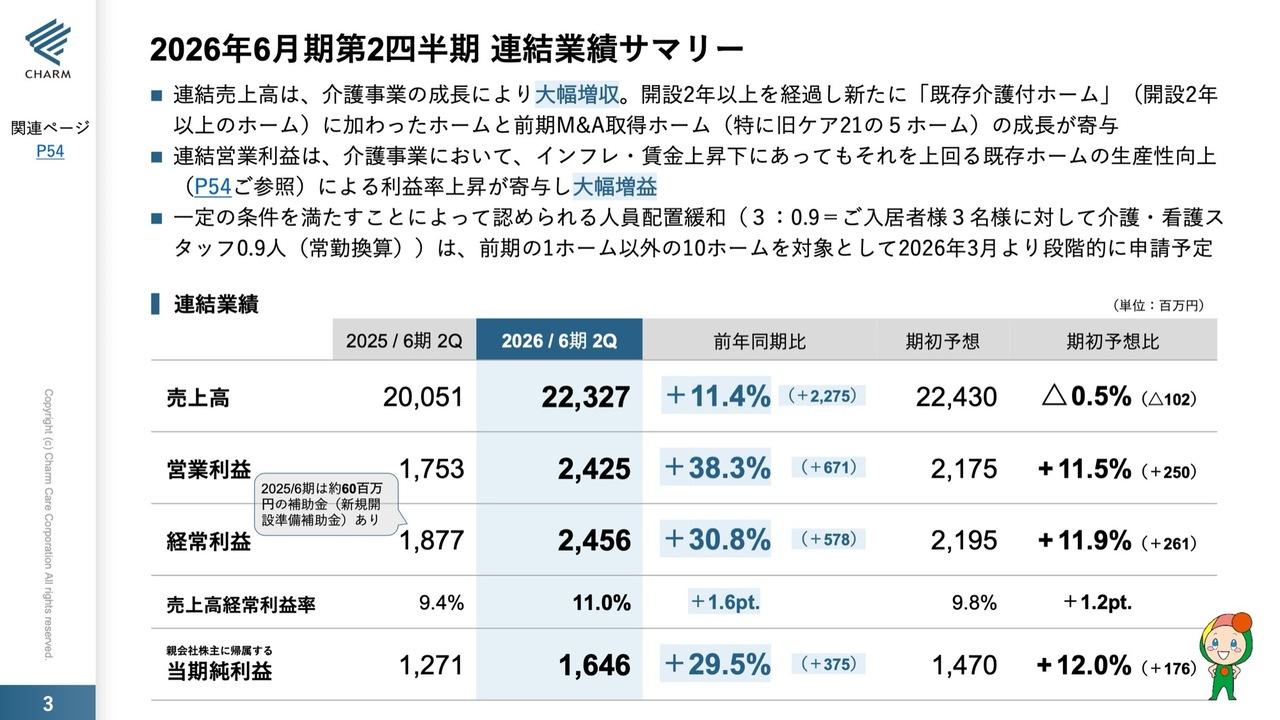
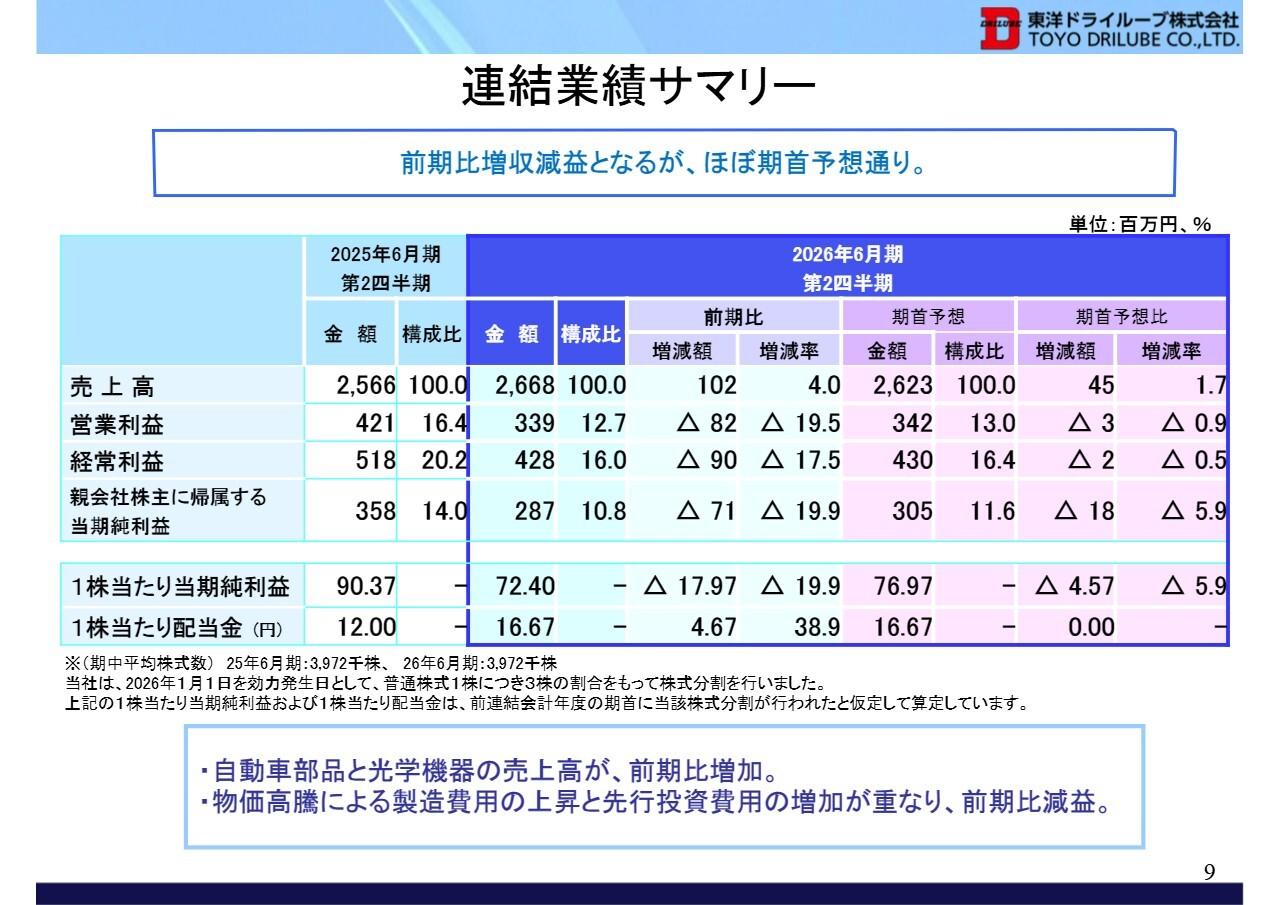
リプロセル、通期は検査項目の保険収載等で売上が伸長 研究支援を拡大し21年度の黒字化を目指す
2019年3月期トピックス

横山周史氏:約半年ぶりの決算説明会です。本日はお足元が悪い中ご足労いただき、誠にありがとうございます。今回は、メディカルも含めてすべて私からご説明いたします。いつもと同じように、前半に定性的な部分、後半に決算数字をご説明いたします。
まず、2019年3月期トピックスということで、全体の定性的な動きをまとめております。全体としては、大きく2つのイベントがございました。
1つは、BioServe India社の買収によるインドへの進出です。現時点ではREPROCELL Indiaへと名前を変えております。地域的にインドに進出したことに加えて、彼らが提供しているゲノム解析の技術を事業として取り入れたことが、1つの大きな特徴です。
もう1つは、同じくゲノムですが、ゲノム編集です。株式会社GenAhead Bioというベンチャー企業と新たに業務提携をいたしまして、ゲノム編集のビジネスを立ち上げました。
研究支援事業に関しては、日本・アメリカ・ヨーロッパの3拠点でiPSのラボを立ち上げ、それぞれの地域で独自のサービスをスタートさせることができました。また、iPS細胞のゲノム編集ビジネスを2018年10月からスタートいたしました。さらに、次世代シーケンシングを使った遺伝子解析サービスもスタートいたしました。
研究支援に関しては後ほど詳しくご説明しますが、もともと我々はiPSから始まり、生体試料バンクなど、生体試料を使った創薬応用をいろいろと進めてまいりました。ただ、いままでゲノムは手がけていませんでしたので、この2つを加えたことで、我々の事業ポートフォリオが非常に大きく広がっております。
続いて、メディカル事業です。まず、台湾から導入した体性幹細胞の細胞医薬品「ステムカイマル®」の治験計画がPMDAを通過いたしました。また、すでにオーファン(ドラッグ)にも指定されておりますので、現在、国のバックアップを得ながら、治験に進めようとしているところです。
2つ目のパイプラインであるiPS由来の再生医療では、iPSから神経グリア細胞をつくり、ALSおよび横断性脊髄炎の2つの疾患の治療を目指しています。こちらはまだ臨床ではなく、もう少し前段階の動物を使った前臨床に進んでいます。
これと関連して、iPSの再生医療を本格的に進めるということで、川崎市の殿町地区にあるライフイノベーションセンターに、GMPの施設であるリプロセル再生医療センターを立ち上げ、こちらでiPSおよびグリア細胞の治験薬の製造を行う準備を整えております。
最後に、いままで臨床検査を10年近く行ってきましたが、2018年4月から当社の検査項目がようやく保険収載され、売上が大幅に伸びました。
REPROCELLグループ

当社の現時点での会社の全体像です。大きな特徴は、日本だけでなく、アメリカ・ヨーロッパ・インドをあわせた4拠点で、グローバルにビジネスを展開していることです。
社員の構成は、日本が37人、アメリカ・イギリス・インドを含めると121人ということで、かなりグローバルな人員構成となっております。
それぞれの拠点で、ラボとオフィスの両方の機能がありますので、単なる販売拠点というわけではありません。それぞれの拠点で、それぞれのR&Dがあり、製造があり、そして販売網があります。
リプロセルの基本成長戦略

リプロセルの基本成長戦略です。少しコンセプチュアルな話ですが、創業以来15年以上、まったく変えていない成長戦略で、脈々とこの戦略で事業を進めております。
1つ目は、「積極的なグローバル化の推進」です。先ほどご説明したように、すでに日本・アメリカ・ヨーロッパ・インドで事業展開しております。我々の市場は、やはり日本だけでは非常に小さく、ライフサイエンスの分野では、日本は世界の約7パーセントと、10パーセント以下の市場しかありません。大きな市場を目指していくということで、一番大きなアメリカ、それに続くヨーロッパを中心に展開しております。
2つ目は、「研究支援とメディカルによる持続的な成長シナリオ」です。実は、こちらも創業以来変わっておりません。まずは、規制の少ない研究支援ビジネスを早期に立ち上げて収益を回していきながら、規制のある再生医療を立ち上げて、急激に売上を伸ばしていこうということで、この2つをハイブリッドで組み合わせるところが、我々の基本戦略です。
3つ目は、「最先端技術による技術優位性の確保」です。学術的にも開発競争が非常に厳しい分野ですので、一歩踏み間違えて遅れてしまうと、すぐにいま持っている技術が陳腐化するリスクがございます。このリスクを回避するために、我々は自社開発にこだわらず、他社との連携、そして大学からの技術導入を含め、常に最先端の技術を取り入れるかたちで開発を行っています。
iPS細胞について
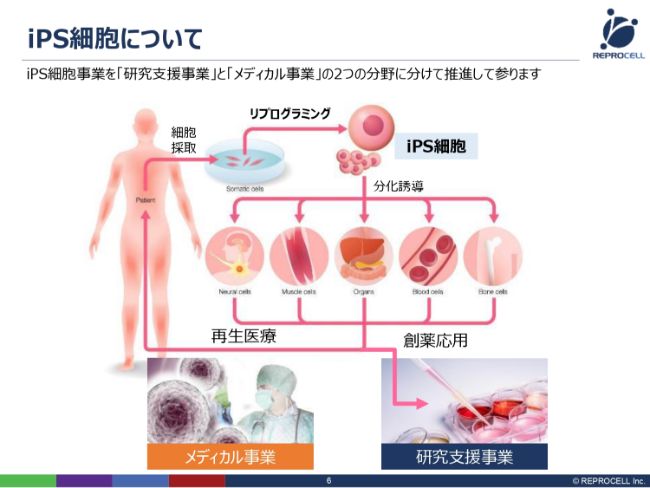
ここからは事業のお話しになります。まず、iPS細胞についてです。ご存知のように、ヒトの血液や皮膚から(細胞を)採って、山中(伸弥)先生の発明された因子を加えることで、リプログラミングが起こってiPS細胞ができます。
もともとは皮膚の細胞からつくっていましたが、我々の技術でいうと、最近では尿から(つくることができます)。実は、尿には細胞がほんの少し含まれておりまして、そのほんの少しの細胞を採って、尿からiPS細胞をつくれるようになってきています。そういう意味では、非常に進化しています。
また、リプログラミングには、実はいろいろな方法があります。(iPS細胞が報告されてから)かれこれ10年以上経っておりますが、我々はRNA(リプログラミング法)という最先端の技術を使っております。これは、がん化のリスクが非常に抑制されるという画期的な技術です。
iPS細胞をさまざまに分化誘導して、再生医療または創薬応用に持っていくわけですが、我々は、再生医療に持っていくメディカル事業、創薬応用に持っていく研究支援事業の両方に、ビジネスとして取り組んでいます。
再生医療に関しては、昨今、理化学研究所の高橋(政代)先生による網膜再生や、京都大学の高橋淳先生によるパーキンソン病など、実際にヒトにiPS由来の細胞が投与される臨床研究や治験が行われるようになってきております。10年前までは本当に夢物語のようなところがありましたが、再生医療がいよいよ本格化しつつあります。
創薬応用に関しては、我々としても、多くの製薬企業さんで、さまざまな用途で使われ出してきていることを、日本だけでなくアメリカ・ヨーロッパを含めて実感しています。
我々は非常に長い間、iPSに取り組んでいますが、昔から考えると、かなり実用化が進んできたなというのが私の印象です。
事業セグメントと成長戦略
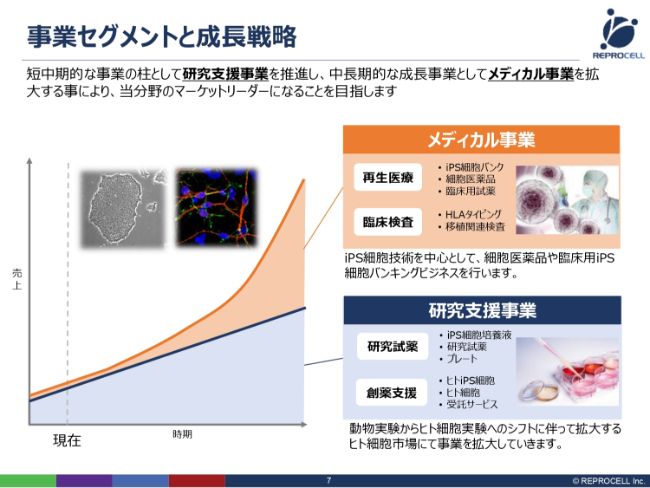
(スライドの図は)メディカル事業と研究支援事業の2つをビジネス的に組み合わせて、どのように売上を上げていくかを時系列で示したものです。
まず、研究支援事業は、対象となるお客さまが、大学の研究者もしくは製薬企業の研究者のみなさまです。そこに、研究用の試薬や細胞、そしてサービスを提供するモデルです。基本的に大きな規制はありませんので、短期に新しい技術を新しいビジネスに変えて売りに出せます。現在、我々の売上の約80パーセント以上は研究支援事業から上がっておりますので、こちらを順調に伸ばしていきたいと考えています。
ただ、基本的には研究支援なので、短期で10倍、100倍になるような市場規模ではありません。そういう意味では、着実にビジネスを進めていくというのが、こちらの研究支援事業ビジネスです。
もう1つのメディカル事業は、iPSもしくは体性幹細胞を中心とした再生医療を考えていますが、こちらに関しては、どちらかというと規制があります。薬事法や再生医療新法があり、そこで国の認可が得られれば一気に売りに出して、急速に売上を立ち上げます。認可までにはどうしても時間がかかりますが、認可を得た瞬間に急速に立ち上がるというビジネスモデルです。
このように、短期的・中期的な研究支援事業、そして中期的・長期的なメディカル事業の2つをハイブリッドでうまく組み合わせることで、継続的な成長を遂げてまいります。
リプロセルの技術プラットフォーム

続いて、3つ目の軸である技術プラットフォームです。かなり細かい話になりますが、もともと我々はiPS細胞の会社としてスタートしました。そして、アメリカの会社を買収することで生体試料のバンクを手に入れ、イギリスの会社を買収することでヒト組織を用いた薬剤応答の技術や3次元組織モデルの技術を手に入れてまいりました。これらはすべて、技術的にシナジーがあり、例えば、生体バンクを使ってiPS細胞をつくることができるようになります。
加えて、当事業年度に関しては、株式会社GenAhead Bioさんと共同でゲノム編集のビジネスをスタートし、さらにインド企業の買収により次世代シーケエンスによる遺伝子解析技術も手に入れました。
いままで、我々は遺伝子にはあまり取り組んできませんでしたが、今年度から大きくスタートさせました。これだけさまざまな技術プラットフォームを持っている会社は、グローバルでもかなり珍しいと思います。
世界的な研究ネットワーク

我々は、もともと京都大学の中辻(憲夫)先生、東京大学の中内(啓光)先生のお二人がファウンダーとなり設立した会社です。このお二人だけにとどまらず、さまざまな日本の先生、海外の先生と一緒に技術を広げてきました。
後ほどご説明しますが、最近ではMahendra Rao先生と一緒にジョイントベンチャーを立ち上げて、iPSのグリア細胞の再生医療を積極的に進めております。
動物実験からヒト細胞を使った実験へ
それでは、研究支援事業とメディカル事業について、具体的にご説明いたします。まず、研究支援事業です。研究支援事業では、基本的にヒト細胞を使った実験に対して、さまざまなサービス・製品を提供していきます。
大雑把にいいますと、いままでは製薬メーカーで動物実験が多用されてきましたが、ヒト細胞を使った実験に置き換えていこうという大きなトレンドがあり、この中で先回りして、さまざまな技術を構築し、豊富なサービス・製品を提供するということが、我々の研究支援ビジネスの基本的なコンセプトです。
研究支援事業の市場規模
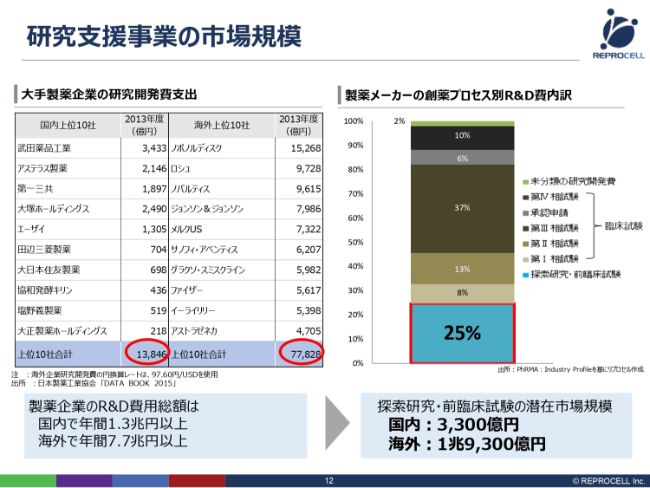
研究支援事業の市場規模についてです。(スライドの表は)古いデータですが、日本国内および海外の大手製薬企業10社のR&D費(研究開発費)を並べたものです。
上位10社を足すと、日本では約1兆3,000億円、海外では約7兆7,000億円になります。もちろんR&D費用全額が我々の市場規模というわけではなく、このうちの一部になります。我々(のサービス・製品)が使われる探索研究であったり、前臨床試験……これは動物の試験ですが、これらの市場となると、製薬メーカーさんのR&D費用全体のうち、約25パーセントが相当します。
したがって、こちらの数字に25パーセントを掛けたもの、つまり3,300億円あるいは1兆9,000億円が、潜在的な市場規模ということになります。もちろんすべてというわけではなく、この何分の1なり10パーセントなりといったところが実際の市場規模になるかなと思っております。
ここで1つ注目していただきたいのは、やはり海外の会社の方がR&D費用が大きいということです。そういう意味では、やはりアメリカ・ヨーロッパの大きなR&D費用を拠出している会社が、我々の主戦場になります。
研究支援事業における成長戦略
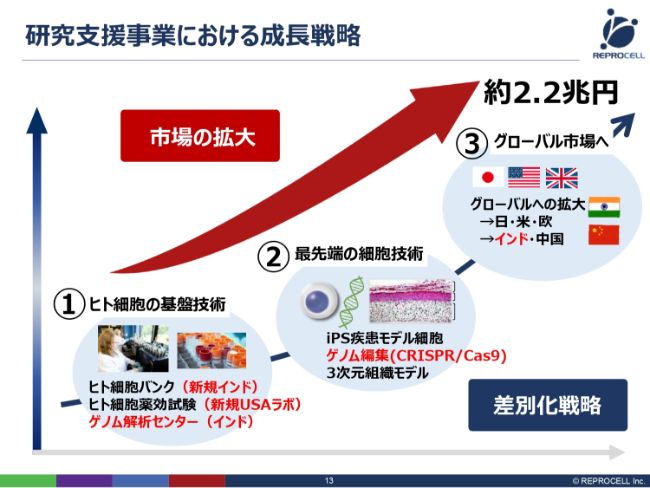
我々の成長戦略です。どのように競合と差別化するかといいますと、1つは、先ほど申し上げたとおり、さまざまな技術の要素を組み合わせて、大きな技術のプラットフォームを構築しています。
一番の基礎となるのが、ヒト細胞の基盤技術です。どのようにして、ヒトの細胞を、インフォームドコンセントを取った上で採ってくるのか。そして、どのように薬効評価あるいはゲノム解析を行うのかといったところが、基本的なところです。
さらにその上に、細胞を加工する先端技術があります。iPS細胞はまさにこちらになりますし、ゲノム編集もこちらです。細胞を加工するさまざまな技術が、この先端技術としてあります。
さらに、そういった加工技術をどのような市場へ売っていくかということで、もちろん、現在の市場が大きい日本・アメリカ・ヨーロッパといった主戦場にも売っていきますが、将来的に成長の見込めるインド・中国にも売っていこうとしています。
実際に2018年度に進捗したところを(スライドに)赤字で示しております。基盤技術に関しても、先端技術に関しても、市場に関しても、研究支援事業についてはかなり大きな進捗がありました。
この中で最も我々にとって重要なiPS細胞の創薬応用を、もう少しクローズアップしてご説明いたします。
iPS細胞の創薬応用
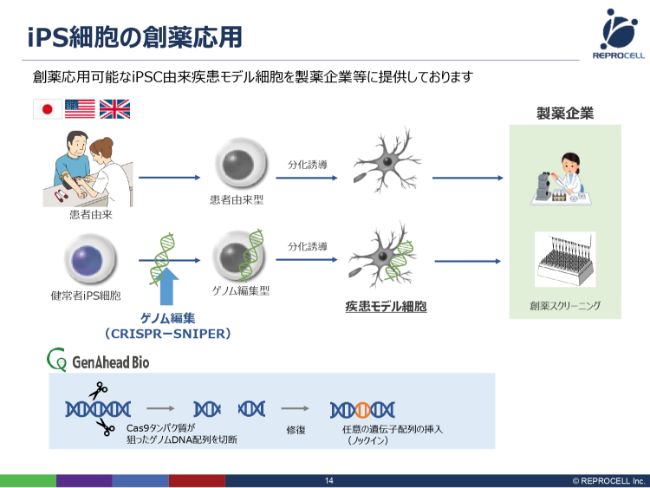
iPS細胞の創薬応用において、最もニーズが高いのが疾患モデル細胞で、さまざまな病気を模倣した細胞をつくっています。
つくり方は2つありまして、1つ目は患者さんから直接細胞を持ってくる方法です。例えば、アルツハイマー病あるいはパーキンソン病の患者さんから細胞を採ってきて、iPS細胞をつくり、それをもう1回神経に変えて、アルツハイマー病あるいはパーキンソン病由来の神経細胞をつくるというものです。
2つ目は、健常者からつくったiPS細胞に、ゲノム編集して特定の疾患遺伝子を導入し、さらに分化誘導して、疾患モデル細胞をつくるというものです。
この2つのつくり方を持っているのが、我々の特徴です。これらの細胞を製薬企業さんに納入したり、サービスを提供したりすることで、製薬メーカーさんの方で創薬スクリーニングに使用することができるようになります。
ゲノム編集に関しては、「CRISPR-SNIPER」という特殊な新しい技術を使っておりますので、後ほどご説明いたします。
iPS細胞由来の様々な細胞
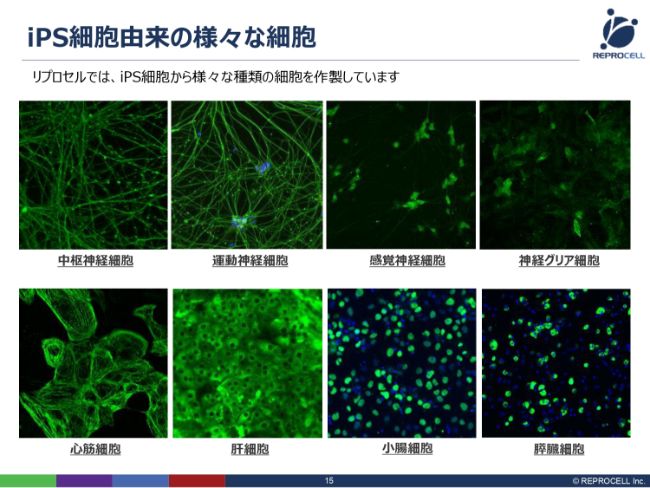
iPS細胞の技術そのものについてです。iPS細胞は、さまざまな細胞にかたちを変えることができます。当初、我々は2009年にヒトiPS由来の心筋細胞を世界で初めて売り出しました。その後、さまざまな細胞種をラインナップしておりますが、最近では神経細胞にかなり力を入れております。神経といっても、いろいろございます。
例えば、大脳にあるような中枢神経系であったり、末端にある運動神経、皮膚にある感覚神経、そして神経グリア細胞といったように、さまざまな神経細胞をつくり分けることができるようになってまいりました。また、小腸細胞や膵臓細胞のような細胞もつくることができます。
これ(スライドの写真)は、実際に我々の内部でつくった細胞の写真ですので、我々の中にこういうケイパビリティがあるとお考えいただければと思います。とくに神経グリア細胞に関しては、今後再生医療に使っていく細胞として、臨床グレードのものをつくっていこうと、現在さらに改良を進めているところです。
遺伝子改変サービス
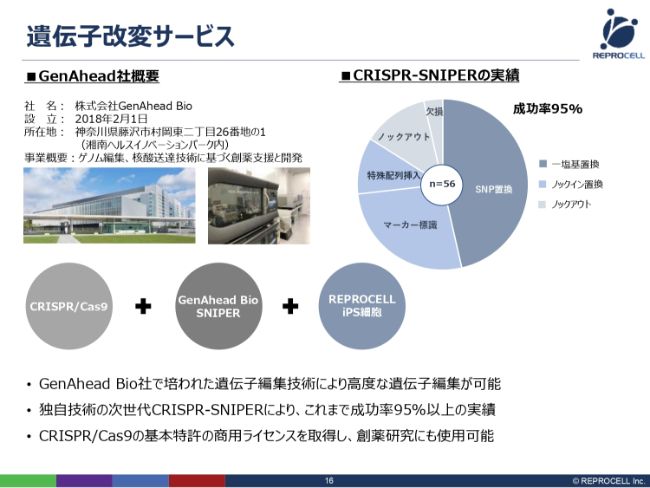
遺伝子改変サービスの技術についてです。こちらは、株式会社GenAhead Bioと提携して進めております。同社はまだ小さいベンチャーですが、もともと武田薬品工業さんで研究されていた方がスピンアウトして設立された会社で、非常に高い技術力をお持ちの会社です。
「CRISPR/Cas9」というのは、もともとアメリカの大学・公的機関で特許化された画期的な遺伝子改変技術です。(「CRISPR-SNIPER」は)それにアドオンするような付加技術で、これを用いることによって「CRISPR/Cas9」の効率を1段、2段と上げることができます。
このような技術をお持ちなのが、GenAhead Bio社です。ここに、さらに我々のiPSの技術を加え、3つの技術を組み合わせることで初めてiPS細胞を使った高度な遺伝子改変技術サービスを提供することができます。
こちら(スライドのグラフ)は、株式会社GenAhead Bioさんの実際の過去のデータです。さまざまな種類の遺伝子改変の実績をお持ちです。成功率はいまのところ95パーセントで、ほとんどミスをしないということになります。
難易度というものがありますので、通常は難しいものでは10パーセントくらいになります。こちら(のグラフ)は、難易度の順に時計回りに並べており、実はSNP置換が最も難しいゲノム編集なのですが、こちらをメインにしているということで、極めて技術力が高いということです。
また、「つくった細胞を、本当に製薬メーカーさんが創薬応用できるの?」とよく聞かれるのですが、「CRISPR/Cas9」の基本特許の商用ライセンスを受けていますので、創薬研究にも使用可能ということで、Freedom to Operateも達成しています。
対象顧客の世界分布
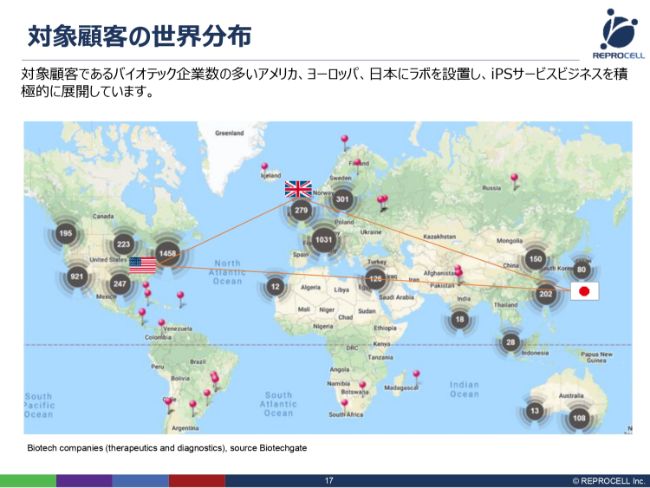
iPSの技術、遺伝子改変、組織調達の技術を使って、どこに売り込んでいくかですが、冒頭で申し上げたように、日本だけではなく、アメリカ・ヨーロッパを中心に展開しています。
こちら(スライドの地図)は、TherapeuticsとDiagnosticsの2つの領域のバイオベンチャーの数をマッピングしたものです。こちらをご覧いただきますと、集計の方法にもよるかもしれませんが、日本は80社程度である一方、アメリカでは東海岸だけで1,458社、西海岸でも921社と、雲泥の差です。そして、ヨーロッパの大陸でも1,000社以上で、アメリカ東海岸に匹敵します。
我々の本当の潜在顧客とは日本の製薬メーカーであり、バイオベンチャーですが、やはりアメリカ・ヨーロッパの製薬企業、そしてバイオベンチャーが我々の大きなお客さんになっていくだろうということで、現在、営業を強化しています。
ラボについても、もともとイギリス・アメリカではiPSにあまり取り組んでいませんでしたが、こちらにもiPS細胞のラボを設置して、現在、3局で技術共有しながら進めています。
REPROCELL India
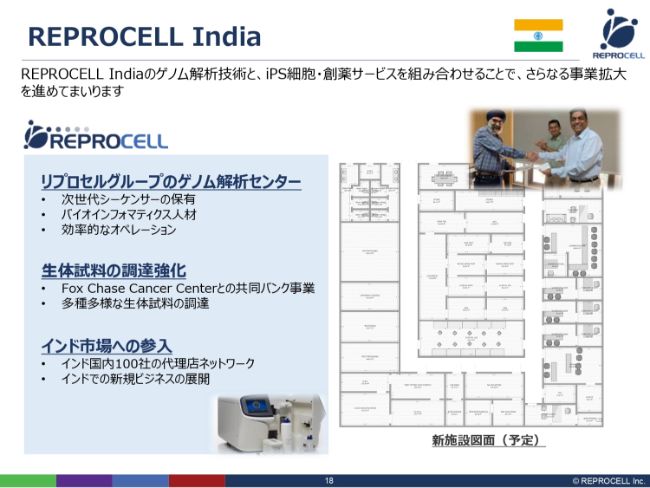
インドに関しては、iPSというよりは遺伝子解析が中心です。そういう意味では、グループ全体の遺伝子解析センターという側面があります。また、アメリカのFox Chase Cancer Centerと共同で、ヒト細胞のバンクを立ち上げました。将来的には、人口が非常に多いインド市場への参入拠点としても機能するということです。
こちら(スライドの右側の図)は見取り図ですが、この度、ラボとオフィスをリニューアルすることになり、このような間取りで現在工事を進めています。
インド進出について
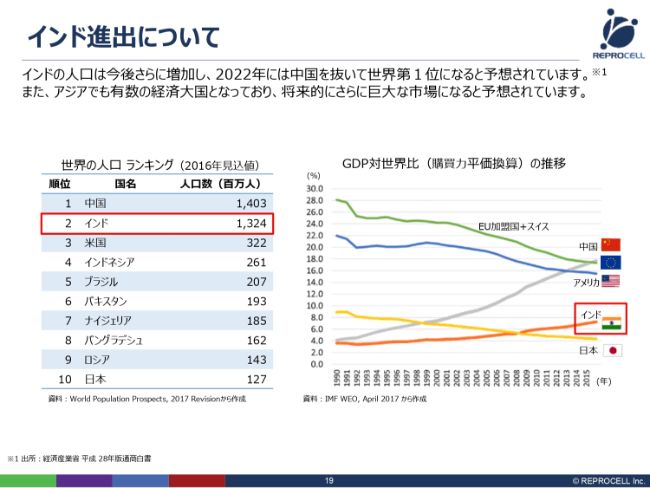
みなさんご存知と思いますが、インドは人口が中国に続いて第2位の非常に大きな国です。GDPについても、こちら(スライドの右のグラフ)は購買力平価という少し特殊な換算ですが、このような換算をすると、すでに日本よりもインドの方がGDPが高くなっています。将来的に、非常に大きな成長が見込める市場です。
個別化医療への展開
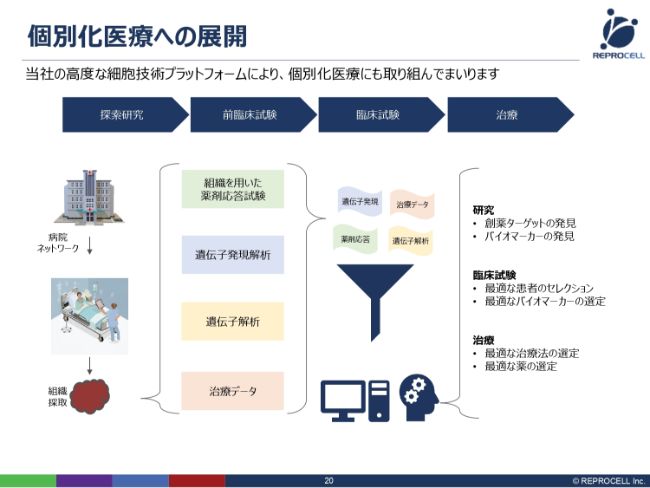
少し話が飛びますが、個別化医療への展開についてです。現在、イギリスで具体的な取り組みを始めています。個別化医療とは何かというと、患者個人のために、どのような薬を投与するのがいいのか、あるいはどのような治療を行うのがいいのかを、個別に選択していくものです。
いまは、病気になると一律で同じ薬を同じように処方されますが、それによって副作用が出る人もいますし、効かない人もいます。それを個々人で判定していこうということで、現在、非常に大きな流れとして世界的に取り組まれています。
これには、さまざまな要素技術が必要となります。例えば、その人から採ってきた細胞でいろいろな薬を評価して、どの薬が効くかといった評価をしたり、その人個人の遺伝情報、そして治療のデータをすべてデータベース化して、AIに取り込みます。そして、データベースで個人の最適な治療法を選択していきます。
インドで遺伝子解析の技術を手に入れたことに加え、我々は病院へのアクセスが非常によく、生体試料が採れて、治療のデータも得られ、薬剤応答も見ることができるということで、これらすべての要素を盛り込むことで、このようなこと(個別化医療)が可能になってきています。こちらに関してはまだ研究開発段階ですが、具体的な取り組みを始めたところです。
リプロセルの再生医療製品品目

引き続き、メディカル事業についてご説明いたします。メディカル事業に関しては、再生医療製品が2つございます。
いま先行しているのが、台湾のステミネント社からライセンス導入した「ステムカイマル®」です。これは何かといいますと、脂肪組織由来の体性幹細胞でして、対象疾患は脊髄小脳変性症です。日本では、我々がエクスクルーシブの契約を結んでいますので、我々が独占的に治験および販売を行います。
もう1つは、iPS細胞を用いた再生医療です。iPS細胞から神経グリア細胞をつくり、これをさまざまな中枢神経系の疾患に投与していくというものです。さまざまな可能性があるのですが、我々としては、まず非常に患者数の少ない疾患であるALS(筋萎縮性側索硬化症)、そしてTM(横断性髄膜炎)の2つの病気からスタートしていこうとしています。こちらはテリトリーがありませんので、日本およびその他の国々へそれぞれ展開していく予定です。
品目① ステムカイマル®の対象疾患
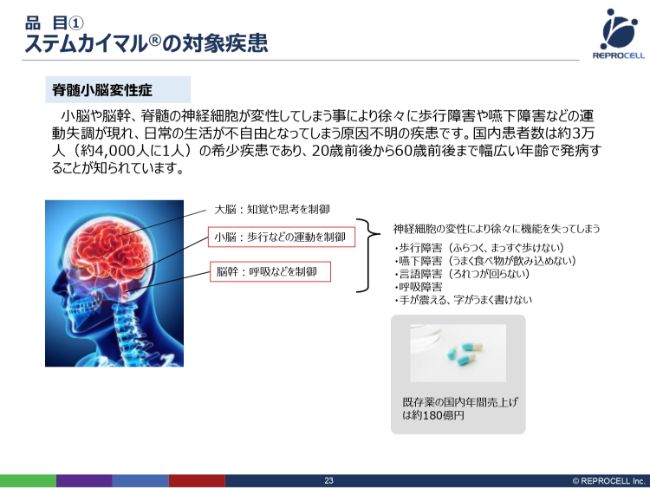
「ステムカイマル®」は、脊髄小脳変性症を治す治療薬というかたちで研究開発を進めています。脊髄小脳変性症は、日本では約3万人と、まだ患者数はそれほど多くない疾患ですが、だいたい20代から60代まで、非常に幅広く罹患する病気で、老人特有の病気ではありません。
脊髄と小脳が変性しますので、歩行障害や呼吸障害などの運動失調が現れます。基本的には、一度なってしまうとなかなかよくならず、どんどん悪くなっていく、進行性の病気です。
現在、日本でも既存薬があり、その年間売上が約180億円です。我々が新たに(「ステムカイマル®」を)出して、この市場を置き換えていくと考えています。
品目① ステムカイマル®のこれまでの臨床試験成績
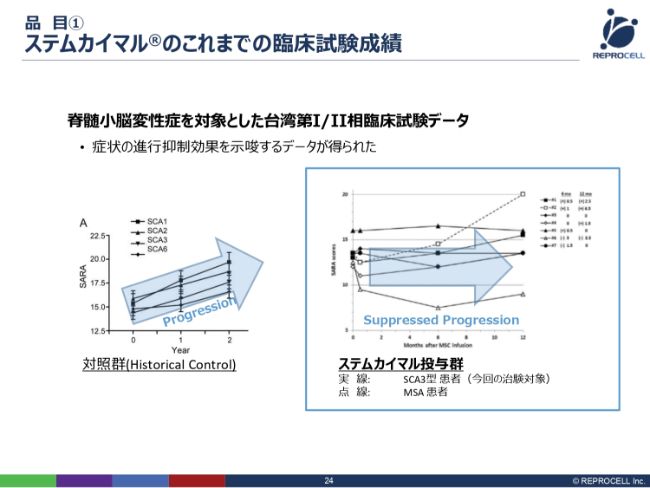
(「ステムカイマル®」は)台湾からの導入製品ですので、台湾で治験が先行して進んでいます。(台湾では)すでに第Ⅱ相臨床試験の患者の組み入れがすべて終了し、現在はモニタリング期間です。1年ほどモニタリングすると最終的な結果が出るということですが、第Ⅰ相臨床試験の前半の部分のデータがすでにオープンにされています。
こちら(スライドの右のグラフ)が「ステムカイマル®」を投与した群で、こちら(スライドの左のグラフ)が投与していない群で、この2つを比較します。このグラフをどう見るかというと、縦軸が「SARA scores」で、運動機能障害があれば、スコアが高くプラスされます。例えば、歩行障害があればプラスになり、手が少し動きにくくなるとまたプラスになるということで、数値が高ければ高いほど、病気が進行していることになります。
横軸が時間ですので、(スライドの左のグラフを)見ていただきますと、1年、2年と経つにつれて、患者さんの症状はどんどん進行しています。一方、「ステムカイマル®」を投与した患者さまは、基本的には横ばいです。1例、このような(スコアが大きく上昇している)ものもありますが、基本的には横ばいで、病気の進行が抑制されるというデータが、すでに発表されています。
我々はこういったデータをもとに導入を決め、現在、治験の準備を進めているところです。
品目① 希少疾病用再生医療等製品の指定について

(「ステムカイマル®」は)すでにオーファンドラッグに指定されています。オーファンドラッグに関しては、基本的には、対象疾患患者数が日本において5万人未満で、医療上の必要性があり、開発の可能性が高いものに指定されます。
まだ治験には入っていませんが、オーファンドラッグに指定されていますので、このメリットを活かしながら、開発を加速させていきたいと考えています。具体的には、開発経費のある一定割合が助成されますし、優先審査を行うこともできます。
品目① ステムカイマル®の世界での開発進捗
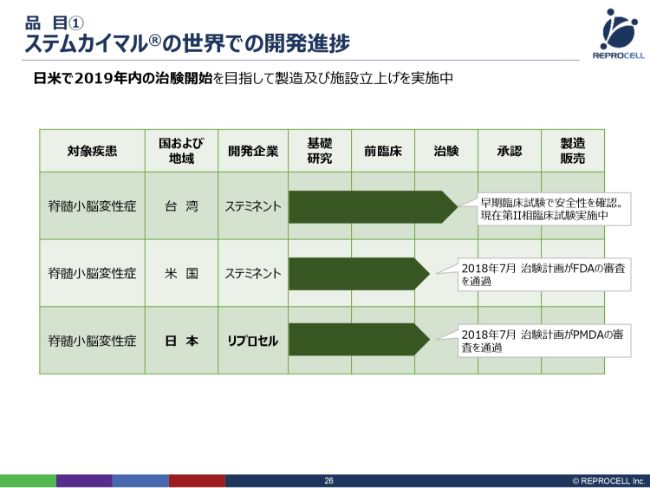
実際の開発の進捗です。日本では、2018年7月に治験計画がPMDAの審査を通過したということで、法的には、いますぐにでも治験を行おうと思えばできるという状況です。
いま何をやっているかといいますと、さまざまな病院さんとお話しをさせていただいたり、倫理審査委員会を立ち上げたり、そして台湾で製造しているものを準備していただいたりと、治験の本格的な準備を進めているというのが実情です。2019年内、年度内ではなく年内に、治験を開始するということで、具体的な線表を引いて進めています。
一方、台湾に関しては我々よりも先行していまして、すでに第Ⅱ相臨床試験の治験の組み入れが終了し、いまはモニタリング期間に入っているということです。
アメリカでは、ステミネント社自身が治験を行うのですが、FDAの審査を通過したということで、日本とほぼ同時期に審査を通過し、現在、この3局で「ステムカイマル®」の脊髄小脳変性症の治験が進んでいるところです。
iPS細胞を用いた再生医療の事業モデル
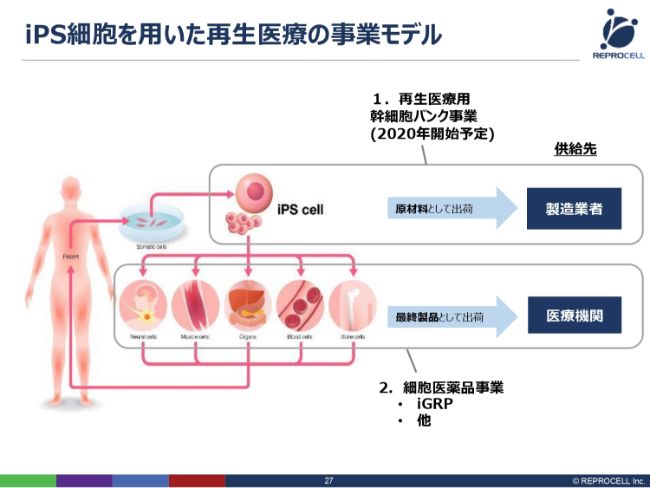
ここからは、iPSの話をさせていただきます。iPS細胞に関しては、ビジネスモデルとして2つ考えています。1つは、先ほど申しましたように、iPSの神経グリア細胞をつくり、それを再生医療製品として、我々自身で認可を取って販売していくというビジネスです。
もう1つは、冒頭で申しましたように、我々にはiPSそのものをつくる技術があり、RNAを用いて非常に高品質な臨床グレードのiPSをつくることができますので、この技術を利用して、iPSそのものをさまざまな会社に販売していく、ライセンスしていくというものです。我々も、すべての臓器をつくることができるわけではないので、さまざまな会社さまに販売、そしてライセンスすることで、iPS細胞を加速させたいと考えています。
品目② iPS細胞由来グリア前駆細胞の共同研究開発
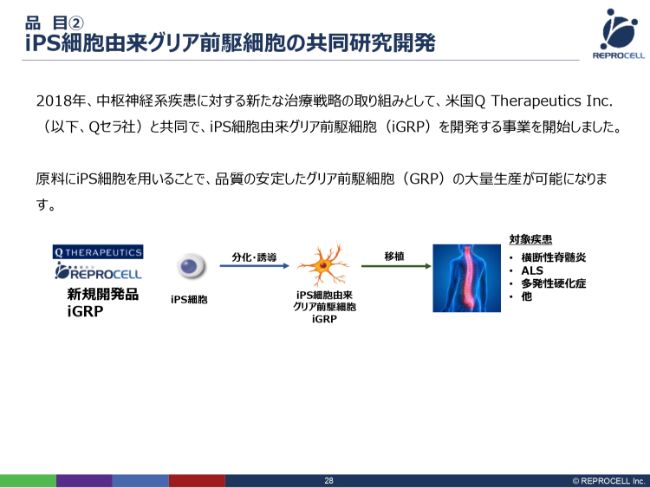
iPS細胞由来のグリア細胞に関していいますと、基本的なプロセスは非常に単純です。iPS細胞から神経グリア細胞を作成し、それを横断性脊髄炎もしくはALSの患者さんに投与して治していくというのが基本的なモデルです。
先ほど写真を示しましたように、我々はiPS細胞からさまざまな神経細胞をつくることが非常に得意です。臨床グレードのiPSをつくることも得意です。ただ、少し弱いところが、神経細胞を移植し、実際に治していくところです。こちらの臨床に関しては、まだそれほど強いとはいえません。
アメリカのQ Therapeutics Inc. という会社はまだベンチャーですが、彼らは神経グリア細胞を患者に移植して治していくというところで非常に先行していて、すでにINDの認可も取っています。
Q Therapeutics Inc. の前臨床および臨床の知識・ノウハウを活かしながら、我々がオリジナルで持っているiPS細胞の技術を組み合わせることで、この開発を加速していこうとしています。
品目② GRPは幅広い中枢神経疾患をターゲットとする
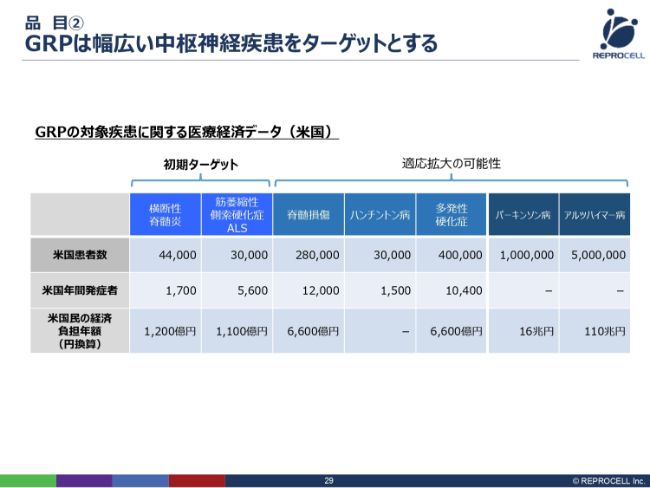
神経グリア細胞については、横断性脊髄炎とALSの2つの疾患にフォーカスして進めてまいります。理由は非常に単純で、まず、Q Therapeutics社がすでにアメリカのINDを取っていて、臨床上の知見がすでにあるということ。そしてもう1つは、患者数がそれほど多くない分野であるため、治験費用がある程度抑えられるということで、ある意味、我々の身の丈にあった治験ができるということです。
そうはいいましても、アメリカでの患者数および医療費負担をここ(スライドの表)にまとめていますが、それほど小さい市場規模ではないということがお分かりいただけると思います。
さらに、この製品のいいところは、理論的にはさまざまな中枢神経系の病気に効くということです。したがって、例えば脊髄損傷やハンチントン病、多発性硬化症といった疾患にも効く可能性がありますし、さらに市場規模の大きいパーキンソン病、アルツハイマー病にも、将来的には広げていけるということです。
このように小さい疾患で一旦認可を取りますと、安全性に関しては担保できますので、その安全性の担保をもって、さらに大きな市場に適応拡大を進め、市場を広げていきたいと考えています。
品目② 合弁会社を通じて製薬企業へのライセンスを実施予定
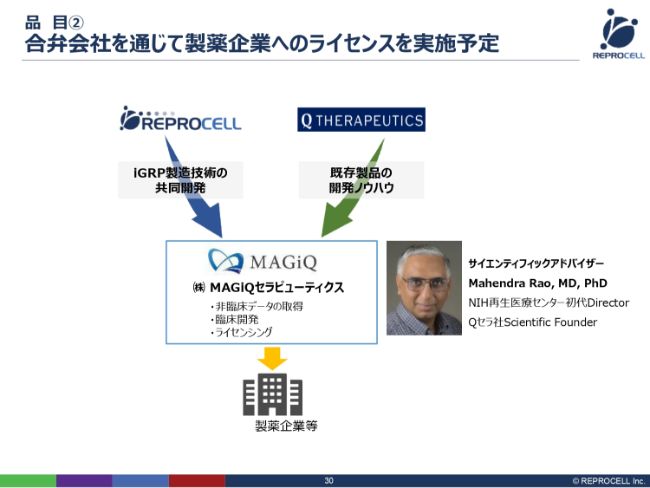
この2つの技術をより強固にするために、昨年(2018年)、株式会社MAGiQセラピューティクスという会社をジョイントベンチャーで立ち上げ、現在、研究開発を進めているところです。
サイエンティフィックアドバイザーとして、Mahendra Rao先生にご参加いただいています。この先生は、もともとNIH再生医療センターの初代Directorで、世界的にも非常に著名な研究者です。
2019年4月、殿町・リプロセル再生医療センター開設 今年度後半の稼働開始を予定
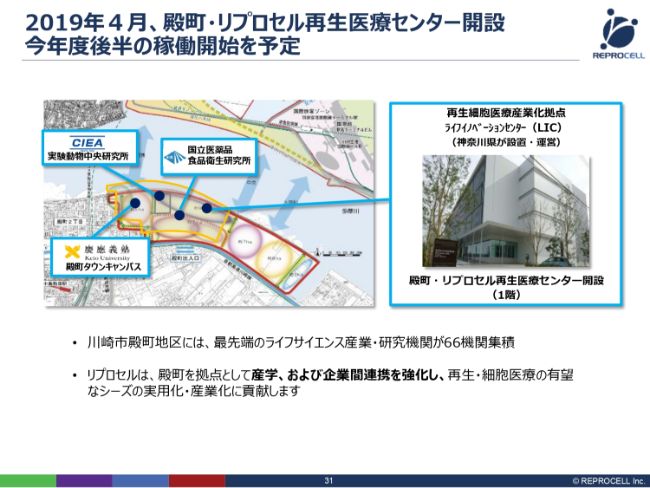
神経グリア細胞のプロジェクトを具体的に進めるために、2019年4月、川崎市に殿町・リプロセル再生医療センターを開設いたしました。もともと、我々はここでAMED(日本医療研究開発機構)のプロジェクトをさまざまな会社さんと一緒にやっていました。そこの成果・施設を有効活用させていただくかたちで、我々がいま、こちらに入っています。
このGMPの施設のほかにも、慶應義塾大学や実験動物中央研究所、国立医薬品食品衛生研究所と連携を取りながら、殿町で再生医療を実用化していこうと動いているところです。
以上、定性的なご説明をさせていただきました。
連結損益計算書
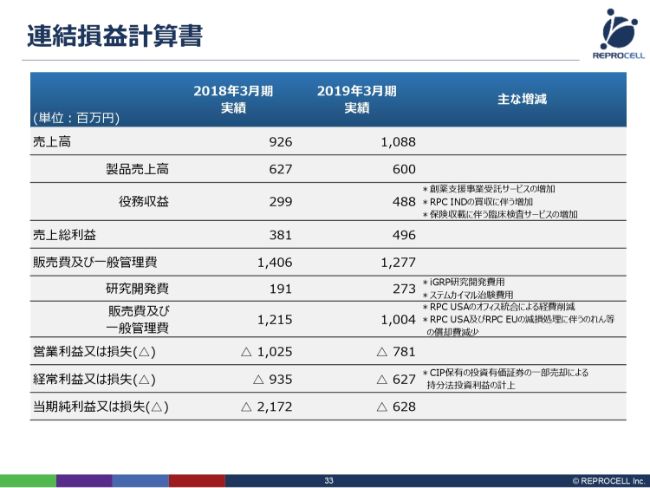
ここからは、決算数字の概要をご説明いたします。まず、売上に関しては、前年度から1億5,000万円ほど増えました。役務収益、サービスの部分が、とくに増加したところです。具体的には、創薬支援のサービス、そしてインドにおけるゲノム解析のサービスです。また、臨床検査もサービスなので、保険収載に伴う臨床検査サービスの増加により、ここが大きく増えました。
費用に関しては、研究開発費が若干増えました。主に再生医療に関して、iPSのグリア細胞の研究開発、そして「ステムカイマル®」の治験費用で増えていますが、一般的なバイオベンチャーさんに比べれば、研究開発費はかなり抑えているかなと思います。
販管費及び一般管理費は、(前年同期比で)2億円ほど減少しています。一番大きいのは、前年度の2018年3月期の12億1,500万円の中には子会社買収に伴うのれんが入っていましたが、この期の期末に減損をいたしましたので、2019年3月期の販管費にはこののれんが乗っていないことです。また、さまざまな経費削減により、販管費が減少いたしました。そういう意味では、営業利益・経常利益とも改善しています。
連結貸借対照表
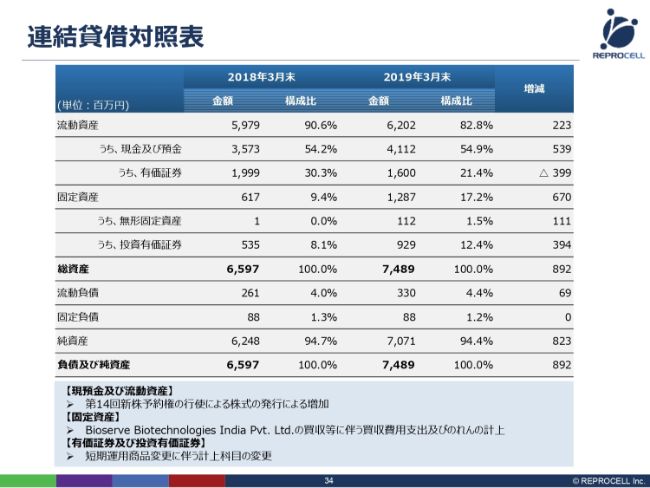
B/Sに関しては、それほど大きな差異はありませんが、第14回新株予約権の行使による増資を行ったことで、現預金が増えています。
固定資産に関しては、無形固定資産は2018年3月期でいったんほぼゼロになりましたが、インドのBioserve Biotechnologies India Pvt. Ltd.の買収に伴い、のれんが乗っています。
少し補足説明をいたしますと、有価証券及び投資有価証券は、流動資産の有価証券が少し減少し、(固定資産の)投資有価証券が少し増えていますが、合計するとあまり変わりません。これは、短期運用をしている有価証券が1年以上か未満かで(流動と固定を)行き来するので、基本的にはあまり変わっていないとお考えください。
中期経営計画
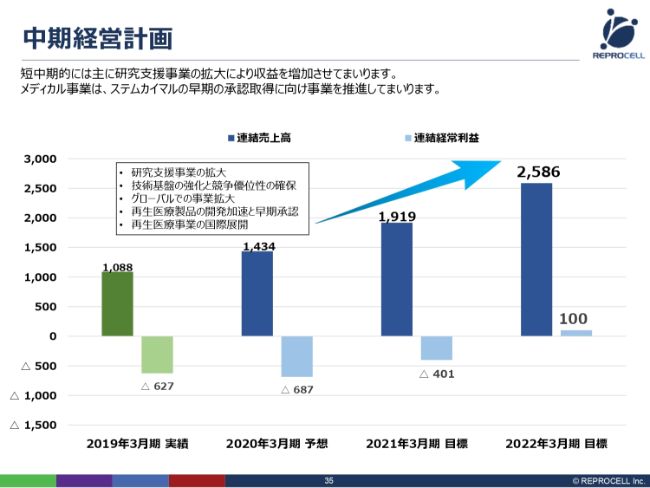
中期経営計画です。(スライドでは)3ヶ年(の目標を)お示ししています。今年度は、売上は14億3,400万円、経常利益はマイナスの6億8,700万円と見ています。これは、治験費用も含んだかたちでの経常利益のマイナスです。
(「ステムカイマル®」は)オーファンドラッグですので、基本的には国の補助があったり、ある程度治験の数も限られていますので、治験費用を含めても、それほど大きな開発費にはなりません。あとは順調に売上を伸ばしていって、2022年3月期には、経常利益ベースで黒字に転換したいと考えています。
「ステムカイマル®」の上市に関しては、まだ2022年3月期では売上を見込んでいません。したがって、ここまでは現状の研究支援ビジネス、そして、先ほど申しました臨床グレードのiPS細胞のライセンスあるいは販売で、黒字化していきたいと考えています。「ステムカイマル®」が承認を取れれば、その次の年あたりから、売上も大きく乗っていくと考えています。
以上、少し長くなりましたが、私からの説明とさせていただきます。どうもありがとうございました。
新着ログ
「化学」のログ