【QAあり】ティムス、次世代の急性期脳梗塞治療薬候補を開発 グローバルの提携実績を経て、日本のアカデミアの可能性を海外市場へ
企業理念

若林拓朗氏(以下、若林):株式会社ティムス代表取締役社長、若林です。今日はこのような機会をいただき、ありがとうございます。まずは当社についてご紹介します。
当社の企業理念は、「飽くなき探求心と挑戦で、世界を変えるクスリを創る」です。当社はあくまでも世界を目指し、世界の大きな市場に向けて薬を開発していきます。
ハイライト
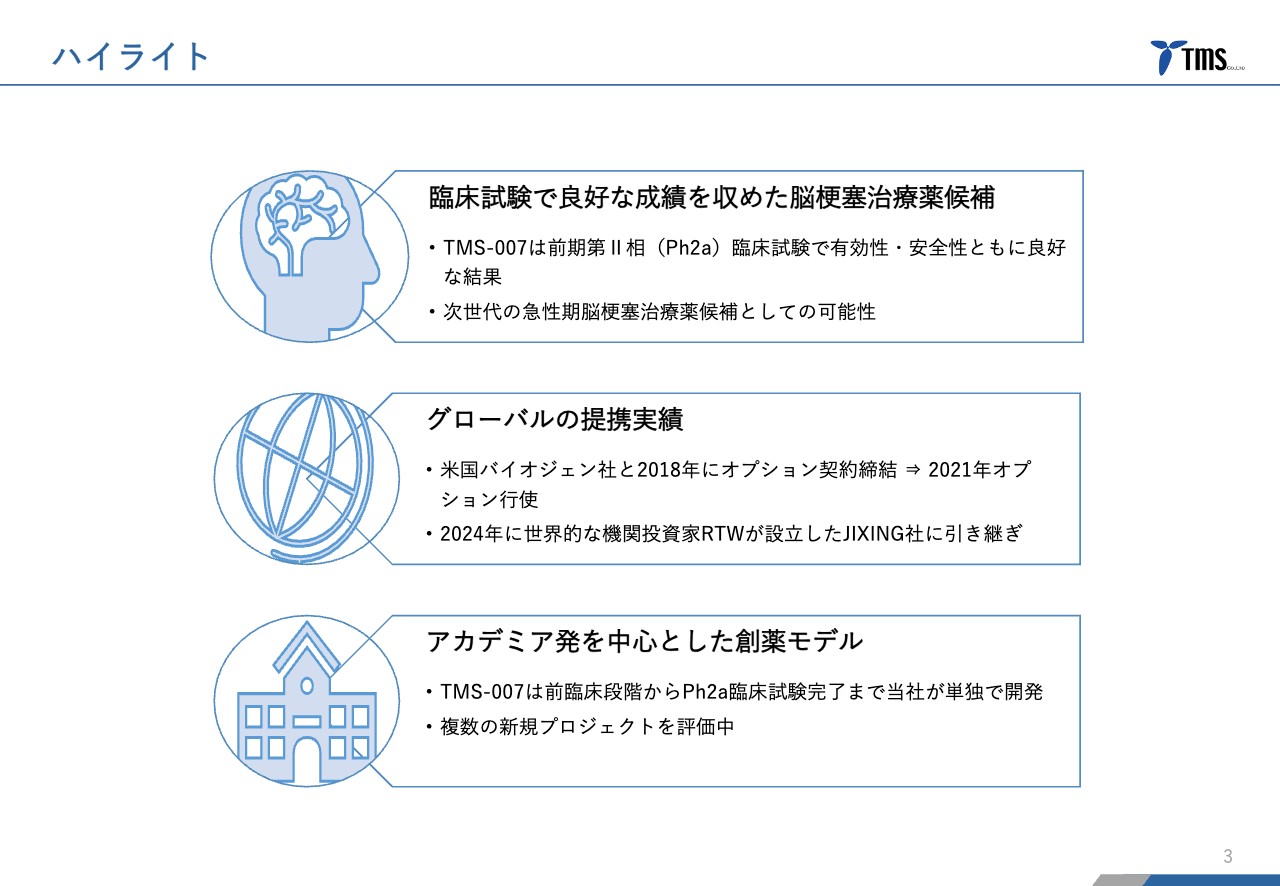
若林:ハイライトは3つです。1つ目に、当社のリードパイプライン「TMS-007」に関しては、脳梗塞の治療薬候補として、前期第Ⅱ相臨床試験で有効性・安全性ともに非常に良好な結果を示すことができました。
その結果を受けて、次世代の急性期脳梗塞治療薬候補としての可能性が大いにあると考えています。
2つ目に、グローバルの提携実績です。「TMS-007」の非常に良好な結果を受けて、アメリカのバイオジェン社と提携に至りました。その後、今年に入ってからになりますが、バイオジェン社から譲渡されるかたちで、JIXING社という中国をベースとしたバイオベンチャーに権利が移りました。
これからはJIXING社と提携していくわけですが、JIXING社を設立したRTWという投資会社は、ニューヨークをベースにしており、ライフサイエンスをほぼ専業にしている投資会社としては世界でも指折りの会社です。このような会社に認められたということになります。
3つ目に「TMS-007」について、当社は研究段階から前臨床、第Ⅰ相臨床試験、前期第Ⅱ相臨床試験と、独力で持ち上げてきたという実績があります。大学の段階から臨床試験まで持ち上げて、グローバルの提携まで実現したというバイオベンチャーは、日本の中でも非常に数少ないと思います。
このような実績を活かして、ほかの大学が抱えているような創薬シーズを世界市場に向けて展開していくことによって、さらなる成長を目指していきたいと考えています。
SMTP化合物
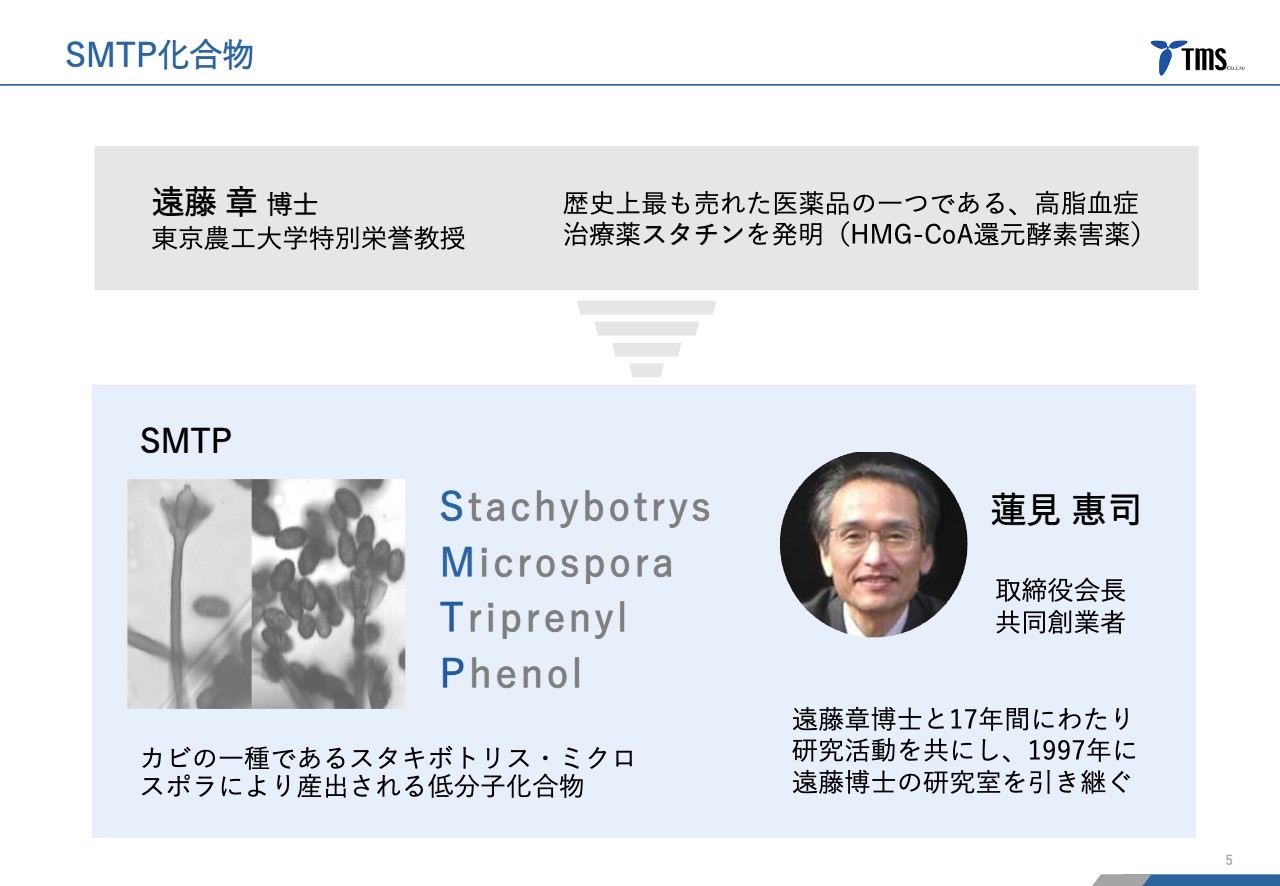
若林:当社の概要です。まず、当社の原点についてお話しします。スライド左下にあるSMTPは、低分子化合物のファミリーなのですが、カビの一種から取られてきた化合物で、当社はこのSMTP化合物ファミリーを中心にこれまで開発を進めてきました。
「TMS-007」も、後続パイプラインの「TMS-008」も、このSMTPという化合物ファミリーに属するものです。だいたい60種類あるのですが、基本的な骨格が同じで、側鎖という周辺のところが少しずつ違うというような化合物ファミリーです。
このSMTP化合物ファミリーを発見したのが、当社の共同創業者で取締役会長でもある蓮見で、この蓮見が長年一緒に共同研究をしてきたのが、スライド上に記載されている遠藤章先生です。
遠藤章先生は、コレステロールを下げるスタチンという薬の発明者として、世界的にも知られている方です。このスタチンも実はカビから取られた化合物で作られています。
スタチンは、一時期世界で2兆円ぐらい売れていたという薬で、実際に患者さまに使われてきた薬の中でも最も売れた薬の1つです。これを発明した遠藤章先生の研究の流れを継いで、このSMTPが生まれました。
アカデミアでの発見をグローバル市場へ
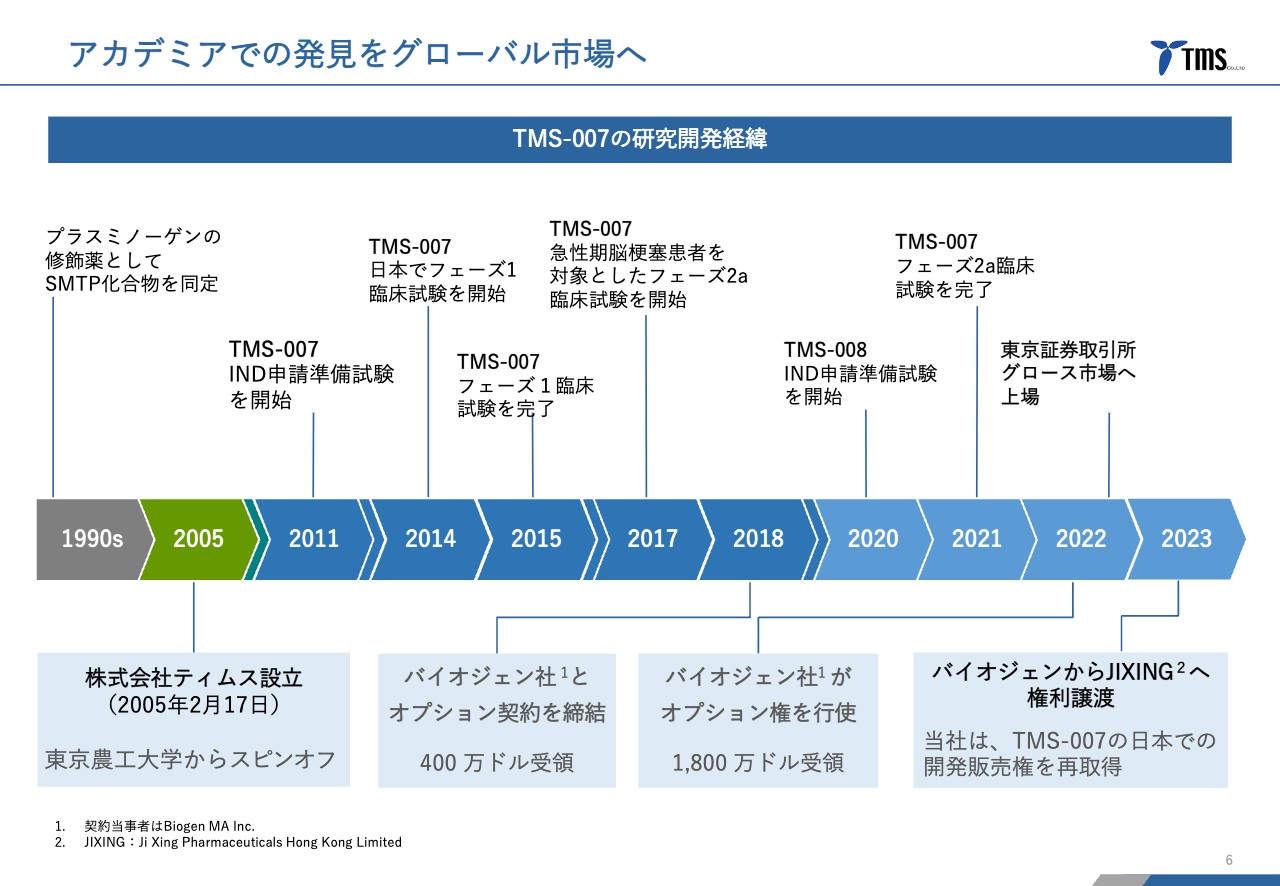
若林:当社の歴史です。1990年代にSMTP化合物が初めて発見されて、2005年に当社が設立されました。その後いろいろとありましたが、「TMS-007」の開発に着手したのが2011年です。
2018年にまずバイオジェン社とオプション契約を締結して、2021年に前期第Ⅱ相臨床試験が終わったのを受けて、バイオジェン社がオプション権を行使しました。その後今年に入り、JIXING社と新たに提携することになったという歴史です。
会社概要:マネジメントチーム

若林:当社のマネジメントチームです。私は基本的にビジネスの人間ですが、発明者である蓮見、それからアステラス製薬で研究所長まで務め、さらに事業開発や製薬業界の研究開発におけるさまざまな経験を豊富に持っている稲村、管理部門をしっかりと固めている伊藤と、非常にバランスが取れた経営陣になっていると考えています。
ちなみに私が社長になったのは2018年ですが、2007年から当社に関わっており、2011年から共同代表取締役となりました。
パイプライン
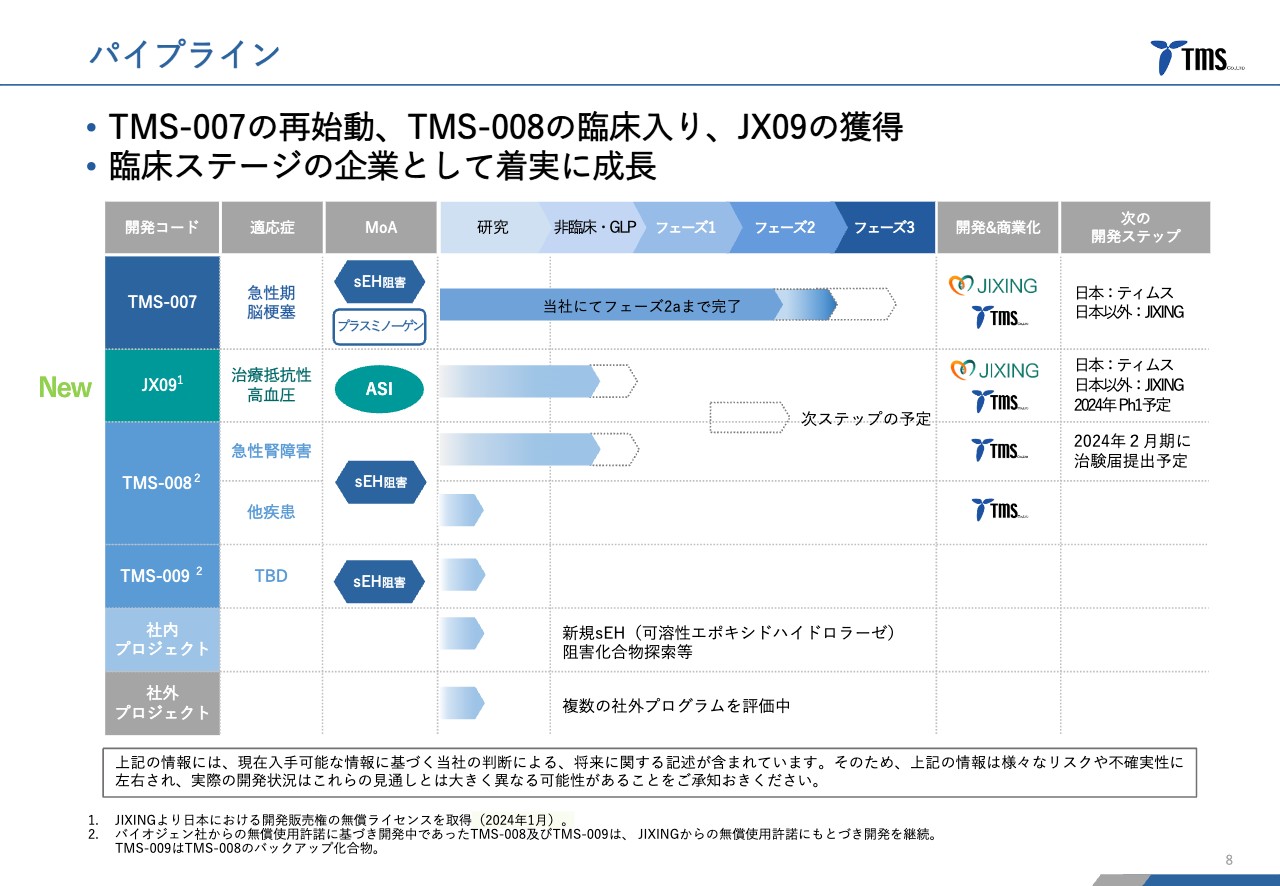
若林:当社のパイプラインです。「TMS-007」が最も進んでおり、前期第Ⅱ相臨床試験が終わった段階です。「TMS-008」「TMS-009」はSMTPファミリーに属する化合物で、間に「JX09」が入っていますが、これは今回JIXING社と提携することによって、当社が日本での開発販売権を入手したものです。
TMS-007:権利の状況
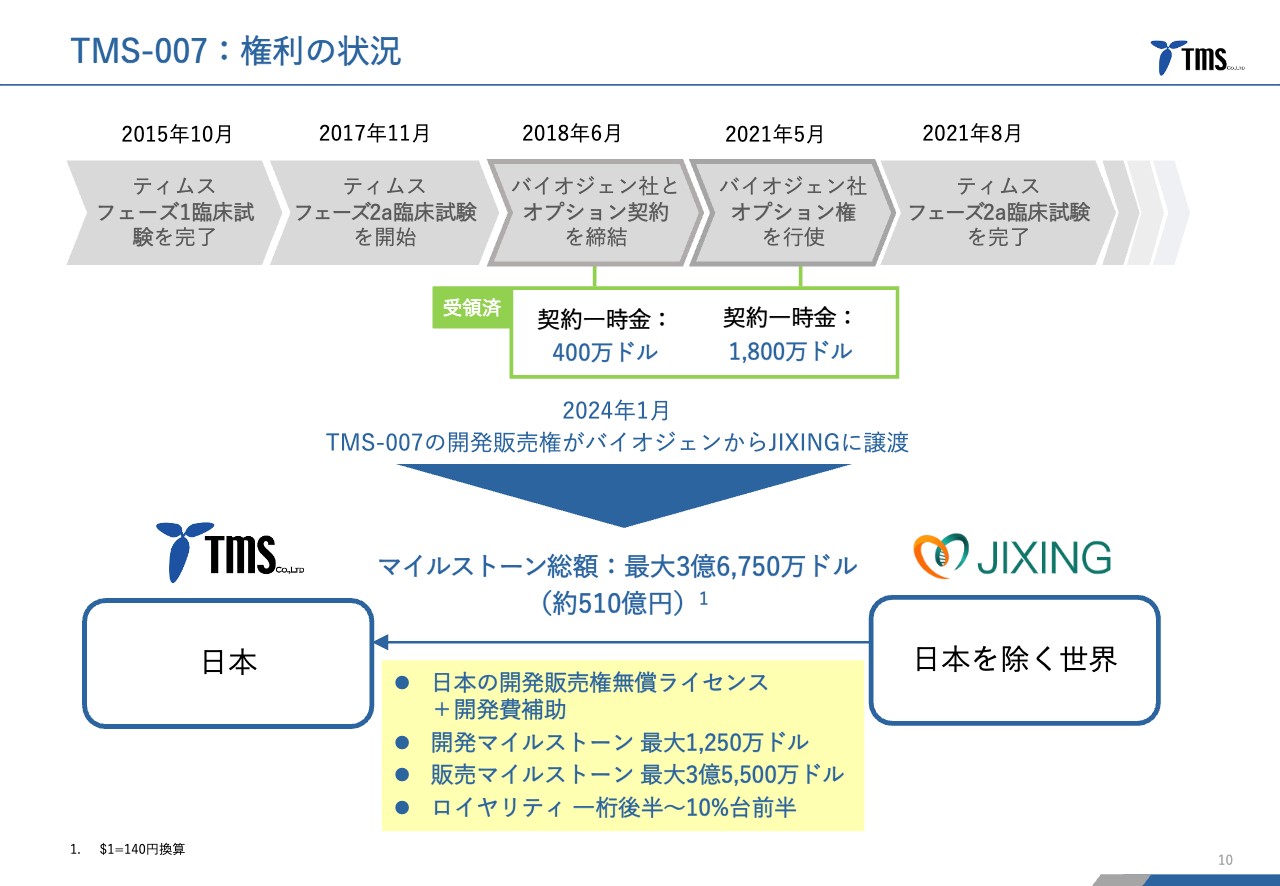
若林:当社のリードパイプラインである「TMS-007」についてご説明します。権利の状況ですが、これまでにバイオジェン社との契約も含めていろいろな変遷がありました。
バイオジェン社からは契約一時金として、これまでに合計で2,200万ドルを受け取っています。その権利が今年1月にJIXING社に移り、JIXING社が日本を除く世界、当社が日本での開発販売権を有するかたちになっています。
いろいろな一時金がありますが、合計で約510億円という規模になっています。
また、スライド下部の黄色い枠内に記載していますが、ロイヤリティという、実際の販売額に対して当社が受領することができる権利が1桁パーセント台の後半から10パーセント台の前半となっています。
あとでご紹介しますが、今、脳梗塞の治療薬として唯一承認されている「t-PA」という薬が年間で3,000億円ぐらい売れていますので、仮に10パーセントとすると300億円程度の収入が、期間中は毎年入ってくるような可能性もあるということです。
坂本慎太郎氏(以下、坂本):最初にバイオジェン社と契約していたものが、JIXING社に譲渡となっています。
例えば、野球選手が特別な活躍をすると、次のチームに行く時に高額な契約金になるというように、「TMS-007」の進みが良く、ポテンシャルが高いためにJIXING社が「高く買うよ」というような状況になったのか、反対に進捗がいまいちだったからなのか、どのような状況だったのでしょうか?
また、このようなことはバイオ業界、製薬業界でよくあることなのか、そのあたりも含めておうかがいしたいです。
若林:バイオベンチャーと大手の製薬会社が組むということは非常に多いですが、その結果、製薬会社から「この件についてはこれ以上参画しない」ということで、権利が返還されるということは非常に多く起こっています。
坂本:ありますね。それで株価が下がることがよくあります。
若林:「◯◯ショック」などとよく言われます。
坂本:この場合は、違うようですね。
若林:そうですね。バイオジェン社は本当は次の治験に移って、その結果次第でどのようにするか決めるということかと思っていたのですが、昨年、バイオジェン社のほうで戦略的にパイプラインを大幅に見直すということがありました。
その一環として、バイオジェン社としては完全に撤退すると宣言したものもいくつかあるのですが、「TMS-007」に関してはJIXING社が興味を示したため、JIXING社に譲渡されたということになりました。
坂本:最初からバイオジェン社とのマイルストーン決定・契約まで、ある程度の青写真があったと思うのですが、JIXING社との契約はそれと変わらないイメージですか? それとも、もっと良くなっているのでしょうか?
若林:当社としては同等と思っています。ただし、中身は少し違います。マイルストーン総額の規模はほぼ同じで、バイオジェン社との場合のほうがやや少なかったです。
一方で、そのマイルストーンの中身は開発マイルストーンと販売マイルストーンと分かれていて、開発マイルストーンのほうがどちらかというと先にもらえるためより価値が高いのですが、その分は減って販売マイルストーンが増えています。
坂本:なるほど。ロイヤリティの1桁パーセント台後半から10パーセント台前半というのは、これはどのような条件で決まってくるのでしょうか? 薬価のようなかたちでしょうか?
若林:これは売上規模ですね。年間の売上規模が一定額を超えると、ロイヤリティ率が増えるということです。
TMS-007:急性期脳梗塞
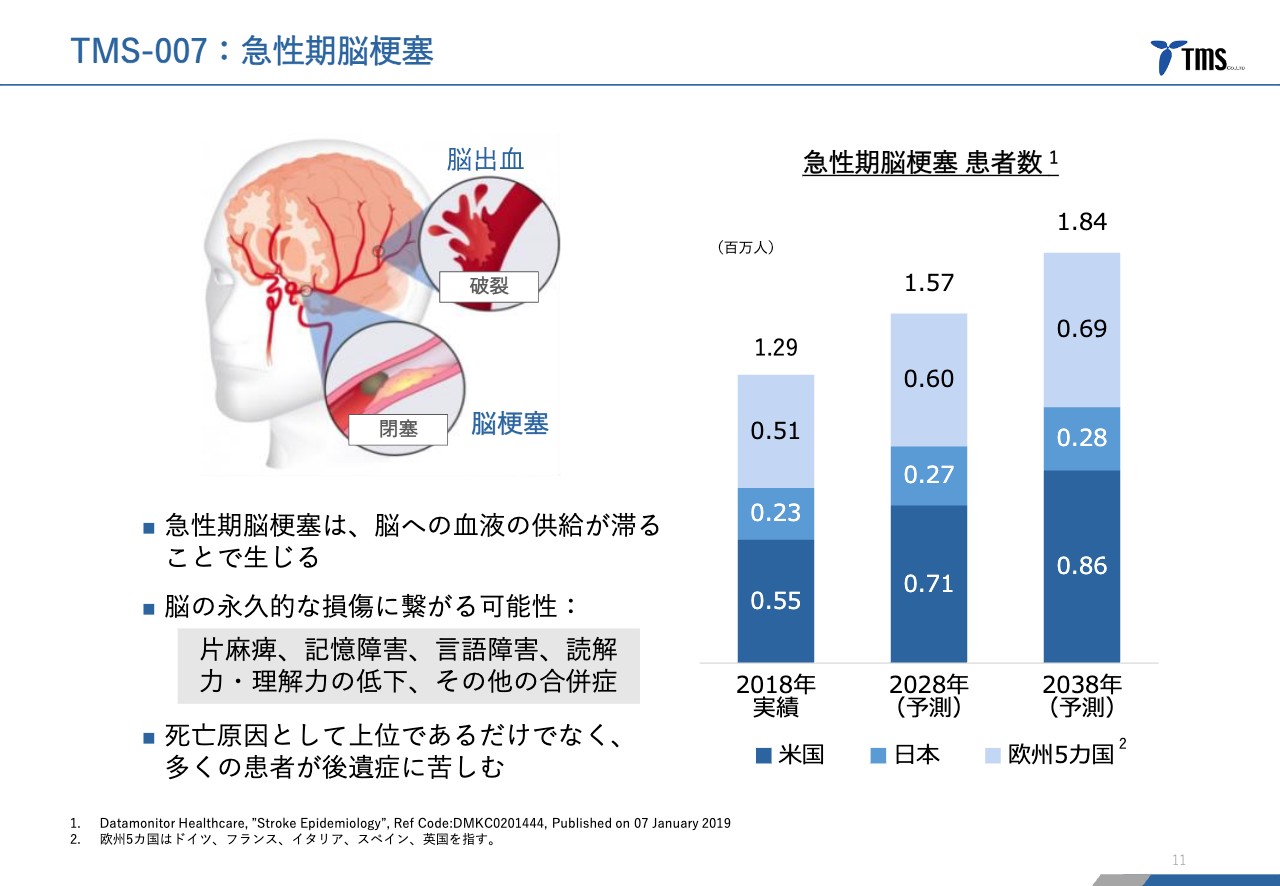
若林:「TMS-007」のご説明を続けます。「TMS-007」は急性期脳梗塞という疾患をターゲットにしています。脳卒中という言い方もありますが、脳卒中は、脳の血管が詰まる脳梗塞と脳の血管が破れて出血する脳出血に分かれています。このうちの脳梗塞をターゲットにしています。
日本での脳梗塞は、脳卒中の中で70パーセント程度、欧米では85パーセント程度です。ご存じの方も多いと思いますが、先進国では死亡原因が4位から6位ぐらいという、非常に死亡原因として多い疾患です。亡くならない場合でも、非常に重い後遺症に悩まされる患者さまが多く、非常に重要な疾患です。
年間の患者数は、アメリカ、日本、それからヨーロッパの主要5ヶ国で、だいたい130万人から140万人と言われています。
FDAによる唯一の承認薬 t-PA
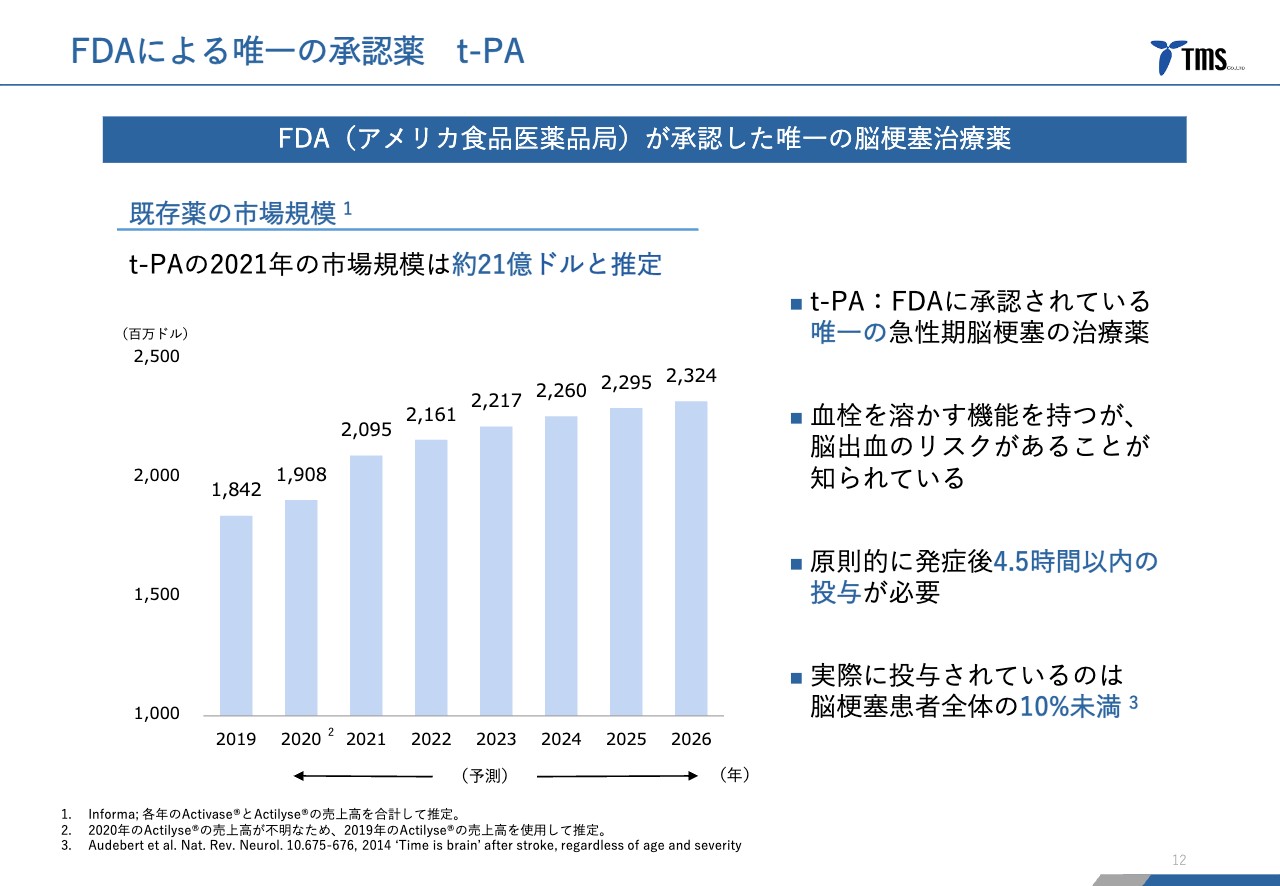
若林:このように非常に重要な疾患なのですが、世界各国で共通に使われている薬が、実は1つしかありません。しかも、1つしかないのにもかかわらず、脳梗塞患者全体の10パーセント未満にしか使われていません。それが「t-PA」という薬です。年間でだいたい20億ドル強、日本円に直すと3,000億円程度売れているものです。
「t-PA」は唯一の薬で、脳梗塞の原因である血栓を取り除くという意味では効果が高い薬なのですが、一方で、脳出血を引き起こしてしまうというリスクが知られています。もちろん全員ではないのですが、そのようなこともあって、使用がかなり制限されているということがあります。
坂本:そのために、結局は10パーセント未満になってしまうということですね。使える人と使えない人がいるというようなことですか?
若林:そのとおりです。特に大きいのは、原則として発症から4.5時間以内に使われなければならないということがあります。使える時間帯が非常に短いということが、投与率が低い大きな要因の1つとなっています。
TMS-007:作用機序
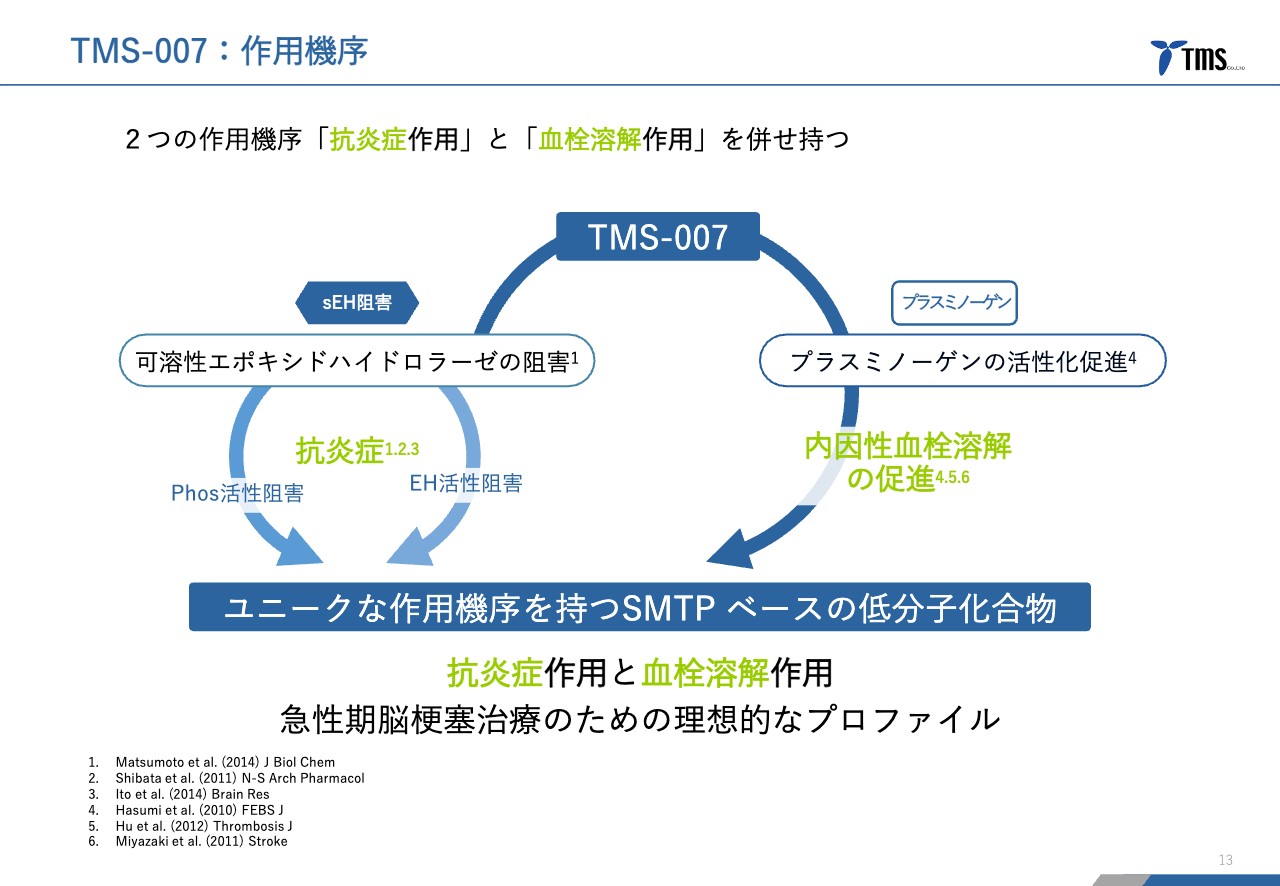
若林:当社は、このような市場に対して「TMS-007」を開発しているわけですが、2つの作用を併せ持っているということが特徴です。抗炎症作用と血栓溶解作用の2つの作用があります。
スライド左側の図が抗炎症作用、右側が血栓溶解作用を示しています。なぜこれがユニークかというと、これまでいろいろな製薬会社が脳梗塞の治療薬にさまざまなチャレンジをしてきたのですが、抗炎症作用を持つ化合物か血栓溶解作用を持つ化合物のどちらかだったのです。
当社の「TMS-007」は両方持っていて、このような作用機序を持つものは脳梗塞の治療薬候補としては初めてになります。
TMS-007:血栓溶解メカニズム
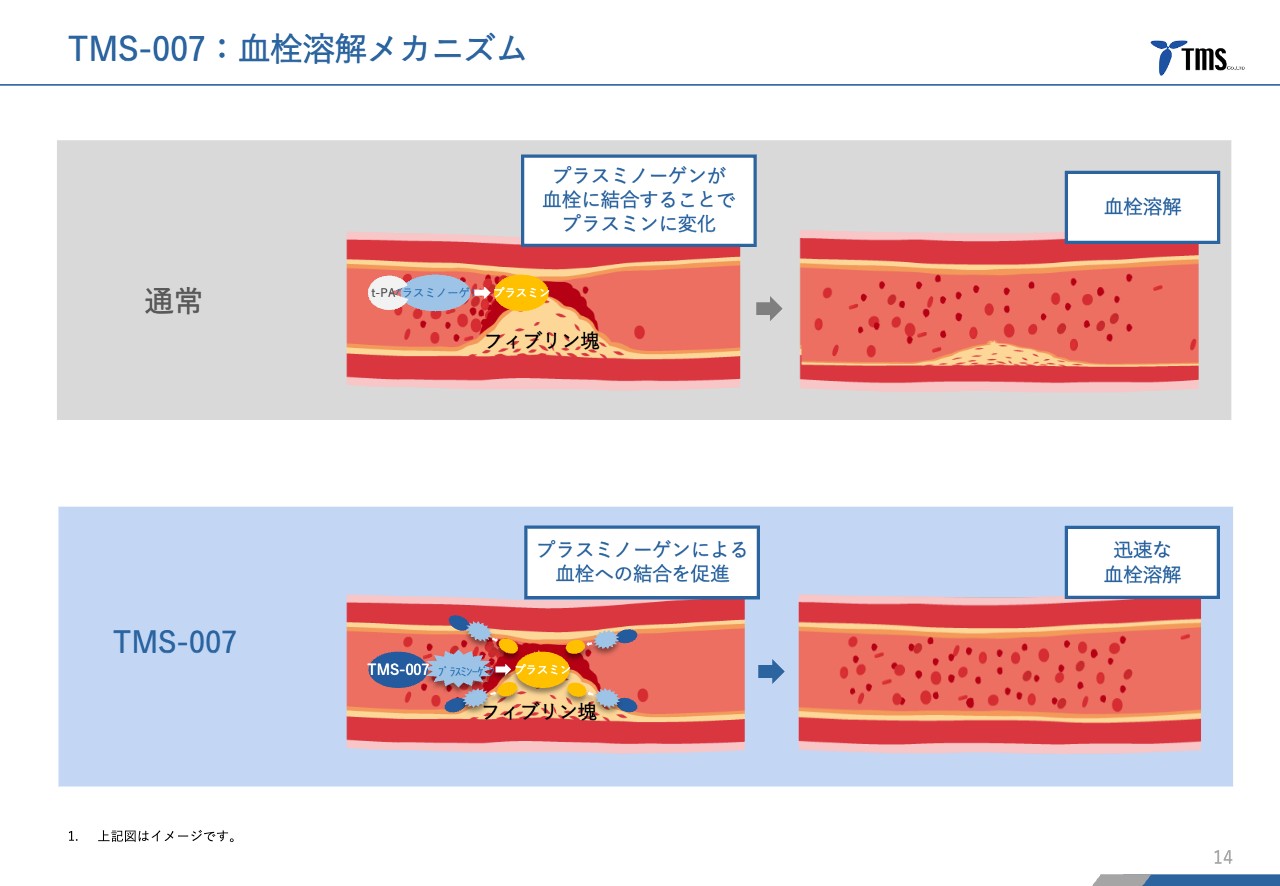
若林:血栓溶解メカニズムです。人間に限らず、あらゆる動物は血栓を溶かす機能を持っているのですが、「TMS-007」はプラスミノーゲンというタンパク質と結合することによって、血栓溶解のスピードを速めるという効果があります。
TMS-007:Ph2a臨床試験は良好な結果
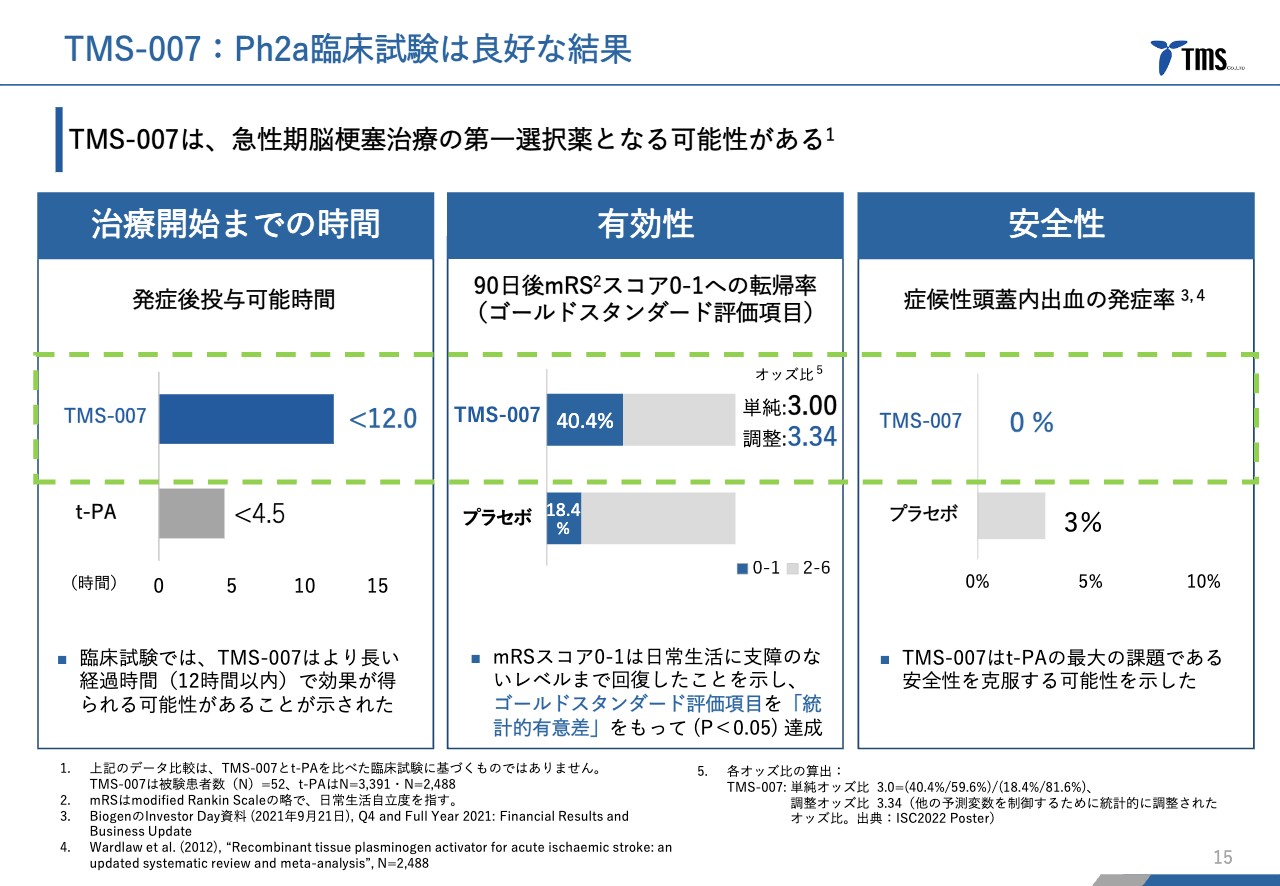
若林:「TMS-007」の前期第Ⅱ相臨床試験結果です。スライドでは3つに分けてご説明しています。
左側の、治療開始までの時間についてご説明します。「t-PA」は発症から4.5時間までしか使用できないのに対して、「TMS-007」前期第Ⅱ相臨床試験では、発症後12時間の患者さままで受け入れて投与しています。平均では、発症からだいたい9.5時間の患者さまに対して投与したということになります。
脳梗塞の治療は、発症から時間がたてばたつほど難しいと一般的に言われているのですが、このような難しい患者さまに対して有効性と安全性の両方で優れた結果を出すことができたと考えています。
TMS-007:Ph2a臨床試験結果ゴールドスタンダード(mRS0-1転帰率)達成
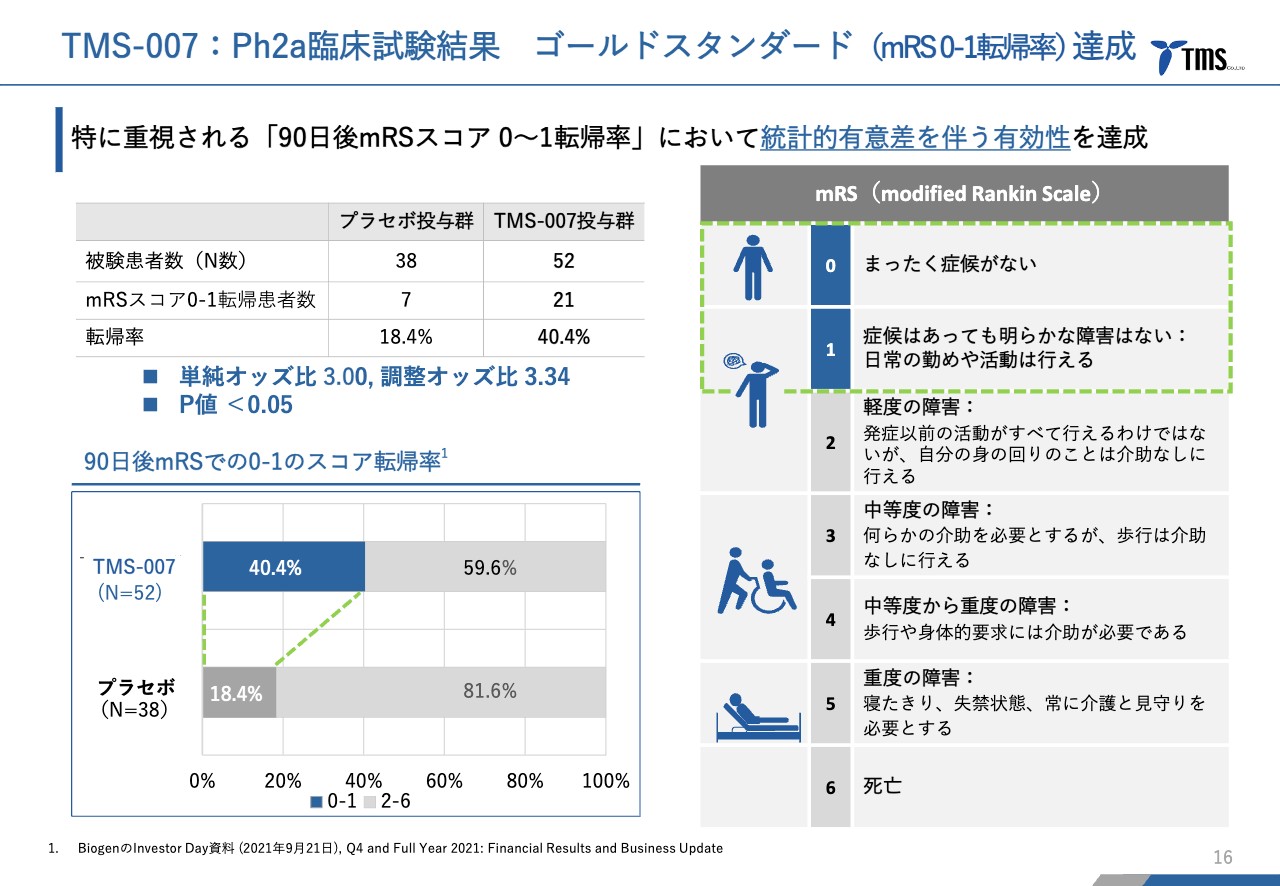
若林:有効性については、mRSという指標があります。スライドの右側に記載されていますが、mRSは非常にシンプルで0から6までの7段階の指標となっています。
0はまったくの健康体、6は死亡です。1は基本的に日常生活をまったく問題なく送れるレベルです。脳梗塞発症から90日後に、この中のどれに該当するかということが、脳梗塞の治療薬の評価としては非常に重要な指標となっています。
坂本:最初3ぐらいだった方が、90日以内に0か1に回復される方もいるということですね。
若林:そのとおりです。
飯村美樹氏(以下、飯村):スライド左下の表にある、プラセボとはどのようなものでしょうか?
若林:プラセボは、基本的には「TMS-007」を抜いたものになります。
坂本:薬を使っていないのに回復するケースということですね。表を見ると、かなり「TMS-007」の有用性が出ています。
若林:左下の表は、0から1になった患者さまの比率ですが、「TMS-007」の投与群では40パーセントを超えて、プラセボ投与群の倍以上となっています。この90日後mRSのスコアの転帰率は、決して大規模な臨床試験ではないのですが、この解析の結果、統計的に有意であり、プラセボよりも優れていると証明されました。
小さな試験では、それだけ大きな差がつかなければ統計上の有意差は出ないことから、ここではかなりの差が出たと言えます。
TMS-007:Ph2a臨床試験結果 良好な血管再開通
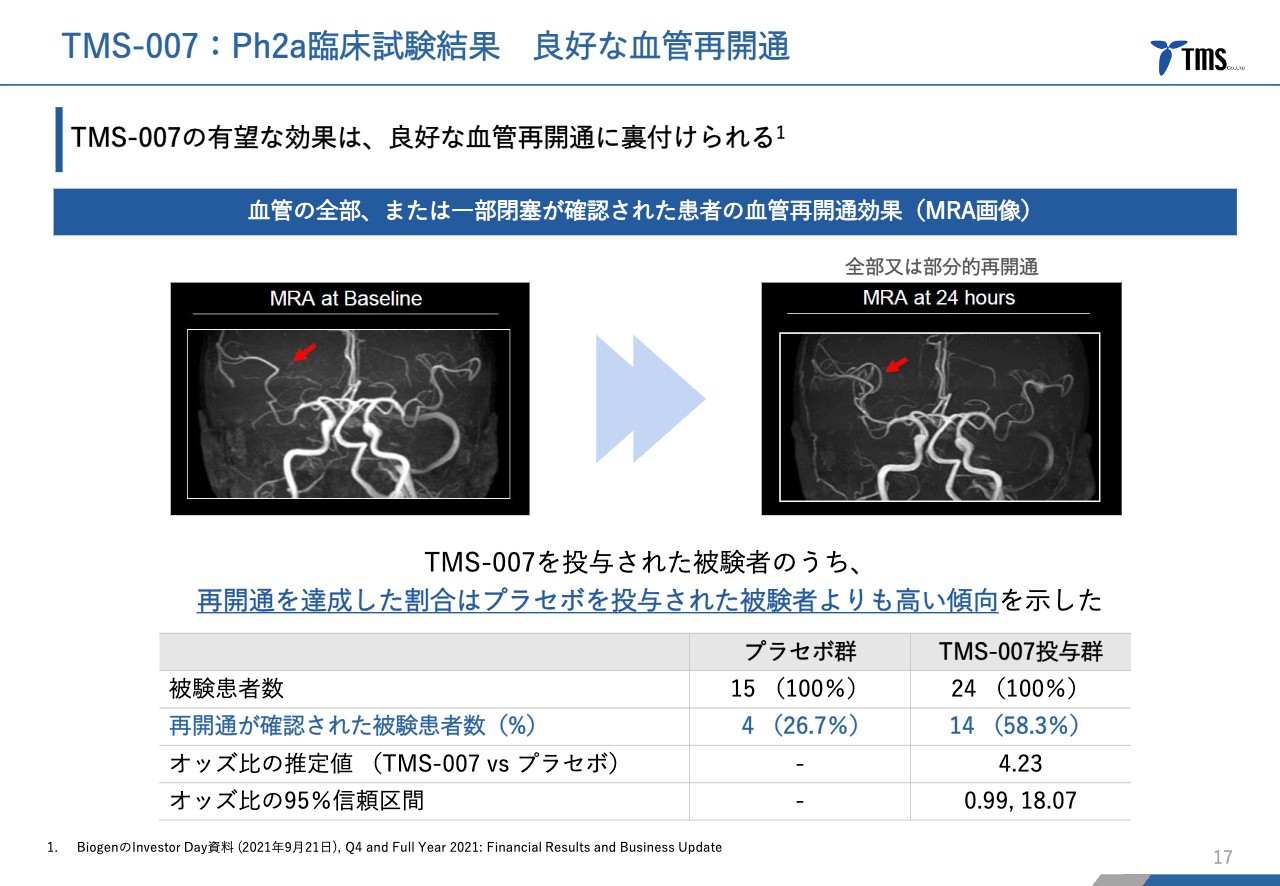
若林:脳梗塞の患者さまのMRA画像をスライドに示しています。臨床試験の際は必ずMRAを撮っています。
左と右の画像では、赤い矢印の部分が少し異なります。左側は血管が閉塞しているため血流が見えませんが、右側は血管が再開通したため、血流が見えています。
患者さま全員の血管が詰まっている場所が明確にわかるわけではありませんが、詰まっている箇所が見える患者さまのうち、何人の血流が再開通したかを評価しています。
結果はプラセボ投与群は26.7パーセント、TMS-007投与群は58.3パーセントと、こちらも倍以上の大きな差がある結果となりました。
先ほどご説明したmRSは自立度の評価と言われており、それがなぜ大きく違ったかについて説明する要因の1つであると考えています。
TMS-007:Ph2a臨床試験結果 安全性
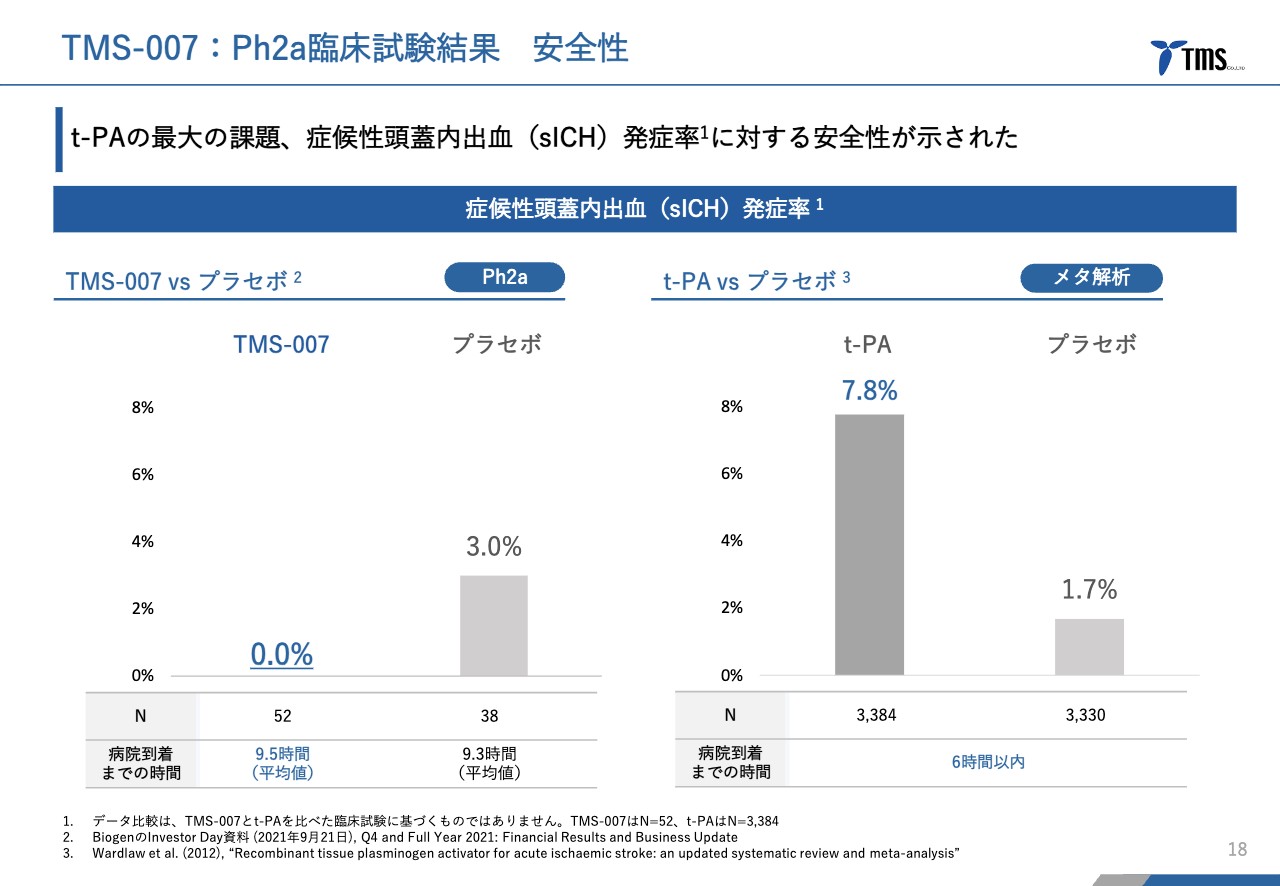
若林:安全性では、症候性頭蓋内出血発症率を見ています。いわゆる脳出血であり、なおかつ微小な脳出血ではなく、症状の悪化を伴う脳出血がどの程度起きているかを測っています。
右側のグラフのとおり、一般的には「t-PA」を使うと6パーセントから7パーセント程度の方が症候性頭蓋内出血を発症すると言われています。
同じ臨床試験ではないため正確な比較ができませんが、それに対し、左側のグラフが示す当社の今回の臨床試験の結果では、発症した患者さまはゼロでした。
坂本:現状では「TMS-007」には脳出血を伴う副作用がない、または少ないということでしょうか?
若林:これだけでは確実なことは言えないと思いますが、そうですね。
坂本:「t-PA」と比べてかなり少ないということですね。
若林:これまでのさまざまな動物実験においても脳出血を引き起こさない、どちらかと言えば抑えられる傾向にあるのではないか、そのようなことが言えるのではないかと思います。
坂本:抗炎症作用などが効くということでしょうか。反対に、現状では「TMS-007」が使えない体質や疾患および疾病はありますか?
若林:現段階において、当社としては特にそのような患者さまの病状は特定できていません。
坂本:そうであればかなり期待できるため、上市すれば、いずれは脳梗塞の患者さまが来たら、はじめにとりあえず投与される薬になる可能性が考えられますね。
若林:まさに、そのようなところを狙っています。
坂本:そうなれば、市場規模はすごいことになりそうですね。
TMS-007の可能性:潜在的な市場規模

若林:市場規模についてお話しします。あまり詳細な数字を出さないようにしていますが、先ほどのご説明のとおり、2021年の「t-PA」の推定売上高は約21億ドル、年間約3,000億円と言われているため、まずここから患者数を拡大できるだろうと考えています。
スライドの図の横軸で示していますが、まず発症後投与可能時間が4.5時間から12時間に広がることで患者数が拡大できると考えています。
また、当社の前期第II相臨床試験で示した安全性が確立したという前提で、それが実現すれば、今まで時間的に問題ないにもかかわらず「t-PA」の投与が控えられていた患者さまにも投与されることが考えられるため、そのような意味でも普及率の拡大が考えられるのではないかと見ています。
合計すると、最大で約5倍に拡大する可能性があるのではないかと思っています。
そして、薬価が縦軸です。当社もさまざまな試算をしていますが、有効性も安全性もさらに「t-PA」より優れていれば、より高い薬価を訴求することも十分に考えられるのではないかと思っています。
これら両方の効果が合わされば、非常に大きな市場規模が想定できます。
坂本:有用性があれば、薬価が高くなる傾向があるということですね。難しい質問かと思いますが、有効性によって何割程度が薬価に乗せられるのでしょうか?
若林:非常に難しいですね。国によってもかなり異なります。
坂本:スライドの表は米国のデータですね。米国にはそのような傾向があるのでしょうか?
若林:そうですね。
坂本:日本はどうですか?
若林:我々もこれから勉強しなければならない部分がありますが、日本は原価方式という、原価にさまざまな加算が付く方式、それから海外で承認されているものに対しては参照薬価方式という、海外の薬価を参照する方式もあり、さまざまな算定方法があります。
当社としては、アメリカでもヨーロッパでも、ロイヤリティが入ってきます。
坂本:分散効果と言うと語弊がありそうですが、さまざまな場所の薬価によって入ってくるロイヤリティが決まるイメージですね。スムーズに進んだ場合、上市はいつ頃を想定されていますか?
若林:なかなかお答えできないのですが、これから次の試験をどのようにデザインしていくかなども関係してきます。
当社は、2022年11月に上場しました。当時は2026年から2028年頃に上市するのではないかとお話ししていましたが、今回、バイオジェン社から開発販売権が移ったために遅れています。その遅延が余分にかかるということではないかと考えています。
坂本:イメージできました。ありがとうございます。
TMS-008:急性腎障害(AKI)
若林:「TMS-007」以外のパイプラインについて、簡単にご説明します。
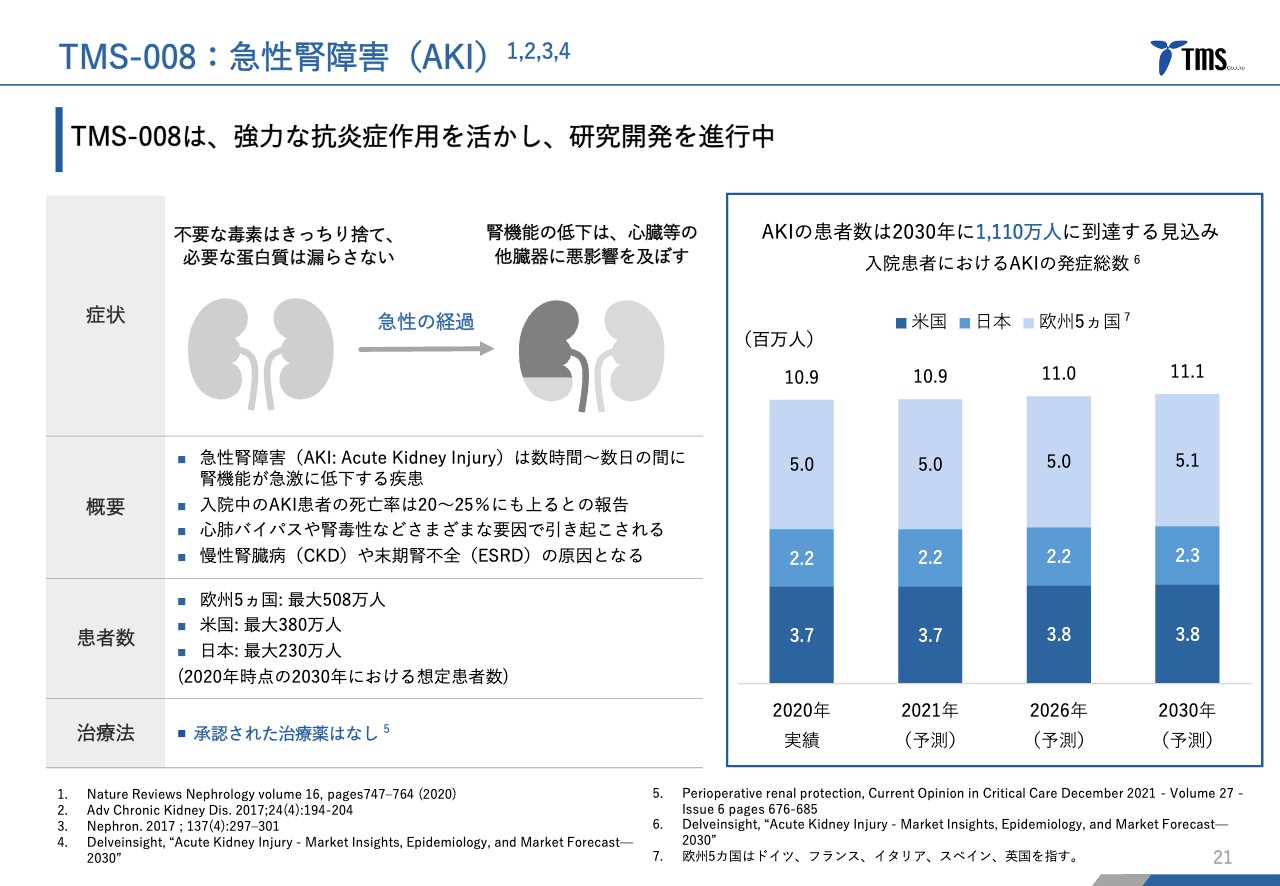
まず、「TMS-008」は非常に強い抗炎症効果を持った化合物です。「TMS-007」と同じSMTPファミリーの化合物ですが、まずは急性腎障害という疾患をターゲットにして開発を進めていきたいと考えています。
急性腎障害とは、腎機能が急激に低下する疾患です。正確な患者数はよくわかっていませんが、先進7ヶ国で1,000万人を超える方々が発症しているという報告もあります。また、さまざまな原因によって発症します。よく知られている原因は、心臓バイパス手術の結果、腎障害が発生する事象です。
ほかには、薬剤性腎障害、つまり薬の副作用で腎障害になる方もいらっしゃいます。入院患者のうち、急性腎障害になった患者さまの死亡率は20パーセント程度という報告もあり、かなり重要な疾患であることは間違いありません。
一方で、急性腎障害を対象にした薬は現時点では存在せず、こちらにも非常に大きなメディカル・ニーズがあります。
坂本:現状は、他の薬を充てているのでしょうか?
若林:そうですね。さまざまな薬の組み合わせがあります。
坂本:汎用性があるということですね。
TMS-008:急性腎障害(AKI)
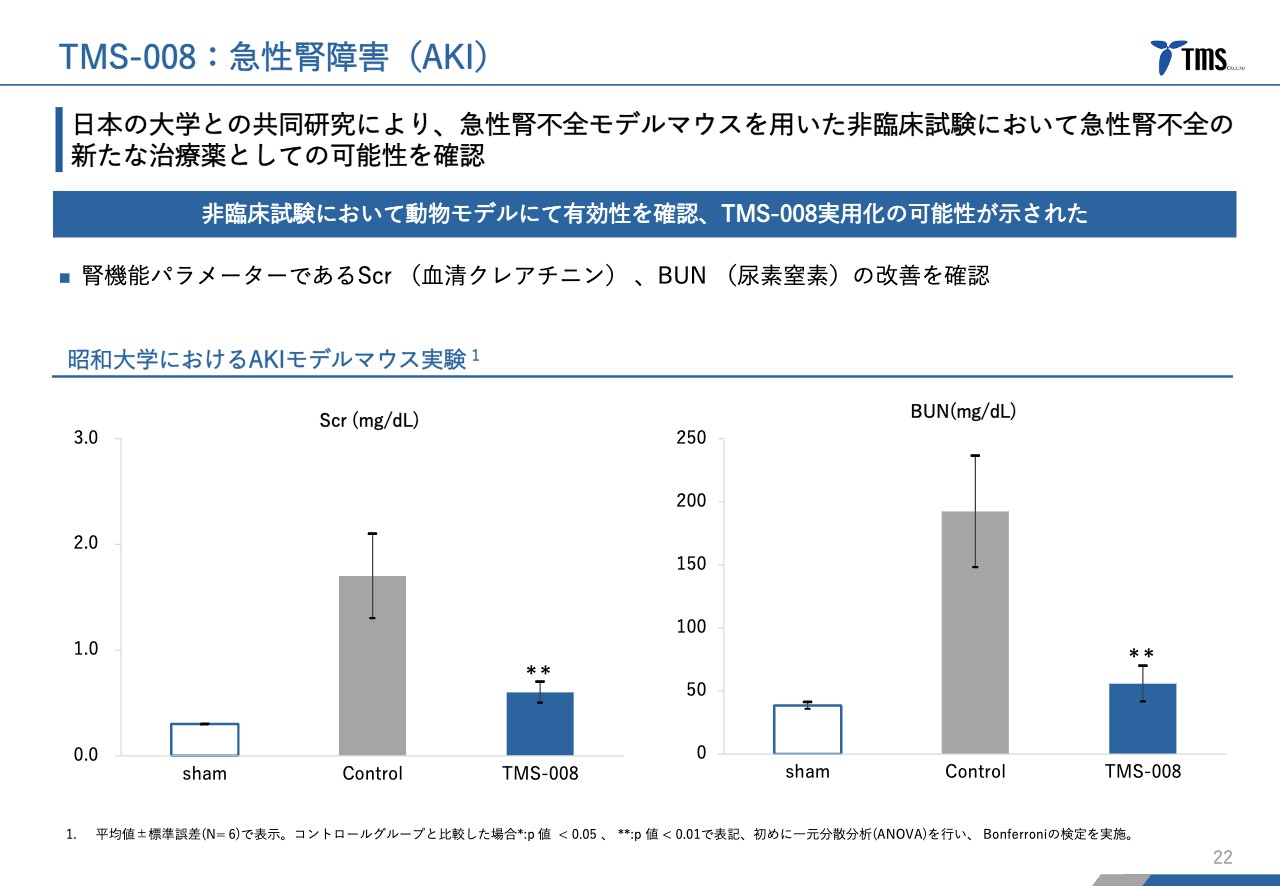
若林:「TMS-008」はこれから臨床試験に入る段階のため、動物モデルの試験結果しかありませんが、スライドには、昭和大学で実施していただいた急性腎不全モデルマウスを用いた実験結果を記載しています。
左側のグラフに示しているSCrは血清クレアチニン、右側のBUNは血中尿素窒素を示しており、どちらも重要な腎機能のマーカーです。
各グラフ中央の「Control」が腎障害を起こしたモデルマウスの数値です。どちらのグラフも非常に数値が高くなっていますが、「TMS-008」を投与することで、通常の状態に近いところまでマーカーが下がっている結果が得られています。
TMS-008:広範な適応症が期待できる抗炎症作用
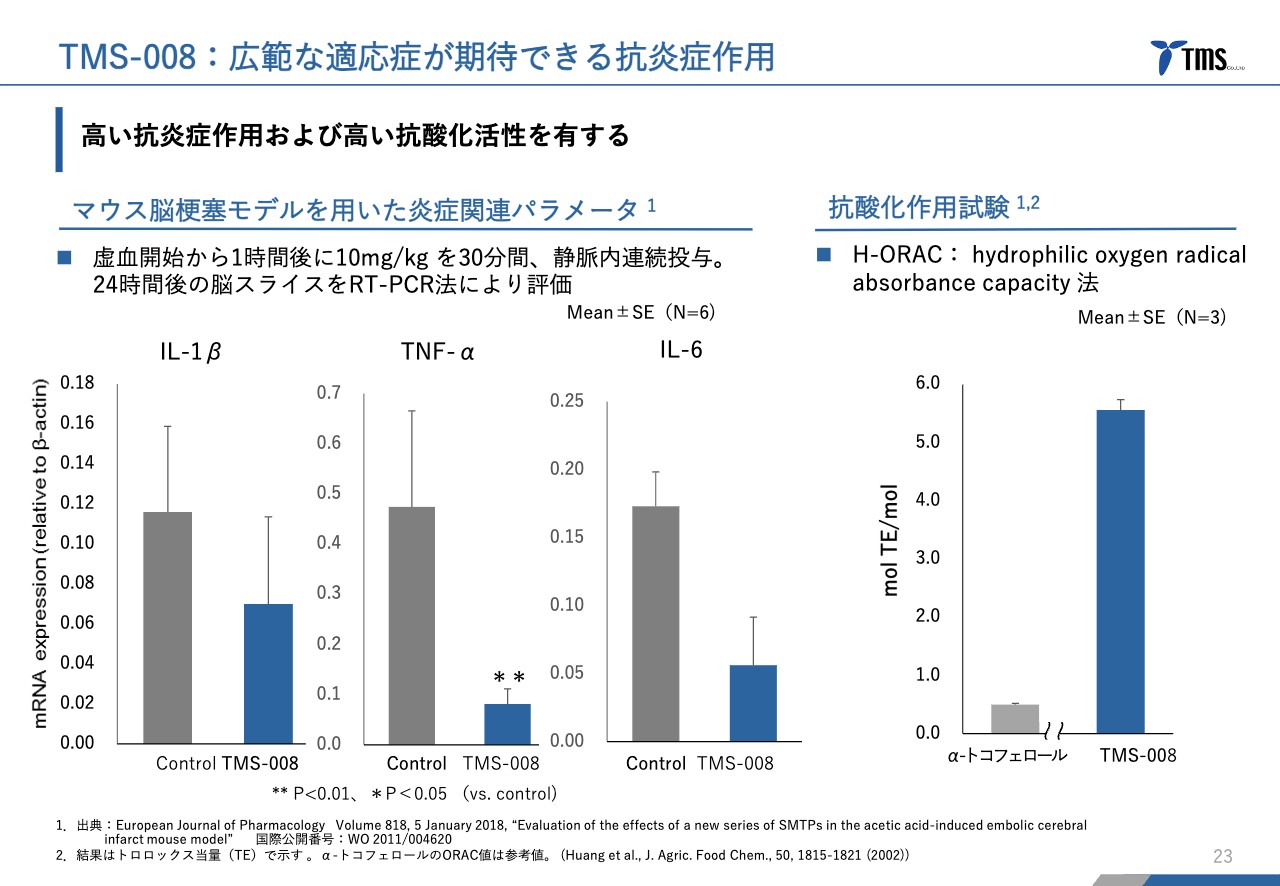
若林:もう少し専門的になってしまいますが、炎症マーカーについてです。
スライド左側からIL-1β、TNF-α、IL-6という炎症に伴って上がるマーカーです。これらのマーカーも「TMS-008」の投与によって下がっており、抗炎症作用を活かして腎障害を緩和していると想定される実験結果になっています。
抗酸化作用というものもあります。右側のグラフのとおり、α-トコフェロール、つまりビタミンEと比較して非常に大きな抗酸化作用を得られていることから、こちらの作用も関係しているのではないかと考えています。
TMS-008/TMS-009の進捗状況
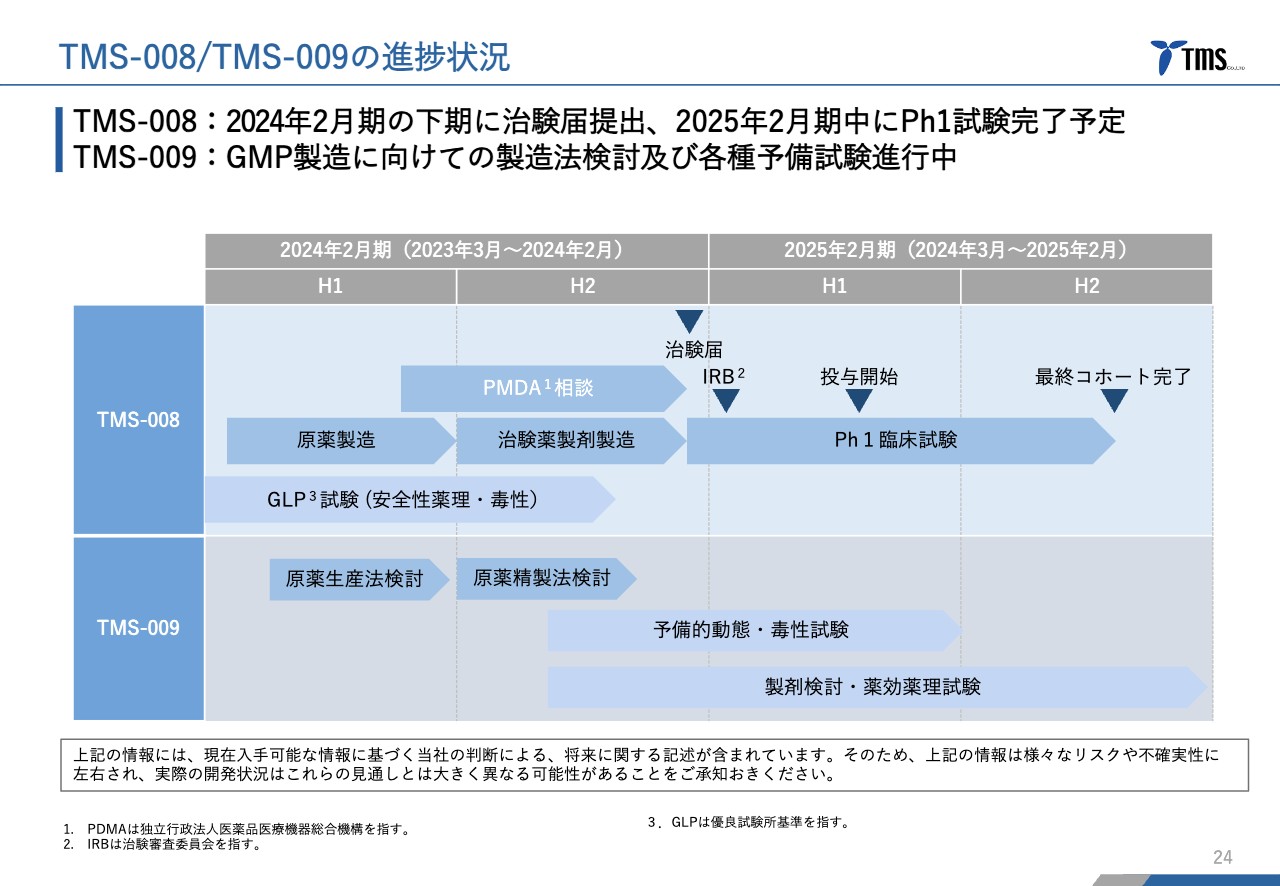
若林:「TMS-008」と、そのバックアップとしての「TMS-009」のスケジュールです。当社は2月決算であり、現在はちょうど決算期が終わろうとしていますが、「TMS-008」はもともと今期中に第Ⅰ相臨床試験の治験届を提出するとご説明しています。
今期はあと1週間しかありませんが、その間に治験届を提出し、来期には第Ⅰ相臨床試験を行うスケジュールで動いています。
坂本:「TMS-009」は何に効くのでしょうか?
若林:「TMS-008」と非常に似ています。
坂本:抗炎症作用で、他のものにも効きますか?
若林:そうですね。あるいは、「TMS-008」が何らかの理由でうまくいかなかった場合に開発されます。
坂本:なるほど。こちらは人体で臨床試験をされていないため回答が難しいと思いますが、「TMS-008」は平均で何回程度投与されるイメージなのでしょうか?
若林:「TMS-007」と同じように、「TMS-008」も1回程度です。
坂本:1回で良いのですか?
若林:何回か投与する可能性もありますが、それほど何回も投与するイメージはありません。
坂本:1回でかなり効くということですね。「TMS-008」はかなり広範囲の疾病に効く印象です。こちらもよくある質問だと思いますが、他の症状、あるいはどのあたりに効きそうですか?
若林:全体像はお話しできないのですが、すでに公表している「これにも効くのではないか」というポイントとして、がんの悪液質という症状があります。
がんそのものではありませんが、がん患者の方が突然急速に痩せてしまうことがありますよね。そこには、がん悪液質と呼ばれる症状が非常に深く関与しています。がん悪液質とは全身性の炎症と言われており、それを「TMS-008」の投与によって抑えることができるのではないかという実験結果もあるため、検討しています。
JX09について

若林:「JX09」は、パイプラインの2番目にあった、JIXING社から導入した治療薬です。こちらは治療抵抗性高血圧という、治療をしてもなかなか血圧が下がらない高血圧患者に対する治療薬として開発中です。
つい先週あたりに、JIXING社がオーストラリアで第Ⅰ相臨床試験を開始した状況です。作用機序としては、アルドステロン合成阻害剤であり、アルドステロンという酵素の合成を抑える薬です。
高血圧患者全体のうち約5パーセントにはアルドステロンの過剰分泌が生じていると考えられており、この分泌を抑えることで高血圧患者の症状を良くします。
現在は「JX09」だけではなく、他社でもいくつか開発されていますが、このアルドステロン合成阻害剤は、標的であるタンパク質、アルドステロン合成酵素、CYP11B2を選択的に抑えることが、非常に重要であると考えられています。
なぜかというと、実は非常によく似たCYP11B1というタンパク質があり、両方を一度に抑えると(阻害剤の)良さがなくなってしまうため、CYP11B2だけを抑えることが非常に重要です。そこで、「JX09」は非常に高い選択性を有しています。
坂本:治療をされている高血圧患者のうち、5パーセントの方はアルドステロンの過剰分泌によって薬が効かないということですか?
若林:そのとおりです。そちらに関しては、次のスライドでご説明します。
JX09について:日本市場
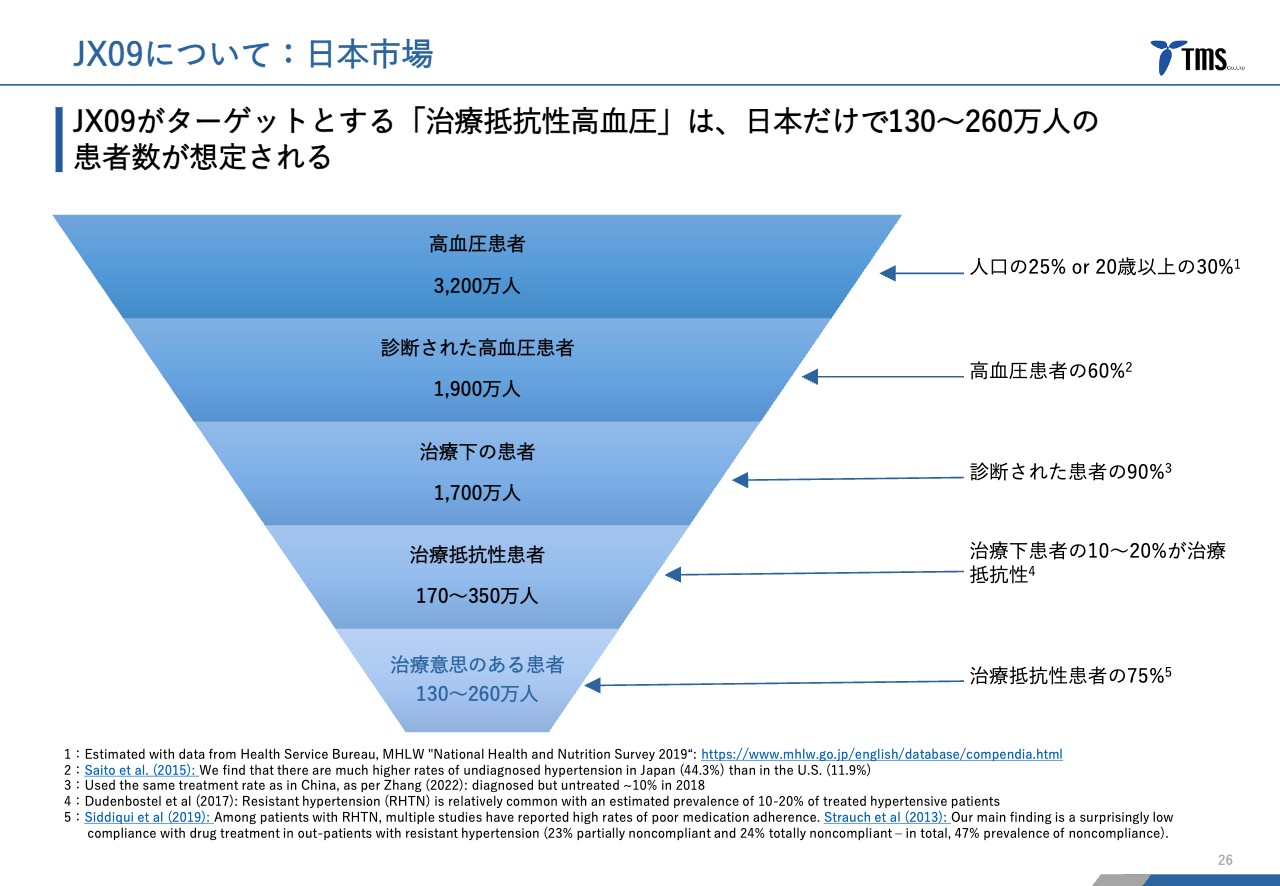
若林:先ほどのご質問については、三角の表の上から4番目にある、「治療抵抗性患者」が該当します。まず、現在実際に市販されている降圧剤ではなかなか効かない患者さまが約10パーセントから20パーセントいらっしゃいます。
坂本:アルドステロンが関与しているからですか?
若林:それがすべてではないと思います。
坂本:可能性があるということですね。そのような患者さまには、この薬が効くかもしれないということでしょうか?
若林:そのとおりです。
坂本:非常によくわかりました。高血圧の方はかなり多いですよね。
若林:そうですね。日本全国に約3,200万人いらっしゃいます。
坂本:日本だけでその人数ですから、世界規模ではとんでもない人数ですよね。もし上市まで進められれば、非常に使われそうな薬ですね。
「JX09」は、他の症例や症状にも使えるのでしょうか? 「TMS-008」の説明において、すべて元は同じ薬であるともおっしゃっていましたが、いかがでしょうか?
若林:先ほど急性腎障害の話をしましたが、現在知られている限りでは、慢性腎臓病にも効くのではないかと言われています。
坂本:それはかなり助かりますね。
若林:非常に患者さまが多く、こちらの可能性もあると考えられます。
成長戦略

若林:成長戦略に関してお話しします。まず「TMS-007」は最も臨床段階で進んでいますので、こちらで成長基盤を確立していきたいと考えています。
後続パイプラインとしては、これから臨床入りする「TMS-008」と今ちょうど臨床入りした「JX09」があります。こちらでパイプラインを拡充して企業価値を向上していきます。
さらに当社では、冒頭にもお伝えしましたが、日本のアカデミアを中心とする優れた創薬シーズを導入して、それを世界の製薬産業や世界の医薬品市場に広げていくことで、より成長を遂げていきたいと考えています。
社内と社外の両輪によりパイプラインの充実を図る
若林:先ほどお話ししたことを図示しています。当社の社内でも、非常に少ない人数ですが研究を続けているものもあります。
社外プログラムのアプローチ
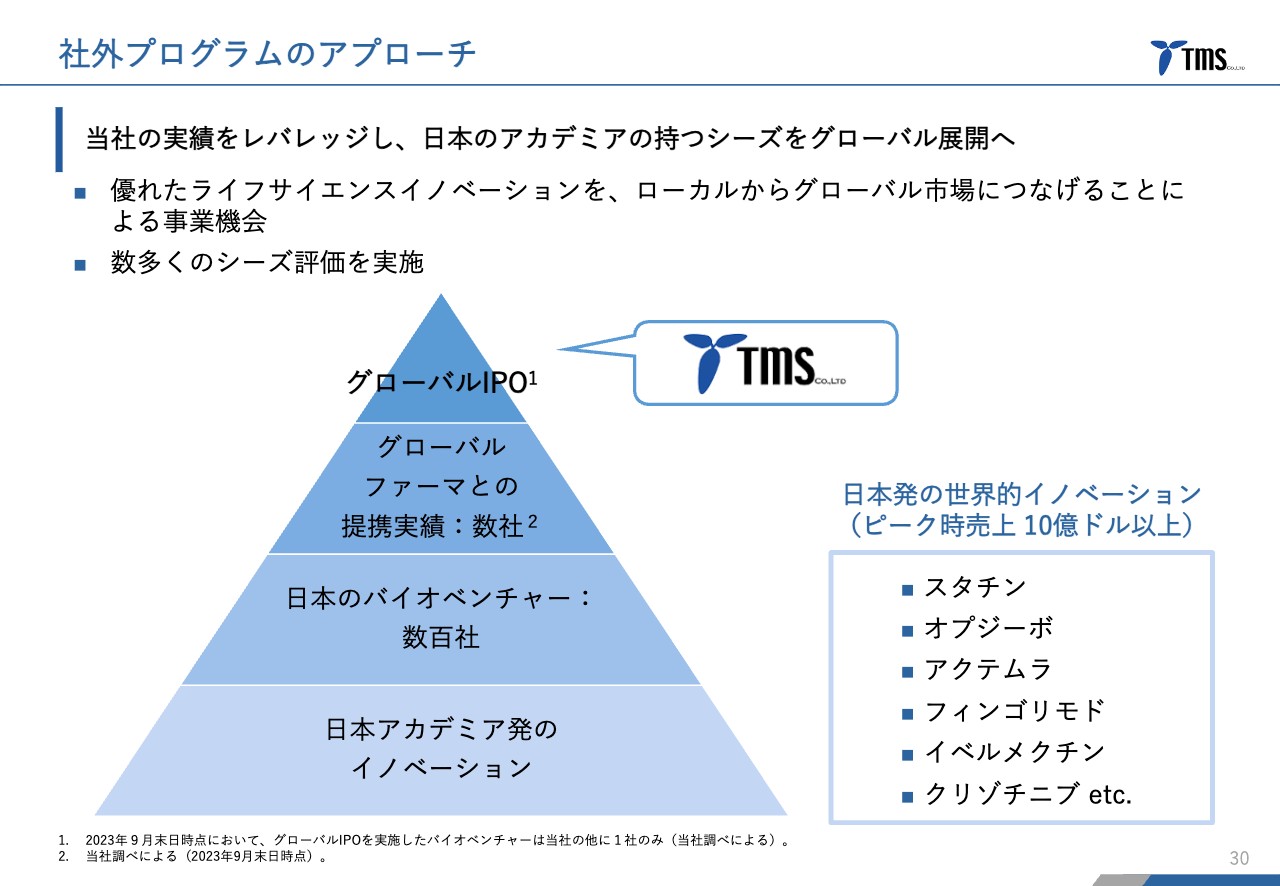
若林:当社のポジショニングのようなものを示しています。日本のアカデミア発のイノベーションがいろいろとある中で、バイオベンチャーも数百社に及びます。上場しているバイオベンチャーでもおそらく50社ぐらいあります。
その中で、グローバルファーマとの提携実績がある会社となるとかなり絞られます。さらに当社はIPOの時点ですでに海外の機関投資家にもアピールすべく、グローバルIPOを行っています。
当社以外にももう1社出てきていますが、日本でバイオベンチャーにおいてグローバルIPOを行ったのは当社が初めてです。このようなグローバルへの窓口、グローバル市場への架け橋としての役割を果たしていきたいと考えています。
質疑応答:JIXING社との開発について
坂本:「今回のJIXING社との提携で開発の治験が進むことになると思います。タイムラインと開発治験の規模、どの国で行うのかということを教えてください」というご質問です。
これからの部分になりますが、お答えできる範囲でお願いします。
若林:どの部分もなかなかはっきりしたことをお話しできず申し訳ありませんが、もちろん決定した際にはその段階で明らかにしていきたいと思います。
世界で使っていただけるお薬になると思っていますので、想定としてはどこの国というわけではなく、広く、かつ非常にできるだけ速やかに進めていきたいと考えています。
質疑応答:JIXING社との提携におけるデメリットについて
坂本:「JIXING社との提携でメリットが多いと考えているのですが、デメリットやリスクのようなものがあれば教えてください」というご質問です。
若林:JIXING社との提携に伴うスペシフィックなリスクは、我々としても今はあまり考えていないところです。あるとすれば、バイオジェン社とJIXING社で少しネームバリューが違うところがあり、それぐらいではないかと思っています。
質疑応答:「TMS-007」の販売網について
坂本:「今回、『TMS-007』の国内販売権を付与されているということですが、現状では貴社に販売網がないという状況です。基本は国内だと思うのですが、製薬企業との提携が必要になると思います。
今の段階から、ある程度パートナーを絞って進んでいくのか、ある程度上市が見えてから条件のよいところを選定するのかについて教えていただければと思います」というご質問です。
若林:現時点では、自社販売も選択肢に含めて広く考えていきたいと思っています。その中で、良い提携先が見つかれば提携先と一緒に進めていくこととし、前広に検討していきたいと考えています。
質疑応答:「TMS-007」に関する最近の活動内容について
坂本:「『TMS-007』に関して、最近の学会発表や論文など業績の内容も含めて教えてください。私の祖母が脳梗塞で倒れて、『TMS-007』を知りました。非常に興味があります」というご質問とご意見をいただいています。
若林:学会発表はポスター発表というかたちで、2022年に実施しました。そこから先は、特にバイオジェン社が情報を開示するかどうかを決められる、情報コントロールをできる立場にありました。
そのためしばらくは新しい情報を開示していませんが、いろいろ準備はしている状況です。具体的にいつということはお話ししにくいのですが、当社としてはできる範囲で開示していきたいと思っています。
質疑応答:今後の資金調達やバックアップ体制について
坂本:「貴社の自己資本比率は98パーセントあるため、直ちに資金不足になることはないと思われます。数年後に開発費用が足りなくなった場合でも、資金調達やバックアップ体制は万全なのでしょうか?」というご質問です。
これから上市に向けて、今まで以上にお金がかかると思います。現状で足りるのかということと、治験の規模と期間の長さにもよると思いますので、そのあたりのイメージのようなものがわかると、投資家もなんとなく理解できるのではないかと思います。
若林:今、当社には30数億円の手元資金があります。これまで年間に10億円を超えて使うことはほとんどありませんでした。もともとパイプラインの前提として、臨床試験は「TMS-008」の1本であり、「TMS-007」はバイオジェン社が開発するため当社はお金がかからないということで進めていました。
それが「TMS-007」の日本での開発費と「JX09」の開発費がかかってくるという状況に変わっています。資金調達と使途に関しては、今いろいろなシナリオを検討しているところです。
坂本:基本的には、ここから「TMS-007」や「JX09」を進めていくかたちとなり、よくあるパターンなのだと思います。他のバイオベンチャーを見ていると、もう1本パイプラインを作るところも出てくると思います。そのあたりのイメージがあれば教えてください。
若林:その前に、当社は「TMS-007」と「JX09」の日本での開発に関して、一応JIXING社との契約で、日本でかかった臨床開発費用の75パーセントは補償いただくということになっています(注:TMS-007の場合は上限1,000万ドル、JX09は上限500万ドルの制限あり)。すべて当社負担というわけではないということをお伝えしておきます。
パイプラインとしては、非常にアーリーなものになるのは間違いないと思いますが、成長戦略としてお話ししたように今いろいろな大学のシーズを見ていて、実際にそれなりのリソースとコストをかけて評価中のものもあります。この結果がよければパイプラインとして上がってくることになると思います。
質疑応答:第Ⅲ相臨床試験の完了時期について
坂本:「うまくいけば第Ⅲ相臨床試験の完了時期はどのぐらいでしょうか?」というご質問です。回答はおそらく難しいと思いますが、興味がおありなのだと思います。
若林:おっしゃるとおり難しいですね。バイオジェン社が考えていた臨床試験のデザインは昨年3月に発表されていて、その直後にいったん停止するという発表が出たのですが、そのデザインは後期第Ⅱ相臨床試験で760名の規模、かつパート1とパート2に分かれているというものでした。
これはオペレーショナリー・シームレスというデザインで、要は、パート2が第Ⅲ相臨床試験相当になることを基本的に想定しているようなデザインなのです。
少し複雑な設計ですが、そのように進めていくのかどうかも含めて今検討しています。いろいろな選択肢が考えられると思っています。バイオジェン社のデザインに近いものも考えられますし、さらに規模を小さくする可能性もあると思います。
あるいは、より承認獲得のスピードを速くできるような方法もあると思うのです。それぞれ良いところと悪いところがあります。その中でどれがJIXING社や当社が考える開発に合っているかという観点で選んでいくことになるかと思います。
坂本:確かに症例はたくさんあるので、治験はそこまで入念に行う必要がなさそうとも思います。この薬に関してはそのようなイメージでしょうか?
若林:はい、そうですね。
坂本:ある効果を見る時に判定が長引くパターンがよくありますよね。例えばアルツハイマーの薬などで非常に長引いていることがあったと思うのですが、この薬についてはそのようなことはないのでしょうか? データだけで進んでいくのでしょうか?
若林:先ほど「TMS-007」の臨床試験の話でお伝えしたmRSという指標は、90日後に有効性を見るという話でした。
坂本:そのような意味では意外と早いのではないかと思いました。
若林:そうですね。一方でより慎重なパターンとしては、90日後も見るし、1年後も見るというものがあります。
坂本:その場合、仮に1年後だとした場合、その有効性はやはり良くなるのでしょうか? リハビリ効果かもしれませんが、今までの「t-PA」に比べて90日後と1年後とではステージが変わる人もいると思います。それも含めて有用性があるのでしょうか?
若林:一般的には、やはり時間が経つと、リハビリ効果で徐々に良くなっているということはあります。当社の薬ではどうかということについては、1年後のデータがないのでわかりません。ただ、90日時点でかなり差が出ているので、そこまで行う必要があるのかと考えているところです。
飯村:視聴者の方からは、「出身が(ティムス本社のある)府中市なので応援したいが、なかなか用語が難しくて」というご感想をいただいています。
若林:そこについては申し訳なく思っているところもあり、できるだけ平易にご説明できるようにしたいと思っています。
飯村:今日初めて聞くカタカナもたくさんあったが、わかりやすく、今日ご覧いただいた方々にもよく理解いただけたのではないかと思います。
坂本:どれをどのようにすると売上に結びつくのかにつながるデータを測っていて、その結果をもとに、上市したら売れるだろうというお話ですよね。
第Ⅲ相臨床試験の後に上市となるのでしょうか? それとも、そこからもう少しかかるのでしょうか?
若林:基本的に、第Ⅲ相臨床試験のあとに上市となります。
質疑応答:開発チームについて
坂本:「『TMS-007』と『TMS-008』の開発チームは何人ぐらいいるのでしょうか? そのメンバーの特徴を教えてください」というご質問です。
飯村:これは、イメージを聞いてみたいということですね。
若林:我々は全体でまだ20人程度の会社です。その中のチームですので非常に少ないのですが、「TMS-007」の前期第Ⅱ相臨床試験を始めた時には、当社は社員が4人でした。
坂本:かなり省エネで来られたのですね。
若林:ほとんどを外部の会社に委託して最大限の協力をいただいて、その分の対価もお支払いしてという体制で進めていくということです。
坂本:社員が20人になっても、基本としてそれは変わらないですよね。そのほうがコスト問題の解決が早いようにも思います。
質疑応答:機関投資家の反応について
坂本:「『TMS-007』の第Ⅱ相臨床試験のポジティブな結果があったということですが、これから第Ⅲ相臨床試験に向かうという状況で、海外の機関投資家から新規のアポイントメントは増えたでしょうか?」というご質問です。
若林:あまり変わらないかもしれません。グローバルIPOということで、最初から一気にいろいろと海外機関投資家へ当たっていきましたが、その後のペースとしてはあまり変わりません。
坂本:どのような質問を受けることが多いですか? 今日私たちがお尋ねしているような質問が多いでしょうか?
若林:上市までのタイミングや、スケジュール感がどうなのかということが一番みなさまの関心が高いところだと思います。
質疑応答:「TMS-007」の対象比率について
坂本:繰り返しのおうかがいになってしまいますが、「『TMS-007』は患者全体の何パーセントが対象になるのでしょうか?」というご質問です。
若林:発症から12時間以内に病院に到着する患者さまが、脳梗塞患者全体のだいたい半分です。
坂本:半分なのですか?
若林:4.5時間以内でだいたい3分の1で、33パーセントから50パーセントというところです。時間帯としてはそうなります。
坂本:全体でも50パーセントぐらいということですね。非常によくわかりました。
若林氏からのご挨拶
若林:当社は日本だけではなく、世界のグローバルの医薬品市場に向けて優れた研究成果を結びつけていきたいと思っています。
どうしても費用先行型となるところもありますが、できるだけ企業価値を高めていきながら、その中でパイプラインを進め、がんばっていきたいと思っています。ぜひ応援いただきたく思います。よろしくお願いします。ありがとうございました。
新着ログ
「医薬品」のログ